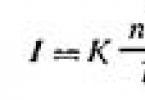Unutarnja energija termodinamičkog sustava može se promijeniti na dva načina:
- počinivši preko rad sustava,
- kroz toplinsku interakciju.
Prijenos topline na tijelo nije povezan s obavljanjem makroskopskog rada na tijelu. NA ovaj slučaj promjena unutarnje energije uzrokovana je time što pojedine molekule tijela s višom temperaturom vrše rad na nekim molekulama tijela s nižom temperaturom. U ovom slučaju toplinska interakcija se ostvaruje zbog toplinske vodljivosti. Prijenos energije moguć je i uz pomoć zračenja. Sustav mikroskopskih procesa (koji se ne odnose na cijelo tijelo, već na pojedine molekule) naziva se prijenos topline. Količina energije koja se prenosi s jednog tijela na drugo kao rezultat prijenosa topline određena je količinom topline koja se prenosi s jednog tijela na drugo.
Definicija
toplina naziva se energija koju prima (ili predaje) tijelo u procesu izmjene topline s okolnim tijelima (okolinom). Toplina se označava, obično slovom Q.
Ovo je jedna od osnovnih veličina u termodinamici. Toplina je uključena u matematičke izraze prvog i drugog zakona termodinamike. Za toplinu se kaže da je energija u obliku molekularnog gibanja.
Toplina se može priopćiti sustavu (tijelu) ili mu se može uzeti. Vjeruje se da je toplina pozitivna ako se sustavu preda.
Formula za izračunavanje topline s promjenom temperature
Elementarna količina topline označava se kao . Imajte na umu da element topline koji sustav prima (odaje) uz malu promjenu svog stanja nije totalni diferencijal. Razlog tome je što je toplina funkcija procesa promjene stanja sustava.
Elementarna količina topline koja se javlja sustavu, a temperatura se mijenja od T do T + dT, je:
gdje je C toplinski kapacitet tijela. Ako je tijelo koje se razmatra homogeno, tada se formula (1) za količinu topline može prikazati kao:
gdje je specifična toplina tijela, m je masa tijela, je molarni toplinski kapacitet, – molekulska masa tvar, je broj molova tvari.
Ako je tijelo homogeno, a toplinski kapacitet se smatra neovisnim o temperaturi, tada se količina topline () koju tijelo primi kada se njegova temperatura poveća za vrijednost može izračunati kao:
gdje je t 2 , t 1 tjelesna temperatura prije i poslije zagrijavanja. Imajte na umu da se pri pronalaženju razlike () u izračunima temperature mogu zamijeniti iu stupnjevima Celzijusa i u kelvinima.
Formula za količinu topline tijekom faznih prijelaza
Prijelaz iz jedne faze tvari u drugu prati apsorpcija ili oslobađanje određene količine topline, koja se naziva toplina faznog prijelaza.
Dakle, za prijenos elementa materije iz čvrstog stanja u tekućinu, treba ga obavijestiti o količini topline () koja je jednaka:
![]()
gdje je specifična toplina taljenja, dm je element mase tijela. U ovom slučaju treba uzeti u obzir da tijelo mora imati temperaturu jednaku talištu dotične tvari. Tijekom kristalizacije oslobađa se toplina jednaka (4).
Količina topline (toplina isparavanja) potrebna za pretvaranje tekućine u paru može se pronaći kao:
![]()
gdje je r specifična toplina isparavanja. Kada se para kondenzira, oslobađa se toplina. Toplina isparavanja jednaka je toplini kondenzacije jednakih masa tvari.
Mjerne jedinice za količinu topline
Osnovna jedinica za mjerenje količine topline u SI sustavu je: [Q]=J
Izvansustavna jedinica topline koja se često nalazi u tehničkim proračunima. [Q]=kal (kalorija). 1 cal = 4,1868 J.
Primjeri rješavanja problema
Primjer
Vježbajte. Koje količine vode treba pomiješati da se dobije 200 litara vode temperature t=40C, ako je temperatura jedne mase vode t 1 =10C, druge mase vode t 2 =60C?
Riješenje. Napišimo jednadžbu toplinska ravnoteža kao:
gdje je Q=cmt - količina topline pripremljena nakon miješanja vode; Q 1 \u003d cm 1 t 1 - količina topline dijela vode s temperaturom t 1 i masom m 1; Q 2 \u003d cm 2 t 2 - količina topline dijela vode s temperaturom t 2 i masom m 2.
Jednadžba (1.1) implicira:
Kada kombiniramo hladne (V 1) i vruće (V 2) dijelove vode u jedan volumen (V), možemo prihvatiti da:
Dakle, dobivamo sustav jednadžbi:
![]()
Rješavajući ga, dobivamo:
![]()
Okvirni plan
otvorena lekcija fizike u 8 „E“ razredu
MOU gimnazija broj 77, o. Toljati
profesori fizike
Ivanova Marija Konstantinovna
Tema lekcije:
Rješavanje zadataka za izračunavanje količine topline potrebne za zagrijavanje tijela ili koju ono oslobađa pri hlađenju.
Datum:
Svrha lekcije:
razviti praktične vještine u izračunavanju količine topline potrebne za zagrijavanje, a koja se oslobađa tijekom hlađenja;
razvijati vještine brojanja, poboljšavati logičke vještine u analizi zapleta problema, rješavanju kvalitativnih i računskih problema;
njegovati sposobnost rada u paru, uvažavati mišljenje protivnika i braniti svoje stajalište, biti oprezan pri rješavanju zadataka iz fizike.
Oprema za nastavu:
računalo, projektor, prezentacija na temu (prilog br. 1), materijali pojedinačna zbirka digitalni obrazovni resursi.
Vrsta lekcije:
rješavanje problema.
“Stavi svoj prst u plamen šibice i doživjet ćeš osjećaj kakav nije jednak ni na nebu ni na zemlji; međutim, sve što se dogodilo jednostavno je rezultat sudara molekula.
J. Wheeler
Tijekom nastave:
Organiziranje vremena
Pozdrav studentima.
Provjera odsutnih učenika.
Predstavljanje teme i ciljeva lekcije.
Provjera domaće zadaće.
1.Frontalno ispitivanje
Koliki je specifični toplinski kapacitet tvari? (Slajd #1)
Koja je jedinica specifičnog toplinskog kapaciteta tvari?
Zašto se vodene površine sporo smrzavaju? Zašto led dugo ne napušta rijeke, a posebno jezera, iako je vrijeme dugo toplo?
Zašto je čak i zimi dovoljno toplo na crnomorskoj obali Kavkaza?
Zašto se mnogi metali značajno ohlade? brže od vode? (Slajd #2)
2. Individualna anketa (kartice s višerazinskim zadacima za nekoliko učenika)
Istraživanje nove teme.
1. Ponavljanje pojma količine topline.
Količina topline- kvantitativna mjera promjene unutarnje energije tijekom prijenosa topline.
Količina topline koju tijelo apsorbira smatra se pozitivnom, a količina oslobođene topline negativnom. Izraz "tijelo ima određenu količinu topline" ili "tijelo sadrži (pohranjuje) određenu količinu topline" nema smisla. Količina topline može se primiti ili predati u bilo kojem procesu, ali se ne može posjedovati.
Tijekom izmjene topline na granici između tijela sporo pokretne molekule hladnog tijela međusobno djeluju s brzo pokretnim molekulama vrućeg tijela. Zbog toga se kinetičke energije molekula izjednačuju i brzine molekula hladnog tijela se povećavaju, a vrućeg tijela smanjuju.
Tijekom izmjene topline ne dolazi do pretvorbe energije iz jednog oblika u drugi, dio unutarnje energije vrućeg tijela prenosi se na hladno tijelo.
2. Formula za količinu topline.
Izvodimo radnu formulu za rješavanje problema za izračunavanje količine topline: Q = cm ( t 2 - t 1 ) - pisanje na ploču i u bilježnice.
Doznajemo da količina topline koju tijelo preda ili primi ovisi o početnoj temperaturi tijela, njegovoj masi i specifičnom toplinskom kapacitetu.
U praksi se često koriste toplinski proračuni. Na primjer, pri izgradnji zgrada potrebno je voditi računa o tome koliko topline cijeli sustav grijanja treba dati zgradi. Također treba znati koliko će topline otići u okolni prostor kroz prozore, zidove, vrata.
3 . Ovisnost količine topline o raznim veličinama . (Slajdovi #3, #4, #5, #6)
4 . Određena toplina (Slajd broj 7)
5. Mjerne jedinice za količinu topline (Slajd broj 8)
6. Primjer rješenja zadatka za izračunavanje količine topline (Slajd broj 10)
7. Rješavanje zadataka za izračunavanje količine topline na ploči i u bilježnicama


Također saznajemo da ako dolazi do izmjene topline između tijela, tada se unutarnja energija svih grijaćih tijela povećava za onoliko koliko se smanjuje unutarnja energija tijela koja se hlade. Za to koristimo primjer riješenog zadatka iz § 9 udžbenika.

Dinamička pauza.
IV. Konsolidacija proučavanog materijala.
1. Pitanja za samokontrolu (Slajd broj 9)
2. Rješavanje problema kvalitete:
Zašto je u pustinjama danju vruće, a noću temperatura pada ispod 0°C? (Pijesak ima mali specifični toplinski kapacitet, pa se brzo zagrijava i hladi.)
Komad olova i komad čelika iste mase udarili su čekićem jednak broj puta. Koji je komad postao vrući? Zašto? (Komad olova se više zagrijavao, jer je specifični toplinski kapacitet olova manji.)
Zašto željezne peći zagrijavaju prostoriju brže od peći od opeke, ali ne ostaju tople tako dugo? (Specifični toplinski kapacitet bakra je manji nego kod opeke.)
Bakreni i čelični utezi iste mase dobivaju jednake količine topline. Koji uteg će najviše promijeniti temperaturu? (Kod bakra, jer specifični toplinski kapacitet bakra je manji.)
Što troši više energije: zagrijavanje vode ili zagrijavanje aluminijske posude, ako su im mase iste? (Za zagrijavanje vode, jer je specifični toplinski kapacitet vode velik.)
Kao što znate, željezo ima veći specifični toplinski kapacitet od bakra. Prema tome, žalac izrađen od željeza imao bi veću zalihu unutarnje energije od istog žalca izrađenog od bakra, ako su im mase i temperature jednake. Zašto su, unatoč tome, vrhovi lemilice izrađeni od bakra? (Bakar ima velika toplinska vodljivost.)
Poznato je da je toplinska vodljivost metala puno veća od toplinske vodljivosti stakla. Zašto su onda kalorimetri napravljeni od metala, a ne od stakla? (Metal ima visoku toplinsku vodljivost i nisku specifičnu toplinu, zbog čega se temperatura unutar kalorimetra brzo izjednačava, a malo se topline troši na zagrijavanje. Osim toga, zračenje metala je puno manje od zračenja stakla, što smanjuje gubitak topline.)
Poznato je da rahli snijeg dobro štiti tlo od smrzavanja, jer sadrži mnogo zraka, koji je slab vodič topline. Ali na kraju krajeva, čak i slojevi zraka graniče s tlom koje nije prekriveno snijegom. Zašto se onda u ovom slučaju ne smrzava puno? (Zrak je u dodiru s tlom koje nije prekriveno snijegom stalno u pokretu, miješan. Ovaj pokretni zrak oduzima toplinu zemlji i povećava isparavanje vlage iz nje. Zrak koji se nalazi između čestica snijega je neaktivan i kao loš vodič topline štiti zemlju od smrzavanja.)
3. Rješenje računskih zadataka
Prva dva zadatka rješavaju visoko motivirani učenici za pločom uz kolektivnu raspravu. Pronalazimo prave pristupe u promišljanju i rješavanju problema.
Zadatak #1.
Pri zagrijavanju komada bakra od 20°C do 170°C potrošeno je 140 000 J topline. Odredite masu bakra.

Zadatak #2
Koliki je specifični toplinski kapacitet tekućine ako je bilo potrebno 150 000 J da se 2 litre zagriju na 20 °C. Gustoća tekućine je 1,5 g / cm³

Učenici u parovima odgovaraju na sljedeća pitanja:
Zadatak broj 3.
Dvije bakrene kuglice mase m o i 4m o zagrijana tako da obje kuglice dobiju jednaku količinu topline. Pritom se velika kugla zagrijala za 5° C. Koliko se zagrijala kugla manje mase?
Zadatak broj 4.
Koliko se topline oslobodi kada se 4 m³ leda ohladi s 10°C na -40°C?
Zadatak broj 5.
U tom će slučaju za zagrijavanje dviju tvari biti potrebno više topline ako je zagrijavanje dviju tvari jednako ∆ t 1 = ∆t 2 Prva tvar je cigla mase 2 kg i s = 880 J / kg ∙ ° C, a mjed - mase 2 kg i s \u003d 400 J / kg ∙ ° C
Zadatak broj 6.
Čelična šipka mase 4 kg se zagrijava. U ovom slučaju potrošeno je 200 000 J topline. Odredite konačnu temperaturu tijela ako je početna temperatura t 0 = 10°C
Kada učenici sami rješavaju probleme, prirodno je da se pojave pitanja. Zajednički se raspravlja o najčešće postavljanim pitanjima. Na pitanja koja su privatne naravi daju se individualni odgovori.
Odraz. Stavljanje oznaka.
Učitelj, nastavnik, profesor: Dakle, dečki, što ste danas naučili na lekciji i što ste naučili novo?
Primjeri odgovora učenika :
Razradio vještine rješavanja kvalitativnih i računskih problema na temu "Izračun količine topline potrebne za zagrijavanje tijela koja se oslobađa pri hlađenju."
Kako se predmeti poput fizike i matematike preklapaju i povezuju uvjerili smo se u praksi.
Domaća zadaća:
Riješite zadatke br. 1024, 1025, iz zbirke zadataka V.I. Lukashik, E. V. Ivanova.
Samostalno osmisliti zadatak za izračunavanje količine topline potrebne za zagrijavanje tijela ili koju ono oslobađa pri hlađenju.
Kao što znate, tijekom različitih mehaničkih procesa dolazi do promjene mehaničke energije W meh. Mjera promjene mehaničke energije je rad sila primijenjenih na sustav:
\(~\Delta W_(meh) = A.\)
Pri prijenosu topline dolazi do promjene unutarnje energije tijela. Mjera promjene unutarnje energije tijekom prijenosa topline je količina topline.
Količina topline je mjera promjene unutarnje energije koju tijelo prima (ili predaje) u procesu prijenosa topline.
Dakle, i rad i količina topline karakteriziraju promjenu energije, ali nisu identični energiji. Oni ne karakteriziraju samo stanje sustava, već određuju proces prijenosa energije iz jednog oblika u drugi (iz jednog tijela u drugo) kada se stanje mijenja i bitno ovise o prirodi procesa.
Glavna razlika između rada i količine topline je u tome što rad karakterizira proces promjene unutarnje energije sustava, popraćen transformacijom energije iz jedne vrste u drugu (iz mehaničke u unutarnju). Količina topline karakterizira proces prijenosa unutarnje energije s jednog tijela na drugo (od više zagrijanog do manje zagrijanog), koji nije popraćen transformacijama energije.
Iskustvo pokazuje da je količina topline potrebna za zagrijavanje tijela s masom m temperatura T 1 do temperature T 2 izračunava se formulom
\(~Q = cm (T_2 - T_1) = cm \Delta T, \qquad (1)\)
gdje c- specifični toplinski kapacitet tvari;
\(~c = \frac(Q)(m (T_2 - T_1)).\)
SI jedinica specifične topline je džul po kilogramu Kelvina (J/(kg K)).
Određena toplina c je brojčano jednaka količini topline koju je potrebno predati tijelu mase 1 kg da bi se ono zagrijalo za 1 K.
Toplinski kapacitet tijelo C T je brojčano jednaka količini topline potrebnoj da se tjelesna temperatura promijeni za 1 K:
\(~C_T = \frac(Q)(T_2 - T_1) = cm.\)
SI jedinica toplinskog kapaciteta tijela je džul po Kelvinu (J/K).
Za promjenu tekućine u paru pri konstantnoj temperaturi potrebna je količina topline
\(~Q = Lm, \qquad (2)\)
gdje L- specifična toplina isparavanja. Kada se para kondenzira, oslobađa se ista količina topline.
Da bi se otopilo kristalno tijelo s masom m kod tališta potrebno je da tijelo javi količinu topline
\(~Q = \lambda m, \qquad (3)\)
gdje λ - specifična toplina taljenja. Prilikom kristalizacije nekog tijela oslobađa se ista količina topline.
Količina topline koja se oslobađa tijekom potpunog izgaranja gorive mase m,
\(~Q = qm, \qquad (4)\)
gdje q- specifična toplina izgaranja.
SI jedinica za specifične topline isparavanja, taljenja i izgaranja je džul po kilogramu (J/kg).
Književnost
Aksenovich L. A. Fizika u Srednja škola: Teorija. Zadaci. Ispitivanja: Proc. dodatak za ustanove koje pružaju opće. okruženja, obrazovanje / L. A. Aksenovich, N. N. Rakina, K. S. Farino; ur. K. S. Farino. - Mn.: Adukatsia i vykhavanne, 2004. - C. 154-155.
« Fizika - 10. razred"
U kojim procesima dolazi do agregatne pretvorbe tvari?
Kako se možete promijeniti agregatno stanje tvari?
Unutarnju energiju bilo kojeg tijela možete promijeniti radom, zagrijavanjem ili, obrnuto, hlađenjem.
Dakle, kod kovanja metala se radi i zagrijava, a istovremeno se metal može zagrijavati na gorućem plamenu.
Također, ako je klip fiksiran (slika 13.5), tada se volumen plina ne mijenja kada se zagrije i ne vrši se nikakav rad. Ali temperatura plina, a time i njegova unutarnja energija, raste.
Unutarnja energija se može povećavati i smanjivati, pa količina topline može biti pozitivna ili negativna.
Proces prijenosa energije s jednog tijela na drugo bez vršenja rada naziva se izmjena topline.
Kvantitativna mjera promjene unutarnje energije tijekom prijenosa topline naziva se količina topline.
Molekularna slika prijenosa topline.
Tijekom izmjene topline na granici između tijela sporo pokretne molekule hladnog tijela međusobno djeluju s brzo pokretnim molekulama vrućeg tijela. Zbog toga se kinetičke energije molekula izjednačuju i brzine molekula hladnog tijela se povećavaju, a vrućeg tijela smanjuju.
Tijekom izmjene topline ne dolazi do pretvorbe energije iz jednog oblika u drugi, već se dio unutarnje energije toplijeg tijela prenosi na manje zagrijano tijelo.
Količina topline i toplinski kapacitet.
Već znate da je za zagrijavanje tijela mase m od temperature t 1 do temperature t 2 potrebno na njega predati količinu topline:
Q \u003d cm (t 2 - t 1) \u003d cm Δt. (13.5)
Kada se tijelo ohladi, njegova konačna temperatura t 2 ispada manja od početne temperature t 1 i količina topline koju tijelo preda je negativna.
Koeficijent c u formuli (13.5) naziva se specifični toplinski kapacitet tvari.
Određena toplina- to je vrijednost brojčano jednaka količini topline koju tvar mase 1 kg primi ili preda kada se njezina temperatura promijeni za 1 K.
Specifični toplinski kapacitet plinova ovisi o procesu prijenosa topline. Ako zagrijavate plin pri konstantnom tlaku, on će se širiti i raditi. Da bi se plin zagrijao za 1 °C pri konstantnom tlaku, treba mu predati više topline nego da bi se zagrijao pri konstantnom volumenu, kada će se plin samo zagrijati.
tekućina i čvrsta tijela malo se proširi kada se zagrije. Njihovi specifični toplinski kapaciteti pri konstantnom volumenu i konstantnom tlaku malo se razlikuju.
Specifična toplina isparavanja.
Za pretvaranje tekućine u paru tijekom procesa vrenja potrebno joj je predati određenu količinu topline. Temperatura tekućine se ne mijenja kada vrije. Transformacija tekućine u paru pri konstantnoj temperaturi ne dovodi do povećanja kinetičke energije molekula, ali je popraćena povećanjem potencijalne energije njihove interakcije. Uostalom, prosječna udaljenost između molekula plina puno je veća nego između molekula tekućine.
Naziva se vrijednost brojčano jednaka količini topline potrebnoj da se tekućina od 1 kg pretvori u paru pri konstantnoj temperaturi specifična toplina isparavanja.
Proces isparavanja tekućine događa se na bilo kojoj temperaturi, dok najbrže molekule napuštaju tekućinu, a ona se tijekom isparavanja hladi. Specifična toplina isparavanja jednaka je specifičnoj toplini isparavanja.
Ova vrijednost je označena slovom r i izražena je u džulima po kilogramu (J/kg).
Specifična toplina isparavanja vode je vrlo visoka: r H20 = 2,256 10 6 J/kg pri temperaturi od 100 °C. U drugim tekućinama, kao što su alkohol, eter, živa, kerozin, specifična toplina isparavanja je 3-10 puta manja od vode.
Za pretvaranje tekućine mase m u paru potrebna je količina topline jednaka:
Q p \u003d rm. (13.6)
Kada se para kondenzira, oslobađa se ista količina topline:
Q k \u003d -rm. (13.7)
Specifična toplina taljenja.
Kada se kristalno tijelo topi, sva toplina koja mu se dovodi odlazi na povećanje potencijalne energije interakcije molekula. Kinetička energija molekula se ne mijenja, budući da se taljenje događa pri konstantnoj temperaturi.
Vrijednost brojčano jednaka količini topline potrebnoj za transformaciju kristalna tvar mase 1 kg na talištu u tekućinu, naziva se specifična toplina taljenja a označavaju se slovom λ.
Tijekom kristalizacije tvari mase 1 kg oslobađa se točno onoliko topline koliko se apsorbira tijekom taljenja.
Specifična toplina taljenja leda je prilično visoka: 3,34 10 5 J/kg.
“Da led nema visoku toplinu taljenja, tada bi se u proljeće cijela masa leda morala otopiti u nekoliko minuta ili sekundi, budući da se toplina kontinuirano prenosi na led iz zraka. Posljedice toga bile bi strašne; jer čak i pod sadašnjom situacijom velike poplave i velike vodene bujice proizlaze iz otapanja velikih masa leda ili snijega.” R. Black, 18. stoljeće
Za taljenje kristalnog tijela mase m potrebna je količina topline jednaka:
Qpl \u003d λm. (13.8)
Količina topline koja se oslobađa tijekom kristalizacije tijela jednaka je:
Q cr = -λm (13.9)
Jednadžba toplinske ravnoteže.
Razmotrimo izmjenu topline unutar sustava koji se sastoji od nekoliko tijela koja početno imaju različite temperature, na primjer, izmjenu topline između vode u posudi i vruće željezne kugle spuštene u vodu. Prema zakonu održanja energije, količina topline koju preda jedno tijelo brojčano je jednaka količini topline koju primi drugo.
Zadana količina topline smatra se negativnom, primljena količina topline smatra se pozitivnom. Dakle, ukupna količina topline Q1 + Q2 = 0.
Ako dolazi do izmjene topline između više tijela u izoliranom sustavu, tada
Q 1 + Q 2 + Q 3 + ... = 0. (13.10)
Jednadžba (13.10) naziva se jednadžba bilance topline.
Ovdje Q 1 Q 2 , Q 3 - količina topline koju su primila ili predala tijela. Te se količine topline izražavaju formulom (13.5) ili formulama (13.6) - (13.9), ako se u procesu prijenosa topline događaju različite fazne transformacije tvari (taljenje, kristalizacija, isparavanje, kondenzacija).