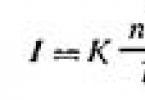Tekst rada je postavljen bez slika i formula.
Puna verzija rada dostupna je u kartici "Job Files" u PDF formatu
Svatko od nas se u svom svakodnevnom životu više puta susreo i suočava s običnim, s jedne strane, ali istovremeno i nevjerojatnim pojavama s druge strane, ne razmišljajući uopće o kakvim divnim fizičkim pojavama imamo posla.
U budućnosti bih želio povezati svoj život sa takvom znanošću kao što je fizika, pa me već zanimaju sva pitanja o ovoj temi i odabrao sam jedan od optičkih učinaka kao temu svog istraživanja.
Do danas postoje radovi posvećeni optičkim efektima, posebno Tyndallovom efektu. Međutim, odlučio sam istražiti ovu temu provodeći eksperiment na vlastitom iskustvu.
Zašto opažamo različite rezultate kada propuštamo svjetlost različitih spektralnih boja kroz mutno staklo, zadimljeni zrak ili otopinu škroba? Zašto nam gusta magla ili kumulusi izgledaju bijeli, a izmaglica od šumskih požara plavkastoljubičasta. Pokušajmo objasniti ove pojave.
Cilj projekta:
detektirati koloide pomoću Tyndallovog efekta;
proučavati utjecaj čimbenika koji određuju prolazak svjetlosnog snopa kroz koloidnu otopinu.
Ciljevi istraživanja:
proučavanje utjecaja valne duljine na provedbu Tyndallovog efekta;
proučavanje utjecaja veličine čestica na provedbu Tyndallovog efekta;
proučavanje utjecaja koncentracije čestica na provedbu Tyndallovog efekta;
tražiti dodatne informacije o Tyndallovom efektu;
generalizacija stečenog znanja.
Tyndallov učinak
Lom svjetlosti, refleksija, disperzija, interferencija, difrakcija i više: optički efekti su svuda oko nas. Jedan od njih je Tyndallov efekt, koji je otkrio engleski fizičar John Tyndall.
John Tyndall je geodet, Faradayev suradnik, direktor Kraljevskog instituta u Londonu, glaciolog i optičar, akustičar i specijalist za magnetizam. Njegovo prezime dalo je ime jednom krateru na Mjesecu, ledenjaku u Čileu i zanimljivom optičkom efektu.
Tyndallov efekt je sjaj optički nehomogenog medija zbog raspršenja svjetlosti koja prolazi kroz njega. Ova pojava nastaje zbog difrakcije svjetlosti na pojedinačnim česticama ili elementima nehomogenosti medija, čija je veličina mnogo manja od valne duljine raspršene svjetlosti.
Što je heterogena okolina? Nehomogeni medij je medij karakteriziran promjenom indeksa loma. Oni. n ≠ konst.
Što je karakteristično za ovaj učinak? Tyndallov efekt tipičan je za koloidne sustave (sustave u kojima je jedna tvar u obliku čestica različitih veličina raspoređena u drugoj. Na primjer, hidrosoli, duhanski dim, magla, gel itd.) s niskom koncentracijom čestica koje imaju indeks loma različit od indeksa loma medija. Obično se promatra kao svjetlosni stožac na tamnoj podlozi (Tyndallov stožac) kada se fokusirana svjetlosna zraka provuče sa strane kroz staklenu posudu s planparalelnim stijenkama ispunjenu koloidnom otopinom. (Koloidne otopine su visoko dispergirani dvofazni sustavi koji se sastoje od disperzijskog medija i disperzne faze, s linearnim veličinama čestica potonje u rasponu od 1 do 100 nm).
Tyndallov efekt je u biti isti kao opalescencija (naglo povećanje raspršenja svjetlosti). No tradicionalno se prvi pojam odnosi na intenzivno raspršenje svjetlosti u ograničenom prostoru duž putanje snopa, a drugi na slabo raspršenje svjetlosti cijelim volumenom promatranog objekta.
Eksperimentalni rad
Koristeći jednostavnu tehniku, vidjet ćemo kako se Tyndallov efekt može koristiti za otkrivanje koloidnih sustava u tekućinama.
Materijali: 2 staklene posude s poklopcima, izvor usmjerenog svjetla (npr. laserski pokazivač), kuhinjska sol, otopina surfaktanta (npr. tekući deterdžent), 1 kokošje jaje, razrijeđena otopina klorovodične kiseline.
Provođenje eksperimenta:
Ulijte vodu u staklenu posudu, potpuno otopite malo kuhinjske soli u njoj.
Bočnu stranu stakla dobivenom otopinom osvijetlimo uskim snopom svjetlosti (zraka laserskog pokazivača). Budući da se sol potpuno otopila, nema vidljivog učinka.
Eksperimentirajte s biološkim materijalom:
Pileće bjelančevine otopite u oko 300 ml 1% otopine soli.
Dobivenu otopinu osvijetlimo uskim snopom svjetlosti. Ako staklo gledate sa strane, na putu snopa vidljiva je svijetla svjetleća traka - pojava Tyndallovog efekta.
Zatim dodajte razrijeđenu otopinu klorovodične kiseline u otopinu proteina. Protein će koagulirati (denaturirati) i stvoriti bjelkasti talog. Na vrhu stakla snop svjetlosti više neće biti vidljiv.
Rezultati eksperimenta: Usmjerite li snop svjetlosti sa strane na staklenu čašu s otopinom soli, snop će biti nevidljiv u otopini. Ako se snop svjetlosti propusti kroz čašu koja sadrži koloidnu otopinu (otopina surfaktanta), bit će vidljiv jer je svjetlost raspršena koloidnim česticama.
Utjecaj valne duljine, veličine čestica i koncentracije na realizaciju Tyndallovog efekta
Valna duljina. Budući da plave valne duljine imaju najkraću duljinu u vidljivom spektru, te se valne duljine reflektiraju od čestica tijekom Tyndallovog efekta, a dulje crvene se lošije raspršuju.
Veličina čestice. Ako se veličina čestica povećava, tada one mogu utjecati na raspršenje svjetlosti bilo koje valne duljine, a "razdvojena" duga se savija, dobivajući potpuno bijelu svjetlost.
Koncentracija čestica. Intenzitet raspršene svjetlosti izravno je proporcionalan koncentraciji čestica u koloidnoj otopini.
Primjena Tyndallovog efekta
Na temelju Tyndallovog efekta, metode detekcije, određivanja veličine i koncentracije koloidnih čestica naširoko se koriste u znanstvenim istraživanjima i industrijskoj praksi (na primjer, u ultramikroskopima).
Ultramikroskop je optički instrument za otkrivanje najmanjih (koloidnih) čestica čije su dimenzije manje od granice rezolucije konvencionalnih svjetlosnih mikroskopa. Mogućnost otkrivanja takvih čestica ultramikroskopom je zbog difrakcije svjetlosti na njima Tyndallovim efektom. S jakim bočnim osvjetljenjem, svaku česticu u ultramikroskopu promatrač označava kao svijetlu točku (svjetleću difrakcijsku točku) na tamnoj pozadini. Zbog difrakcije na najmanjim česticama ima vrlo malo svjetla, stoga se u ultramikroskopu u pravilu koriste jaki izvori svjetlosti.
Ovisno o intenzitetu osvjetljenja, valnoj duljini svjetlosti, razlici između indeksa loma čestice i medija, mogu se detektirati čestice veličine od 20-50 nm do 1-5 μm. Iz difrakcijskih točaka nemoguće je odrediti pravu veličinu, oblik i strukturu čestica. Ultramikroskop ne daje optičke slike predmeta koji se proučavaju. No ultramikroskopom je moguće utvrditi prisutnost i brojčanu koncentraciju čestica, proučavati njihovo kretanje, te izračunati prosječnu veličinu čestica ako je poznata njihova težinska koncentracija i gustoća.
Ultramikroskopi se koriste u proučavanju raspršenih sustava, za kontrolu čistoće atmosferskog zraka. Voda, stupanj kontaminacije optički prozirnih medija stranim inkluzijama.
Zaključak
Tijekom svog istraživanja naučio sam mnogo o optičkim efektima, posebno o Tyndallovom efektu. Ovaj mi je rad pomogao da iznova pogledam kako neke grane fizike tako i naš prekrasni svijet općenito.
Osim aspekata koji se razmatraju u ovom radu, po mom mišljenju, bilo bi zanimljivo istražiti mogućnosti šire praktične primjene Tyndallovog efekta.
Što se tiče svrhe studija, može biti korisno i zanimljivo učenicima koji se bave optikom, kao i svima koji su zainteresirani za fiziku i razne vrste eksperimenata.
Bibliografija
Gavronskaya Yu.Yu. Koloidna kemija: udžbenik. SPb.: Izdavačka kuća Ruskog državnog pedagoškog sveučilišta im. A. I. Herzen, 2007. - 267 str.
Novi politehnički rječnik - M.: Velika ruska enciklopedija, 2000. - .20 str. , 231 str. , 460 str.
Smjernice za izvođenje eksperimenata za "NanoSchoolBox". NanoBioNet e.V/Scince Park Preveo INT.
https://indicator.ru/article/2016/12/04/istoriya-nauki-chelovek-rasseyanie.
http://kf.info.urfu.ru/fileadmin/user_upload/site_62_6389/pdf/FiHNS_proceedings.pdf
http://www.ngpedia.ru/id623274p1.html
ELEKTROKINETIČKA SVOJSTVA KOLOIDA
Elektrokinetičke pojave dijele se u dvije skupine: izravne i obrnute. U izravne spadaju one elektrokinetičke pojave koje nastaju pod djelovanjem vanjskog električnog polja (elektroforeza i elektroosmoza). Obrnuto se nazivaju elektrokinetički fenomeni, kod kojih tijekom mehaničkog kretanja jedne faze u odnosu na drugu nastaje električni potencijal (potencijal strujanja i potencijal taloženja).
Elektroforezu i elektroosmozu otkrio je F. Reiss (1808). Otkrio je da ako se dvije staklene cijevi urone u mokru glinu, napune vodom iu njih stave elektrode, tada se pri prolasku istosmjerne struje čestice gline kreću prema jednoj od elektroda.
Ova pojava kretanja čestica disperzne faze u stalnom električnom polju nazvana je elektroforeza.
U drugom eksperimentu, središnji dio cijevi u obliku slova U u kojoj je bila voda napunjen je zdrobljenim kvarcom, u svako koljeno cijevi postavljena je elektroda i kroz nju je propuštena istosmjerna struja. Nakon nekog vremena, u koljenu, gdje se nalazila negativna elektroda, uočen je porast razine vode, u drugom - pad. Nakon isključenja električne struje razina vode u koljenima cijevi je izjednačena.
Ova pojava gibanja disperzijskog medija u odnosu na stacionarnu disperznu fazu u stalnom električnom polju naziva se elektroosmoza.
Kasnije je Quincke (1859.) otkrio fenomen suprotan elektroosmozi, nazvan perkolacijski potencijal. Sastoji se od činjenice da kada tekućina teče pod pritiskom kroz poroznu dijafragmu, nastaje potencijalna razlika. Glina, pijesak, drvo i grafit ispitani su kao materijali dijafragme.
Fenomen, obrnut od elektroforeze, i nazvan sedimentacijski potencijal, otkrio je Dorn (1878). Kada su se čestice kvarcne suspenzije taložile pod djelovanjem gravitacije, nastala je potencijalna razlika između razina različitih visina u posudi.
Svi elektrokinetički fenomeni temelje se na prisutnosti dvostrukog električnog sloja na granici krute i tekuće faze.
http://junk.wen.ru/o_6de5f3db9bd506fc.html
18. Posebna optička svojstva koloidnih otopina zbog svojih glavnih karakteristika: disperzija i heterogenost. Na optička svojstva disperznih sustava uvelike utječu veličina i oblik čestica. Prolaz svjetlosti kroz koloidnu otopinu popraćen je takvim pojavama kao što su apsorpcija, refleksija, lom i raspršenje svjetlosti. Prevladavanje bilo kojeg od ovih fenomena određeno je omjerom između veličine čestica disperzne faze i valne duljine upadne svjetlosti. NA grubi sustavi uglavnom se opaža refleksija svjetlosti od površine čestica. NA koloidne otopine veličine čestica su usporedive s valnom duljinom vidljive svjetlosti, koja određuje raspršenje svjetlosti zbog difrakcije svjetlosnih valova.
Raspršenje svjetlosti u koloidnim otopinama očituje se u obliku opalescencija– mat sjaj (obično plavkastih nijansi), koji je jasno vidljiv na tamnoj pozadini s bočnim osvjetljenjem sola. Uzrok opalescencije je raspršenje svjetlosti na koloidnim česticama uslijed difrakcije. Opalescencija je povezana s fenomenom karakterističnim za koloidne sustave - Tyndallov učinak: kada snop svjetlosti prolazi kroz koloidnu otopinu iz smjerova okomitih na snop, opaža se stvaranje svjetlećeg stošca u otopini.
Tyndallov efekt, Tyndallovo raspršenje je optički efekt, raspršenje svjetlosti pri prolasku svjetlosne zrake kroz optički nehomogenu sredinu. Obično se promatra kao svjetleći stožac (Tyndallov stožac) vidljiv na tamnoj pozadini.
Tipično je za otopine koloidnih sustava (npr. metalni solovi, razrijeđeni lateksi, duhanski dim), u kojima se čestice i njihova okolina razlikuju po indeksu loma. Brojne optičke metode za određivanje veličine, oblika i koncentracije koloidnih čestica i makromolekula temelje se na Tyndallovom efektu. .
19. Zoli - to su slabo topive tvari (soli kalcija, magnezija, kolesterola i dr.) koje postoje u obliku liofobnih koloidnih otopina.
Newtonska tekućina je viskozna tekućina koja u svom strujanju poštuje Newtonov zakon viskoznog trenja, odnosno tangencijalno naprezanje i gradijent brzine u takvoj tekućini linearno su ovisni. Faktor proporcionalnosti između ovih veličina poznat je kao viskoznost.
Newtonov fluid nastavlja teći čak i ako su vanjske sile vrlo male, sve dok nisu striktno jednake nuli. Za Newtonov fluid, viskoznost, po definiciji, ovisi samo o temperaturi i tlaku (i također o kemijskom sastavu ako fluid nije čist), a ne ovisi o silama koje na njega djeluju. Tipična Newtonova tekućina je voda.
Ne-Newtonov fluid je fluid u kojem njegova viskoznost ovisi o gradijentu brzine. Tipično, takve tekućine su vrlo nehomogene i sastoje se od velikih molekula koje tvore složene prostorne strukture.
Najjednostavniji ilustrativni primjer kućanstva je mješavina škroba s malom količinom vode. Što je brži vanjski utjecaj na makromolekule veziva suspendirane u tekućini, to je njezina viskoznost veća.
***Na Newtona je pala jabuka, Kinezi su se divili kapljicama na lotosovim cvjetovima, a John Tyndall je, vjerojatno šetajući šumom, primijetio stožac svjetlosti. Priča? Može biti. No, u čast posljednjeg heroja nazvan je jedan od najljepših učinaka našeg svijeta - Tyndallov učinak....***
Raspršenje svjetlosti jedna je od općih karakteristika visoko disperznih sustava.
Pod bočnim osvjetljenjem raspršenog sustava opaža se karakterističan iridescentni, u pravilu, plavičasti sjaj, koji je posebno jasno vidljiv na tamnoj pozadini.
Ovo svojstvo, povezano s raspršivanjem svjetlosti česticama raspršene faze, naziva se opalescencija, od imena opala - opalus (lat.), Prozirni mineral plavkaste ili žućkasto-bijele boje. Godine 1868. otkrio je da kada se koloidna otopina osvijetli sa strane snopom svjetlosti iz jakog izvora, opaža se svijetli jednoliko svjetleći stožac - Tyndallov stožac, ili Tyndallov učinak, dok se u slučaju otopine niske molekulske mase tekućina čini optički praznom, tj. trag grede je nevidljiv.
lijevo - 1% otopina škroba, desno - voda.
Tyndallov učinak javlja se tijekom raspršenja suspendiranih čestica, čija veličina premašuje veličinu atoma za desetke puta. Kada se čestice suspenzije povećaju na veličine reda veličine 1/20 valne duljine svjetlosti (od oko 25 nm i više), raspršenje postaje polikromatsko, odnosno svjetlost se počinje ravnomjerno raspršivati po cijelom vidljivom rasponu boja. od ljubičaste do crvene. Kao rezultat toga, Tyndallov efekt nestaje. Zato nam se gusta magla ili kumulusi čine bijelima - sastoje se od guste suspenzije vodene prašine promjera čestica od mikrona do milimetara, što je znatno iznad Tyndallovog praga raspršenja.
Možda mislite da nam nebo izgleda plavo zbog Tyndallovog efekta, ali nije. U nedostatku oblaka ili dima, nebo postaje plavo-plavo zbog raspršenja "dnevne svjetlosti" na molekulama zraka. Ova vrsta raspršenja naziva se Rayleighovo raspršenje (prema Sir Rayleighu). Rayleighovo raspršenje raspršuje plavu i cijan svjetlost čak i više od Tyndallovog efekta: na primjer, plava svjetlost valne duljine 400 nm raspršuje se u čistom zraku devet puta jače od crvene svjetlosti valne duljine 700 nm. Zbog toga nam nebo izgleda plavo - sunčeva svjetlost se raspršuje po cijelom spektralnom području, ali je u plavom dijelu spektra gotovo za red veličine jača nego u crvenom. Ultraljubičaste zrake koje uzrokuju opekline su još više raspršene. Zbog toga se preplanulost prilično ravnomjerno raspoređuje po tijelu, pokrivajući čak i one dijelove kože koji nisu izloženi izravnoj sunčevoj svjetlosti.
Gerasimenko Evgeniya
Ovo izlaganje posvećeno je opisu Tyndallovog efekta i njegovoj praktičnoj primjeni.
Preuzimanje datoteka:
Pregled:
Za korištenje pregleda prezentacija kreirajte Google račun (račun) i prijavite se: https://accounts.google.com
Naslovi slajdova:
Ispunila: učenica 11. razreda "B" Evgenia Gerasimenko Provjerila: učiteljica kemije Yurkina T.I. 2012/2013 akademska godina tyndallov učinak
John Tyndall, irski fizičar i inženjer. Rođen u Lylin Bridgeu, okrug Carlow. Nakon završene srednje škole radio je kao topograf-mjernik u vojnim organizacijama i na izgradnji željeznica. Istodobno je diplomirao na Strojarskom institutu u Prestonu. Otpušten iz vojne geodetske službe zbog prosvjeda protiv loših uvjeta rada. Predavao je na Queenwood Collegeu (Hampshire), a nastavio se i samoobrazovati. Godine 1848–51 slušao predavanja na sveučilištima u Marburgu i Berlinu. Vrativši se u Englesku, postao je učitelj, a potom i profesor na Kraljevskom institutu u Londonu. Glavni radovi znanstvenika posvećeni su magnetizmu, akustici, apsorpciji toplinskog zračenja plinovima i parama, raspršenju svjetlosti u mutnim medijima. Proučavao strukturu i kretanje ledenjaka u Alpama. Tyndall je bio izuzetno strastven oko ideje popularizacije znanosti. Redovito je držao javna predavanja, često u obliku besplatnih predavanja za sve: za radnike u tvorničkim dvorištima u vrijeme ručka, božićna predavanja za djecu u Kraljevskom institutu. Tyndallova slava kao popularizatora stigla je i s druge strane Atlantika - cijela naklada američkog izdanja njegove knjige Fragmenti znanosti rasprodana je u jednom danu. Umro je apsurdnom smrću 1893. godine: dok je pripremala večeru, znanstvenikova supruga (koja ga je nadživjela 47 godina) greškom je umjesto kuhinjske soli upotrijebila jedan od kemijskih reagensa pohranjenih u kuhinji.
Opis Tyndallov efekt - sjaj optički nehomogenog medija uslijed raspršenja svjetlosti koja prolazi kroz njega. Nastaje ogibom svjetlosti na pojedinim česticama ili elementima strukturne nehomogenosti medija, čija je veličina znatno manja od valne duljine raspršene svjetlosti. Tipično je za koloidne sustave (na primjer, hidrosoli, duhanski dim) s niskom koncentracijom čestica disperzne faze, koje imaju indeks loma različit od indeksa loma disperzijskog medija. Obično se promatra kao svjetlosni stožac na tamnoj podlozi (Tyndallov stožac) kada se fokusirana svjetlosna zraka provuče sa strane kroz staklenu ćeliju planparalelnih stijenki ispunjenu koloidnom otopinom. Kratkovalnu komponentu bijele (nemonokromatske) svjetlosti raspršuju koloidne čestice jače od dugovalne komponente, stoga Tyndallov stožac koji ona tvori u neupijajućem pepelu ima plavu nijansu. Tyndallov efekt je u biti isti kao opalescencija. No tradicionalno se prvi pojam odnosi na intenzivno raspršenje svjetlosti u ograničenom prostoru duž putanje snopa, a drugi na slabo raspršenje svjetlosti cijelim volumenom promatranog objekta.
Tyndallov efekt opaža se golim okom kao jednoliki sjaj nekog dijela volumena sustava za raspršivanje svjetlosti. Svjetlost dolazi iz pojedinačnih točkica - difrakcijskih mrlja, dobro vidljivih pod optičkim mikroskopom uz dovoljno jaku iluminaciju razrijeđenog sola. Intenzitet raspršene svjetlosti u određenom smjeru (pri konstantnim parametrima upadne svjetlosti) ovisi o broju raspršujućih čestica i njihovoj veličini.
Vremensko određivanje Vrijeme početka (log do -12 do -6); Životni vijek (log tc -12 do 15); Vrijeme razgradnje (log td -12 do -6); Optimalno vrijeme razvoja (log tk -9 do -7). Tehnička izvedba efekta Učinak se lako može uočiti kada zraka helij-neonskog lasera prođe kroz koloidnu otopinu (jednostavno neobojeni škrobni žele). Dijagram
Primjena efekta Temeljene na Tyndallovom efektu, metode detekcije, određivanja veličine i koncentracije koloidnih čestica (ultramikroskopija, nefelometrija imaju široku primjenu u znanstvenim istraživanjima i industrijskoj praksi).
Primjer. Ultramikroskop. Ultramikroskop je optički instrument za otkrivanje najmanjih (koloidnih) čestica čije su dimenzije manje od granice rezolucije konvencionalnih svjetlosnih mikroskopa. Mogućnost otkrivanja takvih čestica ultramikroskopom je zbog difrakcije svjetlosti na njima Tyndallovim efektom. S jakim bočnim osvjetljenjem, svaku česticu u ultramikroskopu promatrač označava kao svijetlu točku (svjetleću difrakcijsku točku) na tamnoj pozadini. Zbog difrakcije na najmanjim česticama ima vrlo malo svjetla, stoga se u ultramikroskopu u pravilu koriste jaki izvori svjetlosti. Ovisno o intenzitetu osvjetljenja, valnoj duljini svjetlosti, razlici između indeksa loma čestice i medija, mogu se detektirati čestice veličine od 20-50 nm do 1-5 μm. Iz difrakcijskih točaka nemoguće je odrediti pravu veličinu, oblik i strukturu čestica. Ultramikroskop ne daje optičke slike predmeta koji se proučavaju. No ultramikroskopom je moguće utvrditi prisutnost i brojčanu koncentraciju čestica, proučavati njihovo kretanje, te izračunati prosječnu veličinu čestica ako je poznata njihova težinska koncentracija i gustoća. U shemi ultramikroskopa s prorezom (slika 1a), sustav koji se proučava je nepokretan.
U shemi ultramikroskopa s prorezom sustav koji se proučava je nepomičan. Shematski prikaz procjepnog mikroskopa. Kiveta 5 s predmetom koji se proučava osvijetljena je izvorom svjetlosti 1 (2 - kondenzator, 4 - rasvjetna leća) kroz uski pravokutni prorez 3, čija se slika projicira u područje promatranja. U okularu promatračkog mikroskopa 6 vidljive su svjetleće točkice čestica koje se nalaze u ravnini slike proreza. Iznad i ispod osvijetljenog područja prisutnost čestica se ne otkriva.
U protočnom ultramikroskopu proučavane se čestice kreću po cijevi prema oku promatrača. Shematski prikaz protočnog mikroskopa Prelazeći zonu osvjetljenja registriraju se kao sjajni bljeskovi vizualno ili fotometrijskim uređajem. Podešavanjem svjetline osvjetljenja promatranih čestica pomičnim fotometrijskim klinom 7 moguće je izdvojiti za registraciju čestice čija veličina prelazi unaprijed zadanu granicu. Suvremenim in-line ultramikroskopom s laserskim izvorom svjetlosti i optoelektroničkim sustavom detekcije čestica određena je koncentracija čestica u aerosolima u rasponu od 1 do 109 čestica po 1 cm3, a također su određene funkcije raspodjele veličine čestica. Ultramikroskopi se koriste u proučavanju raspršenih sustava, za kontrolu čistoće atmosferskog zraka. Voda, stupanj kontaminacije optički prozirnih medija stranim inkluzijama.
Korištena literatura 1. Fizika. Big Encyclopedic Dictionary.- M.: Big Russian Encyclopedia, 1999.- P.90, 460. 2. Novi politehnički rječnik.- M.: Big Russian Encyclopedia, 2000.- P.20, 231, 460. Ključne riječi optički sjaj inhomogeneous two-phase medium disperzni medij za raspršivanje svjetlosti
Po optičkim svojstvima koloidne otopine bitno se razlikuju od pravih otopina niskomolekularnih tvari, kao i od grubo disperznih sustava. Najkarakterističnija optička svojstva koloidno-disperznih sustava su opalescencija, Faraday-Tyndallov efekt i boja. Svi ovi fenomeni posljedica su raspršenja i apsorpcije svjetlosti od strane koloidnih čestica.
Ovisno o valnoj duljini vidljive svjetlosti i relativnim veličinama čestica disperzne faze, raspršenje svjetlosti poprima različit karakter. Ako veličina čestica prelazi valnu duljinu svjetlosti, tada se svjetlost od njih odbija prema zakonima geometrijske optike. U tom slučaju dio svjetlosnog zračenja može prodrijeti unutar čestica, doživjeti lom, unutarnji odraz i biti apsorbiran.
Ako je veličina čestice manja od poluvalne duljine upadne svjetlosti, opaža se difrakcijsko raspršenje svjetlosti; svjetlost, takoreći, zaobilazi (omotava) čestice koje se susreću na putu. U tom slučaju dolazi do djelomičnog raspršenja u obliku valova koji divergiraju u svim smjerovima. Kao rezultat raspršenja svjetlosti, svaka čestica je izvor novih, manje intenzivnih valova, tj. kao da dolazi do samosvjetljenja svake čestice. Pojava raspršenja svjetlosti na sitnim česticama naziva se opalescencija. Karakterističan je uglavnom za solove (tekuće i čvrste), opaža se samo u reflektiranoj svjetlosti, tj. sa strane ili na tamnoj pozadini. Ova pojava se izražava u pojavi nekog zamućenja sola i u promjeni (“prelijevanju”) njegove boje u odnosu na boju u propuštenoj svjetlosti. Boja u reflektiranoj svjetlosti u pravilu je pomaknuta prema višoj frekvenciji vidljivog dijela spektra. Dakle, bijeli soli (sol srebrnog klorida, kolofonij, itd.) opalescentni plavičastom bojom.
Faraday-Tyndallov učinak. Difrakcijsko raspršenje svjetlosti prvi je primijetio M. V. Lomonosov. Kasnije, 1857. godine, ovaj je fenomen opazio Faraday u zlatnim solima. Pojavu difrakcije (opalescencije) za tekuće i plinovite medije najdetaljnije je proučavao Tyndall (1868).
Ako uzmete jednu čašu s otopinom natrijevog klorida, a drugu s hidrosolom bjelanjka, teško je ustanoviti gdje je koloidna, a gdje prava otopina, jer obje tekućine izgledaju bezbojno i prozirno (sl. 6.5). . Međutim, ta se rješenja mogu lako razlikovati izvođenjem sljedećeg pokusa. Stavimo na izvor svjetlosti (stolnu svjetiljku) neprozirno kućište s rupom, ispred koje, da bismo dobili uži i svjetliji snop svjetlosti, stavimo leću. Ako obje čaše postavimo na putanju snopa svjetlosti, u čaši sa solom ćemo vidjeti svjetlosnu stazu (konus), dok je u staklu s natrijevim kloridom snop gotovo nevidljiv. Po imenu znanstvenika koji su prvi promatrali ovu pojavu, svjetleći stožac u tekućini nazvan je Faraday-Tyndallov stožac (ili efekt). Ovaj učinak karakterističan je za sve koloidne otopine.
Pojava Faraday-Tyndallovog stošca objašnjava se fenomenom raspršenja svjetlosti koloidnim česticama veličine 0,1-0,001 mikrona.
Valna duljina vidljivog dijela spektra je 0,76-0,38 mikrona, pa svaka koloidna čestica raspršuje svjetlost koja pada na nju. Vidljivo je u Faraday-Tyndallovom stošcu kada je vidna linija usmjerena pod kutom u odnosu na zraku koja prolazi kroz sol. Dakle, Faraday-Tyndallov efekt je pojava identična opalescenciji, a od potonje se razlikuje samo po obliku koloidnog stanja, odnosno mikroheterogenosti sustava.
Teoriju raspršenja svjetlosti koloidnim disperznim sustavima razvio je Rayleigh 1871. Ona utvrđuje ovisnost intenziteta (količine energije) raspršene svjetlosti (I) tijekom opalescencije i u Faraday-Tyndallovom stošcu o vanjskim i unutarnjim čimbenicima. Matematički, ova se ovisnost izražava u obliku formule koja se naziva Rayleighova formula:
| | 6.1 |
gdje je I intenzitet raspršene svjetlosti u smjeru okomitom na upadni snop svjetlosti; K je konstanta koja ovisi o indeksima loma disperzijskog medija i disperzne faze; n je broj čestica po jedinici volumena sola; λ je valna duljina upadne svjetlosti; V je volumen svake čestice.
Iz formule (6.1) slijedi da je raspršenje svjetlosti (I) proporcionalno koncentraciji čestica, kvadratu volumena čestice (ili za sferne čestice - šestoj potenciji njihova radijusa) i obrnuto proporcionalno četvrtoj snaga valne duljine upadne svjetlosti. Dakle, raspršenje kratkih valova događa se relativno intenzivnije. Stoga se bezbojni solovi čine crvenkastim u propuštenoj svjetlosti, a plavi u difuznoj svjetlosti.
Bojanje koloidnih otopina. Kao rezultat selektivne apsorpcije svjetlosti (apsorpcije) u kombinaciji s difrakcijom nastaje jedna ili druga boja koloidne otopine. Iskustvo pokazuje da je većina koloidnih (osobito metalnih) otopina svijetlo obojena u široku paletu boja, od bijele do potpuno crne, sa svim nijansama spektra boja. Dakle, As 2 S 3 soli su svijetlo žuti, Sb 2 S 3 - narančasti, Fe (OH) 3 - crvenkasto smeđi, zlatni - svijetlo crveni itd.
Isti sol ima različitu boju ovisno o tome gleda li se u propuštenoj ili reflektiranoj svjetlosti. Solovi iste tvari, ovisno o načinu pripreme, mogu dobiti različitu boju - pojava polikromije (višebojnosti). Boja sola u ovom slučaju ovisi o stupnju disperzije čestica. Dakle, grubo raspršeni zlatni soli imaju plavu boju, veći stupanj disperzije - ljubičastu, a visoko raspršeni - svijetlo crvenu. Zanimljivo je primijetiti da boja metala u nedisperziranom stanju nema nikakve veze s njegovom bojom u koloidnom stanju.
Treba napomenuti da je intenzitet boje solova desetke (ili čak stotine) puta veći od intenziteta molekularnih otopina. Tako je žuta boja sola As 2 S 3 u sloju debljine 1 cm jasno vidljiva pri masenoj koncentraciji od 10 -3 g/l, a crvena boja sola zlata uočljiva je već pri koncentraciji od 10 -3 g/l. 5 g/l.
Lijepa i svijetla boja mnogih dragulja i poludragog kamenja (rubina, smaragda, topaza, safira) rezultat je sadržaja zanemarivih (koje se ne mogu otkriti ni na najboljoj analitičkoj vagi) količina nečistoća teških metala i njihovih oksida, koji se nalaze u koloidno stanje. Dakle, za umjetno dobivanje svijetlog rubinskog stakla koje se koristi za automobilske, biciklističke i druge svjetiljke, dovoljno je dodati samo 0,1 kg koloidnog zlata na 1000 kg staklene mase.