5 pamoka
Tema: Elektrolitinės disociacijos proceso esmė
Tikslai ir siekiai:
Švietimas:suformuoti sąvokas „elektrolitai, neelektrolitai, tirpalas, hidratacija, hidratai, kristaliniai hidratai, kristalizacijos vanduo“, atskleisti elektrolitinės disociacijos proceso esmę, apsvarstyti pagrindines elektrolitinės disociacijos teorijos nuostatas;
Kuriama: ugdyti gebėjimą dirbti su tekstu, charakterizuoti elektrolitinės disociacijos procesą;
Švietimas: ugdyti domėjimąsi chemija, formuoti mokslinę pasaulėžiūrą.
Įranga: druska, vanduo, stalas, vadovėlis, sąsiuviniai, do.kortelės.
Užsiėmimų metu:
1) Organizacinis momentas
2) Tikrinant d.z.
Frontalinis pokalbis: „Pagrindinės neorganinių medžiagų klasės“;
Individualus laiškus. kortelių apklausa
1 variantas. Pateikite apibrėžimus: druskos, oksidai. Pateikite jų klasifikaciją.
Pateikite pavyzdžių
2 variantas. Pateikite apibrėžimus: bazės, rūgštys. Pateikite jų klasifikaciją.
Pateikite pavyzdžių.
Diktantas
Parašykite rūgščių formules, jų rūgščių likučius, nurodykite jų valentingumą.
3) Naujos medžiagos mokymasis
1.Žinių atnaujinimas
I. Eksperimentai su sausomis medžiagomis, tirpalais ir lydalomis elektros srovei pravesti
Pav.1 p.3
Sausas NaCl, soda
Distiliuotas vanduo – nelaidi elektros
NaCl, šarmų, druskų tirpalai – laidūs srovei
Gliukozės tirpalai
Alkoholis – nelaidi elektros
Sachara
Deguonis
azoto
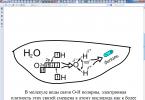
II. Tirpimo vandenyje mechanizmas
1) B įėjimas su jonine jungtimi
2 pav. Na + Cl - + H-O-H
P-re jonai yra hidratuojami - apsuptas vandens molekulių
2) In-in su kovalentiniu poliniu ryšiu
НCl H + + Cl - hidratuoti jonai
Kovalentinė jungtis tampa jonine
III. Medžiagos
Elektrolitai Neelektrolitai p.5
… …
Apibrėžimai
Druskos deguonis
Šarminis azotas
Vandenilio rūgštys
Su joniniu arba kovalentiniu su kovalentiniu nepoliniu / silpnai poliniu ryšiu
labai polinis ryšys
IV. Elektrolitinė disociacija -elektrolito skilimo į jonus procesas, kai jis ištirpsta vandenyje arba ištirpsta.
V. Tirpimas yra fizinis ir cheminis procesas
V. Jonų hidratacija
Kablukovas ir Kistjakovskis pasiūlė, kad kai p-renis, vandens molekulės prisijungia prie jonų ir susidaro hidratuoja
Apibrėžimas p.6
VI Kristaliniai hidratai ir kristalizacijos vanduo
C.7 apibrėžimas
VII.Pagrindinės nuostatoselektrolitinės disociacijos teorijos
Sam-bet p.8-9 mintinai
4) Tvirtinimas
B.1-6 p.13
5) Refleksija
6) d.z.
P.1 perpasakojimas, teorijos apibrėžimai ir nuostatos mintinai
Kazachstanas, Šiaurės Kazachstano sritis, vietovė pavadinta Gabit Musrepov vardu, Sokologorovka kaimas
KSU „Sokologorovskajos vidurinė mokykla“
Pamoka 9 klasėje
Tema: „Disociacijos proceso esmė“
Pamokos planas
Tema: Elektrolitinės disociacijos proceso esmė
Pamokos tikslai: gilinti ir apibendrinti žinias, pagrindines elektrolitinės disociacijos sąvokas; išmokyti jas taikyti sudarant disociacijos lygtis; pateikti idėją apie elektrolitinės disociacijos teorijos universalumą ir jos taikymą neorganinėje chemijoje.
Pagrindinės sąvokos: elektrolitai, neelektrolitai, disociacija, hidratai, kristaliniai hidratai.
Pamokos struktūra
1) Organizacinis momentas
2) Namų darbų tikrinimas
3) Naujos medžiagos mokymasis
4) Naujos medžiagos konsolidavimas
5) Namų darbai, įvertinimas
Per užsiėmimus
1) Organizacinis momentas (3-5 min.)
2) Namų darbų tikrinimas (10 min.)
a) Nustatykite kovalentinius polinius ir nepolinius ryšius šiose molekulėse: N 2, CO 2, NH 3, SO 2, HBr.
b) Kas yra elektronegatyvumas?
c) Kaip susidaro σ ryšiai ir π ryšiai?
d) Dėl ko smarkiai skiriasi CO 2 ir SiO 2 fizikinės savybės?
e) Išvardykite cheminių jungčių tipus.
3) Naujos medžiagos mokymasis (15-20 min.)
Elektrolitai ir neelektrolitai. Medžiagų, turinčių įvairių tipų cheminius ryšius, tirpimo vandenyje ypatumus galima tirti eksperimentiškai, tiriant šių medžiagų tirpalų elektrinį laidumą, naudojant tirpalų elektrinio laidumo tikrinimo prietaisą.
Jei prietaiso elektrodai panardinami, pavyzdžiui, į sausą valgomąją druską, lemputė neužsidega. Tas pats rezultatas bus gautas, jei elektrodai bus nuleisti į distiliuotą vandenį. Tačiau kai elektrodai panardinami į vandeninį natrio chlorido tirpalą, lemputė pradeda šviesti. Tai reiškia, kad natrio chlorido tirpalas praleidžia elektrą. Kitos tirpios druskos, šarmai ir rūgštys elgiasi panašiai kaip natrio chloridas. Druskos ir šarmai praleidžia elektros srovę ne tik vandeniniuose tirpaluose, bet ir lydaluose. Vandeniniai tirpalai, tokie kaip cukrus, gliukozė, alkoholis, deguonis, azotas, nepraleidžia elektros. Pagal šias savybes visos medžiagos skirstomos į e elektrolitų Ir ne elektrolitai.
Medžiagų, turinčių skirtingą cheminio ryšio pobūdį, tirpimo vandenyje mechanizmas. Kodėl druskos, šarmai ir rūgštys vandeniniame tirpale praleidžia elektros srovę iš nagrinėjamų pavyzdžių? Norint atsakyti į šį klausimą, būtina prisiminti, kad medžiagų savybes lemia jų struktūra. Pavyzdžiui, natrio chlorido kristalų struktūra skiriasi nuo deguonies ir vandenilio molekulių struktūros.
Norint teisingai suprasti medžiagų, turinčių joninį ryšį, tirpimo vandenyje mechanizmą, taip pat reikėtų atsižvelgti į tai, kad vandens molekulėse yra kovalentinės labai polinės jungtys tarp vandenilio ir deguonies atomų. Todėl vandens molekulės yra polinės. Dėl to, pavyzdžiui, ištirpus natrio chloridui, vandens molekulės neigiamais poliais pritraukiamos prie teigiamų polių – prie neigiamo krūvio chlorido jonų. Dėl to susilpnėja ryšys tarp jonų ir sunaikinama kristalinė gardelė. Šį procesą taip pat palengvina vandens dielektrinė konstanta, kuris esant 20ºС yra lygus 81. Cheminis ryšys tarp jonų vandenyje, lyginant su vakuumu, susilpnėja 81 kartą.
Kai vandenyje ištirpinamos medžiagos, turinčios labai polinį kovalentinį ryšį, pavyzdžiui, vandenilio chlorido HCl, cheminio ryšio pobūdis pasikeičia, t.y. veikiant poliarinėms vandens molekulėms, kovalentinis polinis ryšys virsta joniniu, o tada vyksta dalelių atskyrimo procesas.
Tirpstant elektrolitams, didėja dalelių svyravimo judesiai, dėl to susilpnėja jų tarpusavio ryšys. Dėl to sunaikinama ir kristalinė gardelė. Vadinasi, ištirpus druskoms ir šarmams šios medžiagos suyra į jonus.
Elektrolito skilimo į jonus procesas, kai jis ištirpsta vandenyje arba ištirpsta, vadinamas elektrolitine disociacija.
Pagrindinės teorinės elektrolitinės disociacijos nuostatos 1887 m. suformulavo švedų mokslininkas Svante Arrhenius. Tačiau S. Arrhenius nepavyko iki galo atskleisti elektrolitinės disociacijos proceso sudėtingumo. Jis neatsižvelgė į tirpiklio molekulių vaidmenį ir manė, kad vandeniniame tirpale yra laisvųjų jonų. Elektrolitinės disociacijos samprata buvo toliau plėtojama Rusijos mokslininkų I. A. Kablukovo ir V. A. Kistyakovskio darbuose. Kad suprastume šių mokslininkų idėjų esmę, susipažinkime su reiškiniais, kurie atsiranda, kai medžiagos ištirpsta vandenyje.
Kai kietas natrio hidroksidas NaOH arba koncentruota sieros rūgštis H 2 SO 4 ištirpinama vandenyje, atsiranda stiprus kaitinimas. Ypač atsargiai reikia tirpinti sieros rūgštį, nes dėl temperatūros padidėjimo dalis vandens gali virsti garais ir, veikiant jo slėgiui, gali išmesti rūgštį iš indo. Norėdami to išvengti, sieros rūgštis plona srovele (bet ne atvirkščiai!) pilama į vandenį nuolat maišant.
Jei, pavyzdžiui, amonio nitratas (amonio nitratas) ištirpinamas vandenyje plonasienėje stiklinėje, padėtoje ant šlapios lentos, tada pastebimas toks stiprus atšalimas, kad stiklas net prišąla prie jo. Kodėl tirpinant medžiagas kai kuriais atvejais pastebimas kaitinimas, o kitais – atšalimas?
Kai kietosios medžiagos ištirpsta, jų kristalinės gardelės sunaikinamos, o susidariusios dalelės pasiskirsto tarp tirpiklio molekulių. Kuriame iš išorės sugeriama reikalinga energija ir atsiranda vėsinimas. Tuo remiantis turėtų būti priskirtas likvidavimo procesas fiziniai reiškiniai.
Kodėl kai kurios medžiagos kaista?
Kaip žinome, šilumos išsiskyrimas yra cheminės reakcijos požymis. Vadinasi, ištirpus taip pat vyksta cheminės reakcijos. Pavyzdžiui, sieros rūgšties molekulės reaguoja su vandens molekulėmis ir susidaro junginiai, kurių sudėtis yra H 2 SO 4 ·H 2 O (sieros rūgšties monohidratas) ir H 2 SO 4 ·2H 2 O (sieros rūgšties dihidratas), t.y. sieros rūgšties molekulė prijungia vieną ar dvi vandens molekules.
Sieros rūgšties molekulių sąveika su vandens molekulėmis vadinama hidratacijos reakcijomis, o medžiagos, kurios šiuo atveju susidaro, vadinamos hidratais.
Iš aukščiau pateiktų pavyzdžių matyti, kad kietosioms medžiagoms ištirpus vandenyje, vyksta tiek fizikiniai, tiek cheminiai procesai. Jei dėl hidratacijos išsiskiria daugiau energijos, nei ji sunaudojama medžiagos kristalams naikinti, tada tirpimą lydi kaitinimas, jei atvirkščiai - aušinimas.
Vadinasi, tirpimas yra fizikinis ir cheminis procesas.
Tokį tirpimo proceso esmės ir sprendimų pobūdžio paaiškinimą pirmasis teoriškai pagrindė didysis rusų mokslininkas D.I.Mendelejevas. jie išsivystė tirpalų hidratų teorija.
Tiriant hidratacijos procesus, mokslininkams kilo klausimas: su kokiomis dalelėmis reaguoja vanduo?
I.A.Kablukovas ir V.A.Kistyakovskis, nepriklausomai vienas nuo kito, pasiūlė, kad elektrolitų jonai reaguoja su vandens molekulėmis, t.y. vyksta jonų drėkinimas. Tai
4) Naujos medžiagos konsolidavimas (5-7 min.)
a) Kada buvo pradėti tyrinėti oro sudėtis?
b) Kokių medžiagų yra ore?
c) Kuris mokslininkas pirmasis nustatė Prancūzijos oro sudėtį 1774 m.?
5) Namų darbai, vertinimas (3 min.)
§26 perpasakojimas p.70-72; pratimai Nr.3, 4,5 p.72
Chemijos pamokos santrauka 9 klasė
Pamokos tema „Elektrolitinė disociacija“
Pamokos tipas:Žinių apibendrinimas ir sisteminimas.
Tikslas:įtvirtinti studentų žinias tema „Elektrolitinės disociacijos teorija“
Užduotys:
Švietimas:
Įtvirtinti studentų žinias apie elektrolitinės disociacijos proceso esmę,
Padėkite mokiniams suprasti pagrindines temos sąvokas,
Padėti įsisavinti proceso mechanizmų ir sąlygų sampratą, naudojant elektrolito, neelektrolito sąvokas;
Išmokite rašyti chemines reakcijas molekuline ir jonine forma.
Kuriama:
gilinti ir plėsti žinias apie medžiagų savybes joniniame lygmenyje;
formuoti mokslinę pasaulėžiūrą ir psichikos veiklos metodų kūrimą;
toliau ugdyti kalbėjimo įgūdžius, stebėjimą ir gebėjimą daryti išvadas remiantis parodomuoju eksperimentu;
mokėti pritaikyti pagrindinius užrašus ir juos rengti savarankiškai.
Pedagogai:
formuoti mokslinį požiūrį į medžiagų struktūrą ir savybes;
atskleisti idėją tobulinti žinias apie fizikinius ir cheminius procesus kaupiant naujus faktus ir remiantis eksperimentu;
sudaryti sąlygas mokymuisi, besidominčiai mokymusi, formuoti mokinių požiūrį į chemiją, kaip į galimą būsimos praktinės veiklos sritį.
Pamokos struktūra:
Organizacinis momentas (2 min.);
Pamokos temos ir tikslo pristatymas (2 min.);
Motyvacijos formavimas (1 min.);
Pagrindinių žinių atnaujinimas (5 min.);
Apibendrinimas ir sisteminimas (15 min.)
Žinių ir įgūdžių pritaikymas (18 min.);
Pamokos rezultatų apibendrinimas (1 min.)
Namų darbų atsiskaitymas ir komentavimas (1 min.)
Per užsiėmimus
Ankstesnėse pamokose susipažinome su viena svarbiausių teorijų, kuria remiasi chemijos mokslas – tai elektrolitinės disociacijos teorija.Mokiniai atidžiai klauso mokytojo
Ir šiandien pamokoje turime apibendrinti ir susisteminti žinias apie šią teoriją ir įtvirtinti gebėjimą sudaryti disociacijos ir jonų mainų reakcijų lygtis. Pamokos metu atliksime įvairias užduotis, tam turite darbalapius su užduotimis ir lentelę, kurioje rezultatus suvesite savo lentelėse. Pamokos pabaigoje galėsite savarankiškai įvertinti savo žinias nagrinėjama tema.
Priekinė
Pirmiausia prisiminkime sąvokos „elektrolitai“ apibrėžimą. Kas tai yra?
Kas yra "ne elektrolitai"?
Dabar pateikite „elektrolitinės disociacijos“ apibrėžimą
Medžiagos koto tirpalai arba lydalaielektrolitų .
Vadinamos medžiagos, kurių tirpalai ir lydalai nelaidžia elektros energijai ne elektrolitai.
Vadinamas elektrolitų skilimo į jonus procesas, kai jie ištirpsta vandenyje arba lydosi elektrolitinė disociacija.
Individualus
Dabar paprašysiu studento eiti prie lentos ir, pasinaudodamas pasiūlyta schema, atskleisti EML proceso esmę. Pateikite atsakymus į klausimus: Kas yra disociacija, asociacija, hidratuoti jonai, katijonai, anijonai.
Kaip įkraunami elektrodai?
Kaip jie vadinami? Kodėl?
Kokie yra jonų krūviai?
Medžiagos, tirpalai arba lydalai kurie praleidžia elektros srovę vadinami elektrolitų . Lydaluose ir tirpaluose elektrolitai skyla į įkrautas daleles -jonų . Elektrolitų skilimo į jonus procesas vadinamaselektrolitinė disociacija . Tai grįžtamasis procesas. Priešingai įkrautų jonų asociacija vadinamaasociacija .
Jonai lydaluose skiriasi nuo jonų tirpaluose tuo, kad pastarieji yra apsupti hidratacijos apvalkalu. Jonai tirpaluose ir lydaluose juda atsitiktinai. Veikiami elektros srovės, jie įgyja kryptingą judėjimą. Teigiamai įkrauti jonai juda link neigiamo elektrodo (katodo) ir todėl vadinamikatijonas ami, neigiamo krūvio jonai juda elektriniame lauke link anodo ir yra vadinamianijonas ami.
Pagrindinės TED nuostatos.
Elektrolitai tirpaluose ir lydaluose skyla į jonus.
Jonai turi kitokią struktūrą nei atomai.
Lyde ir tirpale jonai juda atsitiktinai, bet praeinant elektros srovei, jonai pradeda judėti kryptimi: katijonai - į katodą, anijonai - į anodą.
Taikymas
Individualus
Naudokite diagramą vandens molekulės struktūrai apibūdinti.
Vandens molekulėje O - H ryšiai polinis, šių jungčių elektronų tankis perkeliamas į deguonies atomą kaip labiau elektronegatyvus. Dėl to deguonies atome atsiranda dalinis neigiamas krūvis, o vandenilio atomuose - dalinis teigiamas krūvis. Kadangi H-O-H kampas yra 105°, deguonies atomas ir vandenilio atomai yra skirtinguose molekulės galuose, kuriuose tarsi atsiranda du poliai. Tokios molekulės vadinamos dipoliais.
Individualus
Naudodamiesi schema, pasiūlykite elektrolitų disociacijos mechanizmą
Kai joninis kristalas panardinamas į vandenį, vandens dipoliai yra orientuoti jo jonų atžvilgiu su priešingai įkrautais galais (poliais). Dėl elektrostatinės sąveikos tarp ištirpusios medžiagos jonų ir vandens molekulių joninis kristalas sunaikinamas irhidratuotų jonų tirpaluose (disociacijos procesas). Kai kovalentinį polinį ryšį turinčios medžiagos ištirpsta vandenyje, prieš disociacijos procesą prasideda jungties poliarizacija. Vandens dipoliai, atitinkamai orientuodamiesi, poliarizuoja šį ryšį, pasisuka ji viduje joninis, po kurio vyksta medžiagos disociacija, susidaro hidratuoti jonai.
Tokios idėjos apie junginių su skirtingų tipų cheminėmis jungtimis (CS) disociaciją vandeniniuose tirpaluose susiformavo ne iš karto.
Priekinė
Kaip žinote, yra keletas sprendimų teorijų. Trumpai papasakokite apie šias teorijas ir įvardykite jų autorių.
Kodėl tirpalo praskiedimas padidina disociaciją?
S. Arrhenius ir kiti fizikinės teorijos šalininkai, radę jonų tirpaluose, susidariusiuose veikiant tirpikliui, neatsižvelgė į jų hidrataciją.
DI. Mendelejevas - tirpalų cheminės teorijos autorius, lėtai išskyrė sieros rūgšties hidratusgarinimas jo tirpalai ir siūlė, kad tirpaluose susidaro nestabilūs cheminiai tirpios medžiagos ir tirpiklio junginiai (bendruoju atveju solvatai).
Vėliau I.A. Kablukovas ir kiti mokslininkai, sujungę abi teorijas, parodė, kad tirpimas yra fizinis ir cheminis procesas; dėl to susidaro hidratuoti jonai.
Ištirpus daugėja vandens molekulių, kurios paverčia atomus hidratuotais jonais; taip pat medžiagų disociacija didėja didėjant temperatūrai, nes didėja molekulių judėjimo greitis
Savarankiškas darbas
O dabar savo sąsiuviniuose pabandykite sudaryti atskaitos schemą „Stiprūs ir silpni elektrolitai“. Kiekvienoje grupėje nurodykite 3 pavyzdžius.
Savo abstrakčiai apibrėžkite terminą Disociacijos laipsnis ir jo apibrėžimo formulė
Mokiniai savarankiškai rengia schemą 10-15 minučių.
Kiekybiškai medžiagos disociacijos procesą tirpale galima įvertinti pagal disociacijos laipsnį α. Jis apskaičiuojamas kaip elektrolitų, suskaidytų į jonus, skaičiaus ir bendro ištirpusių medžiagų molekulių skaičiaus santykis ir išreiškiamas procentais.
Disociacijos laipsnis α priklauso nuo cheminio ryšio pobūdžio ištirpusios medžiagos ir tirpiklio kristaluose arba molekulėse. Kuo ši jungtis poliariškesnė, tuo didesnė α reikšmė. Kai tirpalai skiedžiami, didėja a (žr. grafiką, kur c yra tirpalo koncentracija).
Priklausomai nuo disociacijos laipsnio, visi elektrolitai skirstomi į stiprius (α> 30%), vidutinio stiprumo (α nuo 2 iki 30%), silpnus (α).< 1 %). Приведены их примеры.
Ar manote, kad pasiekėme savo tikslus?
Kokia medžiaga jums sukėlė problemų?
Klasės darbų įvertinimas
Parašykite medžiagų disociacijos lygtis: Al 2 (SO 4) 3, K 2 CO 3, FeCl 3.
Programos
1 schema
2 schema

3 schema

4 schema

5 schema


6 schema

Abstraktus
chemijos pamoka 8 klasėje
16 mokykla Saranske
Chemijos katedros IV kurso studentai
Fizikos ir chemijos institutas
Maskvos valstybinis universitetas N. P. Ogareva
Pamokos tema: elektrolitinė disociacija.
Pamokos tikslai:
Švietimas:suformuoti pagrindines sąvokas apie elektrolitus ir neelektrolitus, apie disociacijos lygčių rašymą, svarstyti medžiagų su skirtingų tipų ryšiais disociacijos mechanizmą.
Švietimas: Komandinio darbo įgūdžių formavimas derinant su individualiu darbu, mokinių kūrybinio aktyvumo didinimas, pažintinis domėjimasis chemija, atsakomybės prieš bendražygius jausmas.
Kuriama: Mokinių pažintinių gebėjimų ugdymas, savarankiško mąstymo, gebėjimo logiškai samprotauti, apibendrinti ir daryti išvadas iš gautų žinių formavimas.
Pamokos tipas: sujungti.
Pamokų metodai:
Yra dažni: aiškinamasis ir iliustruojantis;
Privatus: žodžiu – vizualiai – praktiškai.
Įranga ir reagentai:distiliuotas vanduo, KCl (tirpalas ir kieta medžiaga), sacharozės tirpalas, šarmas, HCl, CuSO 4 , prietaisas šių medžiagų tirpalų elektriniam laidumui tirti, cheminė stiklinė.
Pamokos planas:
Organizacinis momentas 1 min.
Namų darbų tikrinimas 10 min
Naujos medžiagos mokymasis 30 min
Apibendrinimas 3 min
Apibendrinant 1min
(vertinimas, namų darbai)
Sveiki bičiuliai!
Džiaugiuosi galėdamas pasveikinti jus pamokoje.
Mano mieli draugai!
Sveikinu visus savo vardu.
Kiekvienas iš jūsų yra geras savaip:
Žmonėms, verslui tai naudinga visiems.
Dabar, vaikinai, neliūdėk
Ir spręsti problemas
Nagi, drąsiai skriskite
Ir gauti užduotis.
Kortelė: „Papildomas sprendimas“
Pavadinkite „papildomą“ (iškritimą iš eilės) sprendimą iš penkių siūlomų. Kodėl manote, kad jis nereikalingas? Ką bendro turi kiti keturi sprendimai?
vario-cinko lydinys (žalvaris)
jodo tirpalas alkoholyje (jodo tinktūra)
vario ir alavo lydinys (bronza)
vario ir nikelio lydinys (kupronikelis)
aliuminio lydinys su variu (duraliuminis)
Kortelė „Trūksta sprendimo“
Kurį iš šių sprendimų (a–c) įdėtumėte vietoj klaustuko 5 punkte? Paaiškinkite, kodėl pasirinkote šį sprendimą? Kodėl kiti sprendimai netinka?
deguonies tirpalas vandenyje
sieros rūgšties tirpalas vandenyje
cukraus tirpalas vandenyje
azoto rūgšties tirpalas vandenyje
a) anglies dioksidas ore, b) natrio chlorido tirpalas vandenyje,
c) aukso ir sidabro lydinys.
Šiuo metu užduodami šie klausimai:
Prisiminkime sprendimų vaidmenį gamtoje ir praktinę žmonių veiklą.
Paaiškinkite fizikinės ir cheminės tirpalų teorijos esmę. Kodėl juos reikia derinti?
Taigi, kas yra sprendimas?
Pateikite įrodymų apie tirpios medžiagos cheminę sąveiką su vandeniu?
Kas yra: hidratacija, hidratai, kristaliniai hidratai?
Koks yra medžiagų tirpumas vandenyje?
Kaip kiekybiškai apibrėžiamos sąvokos „labai tirpus vandenyje“, „mažai tirpus“, „praktiškai netirpus“?
Žaiskime žaidimą „perduok“:
Lentoje parašytas klausimas: ar ši medžiaga klasifikuojama kaip mažai tirpi, labai tirpi ar praktiškai netirpi? (dirbkite su tirpumo lentele)
Klasė suskirstyta į šešias grupes (eilėse). Kiekviena grupė gauna albumo lapą, padalintą į keturias stulpelius (mokinio pavardė ir atsakymai į klausimą) ir tiek eilučių, kiek komandoje yra žaidėjų.
Užduotis – sugalvoti ryšį, kuris nėra toks pat kaip kaimynų, ir atlikti užduotis.
Jei mokinys gali iš karto atsakyti į klausimą, jis parašo atsakymą ir greitai perduoda lapą užpakalyje sėdinčiam komandos nariui. O komanda, kurios lapas pirmiausia pasiekia mokytoją, gauna papildomų taškų.
Leiskite man perskaityti eilėraštį:
Ten gyveno vienas joninis kristalas,
Jonams namas didžiulis,
Jis buvo gražus ir lygus.
Tačiau jam atsitiko bėda.
Ant jo nukrito lašas
Ir kristalas akimirksniu dingo:
Paskirstyti į jonus
Jo protingas vanduo.
Visa šeima nustebo:
– Kas atsitiko lauke?
Ir norint atsakyti į šį klausimą, jums padės šiandienos tema „Elektrolitinė disociacija“. (1 diskelis: temos pavadinimas.) O mūsų pamokos tikslas – supažindinti su naujomis šios temos sąvokomis.
Taigi, žinote, kad yra medžiagų, kurios gerai praleidžia elektrą – tai yra (laidininkai).
Laidininkai skirstomi į pirmosios rūšies laidininkus – metalus ir antros rūšies – elektrolitus.
Prisiminkite, kas yra elektros srovė?(Tai yra nukreiptas įkrautų dalelių judėjimas.)
Nes Dirbsime su elektros aparatu, būtina laikytis saugos taisyklių. Kokias taisykles žinai? (nelieskite plikų laidų, elektrodų rankomis, ypač šlapiomis; kai prietaisas užsidega, išjunkite pagrindinį jungiklį, nepalikite įjungto; gesinkite smėliu)
Atlikime eksperimentą tam tikrų medžiagų tirpalų elektriniam laidumui tirti.
Prietaisas susideda iš stiklinės, į kurią pilamas bandomosios medžiagos tirpalas. Ant stiklo uždedama ebonito plokštelė, kurioje sumontuoti du anglies elektrodai, prie kurių gnybtų tvirtinami laidai. Vienas iš jų yra prijungtas prie lemputės. Išvesties kontaktas iš lemputės ir laidas iš kito gnybto eina į srovės šaltinį.
Elektrodus nuleidžiame į stiklinę su kieta kristaline druska CuSO 4 (neužsidega lemputė), tada į CuSO tirpalą 4 (užsidega lemputė), tada į HCl, sacharozės, šarmo tirpalus ir į distiliuotą vandenį.
Eksperimento metu vaikinai užpildo lentelę:
CuSO4 |
ir tt
Pasakyk man, kodėl valgomosios druskos tirpalas praleidžia elektros srovę, o sacharozės tirpalas – ne?(tai yra dėl jonų susidarymo.) O kas yra jonas? (tai mažiausios įkrautos medžiagos dalelės, lemiančios chemines ir fizines šios medžiagos savybes).
Taigi, pagal gebėjimą pravesti elektros srovę, medžiagos skirstomos į elektrolitus ir neelektrolitus.(disketas Nr. 1: sąvokų apibrėžimai: elektrolitai ir neelektrolitai)
Iš patirties matyti, kad elektrolitams priskiriami druskų, rūgščių, bazių tirpalai, o neelektrolitai – organiniai junginiai, kietosios medžiagos, dujos.
Kuo skiriasi elektrolitai ir neelektrolitai?(ryšio tipas.). Tie. elektrolitai apima medžiagas su joninėmis ir kovalentinėmis polinėmis jungtimis.
Elektrolitų gebėjimas pravesti elektros srovę iš esmės skiriasi nuo metalų gebėjimo pravesti elektros srovę. Kodėl? (nes metalų elektrinis laidumas yra dėl elektronų judėjimo, o elektrolitų elektrinis laidumas yra susijęs su jonų judėjimu.)
Ištirkime medžiagų elgseną vandeniniame tirpale natrio chlorido pavyzdžiu.
Patirtis: elektrodus nuleidžiame į stiklinę su natrio chlorido tirpalu (užsidega lemputė).
Iš eksperimento rezultato darome išvadą, kad veikiant vandeniui medžiagos keičiasi. Dėl vandens elektrolitai suskaidomi į jonus. Šis procesas vadinamas disociacija.
Šį procesą ištyrė švedų mokslininkas Svante Arrhenius. Paklausykime savo klasės draugo žinutės apie jo pasiekimus chemijos srityje (2 diskas: Svante Arrhenius portretas)
Būdamas fizikinės tirpalų teorijos šalininkas, švedų mokslininkas Svante Arrhenius negalėjo atsakyti į klausimą: kodėl vandeniniame tirpale vyksta druskų ir šarmų disociacija? Atsakymą į jį pateikė rusų chemikai Kablukovas, Kistjakovskis. Jų papildymo esmė tokia (įrašams): elektrolito disociacijos tirpale priežastis yra jo hidratacija, t.y. sąveika su vandens molekulėmis. O disociacijos metu susidarantys jonai bus hidratuoti, t.y. susiję su vandens molekulėmis, o jų savybės skirsis nuo nehidratuotų.
Kas yra vandens molekulė? Apskritai vandens molekulė nėra įkrauta. Tačiau vandens molekulės viduje deguonies ir vandenilio atomai yra išdėstyti taip, kad teigiami ir neigiami krūviai yra priešinguose molekulės galuose. Todėl vandens molekulė yra dipolis:
Panagrinėkime natrio chlorido disociacijos mechanizmą ištirpus. Kokio tipo ryšys turi šį ryšį? (joninis).(diskas Nr. 2: joninės struktūros medžiagų disociacija).
Pastebiu, kad elektrolitai, turintys joninę struktūrą, disocijuoja lengviausiai.
Medžiagų disociacija su jonine jungtimi vyksta trimis etapais:
iš pradžių atsitiktinai judančios vandens molekulės šalia kristalo jonų yra orientuotos į jas priešingai įkrautais poliais – vyksta orientacija.
tada vandens dipoliai pritraukiami, sąveikauja su kristalo paviršinio sluoksnio jonais, vyksta hidratacija.
Kai vandens molekulė juda į tirpalą, ji pasiima hidratuotus jonus. Atsiranda disociacija.
O kaip polinių elektrolitų molekulės reaguoja su vandens molekulėmis?
Panašiai, bet vienu žingsniu daugiau (diskas Nr. 2: medžiagų disociacija su kovalentine poline jungtimi):
orientacija
drėkinimas
jonizacija, t.y. kovalentinio polinio ryšio pavertimas joniniu.
disociacija
Taigi elektrolitinė disociacija yra elektrolito skilimo į jonus procesas, kai jis ištirpsta.
Reikėtų atsižvelgti į tai, kad elektrolitų tirpaluose atsitiktinai judantys jonai gali susidurti ir susijungti į molekulę. Tai yra asociacijos procesas.
Atkreipkite dėmesį į ženklą disociacijos lygtyje. (1 diskas: disociacijos lygties rašymas). Kadangi vandens molekulių, prie kurių prisijungia jonai, skaičius nežinomas, elektrolitų disociacijos procesas pavaizduotas supaprastintu būdu: NaCl = Na+ +Cl-
Pavyzdžiui, užrašykite sutrumpintą kai kurių joninės struktūros medžiagų disociacijos lygtį: Ca (OH) 2, Na 2 SO 4, Na 3 PO 4, Al 2 (SO 4).
Šios dienos pamokoje sužinojote, kas yra elektrolitinė disociacija, disociacijos mechanizmas.
Remdamiesi tuo, kas išdėstyta, pasakykite, kokie procesai yra užšifruoti eilėraštyje:
Ten gyveno vienas joninis kristalas,
Jonams namas didžiulis,
Jis buvo gražus ir lygus.
Tačiau jam atsitiko bėda.
Ant jo nukrito lašas
Ir kristalas akimirksniu dingo:
Paskirstyti į jonus
Jo protingas vanduo.
Visa šeima nustebo:
– Kas atsitiko lauke?
Jis staiga atsirado šalia daugybės molekulių,
Jie pribėgo triukšmingame būryje,
Apsuptas tankaus darinio:
„Mes norime pasiūlyti herojams
mūsų draugystė amžina...
Vandenilis virsta anijonais,
hidroksidas į katijonus,
Neatsitraukite nuo jų jonų
Nei čia, nei ten.
(medžiagos, turinčios joninį ryšį, ištirpimas, vandens molekulių orientacija, hidratacija, disociacija)
Namų darbai:§ 35, Nr.2,5,6 147 p.
2





7

Anijonai katijonai anodo katodas - +

Tirpalas Kristalas NaCl Na + + Cl H2OH2O H2OH2O 4 pav.

10 HCl tirpalas H + + Cl - H2OH2O H2OH2O Ryžiai HCl Cl - H+H+ + - H+H Cl-Cl-




14 Patikrinimo testas. 1 variantas. 2 variantas. 1. Neelektrolitai apima: 1) natrio karbonatą 2) etilo alkoholį 3) druskos rūgštį 4) cinko nitratas 1. Neelektrolitus sudaro: 1) bario chloridas 2) cukrus 3) sieros rūgštis 4) kalis. karbonatas 2 Disocijuoja susidarant metalo katijonams ir rūgšties liekanos anijonams: 1). vario (II) hidroksidas 2). natrio hidroksidas 3). aliuminio chloridas 4). anglies rūgštis 2. Susidarant metalo katijonams ir rūgšties liekanos anijonams, ji disocijuoja: 1) sacharozė 2) natrio hidroksidas 3) aliuminio bromidas 4) azoto rūgštis 3. Abi grupės medžiagos yra elektrolitai: 1). CH4, CO2 2). C2H5OH, HNO3 3). CaO, BaSO4 4). NaCl, KOH 3. Elektrolitai yra abi grupės medžiagos: 1). glicerinas, SO2 2). CuCl2, KOH 3). BaO, K2SO4 4). Fe(OH)3, H2SiO3 4. Disociacijos metu susidaro daugiausia vandenilio jonų, lygių: 1). HI 2). H2CO3 3). H2S 4). H2SiO3 4. Dauguma vandenilio jonų susidaro disociacijos metu lygūs: 1). H3PO4 2). H2SO4 3). HNO3 4). HF 5. Aliuminio sulfato disociacijos lygties koeficientų suma yra tokia: 1). 4 2). 6 3). 2 4) Natrio karbonato disociacijos lygties koeficientų suma yra tokia: 1). 4 2). 3 3). 2 4). 1