Цей урок присвячений вивченню теми «Електролітична дисоціація». У процесі вивчення цієї теми Ви зрозумієте суть деяких дивовижних фактів: чому розчини кислот, солей та лугів проводять електричний струм; чому температура кипіння розчину електроліту вища порівняно з розчином неелектроліту.
Тема: Хімічний зв'язок.
Урок:Електролітична дисоціація
Тема нашого уроку - « Електролітична дисоціація». Ми спробуємо пояснити деякі дивовижні факти:
Чому розчини кислот, солей та лугів проводять електричний струм.
Чому температура кипіння розчину електроліту завжди буде вищою, ніж температура кипіння розчину не електроліту тієї ж концентрації.
Сванте Арреніус
У 1887 році шведський фізико - хімік Сванте Арреніус,досліджуючи електропровідність водних розчинів, висловив припущення, що в таких розчинах речовини розпадаються на заряджені частинки - іони, які можуть пересуватися до електродів - негативно зарядженого катода та позитивно зарядженого анода.
Це і є причиною електричного струму в розчинах. Цей процес отримав назву електролітичної дисоціації(Дослівний переклад - розщеплення, розкладання під дією електрики). Така назва також передбачає, що дисоціація відбувається під впливом електричного струму. Подальші дослідження показали, що це не так: іони є тількипереносниками зарядів у розчині і існують у ньому незалежно від того, проходить черезрозчин струм чи ні.За активної участі Сванте Арреніуса було сформульовано теорію електролітичної дисоціації, яку часто називають на честь цього вченого. Основна ідея цієї теорії полягає в тому, що електроліти під дією розчинника мимоволі розпадаються на іони. І саме ці іони є носіями заряду та відповідають за електропровідність розчину.
Електричний струм - це спрямований рух вільних заряджених частинок. Ви вже знаєте, що розчини та розплави солей та лугів електропровідні,тому що складаються не з нейтральних молекул, а із заряджених частинок - іонів. При розплавленні чи розчиненні іони стають вільнимипереносниками електричного заряду.
Процес розпаду речовини на вільні іони при його розчиненні чи розплавленні називають електролітичною дисоціацією.

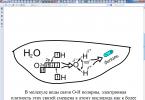
Мал. 1. Схема розпаду на іони хлориду натрію
Сутність електролітичної дисоціації у тому, що іони стають вільними під впливом молекули води. Рис.1. Процес розпаду електроліту на іони відбивають за допомогою хімічного рівняння. Запишемо рівняння дисоціації хлориду натрію та броміду кальцію. При дисоціації одного моля хлориду натрію утворюються один моль катіонів натрію та один моль хлорид – аніонів. NaCl⇄ Na + + Cl -
При дисоціації одного моля броміду кальцію утворюється один моль катіонів кальцію та два моля бромід - аніонів.
CaBr 2 ⇄ Ca 2+ + 2 Br -
Зверніть увагу: Так як у лівій частині рівняння записана формула електронейтральної частки, то сумарний заряд іонів повинен дорівнювати нулю.
Висновок: при дисоціації солей утворюються катіони металу та аніони кислотного залишку.
Розглянемо процес електролітичної дисоціації лугів. Запишемо рівняння дисоціації у розчині гідроксиду калію та гідроксиду барію.
При дисоціації одного молю гідроксиду калію утворюються один моль катіонів калію та один моль гідроксид-аніонів. KOH⇄ K + + OH -
При дисоціації одного молю гідроксиду барію утворюються один моль катіонів барію і два молі гідроксид - аніонів. Ba(OH) 2 ⇄ Ba 2+ + 2 OH -
Висновок:при електролітичній дисоціації лугів утворюються катіони металу та гідроксид - аніони.
Нерозчинні у воді основипрактично не піддаютьсяелектролітичної дисоціації, Так як у воді вони практично нерозчинні, а при нагріванні - розкладаються, так що розплав їх отримати не вдається.


Мал. 2. Будова молекул хлороводню та води
Розглянь процес електролітичної дисоціації кислот. Молекули кислот утворені ковалентним полярним зв'язком, отже, кислоти складаються з іонів, та якщо з молекул.
Виникає питання - як тоді кислота дисоціює, т. е як у кислотах утворюються вільні заряджені частки? Виявляється, іони утворюються у розчинах кислот саме при розчиненні.
Розглянемо процес електролітичної дисоціації хлороводню у воді, але для цього запишемо будову молекул хлороводню та води. Рис.2.
Обидві молекули утворені ковалентним полярним зв'язком. Електронна щільність у молекулі хлороводню зміщена до атома хлору, а молекулі води - до атома кисню. Молекула води здатна відірвати катіон водню від молекули хлороводню, при цьому утворюється катіон гідроксонію Н3О+.
У рівнянні реакції електролітичної дисоціації не завжди враховують утворення катіону гідроксонію – зазвичай кажуть, що утворюється катіон водню.
Тоді рівняння дисоціації хлороводню виглядає так:
HCl⇄ H + + Cl -
При дисоціації одного молю хлороводню утворюються один моль катіону водню та один моль хлорид – аніонів.
Ступінчаста дисоціація сірчаної кислоти
Розглянь процес електролітичної дисоціації сірчаної кислоти. Сірчана кислота дисоціює східчасто, дві стадії.
I-я стадія дисоціації
На першій стадії відривається один катіон водню та утворюється гідросульфат-аніон.

ІІ - я стадія дисоціації
На другій стадії відбувається подальша дисоціація гідросульфат – аніонів. HSO 4 - ⇄ H + + SO 4 2-
Ця стадія є оборотною, тобто утворюються сульфат - іони можуть приєднувати до себе катіони водню і перетворюватися на гідросульфат - аніони. Це показано знаком оборотності.
Існують кислоти, які навіть на першій стадії дисоціюють не повністю – такі кислоти є слабкими. Наприклад, вугільна кислота Н 2 3 .
Тепер ми можемо пояснити, чому температура кипіння розчину електроліту буде вищою, ніж температура кипіння розчину неелектроліту.
При розчиненні молекули розчиненої речовини взаємодіють із молекулами розчинника, наприклад - води. Чим більше частинок розчиненої речовини знаходиться в одному обсязі води, тим вища його температура кипіння. Тепер уявімо, що в однакових обсягах води розчинили рівні кількості речовини-електроліту та речовини – неелектроліту. Електроліт у воді розпадеться на іони, а значить - кількість його частинок буде більшою, ніж у разі розчинення неелектроліту. Таким чином, наявність вільних частинок в електроліті пояснює, чому температура кипіння розчину електроліту буде вищою, ніж температура кипіння розчину неелектроліту.
Підбиття підсумку уроку
На цьому уроці ви дізналися, що розчини кислот, солей та лугів електропровідні, тому що при їх розчиненні утворюються заряджені частки - іони. Такий процес називається електролітичною дисоціацією. При дисоціації солей утворюються катіони металу та аніони кислотних залишків. При дисоціації лугів утворюються катіони металу та гідроксид-аніони. При дисоціації кислот утворюються катіони водню та аніони кислотного залишку.
1. Рудзітіс Г.Є. Неорганічна та органічна хімія. 9 клас: підручник для загальноосвітніх установ: базовий рівень/Г. Є. Рудзітіс, Ф.Г. Фельдман. М: Просвітництво. 2009 119с.:іл.
2. Попель П.П.Хімія: 8 кл.: підручник для загальноосвітніх навчальних закладів/П.П. Попель, Л.С.Крівля. -К.: ІЦ «Академія», 2008.-240 с.: Іл.
3. Габрієлян О.С. Хімія. 9 клас. Підручник Видавництво: Дрофа.:2001. 224с.
1. № № 1,2 6 (с.13) Рудзітіс Г.Є. Неорганічна та органічна хімія. 9 клас: підручник для загальноосвітніх установ: базовий рівень/Г. Є. Рудзітіс, Ф.Г. Фельдман. М: Просвітництво. 2009 119с.:іл.
2. Що таке електролітична дисоціація? Речовини, яких класів належать до електролітів?
3. Речовини, із яким типом зв'язку є електролітами?
Цей урок присвячений вивченню теми «Електролітична дисоціація». У процесі вивчення цієї теми Ви зрозумієте суть деяких дивовижних фактів: чому розчини кислот, солей та лугів проводять електричний струм; чому температура кипіння розчину електроліту вища порівняно з розчином неелектроліту.
Тема: Хімічний зв'язок.
Урок:Електролітична дисоціація
Тема нашого уроку - « Електролітична дисоціація». Ми спробуємо пояснити деякі дивовижні факти:
Чому розчини кислот, солей та лугів проводять електричний струм.
Чому температура кипіння розчину електроліту завжди буде вищою, ніж температура кипіння розчину не електроліту тієї ж концентрації.
Сванте Арреніус
У 1887 році шведський фізико - хімік Сванте Арреніус,досліджуючи електропровідність водних розчинів, висловив припущення, що в таких розчинах речовини розпадаються на заряджені частинки - іони, які можуть пересуватися до електродів - негативно зарядженого катода та позитивно зарядженого анода.
Це і є причиною електричного струму в розчинах. Цей процес отримав назву електролітичної дисоціації(Дослівний переклад - розщеплення, розкладання під дією електрики). Така назва також передбачає, що дисоціація відбувається під впливом електричного струму. Подальші дослідження показали, що це не так: іони є тількипереносниками зарядів у розчині і існують у ньому незалежно від того, проходить черезрозчин струм чи ні.За активної участі Сванте Арреніуса було сформульовано теорію електролітичної дисоціації, яку часто називають на честь цього вченого. Основна ідея цієї теорії полягає в тому, що електроліти під дією розчинника мимоволі розпадаються на іони. І саме ці іони є носіями заряду та відповідають за електропровідність розчину.
Електричний струм - це спрямований рух вільних заряджених частинок. Ви вже знаєте, що розчини та розплави солей та лугів електропровідні,тому що складаються не з нейтральних молекул, а із заряджених частинок - іонів. При розплавленні чи розчиненні іони стають вільнимипереносниками електричного заряду.
Процес розпаду речовини на вільні іони при його розчиненні чи розплавленні називають електролітичною дисоціацією.

Мал. 1. Схема розпаду на іони хлориду натрію
Сутність електролітичної дисоціації у тому, що іони стають вільними під впливом молекули води. Рис.1. Процес розпаду електроліту на іони відбивають за допомогою хімічного рівняння. Запишемо рівняння дисоціації хлориду натрію та броміду кальцію. При дисоціації одного моля хлориду натрію утворюються один моль катіонів натрію та один моль хлорид – аніонів. NaCl⇄ Na + + Cl -
При дисоціації одного моля броміду кальцію утворюється один моль катіонів кальцію та два моля бромід - аніонів.
CaBr 2 ⇄ Ca 2+ + 2 Br -
Зверніть увагу: Так як у лівій частині рівняння записана формула електронейтральної частки, то сумарний заряд іонів повинен дорівнювати нулю.
Висновок: при дисоціації солей утворюються катіони металу та аніони кислотного залишку.
Розглянемо процес електролітичної дисоціації лугів. Запишемо рівняння дисоціації у розчині гідроксиду калію та гідроксиду барію.
При дисоціації одного молю гідроксиду калію утворюються один моль катіонів калію та один моль гідроксид-аніонів. KOH⇄ K + + OH -
При дисоціації одного молю гідроксиду барію утворюються один моль катіонів барію і два молі гідроксид - аніонів. Ba(OH) 2 ⇄ Ba 2+ + 2 OH -
Висновок:при електролітичній дисоціації лугів утворюються катіони металу та гідроксид - аніони.
Нерозчинні у воді основипрактично не піддаютьсяелектролітичної дисоціації, Так як у воді вони практично нерозчинні, а при нагріванні - розкладаються, так що розплав їх отримати не вдається.


Мал. 2. Будова молекул хлороводню та води
Розглянь процес електролітичної дисоціації кислот. Молекули кислот утворені ковалентним полярним зв'язком, отже, кислоти складаються з іонів, та якщо з молекул.
Виникає питання - як тоді кислота дисоціює, т. е як у кислотах утворюються вільні заряджені частки? Виявляється, іони утворюються у розчинах кислот саме при розчиненні.
Розглянемо процес електролітичної дисоціації хлороводню у воді, але для цього запишемо будову молекул хлороводню та води. Рис.2.
Обидві молекули утворені ковалентним полярним зв'язком. Електронна щільність у молекулі хлороводню зміщена до атома хлору, а молекулі води - до атома кисню. Молекула води здатна відірвати катіон водню від молекули хлороводню, при цьому утворюється катіон гідроксонію Н3О+.
У рівнянні реакції електролітичної дисоціації не завжди враховують утворення катіону гідроксонію – зазвичай кажуть, що утворюється катіон водню.
Тоді рівняння дисоціації хлороводню виглядає так:
HCl⇄ H + + Cl -
При дисоціації одного молю хлороводню утворюються один моль катіону водню та один моль хлорид – аніонів.
Ступінчаста дисоціація сірчаної кислоти
Розглянь процес електролітичної дисоціації сірчаної кислоти. Сірчана кислота дисоціює східчасто, дві стадії.
I-я стадія дисоціації
На першій стадії відривається один катіон водню та утворюється гідросульфат-аніон.

ІІ - я стадія дисоціації
На другій стадії відбувається подальша дисоціація гідросульфат – аніонів. HSO 4 - ⇄ H + + SO 4 2-
Ця стадія є оборотною, тобто утворюються сульфат - іони можуть приєднувати до себе катіони водню і перетворюватися на гідросульфат - аніони. Це показано знаком оборотності.
Існують кислоти, які навіть на першій стадії дисоціюють не повністю – такі кислоти є слабкими. Наприклад, вугільна кислота Н 2 3 .
Тепер ми можемо пояснити, чому температура кипіння розчину електроліту буде вищою, ніж температура кипіння розчину неелектроліту.
При розчиненні молекули розчиненої речовини взаємодіють із молекулами розчинника, наприклад - води. Чим більше частинок розчиненої речовини знаходиться в одному обсязі води, тим вища його температура кипіння. Тепер уявімо, що в однакових обсягах води розчинили рівні кількості речовини-електроліту та речовини – неелектроліту. Електроліт у воді розпадеться на іони, а значить - кількість його частинок буде більшою, ніж у разі розчинення неелектроліту. Таким чином, наявність вільних частинок в електроліті пояснює, чому температура кипіння розчину електроліту буде вищою, ніж температура кипіння розчину неелектроліту.
Підбиття підсумку уроку
На цьому уроці ви дізналися, що розчини кислот, солей та лугів електропровідні, тому що при їх розчиненні утворюються заряджені частки - іони. Такий процес називається електролітичною дисоціацією. При дисоціації солей утворюються катіони металу та аніони кислотних залишків. При дисоціації лугів утворюються катіони металу та гідроксид-аніони. При дисоціації кислот утворюються катіони водню та аніони кислотного залишку.
1. Рудзітіс Г.Є. Неорганічна та органічна хімія. 9 клас: підручник для загальноосвітніх установ: базовий рівень/Г. Є. Рудзітіс, Ф.Г. Фельдман. М: Просвітництво. 2009 119с.:іл.
2. Попель П.П.Хімія: 8 кл.: підручник для загальноосвітніх навчальних закладів/П.П. Попель, Л.С.Крівля. -К.: ІЦ «Академія», 2008.-240 с.: Іл.
3. Габрієлян О.С. Хімія. 9 клас. Підручник Видавництво: Дрофа.:2001. 224с.
1. № № 1,2 6 (с.13) Рудзітіс Г.Є. Неорганічна та органічна хімія. 9 клас: підручник для загальноосвітніх установ: базовий рівень/Г. Є. Рудзітіс, Ф.Г. Фельдман. М: Просвітництво. 2009 119с.:іл.
2. Що таке електролітична дисоціація? Речовини, яких класів належать до електролітів?
3. Речовини, із яким типом зв'язку є електролітами?
Конспект
уроку з хімії у 8 класі
школи №16 м. Саранська
студентки 4 курсу хімічного відділення
Інституту фізики та хімії
МДУ ім. Н. П. Огарьова
Тема урока : Електролітична дисоціація.
Цілі уроку:
Освітня:сформувати основні поняття про електроліти та неелектроліти, про написання рівнянь дисоціації, розглянути механізм дисоціації речовин з різним типом зв'язку.
Виховна: Формування навичок колективної роботи у поєднанні з індивідуальною, підвищення творчої активності учнів, пізнавального інтересу до хімії, почуття відповідальності перед своїми товаришами.
Розвиваюча: Розвиток у учнів пізнавальних здібностей, формування самостійності мислення, вміння логічно міркувати, узагальнювати та робити висновки з отриманих знань.
Тип уроку: комбінований.
Методи уроку:
Загальні: пояснювально-ілюстративний;
Приватні: словесно – наочно – практичний.
Обладнання та реактиви:дистильована вода, KCl (р-р і тб.), розчин сахарози, луг, HCl, CuSO 4 , прилад дослідження електропровідності розчинів даних речовин, хімічний стакан.
План уроку:
Організаційний момент 1 хв.
Перевірка домашнього завдання 10 хв.
Вивчення нового матеріалу 30 хв
Узагальнення 3 хв
Підбиття підсумків 1хв
(Виставлення оцінок, домашнє завдання)
Здрастуйте, хлопці!
Я рада вітати вас на уроці.
Милі мої друзі!
Вітаю я всіх від себе.
Кожен з вас по-своєму добрий:
Для людей, для справи всім пригож.
А тепер, хлопці, не сумуйте
І завдання розв'яжіть
Ну ж, сміливо налітай
І завдання отримуй.
Картка: «Зайвий розчин»
Назвіть «зайвий» (випадає з ряду) розчин із п'яти запропонованих. Чому ви вважаєте, що саме він зайвий? Що спільного у чотирьох інших розчинів?
сплав міді з цинком (латунь)
розчин йоду у спирті (йодна настойка)
сплав міді з оловом (бронза)
сплав міді з нікелем (мельхіор)
сплав алюмінію з міддю (дюралюміній)
Картка «Відсутній розчин»
Який із наведених нижче розчинів (а - в) ви помістили б замість знака питання до пункту 5? Поясніть, чому ви вибрали цей розчин? Чому інші розчини не підходять?
розчин кисню у воді
розчин сірчаної кислоти у воді
розчин цукру у воді
розчин азотної кислоти у воді
а) вуглекислий газ у повітрі; б) розчин хлориду натрію у воді,
в) сплав золота та срібла.
У цей час фронтально ставляться питання:
Давайте згадаємо про роль розчинів у природі та практичній діяльності людей.
Поясніть сутність фізичної та хімічної теорії розчинів. Чому їх потрібно об'єднати?
То що таке розчин?
Наведіть докази хімічної взаємодії розчиненої речовини із водою?
Що таке: гідратація, гідрати, кристалогідрати?
Що таке розчинність речовин у воді?
Як кількісно визначаються поняття «добре розчинна у воді речовина», «мало розчинна», «практично нерозчинна»?
Давайте пограємо у гру «передай іншому»:
На дошці записано питання: Дана речовина відноситься до мало розчинної, добре розчинної або практично нерозчинної? (Робота з таблицею розчинності)
Клас поділяється на шість груп (по рядах). Кожна група отримує альбомний лист, поділений на чотири графи (прізвище учня та відповіді на запитання) та стільки рядків, скільки гравців у команді.
Завдання полягає в тому, щоб придумати з'єднання не таке, як у сусідів, і виконати завдання.
Якщо учень відразу може відповісти на запитання, то він пише відповідь і швидко передає листок члену команди, що сидить ззаду. І та команда, чий лист першим дійде до вчителя, отримує додаткові бали.
Давайте я вам зачитаю вірш:
Жив один іонний кристал,
Для іонів будинок величезний,
Був гарний і рівний.
Але трапилося з ним лихо.
Крапля на нього впала,
І кристала вмить не стало:
На іони розпластала
Його спритна вода.
Все сімейство здивувалося:
Що зовні трапилося?
А для того, щоб відповісти на це запитання, вам допоможе сьогоднішня тема «Електролітична дисоціація». (Дискета №1: назва теми.) І метою нашого уроку є ознайомлення з новими поняттями цієї теми.
Отже, вам відомо, що існують речовини, які добре проводять електричний струм – це (провідники).
Провідники поділяються на провідники першого роду – метали та на провідники другого роду – електроліти.
Згадайте, що таке електричний струм?(Це спрямований рух заряджених частинок.)
Т.к. ми будемо працювати з електричним апаратом, то необхідно дотримуватись правил техніки безпеки. Які правила ви знаєте? (не чіпати оголені дроти, електроди руками, особливо мокрими; при загорянні приладу відключити загальний рубильник, не залишати включеним у мережу; гасити піском)
Проведемо досвід вивчення електропровідності розчинів деяких речовин.
Прилад складається зі склянки, в яку наливають розчин досліджуваної речовини. На склянку ставлять пластинку з ебоніту з вмонтованими в неї двома вугільними електродами, до клем яких приєднані дроти. Один із них з'єднаний з лампочкою. Вихідний контакт від лампочки та дріт від іншої клеми йдуть до джерела струму.
Електроди опускаємо у склянку із твердою кристалічною сіллю CuSO 4 (лампочка не загоряється), потім у розчин CuSO 4 (лампочка загоряється), потім у розчини HCl, сахарози, луги та дистильовану воду.
Під час проведення досвіду хлопці заповнюють таблицю:
CuSO 4 |
і т.д.
Скажіть, чому розчин кухонної солі проводить електричний струм, а розчин сахарози не проводить?(це пов'язано з утворенням іонів). А що таке іон? (це найдрібніші заряджені частинки речовини, які зумовлюють хімічні та фізичні властивості цієї речовини).
Таким чином за здатністю проводити електричний струм речовини поділяються на електроліти та неелектроліти.(дискета №1: визначення понять: електроліти та неелектроліти)
З проведеного досвіду видно, що до електролітів відносять розчини солей, кислот, основ, а до неелектролітів - органічні сполуки, тверді речовини, гази.
Скажіть, а чим відрізняються електроліти від неелектролітів?(Типом зв'язку.). Тобто. до електролітів відносяться речовини з іонним та ковалентно-полярним зв'язком.
Здатність електролітів проводити електричний струм принципово відрізняється від здатності проводити електричний струм металів. Чому? (Т. К. Електропровідність металів обумовлена рухом електронів, а електропровідність у електролітів пов'язана з рухом іонів.)
Давайте вивчимо поведінку речовин у водному розчині з прикладу хлориду натрію.
Досвід: електроди опускаємо в склянку з розчином натрію хлориду (лампочка загоряється).
З результату досвіду зробимо висновок, що під впливом води речовини зазнають змін. Вода змушує електроліти розпадатися на іони. Цей процес називається дисоціацією.
Цей процес вивчав шведський вчений Сванте Арреніус. Давайте послухаємо повідомлення вашої однокласниці про його заслуги в хімії (диск №2: портрет Сванте Арреніуса)
Будучи прихильником фізичної теорії розчинів, шведський вчений Сванте Арреніус, не зміг відповісти на запитання: чому саме у водному розчині відбувається дисоціація солей та лугів? Відповідь на нього дали російські хіміки Каблуков, Кістяківський. Суть їх доповнень у наступному (під запис): причиною дисоціації електроліту у розчині є його гідратація, тобто. взаємодія із молекулами води. І іони, що утворюються при дисоціації, будуть гідратованими, тобто. пов'язаними з молекулами води, та їх властивості відрізнятимуться від негідратованих.
Що ж собою являє молекула води? Загалом молекула води не заряджена. Але всередині молекули води атоми кисню та водню розташовуються так, що позитивні та негативні заряди знаходяться у протилежних кінцях молекули. Тому молекула води є диполь:
Розглянемо механізм дисоціації натрію хлориду при розчиненні. Який тип зв'язку у цієї сполуки? (іонний).диск №2: диссоціація речовин з іонною структурою).
Зазначу, що найлегше дисоціюють електроліти, що мають іонну структуру.
Дисоціація речовин з іонним зв'язком протікає у три стадії:
Спочатку хаотично рухомі молекули води в іонів кристала орієнтуються до них протилежно зарядженими полюсами - відбувається орієнтація.
потім диполі води притягуються, взаємодіють із іонами поверхневого шару кристала відбувається гідратація.
молекула води, переміщаючись у розчин, захоплюють із собою гідратовані іони. Відбувається дисоціація.
А як реагують із молекулами води полярні молекули електроліту?
Аналогічно, але на одну стадію більше (диск №2: дисоціація речовин із ковалентно-полярним зв'язком):
орієнтація
гідратація
іонізація, тобто. перетворення ковалентно-полярного зв'язку на іонну.
дисоціація
Таким чином, електролітична дисоціація – процес розпаду електроліту на іони при розчиненні.
Слід враховувати, що в розчинах електролітів іони, що хаотично рухаються, можуть зіткнутися і з'єднатися в молекулу. Це процес асоціації.
Зверніть увагу на знак, що стоїть у рівнянні дисоціації.диск №1: написання рівняння дисоціації). Оскільки число молекул води, яке приєднують іони, невідоме, процес дисоціації електролітів зображують спрощено: NaCl = Na+ +Cl -
Наприклад, запишіть скорочене рівняння дисоціації деяких речовин з іонною будовою: Ca(OH) 2 , Na 2 SO 4 , Na 3 PO 4 Al 2 (SO 4 ).
На сьогоднішньому уроці ви дізналися, що таке електролітична дисоціація, механізм дисоціації.
Виходячи зі всього сказаного, скажіть, які процеси зашифровані у вірші:
Жив один іонний кристал,
Для іонів будинок величезний,
Був гарний і рівний.
Але трапилося з ним лихо.
Крапля на нього впала,
І кристала вмить не стало:
На іони розпластала
Його спритна вода.
Все сімейство здивувалося:
Що зовні трапилося?
Це поряд з'явилася раптом молекул низка,
Підбігли галасливим роєм,
Оточили щільним строєм:
«Запропонувати хочемо героям
нашу дружбу назавжди ... »
Воднем до аніонів,
Гідроксидом до катіонів,
Не втекти від них іонам
Ні туди, ні сюди.
(Розчинення речовини з іонним зв'язком, орієнтація молекул води, гідратація, дисоціація)
Домашнє завдання:§ 35, №2,5,6 стор.147.
2





7

Аніони Катіони Анод Катод - +

Розчин Кристал NaCl Na + + Cl Н2ОН2О Н2ОН2О Рис.4.

10 Розчин НCl Н + + Cl - Н2ОН2О Н2ОН2О Рис HCl Cl - H+H+ + - Н+Н Сl-Сl-




14 Перевірочний тест. Варіант 1. Варіант 2. 1. До неелектролітів відносяться: 1) карбонат натрію 2) етиловий спирт 3) хлороводнева кислота 4) нітрат цинку 1. До неелектролітів відносяться: 1) хлорид барію 2) цукор 3) сірчана кислота 4) карбонат калію 2 .З утворенням катіонів металу та аніонів кислотного залишку дисоціює: 1). гідроксид міді (ІІ) 2). гідроксид натрію 3). хлорид алюмінію 4). вугільна кислота 2. З утворенням катіонів металу та аніонів кислотного залишку дисоціює: 1) сахароза 2) гідроксид натрію 3) бромід алюмінію 4) азотна кислота 3. Електролітами є обидві речовини у групі: 1). CH4, CO2 2). C2H5OH, HNO3 3). СаO, BaSO4 4). NaCl, KOH 3. Електролітами є обидві речовини у групі: 1). гліцерин, SO2 2). CuCl2, KOH 3). BaO, K2SO4 4). Fe(OH)3, H2SiO3 4. Найбільше іонів водню утворюється при дисоціації дорівнює: 1). HI 2). H2CO3 3). H2S 4). H2SiO3 4. Найбільше іонів водню утворюється при дисоціації дорівнює: 1). H3PO4 2). H2SO4 3). HNO3 4). HF 5. Сума коефіцієнтів у рівнянні дисоціації сульфату алюмінію дорівнює: 1). 4 2). 6 3). 2 4) Сума коефіцієнтів у рівнянні дисоціації карбонату натрію дорівнює: 1). 4 2). 3 3). 2 4). 1