Азот утворює кілька сполук з воднем; їх найбільше значення має аміак - безбарвний газ із характерним різким запахом (запах «нашатирного спирту»).
В лабораторії аміак зазвичай отримують, нагріваючи хлорид амонію з гашеним вапном. Реакція виражається рівнянням
Аміак, що виділяється, містить пари води. Для осушення його пропускають через натронне вапно (суміш вапна з їдким натром).

Мал. 114. Прилад демонстрації горіння аміаку в кисні.
Маса 1 л аміаку за нормальних умов дорівнює 0,77 г. Оскільки цей газ значно легший за повітря, його можна збирати в перевернені вгору дном судини.
При охолодженні до аміак під звичайним тиском перетворюється на прозору рідину, що твердне при .
Електронна структура та просторова будова молекули аміаку розглянуті в § 43. У рідкому аміаку молекули пов'язані між собою водневими зв'язками, що зумовлює порівняно високу температуру кипіння аміаку, що не відповідає його малій молекулярній масі (17).
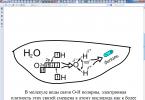
Аміак дуже добре розчинний у воді: 1 об'єм води розчиняє за кімнатної температури близько 700 об'ємів аміаку. Концентрований розчин містить (мас.) і має густину. Розчин аміаку у воді іноді називають нашатирним спиртом. Звичайний медичний нашатирний спирт містить. З підвищенням температури розчинність аміаку зменшується, тому він виділяється при нагріванні з концентрованого розчину, чим іноді користуються в лабораторіях для отримання невеликих кількостей газоподібного аміаку.
При низькій температурі з розчину аміаку може бути виділений кристалогідрат, що плавиться при -. Відомий також кристалогідрат складу. У цих гідратах молекули води та аміаку з'єднані між собою водневими зв'язками.
У хімічному відношенні аміак є досить активним; він вступає у взаємодію з багатьма речовинами. В аміаку азот має найнижчий ступінь окисленості. Тому аміак має лише відновлювальні властивості. Якщо пропускати струм по трубці, вставленої в іншу широку трубку (мал. 114), якою проходить кисень, то аміак можна легко запалити; він горить блідим зеленим полум'ям. При горінні аміаку утворюється вода та вільний азот:
За інших умов аміак може окислюватися до оксиду азоту (див. § 143).
На відміну від водневих сполук неметалів VI і VII груп, аміак не має кислотних властивостей. Проте атоми водню у його молекулі можуть заміщатися атомами металів.
При заміщенні водню металом утворюються сполуки, звані нітридами. Деякі з них, наприклад, нітриди кальцію і магнію, виходять при безпосередній взаємодії азоту з металами при високій температурі;
При зіткненні з водою багато нітридів повністю гідролізуються з утворенням аміаку та гідроксиду металу. Наприклад:
При заміщенні в молекулах аміаку лише один атом водню металами утворюються аміди металів. Так, пропускаючи аміак над розплавленим натрієм, можна отримати амід натрію у вигляді безбарвних кристалів:
Вода розкладає амід натрію;
Маючи сильні основні і водовіднімні властивості, амід натрію знайшов застосування при деяких органічних синтезах, наприклад, у виробництві барвника індиго і деяких лікарських препаратів.
Водень в аміаку може заміщуватися галогенами. Так, при дії хлору на концентрований розчин хлориду амонію виходить нітрид хлору, або хлористий азот,
у вигляді важкої маслянистої вибухової рідини.
Подібними властивостями має нітрид йоду (йодистий азот), що утворюється у вигляді чорного, нерозчинного у воді порошку при дії йоду на аміак. У вологому стані він безпечний, але висушений вибухає від найменшого дотику; при цьому виділяються пари йоду фіолетового кольору.
З фтором азот утворює стійкий фторид азоту.
З даних табл. 6 (стор. 118) видно, що електронегативність хлору і пода менше, а фтору більше, ніж електронегативність азоту. Звідси випливає, що в сполуках і ступінь окисленості азоту дорівнює -3, а вона дорівнює . Тому фторид азоту відрізняється за властивостями від нітридів хлору та йоду. Наприклад, при взаємодії з водою або утворюється аміак, а у разі виходить оксид азоту (III);
![]()
Атом азоту в молекулі аміаку пов'язаний трьома ковалентними зв'язками з атомами водню і зберігає при цьому одну неподілену електронну пару:
Виступаючи як донора електронної пари, атом азоту може брати участь в освіті за донорно-акцепторним способом четвертого ковалентного зв'язку з іншими атомами або іонами, що мають електроноакцепторні властивості.
Цим пояснюється надзвичайно характерна для аміаку здатність вступати до реакції приєднання.
Приклади складних (комплексних) сполук, утворених аміаком в результаті реакцій приєднання, наведені в 201, а також в гол. XVIII. Вище (стор. 124) вже було розглянуто взаємодію молекули з іоном водню, що призводить до утворення іону амонію:
![]()
У цій реакції аміак служить акцептором протона і, отже, з погляду протонної теорії кислот і основ (стор. 237) виявляє властивості основи. Справді, реагуючи з кислотами, що у вільному стані чи розчині, аміак нейтралізує їх, утворюючи солі амонію. Наприклад, з соляною кислотою виходить хлорид амонію:
Взаємодія аміаку з водою теж призводить до утворення не тільки гідратів аміаку, а й частково іона амонію:
В результаті концентрація іонів у розчині зростає. Саме тому водні розчини аміаку мають лужну реакцію. Однак за традицією водний розчин аміаку зазвичай позначають формулою і називають гідроксидом амонію, а лужну реакцію цього розчину розглядають як результат дисоціації молекул .
Аміак - слабка основа. При константі рівноваги його іонізації (див. Попереднє рівняння) дорівнює . В одномолярного водного розчину аміаку міститься лише 0,0042 еквівалента іонів і ; такий розчин має .
Більшість солей амонію безбарвні та добре розчиняються у воді. За деякими своїми властивостями вони подібні до солей лужних металів, особливо калію (іони і мають близькі розміри).
Оскільки водний розчин аміаку є слабкою основою, то солі амонію в розчинах гідролізуються. Розчини солей, утворених аміаком та сильними кислотами, мають слабокислу реакцію.
Гідроліз іону амонію зазвичай записують у такій формі:
Однак правильніше розглядати його як оборотний перехід протону від іону амонію до молекули води:
При додаванні лугу до водного розчину будь-якої солі амонію іони зв'язуються іонами ОН- молекули води і рівновага гідролізу зміщується вправо. Процес, що відбувається при цьому, можна виразити рівнянням:
При нагріванні розчину аміак випаровується, у чому неважко переконатися по запаху. Таким чином, наявність будь-якої амонійної солі в розчині можна виявити, нагріваючи розчин з лугом (реакція на амонію).
Солі амонію термічно нестійкі. При нагріванні вони розкладаються. Це розкладання може відбуватися оборотно або необоротно. Солі амонію, аніон яких не є окислювачем або лише слабкою мірою проявляє окислювальні властивості, розпадаються оборотно. Наприклад, при нагріванні хлорид амонію як би виганяється - розкладається на аміак і хлороводень, які на холодних частинах судини знову з'єднуються в хлорид амонію:
При оборотному розпаді солей амонію, утворених нелетючими кислотами, випаровується лише аміак. Однак продукти розкладання - аміак і кислота, - змішані, знову з'єднуються один з одним. Прикладами можуть бути реакції розпаду сульфату амонію або фосфату амонію.
Солі амонію, аніон яких виявляє різкіше виражені окислювальні властивості, розпадаються незворотно: протікає окислювально-відновна реакція, у ході якої амонію окислюється, а аніон відновлюється. Прикладами можуть бути розпад (§ 136) або розкладання нітрату амонію:
Аміак та солі амонію знаходять широке застосування. Як уже говорилося, аміак навіть при невисокому тиску легко перетворюється на рідину. Оскільки при випаровуванні рідкого аміаку поглинається велика кількість теплоти (1,37), рідкий аміак використовується в різних холодильних пристроях.
Водні розчини аміаку застосовуються в хімічних лабораторіях і виробництвах як слабка легколетюча основа; їх використовують також у медицині та у побуті. Але більшість одержуваного в промисловості аміаку йде на приготування азотної кислоти, а також інших азотовмісних речовин. До найважливіших з них відносяться азотні добрива, насамперед сульфат та нітрат амонію та карбамід (стор. 427).
Сульфат амонію служить добрим добривом і виробляється у великих кількостях.
Нітрат амонію теж застосовується як добрива; відсотковий вміст засвоюваного азоту у цій солі вищий, ніж у інших нітратах чи солях амонію. Крім того, нітрат амонію утворює вибухові суміші з горючими речовинами (амонали), які застосовуються для вибухових робіт.
Хлорид амонію, або нашатир, застосовується в фарбувальній справі, в ситцепечатании, при паянні і лудінні, а також в гальванічних елементах. Застосування хлориду амонію при паянні засноване на тому, що він сприяє видаленню з поверхні металу оксидних плівок, завдяки чому припій добре пристає до металу. При зіткненні сильно нагрітого металу з амонію хлоридом амонію оксиди, що знаходяться на поверхні металу, або відновлюються, або переходять в хлориди. Останні, будучи летючі, ніж оксиди, видаляються з поверхні металу. Для випадку міді і заліза основні процеси, що відбуваються при цьому, можна виразити такими рівняннями:
Перша з цих реакцій є окисно-відновною: мідь, будучи менш активним металом, ніж залізо, відновлюється аміаком, який утворюється при нагріванні.
Рідкий аміак і насичені ним розчини амонійних солей застосовують як добрива. Однією з головних переваг таких добрив є підвищений вміст азоту.
Солі амонію – дуже своєрідні. Всі вони легко розкладаються, причому деякі спонтанно, наприклад карбонат амонію:
(NH4)2CO3 = 2NH3 + Н2О + СО2 (реакція прискорюється при нагріванні).
Інші солі, наприклад хлорид амонію (нашатир), виганяються при нагріванні, тобто спочатку розкладаються на аміак і хлористий під дією нагрівання, а при зниженні температури знову на холодних частинах судини утворюється хлорид амонію:
нагрівання
NH4Cl ⇄ NH3 + НСl
охолодження
Нітрат амонію при нагріванні розкладається на закис азоту та воду. Ця реакція може відбуватися із вибухом:
NH4NО3 = N2О + Н2О
Нітрит амонію NH4NО2 розкладається при нагріванні з утворенням азоту та води, тому ним користуються в лабораторії для одержання азоту.
При дії на солі амонію лугів виділяється аміак:
NH4Cl + NaOH = NaCl + NH3 + H2О
Виділення аміаку - характерна ознака розпізнавання солей амонію. Усі солі амонію є сполуками комплексного характеру.
Аміак та солі амонію знаходять широке застосування. Аміак використовується як сировина для отримання азотної кислоти та її солей, а також солей амонію, які є хорошими азотними добривами. Таким добривом є сульфат амонію (NH4)2SO4 і особливо нітрат амонію NH4NO3 або аміачна селітра, до складу молекули якої входять два атоми азоту: один аміачний, інший нітратний. Рослини спочатку засвоюють аміачний, а потім нітратний. Цей висновок належить основоположнику російської агрохімії акад. Д. Н. Прянішникову, який присвятив свої праці фізіології рослин і обгрунтував значення мінеральних добрив у сільському господарстві.
Аміак у вигляді нашатирного спирту застосовується у медицині. Рідкий аміак використовується у холодильних установках. Хлорид амонію застосовується виготовлення сухого гальванічного елемента Лекланше. Суміш нітрату амонію з алюмінієм та вугіллям, звана амоналом, є сильною вибуховою речовиною.
Карбонат амонію застосовується в кондитерській промисловості як розпушувач тіста.
■ 25. На якій властивості карбонату амонію ґрунтується його використання для розпушування тіста?
26. Як знайти у складі солі іон амонію?
27. Як здійснити низку перетворень:
N2 ⇄ NH3 → NO
↓
NH4N03
Кисневі сполуки азоту
Утворює з киснем кілька сполук, у яких виявляє різні ступені окислення.
Існує закис азоту N2О, або, як його називають, «звеселяючий газ». У ній виявляє ступінь окислення + 1. В окисі азоту NO азот виявляє ступінь окислення + 2, в азотистому ангідриді N2О3 - + 3, в двоокису азоту NО2 - +4, в п'ятиокисі азоту, або азотному
ангідриді, N2О5 - +5.
Закис азоту N2О - несолетворний оксид. Це газ, який досить добре розчинний у воді, але в реакцію з водою не вступає. Закис азоту в суміші з киснем (80% N2O та 20% О2) справляє наркотизуючу дію і застосовується для так званого газового наркозу, перевага якого в тому, що він не має тривалої післядії.
Інші азоту сильно отруйні. Отруйна дія їх позначається зазвичай за кілька годин після вдихання. Перша допомога полягає у прийомі внутрішньо великої кількості молока, вдиханні чистого кисню, потерпілому повинен бути забезпечений спокій.
■ 28. Перерахуйте можливі ступені окислення азоту та , що відповідають цим ступеням окислення.
29. Які заходи першої допомоги слід вживати при отруєннях оксидами азоту?
Найбільш цікавими та важливими оксидами азоту є окис та двоокис азоту, які ми й вивчатимемо.
Окис азоту NО утворюється з азоту та кисню при сильних електричних розрядах. У повітрі під час грози іноді спостерігається утворення окису азоту, але в дуже невеликих кількостях. Окис азоту безбарвний газ, що не має запаху. У воді оксид азоту нерозчинний, тому його можна збирати над водою в тих випадках, коли отримання ведеться лабораторним способом. У лабораторії окис азоту отримують з помірно концентрованої азотної кислоти дією її на:
HNО3 + Сu → Cu(NO3)2 + NO + Н2О
У цьому рівнянні самостійно розставте коефіцієнти.
Окис азоту можна отримати й іншими способами, наприклад, в полум'ї електричної дуги:
N2 + O2 ⇄ 2NO.
У виробництві азотної кислоти окис азоту одержують каталітичним окисленням аміаку, про яке йшлося в § 68, стор 235.
Окис азоту є несолетворним оксидом. Вона легко окислюється киснем повітря і перетворюється при цьому на двоокис азоту NO2. Якщо окислення виробляти у скляній посудині, безбарвний окис азоту перетворюється на бурий газ - двоокис азоту.
■ 30. При взаємодії міді із азотною кислотою виділилося 5,6 л окису азоту. Розрахуйте, скільки прореагувало міді та скільки утворилося солі.
Двоокис азоту NO2 - бурий газ із характерним запахом. Добре розчиняється у воді, тому що реагує з водою за рівнянням:
3NO2 + Н2O = 2HNO3 + NO
У присутності кисню можна отримати лише азотну кислоту:
4NO2 + 2Н2О + O2 = 4HNO3
Молекули двоокису азоту NO2 досить легко з'єднуються попарно і утворюють чотирикис азоту N2O4 - безбарвну рідину, структурна формула якої
Цей процес відбувається на холоді. При нагріванні чотирикіс азоту знову переходить у двоокис.
Двоокис азоту - кислотний оксид, тому що може реагувати з лугами, утворюючи сіль та воду. Однак внаслідок того, що атоми азоту в модифікації N2O4 мають різну кількість валентних зв'язків, при взаємодії двоокису азоту з лугом утворюються дві солі - нітрат і нітрит:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Отримують двоокис азоту, як говорилося вище, окисленням окису:
2NO + О2 = 2NO2
Крім того, двоокис азоту отримують дією концентрованої азотної кислоти на :
Сu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(Конц.)
або краще прожарюванням нітрату свинцю:
2Pb(NO3)2 = 2РbO + 4NO2 + О2
■ 31. Перерахуйте способи одержання двоокису азоту, привівши рівняння відповідних реакцій.
32. Зобразіть схему будови атома азоту в ступені окислення +4 і поясніть, якою має бути його поведінка в окисно-відновних реакціях.
33. У концентровану азотну кислоту помістили 32 г суміші міді та окису міді. Вміст міді у суміші 20%. Який обсяг якогось газу при цьому виділиться. Скільки грам молекул солі при цьому виходить?
Азотиста кислота та нітрити
Азотиста кислота HNO2 – дуже слабка нестійка кислота. Вона існує лише в розведених розчинах (а = 6,3% 0,1 н. розчині). Азотиста кислота легко розкладається з утворенням окису та двоокису азоту
2HNO2 = NO + NO2 + Н2O.
Ступінь окиснення азоту в азотистій кислоті +3. При такому ступені окислення умовно вважатимуться, що з зовнішнього шару атома азоту віддано 3 електрона і ще залишилося 2 валентних електрона. У зв'язку з цим для N+3 в окислювально-відновних реакціях існують дві можливості: він може виявляти як окислювальні, так і відновлювальні властивості залежно від того, в яке середовище-окислювальне або відновне - потрапляє.
Солі азотистої кислоти називаються нітритами. Діючи на нітрити сірчаною кислотою, можна отримати азотисту кислоту:
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2.
Нітрити є солі, досить добре розчинні у воді. Як і сама азотиста кислота, нітрити можуть виявляти окисні властивості при реакції з відновниками, наприклад:
NaNO2 + KI + H2SO4 → I2 + NO…
Знайти кінцеві продукти та розставити коефіцієнти на основі електронного балансу спробуйте самостійно.
Оскільки що виділяється легко виявити за допомогою крохмалю, дана реакція може бути способом виявлення навіть незначних кількостей нітритів у питній воді, присутність яких небажана через отруйність. З іншого боку, нітритний азот може окислюватися до N+5 під впливом сильного окислювача.
NaNO2 + K2Cr2O7 + H2SO4 → NaNO3 + Cr2(SO4)3 + …
Решту продуктів реакції знайдіть самостійно, складіть електронний баланс і розставте коефіцієнти.
■ 34. Закінчіть рівняння.
HNO2 + KMnO4 + H2SO4 → … (N +5, Мn +2).
35. Перерахуйте властивості азотистої кислоти та нітритів.
Азотна кислота
HNO3 – сильний електроліт. Це летюча рідина. Чиста кипить при температурі 86 °, немає кольору; густина її 1,53. У лабораторії зазвичай надходить 65% HNO3 із щільністю 1,40.
димить у повітрі, оскільки її пари, піднімаючись у повітря і з'єднуючись із парами води, утворюють крапельки туману. Азотна кислота поєднується з водою в будь-яких співвідношеннях. Вона має різкий запах, що легко випаровується, тому переливати концентровану азотну кислоту слід лише під тягою. При потраплянні на шкіру азотна кислота може спричинити сильні опіки. Невеликий опік дається взнаки характерною жовтою плямою на шкірі. Сильні опіки можуть спричинити утворення виразок. У разі потрапляння на шкіру азотної кислоти її слід швидко змити великою кількістю води, а потім нейтралізувати слабким розчином соди.
Концентрована 96-98% азотна кислота надходить до лабораторії рідко і при зберіганні досить легко, особливо на світлі розкладається за рівнянням:
4HNO3 = 2Н2O + 4NO2 + O2
Вона постійно забарвлена двоокис азоту в жовтий колір. Надлишок двоокису азоту і поступово випаровуються з розчину, в розчині накопичується, а кислота продовжує розкладатися. У зв'язку з цим концентрація азотної кислоти поступово зменшується. При концентрації 65% азотна кислота може зберігатися тривалий час.
Азотна кислота є одним із найсильніших окислювачів. Вона реагує майже з усіма металами, але виділення водню. Яскраво виражені окисні властивості азотної кислоти надають на деякі ( , ) так звану пасивну дію. Це особливо притаманно концентрованої кислоти. При її вплив на поверхні металу утворюється дуже щільна не розчинна в кислотах оксидна плівка, що захищає метал від подальшого впливу кислоти. Метал стає пасивним. .
Однак із більшістю металів азотна кислота реагує. У всіх реакціях з металами в азотній кислоті відновлюється азот і тим повніше, чим розбавленіша кислота і чим активніший метал.
Концентрована кислота відновлюється до окису азоту. Прикладом цього може бути реакція з міддю, наведена вище (див. § 70). Розведена азотна кислота з міддю відновлюється до окису азоту (див. § 70). Більш активні, наприклад, відновлюють розведену азотну кислоту до закису азоту.
Sn + HNO3 → Sn(NO3)2 + N2O
При дуже сильному розведенні з активним металом, наприклад, з цинком, реакція доходить до утворення солі амонію:
Zn + HNO3 → Zn(NO3)2 + NH4NO3
У всіх наведених схемах реакцій розставте коефіцієнти, склавши електронний баланс самостійно.
■ 36. Чому при зберіганні в лабораторії навіть у добре закупореному посуді концентрація азотної кислоти знижується?
37. Чому концентрована азотна кислота має жовтувато-буре забарвлення?
38. Напишіть рівняння реакції розбавленої азотної кислоти із залізом. Продуктами реакції є нітрат заліза (III) і виділяється газ бурого кольору.
39. Випишіть у зошит усі рівняння реакцій, що характеризують взаємодію азотної кислоти з металами. Перерахуйте, які , крім нітратів металів, утворюються цих реакціях.
Багато хто може горіти в азотній кислоті, наприклад вугілля та :
З + HNO3 → NO + СО2
Р + HNO3 → NO + H3PO4
Вільний у своїй окислюється до фосфорної кислоти. при кип'ятінні в азотній кислоті перетворюється на S+6 і з вільної сірки утворюється:
HNO3 + S → NO + H2SO4
Закінчіть рівняння реакцій самостійно.
Складні можуть горіти в азотній кислоті. Наприклад, в азотній кислоті горять скипидар, нагріте тирсу.
Азотна кислота може окислювати соляну кислоту. Суміш трьох частин соляної та однієї частини азотної кислоти називається «царською горілкою». Така назва дана тому, що ця суміш окислює і платину, на які ніякі кислоти не діють. Реакція протікає за такими стадіями: у самій суміші відбувається окислення іона хлору у вільний і відновлення азоту до утворення хлористого нітрозилу:
HNO3 + 3НСl ⇄ Сl2 + 2Н2O + NOCl
царська горілка хлористий нітрозил
Останній легко розкладається на окис азоту та вільний за рівнянням:
2NOCl = 2NO + Сl2
Вміщене в «царську горілку» металеве легко окислюється хлористим нітрозилом:
Au + 3NOCl = АuСl3 + 3NO
Азотна кислота може вступати у реакцію нітрування з органічними речовинами. При цьому обов'язково має бути концентрована. Суміш концентрованих азотної та сірчаної кислот називається нітруючої сумішшю. За допомогою такої суміші можна отримати з гліцерину нітрогліцерин, з бензолу - нітробензол, з клітковини - нітроклітковину і т. д. У сильно розведеному стані азотна кислота виявляє характерні властивості кислот.
■ 40. Приклади типових властивостей кислот стосовно азотної кислоти наведіть самостійно. Рівняння напишіть у молекулярній та. іонної форми.
41. Чому склянки із концентрованою азотною кислотою забороняється перевозити упакованими у деревні стружки?
42. При випробуванні фенолфталеїном концентрованої азотної кислоти фенолфталеїн набуває помаранчевого забарвлення, а не залишається безбарвним. Чим це пояснюється?
Отримати азотну кислоту у лабораторії дуже легко. Зазвичай її отримують шляхом витіснення з її солей сірчаною кислотою, наприклад:
2KNО3 + H2SО4 = K2SО4 + 2HNО3
На рис. 61 зображено лабораторну установку для отримання азотної кислоти.
У промисловості сировиною отримання азотної кислоти служить аміак. В результаті окислення аміаку у присутності платинового каталізатора утворюється окис азоту:
4NH3 + 5О2 = 4NO + 6Н2О
Як було зазначено вище, окис азоту легко окислюється киснем повітря в двоокис азоту:
2NO + О2 = 2NO2
а двоокис азоту, з'єднуючись з водою, утворює азотну кислоту і знову окис азоту за рівнянням:
3NО2 + Н2О = 2HNО3 + NO.
Потім окис азоту знову подається на окислення:
Перша стадія процесу - окислення аміаку в окис азоту - здійснюється контактному апараті при температурі 820°. Каталізатором служать сітки з платини з домішкою родію, які нагрівають перед запуском апарату. Так як реакція екзотермічна, надалі сітки нагріваються за рахунок тепла реакції. Оксид азоту, що вийшов з контактного апарату, охолоджують до температури близько 40°, так як процес окислення окису азоту йде швидше при більш низькій температурі. При температурі 140° двоокис азоту, що утворюється, розкладається знову на окис азоту і кисню.
Окислення окису азоту в двоокис здійснюється у вежах, званих абсорберами, зазвичай під тиском 8-10 атм. У них одночасно відбувається і поглинання (абсорбція) двоокису азоту, що утворюється водою. Для кращого поглинання двоокису азоту розчин охолоджують. Виходить 50-60% азотної кислоти.
Концентрування азотної кислоти проводять у присутності концентрованої сірчаної кислоти в ректифікаційних колонах. утворює з наявною водою гідрати з температурою кипіння вищою, ніж у азотної кислоти, тому із суміші досить легко виділяються пари азотної кислоти. При конденсації цих пар можна отримати 98-99% азотну кислоту. Зазвичай концентрована кислота застосовується рідко.
■ 43. Запишіть у зошит усі рівняння реакцій, які відбуваються при отриманні азотної кислоти лабораторним та промисловим засобами.
44. Як здійснити низку перетворень:

45. Скільки 10% розчину можна приготувати з азотної кислоти, одержаної взаємодією 2,02 кг нітрату калію з надлишком сірчаної кислоти?
46. Визначте молярність 63% азотної кислоти.
47. Скільки азотної кислоти можна отримати з 1 т аміаку за 70% виходу?
48. Циліндр заповнили окисом азоту шляхом витіснення води. Потім, не виймаючи з води, під нього підвели трубку від газометра.
(див. рис. 34) і почали пропускати . Опишіть, що має спостерігатися у циліндрі, якщо надлишку кисню не допускалося. Обґрунтуйте свою відповідь рівняннями реакцій.

Мал. 62. Горіння вугілля у розплавленій селітрі. 1 – розплавлена селітра; 2 - вогник, що горить; 3 – пісок.
Солі азотної кислоти
Солі азотної кислоти називаються нітратами. Нітрати лужних металів, а також кальцію та амонію називаються селітрами. Наприклад, KNО3 – калійна селітра, NH4NО3 – аміачна селітра. Природні поклади нітрату натрію є у величезній кількості в Чилі, у зв'язку з чим ця сіль отримала назву чилійської селітри.
Мал. 62.Горіння вугілля у розплавленій селітрі. 1 – розплавлена селітра; 2 - вогник, що горить; 3 – пісок.
Солі азотної кислоти, як вона сама, є сильними окислювачами. Наприклад, солі лужних металів при плавленні виділяють за рівнянням:
2KNО3 = 2KNO2+ О2
Завдяки цьому вугілля та інші горючі речовини горять у розплавленій селітрі (рис. 62).
Солі важких металів також розкладаються із виділенням кисню, але з іншою схемою.
2Pb(NО3)2 = 2РbО + 4NO2 + О2

Мал. 63. Кругообіг азоту в природі
Калійна селітра застосовується виготовлення чорного пороху. Для цього її змішують з вугіллям та сіркою. для цієї мети не використовується, тому що вона гігроскопічна. Чорний порох при підпалюванні інтенсивно згоряє за рівнянням:
2KNO3 + 3С + S = N2 + 3CO2 + K2S
Нітрати кальцію та амонію – дуже хороші азотні добрива. Останнім часом набув поширення як добрива та нітрат калію.
Азотна кислота широко застосовується у виробництві хіміко-фармацевтичних препаратів (стрептоцид), органічних барвників, целулоїду, кіно- та фотоплівок. Солі азотної кислоти широко використовуються у піротехніці.
У природі існує кругообіг азоту, при якому рослини при відмиранні повертають назад у ґрунт отриманий з неї азот. Тварини, харчуючись рослинами, повертають азот у ґрунт у вигляді випорожнень, а після смерті їх трупи перегнивають і тим самим також повертають ґрунту отриманий від нього азот (рис.63). Знімаючи врожай, людина втручається в цей кругообіг, порушує його і тим самим збіднює ґрунт азотом, тому доводиться вносити азот на поля у вигляді мінеральних добрив.
■ 49. Як здійснити низку перетворень

Технічна азотна кислота Отримання азотної кислоти здійснюється трьома способами, які ми опишемо в тому порядку, в якому вони почали застосовуватися.
ПЕРЕВІРКА ВИКОНАННЯ ЗАВДАНЬ І ВІДПОВІДІВ НА ПИТАННЯ 4. Для того щоб відповісти на ці питання, уважно прочитайте ще раз §...
Солі амонію При випарюванні нейтралізованих розчинів аміаку іони амонію з'єднуються з аніонами взятих кислот, утворюючи тверді кристалічні речовини, що володіють іонною...
Солі амонію
ДоАтіон амонію NH4+ відіграє роль катіону металу і він утворює з кислотними залишками солі: NH4NO3 - нітрат амонію, або аміачна селітра, (NН4)2SO4 - сульфат амонію і т. д.
Усі солі амонію - тверді кристалічні речовини, добре розчинні у воді. По ряду властивостей вони схожі на солі лужних металів, і в першу чергу на солі калію, так як радіуси іонів К+ та NН приблизно рівні.
Солі амонію одержують взаємодією аміаку або його водного розчину з кислотами.
Вони мають усі властивості солей, зумовлені наявністю кислотних залишків. Наприклад, хлорид або сульфат амонію реагує відповідно з нітратом срібла або хлоридом барію, утворюючи при цьому характерні опади. Карбонат амонію взаємодіє з кислотами, тому що в результаті реакції утворюється вуглекислий газ.
Крім того, іон амонію обумовлює іншу, загальну для всіх солей амонію, властивість: його солі реагують із лугами при нагріванні з виділенням аміаку.
Ця реакція є якісною реакцією на солі амонію, так як аміак, що утворюється, легко виявляється (як саме?).
Третя група властивостей солей амонію - це їхня здатність розкладатися при нагріванні з виділенням газоподібного аміаку, наприклад:
NH4Сl = NH3 + НСl
У цій реакції утворюється також газоподібний хлороводень, який випаровується разом з аміаком, а при охолодженні знову з'єднується з ним, утворюючи сіль, тобто при нагріванні в пробірці сухий хлорид амонію як би виганяється, але на верхніх холодних стінках пробірки знову з'являються білі кристали NН4Сl (рис. 32).
Основні сфери застосування солей амонію були показані раніше, на малюнку 31. Тут звернемо вашу увагу на те, що майже всі солі амонію використовують як азотні добрива. Як ви знаєте, рослини здатні засвоювати азот тільки у зв'язаному вигляді, тобто у вигляді іонів NH4 або N03. Чудовий російський агрохімік Д. Н. Прянишников з'ясував, що якщо рослина має вибір, то вона віддає перевагу катіону амонію нітрат-аніону, тому використання солей амонію в якості азотних добрив особливо ефективно. Дуже цінним азотним добривом є нітрат амонію NH4NO3.
Відзначимо інші сфери застосування деяких солей амонію.
Хлорид амонію NН4Сl використовують при паянні, так як він очищає поверхню металу від оксидної плівки і до неї добре пристає припій.
Гідрокарбонат амонію NН4NС03 і карбонат амонію (NH4)2С03 застосовують у кондитерській справі, так як вони легко розкладаються при нагріванні та утворюють гази, що розпушують тісто і роблять його пишним, наприклад:
NH4НС03 = NH3 + Н20 + CO2
Нітрат амонію NН4NO3 у суміші з порошками алюмінію та вугілля використовують як вибухову речовину — амонал, який широко застосовується при розробці гірських порід.
Тема 2 9 клас
Урок 34
Тема уроку: Солі амонію.
Цілі уроку: освітні
– вивчити склад солей амонію, повторити загальні хімічні властивості солей з прикладу солей амонію, розкрити специфічні властивості цих солей, зумовлені іоном амонію; вивчити практичне застосування солей амонію; поглибити основні хімічні поняття: хімічна реакція;вивчити практичне значення солей амонію.
розвиваючі – розвивати в учнів вміння порівнювати, аналізувати та застосовувати інформацію з інших галузей знань, розвивати комунікативні здібності, вміння пред'являти результати групової діяльності;
виховні - Сприяти вихованню екологічної грамотності у учнів, активної життєвої позиції.
Тип уроку:Вивчення нового матеріалу.
Методи навчання:частково-пошуковий, наочний,Форми організації пізнавальної діяльності:групова, фронтальна, практична.
Технічні засоби навчання:комп'ютер, проектор, екран
Методи роботи: самостійна робота з підручником, робота у парах.
Обладнання та реактиви: розчини - хлориду барію, гідроксиду натрію, соляну кислоту, карбонат амонію, хлорид амонію, сульфат амонію склянку з водою;гідроксид амонію, азотна кислота, сульфат амонію, хлорид амонію, карбонат амонію, нітрат срібла, нітрат калію, соляна кислота, гідроксид натрію;
пробірки, штатив для пробірок, спиртування, ватка, пробіркотримач, фенолфталеїновий папірець.
ХІД УРОКУ: 1. Організаційна частина уроку.
2. Перевірка знань учнів.
Запитання та завдання опитування.
1.Завдання:До 400г розчину з масовою часткою хлориду амонію 8% додали надлишок гідроксиду кальцію. Визначте обсяг газу, що виділився».
2. Запитання: 1. Будова молекули аміаку.
2. Перерахуйте фізичні властивості аміаку.
3.Хімічні властивості аміаку.
4. Перерахуйте сфери застосування аміаку.
3. Завдання "третій зайвий"
До 3 РВ 4 , HCL , H 2 SO 4
Ba (OH) 2, NaNO 3 , NaOH
K 2 O, CO 2 , MgSO 4
4.Тест (1 варіант – азот, 2 варіант – аміак)
1.Газоподібний за звичайних умов
2.Не має запаху
3.Безбарвний
4.У воді малорозчинний
5. Ступінь окислення азоту -3
6.У повітрі не горить
7.Горить у кисні
8.Взаємодіє з кислотами з утворенням солей
9.У молекулі між атомами ковалентний полярний зв'язок
10. Взаємини з воднем у присутності каталізатора
11.Він є найважливішим біогенним елементом.
12.Водний розчин має лужне середовище
13.Він проявляє переважно відновлювальні властивості
14.10% розчин його називається нашатирним спиртом
(Обмінюємося зошитами, перевіряємо).
1, 2, 3, 4, 6, 10, 11, 13
1, 3, 5, 7, 8, 9, 12, 13
3. Вивчення програмного матеріалу.
1. Солі амонію - це складні речовини, що містять у своєму складі іони амонію, з'єднані із кислотними залишками.
Амонію солі - солі, що містять одновалентний іон амонію NH 4 + ; за будовою, кольором та іншими властивостями вони схожі на відповідні солі калію. Всі солі Амонію розчиняються у воді, повністю дисоціюють у водному розчині. Солі Амонію виявляють загальні властивості солей. При дії лугу виділяється газоподібний NH 3 . Усі солі Амонію при нагріванні розкладаються. Отримують їх за взаємодії NH 3 або NH 4 OH із кислотами. Нітрат амонію (аміачна селітра) NH 4 NO 3 застосовують як азотне добриво та для виготовлення вибухових речовин - амонітів, сульфат амонію (NH 4 ) 2 SO 4 застосовується як дешеве азотне добриво, бікарбонат амонію NH4HCO 3 та карбонат амонію (NH 4 ) 2 3 застосовують у харчовій промисловості, при фарбуванні тканин, у виробництві вітамінів, у медицині; хлорид амонію (нашатир) NH 4 Cl застосовується в гальванічних елементах (сухих батареях), при паянні та лудженні, у текстильній промисловості, як добриво, у ветеринарії.
2. Загальна формула солей амонію.
NH 4 R; (NH 4) n R , де R - Кислотний залишок.
У NH 4 CLє катіон амонію
3. Фізичні властивості солей амонію
Солі амонію - тверді, кристалічні речовини, добре розчиняються у воді.
4. Хімічні властивості солей амонію.
Властивості спільні з іншими солями
Специфічні властивості
1.Сильні електроліти
NH 4 N О 3 = NH 4 + +N О 3 -
2.Реагують з кислотами – реакція обміну
(NH 4) 2 СО 3 +2HCl =2NH 4 Cl +CO 2 +H 2 O
3.Реагують з іншими солями
(NH 4) 2 SO 4 +BaCl 2 =2NH 4 Cl +Ba SO 4
4.Зазнають гідролізу
NH 4 Cl +H 2 O.
Це сіль слабкої основи та сильної кислоти. Ланцюжок рветься слабкою ланкою. Гідроліз іде катіоном амонію.
1.При високій температурі розкладаються
а) якщо кислота летюча
NH 4 Cl= NH 3 +HCl
NH 4 HCO 3 → NH 3 + Н 2 O + CO 2
б) якщо кислота нелетюча
(NH 4) 2 SO 4 =?
в) якщо кислота нелетюча і аніон виявляє окисні властивості
(NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O
NH 4 NO 3 = N 2 O + 2 Н 2 O
2.Реагують з лугами
NH 4 Cl +NaOH = NaCl + NH 3 + Н 2 O
Це якісна реакція на солі амонію.
3. З кислотами та солями (реакція обміну)
a) (NH4) 2 CO 3 + 2 НCl → 2NH 4 Cl + Н 2 O + CO 2
2NH 4 + + CO 3 2- + 2H + + 2Cl - → 2NH 4+ + 2Cl - + Н 2 O + CO 2
CO 3 2- + 2H + → Н 2 O + CO 2
б) (NH4) 2 SO 4 + Ba(NO3) 2 → BaSO 4 + 2NH 4 NO 3
2NH 4 + + SO 4 2- + Ba 2+ + 2NO 3 - → BaSO 4 + 2NH 4 + + 2NO 3 -
Ba 2+ + SO 4 2- → BaSO 4
4. Солі амонію піддаються гідролізу (як сіль слабкої основи та сильної кислоти) – середовище кисле:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2О → NH4OH + H+
5. Сильні електроліти (дисоціюють у водних розчинах)
NH 4 Cl → NH 4 + + Cl -

ВИСНОВОК:1) Солі амонію – це електроліти, які дисоціюють на катіон амонію NH
4
+
та аніони кислотного залишку.
2)
Вони виявляють властивості:
а) Загальні із солями-
взаємодіють із кислотами, солями, якщо утворюється осад чи газ.
б) Специфічні -
взаємодіють із лугами з утворенням аміаку, при нагріванні розкладаються, добре розчиняються у воді і є електролітами, при гідролізі показують кислотне середовище або гідроліз йде повністю.
Це цікаво:
Назва «амоній» запропонував у 1808р. Гемфрі Деві. Латинське слово амоніум колись означало "сіль з Аммонії". Амонія – область Лівії. Там був храм єгипетського бога Аммона, на ім'я якого і називалася вся область. В Аммонії здавна отримували амонійні солі, спалюючи верблюжий гній. Під час розпаду солей виходив газ, який зараз називають аміактом. У 1787р. комісія з хімічної номенклатури дала газу ім'я амоніак. Російський хімік Захаров скоротив цю назву до «аміаку».
Розчин аміаку у воді називають нашатирним спиртом. "Нашатирний" тому, що може бути отриманий з нашатирю NH 4 Cl . Але чому ж спирт? Латинське спірітус означає "дух", "душа". Очевидно, невідомий нам хімік, який розчинив у воді отриманий з нашатирю аміак, назвав гостро пахнучу рідину душою нашатиря.
Назва «нітрати» походить від назви м. Нітрії у Верхньому Єгипті, де вперше було знайдено мінерал NH 4 NO 3.
4.Спосіб отримання солей амонію.
1. Солі амонію одержують при взаємодії аміаку з кислотами.
2. При взаємодії аміачної води із кислотами.
5. Найважливіші сфери застосування солей амонію.
Як добриво
Для виробництва вибухових речовин
Гідрокарбонат амонію та карбонат амонію в харчовій промисловості як розпушувач тесту.
При фарбуванні тканин у текстильній промисловості
У виробництві вітамінів
В медицині
При паянні
У сухих батареях
При виробленні шкіри
У піротехніці
Висновки:
Солі амонію утворені катіонами амонію та аніонами кислотних залишків
За фізичними властивостями вони схожі на солі лужних металів, особливо калію
Якісна реакція на катіон амонію – взаємодія з лугами при нагріванні, газ, що виділяється, має характерний запах і забарвлює фенолфталеїновий папірець у малиновий колір.
4. Закріплення вивченого матеріалу
Закріплення вивченого матеріалу можна провести у формі диференційованої індивідуальної самостійної роботи учнів за варіантами.
ВАРІАНТ 1
Напишіть повні та скорочені іонні рівняння реакцій, що відбуваються між речовинами:
-хлоридом амонію та нітратом срібла;
Карбонатом амонію та соляною кислотою;
Нітратом амонію та гідроксидом натрію.
ВАРІАНТ 2
Допишіть рівняння реакцій у повній та скороченій іонній формі:
(NH 4) 2 SO 4 +? → NH 4 CI + BaSO 4 ↓
NH 4 CI +? →? +? + NH 3
(NH 4) 2 S + HCI →? +?
ВАРІАНТ 3
Напишіть повні та скорочені іонні рівняння реакцій, що відбуваються між наступними парами речовин:
-сіль амонію та інша сіль;
Сіль амонію та луг;
Сіль амонію та кислота.
5.Домашнє завдання:§ 26, керівництво 1-4 (письменно)



















 Назад вперед
Назад вперед
Увага! Попередній перегляд слайдів використовується виключно для ознайомлення та може не давати уявлення про всі можливості презентації. Якщо вас зацікавила ця робота, будь ласка, завантажте повну версію.
Вигляд уроку:урок із застосуванням мультимедіа
Цілі уроку:
- Навчальні:Систематизувати знання учнів про солі; формування на межпредметном рівні системи знання солі амонію, мають велике практичне значення.
- Розвиваючі:виробити практичні навички проведення якісних реакцій на солі амонію; вміння аналізувати побачене; розвиток логічного мислення; розвиток пізнавального інтересу при виконанні теоретичних та практичних завдань.
- Виховні:Підвищувати пізнавальну діяльність та активність учнів; виховання вміння працювати у колективі.
Обладнання та реактиви уроку:
1. На столі вчителя: розчин соляної кислоти HCl; гідроксид амонію NH 4 OH; хлорид амонію NH 4 Cl; хлорид натрію NaCl; вода H2O; лакмус; фенолфталеїн; біхромат амонію (NH 4) 2 Cr 2 O 7 .
2. На столі учнів: сульфат амонію (NH 4) 2 SO 4; сірчана кислота H 2 SO 4; хлорид барію BaCl; хлорид амонію NH 4 Cl; гідроксид натрію NaOH;
3.Інтерактивна дошка.
Основні питання:
- Визначення солей амонію.
- Роль солей амонію у народному господарстві.
- Фізичні та хімічні властивості солей амонію.
- Одержання солей амонію.
- Якісні реакції на солі амонію.
Основні поняття:Катіон амонію, солі амонію.
Хід уроку
1. Організаційний момент
Вчитель перевіряє готовність до уроку, повідомляє тему уроку.
2. Перевірка опорних знань (10 хв)
На учительському столі стоять у скляній тарі речовини (солі).
Вчитель: У цій тарі є дивовижна речовина. Колись воно вважалося "милістю божою", символом благополуччя.
:. Але воно може і занапастити живе, через нього навіть море може стати мертвим.
Разом з цим важко перерахувати, де б воно не застосовувалося.
Що ж знаходиться у цій склянці?
(Очікується відповідь сіль.)
Які речовини ми відносимо до солей?
Тренувальна вправа:
З перерахованих речовин виберіть солі та назвіть їх:
KCl NaOH KOH CO 2 H 2 SO 4 Ba(NO 3) 2 CuSO 4 MgO NH 4 Cl H 2 S AgNO 3 (NH 4) 2 SO 4
Які незвичайні солі вам зустрілися?
У складі цих солей знаходиться складний катіон - катіон амонію.
Вчитель вимагає клас сформулювати поняття солі амонію (солі, що з катіонів амонію і аніонів кислотного залишку).
Вчитель: Як ви вважаєте, де можуть застосовуватися ці солі? Чому?
Учні: У сільському господарстві, оскільки містять життєво важливий елемент рослин - азот.
Для всебічної характеристики практичного значення солей амонію доцільно заслухати міні доповідь учнів.
3. Вивчення нового матеріалу (15 хв)
Вчитель: Вивчимо фізичні та хімічні властивості солей амонію на практиці.
Що спільного у фізичних властивостях солей та солей амонію?
Учні: тверді, білі, кристалічні речовини, добре розчиняються у воді, електроліти.
Вчитель: Перевірте розчинність сульфату амонію на практиці, запишіть фізичні властивості у зошит ( проведення експерименту).
Розглянемо хімічні властивості солей амонію.
Згадаймо загальні властивості солей:
(У зошити складається опорний конспект) .
А) дисоціація – запишемо рівняння дисоціації солей
- Хлорида амонію
- Сульфату амонію
Б) Взаємодія із кислотами
2 NH 4 Cl + H 2 SO 4 (NH 4) 2 SO 4 + 2 HCl
Виконати досвід, вказати ознаки реакції ( проведення експерименту).
В) Взаємодія із лугами.
У пробірку опускаємо фенолфталеїновий папір і спостерігаємо зміну забарвлення ( проведення експерименту)

Висновок: дана реакція є якісною на солі амонію.
Г) Взаємодія із солями
NH 4 Cl + AgNO 3 NH 4 NO 3 + AgCl
Учні роблять експеримент, записують рівняння реакції і звіряють їх самостійно з рівнянням на слайді ( проведення експерименту).
Творче завдання: Визначте, яка з трьох пробірок містить сульфат амонію. Запишіть рівняння виконаних реакцій ( проведення експерименту).
Специфічні властивості солей:
Д) Розкладання солей амонію
Демонстраційний досвід: розкладання біхромату амонію; хлориду амонію:
NH 4 Cl NH 3 + HCl
(NH 4) 2 Сr 2 Про 7 N 2 + Сr 2 Про 3 +4H 2 Про
Е) Гідроліз солей амонію
NH 4 Cl + H 2 Про NH 4 OH + HCl
Демонстраційний досвід.
Висновок: середовище лужне, лакмус – синій, фенолфталеїн – малиновий.
Вчитель: Згадайте, якими способами можна отримати солі.
Учні: При взаємодії основи та кислоти; солі та солі; солі та кислоти.
Вчитель демонструє досліди, що учні записують опорний конспект за допомогою слайда.
А) NH 4 OH + HCl NH 4 Cl + H 2 Про
Б) (NH 4) 2 SO 4 + BaCl 2 BaSO 4 + 2 NH 4 Cl
В) (NH 4) 2 С 3 + 2HCl 2 NH 4 Cl + H 2 Про + С 2
Висновок: при написанні рівнянь необхідно дотримуватися умови незворотності хімічних реакцій.
4. Закріплення пройденого матеріалу (15 хв)
Вправа №1.
Вибрати та назвати солі амонію:
I варіант II варіант NaNO 3 BaCl 2
Взаємоперевірка у парах.
Самоперевірка.
NH 3 + HCl NH 4 Cl
2NH 3 + H 2 SO 4 (NH 4) 2 SO 4в) 3
З сірчаною кислотою взаємодіють
Правильна відповідь на слайді відзначена крапками на малюнку, потім точки з'єднуються в посмішку.
Учні звіряють свої відповіді із зразком на екрані, намагаються самостійно аналізувати допущені помилки. Вчитель коригує відповіді учнів.
Вправа №4.(Ігрова вправа розвиває прагнення хлопців до пошуку правильної відповіді, отримавши яку можна буде відкрити сейф).
"Золотий ключик"
Визначте шифр сейфа.
Перерахуйте послідовність цифр (у порядку зростання), що визначають властивості сульфату амонію.
Тест:
- Розчиняються у воді.
- Чи не електроліти.
- Біла кристалічна речовина.
- Пахне аміаком.
- Реагує із хлоридом барію.
- Реагує із гідроксидом кальцію.
- При нагріванні розкладається.
- НЕ ЗНАЮ СЛОВА
- реагує з ортофосфорною кислотою.
- Реагує з НЕЗНАЮ НАЗВА
Відповідь: 1345678
Вчитель пропонує записати хлопцям можливі рівняння реакцій.
5. Домашнє завдання
Творче завдання: Сіль білого кольору, розчинна у воді, з нітратом срібла утворює білий сирний осад, при горінні якого утворюється азот. Назвіть сіль, напишіть рівняння реакцій у молекулярному та іонному вигляді.
6. Висновки уроку (3хв)
Завершення уроку в цікавій творчій формі подарує гарний настрій кожній дитині та підвищить якість засвоєння матеріалу вивченого на уроці.
Складання синквейн (цікавий не римований вірш, який вимагає інформації в коротких виразах, що дозволяє описати побачене та почуте):
Учні пишуть синквейн, працюючи в парах, користуючись підручником та опорним конспектом.
- Солі амонію
- Корисні, важливі
- Перетворюють пустелі на оази
- Реагують як усі солі з солями, кислотами та лугами
- Розкладаються, у сільському господарстві застосовуються.
7. Підбиваючи підсумки уроку, вчитель наводить слова:"Думаючий розум не почувається щасливим, поки йому не вдасться зв'язати в єдино розрізнені факти" (Хевелсі).