Урок 5
Тема: Сутність процесу електролітичної дисоціації
Цілі і завдання:
Освітні:формувати поняття «електроліти, неелектроліти, розчини, гідратація, гідрати, кристалогідрати, кристалізаційна вода», розкрити сутність процесу електролітичної дисоціації, розглянути основні положення теорії електролітичної дисоціації;
Розвиваючі: розвивати вміння працювати з текстом, давати хар-ку процесу електролітичної дисоціації;
Виховні: виховувати інтерес до хімії, формувати науковий світогляд.
Обладнання: солі, вода, таблиця, підручник, зошити, дід.
Хід уроку:
1)Орг.момент
2) Перевірка д.з.
Фронтальна бесіда: "Основні класи неорганічних речовин";
Індив. листів. опитування за картками
Варіант 1: Дати визначення: солі, оксиди. Дати їхню класифікацію.
Навести приклади
Варіант 2: Дати визначення: основи, кислоти. Дати їхню класифікацію.
Навести приклади.
Диктант
Написати формули кислот, їх кислотних залишків, вказати їхню валентність.
3) Вивчення нового матеріалу
1.Актуалізація знань
I. Досліди з сухими речовинами, розчинами та розплавами з проведення електричного струму
Рис.1 с.3
Сухі NaCl, сода
Дистильована вода - не проводять струм
Р-ри NaCl, лугів, солей - проводять струм
Р-ри глюкози
Спирту - не проводять струм
Цукру
Кисню
Азот
ІІ. Механізм розчинення у воді
1) В-в з іонним зв'язком
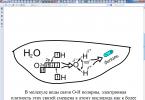
Рис.2 Na + Cl - + Н-О-Н
У р-рі іони гідратовані – оточені молекулами води
2) В-в з ковалентним полярним зв'язком
НCl H++ Cl - гідратовані іони
Ковалентний полярний зв'язок перетворюється на іонний
ІІІ. Речовини
Електроліти Неелектроліти с.5
… …
Визначення
Солі кисень
Луги азот
Кислоти водень
З іонним або ковалентним з ковалентним неполярним/слабополярним зв'язком
сильнополярним зв'язком
IV. Електролітична дисоціація –процес розпаду електроліту на іони при розчиненні у воді чи розплавленні.
V. Розчинення – фізико-хімічний процес
V. Гідратація іонів
Каблуков і Кістяковский припустили, що з р-рении молекули води приєднуються до іонів, обр-сягідрати
Визначення с.6
VI.Кріслаллогідрати та кристалізаційна вода
С.7 визначення
VII.Основні положеннятеорії електролітичної дисоціації
Сам-но с.8-9 напам'ять
4) Закріплення
В.1-6 с.13
5) Рефлексія
6) д.з.
П.1 переказ, визначення та положення теорії напам'ять
Казахстан, Північно-Казахстанська область, район імені Габіта Мусрепова, село Сокологорівка
КДУ «Сокологорівська середня школа»
Урок у 9 класі
Тема: «Сутність процесу дисоціації»
План уроку
Тема: Сутність процесу електролітичної дисоціації
Цілі уроку: поглибити та узагальнити знання, основні поняття електролітичної дисоціації; навчити застосовувати їх у складанні рівнянь дисоціації; дати уявлення про універсальність теорії електролітичної дисоціації, застосування її для неорганічної хімії.
Основні поняття: електроліти, неелектроліти, дисоціація, гідрати, кристаллогідрати.
Структура уроку
1) Організаційний момент
2) Перевірка домашнього завдання
3) Вивчення нового матеріалу
4) Закріплення нового матеріалу
5) Домашнє завдання, виставлення оцінок
Хід уроку
1) Організаційний момент (3-5 хв.)
2) Перевірка домашнього завдання (10 хв.)
а) Визначте ковалентні полярні та неполярні зв'язки у таких молекулах: N 2 , CO 2 , NH 3 , SO 2 , HBr.
б) Що таке електронегативність?
в) Як утворюється σ-зв'язок і π-зв'язок?
г) У чому причина різкої відмінності у фізичних властивостях СО2 та SiO2?
д) Перерахуйте типи хімічного зв'язку.
3) Вивчення нового матеріалу (15-20 хв.)
Електроліти та неелектроліти.З особливостями розчинення у воді речовин з різними типами хімічних зв'язків можна експериментально познайомитися, досліджуючи електричну провідність розчинів цих речовин за допомогою приладу для перевірки електричної провідності розчинів.
Якщо завантажити електроди приладу, наприклад, у суху кухонну сіль, лампочка не засвітиться. Той самий результат вийде, якщо електроди опустити в дистильовану воду. Однак при зануренні електродів у водний розчин натрію хлориду лампочка починає світитися. Отже, розчин натрію хлориду проводить електричний струм. Подібно до хлориду натрію поводяться й інші розчинні солі, луги та кислоти. Солі і луги проводять електричний струм у водних розчинах, а й у розплавах. Водні розчини, наприклад, цукру, глюкози, спирту, кисню, азоту, електричний струм не проводять. На підставі цих властивостей всі речовини поділяють на е електролітиі неелектроліти.
Механізм розчинення у воді речовин із різним характером хімічного зв'язку.Чому з розглянутих прикладів саме солі, луги та кислоти у водному розчині проводять електричний струм? Щоб відповісти на це питання, необхідно згадати, що властивості речовин визначаються їхньою будовою. Наприклад, будова кристалів хлориду натрію відрізняється від будови молекул кисню, водню.
Для правильного розуміння механізму розчинення у воді речовин з іонним зв'язком слід також врахувати, що в молекулах води між атомами водню та кисню є ковалентні сильнополярні зв'язки. Тому молекули води є полярними. Внаслідок цього, наприклад, при розчиненні хлориду натрію молекули води притягуються своїми негативними полюсами до позитивних полюсів - до негативно заряджених хлорид-іонів. В результаті зв'язок між іонами послаблюється і кристалічні грати руйнуються. Цьому процесу сприяє також більша діелектрична проникність води, яка за 20ºС дорівнює 81. Хімічний зв'язок між іонами у воді послаблюється в 81 раз порівняно з вакуумом.
При розчиненні у воді речовин з ковалентним сильнополярним зв'язком, наприклад хлороводню HCl, відбувається зміна характеру хімічного зв'язку, тобто. під впливом полярних молекул води ковалентний полярний зв'язок перетворюється на іонну і далі процес відщеплення частинок.
При розплавленні електролітів посилюються коливальні рухи частинок, що призводить до послаблення зв'язку між ними. В результаті також руйнується кристалічна решітка. Отже, при розчиненні солей та лугів ці речовини розпадаються на іони.
Процес розпаду електроліту на іони при розчиненні його у воді чи розплавленні називається електролітичною дисоціацією.
Основні теоретичні положення електролітичної дисоціаціїсформульовані 1887 р. шведським ученим Сванте Арреніусом. Однак С. Арреніус не вдалося повністю розкрити складність процесу електролітичної дисоціації. Він не враховував роль молекул розчинника та вважав, що у водному розчині знаходяться вільні іони. Подальший розвиток уявлення про електролітичну дисоціацію отримали у працях російських учених І. А. Каблукова та В. А. Кістяковського. Щоб зрозуміти сутність уявлень цих учених, ознайомимося з явищами, що відбуваються під час розчинення речовин, у воді.
При розчиненні у воді твердого гідроксиду натрію NaOH або концентрованої сірчаної кислоти H2SO4 відбувається сильне розігрівання. Особливо обережно необхідно розчиняти сірчану кислоту, оскільки через підвищення температури частина води може перетворитися на пару і під її тиском може викинути кислоту з судини. Щоб цього уникнути, сірчану кислоту тонким струменем наливають у воду (але не навпаки!) при постійному помішуванні.
Якщо ж, наприклад, розчиняти у воді аміачну селітру (нітрат амонію) у тонкостінному склянці, поставленому на мокру дощечку, то спостерігається настільки сильне охолодження, що склянка до неї навіть примерзает. Чому при розчиненні речовин в одних випадках спостерігається розігрівання, а в інших охолодження?
При розчиненні твердих речовин відбувається руйнування їх кристалічних решіток і розподіл частинок, що утворюються між молекулами розчинника. При цьому необхідна енергія поглинається ззовні та відбувається охолодження.За цією ознакою процес розчинення слід віднести до фізичним явищам.
Чому при розчиненні деяких речовин відбувається розігрівання?
Як відомо, виділення теплоти - це ознака хімічної реакції. Отже, при розчиненні здійснюється і хімічні реакції. Наприклад, молекули сірчаної кислоти реагують з молекулами води та утворюються сполуки складу H 2 SO 4 ·H 2 O (моногідрат сірчаної кислоти) та H 2 SO 4 ·2H 2 O (дигідрат сірчаної кислоти), тобто. молекула сірчаної кислоти приєднує одну чи дві молекули води.
Взаємодія молекул сірчаної кислоти з молекулами води відносять до реакцій гідратації, а речовини, що при цьому утворюються, називають гідратами.
З наведених прикладів видно, що з розчиненні твердих речовин, у воді відбуваються як фізичний, і хімічний процеси. Якщо в результаті гідратації виділяється більше енергії, ніж витрачається на руйнування кристалів речовини, тоді розчинення супроводжується розігріванням, якщо навпаки - охолодженням.
Отже, розчинення – це фізико-хімічний процес.
Таке пояснення сутності процесу розчинення та природи розчинів вперше було теоретично обґрунтовано великим російським ученим Д.І.Менделєєвим. ним була розроблена гідратна теорія розчинів.
При вивченні процесів гідратації у вчених постало питання: з якими частинками реагує вода?
І.А.Каблуков та В.А.Кистяковський незалежно один від одного припустили, що з молекулами води реагують іони електролітів, тобто. відбувається гідратація іонів.Це
4) Закріплення нового матеріалу (5-7 хв.)
а) Коли розпочалися дослідження складу повітря?
б) Які речовини містяться у складі повітря?
в) Який вчений вперше встановив склад повітря французький у 1774р.?
5) Домашнє завдання, виставлення оцінок (3хв.)
§26 переказ стор.70-72; вправи № 3, 4,5 стор.72
Конспект уроку з хімії 9 клас
Тема уроку "Електролітична дисоціація"
Тип уроку:Узагальнення та систематизація знань.
Ціль:закріпити знання учнів на тему «Теорія електролітичної дисоціації»
Завдання:
Освітні:
Закріпити знання учнів про сутність процесу електролітичної дисоціації,
Допомогти освоїти учням основні поняття теми,
Допомогти освоїти поняття про механізми та умови протікання процесу, використовуючи поняття електроліт, неелектроліт;
Навчити писати хімічні реакції у молекулярному та іонному вигляді.
Розвиваючі:
поглибити та розширити знання про властивості речовин на іонному рівні;
формувати науковий світогляд та розвиток прийомів мисленнєвої діяльності;
продовжувати розвиток мовних навичок, спостережливості та вміння робити висновки на основі демонстраційного експерименту;
вміти застосувати опорні конспекти та складати їх самостійно.
Виховують:
сформувати науковий світогляд з питань будови та властивостей речовин;
розкрити ідею розвитку у пізнанні фізико-хімічних процесів у міру накопичення нових фактів та на основі експерименту;
створити умови для виховання з інтересом вчитися, працювати над формуванням у учнів ставлення до хімії як можливої галузі майбутньої практичної діяльності.
Структура уроку:
Організаційний момент (2 хв.);
Повідомлення теми та мети уроку (2 хв.);
формування мотивації (1 хв.);
Актуалізація опорних знань (5 хв);
Узагальнення та систематизація (15 хв.)
Застосування знань та вмінь (18 хв.);
Підбиття підсумків роботи на уроці (1 хв.)
Повідомлення та коментування домашнього завдання (1 хв.)
Хід уроку
На попередніх уроках ми познайомилися з однією з найважливіших теорій, яку спирається хімічна наука, – це теорія електролітичної дисоціації.Учні уважно слухають вчителі
А сьогодні на уроці ми маємо узагальнити та систематизувати знання з цієї теорії та закріпити вміння складати рівняння дисоціації та реакцій іонного обміну. Протягом уроку виконуватимемо різноманітні завдання, для цього у вас на столах лежать робочі аркуші із завданнями та таблиця, в яку ви вноситимете результати. Наприкінці уроку ви зможете самостійно оцінити свої знання з пройденої теми.
Фронтальний
Спочатку давайте згадаємо визначення поняття «електроліти». Що це таке?
А що таке «неелектроліти»?
А тепер дайте визначення поняття «електролітична дисоціація»
Речовини, розчини або розплави котоелектролітами .
Речовини, розчини та розплави яких не проводять електричний струм називають неелектролітами.
Процес розпаду електролітів на іони при розчиненні у воді або розплавленні називають електролітичною дисоціацією.
Індивідуальний
Тепер я попрошу вийти до дошки учня та, користуючись запропонованою схемою, розкрити сутність процесу ЕРС. Дати відповіді на запитання: Що таке дисоціація, асоціація, гідратовані іони, катіони, аніони.
Як заряджені електроди?
Як їх називають? Чому?
Які заряди у іонів?
Речовини, розчини або розплави которих проводять електричний струм, називаються електролітами . У розплавах і розчинах електроліти розпадаються на заряджені частинки -іони . Процес розпаду електролітів на іони називаєтьсяелектролітичною дисоціацією . Це оборотний процес. Об'єднання протилежно заряджених іонів називаєтьсяасоціацією .
Іони в розплавах відрізняються від іонів у розчинах тим, що останні оточені гідратною оболонкою. Іони в розчинах та розплавах рухаються хаотично. Під дією електричного струму вони набувають спрямованого руху. Позитивно заряджені іони рухаються до негативного електрода (катода) і тому називаютьсякатіон ами, негативно заряджені іони рухаються в електричному полі до анода і називаютьсяаніонамі.
Основні засади ТЕД.
Електроліти в розчинах і розплавах розпадаються на іони.
Іони мають іншу будову, ніж атоми.
У розплаві та розчині іони рухаються хаотично, але при пропусканні електричного струму іони починають рухатися спрямовано: катіони – до катода, аніони – до анода.
додаток
Індивідуальний
Користуючись схемою, розкажіть про будову молекули води.
У молекулі води зв'язку Про – Н полярні, електронна щільність цих зв'язків зміщена до атома кисню як до більш негативного. Внаслідок цього атомі кисню виникає частковий негативний, але в атомах водню - частковий позитивний заряд. Так як кут Н-О-Н становить 105 °, то атом кисню і атоми водню виявляються на різних кінцях молекули, в якій виникають як би два полюси. Такі молекули називають диполями.
Індивідуальний
Користуючись схемою, запропонуйте механізм дисоціації електролітів
При зануренні у воду іонного кристала диполі води орієнтуються стосовно його іонів протилежно зарядженими кінцями (полюсами). В результаті електростатичної взаємодії між іонами речовини, що розчиняється, і молекулами води відбувається руйнування іонного кристала і утворенняу розчинах гідратованих іонів (процес дисоціації). При розчиненні у воді речовин із ковалентним полярним зв'язком процесу дисоціації передує поляризація зв'язку. Диполі води, орієнтуючись відповідним чином, поляризують цей зв'язок, перетворюючиїї в іонну, далі слідує дисоціація речовини з утворенням гідратованих іонів.
Такі уявлення про дисоціацію у водних розчинах сполук із різним типом хімічного зв'язку (ХС) сформувалися не відразу.
Фронтальний
Як відомо, існує кілька теорій розчинів. Розкажіть коротко про ці теорії та назвіть їх автора.
Чому розведення розчину призводить до посилення дисоціації?
С. Арреніус та інші прихильники фізичної теорії, виявляючи в розчинах іони, що утворилися під дією розчинника, не враховували їх гідратації.
Д.І. Менделєєв - автор хімічної теорії розчинів, виділив гідрати сірчаної кислоти при повільномувипаровуванні її розчинів і висловив думку про те, що в розчинах утворюються неміцні хімічні сполуки розчиненої речовини та розчинника (загалом сольвати).
Згодом І.А. Каблуков та інші вчені, об'єднавши обидві теорії, показали, що розчинення – фізико-хімічний процес; в результаті його утворюються гідратовані іони.
При розчиненні збільшується кількість молекул води, що переводять атоми в гідратовані іони; також дисоціація речовин посилюється при підвищенні температури, внаслідок збільшення швидкості руху молекул
Самостійна робота
А тепер ви самостійно у своїх зошитах спробуйте скласти опорну схему «Сильні та слабкі електроліти». Вкажіть по 3 приклади у кожній групі.
У своєму конспекті дайте визначення поняття Ступінь дисоціаціїта формулу для її визначення
Учні самостійно протягом 10-15 хвилин готують схему.
Кількісно процес дисоціації речовини у розчині можна оцінити за ступенем дисоціації α. Її розраховують як відношення числа молекул електроліту, що розпалися на іони, до загального числа молекул розчиненої речовини і виражають у відсотках.
Ступінь дисоціації залежить від природи хімічного зв'язку в кристалах або молекулах розчиненої речовини та розчинника. Чим полярніший цей зв'язок, тим вище значення α. При розведенні розчинів збільшується (див. графік, де з - концентрація розчину).
Залежно від величини ступеня дисоціації, всі електроліти класифікують на сильні (α > 30 %), середньої сили (α від 2 до 30 %), слабкі (α< 1 %). Приведены их примеры.
Як ви гадаєте, чи вдалося нам досягти поставленої мети?
Який матеріал викликав у вас скруту?
Виставлення оцінок за роботу на уроці
Напишіть рівняння дисоціації речовин: Al 2 (SO 4) 3 , K 2 CO 3 FeCl 3 .
Програми
Схема 1
Схема 2

Схема 3

Схема 4

Схема 5


Схема 6

Конспект
уроку з хімії у 8 класі
школи №16 м. Саранська
студентки 4 курсу хімічного відділення
Інституту фізики та хімії
МДУ ім. Н. П. Огарьова
Тема урока : Електролітична дисоціація.
Цілі уроку:
Освітня:сформувати основні поняття про електроліти та неелектроліти, про написання рівнянь дисоціації, розглянути механізм дисоціації речовин з різним типом зв'язку.
Виховна: Формування навичок колективної роботи у поєднанні з індивідуальною, підвищення творчої активності учнів, пізнавального інтересу до хімії, почуття відповідальності перед своїми товаришами.
Розвиваюча: Розвиток у учнів пізнавальних здібностей, формування самостійності мислення, вміння логічно міркувати, узагальнювати та робити висновки з отриманих знань.
Тип уроку: комбінований.
Методи уроку:
Загальні: пояснювально-ілюстративний;
Приватні: словесно – наочно – практичний.
Обладнання та реактиви:дистильована вода, KCl (р-р і тб.), розчин сахарози, луг, HCl, CuSO 4 , прилад дослідження електропровідності розчинів даних речовин, хімічний стакан.
План уроку:
Організаційний момент 1 хв.
Перевірка домашнього завдання 10 хв.
Вивчення нового матеріалу 30 хв
Узагальнення 3 хв
Підбиття підсумків 1хв
(Виставлення оцінок, домашнє завдання)
Здрастуйте, хлопці!
Я рада вітати вас на уроці.
Милі мої друзі!
Вітаю я всіх від себе.
Кожен з вас по-своєму добрий:
Для людей, для справи всім пригож.
А тепер, хлопці, не сумуйте
І завдання розв'яжіть
Ну ж, сміливо налітай
І завдання отримуй.
Картка: «Зайвий розчин»
Назвіть «зайвий» (випадає з ряду) розчин із п'яти запропонованих. Чому ви вважаєте, що саме він зайвий? Що спільного у чотирьох інших розчинів?
сплав міді з цинком (латунь)
розчин йоду у спирті (йодна настойка)
сплав міді з оловом (бронза)
сплав міді з нікелем (мельхіор)
сплав алюмінію з міддю (дюралюміній)
Картка «Відсутній розчин»
Який із наведених нижче розчинів (а - в) ви помістили б замість знака питання до пункту 5? Поясніть, чому ви вибрали цей розчин? Чому інші розчини не підходять?
розчин кисню у воді
розчин сірчаної кислоти у воді
розчин цукру у воді
розчин азотної кислоти у воді
а) вуглекислий газ у повітрі; б) розчин хлориду натрію у воді,
в) сплав золота та срібла.
У цей час фронтально ставляться питання:
Давайте згадаємо про роль розчинів у природі та практичній діяльності людей.
Поясніть сутність фізичної та хімічної теорії розчинів. Чому їх потрібно об'єднати?
То що таке розчин?
Наведіть докази хімічної взаємодії розчиненої речовини із водою?
Що таке: гідратація, гідрати, кристалогідрати?
Що таке розчинність речовин у воді?
Як кількісно визначаються поняття «добре розчинна у воді речовина», «мало розчинна», «практично нерозчинна»?
Давайте пограємо у гру «передай іншому»:
На дошці записано питання: Дана речовина відноситься до мало розчинної, добре розчинної або практично нерозчинної? (Робота з таблицею розчинності)
Клас поділяється на шість груп (по рядах). Кожна група отримує альбомний лист, поділений на чотири графи (прізвище учня та відповіді на запитання) та стільки рядків, скільки гравців у команді.
Завдання полягає в тому, щоб придумати з'єднання не таке, як у сусідів, і виконати завдання.
Якщо учень відразу може відповісти на запитання, то він пише відповідь і швидко передає листок члену команди, що сидить ззаду. І та команда, чий лист першим дійде до вчителя, отримує додаткові бали.
Давайте я вам зачитаю вірш:
Жив один іонний кристал,
Для іонів будинок величезний,
Був гарний і рівний.
Але трапилося з ним лихо.
Крапля на нього впала,
І кристала вмить не стало:
На іони розпластала
Його спритна вода.
Все сімейство здивувалося:
Що зовні трапилося?
А для того, щоб відповісти на це запитання, вам допоможе сьогоднішня тема «Електролітична дисоціація». (Дискета №1: назва теми.) І метою нашого уроку є ознайомлення з новими поняттями цієї теми.
Отже, вам відомо, що існують речовини, які добре проводять електричний струм – це (провідники).
Провідники поділяються на провідники першого роду – метали та на провідники другого роду – електроліти.
Згадайте, що таке електричний струм?(Це спрямований рух заряджених частинок.)
Т.к. ми будемо працювати з електричним апаратом, то необхідно дотримуватись правил техніки безпеки. Які правила ви знаєте? (не чіпати оголені дроти, електроди руками, особливо мокрими; при загорянні приладу відключити загальний рубильник, не залишати включеним у мережу; гасити піском)
Проведемо досвід вивчення електропровідності розчинів деяких речовин.
Прилад складається зі склянки, в яку наливають розчин досліджуваної речовини. На склянку ставлять пластинку з ебоніту з вмонтованими в неї двома вугільними електродами, до клем яких приєднані дроти. Один із них з'єднаний з лампочкою. Вихідний контакт від лампочки та дріт від іншої клеми йдуть до джерела струму.
Електроди опускаємо у склянку із твердою кристалічною сіллю CuSO 4 (лампочка не загоряється), потім у розчин CuSO 4 (лампочка загоряється), потім у розчини HCl, сахарози, луги та дистильовану воду.
Під час проведення досвіду хлопці заповнюють таблицю:
CuSO 4 |
і т.д.
Скажіть, чому розчин кухонної солі проводить електричний струм, а розчин сахарози не проводить?(це пов'язано з утворенням іонів). А що таке іон? (це найдрібніші заряджені частинки речовини, які зумовлюють хімічні та фізичні властивості цієї речовини).
Таким чином за здатністю проводити електричний струм речовини поділяються на електроліти та неелектроліти.(дискета №1: визначення понять: електроліти та неелектроліти)
З проведеного досвіду видно, що до електролітів відносять розчини солей, кислот, основ, а до неелектролітів - органічні сполуки, тверді речовини, гази.
Скажіть, а чим відрізняються електроліти від неелектролітів?(Типом зв'язку.). Тобто. до електролітів відносяться речовини з іонним та ковалентно-полярним зв'язком.
Здатність електролітів проводити електричний струм принципово відрізняється від здатності проводити електричний струм металів. Чому? (Т. К. Електропровідність металів обумовлена рухом електронів, а електропровідність у електролітів пов'язана з рухом іонів.)
Давайте вивчимо поведінку речовин у водному розчині з прикладу хлориду натрію.
Досвід: електроди опускаємо в склянку з розчином натрію хлориду (лампочка загоряється).
З результату досвіду зробимо висновок, що під впливом води речовини зазнають змін. Вода змушує електроліти розпадатися на іони. Цей процес називається дисоціацією.
Цей процес вивчав шведський вчений Сванте Арреніус. Давайте послухаємо повідомлення вашої однокласниці про його заслуги в хімії (диск №2: портрет Сванте Арреніуса)
Будучи прихильником фізичної теорії розчинів, шведський вчений Сванте Арреніус, не зміг відповісти на запитання: чому саме у водному розчині відбувається дисоціація солей та лугів? Відповідь на нього дали російські хіміки Каблуков, Кістяківський. Суть їх доповнень у наступному (під запис): причиною дисоціації електроліту у розчині є його гідратація, тобто. взаємодія із молекулами води. І іони, що утворюються при дисоціації, будуть гідратованими, тобто. пов'язаними з молекулами води, та їх властивості відрізнятимуться від негідратованих.
Що ж собою являє молекула води? Загалом молекула води не заряджена. Але всередині молекули води атоми кисню та водню розташовуються так, що позитивні та негативні заряди знаходяться у протилежних кінцях молекули. Тому молекула води є диполь:
Розглянемо механізм дисоціації натрію хлориду при розчиненні. Який тип зв'язку у цієї сполуки? (іонний).диск №2: диссоціація речовин з іонною структурою).
Зазначу, що найлегше дисоціюють електроліти, що мають іонну структуру.
Дисоціація речовин з іонним зв'язком протікає у три стадії:
Спочатку хаотично рухомі молекули води в іонів кристала орієнтуються до них протилежно зарядженими полюсами - відбувається орієнтація.
потім диполі води притягуються, взаємодіють із іонами поверхневого шару кристала відбувається гідратація.
молекула води, переміщаючись у розчин, захоплюють із собою гідратовані іони. Відбувається дисоціація.
А як реагують із молекулами води полярні молекули електроліту?
Аналогічно, але на одну стадію більше (диск №2: дисоціація речовин із ковалентно-полярним зв'язком):
орієнтація
гідратація
іонізація, тобто. перетворення ковалентно-полярного зв'язку на іонну.
дисоціація
Таким чином, електролітична дисоціація – процес розпаду електроліту на іони при розчиненні.
Слід враховувати, що в розчинах електролітів іони, що хаотично рухаються, можуть зіткнутися і з'єднатися в молекулу. Це процес асоціації.
Зверніть увагу на знак, що стоїть у рівнянні дисоціації.диск №1: написання рівняння дисоціації). Оскільки число молекул води, яке приєднують іони, невідоме, процес дисоціації електролітів зображують спрощено: NaCl = Na+ +Cl -
Наприклад, запишіть скорочене рівняння дисоціації деяких речовин з іонною будовою: Ca(OH) 2 , Na 2 SO 4 , Na 3 PO 4 Al 2 (SO 4 ).
На сьогоднішньому уроці ви дізналися, що таке електролітична дисоціація, механізм дисоціації.
Виходячи зі всього сказаного, скажіть, які процеси зашифровані у вірші:
Жив один іонний кристал,
Для іонів будинок величезний,
Був гарний і рівний.
Але трапилося з ним лихо.
Крапля на нього впала,
І кристала вмить не стало:
На іони розпластала
Його спритна вода.
Все сімейство здивувалося:
Що зовні трапилося?
Це поряд з'явилася раптом молекул низка,
Підбігли галасливим роєм,
Оточили щільним строєм:
«Запропонувати хочемо героям
нашу дружбу назавжди ... »
Воднем до аніонів,
Гідроксидом до катіонів,
Не втекти від них іонам
Ні туди, ні сюди.
(Розчинення речовини з іонним зв'язком, орієнтація молекул води, гідратація, дисоціація)
Домашнє завдання:§ 35, №2,5,6 стор.147.
2





7

Аніони Катіони Анод Катод - +

Розчин Кристал NaCl Na + + Cl Н2ОН2О Н2ОН2О Рис.4.

10 Розчин НCl Н + + Cl - Н2ОН2О Н2ОН2О Рис HCl Cl - H+H+ + - Н+Н Сl-Сl-




14 Перевірочний тест. Варіант 1. Варіант 2. 1. До неелектролітів відносяться: 1) карбонат натрію 2) етиловий спирт 3) хлороводнева кислота 4) нітрат цинку 1. До неелектролітів відносяться: 1) хлорид барію 2) цукор 3) сірчана кислота 4) карбонат калію 2 .З утворенням катіонів металу та аніонів кислотного залишку дисоціює: 1). гідроксид міді (ІІ) 2). гідроксид натрію 3). хлорид алюмінію 4). вугільна кислота 2. З утворенням катіонів металу та аніонів кислотного залишку дисоціює: 1) сахароза 2) гідроксид натрію 3) бромід алюмінію 4) азотна кислота 3. Електролітами є обидві речовини у групі: 1). CH4, CO2 2). C2H5OH, HNO3 3). СаO, BaSO4 4). NaCl, KOH 3. Електролітами є обидві речовини у групі: 1). гліцерин, SO2 2). CuCl2, KOH 3). BaO, K2SO4 4). Fe(OH)3, H2SiO3 4. Найбільше іонів водню утворюється при дисоціації дорівнює: 1). HI 2). H2CO3 3). H2S 4). H2SiO3 4. Найбільше іонів водню утворюється при дисоціації дорівнює: 1). H3PO4 2). H2SO4 3). HNO3 4). HF 5. Сума коефіцієнтів у рівнянні дисоціації сульфату алюмінію дорівнює: 1). 4 2). 6 3). 2 4) Сума коефіцієнтів у рівнянні дисоціації карбонату натрію дорівнює: 1). 4 2). 3 3). 2 4). 1