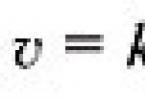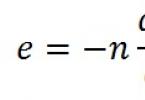Viteza de reacție chimică
și dependența acesteia de diverși factori
Lecție de utilizare a tehnologiei informației
Este imposibil să înveți chimia în orice caz,
fără a vedea practica în sine și fără a-și asuma operații chimice.
M.V. Lomonosov
Restructurarea învățământului superior și secundar de specialitate din țară și reforma școlii prevăd îmbunătățirea în continuare a formelor, metodelor și mijloacelor de predare, utilizarea unei varietăți de tehnologii, inclusiv învățarea centrată pe persoană (PLL), căutarea problemelor și tehnologiile informatice. .
Și noi, profesorii, ne schimbăm. În munca mea încerc să folosesc constant noile dezvoltări și tehnologii educaționale moderne.
Recent, pe discurile computerelor au apărut o mulțime de materiale. Ele pot fi utilizate în elaborarea de eseuri, scrierea lucrărilor la termen și în munca independentă a studenților. Tehnologiile informaționale îmi permit să organizez rapid formarea și testarea cunoștințelor, să creez programe adaptative și să le aplic în predarea chimiei.
Tehnologia calculatoarelor și utilizarea tehnologiilor informatice astăzi acționează nu numai ca un mijloc de automatizare a tuturor proceselor de învățare, ci și ca un instrument pentru creșterea dramatică a eficienței activității intelectuale a elevilor.
Folosesc tehnologia informatică în lecțiile mele în diferite scopuri:
Rezolvarea problemelor, calcule cantitative, prelucrarea datelor (conform algoritmului propus);
Efectuarea autocontrolului și controlului standardizat al cunoștințelor asupra conținutului informațiilor educaționale (teste, sarcini diferențiate de control, hărți și alte chestionare);
Automatizarea unui experiment chimic, conectarea cu echipamente optice (proiectarea experimentelor pe un ecran);
Obținerea datelor de referință necesare, pregătirea de teste, lucrări diferențiate, analizarea greșelilor tipice ale elevilor (sisteme automate de control și bănci de informații);
Munca independentă a studenților pentru a elabora rezumate și lucrări semestriale, a lucra cu materialul, a efectua lucrări de testare (odată ce ați primit rezultatul, exercitați autocontrolul).
Lecția propusă din secțiunea „Cinetică chimică” corespunde programului manualului „Chimie-10” de către autorii L.S. Guzey și R.P. Surovtseva. Studiul acestei teme este precedat de studiul termodinamicii reacțiilor. Materialul propus nu corespunde conținutului minim necesar, ci în primul rând nivelului de profil al pregătirii.
Lecția folosește munca în grup, o abordare diferențiată, tehnologii de dezvoltare și de căutare a problemelor și, cel mai important, tehnologia computerizată pentru a efectua un experiment demonstrativ, care vă permite să înțelegeți clar care este viteza unei reacții chimice și cum depinde aceasta de diverși factori. .
Obiectivele lecției. Actualizarea și aprofundarea cunoștințelor despre viteza reacțiilor chimice; folosind munca de grup, luați în considerare și studiați diverși factori: natura substanțelor care reacţionează, suprafața de contact a substanțelor, temperatura, catalizatorul; folosind o unitate de măsurare computerizată, demonstrați clar care este viteza unei reacții chimice și cum depinde aceasta de concentrația substanțelor care reacţionează.
Motto-ul lecției.„Există doar ceea ce poate fi măsurat” (M. Planck).
Design de clasă. Profesorul informează în prealabil tema lecției viitoare, împarte clasa în patru grupe creative de 5-6 persoane, aproximativ egale ca abilități. În lecția anterioară, elevii primesc teme - să întocmească rapoarte privind aplicarea practică a ecuației Arrhenius și tipurile de cataliză.
Echipamente și reactivi. Pe pupitrele elevilor - manuale, caiete, mese, foi de laborator, rafturi cu eprubete;
Grupa 1: granule de zinc, bandă de magneziu, soluție de acid clorhidric;
grupa 2: bagheta de sticla; pilitură de fier, cui de fier, soluție de clorură de cupru(II);
grupa 3: pipeta, suport pentru eprubete, lampa cu alcool, chibrituri; oxid de cupru (II), soluție de acid sulfuric;
grupa 4(realizează un experiment demonstrativ pe o masă demonstrativă): un computer cu o unitate de măsură, un senzor de densitate optică la o lungime de undă de 525 nm, o cuvă, un agitator magnetic, o seringă de 10 ml, un cilindru gradat de 100 ml; soluții de iodură de potasiu KI 1M, persulfat de potasiu K 2 S 2 O 8 0,1 M, apă distilată.
Elevii fac toate notele în timpul lecției în caietele lor.
ÎN CURILE CURĂRILOR
Motivația pentru importanța temei alese
Profesorul începe să explice materialul cu exemple de reacții chimice care au loc la viteze diferite. Elevii pot da exemple de reacții.
Reacțiile chimice apar cu viteze diferite. Unele progresează lent, de-a lungul lunilor, precum coroziunea fierului sau fermentarea sucului de struguri, care are ca rezultat vin. Altele sunt finalizate în câteva săptămâni, precum fermentația alcoolică a glucozei. Încă altele se termină foarte repede, cum ar fi precipitarea sărurilor insolubile, iar unele apar instantaneu, cum ar fi exploziile.
Aproape instantaneu, foarte rapid, multe reacții apar în soluții apoase:
Să amestecăm soluții apoase de Na 2 CO 3 și CaCl 2, produsul de reacție CaCO 3 este insolubil în apă și se formează imediat;
Dacă adăugăm acid în exces la o soluție alcalină de fenolftaleină, soluția se decolorează instantaneu. Aceasta înseamnă că reacția de neutralizare, reacția de transformare a formei colorate a indicatorului într-una incoloră, decurge foarte repede.
Rugina se formează încet pe obiectele de fier. Produsele de coroziune maro-negru sau verzui (patină) se formează încet pe obiectele din cupru și bronz. Viteza tuturor acestor procese este diferită.
Actualizarea vizualizărilor
despre viteza reacțiilor chimice
Reacțiile chimice sunt unul dintre cele mai importante concepte din chimie. Pentru a le înțelege și a le utiliza cu competență în procesul educațional, profesorul trebuie să cunoască și să fie capabil să explice principalele caracteristici ale oricărei reacții chimice: efect termic, echilibru, viteză. Termodinamica chimică face posibilă prezicerea în ce direcție poate avea loc spontan o anumită reacție chimică, dar termodinamica chimică singură nu răspunde la întrebarea cum și cu ce viteză va avea loc reacția. Conceptul de viteză a unei reacții chimice este unul dintre cele de bază în cinetica chimică.
Pentru a studia materiale noi, elevii folosesc cunoștințele necesare despre viteza unei reacții chimice; trec prin etapa de actualizare a cunoștințelor. Dar acest concept este aprofundat de conceptele de viteză a reacțiilor omogene și eterogene, energie de activare, este introdusă ecuația Arrhenius - aceasta este zona de dezvoltare proximă a elevilor (vezi Anexa nr. 1 „Structura activității de căutare a problemelor a profesorilor iar elevii...”).
Ce intelegi prin viteza de reactie? Cum poate fi măsurat și modificat? Știința care studiază tiparele reacțiilor în timp - cinetica chimică - va ajuta să răspundă la aceste întrebări.
Să ne amintim conceptele și modelele de bază folosite în cinetică (răspunsul elevilor și suplimentele profesorului).
Cinetica chimică este o ramură a chimiei a cărei sarcină este de a explica modificările calitative și cantitative ale proceselor chimice care au loc în timp. De obicei, această sarcină generală este împărțită în două, mai specifice:
1) identificarea mecanismului de reacție - stabilirea etapelor elementare ale procesului și a succesiunii apariției acestora (modificări calitative);
2) descrierea cantitativă a unei reacții chimice - stabilirea unor relații stricte care fac posibilă calcularea modificărilor cantităților de reactivi și produse inițiale pe măsură ce reacția se desfășoară.
Conceptul principal în cinetica chimică este conceptul de viteză de reacție. Viteza de reacție chimică este determinată de cantitatea de substanță reacționată pe unitatea de timp într-o unitate de spațiu de reacție.
Dacă concentrația unuia dintre reactanți scade de la Cu 1 la Cu 2 pentru perioada de la t 1 la t 2, apoi în conformitate cu definiția vitezei de reacție este egal cu (Fig. 1):
Semnul „–” din partea dreaptă a ecuației înseamnă următoarele. Pe măsură ce reacția progresează ( t 2 – t 1) > 0 concentrația de reactivi scade, prin urmare, ( c 2 – c 1) < 0, а т.к. скорость реакции всегда положительна, то перед дробью следует поставить знак «–».
Orez. 1.
|
Cantitativ, relația dintre viteza de reacție și concentrațiile molare ale reactanților este descrisă de legea de bază a cineticii chimice - legea acțiunii masei.
Viteza unei reacții chimice la o temperatură constantă este proporțională cu produsul concentrațiilor reactanților.
Pentru reacție
A A+ b B = Cu C + d D,
în conformitate cu legea acțiunii masei, dependența vitezei de concentrațiile substanțelor care reacţionează poate fi prezentată astfel:
![]()
Unde k– constantă de viteză; n A, n B – ordinele de reacție pentru reactivii A și respectiv B;
n A+ n B este ordinea generală de reacție.
În reacțiile omogene, substanțele care reacționează sunt în aceeași fază gazoasă sau în soluție, amestecate uniform între ele, reacția are loc pe întregul volum al amestecului. Concentrația reactivului este egală cu câtul cantității de substanță împărțit la volumul amestecului: Cu = /V.
Viteza medie de reacție:
![]()
Cu cât perioada de timp este mai scurtă, cu atât viteza de reacție va fi mai precisă.
La interfața de fază apar reacții eterogene: gaz - solid, gaz - lichid, lichid - solid, solid - solid. Reacția rapidă
![]()
măsurată pe unitatea de suprafață de contact a substanțelor care reacţionează S.
Luând în considerare efectele termice ale reacțiilor chimice, transformarea moleculelor reactante (A + B) în molecule de produs (C + D) este explicată din punct de vedere termodinamic ca „urcarea unui munte de energie” în cazul reacțiilor endoterme (Fig. .2, A) sau „în jos” pentru reacții exoterme (Fig. 2, b).
Pentru ca moleculele de reactanți să reacționeze, ele trebuie mai întâi să se aprovizioneze cu energie suplimentară pentru a depăși bariera energetică în drumul către produșii de reacție. Este semnificativ că o astfel de barieră există și în cazul reacțiilor exoterme, astfel încât, în loc să „alunece în jos deal”, moleculele trebuie mai întâi să „urce dealul”.
Orez. 2.
|
Forța motrice a reacției este dorința de a obține un minim de energie.

Pentru ca o reacție să aibă loc, particulele substanțelor care reacţionează trebuie să se ciocnească între ele. Pe măsură ce temperatura crește, numărul acestor ciocniri crește din cauza creșterii energiei cinetice a moleculelor, prin urmare viteza de reacție crește. Dar nu orice ciocnire a moleculelor de substanțe care reacţionează duce la interacțiunea lor: pentru ca moleculele să interacționeze, legăturile dintre atomii din ele trebuie să devină mai slabe sau să se rupă, pentru care trebuie cheltuită o anumită cantitate de energie. Dacă moleculele care se ciocnesc nu au această energie, ciocnirea lor nu duce la o reacție. Excesul de energie pe care trebuie să îl aibă moleculele pentru ca ciocnirea lor să ducă la formarea moleculelor unei noi substanțe se numește energie activatoare această reacție E a, măsurată de obicei în J/mol, kJ/mol. Moleculele cu această energie sunt numite molecule active.
În fig. 3 arată profilurile energetice:
a) reacție endotermă, + H = –Q,
N 2 + O 2 2NO – Q;
b) reacție exotermă, - H = +Q,
H2+I22HI+ Q.
În timpul reacției, legăturile chimice din moleculele active se slăbesc și apar noi legături între particulele de substanțe care reacţionează, se formează o stare de tranziție - un complex activat, când vechile legături nu sunt complet distruse, dar altele noi au început deja să fie construite. Energia de activare este energia necesară pentru formarea unui complex activat. Bariera energetică variază; cu cât este mai mică, cu atât reacția are loc mai ușor și mai rapid.
Punctul situat în vârful barierei energetice se numește stare de tranziție. Din acest punct, sistemul poate trece liber în produsul de reacție sau poate reveni la starea inițială (Fig. 4).
Energia de activare este factorul prin care natura reactanților influențează viteza unei reacții. Pentru unele reacții este mic, pentru altele este mare. Dacă energia de activare este mică (< 40 кДж/моль), то большая часть столкновений между молекулами реагирующих веществ приводит к реакции. Скорость таких реакций велика. Если энергия активации велика (>40 kJ/mol), atunci în acest caz doar o mică parte din ciocnirile moleculelor sau a altor particule duce la o reacție. Viteza unei astfel de reacții este scăzută.
Viteza de reacție la un moment dat poate fi calculată dacă cunoașteți numărul de ciocniri active ale particulelor care reacţionează pe unitatea de timp. Prin urmare, dependența vitezei de reacție de temperatură poate fi scrisă astfel:
0 exp(– E A/ RT),
unde 0 este viteza de reacție, cu condiția ca fiecare coliziune să conducă la interacțiune ( E a = 0). Această expresie pentru viteza de reacție este - Ecuația lui Arrhenius- o ecuaţie importantă în cinetica chimică (pentru aplicarea ei practică, vezi Anexa nr. 2, elevii întocmesc rapoarte).
De ce au loc reacțiile chimice cu viteze diferite? Aceasta este întrebarea principală cu care se confruntă profesorul și copiii la lecție. Elevii îi răspund teoretic prin desfășurarea de experimente de laborator în grup și prin rezolvarea de probleme.
Lucru de grup
Activitatea grupurilor include următoarele activități:
Studiul experimental al factorilor care afectează viteza reacțiilor chimice;
Observarea si analiza rezultatelor experimentale obtinute;
Completarea fișelor de laborator care reflectă progresul și concluziile.
O condiție prealabilă pentru lucrul cu succes în grup și pentru implementarea sarcinilor atribuite este de a oferi locului de muncă al fiecărui student echipamentul și mijloacele vizuale necesare. În timpul lucrului, profesorul abordează toate grupurile și, dacă este necesar, oferă asistență consultativă. Mai jos este conținutul sarcinilor pentru fiecare grup.
Experimentul de laborator nr. 1.
Dependența vitezei unei reacții chimice
din natura reactanţilor
Ţintă. Consolidați conceptul de „viteză a unei reacții chimice” și identificați dependența acestuia de natura substanțelor care reacţionează.
Echipamente și reactivi. Raft cu eprubete; granule de zinc, bandă de magneziu, soluție de acid clorhidric.
Experiență demonstrativă.
Viteza de reacție și dependența acesteia
asupra concentraţiei substanţelor iniţiale
Ţintă. Demonstrați vizual care este viteza unei reacții chimice și cum depinde aceasta de concentrația substanțelor inițiale.
Echipamente și reactivi. Calculator cu unitate de masura, senzor de densitate optica la lungimea de unda = 525 nm, cuva, agitator magnetic, seringa de 5 ml, cilindru gradat de 100 ml; soluții – 1M KI, 0,1M K 2 S 2 O 8, apă distilată.
Esența chimică a procesului. Se studiază reacția de oxidare a ionului de iodură cu persulfatul:
2I – + S 2 O 8 2– = I 2 + 2SO 4 2– .
Reacția se efectuează în exces de iodură de potasiu. Iodul eliberat face soluția maro. Concentrația de iod este determinată de intensitatea culorii soluției folosind un senzor de densitate optică la 525 nm.
Pregătirea pentru muncă. Un senzor de densitate optică reglat la o lungime de undă de 525 nm este conectat la primul canal al unității de măsură. Porniți senzorul în modul dependent de timp, turnați 10 ml de soluție 1M KI și 90 ml de apă distilată în cuvă. Configurați senzorul.
Performanţă.Începeți procesul de amestecare. Luați 5 ml de soluție de K 2 S 2 O 8 într-o seringă, turnați-o rapid în cuvă, pornind simultan procesul de măsurare prin apăsarea butonului de ecran „Start”. Măsurarea este oprită când densitatea optică atinge 0,5.
Repetați experimentul folosind 20 ml de soluție de KI și 80 ml de apă.
Comentarii. Viteza unei reacții este modificarea concentrației de reactanți sau produși de reacție pe unitatea de timp. Viteza de reacție depinde de concentrația reactivilor de pornire la un moment dat.
Concepte deduse. Viteza de reacție, dependența sa de concentrație.
Concluzii. Pe măsură ce reactanții sunt consumați în timpul reacției, viteza scade.
Pe măsură ce concentrația reactivului de pornire crește, viteza de reacție crește. Mai mult, în acest caz, când concentrația a fost dublată, s-a dublat și viteza de reacție.
Experimentul de laborator nr. 2.
Efectul temperaturii asupra vitezei
Ţintă. Consolidați conceptul de „viteză a unei reacții chimice” și explorați efectul temperaturii asupra vitezei unei reacții chimice.
Echipamente și reactivi. Raft cu eprubete, pipetă, lampă cu alcool, suport pentru eprubete; oxid de cupru (II), soluție de acid sulfuric (1:3).
Experimentul de laborator nr. 3.
Dependența vitezei unei reacții chimice
din zona suprafeței de contact
reactanţi
Ţintă. Consolidați conceptul de „viteză a unei reacții chimice” și identificați dependența acestuia de dimensiunea suprafeței de contact a substanțelor care reacţionează.
Echipamente și reactivi. Raft cu eprubete, bagheta de sticla; pilitură de fier, cui de fier, soluție de clorură de cupru (II).
Prezentarea rezultatelor muncii de grup, discuția acestora
Ordinea în care sunt prezentate rezultatele este determinată de numerele grupelor (la rândul lor). Elevii vorbesc la tablă folosind tabele completate pe baza rezultatelor experimentelor lor de laborator. Se organizează o scurtă discuție asupra rezultatelor muncii grupurilor și se formulează concluziile. Profesorul subliniază un alt factor care afectează viteza unei reacții chimice - prezența unui catalizator.
Catalizatori- acestea sunt substanțe care accelerează o reacție chimică, inhibitori- Acestea sunt substanțe care încetinesc o reacție chimică. Catalizatorii și inhibitorii înșiși nu sunt consumați în reacție și nu sunt incluși în produșii de reacție.
Cataliză este procesul de modificare a vitezei unei reacții sub influența unui catalizator. Acțiunea catalizatorului este selectivă. Reacțiile care apar cu participarea unui catalizator sunt numite reacții catalitice.
Mecanismul de cataliză omogenă
Adesea reacțiile sunt lente, deoarece... energia lor de activare E a este mare (fig. 5):
A + B A B AB.
Catalizatorul (K) accelerează reacția:

Energiile de activare E„a și E"" și sunt mici, așa că reacțiile au loc rapid.
Cu participarea unui catalizator, are loc o scădere Eși, se formează un câștig de energie și reacția decurge mai rapid.
V i d y c a t a l i s a
1. Cataliza omogenă– materii prime și catalizator – sistem monofazat.
De exemplu, fluctuațiile naturale ale grosimii stratului de ozon al Pământului sunt asociate cu modificări ale activității solare. În straturile superioare ale atmosferei are loc distrugerea stratului de ozon, catalizată de oxizii de azot:

2. Cataliza eterogenă– materiile prime şi catalizatorul formează un sistem multifazic.

Mecanismul catalizei eterogene include cinci etape:
Difuzie - moleculele care reacţionează difuzează la suprafaţa catalizatorului;
Adsorbție - reactanții se acumulează pe suprafața catalizatorului;
Reacție chimică - suprafața catalizatorului este eterogenă, există centri activi pe ea, slăbesc legăturile dintre atomi din moleculele adsorbite, moleculele care reacţionează sunt deformate, uneori se descompun în atomi, ceea ce facilitează apariția unei reacții chimice;
Desorbție - moleculele de produs sunt mai întâi reținute de suprafața catalizatorului și apoi eliberate;
Difuzie - moleculele de produs difuzează de la suprafața catalizatorului.
Figurat vorbind, mecanismul de acțiune al catalizatorului poate fi comparat cu turiștii care traversează un pas de munte. Turiștii nefamiliarizați cu zona vor alege traseul cel mai evident, dar cel mai dificil, necesitând o urcare și coborâre lungă peste vârful muntelui. Un ghid experimentat (catalizator) își va conduce grupul de-a lungul potecii, trecând de vârf. Deși această potecă este întortocheată, este mai puțin dificilă; este mai ușor să ajungeți la punctul final de-a lungul ei, după care ghidul se întoarce la punctul de plecare.
Un grup special este format din catalizatori care acționează în organismele vii. Astfel de catalizatori se numesc enzime sau enzime.
Enzime (enzime)- acestea sunt molecule de proteine care accelerează procesele chimice în sistemele biologice (există aproximativ 30 de mii de enzime diferite în organism, fiecare dintre ele accelerează reacția corespunzătoare).
Experiență demonstrativă.
Descompunerea catalitică a peroxidului de hidrogen
(dirijat de profesor)
2H2O22H2O + O2.
5 ml dintr-o soluție farmaceutică de peroxid de hidrogen se toarnă în trei eprubete. Prima eprubetă este una de control; pentru comparație, o bucată de carne crudă este aruncată în a doua eprubetă cu o pensetă, iar o bucată de morcov crud este plasată în a treia eprubetă. „Fierberea” se observă în două eprubete, cu excepția primei. În a doua și a treia eprubetă se introduc așchii care mocnesc, care se aprind deoarece se eliberează oxigen. Profesorul explică că descompunerea peroxidului de hidrogen are loc fără catalizator, dar mult mai lent. Reacția poate dura câteva luni. Reacțiile rapide din alte eprubete demonstrează activitatea enzimei catalaze, care se găsește atât în celulele vegetale, cât și în cele animale.
Eficacitatea enzimei catalaze poate fi ilustrată prin date despre descompunerea H2O2 într-o soluţie apoasă.
Enzimele se învață mai detaliat când studiezi cursul de chimie de clasa a XI-a.
Dezvoltarea atenției susținute, capacitatea de a observa experiența, de a efectua analize și de a trage concluzii începe cu un experiment demonstrativ. Forma de lucru în grup vă permite să obțineți în mod eficient cunoștințe, stimulând un sentiment de lucru în echipă.
Utilizarea unui set de echipamente cu o unitate de măsurare computerizată și senzori (temperatură, densitate optică, conductivitate electrică, nivel de pH) extinde semnificativ capacitățile experimentului demonstrativ, deoarece ne permite să privim în interiorul procesului, ceea ce nu am putut face anterior studiind acest subiect doar teoretic. Studiul legilor cantitative este unul dintre subiectele cheie și cele mai complexe din chimie (vezi Anexa nr. 3 „Parametrii utilizați în calculele chimice cantitative”).
În această lecție, ne interesează parametrii de reacție. În lecțiile anterioare, elevii s-au familiarizat cu parametrii termodinamici, iar parametrii materiei și a mediului vor fi studiați în lecțiile ulterioare.
Rezumatul lecției, analiză reflexivă
Profesorul rezumă lecția. Elevii completează fișe de control al lucrărilor elevilor, pe care își indică clasa, numele, prenumele, își evaluează munca la lecție, lucrul în grup, înțelegerea subiectului („rău”, „bun”, „excelent”).
Elevii răspund întrebări.
1. În ce stare de spirit părăsiți lecția?
2. De ce este lecția interesantă pentru fiecare grup și fiecare elev?
3. Care este beneficiul acestei lecții pentru tine?
4. Ce dificultăți ați întâmpinat la lecție?
Clasele diferite oferă întrebări diferite. Din experiență, putem spune că, în stadiul de reflecție, elevii acordă un rating mare lecției („5”, mai rar „4”), notează neobișnuirea, claritatea, bogăția lecției, nivelul emoțional ridicat, logica și material informativ interesant. Cea mai importantă tehnologie dintr-o lecție este colaborarea dintre profesor și elevi. Împreună se ating obiectivele comune, elevii asimilează mai bine materialul și aplică cunoștințele dobândite.
Teme pentru acasă
Împreună cu paragrafele din manual, fiecare grup primește o sarcină individuală pentru a studia influența unui anumit factor asupra vitezei unei reacții chimice.
Sarcina 1. La t= 30 °C reacția se desfășoară în 25 de minute, iar la t= 50 °C – în 4 minute. Calculați coeficientul de temperatură al reacției.
Sarcina 2. Interacțiunea aluminiului cu clorul se desfășoară conform ecuației:
2Al (solid) + 3CI2 (g) = 2AICI3 (solid).
Concentrația inițială de clor este de 0,05 mol/l. Constanta vitezei de reacție este de 0,2 l/(mol s).
Scrieți o expresie matematică pentru viteza de reacție. Cum se modifică viteza de reacție față de cea inițială dacă presiunea din sistem crește de 6 ori?
Sarcina 3. În două vase identice, s-au efectuat reacții de descompunere cu formarea de oxigen și hidrogen. În 10 s, s-au obținut 22,4 litri de O2 în primul vas și 4 g de H2 în al doilea vas. Care reacție chimică are cea mai rapidă viteză? De câte ori?
Sarcina 4. Sugerați modalități de a crește viteza de reacție de 16 ori prin modificarea concentrațiilor substanțelor inițiale:
a) 2Cu (solid) + O 2 (g) = 2CuO (solid);
b) 2H2 (g.) + O2 (g.) = 2H20 (g.).
O caracteristică specială a lecției este că oferă material care depășește domeniul de aplicare al manualului. Acest lucru este necesar atât pentru creșterea erudiției generale, cât și pentru viitorii solicitanți. Materialul suplimentar la clasa de specialitate se bazează în principal pe materiale de la examenele de admitere la diferite universități.
Scopul tehnologiilor educaționale este creșterea eficienței procesului educațional. Principalul lucru în orice tehnologie este să se concentreze asupra personalității elevului. Tehnologia pedagogică este un set de mijloace, metode și procese interconectate necesare pentru un impact țintit asupra formării unei personalități cu calități date. Folosesc o abordare centrată pe elev în lecțiile mele. Ca rezultat, elevii sunt capabili să abordeze studiul materialului mai conștient și mai creativ. Tehnologia cooperării dintre profesor și elev este cea care este importantă în obținerea unor rezultate înalte. Utilizarea activă a elementelor tehnologiilor pedagogice în sala de clasă contribuie la dezvoltarea sferei motivaționale a elevului, inteligența, independența și capacitatea de a controla și gestiona activitățile sale educaționale și cognitive.
Materia mea este chimia, dar predau și studii umane. Folosirea noilor abordări în educație vă permite să vă priviți diferit subiectul. Principalul lucru este să vezi o persoană în fiecare student.
Chimia este știința substanțelor. Abordez studiul substanțelor nu numai din punctul de vedere al semnificației lor practice pentru societate, ci și din poziția unei înțelegeri filozofice a lumii. În lecțiile de chimie și studii umane, arăt integritatea lumii și a omului, încerc să dezvălui copiilor infinitul și armonia vieții, să cultiv dorința de a se înțelege și a se cunoaște pe ei înșiși, dorința de a se îmbunătăți, de a lucra asupra lor pentru a-și îmbunătăți viața. Sunt mulțumit de interesul băieților pentru aceste probleme. Și cred că este util pentru noi, profesorii, să reflectăm și la acest lucru. Numai îmbunătățindu-ne și dezvoltându-ne pe noi înșine îi putem învăța pe copii.
ANEXA Nr. 1
Structura activităților de căutare a problemelor ale profesorilor și elevilor
privind studiul proprietăților substanțelor și esenței reacțiilor chimice
(posibila utilizare a tehnologiei informației)

ANEXA Nr. 2
Utilizarea practică a ecuației ArrheniusExemplul 1. Viteza (frecvența) bipurilor greierelor respectă, deși nu cu strictețe, ecuația Arrhenius, crescând treptat în intervalul de temperatură de la 14,2 °C la 27 °C, cu o energie de activare eficientă. E a = 51 kJ/mol. Pe baza frecvenței ciripiturilor, puteți determina temperatura destul de precis: trebuie să numărați numărul lor în 15 secunde și să adăugați 40, obțineți temperatura în grade Fahrenheit (F) (americanii încă folosesc această scară de temperatură).
Deci, la 55 F (12,8 °C) frecvența de ciripit este de 1 ciripit/s, iar la 100 F (37,8 °C) - 4 ciripit/s.
Exemplul 2.
În intervalul de temperatură de la 18 °C la 34 °C, ritmul cardiac al țestoasei marine este în acord cu ecuația Arrhenius, care dă energia de activare.
E a = 76,6 kJ/mol, dar la temperaturi mai scăzute energia de activare crește brusc. Acest lucru se poate datora faptului că la temperaturi scăzute țestoasa nu se simte foarte bine și ritmul cardiac începe să fie controlat de alte reacții biochimice.
Exemplul 3.
Deosebit de interesante sunt încercările de a „pune dependența lui Arrhenius” de procesele psihologice umane. Astfel, persoanelor cu temperaturi ale corpului diferite (de la 36,4 °C la 39 °C) au fost rugate să numere secundele. S-a dovedit că cu cât temperatura este mai mare, cu atât numărarea este mai rapidă.
(E a = 100,4 kJ/mol). Astfel, simțul nostru subiectiv al timpului se supune ecuației lui Arrhenius. Autorul studiului sociologic, G. Hogland, a sugerat că acest lucru se datorează anumitor procese biochimice din creierul uman.
Cercetătorul german H. von Foerstler a măsurat rata uitării la oameni cu temperaturi diferite. El a dat oamenilor o succesiune de semne diferite și a măsurat timpul în care oamenii și-au amintit această secvență. Rezultatul a fost același cu cel al lui Hoagland: dependența de Arrhenius cu E a = 100,4 kJ/mol.
Aceste exemple arată că multe procese din natură, inclusiv cele psihologice, respectă ecuația Arrhenius cu energii de activare destul de mari. E A. Acest ultim punct este deosebit de important pentru că E iar procesele fizice (de exemplu, fluxul de fluid vâscos) de obicei nu depășesc 20 kJ/mol. O energie mare de activare înseamnă de obicei că legăturile chimice sunt rupte. Deci, în toate exemplele discutate, există, fără îndoială, reacții chimice reale care au loc (evident enzimatice).
ANEXA Nr. 3
Echilibrul procesului de trecere de la o fază la alta fără modificarea compoziției chimice se numește echilibru de fază. Exemple de echilibru de fază pot fi următoarele procese:
evaporare
![]()
Pentru echilibrul de fază se respectă principiul lui Le Chatelier.
Pe măsură ce temperatura crește, echilibrul se deplasează către un proces endotermic, cum ar fi topirea și evaporarea. Odată cu creșterea presiunii, echilibrul se deplasează către procese în care gazul sau vaporii se transformă în stare lichidă sau solidă.
Regula fazei.
Formulat de J. Gibbs. Numărul de grade de libertate C , faze F , componente independente LA și condițiile externe n , care afectează echilibrul, sunt interconectate prin relația:
C+ F = K + n
2.4. Mecanismul reacțiilor chimice. Reacții în lanț. Procese fotochimice. Cataliza omogenă și eterogenă. Autocataliză. Cataliza enzimatică. Otrăvuri catalitice. Reacții oscilatorii.
Energie activatoare. Profilul energetic al reacției.
Reacțiile apar ca urmare a ciocnirilor directe ale moleculelor. Cu toate acestea, nu toate coliziunile duc la o reacție chimică. Formarea de noi substanțe este facilitată doar de molecule care au o cantitate suficientă de energie. Astfel de molecule se numesc molecule active.
Energia minimă suficientă pentru a începe o reacție chimică se numește energie de activare și este exprimată în kcal sau kJ. Cu cât energia de activare este mai mică, cu atât reacția are loc mai rapid.
În reacțiile în care energia de activare este mai mare de 150 kJ la t=25°C, viteza este foarte mică sau practic aceste reacții nu apar. În reacțiile în care energia de activare este mai mică de 60 kJ, viteza este foarte mare (explozie).
Energia de activare Ea depinde de natura elementelor care reacţionează şi serveşte ca caracteristică a fiecărei reacţii.

Diagrama energetică a reacției cu formația
complex activat.
Pentru ca reactanții A și B să formeze produse de reacție C și D, aceștia trebuie să depășească bariera energetică ML. Aceasta necesită energia de activare Ea. În acest caz, în timpul reacției, se formează un grup instabil intermediar din particulele substanțelor de implementare - un complex activat (Fig. 2.6).
Acest complex se descompune pentru a forma produsele finite, iar o astfel de cantitate de energie este eliberată care permite produselor finale să coboare la nivelul energiei medii a produselor finale.
Acea. modificarea produselor poate fi exprimată sub formă de diagrame pentru reacțiile endoterme și exoterme (Fig. 2.7, 2.8).


Diagrama fluxului
reacție exotermă
Diagrama fluxului
reacție endotermă
DESPRE  De obicei, reacțiile dintre substanțele cu legături covalente puternice sunt caracterizate de valori mari ale Ea și decurg lent. Acest lucru se aplică multor interacțiuni, cum ar fi
De obicei, reacțiile dintre substanțele cu legături covalente puternice sunt caracterizate de valori mari ale Ea și decurg lent. Acest lucru se aplică multor interacțiuni, cum ar fi
a cărui viteză în condiții standard este 0.
M  Interacțiunile ionice în soluții se caracterizează prin valori scăzute ale Ea și viteze foarte mari
Interacțiunile ionice în soluții se caracterizează prin valori scăzute ale Ea și viteze foarte mari
Profilul energetic al reacției. A + B = AB (fără catalizator) A + B + K? + B? ? AB + K (cu cat.).
Imaginea 45 din prezentarea „Viteza de reacție chimică” pentru lecții de chimie pe tema „Reacții”Dimensiuni: 1280 x 800 pixeli, format: jpg. Pentru a descărca o imagine gratuită pentru o lecție de chimie, faceți clic dreapta pe imagine și faceți clic pe „Salvați imaginea ca...”. Pentru a afișa imagini în lecție, puteți descărca gratuit și întreaga prezentare „Rate of a chemical reaction.ppt” cu toate imaginile într-o arhivă zip. Dimensiunea arhivei este de 129 KB.
Descărcați prezentareaReacții
„Ecuații chimice” - 7 Н2SO4. Legea conservării masei substanțelor. Ca + O2 CaO. Subiect: Modificări care apar în substanțe. Semne și condiții pentru apariția reacțiilor chimice. TINE MINTE! Ecuații chimice. Formularea modernă a legii: 1756
„Disocierea electrolitică a sărurilor” - Aplicarea sărurilor. Soluție de fenolftaleină Scrieți ecuațiile moleculare și ionice pentru reacțiile posibile. Proprietățile chimice ale sărurilor. 1. Metal + sare 2. Sare + alcali 3. Sare + acid 4. Sare + sare. Sarcina 3. Cu care dintre următoarele substanțe reacționează o soluție de hidroxid de sodiu? NaOH, Ba(OH)2, NH4OH, Al(OH)3.
„Ecuațiile reacțiilor chimice” - D/Z 1) studiați textul § 26 2) finalizați exercițiile scrise Nr. 1-3. Stabilirea unui obiectiv. 2) Vizualizați prezentările studenților despre purificarea apei acasă. Producerea dioxidului de carbon prin interacțiunea dintre sifon și acid. Atom de hidrogen. 4. Vizualizați prezentările studenților cu privire la subiectele selectate. m1. Material de referință pentru lucrul în grup.
„Viteza de reacție chimică” - t1. dCB dt. Viteza unei reacții chimice. a A. Cinetica chimică. dc dt. Clasificarea proceselor după compoziția fazelor. V a) n=0 v b) n=1 v c) n>1. Lant - raioane neramificate. C1. Definiția grafică a lui n. Planul cursului. Reacții în lanț - ramificate. Ecuația cinetică a unei reacții complexe.
„Reacții ale substanțelor” - Clasificarea substanțelor după compoziție: Fotografii cu fragmente de lecții folosind o tablă interactivă. N2. Gradul 10 „Carbohidrați”. Ce substanțe sunt discutate în fragmentul din poemul lui S. Shchipachev „Citind Mendeleev”? Scrieți ecuațiile de reacție pentru producerea sulfatului de aluminiu. Sarcina nr. 4. Sarcina nr. 7. Cinnabru mercur (ii) sulfură.
„Tipuri de reacții chimice” - Toate reacțiile sunt însoțite de efecte termice. Tipuri de reacții chimice. Reacțiile chimice apar: la amestecarea sau contactul fizic al reactivilor, spontan la încălzirea cu participarea catalizatorilor, acțiunea luminii, curentul electric, acțiunea mecanică etc. Karpukhina Irina Stepanovna Profesor de chimie MBOU Școala Gimnazială Nr. 32 Orașul Novosibirsk.
Sunt 28 de prezentări în total
Modificarea entalpiei DH este în esență diferența dintre energiile de legătură ale reactanților și produșilor, inclusiv energiile de conjugare, tensiune și solvatare. DH poate fi calculat prin însumarea energiilor tuturor legăturilor rupte în timpul reacției și scăzând din ele suma energiilor tuturor legăturilor formate, adunând toate modificările energiilor de conjugare, tensiune și solvatare. În plus, modificarea entalpiei poate fi determinată experimental prin măsurarea efectului termic al reacției, deoarece modificarea entalpiei este egală cu efectul termic al reacției, luată cu semnul opus.
- DH=Qр
Modificarea entropiei DS caracterizează gradul de dezordine a sistemului. În chimia organică, acest factor joacă rar un rol important, deoarece reacțiile apar la temperaturi relativ scăzute, la care factorul de entropie este mic. Cu toate acestea, în unele cazuri, schimbarea entropiei poate juca un rol semnificativ:
· întrucât gazele au entropie mai mare decât lichidele (chiar mai mult decât solidele), atunci orice reacție în care substanțele inițiale sunt lichide sau solide, iar unul sau mai mulți produse sunt gazoase, este termodinamic favorabilă, deoarece entropia sistemului crește;
· dacă în timpul unei reacții se formează mai multe molecule de produse decât molecule de substanțe inițiale, atunci reacția decurge cu o creștere a entropiei.
O valoare negativă a DG în sine nu înseamnă că reacția va avea loc într-o perioadă de timp previzibilă. O modificare negativă a energiei libere este un factor necesar, dar nu suficient, pentru apariția spontană a unei reacții chimice. De exemplu, reacția a doi moli de hidrogen cu un mol de oxigen, care are ca rezultat formarea apei, este caracterizată printr-o schimbare negativă mare a energiei libere. Cu toate acestea, un amestec de O 2 și H 2 poate fi păstrat la temperatura camerei timp de decenii fără niciun semn de reacție chimică.
Mecanisme ale reacțiilor organice
Pentru a înțelege reacțiile organice, cunoașterea mecanismelor lor este extrem de utilă.
Mecanismul de reacție - o descriere detaliată a procesului de transformare a compușilor inițiali în produse. Mecanismul include date despre metoda și secvența clivajului și formării legăturilor, structura intermediarilor (produșii intermediari), cinetica, termodinamica și stereochimia reacției. Mecanismul nu ar trebui să contrazică faptele experimentale existente și, atunci când apar altele noi, să le explice și pe acestea.
Când luăm în considerare caracteristicile subtile ale mecanismelor, este extrem de util să folosiți așa-numitele diagrama energetică (profil energetic) reacții. Aceasta este o dependență grafică a energiei sistemului de o funcție complexă a distanței dintre substanțele care reacţionează, care este de obicei numită " coordonata de reactie" sau " progresul reacției„(Figura 3.1).
Orez. 3.1. Diagrama energetică: A – endo-, B – reacție exotermă.
Această figură ilustrează apariția reacțiilor într-un singur pas. O reacție endotermă implică absorbția de căldură, în timp ce o reacție exotermă implică eliberarea de căldură.
Aproape toate reacțiile chimice apar atunci când două sau mai multe, foarte rar, particule de reacție se ciocnesc. Din fig. 3.1 este clar că abordarea moleculelor care reacţionează duce la o creştere a energiei sistemului până la un anumit maxim. Ciocnirile vor fi eficiente atunci când substanțele care reacţionează au o oarecare energie în exces în comparaţie cu energia medie a moleculelor din sistem. Particulele care nu au un astfel de exces de energie se împrăștie în direcții diferite după o coliziune. Energie activatoare- excesul de energie necesar pentru a depăși bariera energetică. Ii corespunde energia maxima a sistemului (punctul cel mai inalt al diagramei energetice). stare de tranziție (complex activat). Prezența unei stări de tranziție explică motivul pentru care chiar și reacțiile exoterme nu apar de obicei spontan, ci numai la încălzire sau la alte mijloace de activare a sistemului.
Starea de tranziție - cel mai înalt punct energetic al reacției - este cea care determină cursul întregii transformări. Cunoașterea structurii sale poate clarifica mecanismul transformării chimice. Cu toate acestea, durata de viață a complexului activat este atât de scurtă încât nu există metode fizice pentru a-l înregistra și, în consecință, pentru a obține cunoștințe despre structura lui.
postulatul lui J. Hammond
Pentru a evalua indirect structura stării de tranziție, utilizați postulatul lui J. Hammond (1955): modificări minore de energie sunt însoțite de modificări minore ale structurii moleculare. Formulare mai clară: structura stării de tranziție este similară cu structura acelor substanțe de care este mai aproape energetic. În reacțiile exoterme, starea de tranziție este mai apropiată ca structură de reactivii inițiali (Fig. 3.1). Acest complex activat se numește stare de tranziție timpurie. Starea de tranziție în reacțiile endoterme este mai apropiată ca structură de produșii de reacție; se numește târziu. Impacturi similare asupra structurilor similare conduc la rezultate similare. Prin urmare totul factori stabilizatori(scăderea stărilor energetice) aproape energetic de starea de tranziţie initial, intermediar sau final substanță, reduce energia complexului activat.
Utilizarea postulatului lui Hammond este deosebit de utilă atunci când se iau în considerare reacțiile în mai multe etape (Figura 3.2).
 |
Figura 3.2. Diagrama energetică a unei reacții în două etape
Din figura 3.2 este clar că reacția are loc în două etape, printr-un singur produs intermediar. Conversia produselor în intermediari (prima etapă) este mai importantă pentru reacția globală decât conversia intermediarilor în produși de reacție (a doua etapă). Acest lucru este confirmat de energiile de activare corespunzătoare din prima și a doua etapă (Ea 1 și, respectiv, Ea 2). Întregul curs al unei reacții este determinat de punctul său energetic cel mai înalt - starea de tranziție a primei etape [PS 1]. Dacă aplicăm postulatul lui Hammond acestei reacții, este ușor de concluzionat că produsul intermediar este cel mai apropiat energetic de stările de tranziție ale ambelor etape ale reacției.
S. Arrhenius a descoperit dependența de temperatură a vitezei multor reacții, care poate fi descrisă prin ecuația:
k = A e - E* / RT
Unde k - constanta de viteză, e - baza logaritmilor naturali, R - constantă universală de gaz, T - temperatura, A - factor pre-exponenţial, E* - energia de activare a reactiei.
teoria coliziunii active(coliziuni)
1) Interacțiunea chimică între molecule este posibilă numai atunci când acestea se ciocnesc.
2) Nu orice ciocnire de molecule duce la o interacțiune chimică, adică este eficientă sau, în terminologia lui Arrhenius, activă. Există o anumită bariera energetică, pe care doar o parte din molecule o poate depăși și cu care interacționa și, de regulă, aceasta este o parte foarte mică din numărul lor total din sistem.
3) Motivul existenței unei bariere energetice este respingerea reciprocă a învelișurilor de electroni ale moleculelor atunci când acestea se apropie una de cealaltă.
4) Pentru ca moleculele să depășească bariera energetică în timpul unei coliziuni, acestea trebuie să se deplaseze una spre cealaltă cu o viteză suficient de mare. Pentru a atinge această viteză necesară, este nevoie de o anumită energie, numită energie de activare. Energie activatoare E* - aceasta este energia in exces al moleculelor active fata de cele inactive, sau altfel, energia pe care trebuie sa o aiba moleculele pentru a putea interactiona. Dimensiunea SI a energiei de activare este J/mol.
5) Cu cât energia de activare a reacției este mai mare, cu atât bariera energetică este mai mare și cu atât mai puține molecule sunt capabile să o depășească. Prin urmare, cu atât mai mult E* , cu atât reacția este mai lentă.
6) Odată cu creșterea temperaturii, viteza de mișcare termică a moleculelor crește, astfel încât proporția de molecule active crește. Cu alte cuvinte, pe măsură ce temperatura crește, activare termică, conducând la o creștere a vitezei de reacție.
calcularea energiei de activare a unei reacții din valorile a două constante de viteză la temperaturi diferite:
T 2 - T 1 k 1
Complex activat este o formațiune instabilă care include toți atomii moleculelor care se ciocnesc și care interacționează. Durata de viață a complexului activat este foarte scurtă; se măsoară în mici (milionimi, zece-milionimi etc.) fracțiuni de secundă. Distanțele dintre atomi dintr-un complex activat sunt oarecum mai mari decât în moleculele obișnuite, deci este necesară energie suplimentară pentru formarea acestuia.
O reprezentare vizuală a cursului unei reacții în timp în conformitate cu teoria stării de tranziție poate oferi profil energetic reacție, de exemplu, exotermă (Fig. 12.6).
Energia sistemului este reprezentată de-a lungul axei ordonatelor E , iar axa x este așa-numita coordonată de reacție. Rezerva medie de energie a mișcării termice a moleculelor substanțelor inițiale corespunde nivelului E ref, energie stocată în complexul activat - nivel E AK. Apoi diferența E AK - E ref este egală cu valoarea barierei energetice pe care moleculele trebuie să o depășească pentru a interacționa (energia de activare). O reprezentare vizuală a acesteia este dată de curba care leagă nivelurile E ref și E AK. Înălțimea barierei energetice depinde de natura substanțelor care reacţionează, de energia necesară pentru formarea complexului activat (energia de activare), precum și de energia medie a mișcării termice a moleculelor. E ref.
Pe măsură ce temperatura crește, nivelul E ref se ridică, bariera energetică devine mai mică și un număr mai mare de molecule pot interacționa. Acesta este motivul pentru care reacția se accelerează odată cu creșterea temperaturii. Când temperatura scade, dimpotrivă, nivelul E ref scade și bariera energetică crește, ceea ce duce la o scădere a vitezei de reacție.
În timpul descompunerii complexului activat cu formarea de molecule de produs, se eliberează energie, ceea ce corespunde diferenței E AK - E prod, unde E prod - rezerva medie de energie a moleculelor de produs. O parte din această energie eliberată egală cu diferența E AK - E ref va fi folosit pentru a activa noi molecule ale substanțelor inițiale, iar excesul E ref - E produsul va fi eliberat în mediu sub forma unui efect termic exotermic al reacției DH r .
Pentru reacțiile endoterme, profilul energetic arată ușor diferit (Fig. 12.7). Se poate observa că în acest caz nivelul de energie E ref mai jos decât nivelul E cont. Ca rezultat al acestei energii E AK - E produsul eliberat în timpul dezintegrarii complexului activat nu este suficient pentru
pentru a provoca activarea de noi molecule de reactant. Prin urmare, pentru a continua reacția, este necesară furnizarea de energie din exterior, sub forma unui efect termic endotermic.
Existența unui complex activat este confirmată de date experimentale. Deci, de exemplu, pentru una dintre reacțiile model simple de interacțiune a unui atom de hidrogen cu o moleculă de hidrogen
Н 2 + Н ® Н + Н 2 ,
valoarea energiei de activare este apropiată de 36,8 kJ/mol. Dacă reacția a continuat prin etapa de disociere completă a moleculelor de H 2 și nu prin etapa de formare a complexului activat H 2 ·H, atunci ar fi necesară o energie de activare de 435,1 kJ/mol.
55. fotochimie. Reacții fotochimice. Legile de bază ale fotochimiei (legea Grotthus-Draper, legea Bunsen-Roscoe, legea Stark-Einstein).
fotochimie aceasta este o ramură a cineticii chimice care se ocupă de comportamentul moleculelor excitate electronic .
În biologie, sunt cunoscute mai multe procese fotochimice care sunt extrem de importante pentru viața atât a organismelor individuale, cât și a biosferei în ansamblu. În primul rând, printre astfel de procese ar trebui să numim fotosintezăÎn plus, sunt extrem de importante fotochimia vederii, fotochimia sintezei vitaminelor, de exemplu, vitamina D în pielea umană, fotochimia bronzării etc.
Reacția fotochimică de descompunere a halogenurilor de argint stă la baza procesului fotografic. Există materiale fotocromatice care își pot schimba culoarea sau transparența atunci când sunt expuse la lumină, care sunt folosite, în special, pentru înregistrarea fotochimică a informațiilor sau pentru fabricarea ochelarilor de soare. Reacțiile fotochimice sunt utilizate și în industria chimică, de exemplu, în sinteza caprolactamei sau în fotopolimerizarea metacrilatului de metil în producerea sticlei organice.
Pentru farmacie, reacțiile fotochimice sunt importante în primul rând în măsura în care lumina poate provoca distrugere ( fotoliză) multe medicamente. Multe alte substanțe și materiale sunt, de asemenea, supuse descompunerii sub influența luminii - lemn, hârtie, vopsele, materiale plastice etc.
În chimie este utilizată pe scară largă metoda luminiscentă de analiză, bazată pe studiul spectrelor de radiații emise de moleculele excitate ale substanțelor studiate.
Legile fotochimiei
Sunt cunoscute următoarele legi ale fotochimiei:
Legea Grotthus-Draper(K.I.D. Grotthus - 1818; J.W. Draper - 1842).