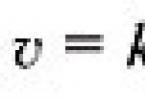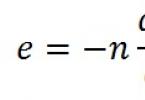Cheminės reakcijos greitis
ir jo priklausomybė nuo įvairių veiksnių
Pamoka naudojant informacines technologijas
Bet kokiu atveju neįmanoma išmokti chemijos,
nematant pačios praktikos ir nesiimdamas cheminių operacijų.
M. V. Lomonosovas
Aukštojo ir vidurinio specializuoto mokslo pertvarka šalyje ir mokyklų reforma numato toliau tobulinti mokymo formas, metodus ir priemones, naudoti įvairias technologijas, įskaitant į asmenį orientuotą mokymąsi (PLL), problemų paiešką ir kompiuterines technologijas. .
Keičiamės ir mes, mokytojai. Savo darbe stengiuosi nuolat naudotis naujovėmis ir šiuolaikinėmis švietimo technologijomis.
Pastaruoju metu kompiuterių diskuose pasirodė daug medžiagos. Jie gali būti naudojami rengiant esė, rašant kursinius darbus ir atliekant savarankišką studentų darbą. Informacinės technologijos leidžia greitai organizuoti mokymus ir žinių patikrinimą, sukurti adaptyvias programas ir jas pritaikyti mokant chemijos.
Kompiuterinės technologijos ir kompiuterinių technologijų naudojimas šiandien veikia ne tik kaip visų mokymosi procesų automatizavimo priemonė, bet ir kaip priemonė, leidžianti smarkiai padidinti mokinių intelektinės veiklos efektyvumą.
Pamokose naudoju kompiuterines technologijas įvairiais tikslais:
Problemų sprendimas, kiekybiniai skaičiavimai, duomenų apdorojimas (pagal siūlomą algoritmą);
Vykdyti savikontrolę ir standartizuotą žinių apie edukacinės informacijos turinį kontrolę (testai, kontrolinės diferencijuotos užduotys, žemėlapiai ir kitos anketos);
Cheminio eksperimento automatizavimas, prijungimas prie optinės įrangos (eksperimentų projektavimas į ekraną);
Reikalingų informacinių duomenų gavimas, testų, diferencijuotų darbų ruošimas, tipinių studentų klaidų analizė (automatizuotos valdymo sistemos ir informaciniai bankai);
Savarankiškas studentų darbas rengiant santraukas ir kursinius darbus, dirbti su medžiaga, atlikti kontrolinį darbą (gavus rezultatą, vykdyti savikontrolę).
Siūloma pamoka iš skyriaus „Cheminė kinetika“ atitinka autorių L. S. Guzey ir R. P. Surovtsevos vadovėlio „Chemija-10“ programą. Prieš pradedant šios temos tyrimą, tiriama reakcijų termodinamika. Siūloma medžiaga atitinka ne reikalaujamą minimalų turinį, o visų pirma profilio mokymo lygį.
Pamokoje naudojamas grupinis darbas, diferencijuotas požiūris, lavinimo ir problemų paieškos technologijos, o svarbiausia – kompiuterinės technologijos, atliekant parodomąjį eksperimentą, leidžiantį aiškiai suprasti, koks yra cheminės reakcijos greitis ir kaip jis priklauso nuo įvairių veiksnių. .
Pamokos tikslai. Atnaujinti ir pagilinti žinias apie cheminių reakcijų greitį; grupiniu darbu apsvarstyti ir tirti įvairius veiksnius: reaguojančių medžiagų pobūdį, medžiagų sąlyčio paviršiaus plotą, temperatūrą, katalizatorių; kompiuteriniu matavimo bloku aiškiai parodyti, koks yra cheminės reakcijos greitis ir kaip jis priklauso nuo reaguojančių medžiagų koncentracijos.
Pamokos šūkis.„Yra tik tai, ką galima išmatuoti“ (M. Planckas).
Klasės dizainas. Mokytojas iš anksto informuoja būsimos pamokos temą, suskirsto klasę į keturias kūrybines grupes po 5-6 žmones, maždaug vienodus gebėjimus. Ankstesnėje pamokoje mokiniai gauna namų darbus – parengti pranešimus apie Arrhenius lygties praktinį pritaikymą ir katalizės rūšis.
Įranga ir reagentai. Ant mokinių stalų - vadovėliai, sąsiuviniai, lentelės, laboratoriniai lapai, stelažai su mėgintuvėliu;
1 grupė: cinko granulės, magnio juosta, druskos rūgšties tirpalas;
2 grupė: stiklo strypas; geležies drožlės, geležies vinys, vario(II) chlorido tirpalas;
3 grupė: pipetė, mėgintuvėlio laikiklis, alko lempa, degtukai; vario(II) oksidas, sieros rūgšties tirpalas;
4 grupė(atlieka demonstracinį eksperimentą ant demonstracinės lentelės): kompiuteris su matavimo bloku, optinio tankio jutikliu, kai bangos ilgis 525 nm, kiuvete, magnetine maišykle, 10 ml švirkštu, 100 ml graduotu cilindru; kalio jodido KI 1M, kalio persulfato K 2 S 2 O 8 0,1 M tirpalai, distiliuotas vanduo.
Visus užrašus mokiniai per pamoką daro į sąsiuvinius.
UŽSIĖMIMŲ LAIKOTARPIU
Pasirinktos temos svarbos motyvavimas
Mokytojas pradeda aiškinti medžiagą skirtingu greičiu vykstančių cheminių reakcijų pavyzdžiais. Mokiniai gali pateikti reakcijų pavyzdžių.
Cheminės reakcijos vyksta skirtingu greičiu. Kai kurie progresuoja lėtai, per mėnesius, pavyzdžiui, geležies korozija arba vynuogių sulčių fermentacija, dėl kurios susidaro vynas. Kiti, pavyzdžiui, alkoholio gliukozės fermentacija, baigiami per kelias savaites. Dar kitos baigiasi labai greitai, pavyzdžiui, nusėda netirpios druskos, o kai kurios įvyksta akimirksniu, pavyzdžiui, sprogimai.
Beveik akimirksniu, labai greitai, vandeniniuose tirpaluose įvyksta daug reakcijų:
Sumaišykime Na 2 CO 3 ir CaCl 2 vandeninius tirpalus, reakcijos produktas CaCO 3 netirpsta vandenyje ir susidaro iš karto;
Jei į šarminį fenolftaleino tirpalą įpilame rūgšties perteklių, tirpalo spalva akimirksniu pasikeičia. Tai reiškia, kad neutralizavimo reakcija, ty spalvotos indikatoriaus formos pavertimo bespalve reakcija, vyksta labai greitai.
Ant geležinių daiktų lėtai susidaro rūdys. Ant varinių ir bronzinių objektų lėtai susidaro juodai rudos arba žalsvos spalvos korozijos produktai (patina). Visų šių procesų greitis yra skirtingas.
Rodinių atnaujinimas
apie cheminių reakcijų greitį
Cheminės reakcijos yra viena iš svarbiausių chemijos sąvokų. Kad juos suprastų ir kompetentingai panaudotų ugdymo procese, mokytojas turi žinoti ir mokėti paaiškinti pagrindines bet kokios cheminės reakcijos charakteristikas: šiluminį efektą, pusiausvyrą, greitį. Cheminė termodinamika leidžia numatyti, kuria kryptimi gali vykti spontaniškai tam tikra cheminė reakcija, tačiau vien cheminė termodinamika neatsako į klausimą, kaip ir kokiu greičiu vyks reakcija. Cheminės reakcijos greičio sąvoka yra viena iš pagrindinių cheminės kinetikos.
Studijuodami naują medžiagą, studentai naudojasi reikiamomis žiniomis apie cheminės reakcijos greitį, pereina žinių atnaujinimo etapą. Bet šią sąvoką pagilina vienalyčių ir nevienalyčių reakcijų greičio, aktyvacijos energijos sąvokos, įvedama Arenijaus lygtis - tai mokinių proksimalinės raidos zona (žr. priedą Nr. 1 „Mokytojų problemų paieškos veiklos struktūra). ir studentai...“).
Ką reiškia reakcijos greitis? Kaip jį galima išmatuoti ir pakeisti? Į šiuos klausimus padės atsakyti mokslas, tiriantis reakcijų modelius laikui bėgant – cheminę kinetiką.
Prisiminkime pagrindines kinetikos sąvokas ir modelius (mokiniai atsako ir mokytojų priedai).
Cheminė kinetika yra chemijos šaka, kurios užduotis yra paaiškinti kokybinius ir kiekybinius cheminių procesų pokyčius, vykstančius laikui bėgant. Paprastai ši bendra užduotis skirstoma į dvi, konkretesnes:
1) reakcijos mechanizmo nustatymas - elementarių proceso etapų ir jų atsiradimo (kokybinių pokyčių) sekos nustatymas;
2) kiekybinis cheminės reakcijos aprašymas - griežtų ryšių nustatymas, leidžiantis apskaičiuoti pradinių reagentų ir produktų kiekio pokyčius vykstant reakcijai.
Pagrindinė cheminės kinetikos sąvoka yra reakcijos greičio sąvoka. Cheminės reakcijos greitis nustatomas pagal medžiagos kiekį, sureaguotą per laiko vienetą reakcijos erdvės vienete.
Jei vieno iš reagentų koncentracija mažėja nuo Su 1 iki Su 2 už laikotarpį nuo t 1 iki t 2, tada pagal reakcijos greičio apibrėžimą yra lygus (1 pav.):
Ženklas „–“ dešinėje lygties pusėje reiškia tai. Reakcijai progresuojant ( t 2 – t 1) > 0 reagentų koncentracija mažėja, todėl ( c 2 – c 1) < 0, а т.к. скорость реакции всегда положительна, то перед дробью следует поставить знак «–».
Ryžiai. 1.
|
Kiekybiškai ryšį tarp reakcijos greičio ir reagentų molinių koncentracijų apibūdina pagrindinis cheminės kinetikos dėsnis – masės veikimo dėsnis.
Cheminės reakcijos greitis pastovioje temperatūroje yra proporcingas reaguojančių medžiagų koncentracijų sandaugai.
Dėl reakcijos
A A+ b B = Su C + d D,
pagal masės veikimo dėsnį greičio priklausomybę nuo reaguojančių medžiagų koncentracijų galima pateikti taip:
![]()
Kur k– greičio konstanta; n A, n B – atitinkamai A ir B reagentų reakcijos eilės;
n A+ n B yra bendra reakcijos tvarka.
Homogeninėse reakcijose reaguojančios medžiagos yra toje pačioje dujų fazėje arba tirpale, tolygiai susimaišę viena su kita, reakcija vyksta visame mišinio tūryje. Reagento koncentracija yra lygi medžiagos kiekio daliai, padalytam iš mišinio tūrio: Su = /V.
Vidutinis reakcijos greitis:
![]()
Kuo trumpesnis laikotarpis, tuo tikslesnis bus reakcijos greitis.
Fazių sąsajoje vyksta heterogeninės reakcijos: dujos – kieta, dujos – skystis, skystis – kieta, kieta – kieta. Greitoji reakcija
![]()
matuojamas reaguojančių medžiagų sąlyčio ploto vienetui S.
Nagrinėjant cheminių reakcijų terminį poveikį, reaguojančių medžiagų molekulių (A + B) pavertimas produkto molekulėmis (C + D) termodinaminiu požiūriu aiškinamas kaip „kopimas į energijos kalną“ endoterminių reakcijų atveju (1 pav. 2, A) arba „leidimas žemyn“ egzoterminėms reakcijoms (2 pav., b).
Kad reaguojančių medžiagų molekulės sureaguotų, jos pirmiausia turi sukaupti papildomos energijos, kad įveiktų energijos barjerą pakeliui į reakcijos produktus. Svarbu tai, kad tokia kliūtis egzistuoja ir egzoterminių reakcijų atveju, todėl, užuot tiesiog „slydusios nuo kalno“, molekulės pirmiausia turi „lipti į kalną“.
Ryžiai. 2.
|
Varomoji reakcijos jėga yra noras pasiekti energijos minimumą.

Kad įvyktų reakcija, reaguojančių medžiagų dalelės turi susidurti viena su kita. Kylant temperatūrai, didėja šių susidūrimų skaičius, nes didėja molekulių kinetinė energija, todėl didėja reakcijos greitis. Tačiau ne kiekvienas reaguojančių medžiagų molekulių susidūrimas sukelia jų sąveiką: kad molekulės sąveikautų, ryšiai tarp jose esančių atomų turi susilpnėti arba nutrūkti, o tam turi būti išleista tam tikra energijos dalis. Jei susiduriančios molekulės neturi šios energijos, jų susidūrimas nesukelia reakcijos. Energijos perteklius, kurį turi turėti molekulės, kad dėl jų susidūrimo susidarytų naujos medžiagos molekulės, vadinama aktyvacijos energijaši reakcija E a, paprastai matuojamas J/mol, kJ/mol. Molekulės, turinčios šią energiją, vadinamos aktyviosiomis molekulėmis.
Fig. 3 rodo energijos profilius:
a) endoterminė reakcija, + H = –K,
N 2 + O 2 2NO – K;
b) egzoterminė reakcija, H = +K,
H 2 + I 2 2 HI + K.
Reakcijos metu susilpnėja cheminiai ryšiai aktyviose molekulėse ir atsiranda nauji ryšiai tarp reaguojančių medžiagų dalelių, susidaro pereinamoji būsena - aktyvuotas kompleksas, kai senieji ryšiai nėra visiškai suardomi, bet jau pradėti kurti nauji. Aktyvinimo energija yra energija, reikalinga aktyvuotam kompleksui susidaryti. Energijos barjeras skiriasi: kuo jis žemesnis, tuo lengviau ir greičiau vyksta reakcija.
Energijos barjero viršuje esantis taškas vadinamas pereinamoji būsena. Nuo šio taško sistema gali laisvai pereiti į reakcijos produktą arba grįžti į pradinę būseną (4 pav.).
Aktyvinimo energija yra veiksnys, kuriuo reagentų prigimtis įtakoja reakcijos greitį. Vienoms reakcijoms jis yra mažas, kitų – didelis. Jei aktyvavimo energija yra maža (< 40 кДж/моль), то большая часть столкновений между молекулами реагирующих веществ приводит к реакции. Скорость таких реакций велика. Если энергия активации велика (>40 kJ/mol), tai tokiu atveju tik nedidelė molekulių ar kitų dalelių susidūrimų dalis sukelia reakciją. Tokios reakcijos greitis mažas.
Reakcijos greitį tam tikru metu galima apskaičiuoti, jei žinote aktyvių reaguojančių dalelių susidūrimų skaičių per laiko vienetą. Todėl reakcijos greičio priklausomybę nuo temperatūros galima parašyti taip:
0 exp (- E a/ RT),
kur 0 yra reakcijos greitis, jei kiekvienas susidūrimas sukelia sąveiką ( E a = 0). Ši reakcijos greičio išraiška yra Arenijaus lygtis- svarbi cheminės kinetikos lygtis (jos praktinis pritaikymas žr. priedą Nr. 2, studentai rengia pranešimus).
Kodėl cheminės reakcijos vyksta skirtingu greičiu? Tai yra pagrindinis klausimas, su kuriuo pamokoje susiduria mokytojas ir vaikai. Į jį mokiniai atsako teoriškai, grupėse atlikdami laboratorinius eksperimentus ir spręsdami uždavinius.
Grupinis darbas
Grupių darbas apima šias veiklas:
Eksperimentinis veiksnių, turinčių įtakos cheminių reakcijų greičiui, tyrimas;
Gautų eksperimentinių rezultatų stebėjimas ir analizė;
Laboratorinių lapų pildymas, atspindintis pažangą ir išvadas.
Sėkmingo darbo grupėse ir pavestų užduočių vykdymo sąlyga yra kiekvieno mokinio darbo vietos aprūpinimas reikalinga įranga ir vaizdinėmis priemonėmis. Darbo metu mokytojas kreipiasi į visas grupes ir, esant reikalui, suteikia konsultacinę pagalbą. Žemiau pateikiamas kiekvienos grupės užduočių turinys.
Laboratorinis eksperimentas Nr.1.
Cheminės reakcijos greičio priklausomybė
nuo reagentų prigimties
Tikslas. Sustiprinti sąvoką „cheminės reakcijos greitis“ ir nustatyti jos priklausomybę nuo reaguojančių medžiagų pobūdžio.
Įranga ir reagentai. Stovas su mėgintuvėliais; cinko granulės, magnio juosta, druskos rūgšties tirpalas.
Demonstracinė patirtis.
Reakcijos greitis ir priklausomybė nuo jo
apie pradinių medžiagų koncentraciją
Tikslas. Vizualiai parodykite, koks yra cheminės reakcijos greitis ir kaip jis priklauso nuo pradinių medžiagų koncentracijos.
Įranga ir reagentai. Kompiuteris su matavimo bloku, optinio tankio jutikliu, kai bangos ilgis = 525 nm, kiuvete, magnetiniu maišytuvu, 5 ml švirkštu, 100 ml graduotu cilindru; tirpalai - 1M KI, 0,1M K 2 S 2 O 8, distiliuotas vanduo.
Cheminė proceso esmė. Tiriama jodido jonų oksidacijos reakcija su persulfatu:
2I – + S 2 O 8 2– = I 2 + 2SO 4 2– .
Reakcija vykdoma kalio jodido pertekliumi. Išsiskyręs jodas tirpalą paruduoja. Jodo koncentracija nustatoma pagal tirpalo spalvos intensyvumą, naudojant optinį tankio jutiklį esant 525 nm.
Pasiruošimas darbui. 525 nm bangos ilgiui sureguliuotas optinis tankio jutiklis yra prijungtas prie pirmojo matavimo įrenginio kanalo. Įjunkite jutiklį nuo laiko priklausomu režimu, į kiuvetę įpilkite 10 ml 1M KI tirpalo ir 90 ml distiliuoto vandens. Nustatykite jutiklį.
Spektaklis. Pradėkite maišymo procesą. Į švirkštą paimkite 5 ml K 2 S 2 O 8 tirpalo, greitai supilkite į kiuvetę, tuo pačiu metu pradėdami matavimo procesą paspausdami ekrano mygtuką „Pradėti“. Matavimas sustabdomas, kai optinis tankis pasiekia 0,5.
Pakartokite eksperimentą naudodami 20 ml KI tirpalo ir 80 ml vandens.
Komentarai. Reakcijos greitis – tai reagentų arba reakcijos produktų koncentracijos pokytis per laiko vienetą. Reakcijos greitis priklauso nuo pradinių reagentų koncentracijos tam tikru metu.
Išvestos sąvokos. Reakcijos greitis, jo priklausomybė nuo koncentracijos.
Išvados. Kadangi reakcijos metu sunaudojami reagentai, greitis lėtėja.
Didėjant pradinio reagento koncentracijai, didėja reakcijos greitis. Be to, šiuo atveju, kai koncentracija buvo padvigubinta, reakcijos greitis taip pat padvigubėjo.
Laboratorinis eksperimentas Nr.2.
Temperatūros įtaka greičiui
Tikslas. Sustiprinkite sąvoką „cheminės reakcijos greitis“ ir ištirkite temperatūros poveikį cheminės reakcijos greičiui.
Įranga ir reagentai. Stovas su mėgintuvėliais, pipete, alkoholio lempa, mėgintuvėlio laikikliu; vario(II) oksido, sieros rūgšties tirpalas (1:3).
Laboratorinis eksperimentas Nr.3.
Cheminės reakcijos greičio priklausomybė
nuo kontaktinio paviršiaus ploto
reagentai
Tikslas. Sustiprinti sąvoką „cheminės reakcijos greitis“ ir nustatyti jos priklausomybę nuo reaguojančių medžiagų kontaktinio paviršiaus dydžio.
Įranga ir reagentai. Stovas su mėgintuvėliais, stiklinė lazdelė; geležies drožlės, geležies vinys, vario(II) chlorido tirpalas.
Grupinio darbo rezultatų pristatymas, jų aptarimas
Rezultatų pateikimo tvarka nustatoma pagal grupių numerius (paeiliui). Mokiniai kalba prie lentos naudodami lenteles, užpildytas pagal savo laboratorinių eksperimentų rezultatus. Organizuojamas trumpas grupių darbo rezultatų aptarimas ir formuluojamos išvados. Mokytojas nurodo dar vieną veiksnį, turintį įtakos cheminės reakcijos greičiui – katalizatoriaus buvimą.
Katalizatoriai- tai medžiagos, kurios pagreitina cheminę reakciją, inhibitoriai– Tai medžiagos, lėtinančios cheminę reakciją. Patys katalizatoriai ir inhibitoriai nėra sunaudojami reakcijoje ir nėra įtraukti į reakcijos produktus.
Katalizė yra reakcijos greičio keitimo procesas veikiant katalizatoriui. Katalizatoriaus veikimas yra selektyvus. Reakcijos, kurios vyksta dalyvaujant katalizatoriui, vadinamos katalizinės reakcijos.
Homogeninės katalizės mechanizmas
Dažnai reakcijos būna lėtos, nes... jų aktyvavimo energija E a yra didelis (5 pav.):
A + B A B AB.
Katalizatorius (K) pagreitina reakciją:

Aktyvinimo energijos E"a ir E"" ir yra maži, todėl reakcijos vyksta greitai.
Dalyvaujant katalizatoriui, sumažėja E ir susidaro energijos padidėjimas ir reakcija vyksta greičiau.
V i d y c a t a l i s a
1. Homogeninė katalizė– pradinės medžiagos ir katalizatorius – vienfazė sistema.
Pavyzdžiui, natūralūs Žemės ozono sluoksnio storio svyravimai yra susiję su saulės aktyvumo pokyčiais. Viršutiniuose atmosferos sluoksniuose ozono sluoksnis sunaikinamas, katalizuojamas azoto oksidų:

2. Heterogeninė katalizė– pradinės medžiagos ir katalizatorius sudaro daugiafazę sistemą.

Heterogeninės katalizės mechanizmas apima penkis etapus:
Difuzija – reaguojančios molekulės difunduoja į katalizatoriaus paviršių;
Adsorbcija – reagentai kaupiasi katalizatoriaus paviršiuje;
Cheminė reakcija - katalizatoriaus paviršius yra nevienalytis, ant jo yra aktyvūs centrai, jie susilpnina ryšius tarp atomų adsorbuotose molekulėse, reaguojančios molekulės deformuojasi, kartais skyla į atomus, o tai palengvina cheminės reakcijos atsiradimą;
Desorbcija – produkto molekulės pirmiausia sulaikomos katalizatoriaus paviršiuje, o po to išleidžiamos;
Difuzija – produkto molekulės difunduoja nuo katalizatoriaus paviršiaus.
Vaizdžiai tariant, katalizatoriaus veikimo mechanizmą galima palyginti su turistais, kertančiais kalnų perėją. Vietovės nepažįstantys turistai pasirinks akivaizdžiausią, bet sunkiausią maršrutą, reikalaujantį ilgo kopimo ir nusileidimo per kalno viršūnę. Patyręs vadovas (katalizatorius) ves savo grupę keliu, pro viršūnę. Nors šis takas vingiuotas, jis ne toks sudėtingas, juo lengviau pasiekti galutinį tašką, po kurio gidas grįžta į pradinį tašką.
Specialią grupę sudaro katalizatoriai, kurie veikia gyvuose organizmuose. Tokie katalizatoriai vadinami fermentais arba fermentais.
Fermentai (fermentai)– tai baltymų molekulės, kurios pagreitina cheminius procesus biologinėse sistemose (kūne yra apie 30 tūkst. įvairių fermentų, kiekvienas iš jų pagreitina atitinkamą reakciją).
Demonstracinė patirtis.
Katalizinis vandenilio peroksido skilimas
(diriguoja mokytojas)
2H 2 O 2 2H 2 O + O 2.
Į tris mėgintuvėlius supilama 5 ml farmacinio vandenilio peroksido tirpalo. Pirmasis mėgintuvėlis yra kontrolinis; palyginimui į antrąjį mėgintuvėlį pincetu įmetamas žalios mėsos gabalas, o į trečiąjį mėgintuvėlį įdedamas žalios morkos gabalas. „Virimas“ stebimas dviejuose mėgintuvėliuose, išskyrus pirmąjį. Į antrąjį ir trečiąjį mėgintuvėlius įvedamos rūkstančios atplaišos, kurios užsidega, nes išsiskiria deguonis. Mokytojas aiškina, kad vandenilio peroksido skaidymas vyksta be katalizatoriaus, bet daug lėčiau. Reakcija gali užtrukti kelis mėnesius. Greitos reakcijos kituose mėgintuvėliuose parodo fermento katalazės, esančios tiek augalų, tiek gyvūnų ląstelėse, darbą.
Katalazės fermento efektyvumą galima iliustruoti duomenimis apie H 2 O 2 skilimą vandeniniame tirpale.
Išsamiau apie fermentus išmokstama studijuojant 11 klasės chemijos kursą.
Nuolatinio dėmesio, gebėjimo stebėti patirtį, atlikti analizę ir daryti išvadas ugdymas prasideda demonstraciniu eksperimentu. Grupinio darbo forma leidžia efektyviai įgyti žinių, ugdant komandinio darbo jausmą.
Naudojant įrangos komplektą su kompiuteriniu matavimo bloku ir jutikliais (temperatūra, optinis tankis, elektrinis laidumas, pH lygis) žymiai išplečiamos parodomojo eksperimento galimybės, nes leidžia pažvelgti į proceso vidų, ko anksčiau negalėjome padaryti nagrinėdami šią temą tik teoriškai. Kiekybinių dėsnių tyrimas yra viena iš pagrindinių ir sudėtingiausių chemijos temų (žr. priedą Nr. 3 „Kiekybiniuose cheminiuose skaičiavimuose naudojami parametrai“).
Šioje pamokoje mus domina reakcijos parametrai. Ankstesnėse pamokose mokiniai susipažino su termodinaminiais parametrais, o medžiagos ir aplinkos parametrai bus tiriami kitose pamokose.
Pamokos santrauka, reflektyvi analizė
Mokytojas apibendrina pamoką. Mokiniai pildo mokinių darbų kontrolinius lapus, kuriuose nurodo savo klasę, pavardę, vardą, įvertina savo darbą pamokoje, grupinį darbą, temos supratimą („blogai“, „gerai“, „puikiai“).
Mokiniai atsako klausimus.
1. Su kokia nuotaika išeinate iš pamokos?
2. Kodėl pamoka įdomi kiekvienai grupei ir kiekvienam mokiniui?
3. Kuo ši pamoka jums naudinga?
4. Su kokiais sunkumais susidūrėte pamokoje?
Skirtingos klasės siūlo skirtingus klausimus. Iš patirties galime pasakyti, kad reflektavimo etape mokiniai pamoką vertina aukštai („5“, rečiau „4“), atkreipia dėmesį į pamokos neįprastumą, aiškumą, turtingumą, aukštą emocinį lygį, logiką, įdomumą. informacinė medžiaga. Svarbiausia pamokos technologija yra mokytojo ir mokinių bendradarbiavimas. Kartu pasiekiami bendri tikslai, mokiniai geriau įsisavina medžiagą, pritaiko įgytas žinias.
Namų darbai
Kartu su vadovėlio pastraipomis kiekviena grupė gauna individualią užduotį ištirti konkretaus veiksnio įtaką cheminės reakcijos greičiui.
1 užduotis. At t= 30 °C reakcija vyksta per 25 minutes, o esant t= 50 °C – per 4 minutes. Apskaičiuokite reakcijos temperatūros koeficientą.
2 užduotis. Aliuminio sąveika su chloru vyksta pagal lygtį:
2Al (kieta) + 3Cl 2 (g) = 2AlCl3 (kieta).
Pradinė chloro koncentracija yra 0,05 mol/l. Reakcijos greičio konstanta yra 0,2 l/(mol s).
Parašykite matematinę reakcijos greičio išraišką. Kaip pasikeičia reakcijos greitis, lyginant su pradiniu, jei slėgis sistemoje padidinamas 6 kartus?
3 užduotis. Dviejuose identiškuose induose buvo vykdomos skilimo reakcijos, susidarant deguoniui ir vandeniliui. Per 10 s pirmajame inde buvo gauta 22,4 litro O 2, o antrajame – 4 g H2. Kurios cheminės reakcijos greitis yra didžiausias? Kiek kartų?
4 užduotis. Pasiūlykite būdus, kaip padidinti reakcijos greitį 16 kartų, keičiant pradinių medžiagų koncentracijas:
a) 2Cu (kieta) + O 2 (g) = 2CuO (kieta);
b) 2H2 (g.) + O2 (g.) = 2H2O (g.).
Ypatinga pamokos ypatybė yra ta, kad joje pateikiama medžiaga, kuri peržengia vadovėlio ribas. Tai būtina tiek siekiant padidinti bendrą erudiciją, tiek būsimiems pretendentams. Papildoma medžiaga specializuotoje klasėje daugiausia paremta medžiaga iš stojamųjų egzaminų į įvairius universitetus.
Ugdymo technologijų tikslas – didinti ugdymo proceso efektyvumą. Bet kurioje technologijoje pagrindinis dalykas yra sutelkti dėmesį į studento asmenybę. Pedagoginės technologijos – tai visuma tarpusavyje susijusių priemonių, metodų ir procesų, reikalingų tikslingai paveikti asmenybės, turinčios tam tikras savybes, formavimąsi. Savo pamokose taikau į mokinį orientuotą metodą. Dėl to studentai gali sąmoningiau ir kūrybiškiau žiūrėti į medžiagos studijas. Būtent mokytojo ir mokinio bendradarbiavimo technologija yra svarbi siekiant aukštų rezultatų. Aktyvus pedagoginių technologijų elementų naudojimas klasėje prisideda prie mokinio motyvacinės sferos, intelekto, savarankiškumo ugdymo, gebėjimo kontroliuoti ir valdyti savo ugdomąją ir pažintinę veiklą.
Mano dalykas – chemija, bet dėstau ir žmogaus studijas. Naudodami naujus švietimo metodus galite kitaip pažvelgti į savo dalyką. Svarbiausia kiekviename mokinyje pamatyti žmogų.
Chemija yra mokslas apie medžiagas. Į medžiagų tyrimą žvelgiu ne tik iš jų praktinės reikšmės visuomenei, bet ir iš filosofinio pasaulio supratimo pozicijų. Chemijos ir žmogaus studijų pamokose parodau pasaulio ir žmogaus vientisumą, stengiuosi atskleisti vaikams gyvenimo begalybę ir harmoniją, ugdyti norą suprasti ir pažinti save, norą tobulėti, dirbti. sau, kad pagerintų savo gyvenimą. Džiaugiuosi vaikinų susidomėjimu šiomis problemomis. Ir manau, kad mums, mokytojams, būtų naudinga tai apmąstyti. Tik patys tobulėdami ir tobulėdami galime mokyti vaikus.
PRIEDAS Nr.1
Mokytojų ir mokinių problemų paieškos veiklos struktūra
apie medžiagų savybių ir cheminių reakcijų esmės tyrimą
(galimas informacinių technologijų naudojimas)

PRIEDAS Nr.2
Praktinis Arrhenius lygties panaudojimas1 pavyzdys. Svirplių pypsėjimo greitis (dažnis) paklūsta, nors ir ne visai griežtai, Arenijaus lygčiai, palaipsniui didėjant temperatūrų diapazone nuo 14,2 °C iki 27 °C, su efektyvia aktyvavimo energija. E a = 51 kJ/mol. Pagal čirškėjimo dažnį galima gana tiksliai nustatyti temperatūrą: reikia suskaičiuoti jų skaičių per 15 sekundžių ir pridėti 40, gaunama temperatūra Farenheito laipsniais (F) (amerikiečiai vis dar naudoja šią temperatūros skalę).
Taigi, esant 55 F (12,8 °C) čiulbėjimo dažnis yra 1 čiulbėjimas / s, o esant 100 F (37,8 °C) - 4 čiulbėjimai / s.
2 pavyzdys.
Temperatūros diapazone nuo 18 °C iki 34 °C jūros vėžlio pulsas atitinka Arrhenius lygtį, kuri suteikia aktyvacijos energiją.
E a = 76,6 kJ/mol, bet žemesnėje temperatūroje aktyvacijos energija smarkiai padidėja. Taip gali būti dėl to, kad esant žemai temperatūrai vėžlys nelabai gerai jaučiasi, o jo širdies ritmą ima kontroliuoti kitos biocheminės reakcijos.
3 pavyzdys.
Ypač įdomūs bandymai „priskirti Arrhenijaus priklausomybę“ nuo žmogaus psichologinių procesų. Taigi žmonių, kurių kūno temperatūra skirtinga (nuo 36,4 °C iki 39 °C), buvo paprašyta skaičiuoti sekundes. Paaiškėjo, kad kuo aukštesnė temperatūra, tuo greičiau skaičiuojama.
(E a = 100,4 kJ/mol). Taigi mūsų subjektyvus laiko pojūtis paklūsta Arrhenijaus lygčiai. Sociologinio tyrimo autorius G. Hoglandas teigė, kad taip yra dėl tam tikrų biocheminių procesų žmogaus smegenyse.
Vokiečių tyrinėtojas H. von Foerstleris išmatavo skirtingos temperatūros žmonių užmaršties greitį. Jis davė žmonėms skirtingų ženklų seką ir išmatavo laiką, per kurį žmonės prisiminė šią seką. Rezultatas buvo toks pat kaip Hoaglando: Arrhenius priklausomybė su E a = 100,4 kJ/mol.
Šie pavyzdžiai rodo, kad daugelis gamtoje vykstančių procesų, įskaitant psichologinius, paklūsta Arrhenijaus lygčiai su gana didele aktyvavimo energija. E A. Šis paskutinis punktas yra ypač svarbus, nes E o fizikiniai procesai (pavyzdžiui, klampus skysčio srautas) paprastai neviršija 20 kJ/mol. Didelė aktyvavimo energija paprastai reiškia, kad cheminiai ryšiai nutrūksta. Taigi visuose aptartuose pavyzdžiuose neabejotinai vyksta tikros cheminės reakcijos (akivaizdžiai fermentinės).
PRIEDAS Nr.3
Perėjimo iš vienos fazės į kitą proceso pusiausvyra nekeičiant cheminės sudėties vadinama fazių pusiausvyra. Fazių pusiausvyros pavyzdžiai gali būti šie procesai:
garinimas
![]()
Fazių pusiausvyrai laikomasi Le Chatelier principo.
Kylant temperatūrai, pusiausvyra pereina link endoterminio proceso, pvz., lydymosi ir garavimo. Didėjant slėgiui, pusiausvyra pereina į procesus, kurių metu dujos ar garai virsta skysta arba kieta būsena.
Fazės taisyklė.
Suformulavo J. Gibbsas. Laisvės laipsnių skaičius C , fazės F , nepriklausomi komponentai KAM ir išorines sąlygas n , turinčios įtakos pusiausvyrai, yra tarpusavyje susiję santykiais:
C+ F = K + n
2.4. Cheminių reakcijų mechanizmas. Grandininės reakcijos. Fotocheminiai procesai. Homogeninė ir nevienalytė katalizė. Autokatalizė. Fermentų katalizė. Kataliziniai nuodai. Virpesių reakcijos.
Aktyvinimo energija. Reakcijos energinis profilis.
Reakcijos atsiranda dėl tiesioginio molekulių susidūrimo. Tačiau ne visi susidūrimai baigiasi chemine reakcija. Naujų medžiagų susidarymą palengvina tik molekulės, kurios turi pakankamai energijos. Tokios molekulės vadinamos aktyviosiomis molekulėmis.
Minimali energija, kurios pakanka cheminei reakcijai pradėti, vadinama aktyvacijos energija ir išreiškiama kcal arba kJ. Kuo mažesnė aktyvinimo energija, tuo greičiau vyksta reakcija.
Reakcijose, kurių aktyvacijos energija yra didesnė nei 150 kJ esant t=25°C, greitis yra labai mažas arba šios reakcijos praktiškai nevyksta. Reakcijose, kuriose aktyvavimo energija yra mažesnė nei 60 kJ, greitis yra labai didelis (sprogimas).
Aktyvinimo energija Ea priklauso nuo reaguojančių elementų pobūdžio ir yra kiekvienos reakcijos charakteristika.

Reakcijos su susidarymu energinė diagrama
aktyvuotas kompleksas.
Kad reagentai A ir B sudarytų reakcijos produktus C ir D, jie turi įveikti energijos barjerą ML. Tam reikia aktyvinimo energijos Ea. Šiuo atveju reakcijos metu iš įgyvendinančių medžiagų dalelių susidaro tarpinė nestabili grupė - aktyvuotas kompleksas (2.6 pav.).
Šis kompleksas suyra ir susidaro galutiniai produktai, ir išsiskiria toks energijos kiekis, kuris leidžia galutiniams produktams nusileisti iki galutinių produktų vidutinės energijos lygio.
Tai. produktų pokytis gali būti išreikštas diagramomis, skirtomis endoterminėms ir egzoterminėms reakcijoms (2.7, 2.8 pav.).


struktūrinė schema
egzoterminė reakcija
struktūrinė schema
endoterminė reakcija
APIE  Paprastai reakcijos tarp medžiagų, turinčių stiprius kovalentinius ryšius, pasižymi didelėmis Ea reikšmėmis ir vyksta lėtai. Tai taikoma daugeliui sąveikų, pvz
Paprastai reakcijos tarp medžiagų, turinčių stiprius kovalentinius ryšius, pasižymi didelėmis Ea reikšmėmis ir vyksta lėtai. Tai taikoma daugeliui sąveikų, pvz
kurio greitis standartinėmis sąlygomis yra 0.
M  joninės sąveikos tirpaluose pasižymi mažomis Ea reikšmėmis ir labai dideliais greičiais
joninės sąveikos tirpaluose pasižymi mažomis Ea reikšmėmis ir labai dideliais greičiais
Reakcijos energinis profilis. A + B = AB (be katalizatoriaus) A + B + K? + B? ? AB + K (su kat.).
45 pav. iš pristatymo „Cheminės reakcijos greitis“ chemijos pamokoms tema „Reakcijos“Matmenys: 1280 x 800 pikselių, formatas: jpg. Norėdami atsisiųsti nemokamą paveikslėlį chemijos pamokai, dešiniuoju pelės mygtuku spustelėkite paveikslėlį ir spustelėkite „Išsaugoti vaizdą kaip...“. Norėdami pamokoje rodyti paveikslėlius, taip pat galite nemokamai atsisiųsti visą pristatymą „Cheminės reakcijos greitis.ppt“ su visomis nuotraukomis zip archyve. Archyvo dydis yra 129 KB.
Parsisiųsti prezentacijąReakcijos
„Cheminės lygtys“ - 7 Н2SO4. Medžiagų masės tvermės dėsnis. Ca + O2 CaO. Tema: Medžiagų pokyčiai. Cheminių reakcijų atsiradimo požymiai ir sąlygos. PRISIMINTI! Cheminės lygtys. Šiuolaikinė įstatymo redakcija: 1756 m
„Elektrolitinė druskų disociacija“ – Druskų panaudojimas. Fenolftaleino tirpalas Užrašykite galimų reakcijų molekulines ir jonines lygtis. Cheminės druskų savybės. 1. Metalas + druska 2. Druska + šarmas 3. Druska + rūgštis 4. Druska + druska. 3 užduotis. Su kuria iš šių medžiagų reaguoja natrio hidroksido tirpalas? NaOH, Ba(OH)2, NH4OH, Al(OH)3.
„Cheminių reakcijų lygtys“ - D/Z 1) išstudijuokite tekstą § 26 2) atlikite rašytinius pratimus Nr. 1-3. Tikslo nustatymas. 2) Peržiūrėkite mokinių pristatymus apie vandens valymą namuose. Anglies dioksido susidarymas sąveikaujant sodai ir rūgščiai. Vandenilio atomas. 4. Peržiūrėkite mokinių pristatymus pasirinktomis temomis. m1. Grupinio darbo informacinė medžiaga.
„Cheminės reakcijos greitis“ - t1. dCB dt. Cheminės reakcijos greitis. a A. Cheminė kinetika. dc dt. Procesų klasifikavimas pagal fazės sudėtį. V a) n=0 v b) n=1 v c) n>1. Grandinė – neišsišakoję rajonai. C1. Grafinis n apibrėžimas. Paskaitos planas. Grandininės – šakotos reakcijos. Sudėtingos reakcijos kinetinė lygtis.
„Medžiagų reakcijos“ – Medžiagų klasifikavimas pagal sudėtį: Pamokų fragmentų nuotraukos naudojant interaktyvią lentą. N2. 10 klasė „Angliavandeniai“. Kokios medžiagos aptariamos ištraukoje iš S. Ščipačiovo eilėraščio „Skaitantis Mendelejevą“? Parašykite aliuminio sulfato gamybos reakcijų lygtis. 4 užduotis. Užduotis Nr.7. Cinabero gyvsidabrio (ii) sulfidas.
„Cheminių reakcijų tipai“ – visas reakcijas lydi šiluminis poveikis. Cheminių reakcijų rūšys. Cheminės reakcijos vyksta: maišant ar fiziškai kontaktuojant su reagentais, savaime, kai kaitinama dalyvaujant katalizatoriams, veikiant šviesai, elektros srovei, mechaniniam veikimui ir tt Karpukhina Irina Stepanovna Chemijos mokytoja MBOU vidurinė mokykla Nr. 32 Novosibirsko miestas.
Iš viso yra 28 pristatymai
Entalpijos pokytis DH iš esmės yra reagentų ir produktų ryšių energijos skirtumas, įskaitant konjugacijos, įtampos ir tirpimo energijas. DH galima apskaičiuoti susumavus visų reakcijos metu nutrūkusių ryšių energijas ir iš jų atėmus visų susidariusių ryšių energijų sumą, pridedant visus konjugacijos, įtempimo ir solvacijos energijų pokyčius. Be to, entalpijos pokytį galima nustatyti eksperimentiniu būdu, matuojant reakcijos terminį efektą, nes entalpijos pokytis lygus reakcijos terminiam efektui, paimtam su priešingu ženklu.
- DH=Qр
Entropijos pokytis DS apibūdina sistemos netvarkos laipsnį. Organinėje chemijoje šis veiksnys retai vaidina svarbų vaidmenį, nes reakcijos vyksta santykinai žemoje temperatūroje, kurioje entropijos koeficientas mažas. Tačiau kai kuriais atvejais entropijos pokytis gali atlikti svarbų vaidmenį:
· kadangi dujos turi didesnę entropiją nei skysčiai (net daugiau nei kietos), tai bet kokia reakcija, kurios metu pradinės medžiagos yra skystos arba kietos, o vienas ar keli produktai yra dujiniai, yra termodinamiškai palanki, nes didėja sistemos entropija;
· jeigu reakcijos metu produktų molekulių susidaro daugiau nei pradinių medžiagų molekulių, tai reakcija vyksta didėjant entropijai.
Neigiama DG vertė savaime nereiškia, kad reakcija įvyks per numatytą laikotarpį. Neigiamas laisvosios energijos pokytis yra būtinas, bet nepakankamas veiksnys spontaniškai cheminei reakcijai įvykti. Pavyzdžiui, dviejų molių vandenilio reakcijai su vienu moliu deguonies, dėl kurios susidaro vanduo, būdingas didelis neigiamas laisvosios energijos pokytis. Tačiau O 2 ir H 2 mišinys gali būti laikomas kambario temperatūroje dešimtmečius be jokių cheminės reakcijos požymių.
Organinių reakcijų mechanizmai
Norint suprasti organines reakcijas, labai praverčia žinios apie jų mechanizmus.
Reakcijos mechanizmas – išsamus pradinių junginių pavertimo produktais proceso aprašymas. Mechanizmas apima duomenis apie ryšio skilimo ir susidarymo būdą ir seką, tarpinių produktų (tarpinių produktų) struktūrą, kinetiką, termodinamiką ir reakcijos stereochemiją. Mechanizmas neturėtų prieštarauti esamiems eksperimentiniams faktams, o kai atsiranda naujų, paaiškinkite ir juos.
Svarstant subtilias mechanizmų ypatybes itin pravartu pasinaudoti vadinamuoju energijos diagrama (energetinis profilis) reakcijos. Tai yra grafinė sistemos energijos priklausomybė nuo sudėtingos atstumo tarp reaguojančių medžiagų funkcijos, kuri paprastai vadinama " reakcijos koordinatės" arba " reakcijos progresas“ (3.1 pav.).
Ryžiai. 3.1. Energijos diagrama: A – endo-, B – egzoterminė reakcija.
Šis paveikslas iliustruoja vienos pakopos reakcijų atsiradimą. Endoterminė reakcija apima šilumos sugėrimą, o egzoterminė – šilumos išsiskyrimą.
Beveik visos cheminės reakcijos įvyksta susidūrus dviem ar daugiau, labai retai reaguojančių dalelių. Iš pav. 3.1 aišku, kad reaguojančių molekulių požiūris padidina sistemos energiją iki tam tikro maksimumo. Susidūrimai bus veiksmingi, kai reaguojančios medžiagos turės šiek tiek energijos pertekliaus, palyginti su vidutine sistemos molekulių energija. Tokio energijos pertekliaus neturinčios dalelės po susidūrimo išsisklaido įvairiomis kryptimis. Aktyvinimo energija- energijos perteklius, reikalingas energijos barjerui įveikti. Didžiausia sistemos energija (aukščiausias energijos diagramos taškas) atitinka pereinamoji būsena (aktyvuotas kompleksas). Būtent pereinamosios būsenos buvimas paaiškina priežastį, kad net egzoterminės reakcijos dažniausiai nevyksta savaime, o tik kaitinant ar kitomis priemonėmis aktyvuojant sistemą.
Būtent pereinamoji būsena – aukščiausias reakcijos energijos taškas – nulemia visos transformacijos eigą. Žinios apie jo struktūrą gali išsiaiškinti cheminės transformacijos mechanizmą. Tačiau aktyvuoto komplekso gyvavimo laikas yra toks trumpas, kad nėra fizinių metodų jį užregistruoti ir, atitinkamai, gauti žinių apie jo struktūrą.
J. Hammondo postulatas
Norėdami netiesiogiai įvertinti pereinamosios būsenos struktūrą, naudokite J. Hammondo postulatas (1955 m.): nedidelius energijos pokyčius lydi nedideli molekulinės struktūros pokyčiai. Aiškesnė formuluotė: pereinamosios būsenos struktūra panaši į tų medžiagų, kurioms ji yra artimesnė energija, struktūrą. Egzoterminėse reakcijose pereinamoji būsena savo struktūra artimesnė pradiniams reagentams (3.1 pav.). Šis aktyvuotas kompleksas vadinamas ankstyva pereinamoji būsena. Pereinamoji būsena endoterminėse reakcijose yra artimesnė reakcijos produktams; ji vadinama vėlai. Panašus poveikis panašioms struktūroms lemia panašius rezultatus. Todėl viskas stabilizuojantys veiksniai(mažina energijos būsenas) energetiškai arti pereinamosios būsenos pradinis, tarpinis arba galutinis medžiaga, sumažina aktyvuoto komplekso energiją.
Hammondo postulato naudojimas ypač naudingas svarstant daugiapakopes reakcijas (3.2 pav.).
 |
3.2 pav. Dviejų pakopų reakcijos energijos diagrama
Iš 3.2 paveikslo matyti, kad reakcija vyksta dviem etapais per vieną tarpinį produktą. Produktų pavertimas tarpiniais produktais (pirmas etapas) yra svarbesnis visai reakcijai nei tarpinių produktų pavertimas reakcijos produktais (antrasis etapas). Tai patvirtina atitinkamos pirmosios ir antrosios pakopos aktyvinimo energijos (atitinkamai Ea 1 ir Ea 2). Visą reakcijos eigą lemia aukščiausias jos energijos taškas – pirmosios pakopos pereinamoji būsena [PS 1]. Jei šiai reakcijai pritaikysime Hamondo postulatą, nesunku daryti išvadą, kad tarpinis produktas yra energetiškai arčiausiai abiejų reakcijos etapų pereinamųjų būsenų.
S. Arrhenius atrado daugelio reakcijų greičio priklausomybę nuo temperatūros, kurią galima apibūdinti lygtimi:
k = A e - E* / RT
Kur k - greičio konstanta, e - natūraliųjų logaritmų bazė, R - universali dujų konstanta, T - temperatūra, A - ikieksponentinis koeficientas, E* - reakcijos aktyvavimo energija.
aktyvaus susidūrimo teorija(susidūrimai)
1) Cheminė sąveika tarp molekulių įmanoma tik tada, kai jos susiduria.
2) Ne kiekvienas molekulių susidūrimas sukelia cheminę sąveiką, tai yra, ji yra veiksminga arba, Arrhenijaus terminologija, aktyvi. Yra tam tikras energetinis barjeras, kurią įveikti ir sąveikauti gali tik dalis molekulių, ir, kaip taisyklė, tai yra labai maža jų bendro skaičiaus sistemoje dalis.
3) Energetinio barjero egzistavimo priežastis yra abipusis molekulių elektronų apvalkalų atstūmimas, kai jie artėja vienas prie kito.
4) Kad molekulės susidūrimo metu įveiktų energijos barjerą, jos turi judėti viena link kitos pakankamai dideliu greičiu. Norint pasiekti šį reikiamą greitį, reikia tam tikros energijos, vadinamos aktyvavimo energija. Aktyvinimo energija E* - tai aktyvių molekulių energijos perteklius, palyginti su neaktyviomis, arba kitaip, energija, kurią turi turėti molekulės, kad galėtų sąveikauti. Aktyvinimo energijos SI matmuo yra J/mol.
5) Kuo didesnė reakcijos aktyvavimo energija, tuo didesnis energijos barjeras, ir tuo mažiau molekulių sugeba ją įveikti. Todėl tuo daugiau E* , tuo reakcija vyksta lėčiau.
6) Kylant temperatūrai, didėja molekulių šiluminio judėjimo greitis, todėl didėja aktyvių molekulių dalis. Kitaip tariant, kylant temperatūrai, terminis aktyvinimas, todėl padidėja reakcijos greitis.
reakcijos aktyvavimo energijos apskaičiavimas pagal dviejų greičio konstantų vertes skirtingose temperatūrose:
T 2 – T 1 k 1
Suaktyvintas kompleksas yra nestabilus darinys, apimantis visus susidūrusių ir sąveikaujančių molekulių atomus. Aktyvuoto komplekso tarnavimo laikas yra labai trumpas; jis matuojamas mažomis (milijoninėmis, dešimtimis milijoninėmis ir kt.) sekundės dalimis. Atstumai tarp atomų aktyvuotame komplekse yra kiek didesni nei įprastose molekulėse, todėl jo susidarymui reikia papildomos energijos.
Gali duoti vaizdinį reakcijos eigos vaizdą laikui bėgant pagal pereinamosios būsenos teoriją energetinis profilis reakcija, pvz., egzoterminė (12.6 pav.).
Sistemos energija brėžiama išilgai ordinačių ašies E , o x ašis yra vadinamoji reakcijos koordinatė. Vidutinis pradinių medžiagų molekulių šiluminio judėjimo energijos rezervas atitinka lygį E ref, aktyvuotame komplekse sukaupta energija – lygis E AK. Tada skirtumas E AK - E ref yra lygus energijos barjero, kurį molekulės turi įveikti, kad galėtų sąveikauti, vertei (aktyvacijos energija). Vizualinį jo vaizdą suteikia lygius jungianti kreivė E ref ir E AK. Energetinio barjero aukštis priklauso nuo reaguojančių medžiagų pobūdžio, energijos, reikalingos aktyvuotam kompleksui susidaryti (aktyvacijos energija), taip pat nuo molekulių šiluminio judėjimo vidutinės energijos. E ref.
Kylant temperatūrai, lygis E ref pakyla, energijos barjeras tampa mažesnis ir gali sąveikauti didesnis skaičius molekulių. Tai yra priežastis, kodėl reakcija greitėja didėjant temperatūrai. Kai temperatūra mažėja, priešingai, lygis E ref mažėja, o energijos barjeras didėja, todėl sumažėja reakcijos greitis.
Aktyvuoto komplekso skilimo metu susidarant produkto molekulėms išsiskiria energija, kuri atitinka skirtumą E AK - E prod, kur E prod – vidutinis produkto molekulių energijos rezervas. Dalis šios išleistos energijos lygi skirtumui E AK - E ref bus naudojamas aktyvuoti naujas pradinių medžiagų molekules ir perteklių E nuorod. - E produktas bus išleistas į aplinką egzoterminio terminio reakcijos pavidalu DH r .
Endoterminių reakcijų energijos profilis atrodo šiek tiek kitoks (12.7 pav.). Matyti, kad šiuo atveju energijos lygis E ref žemesnis už lygį E tęsinys Dėl šios energijos E AK - E aktyvuoto komplekso irimo metu išsiskiriančio produkto nepakanka
sukelti naujų reaguojančių molekulių aktyvavimą. Todėl norint tęsti reakciją, reikia tiekti energiją iš išorės, endoterminio šiluminio efekto pavidalu.
Aktyvuoto komplekso egzistavimą patvirtina eksperimentiniai duomenys. Pavyzdžiui, vienai iš paprastų vandenilio atomo sąveikos su vandenilio molekule modelio reakcijų
Н 2 + Н ® Н + Н 2 ,
aktyvacijos energijos vertė yra artima 36,8 kJ/mol. Jei reakcija vyktų per visiško H 2 molekulių disociacijos etapą, o ne per aktyvuoto komplekso H 2 ·H susidarymo etapą, tuomet reikėtų 435,1 kJ/mol aktyvacijos energijos.
55. fotochemija. Fotocheminės reakcijos. Pagrindiniai fotochemijos dėsniai (Grotthuso-Draperio dėsnis, Bunseno-Roscoe dėsnis, Starko-Einšteino dėsnis).
fotochemija Tai cheminės kinetikos šaka, nagrinėjanti elektroniniu būdu sužadintų molekulių elgseną .
Biologijoje yra žinomi keli fotocheminiai procesai, kurie yra nepaprastai svarbūs tiek atskirų organizmų, tiek visos biosferos gyvenimui. Visų pirma, tarp tokių procesų turėtume įvardinti fotosintezė Be to, nepaprastai svarbi yra regėjimo fotochemija, vitaminų sintezės fotochemija, pavyzdžiui, vitamino D žmogaus odoje, įdegio fotochemija ir kt.
Fotocheminė sidabro halogenidų skilimo reakcija yra fotografavimo proceso pagrindas. Yra fotochrominių medžiagų, kurios gali pakeisti spalvą arba skaidrumą veikiant šviesai, kurios ypač naudojamos fotocheminiam informacijos įrašymui arba saulės akinių gamybai. Fotocheminės reakcijos taip pat naudojamos chemijos pramonėje, pavyzdžiui, kaprolaktamo sintezėje arba metilmetakrilato fotopolimerizacijoje organinio stiklo gamyboje.
Farmacijai fotocheminės reakcijos yra svarbios visų pirma tiek, kiek šviesa gali sukelti sunaikinimą ( fotolizė) daug vaistų. Daugelis kitų medžiagų ir medžiagų taip pat suyra veikiant šviesai – mediena, popierius, dažai, plastikai ir kt.
Chemijoje plačiai taikomas liuminescencinis analizės metodas, pagrįstas tiriamų medžiagų sužadintų molekulių skleidžiamos spinduliuotės spektrų tyrimu.
Fotochemijos dėsniai
Yra žinomi šie fotochemijos dėsniai:
Grotthuso-Draperio įstatymas(K.I.D. Grotthusas – 1818 m.; J. W. Draperis – 1842 m.).