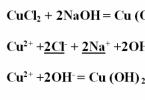Переважна більшість реакцій, з якими нам доведеться стикатися щодо властивостей окремих елементів та їх сполук, протікає в розчинах електролітів між їх іонами. Тому дуже важливо опанувати техніку складання іонних рівнянь.
У попередньому параграфі детально розібрали типові приклади іонних реакцій. На підставі всього сказаного там про іонні рівняння можна рекомендувати наступний порядок їх складання:
1.Написати рівняння реакції у молекулярній формі.
2.Переписати ж рівняння, залишивши нерозчинні чи слабо дисоціюючі як молекул і записавши решту як іонів, куди вони дисоциируют.
3.Виключити іони, які беруть участь у реакції, т. е. які у лівої і правої частинах рівняння у рівній кількості.
Для закріплення у пам'яті цих прийомів наведемо два приклади складання іонних рівнянь.
приклад1. Складання іонного рівняння реакції між сірководнем (слабка кислота) та сірчанокислою міддю:
1) CuSO 4 + H 2 S = CuS + H 2 SO 4
2) Су + SO 4 » + H 2 S = CuS + 2H + SO 4 »
3) Cu + H 2 S = CuS + 2H
приклад2. Складання іонного рівняння реакції між гідратом окису свинцю та соляною кислотою:
1) Рb(ОН) 2 + 2НСl = РЬСl 2 + 2Н 2 O
2) Pb(OH) 2 + 2H + 2Cl' = РbСl 2 + 2Н 2 O
З останнього- рівняння нічого не можна виключити, оскільки обидва іони - Н і Сl' беруть участь у реакції.
При деякому навичці можна відразу складати, минаючи першу і другу стадії. Для цього треба тільки ясно уявляти собі: а) утворення якого зумовлює перебіг цієї реакції; б) чи є необхідні для його утворення іони в готовому вигляді в розчині або вони утворюються в процесі реакції з молекул слабо дисоціюючих або важко розчинних речовин. У цьому випадку зручніше починати складання рівняння з другої його половини, тобто перш за все написати формулу речовини, що утворюється, потім ті іони або іони і молекули, які необхідні для його утворення, нарешті, іони, що виходять в результаті реакції. Після цього потрібно підібрати коефіцієнти.
Для складання іонних рівнянь необхідно знати, які солі розчиняються у воді та які практично нерозчинні. Деякі загальні дані про розчинність у воді найважливіших солей найбільш поширених металів наведено в табл. 14.
Таблиця 14
Ви читаєте, стаття на тему Складання іонних рівнянь
| Найменування параметру | Значення |
| Тема статті: | Іонні рівняння |
| Рубрика (тематична категорія) | Метали та Зварювання |
Більшість хімічних реакцій протікає у розчинах. Розчини електролітів містять іони, у зв'язку з цим реакції та розчини електролітів фактично зводяться до реакцій між іонами. Реакції між іонами називають іонними реакціями, а рівняння таких реакцій – іонними рівняннями. При складанні іонних рівняннях слід керуватися тим, що формули речовин малодисоціюючих, нерозчинних і газоподібних записуються в молекулярному вигляді.
Біла речовина випадає в осад, то поряд з її формулою ставлять стрілку, спрямовану вниз, а якщо в ході реакції виділяється газоподібна речовина, то поряд з формулою ставлять стрілку, спрямовану вгору.
Перепишемо це рівняння, зобразивши сильні електроліти у вигляді іонів, а реакції, що йдуть зі сфери, - у вигляді молекул:
Ми записали таким чином повне іонне рівняння реакції.
Якщо виключити з обох частин рівності однакові іони, тобто не беруть участь у реакції в лівій і правій часто рівняння), то отримаємо скорочене іонне рівняння реакції:
Τᴀᴋᴎᴎᴩᴀᴈᴏᴍ, скорочені іонні рівняння являють собоюрівняння в загальному вигляді, які характеризують сутність хімічної реакції показують, які іони реагують і яка речовина утворюється в результаті.
Реакції іонного обміну протікають остаточно у випадках, коли утворюється або осад, або малодиссоциирующее речовина, наприклад вода. Біля до розчину гідроксиду натрію, забарвленого фенолфталеїном у малиновий колір, прилити надлишок розчину азотної кислоти, то розчин знебарвиться, що послужить сигналом протікання хімічної реакції:
Воно показує, що взаємодія сильної кислоти та лугу зводиться до взаємодії іонів Н+ та іонів ВІН -, в результаті якого утворюється речовина, що малодисоцтує, - вода.
Зазначена реакція взаємодії сильної кислоти з лугом називається реакцією нейтралізації. Це окремий випадок реакції обміну.
Подібна реакція обміну може протікати не тільки між кислотами та лугами, а й між кислотами та нерозчинними основами. Наприклад, якщо отримати блакитний осад нерозчинного гідроксиду міді (II) взаємодією сульфату міді II з лугом:
а потім поділити отриманий осад на три частини і прилити до осаду в першій пробірці розчин сірчаної кислоти, осад в другій пробірці розчин соляної кислоти, а до осаду в третій пробірці розчин азотної кислоти, то у всіх трьох пробірках осад розчиниться. Це означатиме, що у всіх випадках пройшла хімічна реакція, суть якої і відображена за допомогою одного й того ж іонного рівняння.
Щоб переконатися в цьому, запишіть молекулярні, повні та скорочені іонні рівняння наведених реакцій.
Розглянемо іонні реакції, які протікають із утворенням газу. У дві пробірки наллємо по 2 мл розчинів карбонату натрію та карбонату калію. Далі в першу прилив розчин соляної, а в другу - азотної кислоти. В обох випадках ми помітимо характерне "закипання" через вуглекислий газ, що виділяється. Запишемо рівняння реакцій для першого випадку:
Реакції, що протікають у розчинах електролітів, описуються за допомогою іонних рівнянь. Ці реакції називав реакціями іонного обміну, оскільки у розчинах електроліти обмінюються своїми іонами. Τᴀᴋᴎᴎᴎᴈᴈᴏᴍ, можна зробити два висновки. 1. Реакції у водних розчинах електролітів є реакціями між іонами, тому зображуються у вигляді іонних рівнянь. Вони простіше молекулярних і мають більш загальний характер.
2. Реакції іонного обміну в розчинах електролітів практично незворотно протікають тільки в тому випадку, якщо у результаті утворюється осад, газ або малодисоціююча речовина.
7. Комплексні з'єднання
Іонні рівняння - поняття та види. Класифікація та особливості категорії "Іонні рівняння" 2017, 2018.
Досить часто школярам та студентам доводиться складати т.з. іонні рівняння реакцій. Зокрема, саме цій темі присвячено завдання 31, що пропонується на ЄДІ з хімії. У цій статті детально обговоримо алгоритм написання коротких і повних іонних рівнянь, розберемо багато прикладів різного рівня складності.
Навіщо потрібні іонні рівняння
Нагадаю, що при розчиненні багатьох речовин у воді (і не лише у воді!) відбувається процес дисоціації – речовини розпадаються на іони. Наприклад, молекули HCl у водному середовищі дисоціюють на катіони водню (H + , точніше, H 3 O +) та аніони хлору (Cl -). Бромід натрію (NaBr) перебуває у водному розчині над вигляді молекул, а вигляді гідратованих іонів Na + і Br - (до речі, у твердому броміді натрію теж є іони).
Записуючи " звичайні " (молекулярні) рівняння, ми враховуємо, що у реакцію вступають не молекули, а іони. Ось, наприклад, як виглядає рівняння реакції між соляною кислотою та гідроксидом натрію:
HCl + NaOH = NaCl + H 2 O. (1)
Вочевидь, ця схема не дуже чітко визначає процес. Як ми вже сказали, у водному розчині практично немає молекул HCl, а є іони H + та Cl - . Так само справи і з NaOH. Правильніше було б записати таке:
H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O. (2)
Це і є повне іонне рівняння. Замість "віртуальних" молекул ми бачимо частки, які реально присутні в розчині (катіони та аніони). Не будемо поки що зупинятися на питанні, чому H2O ми записали в молекулярній формі. Трохи згодом це буде пояснено. Як бачите, немає нічого складного: ми замінили молекули іонами, які утворюються за їхньої дисоціації.
Втім, навіть повне іонне рівняння не є бездоганним. Дійсно, придивіться уважніше: і в лівій, і в правій частинах рівняння (2) присутні однакові частинки - катіони Na + та аніони Cl -. У процесі реакції ці іони не змінюються. Навіщо вони взагалі потрібні? Приберемо їх та отримаємо коротке іонне рівняння:
H + + OH - = H 2 O. (3)
Як бачите, все зводиться до взаємодії іонів H+ та OH – з утворенням води (реакція нейтралізації).
Всі, повне та коротке іонні рівняння записані. Якби ми вирішували завдання 31 на ЄДІ з хімії, то отримали б за неї максимальну оцінку – 2 бали.
Отже, ще раз про термінологію:
- HCl + NaOH = NaCl + H 2 O - молекулярне рівняння ("звичайне" рівняння, що схематично відображає суть реакції);
- H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O - повне іонне рівняння (видні реальні частинки, що знаходяться в розчині);
- H + + OH - = H 2 O - коротке іонне рівняння (ми прибрали все "сміття" - частки, які не беруть участь у процесі).
Алгоритм написання іонних рівнянь
- Складаємо молекулярне рівняння реакції.
- Усі частинки, що дисоціюють у розчині у відчутній мірі, записуємо у вигляді іонів; речовини, які не схильні до дисоціації, залишаємо "у вигляді молекул".
- Забираємо з двох частин рівняння т.з. іони-спостерігачі, т. е. частки, які беруть участь у процесі.
- Перевіряємо коефіцієнти та отримуємо остаточну відповідь – коротке іонне рівняння.
Приклад 1. Складіть повне та коротке іонні рівняння, що описують взаємодію водних розчинів хлориду барію та сульфату натрію.
Рішення. Діятимемо відповідно до запропонованого алгоритму. Складемо спочатку молекулярне рівняння. Хлорид барію та сульфат натрію – це дві солі. Заглянемо у розділ довідника "Властивості неорганічних сполук". Бачимо, що солі можуть взаємодіяти один з одним, якщо під час реакції утворюється осад. Перевіримо:
Вправа 2. Доповніть рівняння наступних реакцій:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3) 2 =
- Zn + FeCl 2 =
Вправа 3. Напишіть молекулярні рівняння реакцій (у водному розчині) між: а) карбонатом натрію та азотною кислотою; б) хлоридом нікелю (II) та гідроксидом натрію; в) ортофосфорною кислотою та гідроксидом кальцію; г) нітратом срібла та хлоридом калію; (V) та гідроксидом калію.
Щиро сподіваюся, що у вас не виникло проблем із виконанням цих трьох завдань. Якщо це не так, необхідно повернутись до теми "Хімічні властивості основних класів неорганічних сполук".
Як перетворити молекулярне рівняння на повне іонне рівняння
Починається найцікавіше. Ми повинні зрозуміти, які речовини слід записувати у вигляді іонів, а які залишити в "молекулярній формі". Доведеться запам'ятати таке.
У вигляді іонів записують:
- розчинні солі (наголошую, тільки солі добре розчинні у воді);
- луги (нагадаю, що лугами називають розчинні у воді основи, але не NH 4 OH);
- сильні кислоти (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 ...).
Як бачите, запам'ятати цей список зовсім нескладно: до нього входять сильні кислоти та основи та всі розчинні солі. До речі, особливо пильним юним хімікам, яких може обурити той факт, що сильні електроліти (нерозчинні солі) не увійшли до цього переліку, можу повідомити таке: НЕвключення нерозчинних солей у цей список не відкидає того, що вони є сильними електролітами.
Всі інші речовини повинні бути присутніми в іонних рівняннях у вигляді молекул. Тим вимогливим читачам, яких не влаштовує розпливчастий термін "всі інші речовини", і які, наслідуючи приклад героя відомого фільму, вимагають "оголосити повний список" даю таку інформацію.
У вигляді молекул записують:
- всі нерозчинні солі;
- всі слабкі підстави (включаючи нерозчинні гідроксиди, NH 4 OH та подібні до нього речовини);
- всі слабкі кислоти (H 2 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практично всі органічні кислоти ...);
- взагалі, всі слабкі електроліти (включаючи воду!);
- оксиди (всіх типів);
- всі газоподібні сполуки (зокрема, H 2 , CO 2 , SO 2 H 2 S, CO);
- прості речовини (метали та неметали);
- Майже всі органічні сполуки (виняток - розчинні у питній воді солі органічних кислот).
Уф-ф, здається, я нічого не забув! Хоча простіше, на мою думку, все ж таки запам'ятати список N 1. З принципово важливого у списку N 2 ще раз відзначу воду.
Давайте тренуватись!
Приклад 2. Складіть повне іонне рівняння, що описують взаємодію гідроксиду міді (II) та соляної кислоти.
Рішення. Почнемо, звісно, з молекулярного рівняння. Гідроксид міді (II) - нерозчинна основа. Усі нерозчинні основи реагують із сильними кислотами з утворенням солі та води:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
Нині ж з'ясовуємо, які речовини записувати як іонів, які - як молекул. Нам допоможуть наведені вище списки. Гідроксид міді (II) - нерозчинна основа (див. таблицю розчинності), слабкий електроліт. Нерозчинні основи записують у молекулярній формі. HCl - сильна кислота, що в розчині практично повністю дисоціює на іони. CuCl 2 – розчинна сіль. Записуємо в іонній формі. Вода – лише у вигляді молекул! Отримуємо повне іонне рівняння:
Сu(OH) 2 + 2H + + 2Cl - = Cu 2+ + 2Cl - + 2H 2 O.
Приклад 3. Складіть повне іонне рівняння реакції діоксиду вуглецю з водним розчином NaOH.
Рішення. Діоксид вуглецю – типовий кислотний оксид, NaOH – луг. При взаємодії кислотних оксидів з водними розчинами лугів утворюються сіль та вода. Складаємо молекулярне рівняння реакції (не забувайте, до речі, про коефіцієнти):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 - оксид, газоподібне з'єднання; зберігаємо молекулярну форму. NaOH - сильна основа (луг); записуємо у вигляді іонів. Na 2 CO 3 - розчинна сіль; пишемо як іонів. Вода – слабкий електроліт, що практично не дисоціює; залишаємо у молекулярній формі. Отримуємо таке:
З 2 + 2Na + + 2OH - = Na 2+ + CO 3 2- + H 2 O.
Приклад 4. Сульфід натрію у водному розчині реагує з хлоридом цинку з утворенням осаду. Складіть повне іонне рівняння цієї реакції.
Рішення. Сульфід натрію та хлорид цинку – це солі. При взаємодії цих солей випадає осад сульфіду цинку:
Na 2 S + ZnCl 2 = ZnS ↓ + 2NaCl.
Я відразу запишу повне іонне рівняння, а ви самостійно проаналізуєте його:
2Na + + S 2- + Zn 2+ + 2Cl - = ZnS↓ + 2Na + + 2Cl - .
Пропоную вам кілька завдань для самостійної роботи та невеликий тест.
Вправа 4. Складіть молекулярні та повні іонні рівняння наступних реакцій:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Вправа 5. Напишіть повні іонні рівняння, що описують взаємодію: а) оксиду азоту (V) з водним розчином гідроксиду барію; б) розчину гідроксиду цезію з йодоводородною кислотою; в) водних розчинів сульфату міді та сульфіду калію; ІІІ).
Заняття 7.
Розчини
Розчин – це однорідна (гомогенная) система змінного складу, що з двох і більше компонентів. Розчини бувають рідкими, твердими та газоподібними. Рідкі розчини складаються з розчинникаі розчинної речовини.Найчастіше як розчинник виступає вода. При розчиненні відбувається фізичний процес (руйнування структури речовини) та хімічний процес (взаємодія частинок речовини з розчинником).
Всі речовини по відношенню до розчинення поділяються на три групи:
1. розчинні - понад 1 г на 100 г розчинника
2. малорозчинні - від 0,001 г до 1 г на 100 г розчинника
3. нерозчинні - менше 0,001 г на 100 г розчинника
Для оцінки розчинності речовини застосовують коефіцієнт розчинності,що показує, яка маса речовини може розчинитися в 100 г розчинника при цій температурі.
Розчини, залежно від кількості розчиненої речовини, бувають:
1. ненасичений розчин – у ньому розчинено речовини менше, ніж можливо за даних умов.
2. насичений розчин – у ньому розчинено максимально можливу кількість речовини за умов.
3. пересичений розчин – у ньому розчинено речовини більше, ніж можливо за даних умов.
Способи вираження складу розчинів
1. Масова частка (відсоткова концентрація розчину) – відношення маси розчиненої речовини до маси всього розчину:
m (речовини)
ω = ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶
m (розчину)
2. Молярна концентрація – показує кількість розчиненої речовини у 1 лрозчину.
n (речовини) m (речовини)
С = ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶
V(розчину) M(речовини)·V(розчину)
Наприклад, якщо в 1 л розчину міститься 1 моль речовини, такий розчин називають одномолярним і позначають 1М.
Теорія електролітичної дисоціації
Електроліти – це речовини, розчини та розплави яких проводять електричний струм. Частинки, які проводять струм у розчині – це іони.Вони утворюються із твердих речовин при їх розчиненні.
Іони – заряджені частинки: Cl - , Cu 2+ , NO 3 -
Катіони– іони із зарядом +
Аніони– іони із зарядом –
Властивості іонів дуже відрізняються від властивостей атомів, з яких вони утворилися!!!
Процес розпаду електролітів на іони у процесі розчинення чи розплавлення називається ЕЛЕКТРОЛІТИЧНОЮ ДИССОЦІАЦІЄЮ.
До електролітам відносяться:
1) речовини, що мають іонні кристалічні грати(Солі, гідроксиди) - містять іони вже в твердому стані;
2) речовини з ковалентним сильно полярним зв'язком(кислоти), у процесі розчинення утворюють іони.
Неелектролітами є більшість органічних речовин (крім кислот і солей, а також фенолів): спирти, ефіри, альдегіди, вуглеводні, вуглеводи.
Як відбувається процес розчинення електроліту?
Розглянемо цей процес на прикладі розчинення кухонної солі та соляної кислоти. Молекули є дипольними, тобто. один кінець молекули заряджений негативно, інший – позитивно.
Молекула води негативним полюсом підходить до іону натрію, позитивним до іону хлору; оточують іони з усіх боків і виривають із кристала, причому лише з його поверхні. Вільні іони, які у водному розчині, оточуються полярними молекулами води: навколо іонів утворюється гідратна оболонка, тобто. протікає процес гідратації.
При розчиненні молекули з ковалентним полярним зв'язком молекули води, оточивши полярну молекулу, спочатку розтягують зв'язок у ній, збільшуючи її полярність, потім розривають її на іони, які гідратуються і рівномірно розподіляються в розчині.
При розплавленні, коли відбувається нагрівання кристала, іони починають здійснювати інтенсивні коливання у вузлах кристалічної решітки, внаслідок чого вона руйнується, утворюється розплав, що складається з іонів.
Характеристика глибини протікання процесу дисоціації є ступінь дисоціації .
Ступінь дисоціації– це відношення числа молекул, що продісоціювали, до загального числа молекул розчиненого електроліту:
N (продіс)
α = ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶
N (заг)
Якщо ступінь дисоціації дорівнює 0 – речовина не є електролітом.
Ступінь дисоціації речовин – величина, яка залежить від різних факторів:
· чим вище температура, тим ступінь дисоціації вище;
· чим більше концентраціяречовини, тим ступінь дисоціації менше.
За ступенем дисоціації електроліти ділять на сильні та слабкі:
Процес дисоціації можна записати так:
1. Якщо електроліт – сильний, він дисоціює повністю в ОДНУ СТУПЕНЬ, всі молекули перетворюються на іони:
Cu(NO 3) 2 à Cu 2+ + 2NO 3 - (α=1)
KAl(SO 4) 2 à K + + Al 3+ +2SO 4 2- (α=1)
2. Якщо електроліт – слабкий,він дисоціює по сходах, не повністю,ступінь дисоціації на кожному наступному ступені набагато менше, ніж на попередньому:
H 2 S ⇄ H + + HS - (α<1) HS - ⇄ H + + S 2- (α<<1)
Mg(OH) 2 ⇄ Mg(OH) + OH - (α<1) Mg(OH) + ⇄ Mg 2+ + OH - (α<<1)
3. Якщо склад речовини є зв'язку різних типів, то спочатку дисоціюють іоннізв'язки, потім найбільш полярні:
NaHCO 3 à Na + + HCO 3 - (α=1) HCO 3 - ⇄ H + + CO 3 2- (α< 1)
Cu(OH)Cl à CuOH + + Cl - (α=1) CuOH + ⇄ Cu 2+ + OH - (α< 1)
Реакції іонного обміну
Реакції іонного обміну – це реакції між складними речовинами у розчинах, у яких реагирующие речовини обмінюються своїми складовими частинами. Оскільки у цих реакціях відбувається обмін іонами – вони називаються іонними.
Правило Бертоллі
Реакції обміну у розчинах електролітів можливі тільки тодіколи в результаті реакції утворюється або тверда малорозчинна речовина, або газоподібна, або малодисоціююча, тобто слабкий електроліт.
Приклади: ZnO + Н 2 SО 4 = ZnSО 4 + Н 2 О,
AgNО 3 + КВr = АgВr↓+ КNО 3 ,
СrСl 3 + 3NаОН = Сr(ОН) 3 ↓+ 3NаСl
До 2 СО 3 + 2НСl = 2КСl + Н 2 Про + СО 2
Складання рівнянь реакцій іонного обміну:
| 1.Записуємо молекулярне рівняння реакції, не забуваючи розставити коефіцієнти: | 3NaOH + FeCl 3 = Fe(OH) 3 + 3NaCl |
| 2. За допомогою таблиці розчинності визначаємо розчинність кожної речовини. Підкреслимо речовини, які ми не представлятимемо у вигляді іонів. | р р нр 3NaOH + FeCl 3 = Fe(OH) 3+ 3NaCl |
| 3.Складаємо повне іонне рівняння. Сильні електроліти записують як іонів, а слабкі електроліти, малорозчинні речовини і газоподібні речовини записують як молекул. | 3Na + + 3OH - + Fe 3+ + 3Cl - = = Fe(OH) 3+ 3Na + + 3Cl - |
| 4. Знаходимо однакові іони (вони не взяли участі в реакції у лівій та правій частинах рівняння реакції) та скорочуємо їх зліва та праворуч. | 3Na + + 3OH - + Fe 3+ + 3Cl - = = Fe(OH) 3 + 3Na + + 3Cl - |
| 5.Складаємо підсумкове скорочене іонне рівняння (виписуємо формули іонів чи речовин, що взяли участь у реакції). | Fe 3+ + 3OH - = Fe(OH) 3 |
У вигляді іонів не уявляють :
1. Неелектроліти (оксиди, прості речовини);
2. Опади; гази; воду; слабкі електроліти (кислоти та основи);
3. Аніони кислотних залишків кислих солей слабких кислот (НСО 3 - , Н 2 РО 4 - тощо) і катіони основних солей слабких основ Al(OH) 2+ .
Приклади складання іонних рівнянь.
Приклад 1. Сульфід цинку + соляна кислота
Складемо рівняння реакції та перевіримо розчинність усіх речовин. Побачимо, що сульфід цинку нерозчинний.
ZnS + 2HCl à ZnCl 2 + H 2 S - Молекулярна форма
Чому ця реакція протікає остаточно? У ній виділяється газ сірководень, який ми теж не розбиватимемо на іони.
ZnS+2H + +2Cl - àZn 2+ +2Cl - + H 2 S-Повне іонно-молекулярне рівняння
Скорочуємо ті іони, які змінилися у процесі реакції – це лише хлорид-ионы.
ZnS+2H + àZn 2+ + H 2 S- скорочене іонне рівняння
Приклад 2. Гідрокарбонат калію + гідроксид калію à
K HCO 3 + KOH à K 2 CO 3 + H 2 O
Згадаємо, що кислі аніони слабких кислот є слабкими електролітами і на іони не розбиваються:
До + + НСО 3 -+ К + + ВІН - à 2K + + CO 3 2- + H 2 O
І тепер скорочуємо: НСО 3 -+ ВІН - à CO 3 2- + H 2 O
Інструкція
Перш ніж приступати до іонних рівнянь, необхідно засвоїти деякі правила. Нерозчинні у воді, газоподібні та малодисоціюючі речовини (наприклад, вода) на іони не розпадаються, а значить, записуйте їх у молекулярному вигляді. Також сюди відносяться слабкі електроліти, такі як H2S, H2CO3, H2SO3, NH4OH. Розчинність сполук можна з'ясувати за таблицею розчинності, яка є дозволеним довідковим матеріалом на всіх видах контролю. Там же вказані всі заряди, які притаманні катіону та аніону. Для повноцінного виконання завдання необхідно написати молекулярне, повне та іонне скорочене рівняння.
Приклад № 1. реакцію нейтралізації між сірчаною кислотою та гідроксидом калію, розгляньте її з погляду ТЕД (теорії електролітичної дисоціації). Спочатку запишіть рівняння реакції в молекулярному вигляді та .H2SO4 + 2KOH = K2SO4 + 2H2O Проаналізуйте отримані речовини на їх розчинність та дисоціацію. Усі сполуки розчиняються у питній воді, отже на іони. Виняток тільки вода, яка на іони не розпадається, отже, залишиться в молекулярному вигляді. Щоб скоротити однакові іони, закресліть їх. H2O
Приклад № 2. Напишіть реакцію обміну між хлоридом міді та гідроксидом натрію, розгляньте її з погляду ТЕД. Запишіть рівняння реакції у молекулярному вигляді та розставте коефіцієнти. В результаті гідроксид міді, що утворився, випав в осад блакитного кольору. CuCl2 + 2NaOH = Cu(OH) 2↓ +2NaClПроаналізуйте всі речовини на їх розчинність у воді – розчинні всі, крім гідроксиду міді, який на іони дисоціювати не буде. Запишіть іонне повне рівняння, підкресліть і скоротите однакові іони:

Приклад № 3. Напишіть реакцію обміну між карбонатом натрію та соляною кислотою, розгляньте її з погляду ТЕД. Запишіть рівняння реакції у молекулярному вигляді та розставте коефіцієнти. В результаті реакції утворюється хлорид натрію та виділяється газоподібна речовина СО2 (вуглекислий газ або оксид вуглецю (IV)). Воно утворюється за рахунок розкладання слабкої вугільної кислоти, що розпадається на оксид та воду. Na2CO3 + 2HCl = 2NaCl + CO2+H2O Проаналізуйте всі речовини на їх розчинність у воді та дисоціацію. Вуглекислий газ йде з системи, як газоподібна сполука, вода – це малодисоціююча речовина. Решта всіх речовин на іони розпадаються. Запишіть іонне повне рівняння, підкресліть і скоротите однакові іони:2Na+ +СO3 2- +2H+ +2Cl- =2Na+ +2Cl- +CO2+H2OЗалишається іонне скорочене рівняння:СO3 2- +2H+ =CO2+H2O