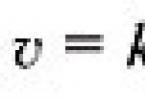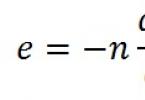Швидкість хімічної реакції
та її залежність від різних факторів
Урок із використанням інформаційних технологій
Хімії в жодному разі навчитися неможливо,
не бачачи самої практики і не беручись за хімічні операції.
М.В.Ломоносов
Перебудова вищої та середньої спеціальної освіти в країні, шкільна реформа передбачають подальше вдосконалення форм, методів та засобів навчання, використання різноманітних технологій, зокрема особистісно орієнтованого навчання (ЛОО), проблемно-пошукових та комп'ютерних технологій.
Ми, педагоги, теж розбудовуємось. Я намагаюся постійно використовувати нові розробки, сучасні освітні технології.
Останнім часом з'явилося багато матеріалів на дисках. Їх можна використовувати у створенні рефератів, написанні курсових робіт, при самостійної роботі учнів. Мені інформаційні технології дозволяють швидко організувати навчання та перевірку знань, складати адаптивні програми та застосовувати їх у навчанні хімії.
Комп'ютерна техніка та використання комп'ютерних технологій сьогодні виступають не лише як засіб автоматизації всіх процесів навчання, а й як інструмент різкого підвищення ефективності інтелектуальної діяльності учнів.
Комп'ютерні технології на своїх уроках я використовую з різною метою:
Розв'язання задач, кількісні розрахунки, обробка даних (за запропонованим алгоритмом);
Здійснення самоконтролю та стандартизований контроль знань щодо змісту навчальної інформації (тестові, контрольні диференційовані завдання, карти та інші опитувальники);
Автоматизація хімічного експерименту; з'єднання з оптичною апаратурою (проекції дослідів на екран);
отримання необхідних довідкових даних, складання контрольних, диференційованих робіт, аналіз типових помилок учнів (автоматизовані системи управління та інформаційні банки);
Самостійна робота учнів з розробки рефератів та курсових робіт, робота з матеріалом, виконання перевірочних робіт (отримуючи результат, здійснювати самоконтроль).
Запропонований урок із розділу «Хімічна кінетика» відповідає програмі підручника «Хімія-10» авторів Л.С.Гузея та Р.П.Суровцевої. Дослідження цієї теми передує вивчення термодинаміки реакцій. Запропонований матеріал відповідає не обов'язковому мінімуму змісту, а насамперед профільному рівню навчання.
На уроці використовується групова робота, диференційований підхід, розвиваючі та проблемно-пошукові технології, а найголовніше – комп'ютерні технології для проведення демонстраційного експерименту, що дозволяє наочно зрозуміти, що таке швидкість хімічної реакції та як вона залежить від різних факторів.
Цілі уроку.Актуалізувати та поглибити знання про швидкість хімічної реакції; використовуючи роботу в групах, розглянути та вивчити від різних факторів: природи речовин, що реагують, площі поверхні зіткнення речовин, температури, каталізатора; використовуючи комп'ютерний вимірювальний блок, наочно продемонструвати, що таке швидкість хімічної реакції і як залежить від концентрації реагуючих речовин.
Девіз уроку."Існує лише те, що можна виміряти" (М.Планк).
Оформлення класу.Вчитель заздалегідь повідомляє тему майбутнього уроку, ділить клас чотирма творчі групи по 5–6 людина, приблизно однакові здібностям. На попередньому уроці учні отримують домашнє завдання – підготувати повідомлення про практичне застосування рівняння Арреніуса та види каталізу.
Обладнання та реактиви.На кладках учнів – підручники, зошити, таблиці, лабораторні листи, штативи з пробірками;
група 1: цинк у гранулах, магнієва стрічка, розчин соляної кислоти;
група 2: скляна паличка; залізна тирса, залізний цвях, розчин хлориду міді(II);
група 3: піпетка, пробіркотримач, спиртування, сірники; оксид міді(II), розчин сірчаної кислоти;
група 4(Виконує демонстраційний досвід на демонстраційному столі): комп'ютер з вимірювальним блоком, датчик оптичної щільності при довжині хвилі 525 нм, кювета, магнітна мішалка, шприц на 10 мл, мірний циліндр на 100 мл; розчини йодиду калію KI 1М, персульфату калію K 2 S 2 O 8 0,1М, дистильована вода.
Усі записи під час уроку учні виконують у зошитах.
ХІД УРОКУ
Мотивація важливості обраної теми
Вчитель починає пояснення матеріалу з прикладів хімічних реакцій, що протікають із різною швидкістю. Приклади реакцій можуть наводити учні.
Хімічні реакції протікають із різними швидкостями. Одні йдуть повільно, місяцями, як, наприклад, корозія заліза чи ферментація (бродіння) виноградного соку, у результаті виходить вино. Інші завершуються за кілька тижнів як спиртове бродіння глюкози. Треті закінчуються дуже швидко, наприклад, осадження нерозчинних солей, а деякі протікають миттєво, наприклад вибухи.
Практично миттєво, дуже швидко йдуть багато реакцій у водних розчинах:
Змішаємо водні розчини Na 2 CO 3 і CaCl 2 продукт реакції CaCO 3 - нерозчинний у воді, утворюється негайно;
До лужного розчину фенолфталеїну додамо надлишок кислоти, розчин знебарвлюється миттєво. Це означає, що реакція нейтралізації, реакція перетворення забарвленої форми індикатора на безбарвну йдуть дуже швидко.
Повільно утворюється іржа на залізних предметах. На мідних і бронзових предметах повільно утворюються продукти корозії чорно-коричневого чи зеленого кольору (патина). Швидкість усіх цих процесів є різною.
Актуалізація уявлень
про швидкість хімічних реакцій
Хімічні реакції - одне з найважливіших понять хімії. Для їх розуміння та грамотного використання у навчальному процесі вчителю необхідно знати та вміти пояснити основні характеристики будь-якої хімічної реакції: тепловий ефект, рівновагу, швидкість. Хімічна термодинаміка дає можливість передбачити, в якому напрямку може мимовільно протікати та чи інша хімічна реакція, але одна хімічна термодинаміка не дає відповіді на питання про те, як і з якою швидкістю протікатиме реакція. Поняття про швидкість хімічної реакції – одне з основних у хімічній кінетиці.
Для вивчення нового матеріалу учні використовують необхідні знання швидкості хімічної реакції, проходить етап актуалізації знань. Але це поняття поглиблюється поняттями швидкості гомогенних та гетерогенних реакцій, енергією активації, запроваджується рівняння Арреніуса – це зона найближчого розвитку учнів (див. додаток № 1 «Структура проблемно-пошукової діяльності вчителя та учнів…»).
Що розуміють під швидкістю реакції? Як її можна виміряти та змінити? Відповісти на ці питання допоможе наука, яка вивчає закономірності перебігу реакцій у часі, – хімічна кінетика.
Нагадаємо основні поняття та закономірності, що використовуються в кінетиці (відповідають учні та доповнює вчитель).
Хімічна кінетика – це розділ хімії, завдання якого – пояснення якісних та кількісних змін хімічних процесів, що відбуваються у часі. Зазвичай це загальне завдання поділяють на дві, конкретніші:
1) виявлення механізму реакції - встановлення елементарних стадій процесу та послідовності їх протікання (якісні зміни);
2) кількісний опис хімічної реакції - встановлення суворих співвідношень, які дозволяють розраховувати зміни кількостей вихідних реагентів та продуктів у міру протікання реакції.
Основним поняттям у хімічній кінетиці є поняття про швидкість реакції. Швидкість хімічної реакціївизначається кількістю речовини, що прореагував в одиницю часу в одиниці реакційного простору.
Якщо концентрація однієї з реагуючих речовин зменшилася від з 1 до з 2 за проміжок часу від t 1 до t 2 , то відповідно до визначення швидкості реакції дорівнює (рис. 1):
Знак «–» у правій частині рівняння означає таке. У міру перебігу реакції ( t 2 – t 1) > 0 концентрація реагентів зменшується, отже, ( c 2 – c 1) < 0, а т.к. скорость реакции всегда положительна, то перед дробью следует поставить знак «–».
Мал. 1.
|
Кількісно залежність між швидкістю реакції та молярними концентраціями реагуючих речовин описується основним законом хімічної кінетики – законом діючих мас.
Швидкість хімічної реакції за постійної температури пропорційна добутку концентрацій реагуючих речовин.
Для реакції
аА+ bВ = зЗ + d D,
відповідно до закону діючих мас, залежність швидкості від концентрацій реагуючих речовин може бути представлена у вигляді:
![]()
де k- Константа швидкості; nА, n B – порядки реакції відповідно до реагентів А та В;
nА+ n B – загальний порядок реакції.
В г о м о г е н н і х реакції реагуючі речовини знаходяться в одній газовій фазі або в розчині, рівномірно перемішані між собою, реакція йде по всьому об'єму суміші. Концентрація реагенту дорівнює частці від розподілу кількості речовини на об'єм суміші: з = /V.
Середня швидкість реакції:
![]()
Чим менший проміжок часу, тим точнішим буде значення швидкості реакції.
Г е т р о г е н н і е р е а к ц и і йдуть межі розділу фаз: газ – тверда речовина, газ – рідина, рідина – тверда речовина, тверда речовина – тверда речовина. Швидкість реакції
![]()
вимірюється на одиниці площі дотику реагуючих речовин S.
При розгляді теплових ефектів хімічних реакцій перетворення молекул реагентів (А+В) на молекули продуктів (С+D) з термодинамічної точки зору пояснюється як «сходження на енергетичну гору» у разі ендотермічних реакцій (рис. 2, а) або «спуск із гори» для екзотермічних реакцій (рис. 2, б).
Молекулам реагентів, щоб прореагувати, необхідно попередньо запастися додатковою енергією, щоб подолати енергетичний бар'єр на шляху до продуктів реакції. Істотно, що такий бар'єр є й у разі екзотермічних реакцій, тому замість простого «зісковзування з гірки» молекулам доводиться попередньо «лізти в гору».
Мал. 2.
|
Рухаюча сила реакції – прагнення дійти мінімуму енергії.

Щоб реакція могла протікати, частки реагуючих речовин повинні зіштовхнутися друг з одним. Зі зростанням температури кількість цих зіткнень зростає внаслідок збільшення кінетичної енергії молекул, тому збільшується швидкість реакції. Але далеко не всяке зіткнення молекул реагуючих речовин призводить до їхньої взаємодії: для взаємодії молекул зв'язку між атомами в них повинні стати слабшими або порватися, на що повинна бути витрачена певна енергія. Якщо молекули, що стикаються, не володіють такою енергією, їх зіткнення не призводить до реакції. Надмірна енергія, якою повинні мати молекули для того, щоб їх зіткнення могло призвести до утворення молекул нової речовини, називається енергією активаціїданої реакції Еа зазвичай вимірюється в Дж/моль, кДж/моль. Молекули, що мають таку енергію, називаються активними молекулами.
На рис. 3 зображені енергетичні профілі:
а) ендотермічної реакції + H = –Q,
N 2 + O 2 2NO - Q;
б) екзотермічної реакції; H = +Q,
H 2 + I 2 2HI + Q.
В процесі реакції хімічні зв'язки в активних молекулах слабшають і виникають нові зв'язки між частинками речовин, що реагують, утворюється перехідний стан - активований комплекс, коли старі зв'язки не повністю зруйновані, а нові вже почали будуватися. Енергія активації – енергія, необхідна виникнення активованого комплексу. Енергетичний бар'єр різний, що він нижче, тим легше і швидше йде реакція.
Крапка, що знаходиться на вершині енергетичного бар'єру, має назву перехідного стану. З цієї точки система може вільно перейти в продукт реакції або повернутися до початкового стану (рис. 4).
Енергія активації – це чинник, з якого природа реагуючих речовин впливає швидкість реакції. Для деяких реакцій вона мала, для інших – велика. Якщо енергія активації мала (< 40 кДж/моль), то большая часть столкновений между молекулами реагирующих веществ приводит к реакции. Скорость таких реакций велика. Если энергия активации велика (>40 кДж/моль), то в цьому випадку лише мала частина зіткнень молекул або інших частинок призводить до реакції. Швидкість такої реакції мала.
Швидкість реакції в даний момент часу можна розрахувати, якщо знати кількість активних зіткнень частинок, що реагують, в одиницю часу. Тому залежність швидкості реакції від температури можна записати у вигляді:
0 exp(– E a / RT),
де 0 – швидкість реакції за умови, що кожне зіткнення призводить до взаємодії ( Еа = 0). Цей вираз для швидкості реакції – рівняння Арреніуса– важливе рівняння у хімічній кінетиці (його практичне застосування див. у додатку № 2, учні роблять повідомлення).
Чому хімічні реакції йдуть із різною швидкістю? Ось основне питання, яке стоїть перед учителем та хлопцями на уроці. Учні відповідають нього теоретично, проводячи лабораторні експерименти у групах і вирішуючи завдання.
Робота у групах
Робота груп включає наступні види діяльності:
Експериментальне вивчення чинників, що впливають швидкість хімічної реакції;
Спостереження та аналіз отриманих результатів дослідів;
Заповнення лабораторних листів, що відображають хід роботи та висновки.
Обов'язкова умова успішної роботи у групах та реалізації поставлених завдань – забезпечення кожного робочого місця учня необхідним обладнанням, наочними посібниками. Під час роботи вчитель підходить до всіх груп, у разі потреби надає консультативну допомогу. Нижче розкрито зміст завдань для роботи кожної групи.
Лабораторний досвід №1.
Залежність швидкості хімічної реакції
від природи реагуючих речовин
Ціль. Закріпити поняття «швидкість хімічної реакції» та виявити її залежність від природи реагуючих речовин.
Обладнання та реактиви.Штатив із пробірками; цинк у гранулах, магнієва стрічка, розчин соляної кислоти.
Демонстраційний досвід.
Швидкість реакції та її залежність
від концентрації вихідних речовин
Ціль. Наочно продемонструвати, що таке швидкість хімічної реакції та як вона залежить від концентрації вихідних речовин.
Обладнання та реактиви.Комп'ютер із вимірювальним блоком, датчик оптичної густини при довжині хвилі = 525 нм, кювета, магнітна мішалка, шприц на 5 мл, мірний циліндр на 100 мл; розчини - 1M KI, 0,1 M K 2 S 2 O 8 дистильована вода.
Хімічна сутність процесу.Досліджується реакція окислення йодид-іону персульфатом:
2I – + S 2 O 8 2– = I 2 + 2SO 4 2– .
Реакція проводиться у надлишку йодиду калію. Йод, що виділяється, забарвлює розчин у коричневий колір. Концентрацію йоду визначають за інтенсивністю фарбування розчину за допомогою датчика оптичної густини при 525 нм.
Підготовка до роботи.До першого каналу вимірювального блоку підключають датчик оптичної густини, налаштований на довжину хвилі 525 нм. Включають датчик у режимі залежності від часу, наливають у кювету 10 мл 1M розчину KI та 90 мл дистильованої води. Налаштовують датчик.
Виконання.Запускають процес перемішування. Відбирають у шприц 5 мл розчину K 2 S 2 O 8 швидко виливають його в кювету, запускаючи одночасно процес вимірювання натисканням на екранну кнопку «Пуск». Вимірювання припиняють, коли оптична густина досягне значення 0,5.
Повторюють експеримент, використовуючи 20 мл розчину KI та 80 мл води.
Коментарі.Швидкість реакції – це зміна концентрації речовин, що реагують або продуктів реакції в одиницю часу. Швидкість реакції залежить від концентрації вихідних реагентів у час.
Поняття, що виводяться.Швидкість реакції, її залежність від концентрації.
Висновки.Оскільки реагенти в процесі реакції витрачаються, швидкість уповільнюється.
У разі збільшення концентрації вихідного реагенту швидкість реакції збільшується. Причому у разі зі збільшенням концентрації вдвічі швидкість реакції також збільшилася вдвічі.
Лабораторний досвід №2.
Вплив температури на швидкість
Ціль. Закріпити поняття «швидкість хімічної реакції» та дослідити вплив температури на швидкість хімічної реакції.
Обладнання та реактиви.Штатив з пробірками, піпетка, спиртування, пробіркотримач; оксид міді(II), розчин сірчаної кислоти (1:3).
Лабораторний досвід №3.
Залежність швидкості хімічної реакції
від площі поверхні дотику
реагуючих речовин
Ціль. Закріпити поняття «швидкість хімічної реакції» та виявити її залежність від величини поверхні зіткнення реагуючих речовин.
Обладнання та реактиви.Штатив із пробірками, скляна паличка; залізна тирса, залізний цвях, розчин хлориду міді(II).
Подання результатів групової роботи, їх обговорення
Порядок подання результатів визначається номерами груп (по черзі). Учні виступають біля дошки, використовуючи таблиці, заповнені за результатами лабораторних дослідів. Організується коротке обговорення результатів роботи груп, формулюються висновки. Вчитель вказує на ще один чинник, що впливає швидкість хімічної реакції, – присутність каталізатора.
Каталізатори- Це речовини, що прискорюють хімічну реакцію, інгібітори- Це речовини, що уповільнюють хімічну реакцію. Самі каталізатори та інгібітори реакції не витрачаються і не входять до складу продуктів реакції.
Каталіз- Це процес зміни швидкості реакції під дією каталізатора. Дія каталізатора вибіркова. Реакції, що протікають за участю каталізатора, називають каталітичними реакціями.
М е х а н і з м г о м о г е н н о г к о т а л і з а
Нерідко реакції йдуть повільно, т.к. їхня енергія активації Еа велика (рис. 5):
А + В А В АВ.
Каталізатор (K) прискорює реакцію:

Енергії активації E"а і EА малі, тому реакції протікають швидко.
За участю каталізатора відбувається зниження Еа, утворюється виграш енергії та реакція протікає швидше.
Відикаталіза
1. Гомогенний каталіз– вихідні речовини та каталізатор – однофазна система.
Наприклад, природні коливання товщини озонового шару Землі пов'язані із зміною сонячної активності. У верхніх шарах атмосфери відбувається руйнування озонового шару, що каталізується оксидами азоту:

2. Гетерогенний каталіз– вихідні речовини та каталізатор утворюють різнофазну систему.

М е х а н і з м г е т е р о г е н н о г о к а т ал і з а включає п'ять стадій:
Дифузія – молекули, що реагують, дифундують до поверхні каталізатора;
Адсорбція – речовини, що реагують, накопичуються на поверхні каталізатора;
Хімічна реакція - поверхня каталізатора неоднорідна, на ній є активні центри, вони послаблюють зв'язки між атомами в молекулах, що адсорбуються, реагують молекули деформуються, іноді розпадаються на атоми, що полегшує протікання хімічної реакції;
Десорбція - молекули продукту спочатку утримуються поверхнею каталізатора, потім звільняються;
Дифузія – молекули продукту дифундують із поверхні каталізатора.
p align="justify"> Образно кажучи, механізм дії каталізатора можна порівняти з переходом туристів через гірський перевал. Туристи, що не знають місцевості, виберуть найочевидніший, але найважчий шлях, що вимагає тривалого сходження і спуску через вершину гори. Досвідчений провідник (каталізатор) поведе свою групу стежкою, минаючи вершину. Нехай цей шлях звивистий, але менш важкий, ним легше дійти до кінцевого пункту, після чого провідник повертається у вихідний пункт.
Особливу групу становлять каталізатори, які у живих організмах. Такі каталізатори називаються ферментами або ензимами.
Ферменти (ензими)- Це білкові молекули, що прискорюють хімічні процеси в біологічних системах (в організмі близько 30 тис. різних ферментів, кожен з них прискорює відповідну йому реакцію).
Демонстраційний досвід.
Каталітичне розкладання пероксиду водню
(Проводить вчитель)
2H 2 O 2 2H 2 O + O 2 .
Три пробірки наливають по 5 мл аптечного розчину пероксиду водню. Перша пробірка – контрольна, для порівняння, у другу пробірку пінцетом опускають шматочок сирого м'яса, у третю – шматочок сирої моркви. Спостерігається «закипання» у двох пробірках, крім першої. У другу і третю пробірки вносять тліючі лучинки, які спалахують, т.к. виділяється кисень. Вчитель пояснює, що розкладання пероксиду водню відбувається і без каталізатора, але набагато повільніше. Реакція може тривати кілька місяців. Швидкі реакції в інших пробірках демонструють роботу ферменту - каталази, який знаходиться і в рослинних, і тваринних клітинах.
Ефективність дії ферменту каталази можна проілюструвати даними про розкладання H2O2 у водному розчині.
Докладніше з ферментами знайомляться щодо курсу хімії 11-го класу.
З демонстраційного експерименту починається виховання сталої уваги, вміння спостерігати за досвідом, проводити аналіз, робити висновки. Групова форма роботи дозволяє ефективно здобувати знання, виховуючи почуття колективізму.
Використання комплекту устаткування з вимірювальним комп'ютерним блоком і датчиками (температури, оптичної щільності, електропровідності, рівня рН) значно розширює можливості демонстраційного експерименту, т.к. дозволяє зазирнути всередину процесу, чого раніше, вивчаючи цю тему лише теоретично, ми зробити було неможливо. Вивчення кількісних закономірностей – одна з ключових та найскладніших тем у хімії (див. додаток № 3 «Параметри, що використовуються у кількісних хімічних розрахунках»).
На цьому уроці нас цікавлять параметри реакції. На попередніх уроках учні познайомилися з термодинамічних параметрів, а параметри речовини та середовища будуть вивчатися на наступних уроках.
Підсумки уроку, рефлексивний аналіз
Вчитель підбиває підсумки уроку. Учні заповнюють листки контролю роботи учня, у яких вони вказують клас, прізвище, ім'я, оцінюють своєї роботи на уроці, роботу групи, розуміння теми («погано», «добре», «відмінно»).
Учні відповідають питання.
1. З яким настроєм ви йдете з уроку?
2. Чим цікавий урок для кожної групи та кожного учня?
3. Яка користь цього уроку для вас?
4. З якими труднощами ви зіткнулися на уроці?
У різних класах пропонують різні питання. З досвіду можна сказати, що у рефлексивному етапі учні дають високу оцінку уроку («5», рідше «4»), відзначають незвичність, наочність, насиченість уроку, високий емоційний рівень, логічність, цікавий інформаційний матеріал. Найбільш важливою на уроці є технологія співпраці вчителя та учнів. Разом досягаються загальні цілі, учні краще засвоюють матеріал та застосовують отримані знання.
Домашнє завдання
Поряд із параграфами підручника кожна група отримує індивідуальне завдання щодо вивчення впливу того чи іншого фактора на швидкість хімічної реакції.
Завдання 1. При t= 30 °С реакція протікає за 25 хв, а при t= 50 ° С – за 4 хв. Розрахуйте коефіцієнт температури реакції.
Завдання 2. Взаємодія алюмінію з хлором протікає за рівнянням:
2Al (тв.) + 3Cl 2 (р.) = 2AlCl 3 (тв.).
Початкова концентрація хлору 0,05 моль/л. Константа швидкості реакції 0,2 л/(моль).
Напишіть математичний вираз швидкості реакції. Як змінюється швидкість реакції порівняно з початковою, якщо тиск у системі збільшити у 6 разів?
Завдання 3. У двох однакових судинах проводили реакції розкладання з утворенням кисню та водню. За 10 с у першій посудині одержали 22,4 л О 2 , а в другій – 4 г Н 2 . Швидкість якої хімічної реакції більша? Скільки разів?
Завдання 4. Запропонуйте способи збільшення швидкості реакції у 16 разів шляхом зміни концентрацій вихідних речовин:
а) 2Cu (тв.) + O 2 (р.) = 2CuO (тв.);
б) 2H 2 (р.) + O 2 (р.) = 2H 2 O (р.).
Особливістю уроку є те, що пропонується матеріал, що виходить за межі підручника. Це необхідно як підвищення загальної ерудиції, так майбутніх абітурієнтів. Додатковий матеріал у профільному класі ґрунтується головним чином на матеріалах вступних іспитів у різні вузи.
Мета педагогічних технологій – підвищення ефективності навчального процесу. Головне у будь-якій технології – орієнтація на особистість учня. Педагогічна технологія – це сукупність взаємозалежних засобів, методів, процесів, необхідні цілеспрямованого на формування особистості із заданими якостями. На своїх уроках я використовую особистісно орієнтований підхід. Як наслідок, учням вдається підійти свідоміше і творчіше до вивчення матеріалу. Саме технологія співпраці вчителя та учня важлива у досягненні високих результатів. Активне застосування елементів педагогічних технологій на уроках сприяє розвитку учня мотиваційної сфери, інтелекту, самостійності, здатності контролювати та керувати своєю навчально-пізнавальною діяльністю.
Мій предмет – хімія, але ще я викладаю людинознавство. Використання нових підходів в освіті дозволяє по-іншому дивитися на предмет. Головне – бачити у кожному учні людину.
Хімія - наука про речовини. Я підходжу до вивчення речовин не лише з погляду їхньої практичної значущості для суспільства, а й з позиції філософського осмислення світу. На уроках хімії та людинознавства я показую цілісність світу та людини, намагаюся розкрити дітям безмежність та гармонію життя, виховати прагнення до розуміння та пізнання себе, бажання себе вдосконалювати, працювати над собою, щоб покращити життя. Мене тішить інтерес хлопців до цих проблем. І я думаю, що поміркувати над цим корисно і нам, учителям. Тільки вдосконалюючи та розвиваючи себе, ми можемо навчати хлопців.
ДОДАТОК № 1
Структура проблемно-пошукової діяльності вчителя та учнів
з дослідження властивостей речовин та сутності хімічних реакцій
(можливе використання інформаційних технологій)

ДОДАТОК № 2
Практичне використання рівняння Арреніусаприклад 1. Швидкість (частота) пілікання цвіркунів підпорядковується, хоч і не цілком суворо, рівнянню Арреніуса, плавно збільшуючись у температурному інтервалі від 14,2 до 27 °С, з ефективною енергією активації E a = 51 кДж/моль. По частоті стрекотань можна досить точно визначити температуру: треба підрахувати їхнє число за 15 с і додати 40, вийде температура в градусах Фаренгейта (F) (американці досі користуються цією температурною шкалою).
Так, при 55 F (12,8 ° С) частота стрекотань становить 1 ст./с, а при 100 F (37,8 ° С) - 4 ст./с.
приклад 2.
У температурному інтервалі від 18 до 34 °С частота серцевих скорочень морської черепахи узгоджується з рівнянням Арреніуса, яке дає енергію активації
E a = 76,6 кДж/моль, але за нижчих температур енергія активації різко збільшується. Це може бути пов'язано з тим, що при знижених температурах черепаха почувається не дуже добре і частота серцевих скорочень починає керуватися іншими біохімічними реакціями.
приклад 3.
Особливо цікавими є спроби «покласти на ареніусівську залежність» психологічні процеси людини. Так, людей із різною температурою тіла (від 36,4 °С до 39 °С) просили відрахувати секунди. Виявилося, що чим вищою була температура, тим швидше був рахунок
(Еа = 100,4 кДж/моль). Таким чином, наше суб'єктивне відчуття часу підпорядковується рівнянню Арреніуса. Автор проведеного соціологічного дослідження Г.Хогланд висловив припущення, що це пов'язано з деякими біохімічними процесами в мозку людини.
Німецький дослідник Х. фон Ферстлер вимірював у людей із різною температурою швидкість забування. Він давав людям послідовність різних знаків та вимірював час, протягом якого люди цю послідовність пам'ятали. Результат був той самий, що й у Хогланда: ареніусівська залежність з Еа = 100,4 кДж/моль.
Ці приклади показують, що багато процесів у природі, включаючи і психологічні, підпорядковуються рівнянню Арреніуса з досить високими значеннями енергії активації Еа. Останнє зауваження особливо важливе, тому що Еа фізичних процесів (наприклад, в'язкого перебігу рідини) зазвичай не перевищує 20 кДж/моль. Висока енергія активації означає, зазвичай, що має місце розрив хімічних зв'язків. Так що у всіх розібраних прикладах, безсумнівно, мають місце справжнісінькі хімічні реакції (очевидно, ферментативні).
ДОДАТОК № 3
Рівновага процесу переходу однієї фази до іншої без зміни хімічного складу називається фазовою рівновагою. Прикладами фазової рівноваги можуть бути такі процеси:
випаровування
![]()
Для фазової рівноваги дотримується принцип Ле Шательє.
При підвищенні температури рівновага зміщується у бік ендотермічного процесу, наприклад, плавлення та випаровування. Зі збільшенням тиску рівновага зміщується у бік процесів, при яких газ або пара перетворюються на рідкий або твердий стан.
Правило фаз.
Сформульовано Дж. Гіббсом. Число ступенів свободи C , фаз Ф , незалежних компонентів До та зовнішніх умов н , що впливають на рівновагу, взаємопов'язані співвідношенням:
C+ Ф = К + н
2.4. Механізм хімічної реакції. Ланцюгові реакції. Фотохімічні процеси. Гомогенний та гетерогенний каталіз. Автокаталіз. Ферментативний каталіз. Каталітичні отрути. Коливальні реакції.
Енергія активації. Енергетичний профіль реакції.
Реакції відбуваються внаслідок безпосереднього зіткнення молекул. Однак не всі зіткнення призводять до хімічної взаємодії. Утворенню нових речовин сприяють лише молекули, які мають достатній запас енергії. Такі молекули називають активними молекулами.
Та мінімальна енергія, достатня для початку хімічної реакції, називається енергією активації і виражається в ккал або кДж. Що менше енергія активації, то швидше йде реакція.
У реакціях, де енергія активації більша, ніж 150 кДж при t=25°С, швидкість дуже мала або практично ці реакції не протікають. У реакціях, де енергія активації менша за 60 кДж, швидкість дуже велика (вибух).
Величина енергії активації Еа залежить від природи елементів, що реагують, і служить характеристикою кожної реакції.

Енергетична діаграма перебігу реакції з утворенням
активованого комплексу
Щоб реагуючі речовини А та В утворили продукти реакції С та Д вони повинні подолати енергетичний бар'єр МL. На це витрачається енергія активації Еа. При цьому в ході реакції з частинок речовин, що реалізують, утворюється проміжне нестійке угруповання - активований комплекс (рис.2.6).
Цей комплекс розпадається з утворенням кінцевих продуктів, причому виділяється така кількість енергії, яка дозволяє кінцевим продуктам спуститися рівня середньої енергії кінцевих продуктів.
Т.о. зміну продуктів можна виразити у вигляді схем для ендотермічної та екзотермічної реакції (рис.2.7, 2.8).


схема протікання
екзотермічної реакції
схема протікання
ендотермічної реакції
Про  Швидко реакції між речовинами з міцними ковалентними зв'язками характеризуються великими значеннями Еа і йдуть повільно. Це стосується багатьох взаємодій, як
Швидко реакції між речовинами з міцними ковалентними зв'язками характеризуються великими значеннями Еа і йдуть повільно. Це стосується багатьох взаємодій, як
швидкість яких за стандартних умов дорівнює 0.
М  Червоними значеннями Еа і дуже великими швидкостями характеризуються іонні взаємодії в розчинах
Червоними значеннями Еа і дуже великими швидкостями характеризуються іонні взаємодії в розчинах
Енергетичний профіль реакції. А + В = АВ (без каталізатора) А + В + К? + В? ? AB + K (з кат.).
Зображення 45 з презентації «Швидкість хімічної реакції»до уроків хімії на тему «Реакції»Розміри: 1280 х 800 пікселів, формат: jpg. Щоб безкоштовно скачати картинку для уроку хімії, клацніть на зображенні правою кнопкою мишки та натисніть «Зберегти зображення як...». Для показу картинок на уроці Ви також можете безкоштовно скачати презентацію «Швидкість хімічної реакції.ppt» з усіма картинками в zip-архіві. Розмір архіву – 129 КБ.
Завантажити презентаціюРеакції
«Хімічні рівняння» – 7 н2so4. Закон збереження маси речовин. Са+О2 СаО. Тема: Зміни щодо речовин. Ознаки та умови протікання хімічних реакцій. Згадай! Хімічні рівняння. Сучасне формулювання закону: 1756 р.
"Електролітична дисоціація солей" - Застосування солей. Розчин фенолфталеїну Запишіть молекулярні та іонні рівняння можливих реакцій. Хімічні властивості солей. 1. Метал + сіль 2. Сіль + луг 3. Сіль + кислота 4. Сіль + сіль. Завдання 3. З якими з наведених речовин реагує розчин гідроксиду натрію? NaOH, Ba(OH)2, NH4OH, Al(OH)3.
«Рівняння хімічних реакцій» - Д/З 1) вивчити текст § 26 2) виконати письмово вправи №1-3. Постановка цілі. 2) Перегляд презентацій учнів про очищення води в домашніх умовах. Отримання вуглекислого газу взаємодією соди та кислоти. Атом водню. 4. Перегляд презентацій учнів з вибраних тем. m1. Матеріал для групової роботи.
"Швидкість хімічної реакції" - t1. dCB dt. Швидкість хімічної реакції. a A. Хімічна кінетика. dc dt. Класифікація процесів за фазовим складом. V а) n=0 v б) n=1 v) n>1. Ланцюгові - нерозгалужені р-ції. З 1. Графічне визначення n. План лекції. Ланцюгові - розгалужені реакції. Кінетичне рівняння складної реакції.
«Реакції речовин» – Класифікація речовин за складом: Фотографії фрагментів уроків з використанням інтерактивної дошки. N2. 10 клас «Вуглеводи». Про які речовини йдеться у уривку із вірша С.Щипачова «Читая Менделєєва»? Напишіть рівняння реакцій одержання сульфату алюмінію. Завдання №4. Завдання №7. Кіновар сульфід ртуті (ii).
«Типи хімічних реакцій» - Усі реакції супроводжуються тепловими ефектами. Типи хімічних реакцій Хімічні реакції відбуваються: при змішуванні або фізичному контакті реагентів мимовільно при нагріванні за участю каталізаторів дії світла електричного струму механічного впливу і т.п.
Всього у темі 28 презентацій
Зміна ентальпії DH, по суті, - різниця енергій зв'язків реагентів та продуктів, включаючи енергії сполучення, напруги та сольватації. DH можна розрахувати, підсумовуючи енергії всіх зв'язків, що розриваються в ході реакції і віднімаючи з них суму енергій всіх зв'язків, що утворюються, додавши всі зміни енергій сполучення, напруги і сольватації. З іншого боку, зміну ентальпії можна визначити експериментально, вимірявши тепловий ефект реакції, т.к. зміна ентальпії дорівнює тепловому ефекту реакції, взятому зі зворотним знаком.
- DH =Qр
Зміна ентропії DS характеризує міру безладдя системи. У органічної хімії цей чинник рідко грає велику роль, т.к. реакції йдуть за відносно невеликих температур, при яких ентропійний фактор малий. Тим не менш, у деяких випадках зміна ентропії може відігравати помітну роль:
· оскільки гази мають вищу ентропію, ніж рідини (тим більше, ніж тверді речовини), то будь-яка реакція, в якій вихідні речовини рідкі або тверді, а один або більше продуктів – газоподібні, термодинамічно вигідна, оскільки ентропія системи зростає;
· якщо в ході реакції утворюється більше молекул продуктів, ніж молекул вихідних речовин, реакція протікає зі збільшенням ентропії.
Саме собою негативне значення DG не означає, що реакція протікатиме в найближчий період часу. Негативна величина зміни вільної енергії є необхідним, але не достатнім фактором мимовільного перебігу хімічної реакції. Наприклад, реакція двох моль водню з одним моль кисню, що протікає з утворенням води, характеризується великою негативною величиною зміни вільної енергії. Однак, суміш О2 і Н2 може десятиліттями зберігатися при кімнатній температурі без ознак хімічної реакції.
Механізми органічних реакцій
Для розуміння органічних реакцій надзвичайно корисним є знання їх механізмів.
Механізм реакції – детальний опис процесу перетворення вихідних сполук на продукти. Механізм включає дані про спосіб і послідовність розриву та утворення зв'язків, будову інтермедіатів (проміжних продуктів), кінетиці, термодинаміки та стереохімії реакції. Механізм не повинен суперечити наявним експериментальним фактам, а при появі нових пояснювати їх.
При розгляді тонких особливостей механізмів надзвичайно корисним є використання так званої енергетичної діаграми (енергетичного профілю) реакції. Це графічна залежність енергії системи від складної функції відстані між речовинами, що реагують, яку зазвичай називають « координатою реакції» або « перебігом реакції(рис 3.1).
Мал. 3.1. Енергетична діаграма: А – ендо-, Б – екзотермічна реакція.
Даний малюнок ілюструє перебіг одностадійних реакцій. Ендотермічна реакція проходить із поглинанням тепла, екзотермічна – із виділенням.
Практично всі хімічні реакції відбуваються при зіткненні двох або більше, що дуже рідко реагують частинок. З рис. 3.1 видно, що зближення молекул, що реагують, веде до зростання енергії системи до деякого максимуму. Зіткнення будуть ефективними в тому випадку, коли реагуючі речовини мають деякий надлишок енергії в порівнянні з середньою енергією молекул в системі. Частки, що не мають такого надлишку, енергії після зіткнення розлітаються в різні боки. Енергія активації- надлишок енергії, необхідний подолання енергетичного бар'єру. Максимальна енергія системи (вища точка енергетичної діаграми) відповідає перехідний стан (активований комплекс). Саме наявність перехідного стану пояснює причину того, що навіть екзотермічні реакції зазвичай не відбуваються спонтанно, а лише при нагріванні або інших способах активації системи.
Саме перехідний стан – найвища енергетична точка реакції – визначає перебіг всього перетворення. Знання його будови здатне внести ясність у механізм хімічного перетворення. Проте, час життя активованого комплексу настільки мало, що немає фізичних методів, дозволяють його зареєструвати, і, отже, отримати знання про його будову.
Постулат Дж. Хеммонда
Для непрямої оцінки будови перехідного стану використовують постулат Дж. Хеммонда (1955 р.): несуттєві енергетичні зміни супроводжуються незначними змінами молекулярної структури. Більш зрозуміле формулювання: будова перехідного стану схожа на будову тих речовин, до яких вона ближча за енергією. В екзотермічних реакціях перехідний стан ближчий за будовою до вихідних реагентів (рис. 3.1). Такий активований комплекс називають раннім перехідним станом. Перехідний стан в ендотермічних реакціях ближчий за структурою до продуктів реакції, його називають пізнім. Однотипні на схожі структури призводять до близького результату. Тому все фактори, що стабілізують(знижують енергію стану) енергетично близьке до перехідного станувихідне, проміжне або кінцеве речовина, що знижують та енергію активованого комплексу.
Використання постулату Хеммонда особливо корисне під час розгляду багатостадійних реакцій (рис. 3.2).
 |
Рис. 3.2. Енергетична діаграма двостадійної реакції
З малюнка 3.2 видно, що реакція протікає дві стадії, через один проміжний продукт. Перетворення продуктів на інтермедіат (перша стадія) має більше значення для всієї реакції, ніж перетворення інтермедіату на продукти реакції (друга стадія). У цьому переконують відповідні енергії активації першої та другої стадій (Ea 1 та Ea 2 відповідно). Весь хід реакції визначає її найвища енергетична точка - перехідний стан першої стадії [ПС 1]. Якщо застосувати до цієї реакції постулат Хеммонда, легко зробити висновок, що до перехідних станів обох стадій реакції енергетично найближче проміжний продукт.
С.Арреніус відкрив температурну залежність швидкості багатьох реакцій, яку можна описати рівнянням:
k = А е - Е* / RT
де k - константа швидкості, e - основа натуральних логарифмів, R - універсальна газова постійна, T - Температура, А - передекспоненційний множник, Е* - Енергія активації реакції.
теорія активних зіткнень(Зіткнень)
1) Хімічне взаємодія між молекулами можливе лише за її зіткненні.
2) Не кожне зіткнення молекул призводить до хімічної взаємодії, тобто є результативним або, за термінологією Арреніуса, активним. Існує якийсь енергетичний бар'єр, Подолати який і вступити у взаємодію може лише частина молекул, причому, як правило, це дуже мала частина від їх загальної кількості в системі.
3) Причиною, що зумовлює існування енергетичного бар'єру, є взаємне відштовхування електронних оболонок молекул за її зближення.
4) Для того щоб молекули могли при зіткненні подолати енергетичний бар'єр, вони повинні рухатися назустріч один одному з досить великою швидкістю. Для досягнення цієї необхідної швидкості потрібна певна енергія, яка називається енергією активації. Енергія активації Е* - це надлишок енергії активних молекул порівняно з неактивними, чи інакше, енергія, якою повинні мати молекули, щоб мати можливість вступити у взаємодію. Розмірність СІ енергії активації – Дж/моль.
5) Чим більша енергія активації реакції, тим більший енергетичний бар'єр, і тим менше молекул здатне його подолати. Тому чим більше Е* тим повільніше йде реакція.
6) З підвищенням температури збільшується швидкість теплового руху молекул, тому частка активних молекул зростає. Іншими словами, при підвищенні температури відбувається термічна активація, що призводить до збільшення швидкості реакції
обчислення енергії активації реакції за значеннями двох констант швидкості за різних температур:
Т 2 - Т 1 k 1
Активований комплексявляє собою нестійке утворення, в яке входять всі атоми молекул, що зіткнулися і вступили у взаємодію. Час життя активованого комплексу замало; воно вимірюється малими (мільйонними, десятимільйонними тощо. буд.) частками секунди. Відстань між атомами в активованому комплексі дещо більша, ніж у звичайних молекулах, тому для його утворення потрібна додаткова енергія.
Наочне уявлення про перебіг реакції в часі відповідно до теорії перехідного стану може дати енергетичний профільреакції, наприклад, екзотермічної (рис. 12.6).
По осі ординат відкладається енергія системи Е , а вісь абсцис – це так звана координата реакції. Середньому запасу енергії теплового руху молекул вихідних речовин відповідає рівень Е вих, енергії, що запасається в активованому комплексі - рівень Е АК. Тоді різниця Е АК - Е их дорівнює величині енергетичного бар'єру, який повинні подолати молекули для того, щоб вступити у взаємодію енергія активації. Наочне уявлення про нього дає крива, що з'єднує рівні Е вих і Е АК. Висота енергетичного бар'єру залежить від природи речовин, що реагують, енергії, необхідної для утворення активованого комплексу (енергії активації), а також від середньої енергії теплового руху молекул Е вих.
При підвищенні температури рівень Е Вих піднімається, величина енергетичного бар'єру стає менше і у взаємодію може вступити більше молекул. Це і є причиною прискорення реакції з підвищенням температури. При зниженні температури, навпаки, рівень Е Вих опускається і величина енергетичного бар'єру зростає, що призводить до зменшення швидкості реакції.
При розпаді активованого комплексу з утворенням молекул продуктів виділяється енергія, якій відповідає різниця Е АК - Е прод, де Е прод – середній запас енергії молекул продуктів. Частина цієї енергії, що виділяється, рівна різниці Е АК - Е вих, піде на активацію нових молекул вихідних речовин, а надлишок Е вих - Е прод виділиться у навколишнє середовище у вигляді екзотермічного теплового ефекту реакції DН r .
Для ендотермічних реакцій енергетичний профіль виглядає дещо інакше (рис. 12.7). Видно, що у цьому випадку енергетичний рівень Е вих нижче, ніж рівень Е прод. Внаслідок цього енергії Е АК - Е прод, що виділяється при розпаді активованого комплексу, недостатньо для того,
щоб викликати активацію нових молекул реагуючих речовин. Тому для продовження реакції необхідне підведення енергії ззовні у вигляді ендотермічного теплового ефекту.
Існування активованого комплексу підтверджується експериментальними даними. Так, наприклад, для однієї з нескладних модельних реакцій взаємодії атома водню з молекулою водню
Н 2 + Н ® Н + Н 2
значення енергії активації близько 36,8 кДж/моль. Якби реакція йшла через стадію повної дисоціації молекул Н 2 а не через стадію утворення активованого комплексу Н 2 · Н, то була б потрібна енергія активації 435,1 кДж/моль.
55. Фотохімія. Фотохімічні реакції. Основні закони фотохімії (Закон Гротгуса-Дрейпера, закон Бунзена-Роско, закон Штарка-Ейнштейна).
фотохіміяце - розділ хімічної кінетики, що займається поведінкою електронно-збуджених молекул .
У біології відомо кілька фотохімічних процесів, що мають надзвичайно велике значення для життєдіяльності як окремих організмів, так і біосфери загалом. Насамперед серед таких процесів слід назвати фотосинтезКрім того, надзвичайно важливими є фотохімія зору, фотохімія синтезу вітамінів, наприклад, вітаміну D у людській шкірі, фотохімія засмаги та ін.
Фотохімічна реакція розкладання галогенідів срібла є основою фотографічного процесу. Існують фотохромні матеріали, здатні змінювати колір або прозорість під дією світла, що використовується, зокрема, для фотохімічного запису інформації або виготовлення сонцезахисних окулярів. Фотохімічні реакції використовуються і в хімічній промисловості, наприклад, при синтезі капролактаму або фотополімеризації метилметакрилату у виробництві органічного скла.
Для фармації фотохімічні реакції важливі в першу чергу остільки, оскільки світло може викликати деструкцію. фотоліз) багатьох лікарських препаратів. Розкладу під впливом світла схильні і багато інших речовин і матеріали - деревина, папір, фарби, пластмаси тощо.
У хімії досить широко використовується люмінесцентний метод аналізу, заснований на вивченні спектрів випромінювання, що випромінюється збудженими молекулами досліджуваних речовин.
Закони фотохімії
Відомі такі закони фотохімії:
Закон Гроттгуса – Дрейпера(К.І.Д.Гроттгус – 1818; Дж.У.Дрейпер – 1842).