Lekcia 5
Téma: Podstata procesu elektrolytickej disociácie
Ciele a ciele:
Vzdelávacie:formovať pojmy „elektrolyty, neelektrolyty, roztok, hydratácia, hydráty, kryštalické hydráty, kryštalizačná voda“, odhaliť podstatu procesu elektrolytickej disociácie, zvážiť hlavné ustanovenia teórie elektrolytickej disociácie;
vyvíja sa: rozvíjať schopnosť pracovať s textom, charakterizovať proces elektrolytickej disociácie;
Vzdelávacie: pestovať záujem o chémiu, formovať vedecký svetonázor.
Vybavenie: soľ, voda, stôl, učebnica, zošity, did.karty.
Počas tried:
1) Organizačný moment
2) Kontrola d.z.
Frontálny rozhovor: "Hlavné triedy anorganických látok";
Individuálne písmená. prieskum karty
Možnosť 1: Uveďte definície: soli, oxidy. Uveďte ich klasifikáciu.
Uveďte príklady
Možnosť 2: Uveďte definície: zásady, kyseliny. Uveďte ich klasifikáciu.
Uveďte príklady.
Diktát
Napíšte vzorce kyselín, ich zvyškov kyselín, označte ich mocenstvo.
3) Učenie sa nového materiálu
1. Aktualizácia vedomostí
I. Pokusy so suchými látkami, roztokmi a taveninami na vedenie elektrického prúdu
Obr.1 str.3
Suchý NaCl, sóda
Destilovaná voda - nevedie elektrinu
Roztoky NaCl, alkálie, soli - vedú prúd
Roztoky glukózy
Alkohol - neveďte elektrický prúd
Sahara
Kyslík
dusíka
II. Mechanizmus rozpúšťania vo vode
1) B-in s iónovou väzbou
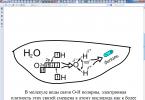
Obr. 2 Na + Cl - + H-O-H
V p-re sú ióny hydratované - obklopený molekulami vody
2) In-in s kovalentnou polárnou väzbou
НCl H + + Cl - hydratované ióny
Kovalentná väzba sa stáva iónovou
III. Látky
Elektrolyty Neelektrolyty str.5
… …
Definície
Soľný kyslík
Alkalický dusík
Vodíkové kyseliny
S iónovou alebo kovalentnou s kovalentnou nepolárnou / slabo polárnou väzbou
vysoko polárna väzba
IV. Elektrolytická disociácia -proces rozkladu elektrolytu na ióny pri rozpustení vo vode alebo roztavení.
V. Rozpúšťanie je fyzikálny a chemický proces
V. Hydratácia iónov
Kablukov a Kistyakovsky navrhli, že keď p-rénium, molekuly vody sa viažu na ióny a vytvárajú hydratuje
Definícia str.6
VI Kryštalické hydráty a kryštalická voda
C.7 definícia
VII.Základné ustanoveniateórie elektrolytickej disociácie
Sam-ale str.8-9 naspamäť
4) Upevnenie
B.1-6 str.13
5) Reflexia
6) d.z.
P.1 prerozprávanie, definície a ustanovenia teórie naspamäť
Kazachstan, región Severný Kazachstan, oblasť pomenovaná podľa Gabita Musrepova, obec Sokologorovka
KSU "Sokolgorovskaya stredná škola"
Lekcia v 9. ročníku
Téma: "Podstata procesu disociácie"
Plán lekcie
Predmet: Podstata procesu elektrolytickej disociácie
Ciele lekcie: prehĺbiť a zovšeobecniť vedomosti, základné pojmy elektrolytickej disociácie; naučiť ich aplikovať pri zostavovaní disociačných rovníc; poskytnúť predstavu o univerzálnosti teórie elektrolytickej disociácie a jej aplikácie v anorganickej chémii.
Základné pojmy: elektrolyty, neelektrolyty, disociácia, hydráty, kryštálové hydráty.
Štruktúra lekcie
1) Organizačný moment
2) Kontrola domácich úloh
3) Učenie sa nového materiálu
4) Konsolidácia nového materiálu
5) Domáce úlohy, známkovanie
Počas vyučovania
1) Organizačný moment (3-5 min.)
2) Kontrola domácich úloh (10 min.)
a) Určte kovalentné polárne a nepolárne väzby v molekulách: N 2, CO 2, NH 3, SO 2, HBr.
b) Čo je elektronegativita?
c) Ako vznikajú σ-väzby a π-väzby?
d) Čo je príčinou prudkého rozdielu vo fyzikálnych vlastnostiach CO 2 a SiO 2?
e) Vymenuj druhy chemických väzieb.
3) Učenie sa nového materiálu (15-20 min.)
Elektrolyty a neelektrolyty. Vlastnosti rozpúšťania látok s rôznymi typmi chemických väzieb vo vode možno experimentálne študovať štúdiom elektrickej vodivosti roztokov týchto látok pomocou zariadenia na testovanie elektrickej vodivosti roztokov.
Ak sú elektródy prístroja ponorené napríklad do suchej kuchynskej soli, žiarovka sa nerozsvieti. Rovnaký výsledok sa dosiahne, ak sa elektródy ponoria do destilovanej vody. Keď sa však elektródy ponoria do vodného roztoku chloridu sodného, žiarovka začne svietiť. To znamená, že roztok chloridu sodného vedie elektrický prúd. Ostatné rozpustné soli, zásady a kyseliny sa správajú podobne ako chlorid sodný. Soli a zásady vedú elektrický prúd nielen vo vodných roztokoch, ale aj v taveninách. Vodné roztoky, ako je cukor, glukóza, alkohol, kyslík, dusík, nevedú elektrický prúd. Na základe týchto vlastností sa všetky látky delia na napr elektrolytov A neelektrolytov.
Mechanizmus rozpúšťania látok s rôznou povahou chemickej väzby vo vode. Prečo soli, zásady a kyseliny vo vodnom roztoku vedú elektrický prúd z uvažovaných príkladov? Na zodpovedanie tejto otázky je potrebné pripomenúť, že vlastnosti látok sú určené ich štruktúrou. Napríklad štruktúra kryštálov chloridu sodného sa líši od štruktúry molekúl kyslíka a vodíka.
Pre správne pochopenie mechanizmu rozpúšťania látok s iónovou väzbou vo vode treba vziať do úvahy aj to, že v molekulách vody existujú kovalentné vysoko polárne väzby medzi atómami vodíka a kyslíka. Preto sú molekuly vody polárne. Výsledkom je, že napríklad pri rozpustení chloridu sodného sú molekuly vody priťahované svojimi zápornými pólmi k ich kladným pólom - k záporne nabitým chloridovým iónom. Výsledkom je oslabenie väzby medzi iónmi a zničenie kryštálovej mriežky. Tento proces je tiež uľahčený dielektrická konštanta vody, čo sa pri 20ºС rovná 81. Chemická väzba medzi iónmi vo vode je oslabená 81-krát v porovnaní s vákuom.
Keď sa vo vode rozpustia látky s vysoko polárnou kovalentnou väzbou, napríklad chlorovodík HCl, zmení sa charakter chemickej väzby, t.j. vplyvom polárnych molekúl vody sa kovalentná polárna väzba zmení na iónovú a následne proces odštiepenia častíc.
Počas tavenia elektrolytov sa zväčšujú oscilačné pohyby častíc, čo vedie k oslabeniu väzby medzi nimi. V dôsledku toho je zničená aj kryštálová mriežka. V dôsledku toho, keď sa soli a zásady rozpustia, tieto látky sa rozložia na ióny.
Proces rozkladu elektrolytu na ióny, keď je rozpustený vo vode alebo roztavený, sa nazýva elektrolytická disociácia.
Základné teoretické ustanovenia elektrolytickej disociácie formuloval v roku 1887 švédsky vedec Svante Arrhenius. S. Arrheniusovi sa však nepodarilo úplne odhaliť zložitosť procesu elektrolytickej disociácie. Nebral do úvahy úlohu molekúl rozpúšťadla a veril, že vo vodnom roztoku sú prítomné voľné ióny. Koncept elektrolytickej disociácie sa ďalej rozvíjal v prácach ruských vedcov I. A. Kablukova a V. A. Kistyakovského. Aby sme pochopili podstatu myšlienok týchto vedcov, zoznámime sa s javmi, ktoré sa vyskytujú pri rozpustení látok vo vode.
Keď sa tuhý hydroxid sodný NaOH alebo koncentrovaná kyselina sírová H2S04 rozpustí vo vode, dôjde k silnému zahrievaniu. Zvlášť opatrne je potrebné rozpúšťať kyselinu sírovú, pretože v dôsledku zvýšenia teploty sa časť vody môže zmeniť na paru a pod jej tlakom môže kyselinu vyhodiť z nádoby. Aby ste tomu zabránili, kyselina sírová sa vleje do vody tenkým prúdom (ale nie naopak!) za stáleho miešania.
Ak sa napríklad dusičnan amónny (dusičnan amónny) rozpustí vo vode v tenkostennom pohári umiestnenom na mokrej doske, potom sa pozoruje také silné ochladenie, že sklo k nemu dokonca primrzne. Prečo sa pri rozpúšťaní látok v niektorých prípadoch pozoruje zahrievanie a v iných chladenie?
Keď sa pevné látky rozpustia, ich kryštálové mriežky sa zničia a výsledné častice sa rozdelia medzi molekuly rozpúšťadla. V čom potrebná energia je absorbovaná zvonku a dochádza k ochladzovaniu. Na tomto základe by sa mal pripísať proces rozpúšťania fyzikálnych javov.
Prečo dochádza k zahrievaniu, keď sú niektoré látky rozpustené?
Ako vieme, uvoľňovanie tepla je znakom chemickej reakcie. teda pri rozpustení sa uskutočňujú aj chemické reakcie. Napríklad molekuly kyseliny sírovej reagujú s molekulami vody a vznikajú zlúčeniny zloženia H 2 SO 4 ·H 2 O (monohydrát kyseliny sírovej) a H 2 SO 4 ·2H 2 O (dihydrát kyseliny sírovej), t.j. molekula kyseliny sírovej pripojí jednu alebo dve molekuly vody.
Interakcia molekúl kyseliny sírovej s molekulami vody sa označuje ako hydratačné reakcie a látky, ktoré v tomto prípade vznikajú, sa nazývajú hydráty.
Z vyššie uvedených príkladov je vidieť, že pri rozpustení pevných látok vo vode dochádza k fyzikálnym aj chemickým procesom. Ak sa v dôsledku hydratácie uvoľní viac energie, ako sa vynaloží na zničenie kryštálov látky, potom je rozpustenie sprevádzané zahrievaním, ak naopak - chladením.
teda rozpúšťanie je fyzikálno-chemický proces.
Takéto vysvetlenie podstaty procesu rozpúšťania a povahy riešení prvýkrát teoreticky zdôvodnil veľký ruský vedec D.I. Mendelejev. vyvinuli sa hydrátová teória roztokov.
Pri štúdiu procesov hydratácie mali vedci otázku: s akými časticami reaguje voda?
I.A.Kablukov a V.A.Kistyakovsky nezávisle od seba navrhli, že ióny elektrolytov reagujú s molekulami vody, t.j. deje iónová hydratácia. Toto
4) Konsolidácia nového materiálu (5-7 min.)
a) Kedy sa začal výskum zloženia vzduchu?
b) Aké látky sú prítomné vo vzduchu?
c) Ktorý vedec ako prvý zistil zloženie francúzskeho vzduchu v roku 1774?
5) Domáce úlohy, známkovanie (3 min.)
§26 prerozprávanie str.70-72; cvičenia č.3, 4,5 str.72
Zhrnutie hodiny chémie 9. ročníka
Téma lekcie "Elektrolytická disociácia"
Typ lekcie: Zovšeobecňovanie a systematizácia poznatkov.
Cieľ: upevniť vedomosti študentov na tému "Teória elektrolytickej disociácie"
Úlohy:
Vzdelávacie:
Upevniť vedomosti študentov o podstate procesu elektrolytickej disociácie,
Pomôžte študentom pochopiť základné pojmy z danej témy,
Pomôcť osvojiť si koncepciu mechanizmov a podmienok procesu pomocou pojmov elektrolyt, neelektrolyt;
Naučte sa písať chemické reakcie v molekulárnej a iónovej forme.
vyvíja sa:
prehlbovať a rozširovať poznatky o vlastnostiach látok na iónovej úrovni;
formovať vedecký rozhľad a rozvoj metód duševnej činnosti;
pokračovať v rozvoji rečových schopností, pozorovania a schopnosti vyvodzovať závery na základe demonštračného experimentu;
vedieť aplikovať základné poznámky a samostatne ich zostaviť.
Pedagógovia:
vytvoriť si vedecký pohľad na štruktúru a vlastnosti látok;
odhaliť myšlienku rozvoja v poznaní fyzikálnych a chemických procesov pri hromadení nových faktov a na základe experimentu;
vytvárať podmienky pre vzdelávanie so záujmom o učenie, pracovať na formovaní postojov študentov k chémii ako možnej oblasti budúcej praktickej činnosti.
Štruktúra lekcie:
Organizačný moment (2 min.);
Prezentácia témy a účelu hodiny (2 min.);
Tvorba motivácie (1 min.);
Aktualizácia základných vedomostí (5 min.);
Zovšeobecnenie a systematizácia (15 min.)
Aplikácia vedomostí a zručností (18 min.);
Zhrnutie výsledkov lekcie (1 min.)
Hlásenie a komentovanie domácich úloh (1 min.)
Počas vyučovania
V predchádzajúcich lekciách sme sa zoznámili s jednou z najdôležitejších teórií, o ktorú sa opiera chemická veda – ide o teóriu elektrolytickej disociácie.Žiaci pozorne počúvajú učiteľa
A dnes v lekcii musíme zovšeobecniť a systematizovať poznatky o tejto teórii a upevniť schopnosť zostaviť rovnice disociačných a iónomeničových reakcií. Počas hodiny budeme plniť rôzne úlohy, k tomu máte pracovné listy s úlohami a tabuľku, do ktorej budete zapisovať výsledky do svojich tabuliek. Na konci hodiny budete môcť samostatne zhodnotiť svoje vedomosti o preberanej téme.
Predné
Najprv si spomeňme na definíciu pojmu „elektrolyty“. Čo to je?
Čo sú to „neelektrolyty“?
Teraz uveďte definíciu "elektrolytickej disociácie"
Látky roztoky alebo taveniny kotoelektrolytov .
Látky, ktorých roztoky a taveniny nevedú elektrický prúd, sa nazývajú neelektrolytov.
Proces rozkladu elektrolytov na ióny pri rozpustení vo vode alebo tavení sa nazýva elektrolytická disociácia.
Individuálne
Teraz požiadam študenta, aby išiel k tabuli a pomocou navrhovanej schémy odhalil podstatu procesu EMF. Dajte odpovede na otázky: Čo je disociácia, asociácia, hydratované ióny, katióny, anióny.
Ako sa nabíjajú elektródy?
ako sa volajú? prečo?
Aké sú náboje iónov?
Látky, roztoky alebo taveniny ktoré vedú elektrický prúd sa nazývajú elektrolytov . V taveninách a roztokoch sa elektrolyty rozkladajú na nabité častice -ióny . Proces, pri ktorom sa elektrolyty rozkladajú na ióny, sa nazývaelektrolytická disociácia . Toto je reverzibilný proces. Asociácia opačne nabitých iónov sa nazývazdruženia .
Ióny v taveninách sa líšia od iónov v roztokoch tým, že tieto sú obklopené hydratačným obalom. Ióny v roztokoch a taveninách sa pohybujú náhodne. Pod vplyvom elektrického prúdu získavajú usmernený pohyb. Kladne nabité ióny sa pohybujú smerom k negatívnej elektróde (katóde), a preto sa nazývajúkatión ami, záporne nabité ióny sa pohybujú v elektrickom poli smerom k anóde a nazývajú saanión ami.
Základné ustanovenia TED.
Elektrolyty v roztokoch a taveninách sa rozkladajú na ióny.
Ióny majú inú štruktúru ako atómy.
V tavenine a roztoku sa ióny pohybujú náhodne, ale keď prejde elektrický prúd, ióny sa začnú pohybovať v smere: katióny - ku katóde, anióny - k anóde.
Aplikácia
Individuálne
Pomocou diagramu opíšte štruktúru molekuly vody.
V molekule vody sú väzby O - H polárne, elektrónová hustota týchto väzieb je posunutá k atómu kyslíka ako elektronegatívnejšia. V dôsledku toho vzniká čiastočný záporný náboj na atóme kyslíka a čiastočný kladný náboj na atómoch vodíka. Pretože uhol H-O-H je 105°, atóm kyslíka a atóm vodíka sú na rôznych koncoch molekuly, v ktorej sa akoby objavili dva póly. Takéto molekuly sa nazývajú dipóly.
Individuálne
Pomocou schémy navrhnite mechanizmus disociácie elektrolytov
Keď je iónový kryštál ponorený do vody, dipóly vody sú orientované vzhľadom na jej ióny s opačne nabitými koncami (pólmi). V dôsledku elektrostatickej interakcie medzi iónmi rozpustenej látky a molekulami vody dochádza k deštrukcii iónového kryštálu av roztokoch hydratovaných iónov (proces disociácie). Keď sú látky s kovalentnou polárnou väzbou rozpustené vo vode, procesu disociácie predchádza polarizácia väzby. Dipóly vody, ktoré sa podľa toho orientujú, polarizujú túto väzbu a otáčajú sa ju v iónové, po ktorom nasleduje disociácia látky za vzniku hydratovaných iónov.
Takéto predstavy o disociácii vo vodných roztokoch zlúčenín s rôznymi typmi chemických väzieb (CS) nevznikli okamžite.
Predné
Ako viete, existuje niekoľko teórií riešení. Povedzte nám stručne o týchto teóriách a uveďte ich autora.
Prečo riedenie roztoku vedie k zvýšenej disociácii?
S. Arrhenius a ďalší priaznivci fyzikálnej teórie, nachádzajúci ióny v roztokoch vzniknutých pôsobením rozpúšťadla, nebrali do úvahy ich hydratáciu.
DI. Mendelejev - autor chemickej teórie roztokov, pomaly izoloval hydráty kyseliny sírovejodparovanie jeho roztoky a navrhol, že nestabilné chemické zlúčeniny rozpustenej látky a rozpúšťadla (vo všeobecnom prípade solváty) sa tvoria v roztokoch.
Následne I.A. Kablukov a ďalší vedci kombinovaním oboch teórií ukázali, že rozpúšťanie je fyzikálny a chemický proces; v dôsledku toho sa tvoria hydratované ióny.
Po rozpustení sa zvyšuje počet molekúl vody, ktoré premieňajú atómy na hydratované ióny; tiež sa disociácia látok zvyšuje so zvyšujúcou sa teplotou v dôsledku zvýšenia rýchlosti pohybu molekúl
Samostatná práca
A teraz sa pokúste sami vo svojich notebookoch zostaviť referenčný diagram „Silné a slabé elektrolyty“. V každej skupine uveďte 3 príklady.
Vo svojom abstrakte definujte pojem Stupeň disociácie a vzorec na jeho definíciu
Žiaci samostatne pripravujú schému 10-15 minút.
Kvantitatívne možno proces disociácie látky v roztoku odhadnúť zo stupňa disociácie α. Vypočítava sa ako pomer počtu molekúl elektrolytu rozložených na ióny k celkovému počtu molekúl rozpustenej látky a vyjadruje sa v percentách.
Stupeň disociácie α závisí od povahy chemickej väzby v kryštáloch alebo molekulách rozpustenej látky a rozpúšťadla. Čím je táto väzba polárnejšia, tým je hodnota α vyššia. Keď sa roztoky zriedia, a sa zvyšuje (pozri graf, kde c je koncentrácia roztoku).
V závislosti od stupňa disociácie sa všetky elektrolyty rozdeľujú na silné (α> 30 %), stredne silné (α od 2 do 30 %), slabé (α< 1 %). Приведены их примеры.
Myslíte si, že sme dosiahli naše ciele?
Aký materiál vám robil problémy?
Známkovanie za prácu v triede
Napíšte rovnice pre disociáciu látok: Al 2 (SO 4) 3, K 2 CO 3, FeCl 3.
Aplikácie
Schéma 1
Schéma 2

Schéma 3

Schéma 4

Schéma 5


Schéma 6

Abstraktné
hodina chémie v 8. ročníku
Škola č.16 v Saransku
Žiaci 4. ročníka chemického odboru
Ústav fyziky a chémie
Moskovská štátna univerzita N. P. Ogareva
Téma lekcie: elektrolytická disociácia.
Ciele lekcie:
Vzdelávacie:formovať základné pojmy o elektrolytoch a neelektrolytoch, o písaní disociačných rovníc, uvažovať o mechanizme disociácie látok s rôznymi typmi väzieb.
Vzdelávacie: Formovanie zručností tímovej práce v kombinácii s individuálnou prácou, zvyšovanie tvorivej aktivity študentov, kognitívny záujem o chémiu, zmysel pre zodpovednosť voči svojim kamarátom.
vyvíja sa: Rozvoj kognitívnych schopností žiakov, formovanie samostatného myslenia, schopnosti logicky uvažovať, zovšeobecňovať a vyvodzovať závery zo získaných poznatkov.
Typ lekcie: kombinované.
Metódy lekcie:
Sú bežné: vysvetľujúce a názorné;
Súkromné: verbálne - vizuálne - praktické.
Vybavenie a činidlá:destilovaná voda, KCl (roztok a tuhá látka), roztok sacharózy, zásada, HCl, CuSO 4 , prístroj na štúdium elektrickej vodivosti roztokov týchto látok, chemická kadička.
Plán lekcie:
Organizačný moment 1 min.
Kontrola domácich úloh 10 min
Učenie nového materiálu 30 min
Generalizácia 3 min
Zhrnutie 1 min
(známkovanie, domáca úloha)
Ahojte chalani!
Som rád, že vás môžem privítať na lekcii.
Moji drahí priatelia!
Všetkým vo svojom mene blahoželám.
Každý z vás je dobrý svojím vlastným spôsobom:
Pre ľudí, pre podnikanie je to dobré pre všetkých.
Teraz chlapci nebuďte smutní
A riešiť problémy
Poď, kľudne lietaj
A dostávať úlohy.
Karta: "Extra riešenie"
Pomenujte „extra“ (vypadnutie z radu) riešenie z piatich navrhnutých. Prečo si myslíte, že je nadbytočný? Čo majú ostatné štyri riešenia spoločné?
zliatina medi a zinku (mosadz)
roztok jódu v alkohole (jódová tinktúra)
zliatina medi a cínu (bronz)
zliatina medi a niklu (cupronikel)
zliatina hliníka s meďou (dural)
Karta „Chýbajúce riešenie“
Ktoré z nasledujúcich riešení (a - c) by ste umiestnili namiesto otáznika v bode 5? Vysvetlite, prečo ste si vybrali toto riešenie? Prečo iné riešenia nie sú vhodné?
roztok kyslíka vo vode
roztok kyseliny sírovej vo vode
cukrový roztok vo vode
roztok kyseliny dusičnej vo vode
a) oxid uhličitý vo vzduchu, b) roztok chloridu sodného vo vode,
c) zliatina zlata a striebra.
V tejto chvíli sa kladú tieto otázky:
Pripomeňme si úlohu riešení v prírode a praktickú činnosť ľudí.
Vysvetlite podstatu fyzikálnej a chemickej teórie roztokov. Prečo je potrebné ich kombinovať?
Aké je teda riešenie?
Uveďte dôkaz o chemickej interakcii rozpustenej látky s vodou?
Čo je to: hydratácia, hydratuje, kryštalické hydráty?
Aká je rozpustnosť látok vo vode?
Ako sú kvantitatívne definované pojmy „veľmi rozpustný vo vode“, „málo rozpustný“, „prakticky nerozpustný“?
Poďme si zahrať hru „pošli to ďalej“:
Na tabuli je napísaná otázka: Je táto látka klasifikovaná ako slabo rozpustná, vysoko rozpustná alebo prakticky nerozpustná? (pracujte s tabuľkou rozpustnosti)
Trieda je rozdelená do šiestich skupín (v radoch). Každá skupina dostane albumový list rozdelený do štyroch stĺpcov (priezvisko študenta a odpovede na otázku) a toľko riadkov, koľko je hráčov v tíme.
Úlohou je vymyslieť spojenie, ktoré nie je rovnaké ako u susedov, a splniť úlohy.
Ak študent dokáže okamžite odpovedať na otázku, potom napíše odpoveď a rýchlo odovzdá hárok členovi tímu, ktorý sedí za ním. A tím, ktorého hárok sa dostane k učiteľovi ako prvý, získa body navyše.
Dovoľte mi prečítať vám báseň:
Žil jeden iónový kryštál,
Pre ióny je dom obrovský,
Bol pekný a vyrovnaný.
Stali sa mu však problémy.
Spadla na neho kvapka
A kryštál bol v okamihu preč:
Rozložte na ióny
Jeho šikovná voda.
Celá rodina bola prekvapená:
"Čo sa stalo vonku?"
A aby ste na túto otázku odpovedali, pomôže vám dnešná téma „Elektrolytická disociácia“. (disketa č. 1: názov témy.) A cieľom našej lekcie je predstaviť nové koncepty tejto témy.
Takže viete, že existujú látky, ktoré dobre vedú elektrický prúd - to sú (vodiče).
Vodiče sa delia na vodiče prvého druhu - kovy a vodiče druhého druhu - elektrolyty.
Pamätajte si, čo je elektrický prúd?(Toto je riadený pohyb nabitých častíc.)
Pretože Budeme pracovať s elektrickým prístrojom, je potrebné dodržiavať bezpečnostné predpisy. Aké pravidlá poznáte? (nedotýkajte sa holých drôtov, elektród rukami, najmä mokrými; keď sa prístroj rozsvieti, vypnite hlavný vypínač, nenechávajte ho zapojený, uhaste pieskom)
Urobme experiment na štúdium elektrickej vodivosti roztokov určitých látok.
Zariadenie pozostáva zo skla, do ktorého sa naleje roztok testovanej látky. Na skle je umiestnená doska z ebonitu, v ktorej sú namontované dve uhlíkové elektródy, na ktorých svorky sú pripevnené drôty. Jeden z nich je pripojený k žiarovke. Výstupný kontakt zo žiarovky a vodič z druhej svorky idú do zdroja prúdu.
Elektródy spustíme do pohára s pevnou kryštalickou soľou CuSO 4 (kontrolka sa nerozsvieti), potom do roztoku CuSO 4 (žiarovka sa rozsvieti), potom do roztokov HCl, sacharózy, alkálií a do destilovanej vody.
Počas experimentu chlapci vypĺňajú tabuľku:
CuS04 |
atď.
Povedzte mi, prečo roztok kuchynskej soli vedie elektrický prúd, ale roztok sacharózy nie?(je to spôsobené tvorbou iónov.) A čo je to ión? (sú to najmenšie nabité častice látky, ktoré určujú chemické a fyzikálne vlastnosti tejto látky).
Podľa schopnosti viesť elektrický prúd sa teda látky delia na elektrolyty a neelektrolyty.(disketa č. 1: definície pojmov: elektrolyty a neelektrolyty)
Zo skúseností je zrejmé, že medzi elektrolyty patria roztoky solí, kyselín, zásad a neelektrolytov - organické zlúčeniny, pevné látky, plyny.
Aký je rozdiel medzi elektrolytmi a neelektrolytmi?(typ pripojenia.). Tie. elektrolyty zahŕňajú látky s iónovými a kovalentno-polárnymi väzbami.
Schopnosť elektrolytov viesť elektrický prúd je zásadne odlišná od schopnosti viesť elektrický prúd kovov. prečo? (pretože elektrická vodivosť kovov je spôsobená pohybom elektrónov a elektrická vodivosť elektrolytov je spojená s pohybom iónov.)
Poďme študovať správanie látok vo vodnom roztoku na príklade chloridu sodného.
Skúsenosti: spustíme elektródy do pohára s roztokom chloridu sodného (žiarovka sa rozsvieti).
Z výsledku experimentu usudzujeme, že vplyvom vody dochádza k zmenám látok. Voda spôsobuje rozklad elektrolytov na ióny. Tento proces sa nazýva disociácia.
Tento proces študoval švédsky vedec Svante Arrhenius. Vypočujme si odkaz vášho spolužiaka o jeho úspechoch v chémii (disk #2: Portrét Svante Arrheniusa)
Švédsky vedec Svante Arrhenius ako prívrženec fyzikálnej teórie roztokov nedokázal odpovedať na otázku: prečo dochádza k disociácii solí a zásad vo vodnom roztoku? Odpoveď na ňu dali ruskí chemici Kablukov, Kistyakovsky. Podstata ich prídavkov je nasledovná (pre poriadok): dôvodom disociácie elektrolytu v roztoku je jeho hydratácia, t.j. interakcia s molekulami vody. A ióny, ktoré vznikajú pri disociácii, budú hydratované, t.j. spojené s molekulami vody a ich vlastnosti sa budú líšiť od nehydratovaných.
Čo je molekula vody? Vo všeobecnosti molekula vody nie je nabitá. Ale vo vnútri molekuly vody sú atómy kyslíka a vodíka usporiadané tak, že kladné a záporné náboje sú na opačných koncoch molekuly. Preto je molekula vody dipól:
Zoberme si mechanizmus disociácie chloridu sodného pri rozpustení. Aký typ pripojenia má toto pripojenie? (iónové).(disk №2: disociácia látok s iónovou štruktúrou).
Všimol som si, že elektrolyty, ktoré majú iónovú štruktúru, sa najľahšie disociujú.
Disociácia látok s iónovou väzbou prebieha v troch fázach:
najprv sú k nim orientované náhodne sa pohybujúce molekuly vody v blízkosti iónov kryštálu s opačne nabitými pólmi - dochádza k orientácii.
potom sa vodné dipóly priťahujú, interagujú s iónmi povrchovej vrstvy kryštálu, dochádza k hydratácii.
Keď sa molekula vody presunie do roztoku, vezme so sebou hydratované ióny. Dochádza k disociácii.
A ako reagujú polárne molekuly elektrolytu s molekulami vody?
Podobné, ale o krok viac (disk №2: disociácia látok s kovalentno-polárnou väzbou):
orientácia
hydratácia
ionizácia, t.j. premena kovalentno-polárnej väzby na iónovú.
disociácia
Elektrolytická disociácia je teda proces rozkladu elektrolytu na ióny po rozpustení.
Malo by sa vziať do úvahy, že v roztokoch elektrolytov sa náhodne sa pohybujúce ióny môžu zraziť a spojiť do molekuly. Toto je proces združovania.
Venujte pozornosť znamienku v disociačnej rovnici. (disk #1: písanie disociačnej rovnice). Keďže počet molekúl vody, na ktoré sa ióny viažu, nie je známy, proces disociácie elektrolytu je znázornený zjednodušeným spôsobom: NaCl = Na+ +Cl-
Zapíšte si napríklad skrátenú rovnicu pre disociáciu niektorých látok s iónovou štruktúrou: Ca (OH) 2, Na2S04, Na3P04, Al2(S04).
V dnešnej lekcii ste sa naučili, čo je elektrolytická disociácia, mechanizmus disociácie.
Na základe vyššie uvedeného povedzte, aké procesy sú v básni zašifrované:
Žil jeden iónový kryštál,
Pre ióny je dom obrovský,
Bol pekný a vyrovnaný.
Stali sa mu však problémy.
Spadla na neho kvapka
A kryštál bol v okamihu preč:
Rozložte na ióny
Jeho šikovná voda.
Celá rodina bola prekvapená:
"Čo sa stalo vonku?"
Zrazu sa objavil vedľa série molekúl,
Pribehli v hlučnom roji,
Obklopený hustou formáciou:
„Chceme ponúknuť hrdinov
naše priateľstvo navždy...
Vodík na anióny,
hydroxid na katióny,
Neodchádzajte od nich iónov
Ani tu, ani tam.
(rozpustenie látky s iónovou väzbou, orientácia molekúl vody, hydratácia, disociácia)
Domáca úloha:§ 35, č. 2,5,6 s.147.
2





7

Anióny Katóda Anóda - +

Kryštál roztoku NaCl Na + + Cl H2OH2O H2OH2O Obr.4.

10 HCl roztok H + + Cl - H2OH2O H2OH2O Ryža HCl Cl - H+H+ + - H+H Cl-Cl-




14 Overovací test. Možnosť 1. Možnosť 2. 1. Neelektrolyty zahŕňajú: 1) uhličitan sodný 2) etylalkohol 3) kyselinu chlorovodíkovú 4) dusičnan zinočnatý 1. Neelektrolyty zahŕňajú: 1) chlorid bárnatý 2) cukor 3) kyselinu sírovú 4) draslík uhličitan 2 Disociuje sa tvorbou katiónov kovov a aniónov zvyšku kyseliny: 1). hydroxid meďnatý 2). hydroxid sodný 3). chlorid hlinitý 4). kyselina uhličitá 2. Za vzniku katiónov kovov a aniónov zvyšku kyseliny disociuje: 1) sacharózu 2) hydroxid sodný 3) bromid hlinitý 4) kyselinu dusičnú 3. Obidve látky v skupine sú elektrolyty: 1). CH4, CO2 2). C2H5OH, HN03 3). CaO, BaS04 4). NaCl, KOH 3. Elektrolyty sú obe látky v skupine: 1). glycerín, SO2 2). CuCl2, KOH 3). BaO, K2SO4 4). Fe(OH)3, H2SiO3 4. Väčšina vodíkových iónov vzniká pri disociácii rovná: 1). ahoj 2). H2C03 3). H2S 4). H2SiO3 4. Väčšina vodíkových iónov vzniká pri disociácii rovná: 1). H3P04 2). H2S04 3). HNO3 4). HF 5. Súčet koeficientov v rovnici disociácie síranu hlinitého je: 1). 4 2). 6 3). 2 4) Súčet koeficientov v disociačnej rovnici uhličitanu sodného je: 1). 4 2). 3 3). 2 4). 1