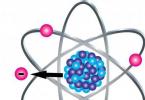
Dnes budeme viesť lekciu nielen modelovania, ale aj chémie a vyrobíme modely molekúl z plastelíny. Plastelínové gule môžu byť reprezentované ako atómy a obyčajné zápalky alebo špáradlá pomôžu ukázať štrukturálne spojenia. Túto metódu môžu využiť učitelia pri vysvetľovaní nového učiva z chémie, rodičia pri kontrole a štúdiu domácich úloh a samotné deti, ktoré sa o predmet zaujímajú. Jednoduchší a dostupnejší spôsob vytvárania obrazového materiálu pre mentálnu vizualizáciu mikroobjektov asi neexistuje.
Ako príklad uvádzame zástupcov zo sveta organickej a anorganickej chémie. Analogicky s nimi je možné vytvoriť iné štruktúry, hlavnou vecou je pochopiť celú túto rozmanitosť.
Materiály pre prácu:
- plastelína dvoch alebo viacerých farieb;
- štruktúrne vzorce molekúl z učebnice (ak je to potrebné);
- zápalky alebo špáradlá.
1. Pripravte si plastelínu na modelovanie guľovitých atómov, z ktorých sa vytvoria molekuly, ako aj zápalky na znázornenie väzieb medzi nimi. Prirodzene, je lepšie ukázať atómy rôznych typov v inej farbe, aby bolo jasnejšie predstaviť si konkrétny objekt mikrosveta.
2. Na výrobu guľôčok odštipnite potrebný počet porcií plastelíny, premiešajte v rukách a v dlaniach vyvaľkajte do tvarov. Na vyrezávanie molekúl organických uhľovodíkov môžete použiť väčšie červené gule - to bude uhlík a menšie modré gule - vodík.

3. Na vytvorenie molekuly metánu vložte štyri zápalky do červenej gule tak, aby smerovali k vrcholom štvorstenu.

4. Umiestnite modré loptičky na voľné konce zápaliek. Molekula zemného plynu je pripravená.

5. Pripravte si dve rovnaké molekuly, aby ste svojmu dieťaťu vysvetlili, ako možno získať molekulu nasledujúceho uhľovodíka, etánu.

6. Spojte dva modely odstránením jednej zápalky a dvoch modrých guľôčok. Ethan je pripravený.

7. Ďalej pokračujte vo vzrušujúcej aktivite a vysvetlite, ako vzniká viacnásobná väzba. Odstráňte dve modré guľôčky a zdvojnásobte väzbu medzi uhlíkmi. Podobným spôsobom môžete formovať všetky molekuly uhľovodíkov potrebné na lekciu.

8. Rovnaká metóda je vhodná na vyrezávanie molekúl anorganického sveta. Rovnaké plastelínové gule vám pomôžu realizovať vaše plány.

9. Vezmite centrálny atóm uhlíka - červenú guľu. Vložte do nej dve zápalky, ktoré definujú lineárny tvar molekuly, na voľné konce zápaliek pripevnite dve modré guľôčky, ktoré v tomto prípade predstavujú atómy kyslíka. Máme teda molekulu oxidu uhličitého lineárnej štruktúry.

10. Voda je polárna kvapalina a jej molekuly sú hranaté útvary. Pozostávajú z jedného atómu kyslíka a dvoch atómov vodíka. Uhlová štruktúra je určená osamelým párom elektrónov na centrálnom atóme. Môže byť tiež znázornený ako dve zelené bodky.

Toto sú vzrušujúce kreatívne lekcie, ktoré by ste určite mali cvičiť so svojimi deťmi. Študenti akéhokoľvek veku sa začnú zaujímať o chémiu a lepšie pochopia predmet, ak im počas procesu učenia bude poskytnutá vlastná názorná pomôcka.

GBPOU NSO "Kolyvanská agrárna vysoká škola"
Inštruktážna technologická mapa č.1
podľa OUD. jedenásť Chémia
profesií 35.01.23 Pani statku, 19.1.2004 Baker
Sekcia 1: Organická chémia
Téma 1.1: Základné pojmy organickej chémie a teória štruktúry organických zlúčenín.
Názov práce : Tvorba modelov molekúl - zástupcov rôznych tried organických zlúčenín.
Cieľ práce:
zovšeobecňovať a systematizovať poznatky žiakov o teórii štruktúry organických zlúčenín;
upevniť schopnosť zostaviť štruktúrne vzorce uhľovodíkov;
Študent musí dosiahnuť tieto výsledky:
osobné:
− pocit hrdosti a úcty k histórii a úspechom domácej chemickej vedy; chemicky spôsobilé správanie v odborných činnostiach a doma pri manipulácii s chemikáliami, materiálmi a procesmi;
− pripravenosť pokračovať vo vzdelávaní a zdokonaľovaní vo zvolenej odbornej činnosti a objektívne uvedomenie si úlohy chemických kompetencií v tejto oblasti;
− schopnosť využívať výdobytky modernej chemickej vedy a chemických technológií na zlepšenie vlastného intelektuálneho rozvoja vo vybranej profesionálnej činnosti;
meta-predmet:
− využívanie rôznych druhov kognitívnych činností a základných intelektuálnych operácií (vyslovenie problému, formulovanie hypotéz, analýza a syntéza, porovnávanie, zovšeobecňovanie, systematizácia, identifikácia vzťahov príčin a následkov, hľadanie analógov, formulovanie záverov) riešiť problém, využitie základných metód poznávania (pozorovanie, vedecký experiment) na štúdium rôznych aspektov chemických objektov a procesov, s ktorými je potrebné sa v odbornej oblasti stretnúť;
− využitie rôznych zdrojov na získanie chemických informácií, schopnosť posúdiť ich spoľahlivosť s cieľom dosiahnuť dobré výsledky v profesionálnej oblasti;
predmet :
− formovanie predstáv o mieste chémie v modernom vedeckom obraze sveta;
Pochopenie úlohy chémie pri formovaní obzorov človeka a funkčnej gramotnosti pri riešení praktických problémov;
− ovládanie základných chemických pojmov, teórií, zákonov a zákonitostí;
Dôverné používanie chemickej terminológie a symbolov;
− zvládnutie základných metód vedeckého poznania používaných v chémii: pozorovanie, opis, meranie, experiment;
Schopnosť spracovať, vysvetliť výsledky experimentov a vyvodiť závery;
− ochota a schopnosť aplikovať kognitívne metódy pri riešení praktických problémov;
− rozvinutá schopnosť poskytovať kvantitatívne odhady a robiť výpočty pomocou chemických vzorcov a rovníc;
− znalosť bezpečnostných pravidiel pri používaní chemikálií;
− formovanie vlastnej pozície vo vzťahu k chemickým informáciám získaným z rôznych zdrojov.
Forma štúdia : individuálny
Štandardný čas: 2 hodiny
Vybavenie pracoviska : Sada guľôčkových modelov molekúl, tabuľka „Nasýtené uhľovodíky“, periodická tabuľka, kartičky s inštruktážnou technikou, notebooky
Literatúra:
Prostriedky vzdelávania: verbálny (verbálny), vizuálny
Bezpečnostné opatrenia: oboznámení s bezpečnostnými pravidlami na pracovisku a v kancelárii.
Smernice
Uhľovodíky sú organické látky pozostávajúce z atómov uhlíka a vodíka. Atóm uhlíka vo všetkých organických zlúčeninách je štvormocný. Atómy uhlíka môžu tvoriť priame, rozvetvené a uzavreté reťazce. Vlastnosti látok závisia nielen od kvalitatívneho a kvantitatívneho zloženia, ale aj od poradia, v ktorom sú atómy navzájom spojené. Látky, ktoré majú rovnaký molekulový vzorec, ale odlišnú štruktúru, sa nazývajú izoméry. Predpony označujú množstvodi - dva,tri - tri,tetra - štyri;cyklo - znamená uzavretý.
Prípony v názvoch uhľovodíkov označujú prítomnosť viacnásobnej väzby:
en
jednoduchá väzba medzi atómami uhlíka(C - C);
en
dvojitá väzba medzi atómami uhlíka(C = C);
v
trojitá väzba medzi atómami uhlíka(S
=
S);
dién
dve dvojité väzby medzi atómami uhlíka(C = C - C = C);
Radikály:metyl -CH 3 ; etyl -C 2 N 5 ; chlór -Cl; bróm -Br.
Príklad. Vytvorte model molekuly propánu.
Molekula propánuC 3 H 8 obsahuje tri atómy uhlíka a osem atómov vodíka. Atómy uhlíka sú navzájom spojené. Prípona– en označuje prítomnosť jednoduchej väzby medzi atómami uhlíka. Atómy uhlíka sú umiestnené pod uhlom 109 28 minút.
Molekula má tvar pyramídy. Nakreslite atómy uhlíka ako čierne krúžky, atómy vodíka ako biele krúžky a atómy chlóru ako zelené krúžky.
Pri kreslení modelov sledujte pomer veľkostí atómov.
Nájdite molárnu hmotnosť pomocou periodickej tabuľky
PANI 3 N 8 a) = 12.3 + 1.8 = 44 g/mol.
Ak chcete pomenovať uhľovodík, musíte:
Vyberte najdlhšiu reťaz.
Číslo začínajúce od okraja, ku ktorému je radikálová alebo násobná väzba najbližšie.
Uveďte zvyšok, ak je označených niekoľko. (Číslo pred menom).
Pomenujte radikál, začnite najmenším radikálom.
Pomenujte najdlhšiu reťaz.
Uveďte polohu násobnej väzby. (číslo za menom).
Príklad

Pri vytváraní vzorcov podľa názvu musíte:
Určte počet atómov uhlíka v reťazci.
Určte polohu násobnej väzby. (číslo za menom).
Určte polohu radikálov. (Číslo pred menom).
Napíšte vzorce radikálov.
Nakoniec určte počet a usporiadanie atómov vodíka.
Zákazka
Úloha č.1 . Vytvorte modely molekúl:
1) množstvo alkánov: metán, etán, bután, pentán, hexán, heptán, oktán, nonán a dekán;
2) Cykloalkány: cyklopropán,cyklopetán
3) 2-metylpropán,
4) 1,2-dichlóretán.
Nakreslite molekulárne modely do svojho notebooku. Napíšte štruktúrne vzorce týchto látok. Nájdite ich molekulové hmotnosti.
Úloha č.2. Vymenujte látky:

Úloha č.3. Skladať štrukturálne vzorce látok:
a) butén-2, napíšte jeho izomér;
b) 3,3-dimetylpentín-1.
Kontrolné otázky
Uveďte všeobecný vzorec pre nasýtené uhľovodíky.
Ktoré látky sa nazývajú homológy a ktoré sú izoméry?
Učiteľ: Rachkovskaya A.I.
7.1. Obrázok ukazuje experiment ilustrujúci, že telesá sa pri zahrievaní rozťahujú. Perom zakrúžkujte na obrázku predmet, ktorý sa v tomto experimente zahrieval – guľu alebo prsteň. Svoju odpoveď zdôvodnite.
7.2. Vyberte správny výrok.
Podľa moderných predstáv, keď sa banka s vodou ochladí, hladina vody v trubici klesne, pretože... . 
7.3. Látky sa skladajú z drobných čiastočiek. Aké javy a experimenty to potvrdzujú?
7.4. V tabuľke sú presné údaje o zmene objemu vody V v závislosti od času t počas ohrevu.
Odpovedz na otázku.
a) Dá sa povedať, že počas celej doby pozorovania bola voda v banke zohrievaná rovnomerne? Vysvetli svoju odpoveď.
b) Ako sa zmenil objem vody pri zahriatí?

8.1. Vyberte správny výrok.
Ak necht zahrejete, predĺži sa a zhrubne. Stáva sa to preto, že pri zahrievaní... . 
8.2. Napíšte slová molekula, kvapka, atóm v takom poradí, aby každý nasledujúci prvok bol súčasťou predchádzajúceho.
8.3. Na obrázku sú znázornené modely molekúl vody, kyslíka a oxidu uhličitého. Všetky molekuly obsahujú atóm kyslíka (čierne). Doplňte medzery v texte.

8.4. Zmerajte si dĺžku paže od lakťa po malíček a porovnajte meranie s veľkosťou molekuly vody.
9.1. Doplňte medzery v texte. „V ____ sa anglický botanik Robert Brown pozerá cez mikroskop...“

9.2. Obrázok schematicky znázorňuje molekuly kvapaliny obklopujúce zrno farby umiestnené v tejto kvapaline. Šípky označujú smer pohybu molekúl kvapaliny v určitom časovom bode.

9.3. Označte tie javy, ktoré sú príkladmi Brownovho pohybu.
9.4. Obrázok ukazuje prerušovanú čiaru, po ktorej sa vo vzduchu niekoľko sekúnd pohybovala škvrna prachu.

a) Vysvetlite, prečo zrnko prachu počas pozorovania mnohokrát zmenilo smer svojho pohybu.
V dôsledku zrážok s molekulami vzduchu a inými prachovými časticami.
b) Na obrázku označte body, v ktorých bola prachová častica ovplyvnená molekulami, ktoré ju obklopujú.
10.1. Do skleneného valca sa zhora naleje čistá voda a cez úzku trubicu sa na dno naleje roztok síranu meďnatého. Valec je v pokoji, keď konštantná teplota. Ukážte na obrázku, ako bude obsah valca vyzerať v rôznych intervaloch.

10.2. Dve rovnaké gumové guľôčky sú spojené priehľadnou hadicou (pozri obrázok) a ľavá guľa je v oboch prípadoch naplnená vodíkom (vyfarbi vodík modro), pravá je na obrázku a prázdna a na obrázku b je naplnená vzduchom (zafarbite vzduch na zeleno). Hadica je upnutá medzi guľôčky.

10.3. Prečiarknite jedno zo zvýraznených slov, aby ste dokončili správne vysvetlenie opísaného experimentu.

10.4. Domáci experiment.
Na dno pohára studenej vody dajte kúsok cukru, ale nemiešajte. Napíšte, ako dlho vám trvalo zistiť prítomnosť molekúl cukru na povrchu vody v pohári a aký „prístroj“ ste použili.
11.1. Doplňte medzery v texte slovami: silnejší; slabší; príťažlivosť; odpudzovanie.

11.2. Spojte javy a ich zodpovedajúce vysvetlenia čiarami.

11.3. Prečiarknite jedno zo zvýraznených slov, aby ste dokončili správne vysvetlenie opísaného experimentu.

11.4. Dokončite vetu, aby ste získali správne vysvetlenie javu.
11.5. Doplňte medzery v texte. "V každodennom živote sa často stretávame s fenoménom zvlhčovania a nezmáčania."

12.1. Aký stav hmoty charakterizujú uvedené charakteristiky?
Organická chémia.
2.1. Téma: " Teória štruktúry organických zlúčenín"
2.1.1. Základné princípy teórie štruktúry organických zlúčenín a klasifikácie organických zlúčenín.
1. Prírodné a syntetické organické látky. Trochu z histórie organickej chémie. Všeobecné vlastnosti organických látok (zloženie, typ chemickej väzby, kryštalická štruktúra, rozpustnosť, vzťah k zahrievaniu v prítomnosti kyslíka a bez neho).
2. Teória štruktúry organických zlúčenín od A.M. Butlerova. Vývoj teórie a jej význam.
3. Klasifikácia organických látok.
Organické látky dostali svoj názov, pretože prvé zo študovaných látok tejto skupiny boli súčasťou živých organizmov. Väčšina v súčasnosti známych organických látok sa v živých organizmoch nenachádza, získavajú sa (syntetizujú) v laboratóriu. Preto sa rozlišujú prírodné (prírodné) organické látky (aj keď väčšina z nich sa dnes dá získať v laboratóriu) a organické látky, ktoré sa v prírode nevyskytujú – syntetické organické látky. Tie. Názov „organické látky“ je historický a nemá veľký význam. Všetky organické zlúčeniny sú zlúčeniny uhlíka. Organické látky zahŕňajú zlúčeniny uhlíka, okrem jednoduchých látok tvorených uhlíkom, jeho oxidmi, kyselinou uhličitou a jej soľami, ktoré sa študujú v rámci anorganickej chémie. Inými slovami: organická chémia je chémia zlúčenín uhlíka.
Stručná história vývoja organizačnej chémie:
Berzelius, 1827, prvá učebnica organickej chémie. Vitalisti. Doktrína „životnej sily“.
Prvé organické syntézy. Wöhler, 1824, syntéza kyseliny šťaveľovej a močoviny. Kolbe, 1845, kyselina octová. Berthelot, 1845, tučný. Butlerov, 1861, cukrová látka.
Ale ako veda sa organická chémia začala vytvorením teórie štruktúry organických zlúčenín. Významne k nemu prispeli nemecký vedec F.A.Kekule a Škót A.S.Cooper. Ale rozhodujúci prínos nepochybne patrí ruskému chemikovi A.M. Butlerovovi.
Spomedzi všetkých prvkov uhlík vyniká svojou schopnosťou vytvárať stabilné zlúčeniny, v ktorých sú jeho atómy navzájom spojené v dlhých reťazcoch rôznych konfigurácií (lineárne, rozvetvené, uzavreté). Dôvod tejto schopnosti: približne rovnaká väzbová energia C-C a C-O (pre ostatné prvky je energia druhého oveľa vyššia). Okrem toho môže byť atóm uhlíka v jednom z troch typov hybridizácie, pričom môže vytvárať jednoduché, dvojité alebo trojité väzby nielen medzi sebou navzájom, ale aj s atómami kyslíka alebo dusíka. Pravda, oveľa častejšie (takmer vždy) sú atómy uhlíka spojené s atómami vodíka. Ak organická zlúčenina obsahuje iba uhlík a vodík, zlúčeniny sa nazývajú uhľovodíky. Všetky ostatné zlúčeniny možno považovať za deriváty uhľovodíkov, v ktorých sú niektoré atómy vodíka nahradené inými atómami alebo skupinami atómov. Preto presnejšia definícia: Organické zlúčeniny sú uhľovodíky a ich deriváty.
Existuje veľa organických zlúčenín - viac ako 10 miliónov (asi 500 tisíc anorganických). Zloženie, štruktúra a vlastnosti všetkých organických látok majú veľa spoločného.
Organické látky majú obmedzené kvalitatívne zloženie. Nevyhnutne C a H, často O alebo N, menej často halogény, fosfor, síra. Ostatné prvky sú zahrnuté veľmi zriedkavo. Ale počet atómov v molekule môže dosiahnuť milióny a molekulová hmotnosť môže byť veľmi veľká.
Štruktúra organických zlúčenín. Pretože zloženie - nekovy. => Chemická väzba: kovalentná. Nepolárne a polárne. Iónové veľmi zriedkavo. => Kryštálová mriežka najčastejšie molekulárne.
Všeobecné fyzikálne vlastnosti: nízky bod varu a topenia. Organické látky zahŕňajú plyny, kvapaliny a taviteľné tuhé látky. Často prchavý a môže mať zápach. Zvyčajne bezfarebný. Väčšina organických látok je vo vode nerozpustná.
Všeobecné chemické vlastnosti:
1) pri zahrievaní bez prístupu vzduchu všetky organické látky „zuhoľnatejú“, t.j. v tomto prípade vzniká uhlie (presnejšie sadze) a niektoré ďalšie anorganické látky. Kovalentné väzby sú prerušené, najprv polárne, potom nepolárne.
2) Pri zahrievaní v prítomnosti kyslíka sa všetky organické látky ľahko oxidujú a konečnými produktmi oxidácie sú oxid uhličitý a voda.
Charakteristiky priebehu organických reakcií. Organické reakcie zahŕňajú molekuly, počas reakcie musia byť niektoré kovalentné väzby prerušené a iné vytvorené. Chemické reakcie s organickými zlúčeninami preto zvyčajne prebiehajú veľmi pomaly, vyžadujú si použitie zvýšenej teploty, tlaku a katalyzátorov. Anorganické reakcie zvyčajne zahŕňajú ióny, reakcie prebiehajú veľmi rýchlo, niekedy okamžite, pri normálnej teplote. Organické reakcie zriedkavo vedú k vysokým výťažkom (zvyčajne menej ako 50 %). Často sú reverzibilné; okrem toho sa môže vyskytnúť nie jedna, ale niekoľko reakcií, ktoré si navzájom konkurujú, čo znamená, že reakčné produkty budú zmesou rôznych zlúčenín. Preto je aj forma zaznamenávania organických reakcií trochu odlišná. Tie. nepoužívajú chemické rovnice, ale schémy chemických reakcií, v ktorých nie sú koeficienty, ale sú podrobne uvedené reakčné podmienky. Pod rovnicu je tiež zvykom zapisovať názvy organizácií. látky a typ reakcie.
Vo všeobecnosti sa však organické látky a reakcie riadia všeobecnými zákonmi chémie a organické látky sa menia na anorganické alebo môžu byť vytvorené z anorganických. Čo opäť zdôrazňuje jednotu sveta okolo nás.
Základné princípy teórie chemickej štruktúry, ktoré stanovil mladý A.M. Butlerov na medzinárodnom kongrese prírodných vedcov v roku 1861.
1). Atómy v molekulách sú navzájom spojené v určitom poradí, v súlade s ich valenciou. Postupnosť kombinácie atómov sa nazýva chemická štruktúra .
Valencia je schopnosť atómov vytvárať určitý počet väzieb (kovalentných). Valencia závisí od počtu nespárovaných elektrónov v atóme prvku, pretože kovalentné väzby vznikajú zdieľaním elektrónových párov, keď sú elektróny spárované. Uhlík vo všetkých organických látkach je štvormocný. Vodík - 1, kyslík - P, dusík - Ш, síra - P, chlór - 1.
Spôsoby zobrazenia organických molekúl.
Molekulový vzorec je konvenčným vyjadrením zloženia látky. H 2 CO 3 - kyselina uhličitá, C 12 H 22 O 11 - sacharóza. Takéto vzorce sú vhodné na výpočty. Neposkytujú však informácie o štruktúre a vlastnostiach látky. Preto sa aj molekulové vzorce v organických látkach píšu zvláštnym spôsobom: CH 3 OH. Ale oveľa častejšie používajú štruktúrne vzorce. Štruktúrny vzorec odráža poradie, v ktorom sú atómy spojené v molekule (t. j. chemická štruktúra). A základom každej organickej molekuly je uhlíková kostra je reťazec atómov uhlíka prepojených kovalentnými väzbami.
Elektrónové vzorce molekúl - väzby medzi atómami sú znázornené v pároch elektrónov.
Úplný štruktúrny vzorec zobrazuje všetky spojenia s pomlčkami. Chemická väzba tvorená jedným párom elektrónov sa nazýva jednoduchá väzba a v štruktúrnom vzorci je znázornená jednou čiarou. Dvojitú väzbu (=) tvoria dva páry elektrónov. Trojitý (≡) je tvorený tromi pármi elektrónov. A celkový počet týchto väzieb musí zodpovedať valencii prvku.
 V kondenzovanom štruktúrnom vzorci sú pomlčky jednoduchých väzieb vynechané a atómy spojené s jedným alebo druhým atómom uhlíka sú napísané hneď za ním (niekedy v zátvorkách).
V kondenzovanom štruktúrnom vzorci sú pomlčky jednoduchých väzieb vynechané a atómy spojené s jedným alebo druhým atómom uhlíka sú napísané hneď za ním (niekedy v zátvorkách).
Skeletálne vzorce sú ešte skrátenejšie. Používajú sa však menej často. Napríklad:

Štrukturálne vzorce odrážajú iba poradie spájania atómov. Molekuly organických zlúčenín však zriedkavo majú plochú štruktúru. Trojrozmerný obraz molekuly je dôležitý pre pochopenie mnohých chemických reakcií. Obraz molekuly je opísaný pomocou pojmov, ako je dĺžka väzby a uhol väzby. Okrem toho je možná voľná rotácia okolo jednoduchých väzieb. Molekulové modely poskytujú vizuálnu reprezentáciu.
Na obrázku sú znázornené modely molekúl štyroch chemických látok. Koľko chemických prvkov tvoria tieto látky? Zapíšte si symboly týchto prvkov.prvá je molekula vody, druhá je molekula oxidu uhličitého, tretia je molekula metánu, štvrtá je molekula oxidu siričitého.
Dobrý deň, prosím pomôžte mi vyriešiť test 2 z chémie8. trieda
na tému „Jednoduché látky. Množstvo hmoty."
Možnosť 1.
A1. Znak prvku tvoriaceho jednoduchú hmotu – nekov:
1) Na 2) C 3) K 4) Al
A2. Jednoduchá látka – kov:
1) kyslík 2) meď 3) fosfor 4) síra
A3. Normálny fyzikálny stav jednoduchej látky ortuti
podmienky:
1) pevné 2) kvapalné 3) plynné
A4. Chemická väzba je kovalentná nepolárna
v podstate:
1) železo 2) chlór 3) voda 4) meď
A5. Alotropická modifikácia kyslíka:
1) grafit 2) biely fosfor 3) ozón 4) uhlie
A6. Označenie 3O2 znamená:
1) 2 molekuly kyslíka
2) 3 molekuly kyslíka
3) 5 atómov kyslíka
4) 6 atómov kyslíka
A7. Hmotnosť 3 mólov sírovodíka H2S sa rovná:
1) 33 2) 34 3) 99 4) 102
A8. Objem, ktorý zaberajú 2 móly plynnej látky s
vzorec SO2 (n.s):
1)22,4 l. 2) 33,6 l. 3) 44,8 l. 4) 67,2 l.
A9. Skupina látok s iónovým typom chemickej väzby:
1) Cl2, H2, O2 2) KCl, NaBr, CaI2
3) H2O, CO2, NaCl 4) K2O, MgO, NaI
A10. Molárny objem je. . .
1) objem akéhokoľvek plynu pri č. 2) objem 2 g akéhokoľvek plynu pri nule
3) objem 1 mólu akéhokoľvek plynu v č.4) objem 12 * 1023 molekúl v č.
A11. 3 molekuly chlóru:
1)3Cl2 2)3Cl 3)Cl2 4)6Cl
Q1. Identifikujte tvrdú, mäkkú látku, ktorá zanecháva stopy na papieri, má mierny kovový lesk a je elektricky vodivá:
1) diamant 2) uhlie 3) grafit 4) biely fosfor
AT 2. Počet molekúl v 2 mmol vody je:
1) 12*1023. 2) 12*1020. 3) 18*1020 4) 12*1018
AT 3. Látky usporiadané v rastúcom poradí nekovových
vlastnosti:
1) K, Na, Rb, Li 2) Li, Na K, Rb 3) Rb, K, Na, Li 4) Na, Rb, K, Li
C1. Vypočítajte objem 140 kg. dusík N2 pri č.
A.Na B.C C.K D.Al
2) Jednoduchá látka - kov:
A. kyslík B. Meď C. Fosfor D. Síra
3) Fyzikálny stav jednoduchej látky ortuti za normálnych podmienok:
A. Tuhá látka B. Kvapalná C. Plynná
4) Chemická väzba je v látke kovalentná nepolárna:
A. Železo B. Kvapalné C. Plynné
5) Alotropická modifikácia kyslíka:
A. Grafit B. Ozón
B. Biely fosfor D. Diamant
6) Atóm prvku tvoriaci jednoduchú látku - kov, zodpovedá elektronickému diagramu:
A. +18))) B. +3)) C. +6)) D. +15)))
288 21 24 285
7) Záznam ZO2 znamená:
A. 2 molekuly kyslíka
B. 3 molekuly kyslíka
B. 5 atómov kyslíka
D. 3 atómy kyslíka
8) Hmotnosť 3 mólov sírovodíka H2S sa rovná: (s roztokom)
A. 33 g B. 34 g C 99 g D 102 g.
9) Objem, ktorý zaberajú 2 móly plynnej látky so vzorcom SO2 (n.s.): (s roztokom)
A. 22,4 l. B. 33,6 l. V. 44,8 l. G. 67,2 l.
10) množstvo oxidu uhličitého CO2, ktorý obsahuje 36*10(23) molekúl, sa rovná: (s roztokom)
11) Zápas:
Typ chemickej väzby:
1. Iónové B. Kovalentné polárne C. Kovové
Chemický vzorec látky:
A.CI2 B.K C.NaCI D.Fe D.NH3
12) Vypočítajte objem kyslíka O2 s hmotnosťou 160 g (č.) (s roztokom)
13) Doplňte definíciu: „Alotropia je fenomén...“
14) Vyberte vlastnosti, ktoré charakterizujú grafit.
A. Pevné
B. Mäkký, zanecháva stopy na papieri.
B. Bezfarebný, priehľadný.
D. Má mierny kovový lesk
D. Elektricky vodivé.
elektróny úrovne 3?
1) Mg a Al 2) O a S 3) N a S 4) B a Al
2. Atóm prvku tvoriaci jednoduchú látku - nekov - zodpovedá
elektronický obvod?
1) +11)2)8)1 2) +8)2)6 3) +12)2)8)2 4) +4)2)2
3. Dusík vykazuje najvyšší stupeň oxidácie v kombinácii so vzorcom:
1) N02 2) N0 3) NH3 4) N205
4. Ktorá látka má kovalentnú nepolárnu väzbu?
1) O2 2) H2O 3) CaCl2 4) Ba
5. Elektrónovému vzorcu 1s2 2s2 2p1 zodpovedá atóm:
1) berýlium 2) kremík 3) uhlík 4) bór
6. S nárastom náboja jadier atómov v rade F -Cl - Br -I, nekovové
vlastnosti?
1) zintenzívniť 2) oslabiť 3) nemeniť sa 4) pravidelne meniť
7. uveďte vzorec zlúčeniny s kovalentnou polárnou chemickou väzbou:
1) H2 2) NH3 3) Ca3N2 4) C
8. Stupeň oxidácie fosforu v zlúčeninách P2O5, PH3, Ca3P2, resp.
rovný?
1) +3, -3, +5 2) -3, +3, +5 3) +5, +5, -3 4) +5, -3, -3
9. Sú nasledujúce tvrdenia pravdivé?
A. V období kovové vlastnosti atómov prvkov s rastúcim rádom
čísla sú čoraz silnejšie.
B. V období kovové vlastnosti atómov prvkov s rastúcim rádom
čísla slabnú.
1) iba A je pravdivé 2) oba úsudky sú pravdivé 3) iba B je pravdivé 4) oba úsudky nie sú
sú pravdivé
10. Chemický prvok, v ktorého atóme sú elektróny rozdelené medzi vrstvy takto:
2,8,8,2, v periodickej tabuľke je:
A) v 4. období, 2. skupina, sekundárna podskupina
B) v 4. tretine 2. skupina hlavnej podskupiny
B) v 3. tretine 5. skupina hlavnej podskupiny
D) v 3. období, 5. skupina, sekundárna podskupina