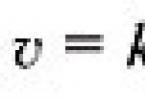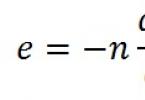Rýchlosť chemickej reakcie
a jeho závislosť od rôznych faktorov
Lekcia s využitím informačných technológií
V žiadnom prípade nie je možné naučiť sa chémiu,
bez toho, aby ste videli samotnú prax a bez toho, aby ste podstúpili chemické operácie.
M.V. Lomonosov
Reštrukturalizácia vyššieho a stredného odborného vzdelávania v krajine a školská reforma zabezpečujú ďalšie skvalitňovanie foriem, metód a prostriedkov výučby, využívanie rôznych technológií vrátane učenia zameraného na človeka (PLL), hľadania problémov a počítačových technológií. .
Aj my, učitelia, sa meníme. Vo svojej práci sa snažím neustále využívať novinky a moderné vzdelávacie technológie.
V poslednej dobe sa na diskoch počítačov objavilo množstvo materiálov. Môžu byť použité pri príprave esejí, písaní semestrálnych prác a pri samostatnej práci študentov. Informačné technológie mi umožňujú rýchlo organizovať školenia a testovanie vedomostí, vytvárať adaptívne programy a aplikovať ich vo vyučovaní chémie.
Výpočtová technika a využívanie výpočtovej techniky dnes pôsobí nielen ako prostriedok automatizácie všetkých vzdelávacích procesov, ale aj ako nástroj na dramatické zvýšenie efektívnosti intelektuálnej činnosti študentov.
Používam výpočtovú techniku na svojich hodinách na rôzne účely:
Riešenie problémov, kvantitatívne výpočty, spracovanie dát (podľa navrhnutého algoritmu);
Vykonávanie sebakontroly a štandardizovanej kontroly vedomostí o obsahu vzdelávacích informácií (testy, kontrolné diferencované úlohy, mapy a iné dotazníky);
Automatizácia chemického experimentu, prepojenie s optickým zariadením (premietanie experimentov na plátno);
Získavanie potrebných referenčných údajov, príprava testov, diferencovaných prác, analýza typických chýb študentov (automatizované riadiace systémy a informačné banky);
Samostatná práca študentov na vypracovaní abstraktov a semestrálnych prác, práca s materiálom, vykonanie testovej práce (po obdržaní výsledku precvičiť sebakontrolu).
Navrhovaná lekcia z časti „Chemická kinetika“ zodpovedá programu učebnice „Chémia-10“ od autorov L.S. Guzey a R.P. Surovtseva. Štúdiu tejto témy predchádza štúdium termodynamiky reakcií. Navrhovaný materiál nezodpovedá požadovanému minimálnemu obsahu, ale predovšetkým profilovej úrovni školenia.
Lekcia využíva skupinovú prácu, diferencovaný prístup, vývojové technológie a technológie na vyhľadávanie problémov, a čo je najdôležitejšie, počítačovú technológiu na vykonanie demonštračného experimentu, ktorý vám umožní jasne pochopiť, aká je rýchlosť chemickej reakcie a ako závisí od rôznych faktorov. .
Ciele lekcie. Aktualizovať a prehĺbiť poznatky o rýchlosti chemických reakcií; pomocou skupinovej práce zvážte a študujte rôzne faktory: povaha reagujúcich látok, plocha kontaktu látok, teplota, katalyzátor; pomocou počítačovej meracej jednotky názorne preukázať, aká je rýchlosť chemickej reakcie a ako závisí od koncentrácie reagujúcich látok.
Motto lekcie.„Existuje len to, čo sa dá merať“ (M. Planck).
Dizajn triedy. Učiteľ vopred informuje o téme nadchádzajúcej hodiny, rozdelí triedu do štyroch tvorivých skupín po 5-6 ľudí, ktorí majú približne rovnaké schopnosti. Na predchádzajúcej hodine dostávajú študenti domácu úlohu – pripraviť správy o praktickej aplikácii Arrheniovej rovnice a typoch katalýzy.
Vybavenie a činidlá. Na stoloch žiakov - učebnice, zošity, tabuľky, laboratórne listy, stojany so skúmavkami;
skupina 1: zinkové granule, horčíková páska, roztok kyseliny chlorovodíkovej;
skupina 2: sklenená tyč; železné piliny, železný klinec, roztok chloridu meďnatého;
skupina 3: pipeta, držiak na skúmavky, alkoholová lampa, zápalky; oxid meďnatý, roztok kyseliny sírovej;
skupina 4(vykonáva demonštračný pokus na demonštračnom stole): počítač s meracou jednotkou, snímač optickej hustoty pri vlnovej dĺžke 525 nm, kyveta, magnetické miešadlo, 10 ml striekačka, 100 ml odmerný valec; roztoky jodidu draselného KI 1M, persíran draselný K 2 S 2 O 8 0,1 M, destilovaná voda.
Žiaci si počas hodiny robia všetky poznámky do svojich zošitov.
POČAS VYUČOVANIA
Motivácia pre dôležitosť zvolenej témy
Učiteľ začne látku vysvetľovať príkladmi chemických reakcií prebiehajúcich rôznou rýchlosťou. Žiaci môžu uviesť príklady reakcií.
Chemické reakcie prebiehajú rôznymi rýchlosťami. Niektoré postupujú pomaly, v priebehu mesiacov, ako napríklad korózia železa alebo kvasenie hroznovej šťavy, čoho výsledkom je víno. Iné sú dokončené za niekoľko týždňov, ako napríklad alkoholová fermentácia glukózy. Iné končia veľmi rýchlo, napríklad zrážaním nerozpustných solí, a niektoré sa vyskytujú okamžite, napríklad výbuchy.
Takmer okamžite, veľmi rýchlo, vo vodných roztokoch dochádza k mnohým reakciám:
Zmiešame vodné roztoky Na 2 CO 3 a CaCl 2, reakčný produkt CaCO 3 je vo vode nerozpustný a ihneď vzniká;
Ak do alkalického roztoku fenolftaleínu pridáme prebytočnú kyselinu, roztok sa okamžite zafarbí. To znamená, že neutralizačná reakcia, reakcia premeny farebnej formy indikátora na bezfarebnú, prebieha veľmi rýchlo.
Na železných predmetoch sa pomaly tvorí hrdza. Na medených a bronzových predmetoch sa pomaly tvoria čiernohnedé alebo zelenkasté korózne produkty (patina). Rýchlosť všetkých týchto procesov je rôzna.
Aktualizujú sa zobrazenia
o rýchlosti chemických reakcií
Chemické reakcie sú jedným z najdôležitejších pojmov v chémii. Na ich pochopenie a kompetentné využitie vo vzdelávacom procese musí učiteľ poznať a vedieť vysvetliť hlavné charakteristiky akejkoľvek chemickej reakcie: tepelný efekt, rovnováha, rýchlosť. Chemická termodynamika umožňuje predpovedať, akým smerom môže konkrétna chemická reakcia spontánne prebiehať, ale samotná chemická termodynamika neodpovedá na otázku, ako a akou rýchlosťou bude reakcia prebiehať. Pojem rýchlosti chemickej reakcie je jedným zo základných v chemickej kinetike.
Na štúdium nového materiálu študenti využívajú potrebné poznatky o rýchlosti chemickej reakcie, prechádzajú fázou aktualizácie vedomostí. Ale tento pojem sa prehlbuje o pojmy rýchlosť homogénnych a heterogénnych reakcií, aktivačná energia, zavádza sa Arrheniova rovnica - to je zóna proximálneho rozvoja žiakov (pozri prílohu č. 1 „Štruktúra problémovo-hľadacej aktivity učiteľov a študenti...“).
Čo myslíš rýchlosťou reakcie? Ako sa to dá merať a meniť? Veda, ktorá skúma vzorce reakcií v čase – chemická kinetika – pomôže odpovedať na tieto otázky.
Pripomeňme si základné pojmy a vzorce používané v kinetike (odpoveď študentov a doplnky pre učiteľov).
Chemická kinetika je odvetvie chémie, ktorého úlohou je vysvetliť kvalitatívne a kvantitatívne zmeny v chemických procesoch, ktoré sa vyskytujú v priebehu času. Zvyčajne je táto všeobecná úloha rozdelená na dve, konkrétnejšie:
1) identifikácia reakčného mechanizmu - stanovenie základných štádií procesu a postupnosti ich výskytu (kvalitatívne zmeny);
2) kvantitatívny popis chemickej reakcie - stanovenie prísnych vzťahov, ktoré umožňujú vypočítať zmeny v množstvách počiatočných činidiel a produktov v priebehu reakcie.
Hlavným konceptom v chemickej kinetike je koncept rýchlosti reakcie. Rýchlosť chemickej reakcie je určená množstvom látky zreagovanej za jednotku času v jednotke reakčného priestoru.
Ak sa koncentrácia jednej z reaktantov zníži z s 1 až s 2 na obdobie od t 1 až t 2, potom v súlade s definíciou reakčnej rýchlosti sa rovná (obr. 1):
Znamienko „–“ na pravej strane rovnice znamená nasledovné. Ako reakcia postupuje ( t 2 – t 1) > 0 koncentrácia činidiel klesá, preto ( c 2 – c 1) < 0, а т.к. скорость реакции всегда положительна, то перед дробью следует поставить знак «–».
Ryža. 1.
|
Kvantitatívne vzťah medzi rýchlosťou reakcie a molárnymi koncentráciami reaktantov popisuje základný zákon chemickej kinetiky – zákon o pôsobení hmoty.
Rýchlosť chemickej reakcie pri konštantnej teplote je úmerná súčinu koncentrácií reaktantov.
Na reakciu
A A+ b B = s C + d D,
v súlade so zákonom hromadného pôsobenia môže byť závislosť rýchlosti od koncentrácie reagujúcich látok prezentovaná ako:
![]()
Kde k– rýchlostná konštanta; n A, n B – reakčné poradia pre činidlá A a B, v tomto poradí;
n A+ n B je všeobecné poradie reakcie.
Pri homogénnych reakciách sú reagujúce látky v rovnakej plynnej fáze alebo v roztoku, navzájom rovnomerne zmiešané, reakcia prebieha v celom objeme zmesi. Koncentrácia činidla sa rovná podielu množstva látky vydeleného objemom zmesi: s = /V.
Priemerná rýchlosť reakcie:
![]()
Čím kratší je časový úsek, tým presnejšia bude rýchlosť reakcie.
Na fázovom rozhraní prebiehajú heterogénne reakcie: plyn - pevná látka, plyn - kvapalina, kvapalina - pevná látka, pevná látka - pevná látka. Rýchla reakcia
![]()
merané na jednotku plochy kontaktu reagujúcich látok S.
Pri zvažovaní tepelných účinkov chemických reakcií sa transformácia molekúl reaktantov (A + B) na molekuly produktu (C + D) vysvetľuje z termodynamického hľadiska ako „šplhanie na energetickú horu“ v prípade endotermických reakcií (obr. 2, A) alebo „ísť z kopca“ pre exotermické reakcie (obr. 2, b).
Aby mohli molekuly reaktantov reagovať, musia sa najprv zásobiť dodatočnou energiou, aby prekonali energetickú bariéru na ceste k reakčným produktom. Je príznačné, že takáto bariéra existuje aj v prípade exotermických reakcií, takže namiesto jednoduchého „skĺznutia z kopca“ musia molekuly najprv „vyliezť do kopca“.
Ryža. 2.
|
Hnacou silou reakcie je túžba dosiahnuť minimum energie.

Aby došlo k reakcii, musia sa častice reagujúcich látok navzájom zraziť. So zvyšujúcou sa teplotou sa zvyšuje počet týchto zrážok v dôsledku zvýšenia kinetickej energie molekúl, preto sa zvyšuje rýchlosť reakcie. Ale nie každá zrážka molekúl reagujúcich látok vedie k ich interakcii: na interakciu molekúl sa musia väzby medzi atómami v nich oslabiť alebo sa rozbiť, na čo je potrebné vynaložiť určité množstvo energie. Ak zrážajúce sa molekuly túto energiu nemajú, ich zrážka nevedie k reakcii. Nadbytočná energia, ktorú musia mať molekuly, aby ich zrážka viedla k vytvoreniu molekúl novej látky, sa nazýva aktivačnej energie túto reakciu E a, zvyčajne merané v J/mol, kJ/mol. Molekuly s touto energiou sa nazývajú aktívne molekuly.
Na obr. 3 ukazuje energetické profily:
a) endotermická reakcia, + H = –Q,
N 2 + O 2 2NO – Q;
b) exotermická reakcia, H = +Q,
H2+I22HI+ Q.
Pri reakcii dochádza k oslabeniu chemických väzieb v aktívnych molekulách a vzniku nových väzieb medzi časticami reagujúcich látok, vzniká prechodný stav - aktivovaný komplex, kedy staré väzby nie sú úplne zničené, ale už sa začali budovať nové. Aktivačná energia je energia potrebná na vytvorenie aktivovaného komplexu. Energetická bariéra sa mení, čím je nižšia, tým ľahšie a rýchlejšie prebieha reakcia.
Bod nachádzajúci sa v hornej časti energetickej bariéry sa nazýva prechodný stav. Od tohto bodu môže systém voľne prejsť do reakčného produktu alebo sa vrátiť do pôvodného stavu (obr. 4).
Aktivačná energia je faktor, ktorým povaha reaktantov ovplyvňuje rýchlosť reakcie. Pre niektoré reakcie je to malé, pre iné veľké. Ak je aktivačná energia malá (< 40 кДж/моль), то большая часть столкновений между молекулами реагирующих веществ приводит к реакции. Скорость таких реакций велика. Если энергия активации велика (>40 kJ/mol), potom v tomto prípade len malá časť zrážok molekúl alebo iných častíc vedie k reakcii. Rýchlosť takejto reakcie je nízka.
Rýchlosť reakcie v danom čase sa dá vypočítať, ak poznáte počet aktívnych zrážok reagujúcich častíc za jednotku času. Závislosť rýchlosti reakcie od teploty možno teda zapísať ako:
0 exp(– E a/ RT),
kde 0 je rýchlosť reakcie za predpokladu, že každá zrážka vedie k interakcii ( E a = 0). Tento výraz pre rýchlosť reakcie je - Arrheniova rovnica- dôležitá rovnica v chemickej kinetike (jej praktické uplatnenie pozri v prílohe č. 2, študenti robia správy).
Prečo chemické reakcie prebiehajú rôznymi rýchlosťami? Toto je hlavná otázka, ktorá stojí pred učiteľom a deťmi na hodine. Študenti na ňu odpovedajú teoreticky vykonávaním laboratórnych pokusov v skupinách a riešením úloh.
Skupinová práca
Práca skupín zahŕňa tieto činnosti:
Experimentálne štúdium faktorov ovplyvňujúcich rýchlosť chemických reakcií;
Pozorovanie a analýza získaných experimentálnych výsledkov;
Vyplnenie laboratórnych hárkov odrážajúcich pokrok a závery.
Predpokladom úspešnej práce v skupinách a plnenia zadaných úloh je vybavenie pracoviska každého študenta potrebným vybavením a názornými pomôckami. Počas práce učiteľ oslovuje všetky skupiny a v prípade potreby poskytuje poradenskú pomoc. Nižšie je uvedený obsah úloh pre každú skupinu.
Laboratórny pokus č.1.
Závislosť rýchlosti chemickej reakcie
od povahy reaktantov
Cieľ. Posilniť pojem „rýchlosť chemickej reakcie“ a identifikovať jej závislosť od povahy reagujúcich látok.
Vybavenie a činidlá. Stojan so skúmavkami; zinkové granule, horčíková páska, roztok kyseliny chlorovodíkovej.
Demonštračná skúsenosť.
Rýchlosť reakcie a jej závislosť
o koncentrácii východiskových látok
Cieľ. Vizuálne ukážte, aká je rýchlosť chemickej reakcie a ako závisí od koncentrácie východiskových látok.
Vybavenie a činidlá. Počítač s meracou jednotkou, senzor optickej hustoty pri vlnovej dĺžke = 525 nm, kyveta, magnetické miešadlo, 5 ml striekačka, 100 ml odmerný valec; roztoky - 1M KI, 0,1M K 2 S 2 O 8, destilovaná voda.
Chemická podstata procesu.Študuje sa reakcia oxidácie jodidového iónu s persíranom:
2I – + S 2 O 8 2– = I 2 + 2SO 4 2–.
Reakcia sa uskutočňuje v nadbytku jodidu draselného. Uvoľnený jód zafarbí roztok do hneda. Koncentrácia jódu je určená intenzitou farby roztoku s použitím senzora optickej hustoty pri 525 nm.
Príprava na prácu. K prvému kanálu meracej jednotky je pripojený senzor optickej hustoty naladený na vlnovú dĺžku 525 nm. Zapnite senzor v časovo závislom režime, nalejte do kyvety 10 ml 1M roztoku KI a 90 ml destilovanej vody. Nastavte snímač.
Výkon. Spustite proces miešania. Vezmite 5 ml roztoku K 2 S 2 O 8 do injekčnej striekačky, rýchlo ho nalejte do kyvety a súčasne spustite proces merania stlačením tlačidla obrazovky „Štart“. Meranie sa zastaví, keď optická hustota dosiahne 0,5.
Experiment opakujte s použitím 20 ml roztoku KI a 80 ml vody.
Komentáre. Rýchlosť reakcie je zmena koncentrácie reaktantov alebo reakčných produktov za jednotku času. Rýchlosť reakcie závisí od koncentrácie východiskových činidiel v danom čase.
Vyvodené pojmy. Rýchlosť reakcie, jej závislosť od koncentrácie.
Závery. Keď sa reaktanty počas reakcie spotrebúvajú, rýchlosť sa spomaľuje.
So zvyšujúcou sa koncentráciou východiskového činidla sa zvyšuje rýchlosť reakcie. Navyše v tomto prípade, keď sa koncentrácia zdvojnásobila, zdvojnásobila sa aj rýchlosť reakcie.
Laboratórny pokus č.2.
Vplyv teploty na rýchlosť
Cieľ. Posilnite pojem „rýchlosť chemickej reakcie“ a preskúmajte vplyv teploty na rýchlosť chemickej reakcie.
Vybavenie a činidlá. Stojan so skúmavkami, pipeta, alkoholová lampa, držiak na skúmavky; oxid meďnatý, roztok kyseliny sírovej (1:3).
Laboratórny pokus č.3.
Závislosť rýchlosti chemickej reakcie
z kontaktnej plochy
reaktanty
Cieľ. Posilniť pojem „rýchlosť chemickej reakcie“ a identifikovať jej závislosť od veľkosti kontaktnej plochy reagujúcich látok.
Vybavenie a činidlá. Stojan so skúmavkami, sklenená tyčinka; železné piliny, železný klinec, roztok chloridu meďnatého.
Prezentácia výsledkov skupinovej práce, ich diskusia
Poradie, v ktorom sú výsledky prezentované, je určené číslami skupín (postupne). Študenti hovoria na tabuli pomocou tabuliek vyplnených na základe výsledkov ich laboratórnych experimentov. Organizuje sa krátka diskusia o výsledkoch práce skupín a formulujú sa závery. Učiteľ upozorňuje na ďalší faktor, ktorý ovplyvňuje rýchlosť chemickej reakcie – na prítomnosť katalyzátora.
Katalyzátory- sú to látky, ktoré urýchľujú chemickú reakciu, inhibítory- Sú to látky, ktoré spomaľujú chemickú reakciu. Samotné katalyzátory a inhibítory sa pri reakcii nespotrebúvajú a nie sú zahrnuté v reakčných produktoch.
Katalýza je proces zmeny rýchlosti reakcie pod vplyvom katalyzátora. Pôsobenie katalyzátora je selektívne. Reakcie, ktoré sa vyskytujú za účasti katalyzátora, sa nazývajú katalytické reakcie.
Mechanizmus homogénnej katalýzy
Reakcie sú často pomalé, pretože... ich aktivačnej energie E a je veľké (obr. 5):
A + B A B AB.
Katalyzátor (K) urýchľuje reakciu:

Aktivačné energie E"a E"" a sú malé, takže reakcie prebiehajú rýchlo.
Za účasti katalyzátora dochádza k poklesu E a vzniká prírastok energie a reakcia prebieha rýchlejšie.
V i d y c a t a l i s a
1. Homogénna katalýza– východiskové materiály a katalyzátor – jednofázový systém.
Napríklad prirodzené kolísanie hrúbky ozónovej vrstvy Zeme súvisí so zmenami slnečnej aktivity. V horných vrstvách atmosféry dochádza k deštrukcii ozónovej vrstvy katalyzovanej oxidmi dusíka:

2. Heterogénna katalýza– východiskové materiály a katalyzátor tvoria viacfázový systém.

Mechanizmus heterogénnej katalýzy zahŕňa päť stupňov:
Difúzia - reagujúce molekuly difundujú na povrch katalyzátora;
Adsorpcia - reaktanty sa hromadia na povrchu katalyzátora;
Chemická reakcia - povrch katalyzátora je heterogénny, sú na ňom aktívne centrá, oslabujú väzby medzi atómami v adsorbovaných molekulách, reagujúce molekuly sa deformujú, niekedy sa rozpadnú na atómy, čo uľahčuje vznik chemickej reakcie;
Desorpcia - molekuly produktu sú najskôr zadržané povrchom katalyzátora a potom uvoľnené;
Difúzia - molekuly produktu difundujú z povrchu katalyzátora.
Obrazne povedané, mechanizmus účinku katalyzátora možno prirovnať k prechodu turistov cez horský priesmyk. Turisti, ktorí túto oblasť nepoznajú, si vyberú tú najzrejmejšiu, no najťažšiu cestu, ktorá si vyžaduje dlhé stúpanie a zostup cez vrchol hory. Skúsený sprievodca (katalyzátor) povedie svoju skupinu po ceste popri vrchole. Táto cesta je síce kľukatá, je však menej náročná, ľahšie sa po nej dostanete do konečného bodu, po ktorom sa sprievodca vráti do východiskového bodu.
Osobitnú skupinu tvoria katalyzátory, ktoré pôsobia v živých organizmoch. Takéto katalyzátory sa nazývajú enzýmy alebo enzýmy.
Enzýmy (enzýmy)- sú to proteínové molekuly, ktoré urýchľujú chemické procesy v biologických systémoch (v tele je asi 30 tisíc rôznych enzýmov, z ktorých každý urýchľuje zodpovedajúcu reakciu).
Demonštračná skúsenosť.
Katalytický rozklad peroxidu vodíka
(pod vedením učiteľa)
2H202 2H20 + 02.
5 ml farmaceutického roztoku peroxidu vodíka sa naleje do troch skúmaviek. Prvá skúmavka je kontrolná, na porovnanie sa do druhej skúmavky pinzetou vhodí kúsok surového mäsa a do tretej skúmavky sa vloží kúsok surovej mrkvy. „Vrenie“ sa pozoruje v dvoch skúmavkách, okrem prvej. Do druhej a tretej skúmavky sa vložia tlejúce úlomky, ktoré sa rozhoria, pretože sa uvoľňuje kyslík. Učiteľ vysvetľuje, že rozklad peroxidu vodíka prebieha bez katalyzátora, ale oveľa pomalšie. Reakcia môže trvať niekoľko mesiacov. Rýchle reakcie v iných skúmavkách demonštrujú prácu enzýmu katalázy, ktorý sa nachádza v rastlinných aj živočíšnych bunkách.
Účinnosť enzýmu katalázy možno ilustrovať údajmi o rozklade H202 vo vodnom roztoku.
Enzýmy sa podrobnejšie učia pri štúdiu chémie pre 11. ročník.
Rozvoj trvalej pozornosti, schopnosti pozorovať skúsenosti, vykonávať analýzy a vyvodzovať závery začína demonštračným experimentom. Skupinová forma práce vám umožňuje efektívne získavať vedomosti, podporuje zmysel pre tímovú prácu.
Použitie zostavy zariadení s počítačovou meracou jednotkou a snímačmi (teplota, optická hustota, elektrická vodivosť, hladina pH) výrazne rozširuje možnosti demonštračného experimentu, pretože nám umožňuje nahliadnuť do vnútra procesu, čo sme predtým nemohli urobiť iba teoretickým štúdiom tejto témy. Štúdium kvantitatívnych zákonov je jednou z kľúčových a najkomplexnejších tém v chémii (pozri prílohu č. 3 „Parametre používané pri kvantitatívnych chemických výpočtoch“).
V tejto lekcii nás zaujímajú parametre reakcie. V predchádzajúcich lekciách sa študenti oboznámili s termodynamickými parametrami a parametre hmoty a prostredia budú študované v ďalších lekciách.
Zhrnutie lekcie, reflexná analýza
Učiteľ zhrnie lekciu. Študenti vypĺňajú kontrolné hárky práce študentov, na ktorých uvádzajú svoju triedu, priezvisko, meno, hodnotia svoju prácu na hodine, skupinovú prácu, pochopenie témy („zlé“, „dobré“, „výborné“).
Študenti odpovedajú otázky.
1. V akej nálade odchádzate z hodiny?
2. Prečo je hodina zaujímavá pre každú skupinu a každého študenta?
3. Aký je pre vás prínos tejto lekcie?
4. S akými ťažkosťami ste sa stretli na hodine?
Rôzne triedy ponúkajú rôzne otázky. Zo skúseností môžeme povedať, že v reflexnej fáze študenti dávajú lekcii vysoké hodnotenie („5“, menej často „4“), všímajú si nezvyčajnosť, jasnosť, bohatosť hodiny, vysokú emocionálnu úroveň, logiku a zaujímavosť. informačný materiál. Najdôležitejšou technológiou na hodine je spolupráca medzi učiteľom a študentmi. Spoločne sa dosahujú spoločné ciele, žiaci si lepšie osvojujú látku a aplikujú získané poznatky.
Domáca úloha
Spolu s odsekmi učebnice dostane každá skupina individuálnu úlohu študovať vplyv konkrétneho faktora na rýchlosť chemickej reakcie.
Úloha 1. O t= 30 °C reakcia prebieha za 25 minút a pri teplote 30 °C t= 50 °C – za 4 minúty. Vypočítajte teplotný koeficient reakcie.
Úloha 2. Interakcia hliníka s chlórom prebieha podľa rovnice:
2Al (tuhá látka) + 3Cl2 (g) = 2AlCl3 (tuhá látka).
Počiatočná koncentrácia chlóru je 0,05 mol/l. Reakčná rýchlostná konštanta je 0,2 l/(mol s).
Napíšte matematický výraz pre rýchlosť reakcie. Ako sa zmení rýchlosť reakcie v porovnaní s počiatočnou, ak sa tlak v systéme zvýši 6-krát?
Úloha 3. V dvoch rovnakých nádobách prebiehali rozkladné reakcie za vzniku kyslíka a vodíka. Za 10 s sa v prvej nádobe získalo 22,4 litra O2 a v druhej nádobe 4 g H2. Ktorá chemická reakcia má najvyššiu rýchlosť? Koľko krát?
Úloha 4. Navrhnite spôsoby, ako zvýšiť rýchlosť reakcie 16-krát zmenou koncentrácií východiskových látok:
a) 2Cu (tuhá látka) + 02 (g) = 2CuO (tuhá látka);
b) 2H2 (g.) + 02 (g.) = 2H20 (g.).
Zvláštnosťou hodiny je, že ponúka látku, ktorá presahuje rámec učebnice. Je to potrebné tak pre zvýšenie všeobecnej erudície, ako aj pre budúcich uchádzačov. Doplnkový materiál v špecializovanej triede vychádza najmä z materiálov z prijímacích skúšok na rôzne vysoké školy.
Cieľom vzdelávacích technológií je zvýšiť efektivitu vzdelávacieho procesu. Hlavnou vecou v akejkoľvek technológii je zamerať sa na osobnosť študenta. Pedagogická technika je súbor vzájomne prepojených prostriedkov, metód a procesov potrebných na cielené pôsobenie na formovanie osobnosti s danými vlastnosťami. Na hodinách používam prístup zameraný na študenta. Vďaka tomu môžu študenti pristupovať k štúdiu látky uvedomelejšie a tvorivejšie. Práve technológia spolupráce medzi učiteľom a žiakom je dôležitá pri dosahovaní vysokých výsledkov. Aktívne využívanie prvkov pedagogických technológií na vyučovaní prispieva k rozvoju motivačnej sféry žiaka, inteligencie, samostatnosti, schopnosti kontrolovať a riadiť svoje vzdelávacie a kognitívne aktivity.
Mojím predmetom je chémia, ale učím aj humanitné štúdiá. Používanie nových prístupov vo vzdelávaní vám umožňuje pozerať sa na váš predmet inak. Hlavné je v každom študentovi vidieť človeka.
Chémia je veda o látkach. K štúdiu látok pristupujem nielen z pohľadu ich praktického významu pre spoločnosť, ale aj z pozície filozofického chápania sveta. Na hodinách chémie a humanistiky ukazujem celistvosť sveta a človeka, snažím sa deťom odhaľovať nekonečnosť a harmóniu života, pestovať túžbu porozumieť a poznať seba, túžbu zdokonaľovať sa, pracovať. na seba, aby zlepšili svoj život. Teší ma záujem chalanov o tieto problémy. A myslím si, že je užitočné, aby sme sa nad tým zamysleli aj my učitelia. Len tým, že sa budeme zdokonaľovať a rozvíjať sami seba, môžeme učiť deti.
PRÍLOHA č.1
Štruktúra problémových aktivít učiteľov a žiakov
o štúdiu vlastností látok a podstate chemických reakcií
(možné využitie informačných technológií)

PRÍLOHA č.2
Praktické využitie Arrheniovej rovnicePríklad 1 Rýchlosť (frekvencia) pípania cvrčkov sa riadi, aj keď nie celkom striktne, Arrheniovej rovnici, postupne sa zvyšuje v teplotnom rozsahu od 14,2 °C do 27 °C s účinnou aktivačnou energiou. E a = 51 kJ/mol. Na základe frekvencie cvrlikania môžete určiť teplotu pomerne presne: ich počet musíte spočítať za 15 sekúnd a pridať 40, dostanete teplotu v stupňoch Fahrenheita (F) (Američania stále používajú túto teplotnú stupnicu).
Takže pri 55 F (12,8 °C) je frekvencia cvrlikania 1 cvrlikanie/s a pri 100 F (37,8 °C) - 4 pípnutia/s.
Príklad 2
V teplotnom rozsahu od 18 °C do 34 °C srdcová frekvencia morskej korytnačky súhlasí s Arrheniovou rovnicou, ktorá udáva aktivačnú energiu
E a = 76,6 kJ/mol, ale pri nižších teplotách sa aktivačná energia prudko zvyšuje. Môže to byť spôsobené tým, že pri nízkych teplotách sa korytnačka necíti veľmi dobre a jej tep začína byť riadený inými biochemickými reakciami.
Príklad 3
Mimoriadne zaujímavé sú pokusy „vložiť Arrheniovu závislosť“ na ľudské psychologické procesy. Ľudia s rôznou telesnou teplotou (od 36,4 °C do 39 °C) teda mali počítať sekundy. Ukázalo sa, že čím vyššia teplota, tým rýchlejšie počítanie.
(E a = 100,4 kJ/mol). Náš subjektívny zmysel pre čas sa teda riadi Arrheniovou rovnicou. Autor sociologickej štúdie G. Hogland naznačil, že je to spôsobené určitými biochemickými procesmi v ľudskom mozgu.
Nemecký výskumník H. von Foerstler meral mieru zabúdania u ľudí s rôznymi teplotami. Dal ľuďom postupnosť rôznych znamení a meral čas, počas ktorého si ľudia túto postupnosť zapamätali. Výsledok bol rovnaký ako u Hoaglanda: Arrheniusova závislosť s E a = 100,4 kJ/mol.
Tieto príklady ukazujú, že mnohé procesy v prírode, vrátane psychologických, sa riadia Arrheniovou rovnicou s pomerne vysokými aktivačnými energiami E A. Tento posledný bod je obzvlášť dôležitý, pretože E a fyzikálne procesy (napríklad prúdenie viskóznej tekutiny) zvyčajne nepresahujú 20 kJ/mol. Vysoká aktivačná energia zvyčajne znamená prerušenie chemických väzieb. Takže vo všetkých diskutovaných príkladoch nepochybne prebiehajú skutočné chemické reakcie (samozrejme enzymatické).
PRÍLOHA č.3
Rovnováha procesu prechodu z jednej fázy do druhej bez zmeny chemického zloženia sa nazýva fázová rovnováha. Príklady fázovej rovnováhy môžu byť nasledujúce procesy:
odparovanie
![]()
Pre fázovú rovnováhu sa dodržiava Le Chatelierov princíp.
Ako teplota stúpa, rovnováha sa posúva smerom k endotermickému procesu, ako je topenie a vyparovanie. So zvyšujúcim sa tlakom sa rovnováha posúva smerom k procesom, pri ktorých sa plyn alebo para mení na kvapalné alebo pevné skupenstvo.
Pravidlo fázy.
Formuloval J. Gibbs. Počet stupňov voľnosti C , fázy F , nezávislé komponenty TO a vonkajšie podmienky n , ovplyvňujúce rovnováhu, sú vzájomne prepojené vzťahom:
C+ F = K + n
2.4. Mechanizmus chemických reakcií. Reťazové reakcie. Fotochemické procesy. Homogénna a heterogénna katalýza. Autokatalýza. Enzýmová katalýza. Katalytické jedy. Oscilačné reakcie.
Aktivačná energia. Energetický profil reakcie.
Reakcie sa vyskytujú v dôsledku priamych zrážok molekúl. Nie všetky zrážky však vedú k chemickej reakcii. Tvorbu nových látok uľahčujú len molekuly, ktoré majú dostatočný prísun energie. Takéto molekuly sa nazývajú aktívne molekuly.
Minimálna energia dostatočná na spustenie chemickej reakcie sa nazýva aktivačná energia a vyjadruje sa v kcal alebo kJ. Čím nižšia je aktivačná energia, tým rýchlejšie prebieha reakcia.
Pri reakciách, kde je aktivačná energia väčšia ako 150 kJ pri t=25°C, je rýchlosť veľmi nízka alebo k týmto reakciám prakticky nedochádza. Pri reakciách, kde je aktivačná energia menšia ako 60 kJ, je rýchlosť veľmi vysoká (výbuch).
Aktivačná energia Ea závisí od povahy reagujúcich prvkov a slúži ako charakteristika každej reakcie.

Energetický diagram reakcie s tvorbou
aktivovaný komplex.
Aby reaktanty A a B vytvorili reakčné produkty C a D, musia prekonať energetickú bariéru ML. To si vyžaduje aktivačnú energiu Ea. V tomto prípade počas reakcie vzniká z častíc implementačných látok intermediárna nestabilná skupina - aktivovaný komplex (obr. 2.6).
Tento komplex sa rozkladá za vzniku konečných produktov a uvoľňuje sa také množstvo energie, ktoré umožňuje, aby konečné produkty klesali na úroveň priemernej energie konečných produktov.
To. zmenu produktov je možné vyjadriť vo forme diagramov pre endotermické a exotermické reakcie (obr. 2.7, 2.8).


vývojový diagram
exotermická reakcia
vývojový diagram
endotermická reakcia
O  Reakcie medzi látkami so silnými kovalentnými väzbami sú zvyčajne charakterizované veľkými hodnotami Ea a prebiehajú pomaly. Týka sa to mnohých interakcií, napr
Reakcie medzi látkami so silnými kovalentnými väzbami sú zvyčajne charakterizované veľkými hodnotami Ea a prebiehajú pomaly. Týka sa to mnohých interakcií, napr
ktorého rýchlosť za štandardných podmienok je 0.
M  iónové interakcie v roztokoch sa vyznačujú nízkymi hodnotami Ea a veľmi vysokými rýchlosťami
iónové interakcie v roztokoch sa vyznačujú nízkymi hodnotami Ea a veľmi vysokými rýchlosťami
Energetický profil reakcie. A + B = AB (bez katalyzátora) A + B + K? + B? ? AB + K (s kat.).
Obrázok 45 z prezentácie „Rýchlosť chemickej reakcie“ na hodiny chémie na tému „Reakcie“Rozmery: 1280 x 800 pixelov, formát: jpg. Ak si chcete stiahnuť bezplatný obrázok na lekciu chémie, kliknite pravým tlačidlom myši na obrázok a kliknite na „Uložiť obrázok ako...“. Na zobrazenie obrázkov v lekcii si môžete bezplatne stiahnuť celú prezentáciu „Rýchlosť chemickej reakcie.ppt“ so všetkými obrázkami v zip archíve. Veľkosť archívu je 129 kB.
Stiahnite si prezentáciuReakcie
„Chemické rovnice“ - 7 Н2SO4. Zákon zachovania hmotnosti látok. Ca + O2 CaO. Téma: Zmeny vyskytujúce sa v látkach. Znaky a podmienky výskytu chemických reakcií. PAMATUJTE SI! Chemické rovnice. Moderné znenie zákona: 1756
„Elektrolytická disociácia solí“ - Aplikácia solí. Roztok fenolftaleínu Napíšte molekulové a iónové rovnice pre možné reakcie. Chemické vlastnosti solí. 1. Kov + soľ 2. Soľ + zásada 3. Soľ + kyselina 4. Soľ + soľ. Úloha 3. S ktorou z nasledujúcich látok reaguje roztok hydroxidu sodného? NaOH, Ba(OH)2, NH4OH, Al(OH)3.
„Rovnice chemických reakcií“ - D/Z 1) preštudovať si text § 26 2) absolvovať písomné cvičenia č. 1-3. Stanovenie cieľa. 2) Pozrite si študentské prezentácie o čistení vody doma. Výroba oxidu uhličitého interakciou sódy a kyseliny. Atóm vodíka. 4. Prezrite si študentské prezentácie na vybrané témy. m1. Referenčný materiál pre skupinovú prácu.
„Rýchlosť chemickej reakcie“ - t1. DCB dt. Rýchlosť chemickej reakcie. a A. Chemická kinetika. dc dt. Klasifikácia procesov podľa fázového zloženia. V a) n=0 v b) n=1 v c) n>1. Reťaz - nerozvetvené okresy. C1. Grafická definícia n. Plán prednášok. Reťazové - rozvetvené reakcie. Kinetická rovnica komplexnej reakcie.
„Reakcie látok“ - Klasifikácia látok podľa zloženia: Fotografie fragmentov lekcií pomocou interaktívnej tabule. N2. Stupeň 10 „Sacharidy“. O akých látkach hovorí úryvok z básne S. Ščipačova „Čítanie Mendelejeva“? Napíšte reakčné rovnice na výrobu síranu hlinitého. Úloha č.4. Úloha č.7. sulfid rumelkovej ortuti (ii).
„Typy chemických reakcií“ - Všetky reakcie sú sprevádzané tepelnými účinkami. Druhy chemických reakcií. Chemické reakcie sa vyskytujú: pri miešaní alebo fyzikálnom kontakte činidiel, spontánne pri zahrievaní za účasti katalyzátorov, pôsobením svetla, elektrického prúdu, mechanického pôsobenia atď. Karpukhina Irina Stepanovna Učiteľ chémie MBOU Stredná škola č. 32 Mesto Novosibirsk.
Celkovo je 28 prezentácií
Zmena entalpie DH je v podstate rozdiel v energiách väzieb reaktantov a produktov, vrátane energií konjugácie, napätia a solvatácie. DH možno vypočítať sčítaním energií všetkých väzieb prerušených počas reakcie a odčítaním súčtu energií všetkých vytvorených väzieb, pripočítaním všetkých zmien v konjugačných, napäťových a solvatačných energiách. Okrem toho možno zmenu entalpie určiť experimentálne meraním tepelného účinku reakcie, keďže zmena entalpie sa rovná tepelnému účinku reakcie s opačným znamienkom.
- DH=Qр
Zmena entropie DS charakterizuje stupeň neusporiadanosti systému. V organickej chémii tento faktor málokedy hrá veľkú úlohu, pretože reakcie prebiehajú pri relatívne nízkych teplotách, pri ktorých je faktor entropie malý. V niektorých prípadoch však môže zmena entropie zohrávať významnú úlohu:
· keďže plyny majú vyššiu entropiu ako kvapaliny (ešte viac ako pevné látky), potom každá reakcia, pri ktorej sú východiskové látky kvapalné alebo pevné a jeden alebo viac produktov je plynných, je termodynamicky priaznivá, pretože entropia systému sa zvyšuje;
· ak pri reakcii vzniká viac molekúl produktov ako molekúl východiskových látok, tak reakcia prebieha so zvýšením entropie.
Záporná hodnota DG sama o sebe neznamená, že reakcia nastane v dohľadnom časovom období. Negatívna zmena voľnej energie je nevyhnutným, ale nie postačujúcim faktorom pre spontánny výskyt chemickej reakcie. Napríklad reakcia dvoch mólov vodíka s jedným mólom kyslíka, pri ktorej vzniká voda, sa vyznačuje veľkou negatívnou zmenou voľnej energie. Zmes O 2 a H 2 sa však môže skladovať pri izbovej teplote aj desiatky rokov bez akýchkoľvek známok chemickej reakcie.
Mechanizmy organických reakcií
Na pochopenie organických reakcií je mimoriadne užitočná znalosť ich mechanizmov.
Reakčný mechanizmus - podrobný popis procesu premeny východiskových zlúčenín na produkty. Mechanizmus zahŕňa údaje o spôsobe a postupnosti štiepenia a tvorby väzby, štruktúre medziproduktov (medziproduktov), kinetike, termodynamike a stereochémii reakcie. Mechanizmus by nemal byť v rozpore s existujúcimi experimentálnymi faktami, a keď sa objavia nové, tiež ich vysvetlite.
Pri zvažovaní jemných vlastností mechanizmov je mimoriadne užitočné použiť tzv energetický diagram (energetický profil) reakcie. Ide o grafickú závislosť energie systému od komplexnej funkcie vzdialenosti medzi reagujúcimi látkami, ktorá sa zvyčajne nazýva „ reakčná súradnica" alebo " priebeh reakcie"(Obrázok 3.1).
Ryža. 3.1. Energetický diagram: A – endo-, B – exotermická reakcia.
Tento obrázok ilustruje výskyt jednostupňových reakcií. Endotermická reakcia zahŕňa absorpciu tepla, zatiaľ čo exotermická reakcia zahŕňa uvoľňovanie tepla.
Takmer všetky chemické reakcie sa vyskytujú, keď sa zrazia dve alebo viac, veľmi zriedkavo, reagujúcich častíc. Z obr. 3.1 je zrejmé, že približovanie sa reagujúcich molekúl vedie k zvýšeniu energie systému na určité maximum. Zrážky budú účinné, keď majú reagujúce látky určitú nadbytočnú energiu v porovnaní s priemernou energiou molekúl v systéme. Častice, ktoré nemajú taký prebytok energie, sa po zrážke rozptýlia rôznymi smermi. Aktivačná energia- nadmerná energia potrebná na prekonanie energetickej bariéry. Maximálna energia sústavy (najvyšší bod energetického diagramu) zodpovedá prechodný stav (aktivovaný komplex). Prítomnosť prechodového stavu vysvetľuje dôvod, prečo ani exotermické reakcie zvyčajne neprebiehajú spontánne, ale iba pri zahrievaní alebo inom spôsobe aktivácie systému.
Práve prechodový stav – najvyšší energetický bod reakcie – určuje priebeh celej premeny. Znalosť jeho štruktúry môže objasniť mechanizmus chemickej premeny. Životnosť aktivovaného komplexu je však taká krátka, že neexistujú žiadne fyzikálne metódy na jeho registráciu a následne na získanie poznatkov o jeho štruktúre.
Postulát J. Hammonda
Na nepriame posúdenie štruktúry prechodného stavu použite postulát J. Hammonda (1955): menšie energetické zmeny sú sprevádzané malými zmenami v molekulárnej štruktúre. Jasnejšia formulácia: štruktúra prechodného stavu je podobná štruktúre tých látok, ktorým je energeticky bližšie. Pri exotermických reakciách je prechodný stav štruktúrou bližšie k počiatočným činidlám (obr. 3.1). Tento aktivovaný komplex je tzv skorý prechodný stav. Prechodný stav pri endotermických reakciách je štruktúrou bližšie k reakčným produktom, nazýva sa neskoro. Podobné dopady na podobné štruktúry vedú k podobným výsledkom. Preto všetko stabilizujúce faktory(zníženie energetických stavov) energeticky blízko k prechodnému stavu počiatočné, stredné alebo konečné látky, znižujú energiu aktivovaného komplexu.
Použitie Hammondovho postulátu je užitočné najmä pri zvažovaní viacstupňových reakcií (obrázok 3.2).
 |
Obrázok 3.2. Energetický diagram dvojstupňovej reakcie
Z obrázku 3.2 je zrejmé, že reakcia prebieha v dvoch stupňoch, cez jeden medziprodukt. Premena produktov na medziprodukty (prvý stupeň) je pre celkovú reakciu dôležitejšia ako premena medziproduktov na reakčné produkty (druhý stupeň). Potvrdzujú to zodpovedajúce aktivačné energie prvého a druhého stupňa (Ea 1, resp. Ea 2). Celý priebeh reakcie je určený jej najvyšším energetickým bodom - prechodovým stavom prvého stupňa [PS 1]. Ak na túto reakciu aplikujeme Hammondov postulát, je ľahké usúdiť, že medziprodukt je energeticky najbližšie k prechodovým stavom oboch stupňov reakcie.
S. Arrhenius objavil teplotnú závislosť rýchlosti mnohých reakcií, ktorú možno opísať rovnicou:
k = A e - E* / RT
Kde k - rýchlostná konštanta, e - základňa prirodzených logaritmov, R - univerzálna plynová konštanta, T - teplota, A - predexponenciálny faktor, E* - reakčná aktivačná energia.
teória aktívnej zrážky(zrážky)
1) Chemická interakcia medzi molekulami je možná len vtedy, keď sa zrazia.
2) Nie každá zrážka molekúl vedie k chemickej interakcii, to znamená, že je účinná alebo v Arrheniovej terminológii aktívna. Existuje určitá energetická bariéra, ktoré len časť molekúl dokáže prekonať a interagovať s nimi, a to je spravidla veľmi malá časť z ich celkového počtu v systéme.
3) Dôvodom existencie energetickej bariéry je vzájomné odpudzovanie elektrónových obalov molekúl pri ich priblížení.
4) Aby molekuly pri zrážke prekonali energetickú bariéru, musia sa k sebe pohybovať dostatočne vysokou rýchlosťou. Na dosiahnutie tejto požadovanej rýchlosti je potrebná určitá energia, ktorá sa nazýva aktivačná energia. Aktivačná energia E* - je to prebytok energie aktívnych molekúl v porovnaní s neaktívnymi, alebo inak energia, ktorú musia molekuly mať, aby mohli interagovať. Rozmer SI aktivačnej energie je J/mol.
5) Čím väčšia je aktivačná energia reakcie, tým väčšia je energetická bariéra a tým menej molekúl ju dokáže prekonať. Preto čím viac E* , tým pomalšia reakcia prebieha.
6) So zvyšujúcou sa teplotou sa zvyšuje rýchlosť tepelného pohybu molekúl, takže sa zvyšuje podiel aktívnych molekúl. Inými slovami, keď teplota stúpa, tepelná aktiváciačo vedie k zvýšeniu reakčnej rýchlosti.
výpočet aktivačnej energie reakcie z hodnôt dvoch rýchlostných konštánt pri rôznych teplotách:
T 2 - T 1 k 1
Aktivovaný komplex je nestabilná formácia, ktorá zahŕňa všetky atómy kolidujúcich a interagujúcich molekúl. Životnosť aktivovaného komplexu je veľmi krátka; meria sa v malých (milióntinach, desaťmilióntinách atď.) zlomkoch sekundy. Vzdialenosti medzi atómami v aktivovanom komplexe sú o niečo väčšie ako v bežných molekulách, takže na jeho vytvorenie je potrebná dodatočná energia.
Vizuálne znázornenie priebehu reakcie v čase v súlade s teóriou prechodového stavu môže poskytnúť energetický profil reakcia, napríklad exotermická (obr. 12.6).
Energia systému je vynesená pozdĺž ordinátnej osi E a os x je takzvaná reakčná súradnica. Priemerná energetická rezerva tepelného pohybu molekúl východiskových látok zodpovedá hladine E ref, energia uložená v aktivovanom komplexe - úroveň E AK. Potom rozdiel E AK - E ref sa rovná hodnote energetickej bariéry, ktorú musia molekuly prekonať, aby mohli interagovať (aktivačná energia). Vizuálne znázornenie je dané krivkou spájajúcou úrovne E ref a E AK. Výška energetickej bariéry závisí od povahy reagujúcich látok, energie potrebnej na vytvorenie aktivovaného komplexu (aktivačná energia), ako aj od priemernej energie tepelného pohybu molekúl. E ref.
Ako teplota stúpa, hladina E ref stúpa, energetická bariéra sa zmenšuje a väčší počet molekúl môže interagovať. To je dôvod, prečo sa reakcia zrýchľuje so zvyšujúcou sa teplotou. Keď teplota naopak klesá, hladina E ref klesá a energetická bariéra sa zvyšuje, čo vedie k zníženiu rýchlosti reakcie.
Pri rozklade aktivovaného komplexu s tvorbou molekúl produktu sa uvoľňuje energia, ktorá zodpovedá rozdielu E AK - E prod, kde E prod - priemerná energetická rezerva molekúl produktu. Časť tejto uvoľnenej energie sa rovná rozdielu E AK - E ref sa použije na aktiváciu nových molekúl východiskových látok a prebytku E ref - E produkt sa uvoľní do prostredia vo forme exotermického tepelného účinku reakcie DH r .
Pre endotermické reakcie vyzerá energetický profil trochu inak (obr. 12.7). Je vidieť, že v tomto prípade úroveň energie E ref nižšie ako úroveň E pokračovanie V dôsledku tejto energie E AK - E produkt uvoľnený pri dezintegrácii aktivovaného komplexu nestačí na
spôsobiť aktiváciu nových molekúl reaktantov. Pre pokračovanie reakcie je preto potrebné dodať energiu zvonku, vo forme endotermického tepelného efektu.
Existencia aktivovaného komplexu je potvrdená experimentálnymi údajmi. Tak napríklad pre jednu z jednoduchých modelových reakcií interakcie atómu vodíka s molekulou vodíka
Н 2 + Н ® Н + Н 2 ,
hodnota aktivačnej energie sa blíži k 36,8 kJ/mol. Ak by reakcia prebehla cez štádium úplnej disociácie molekúl H2, a nie cez štádium tvorby aktivovaného komplexu H2·H, potom by bola potrebná aktivačná energia 435,1 kJ/mol.
55. fotochémia. Fotochemické reakcie. Základné zákony fotochémie (Grotthusov-Draperov zákon, Bunsen-Roscoeov zákon, Starkov-Einsteinov zákon).
fotochémia toto je odvetvie chemickej kinetiky, ktoré sa zaoberá správaním elektronicky excitovaných molekúl .
V biológii je známych viacero fotochemických procesov, ktoré sú mimoriadne dôležité pre život ako jednotlivých organizmov, tak aj biosféry ako celku. Po prvé, medzi takéto procesy by sme mali menovať fotosyntéza Okrem toho je mimoriadne dôležitá fotochémia zraku, fotochémia syntézy vitamínov, napríklad vitamín D v ľudskej koži, fotochémia opaľovania atď.
Fotochemická reakcia rozkladu halogenidov striebra je základom fotografického procesu. Existujú fotochromatické materiály, ktoré môžu pri vystavení svetlu meniť farbu alebo priehľadnosť, ktoré sa používajú najmä na fotochemický záznam informácií alebo na výrobu slnečných okuliarov. Fotochemické reakcie sa využívajú aj v chemickom priemysle, napríklad pri syntéze kaprolaktámu alebo pri fotopolymerizácii metylmetakrylátu pri výrobe organického skla.
Pre farmáciu sú fotochemické reakcie dôležité predovšetkým preto, že svetlo môže spôsobiť deštrukciu ( fotolýza) veľa liekov. Pod vplyvom svetla podlieha rozkladu aj mnoho ďalších látok a materiálov – drevo, papier, farby, plasty atď.
V chémii je široko používaná luminiscenčná metóda analýzy založená na štúdiu spektier žiarenia emitovaného excitovanými molekulami skúmaných látok.
Zákony fotochémie
Sú známe nasledujúce zákony fotochémie:
Grotthusov-Draperov zákon(K.I.D. Grotthus - 1818; J.W. Draper - 1842).