Fyzikálnochemické metódy analýzy (PCMA) sú založené na využití vzťahu medzi nameranými fyzikálnymi vlastnosťami látok a ich kvalitatívnym a kvantitatívnym zložením. Keďže fyzikálne vlastnosti látok sa merajú pomocou rôznych zariadení - „nástrojov“, tieto metódy analýzy sa nazývajú aj inštrumentálne metódy.
Najväčšie praktické aplikácie medzi FHMA sú:
- elektrochemické metódy– na základe merania potenciálu, prúdu, množstva elektriny a iných elektrických parametrov;
- spektrálne a iné optické metódy– založené na fenoméne absorpcie alebo emisie elektromagnetického žiarenia (EMR) atómami alebo molekulami látky;
- chromatografické metódy– sú založené na sorpčných procesoch prebiehajúcich v dynamických podmienkach s usmerneným pohybom mobilnej fázy voči stacionárnej.
Medzi výhody PCMA patrí vysoká citlivosť a nízky detekčný limit - hmotnosť do 10-9 μg a koncentrácia do 10-12 g/ml, vysoká selektivita (selektivita), ktorá umožňuje stanovenie zložiek zmesí bez ich predbežnej separácie, ako aj ako rýchla analýza, možnosť ich automatizácie a automatizácie.
Elektrochemické metódy sú široko používané v analytickej chémii. Výber metódy analýzy pre konkrétny objekt analýzy je určený mnohými faktormi, medzi ktoré patrí predovšetkým dolná hranica definície prvku.
Údaje o spodnej hranici detekcie rôznych prvkov niektorými metódami sú uvedené v tabuľke.
Medze stanovenia (μg/ml) prvkov rôznymi metódami
| Element | MAS | AAS | PTP | WILLOW | Ionometria | Ampere.titles. |
| Ag | 0,1- ditizón | 0,07 | 0,2 | 0.00001 | 0.02 | 0.05 |
| Ako | 0,05 - molybd.modrá | 0,2 | 0,04 | 0,02 | - | 0,05 |
| Au | 0,04-metylfiol. | 0,3 | 0,005 | 0,001 | - | 0,05 |
| Bi | 0,07-ditizón | 0,005 | 0,00001 | - | 0,5 | |
| Cd | 0,04-ditizón | 0,05 | 0,002 | 0,00001 | 0,03 | 0,5 |
| Cr | 0,04-difenylkarbazid | 0,2 | 0,02 | - | - | |
| Cu | 0,03-ditizón | 0,2 | 0,002 | 0,00002 | 0,01 | 0,05 |
| Hg | 0,08-ditizón | - | 0,00005 | |||
| Pb | 0,08-ditizón | 0,6 | 0,003 | 0,00002 | 0,03 | |
| Sb | 0,08-rodamín | 0,004 | 0,00004 | - | 0,5 | |
| Fe | 0,1-rodanid | 0,2 | 0,003 | 0,0002 | 0,3 | 0,5 |
| Se | 0,08-diamino-noftalén | 0,3 | 0,2 | 0,00002 | - | 0,5 |
| Sn | 0,07-fenyl-flurióm | 0,4 | 0,003 | 0,00004 | - | 0,5 |
| Te | 0,1-bizmuthol | 0,7 | 0,02 | - | - | |
| Tl | 0,06-rodamín | 0,6 | 0,01 | 0,00002 | - | 0,5 |
| Zn | 0,02-ditizón | 0,02 | 0,003 | 0,0003 | - | 0,5 |
| F- | - | - | - | - | 0,02 | 5-10 |
| NH4+,NO3- | - | - | - | - | 0,1 | 1-5 |
MAS - molekulová absorpčná spektrometria (fotometria);
AAS - atómová absorpčná spektrometria (plameňová fotometria);
PTP - polarografia striedavého prúdu;
IVA - stripovacia voltametria.
Chyby stanovenia v FHMA sú asi 2-5%, vykonávanie analýz vyžaduje použitie zložitého a drahého zariadenia.
Rozlišovať priame a nepriame metódy fyzikálnej a chemickej analýzy. Priame metódy využívajú závislosť veľkosti meraného analytického signálu od koncentrácie stanovovanej zložky. Pri nepriamych metódach sa meria analytický signál s cieľom nájsť koncový bod titrácie stanovovanej zložky vhodným titračným činidlom, to znamená, že sa využíva závislosť meraného parametra od objemu titračného činidla.
Elektrochemické metódy analýzy sú založené na štúdiu a využití procesov prebiehajúcich na povrchu elektródy alebo v blízkoelektródovom priestore. Ako analytický signál môže slúžiť akýkoľvek elektrický parameter (potenciál, elektrický prúd, množstvo elektriny atď.), ktorý funkčne súvisí s koncentráciou určovanej zložky a je vhodný na správne meranie.
Podľa charakteru meraného analytického signálu sa elektrochemické metódy analýzy delia na potenciometria, voltametria, coulometria a množstvo ďalších metód:
Charakteristická závislosť elektrochemického signálu od nezávislej premennej
| Metóda | Meraný signál | Závislosť signálu od nezávislej premennej |
| Potenciometria, ionometria | potenciál E = f(C) C-koncentrácia analytu | |
| Potenciometrická titrácia | potenciál E = f(V), V je objem titračného činidla |
 |
| polarografia, voltametria | prúd I = f(E), E – potenciál polarizácie elektródy |  |
| stripovacia voltametria | prúd I n = f(E) |  |
| chronopotenciometria | potenciál E =f(t), t – čas polarizácie elektródy pri I=konšt. |
 |
| amperometrická titrácia s jednou indikačnou elektródou | prúd I = f(V), V – objem titračného činidla |  |
| amperometrická titrácia s dvoma indikátorovými elektródami | prúd I = f(V) V – objem titračného činidla |  |
| coulometria | Q = f(C), C – látkové množstvo |  |
| konduktometria | G = f(C), C – koncentrácia iónov v roztoku |  |
| konduktometrická titrácia | elektrická vodivosť G = f(V), V – objem titračného činidla |  |
Potenciometria
Potenciometrické merania sú založené na závislosti rovnovážneho potenciálu elektródy od aktivity (koncentrácie) stanovovaného iónu. Pre merania je potrebné zostrojiť galvanický článok z vhodného indikačná elektróda a referenčná elektróda, a tiež majú zariadenie na meranie potenciálu indikačnej elektródy (EMF galvanického článku), za podmienok blízkych termodynamickým, keď má indikačná elektróda rovnovážny (alebo blízko neho) potenciál, to znamená bez odstránenia viditeľného prúdu z galvanický článok, keď je okruh uzavretý. V tomto prípade nemôžete použiť bežný voltmetr, ale mali by ste ho použiť potenciometer- elektronické zariadenie s vysokým vstupným odporom (1011 - 1012 Ohmov), ktoré eliminuje vznik elektródových elektrochemických reakcií a výskyt prúdu v obvode.
Indikátorová elektróda je elektróda, ktorej potenciál závisí od aktivity (koncentrácie) stanovovaného iónu v analyzovanom roztoku.
Referenčná elektróda je elektróda, ktorej potenciál zostáva v podmienkach analýzy konštantný. Potenciál indikačnej elektródy sa meria vzhľadom na referenčnú elektródu. E(EMF galvanického článku).
V potenciometrii sa používajú dve hlavné triedy indikačných elektród - výmena elektrónov a výmena iónov.
Elektródy na výmenu elektrónov– sú to elektródy, na ktorých povrchu prebiehajú elektródové reakcie s účasťou elektrónov. Takéto elektródy zahŕňajú elektródy prvého a druhého druhu, redoxné elektródy.
Elektródy prvého druhu- sú to elektródy, ktoré sú reverzibilné katiónom spoločným pre materiál elektródy, napríklad kov M, ponorený do roztoku soli toho istého kovu. Na povrchu takejto elektródy nastáva reverzibilná reakcia M n+ + nie↔ M a jeho skutočný potenciál závisí od aktivity (koncentrácie) katiónov kovov v roztoku v súlade s Nernstovou rovnicou:

Pre teplotu 250 C (298 K) a pre podmienky, kde sa aktivita iónov približne rovná koncentrácii (γ → 1):

Elektródy prvého druhu môžu byť vyrobené z rôznych kovov, napríklad Ag (striebro), Cu (meď), Zn (zinok), Pb (olovo) atď.
Schematicky sú elektródy prvého druhu písané ako M | M n+ , kde zvislá čiara znázorňuje hranicu tuhej (elektróda) a kvapalnej (roztok) fázy. Napríklad strieborná elektróda ponorená do roztoku dusičnanu strieborného je znázornená takto - Ag | Ag+; v prípade potreby uveďte koncentráciu elektrolytu – Ag | AgN03 (0,1 M).
Elektródy prvého druhu zahŕňajú plynová vodíková elektróda Pt(H2) | H+ (2H++ 2e↔ H 2, E 0 = 0):

Elektródy druhého druhu- sú to aniónové reverzibilné elektródy, napríklad kov potiahnutý ťažko rozpustnou soľou tohto kovu, ponorený do roztoku obsahujúceho anión tejto ťažko rozpustnej soli M, MA | A n-. Na povrchu takejto elektródy nastáva reverzibilná reakcia MA + nie↔ M + A n- a jeho skutočný potenciál závisí od aktivity (koncentrácie) aniónu v roztoku v súlade s Nernstovou rovnicou (pri T= 298 K a γ → 1):

Príkladmi elektród druhého typu sú chlorid strieborný (AgCl + e↔ Ag + Cl -) a kalomel (Hg 2 Cl 2 + 2e↔ 2Hg + 2Cl -) elektródy:

Redoxné elektródy– ide o elektródy, ktoré pozostávajú z inertného materiálu (platina, zlato, grafit, sklený uhlík atď.) ponoreného do roztoku obsahujúceho oxidované (Ok) a redukované (Boc) formy stanovovanej látky. Na povrchu takejto elektródy dochádza k reverzibilnej reakcii Oc + nie↔ Boc a jeho skutočný potenciál závisí od aktivity (koncentrácie) oxidovaných a redukovaných foriem látky v roztoku v súlade s Nernstovou rovnicou (pri T= 298 K a γ → 1):

Ak sa vodíkové ióny zúčastňujú elektródovej reakcie, potom sa ich aktivita (koncentrácia) berie do úvahy v zodpovedajúcich Nernstových rovniciach pre každý konkrétny prípad.
Elektródy na výmenu iónov- Sú to elektródy, na ktorých povrchu prebiehajú iónomeničové reakcie. Takéto elektródy sa tiež nazývajú iónovo selektívne alebo membránové. Najdôležitejšou zložkou takýchto elektród je polopriepustná membrána– tenký pevný alebo tekutý film, ktorý oddeľuje vnútornú časť elektródy (vnútorný roztok) od analyzovaného roztoku a má schopnosť prenášať iba ióny jedného typu X (katióny alebo anióny). Štrukturálne sa membránová elektróda skladá z vnútornej referenčnej elektródy (zvyčajne chloridu strieborného) a vnútorného roztoku elektrolytu s konštantnou koncentráciou potenciál určujúceho iónu, oddeleného od vonkajšieho (testovaného) roztoku citlivou membránou.
Skutočný potenciál iónovo selektívnych elektród, meraný vzhľadom na akúkoľvek referenčnú elektródu, závisí od aktivity tých iónov v roztoku, ktoré sú sorbované membránou:

Kde const – konštantná v závislosti od povahy membrány ( potenciál asymetrie) a potenciálny rozdiel medzi externými a internými referenčnými elektródami, n A A(X n±) – náboj a aktivita potenciálne určujúceho iónu. Ak sa iónovo selektívny elektródový potenciál meria vzhľadom na štandardnú vodíkovú elektródu, potom konštanta predstavuje štandardný elektródový potenciál E 0.
Pre membránové elektródy hodnota sklon funkcie elektródy sa môže líšiť od teoretického Nernstovská magnitúda (0,059 V); v tomto prípade je skutočná hodnota funkcie elektródy θ sa určí ako dotyčnica sklonu kalibračného grafu. potom:

Je opísaný potenciál membránovej elektródy v roztoku obsahujúcom okrem detegovateľného iónu X aj cudzí ión B, ktorý ovplyvňuje potenciál elektródy. Nikolského rovnica(upravená Nernstova rovnica):

Kde z- náboj cudzieho (rušivého) iónu, KХ/В – koeficient selektivity membránovej elektródy.
Koeficient selektivity K X/B charakterizuje citlivosť elektródovej membrány na detegovateľné ióny X v prítomnosti interferujúcich iónov B. Ak K H/V<1, то электрод селективен относительно ионов Х и, чем меньше числовое значение коэффициента селективности, тем выше селективность электрода по отношению к определяемым ионам и меньше мешающее действие посторонних ионов. Если коэффициент селективности равен 0,01, то это означает, что мешающий ион В оказывает на величину электродного потенциала в 100 раз меньшее влияние, чем определяемый ион той же молярной концентрации.
Koeficient selektivity sa vypočíta ako pomer aktivít (koncentrácií) detekovaných a interferujúcich iónov, pri ktorých elektróda nadobúda rovnaký potenciál v roztokoch týchto látok, berúc do úvahy ich náboje:

Keď poznáte hodnotu koeficientu selektivity, môžete vypočítať koncentráciu interferujúceho iónu, ktorý ovplyvňuje potenciál iónovo selektívnej elektródy (príklad).
Príklad. Aká koncentrácia dusičnanových iónov musí byť vytvorená v 1∙10-3 M roztoku fluoridu sodného, aby iónovo selektívna fluoridová elektróda bola rovnako citlivá na oba ióny, ak má koeficient elektródovej selektivity?

Riešenie.
Odvtedy

To znamená, že koncentrácia dusičnanových iónov v analyzovanom roztoku nad 0,5 mol/l má významný vplyv na stanovenie fluoridového iónu v jeho milimolárnych roztokoch.
Klasickým príkladom iónovo selektívnej pevnej membránovej elektródy je sklenená elektróda s vodíkovou funkciou, ktorá sa používa na meranie koncentrácie vodíkových iónov v roztoku (sklená pH elektróda). Pre takéto elektródy je membrána špeciálne sklo určitého zloženia a vnútorným elektrolytom je 0,1 M roztok kyseliny chlorovodíkovej:
Ag, AgCl | 0,1 M HCl | sklenená membrána | testovací roztok
Na povrchu sklenenej membrány prebieha proces iónovej výmeny:
SiO-Na+ (sklo) + H+ (roztok) → -SiO-H+ (sklo) + Na+ (roztok)
v dôsledku toho sa vytvorí dynamická rovnováha medzi iónmi vodíka v skle a roztokom H+ (sklo) ↔ H+ (roztok), čo vedie k vzniku potenciálu:
E = konštanta + θ lg a(H+) = konšt – θ pH
Sklenená elektróda s vysokým obsahom Al2O3 v membráne meria aktivitu sodných iónov v roztoku (sklenená Na-elektróda, sodík-selektívna elektróda). V tomto prípade je vnútorným roztokom 0,1 M roztok chloridu sodného:
Ag, AgCl | 0,1 M NaCl | sklenená membrána | testovací roztok
Na povrchu sklenenej membrány sodíkovo selektívnej elektródy sa vytvorí rovnováha medzi iónmi sodíka v skle a roztokom Na+ (sklo) ↔ Na+ (roztok), čo vedie k vzniku potenciálu:
E = konštanta + θ lg a(Na+) = konšt – θ pNa
Najpokročilejšia elektróda s kryštalickou membránou je fluoridovo selektívna elektróda, ktorej membrána je vyrobená z doštičky monokryštálu fluoridu lantanitého (LaF3), aktivovaného na zvýšenie vodivosti fluoridom európiam (EuF 2):
Ag, AgCl | 0,1 M NaCl, 0,1 M NaF | LaF 3 (EuF 2) | testovací roztok
Potenciál fluoridovej elektródy je určený procesom iónovej výmeny na jej povrchu F- (membrána) ↔ F- (roztok):
E = konštanta – θ lg a(F-) = konšt + θ pF
Hodnoty konštanty a strmosti funkcie elektródy θ pre iónovo selektívne elektródy určené z kalibračného grafu E ÷рХ ako úsečka na osi y a dotyčnica uhla sklonu priamky, resp. Pre sklenenú pH elektródu je táto operácia nahradená nastavením prístrojov (pH metrov) pomocou štandardných tlmivých roztokov s presne známymi hodnotami pH.
Schematický pohľad na sklenené a fluoridovo selektívne elektródy je znázornený na obrázkoch:
V spojení s indikačnou elektródou na meranie jej potenciálu (EMF galvanického článku) sa používa referenčná elektróda so známym a stabilným potenciálom, nezávislým od zloženia skúmaného roztoku. Ako referenčné elektródy sa najčastejšie používajú chloridové a kalomelové elektródy. Obe elektródy patria k elektródam druhého typu a vyznačujú sa vysokou stabilitou v prevádzke.
Potenciály chloridových a kalomelových elektród závisia od aktivity (koncentrácie) chloridových iónov (pri T= 298 K a γ → 1):

Ako referenčné elektródy sa najčastejšie používajú elektródy s nasýteným roztokom chloridu draselného - pri 250C je potenciál nasýtenej referenčnej elektródy chloridu strieborného +0,201 V a nasýtenej kalomelovej elektródy +0,247 V (vzhľadom na štandardnú vodíkovú elektródu) . Potenciály pre chlorid strieborný a kalomelové referenčné elektródy obsahujúce 1 M a 0,1 M roztoky chloridu draselného možno nájsť v referenčných tabuľkách.
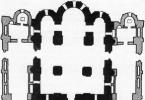
Schematický pohľad na nasýtený chlorid strieborný a kalomelové referenčné elektródy je znázornený na obrázku:

Referenčné elektródy chloridu strieborného (A) a kalomel (b)
1 - azbestové vlákno zabezpečujúce kontakt s analyzovaným roztokom
2 - roztok KCl (nasýtený)
3 - otvor pre kontakt
4 - roztok KCl (nasýtený), AgCl (pevný)
5 - otvor na privádzanie roztoku KCl
6 - pasta zo zmesi Hg2Cl2, Hg a KS1 (nasýtená)
Potenciometrická analýza sa široko používa na priame stanovenie aktivity (koncentrácie) iónov v roztoku meraním rovnovážneho potenciálu indikačnej elektródy (EMF galvanického článku) - priama potenciometria (ionometria), ako aj na označenie koncového bodu titrácie ( ktt) zmenou potenciálu indikačnej elektródy počas titračného procesu ( potenciometrická titrácia).
Vo všetkých technikách priama potenciometria Využíva sa závislosť indikačnej elektródy od aktivity (koncentrácie) stanovovaného iónu, ktorá je opísaná Nernstovou rovnicou. Výsledky analýzy znamenajú stanovenie koncentrácie látky a nie jej aktivity, čo je možné, keď sa koeficienty aktivity iónov rovnajú jednotke (γ → 1) alebo ich konštantnej hodnote (konštantná iónová sila roztoku), preto sa v ďalších diskusiách používajú iba závislosti od koncentrácie.
Koncentráciu stanovovaného iónu možno vypočítať z experimentálne zisteného potenciálu indikačnej elektródy, ak je známa konštantná zložka elektródy (štandardný potenciál E 0) a strmosť funkcie elektródy θ . V tomto prípade sa galvanický článok skladá z indikačnej elektródy a referenčnej elektródy, meria sa jeho EMF, vypočíta sa potenciál indikačnej elektródy (vzhľadom na SHE) a koncentrácia stanovovaného iónu.
IN kalibračná tabuľka metódy pripravte sériu štandardných roztokov so známou koncentráciou stanovovaného iónu a konštantnou iónovou silou, zmerajte potenciál indikačnej elektródy vzhľadom na referenčnú elektródu (EMF galvanického článku) v týchto roztokoch a vytvorte závislosť založenú na získané údaje E÷ r S(A) (kalibračný graf). Potom zmerajte potenciál indikačnej elektródy v analyzovanom roztoku E x (za rovnakých podmienok) a p sa určí z grafu S x(A) a vypočítajte koncentráciu analytu v analyzovanom roztoku.
IN štandardná (porovnávacia) metóda zmerajte potenciál indikačnej elektródy v analyzovanom roztoku ( E x) a v štandardnom roztoku analytu ( E st). Koncentrácia stanovovaného iónu sa vypočíta na základe Nernstových rovníc pre analyzovanú vzorku a štandardnú vzorku. Sklon funkcie elektródy pre indikačnú elektródu θ
Použitím aditívna metóda najprv zmerajte potenciál indikačnej elektródy v analyzovanom roztoku ( E x), potom k nemu pridajte určitý objem štandardného roztoku analytu a zmerajte potenciál elektródy vo výslednom roztoku s prísadou ( E x+d). Koncentrácia stanovovaného iónu sa vypočíta na základe Nernstových rovníc pre analyzovanú vzorku a vzorku s prísadou. Sklon funkcie elektródy pre indikačnú elektródu θ musia byť vopred známe alebo určené z kalibračného plánu.
O potenciometrická titrácia zmerajte a zaznamenajte EMF elektrochemického článku (potenciál indikačnej elektródy) po pridaní každej dávky titrantu. Potom sa na základe získaných výsledkov zostrojia titračné krivky - integrálne v súradniciach E ÷ V(a) A diferenciál v súradniciach ∆ E/∆V ÷ V (b) a určite koncový bod titrácie ( ktt) graficky:

Potenciometrická titrácia využíva všetky hlavné typy chemických reakcií – acidobázickú, redoxnú, precipitáciu a komplexáciu. Sú na ne kladené rovnaké požiadavky ako pri vizuálnej titrimetrii, doplnené o prítomnosť vhodnej indikačnej elektródy na zaznamenávanie zmien koncentrácie iónov určujúcich potenciál počas titrácie.
Chyba stanovenia pri potenciometrickej titrácii je 0,5-1%, čo je výrazne nižšie ako pri priamych potenciometrických meraniach (2-10%), sú však pozorované vyššie detekčné limity - viac ako 10 -4 mol/l.
Coulometria
Coulometria kombinuje analytické metódy založené na meraní množstva elektriny vynaloženej na elektrochemickú reakciu. Výsledkom elektrochemickej reakcie je kvantitatívna elektrokonverzia (oxidácia alebo redukcia) analytu na pracovnej elektróde (priama coulometria) alebo produkcia medziproduktu (titrant), ktorý stechiometricky reaguje s analytom (nepriama coulometria, coulometrická titrácia).
Základom coulometrických metód je Faradayov zákon, ktorý stanovuje súvislosť medzi množstvom elektrokonvertovanej (oxidovanej alebo redukovanej) látky a množstvom spotrebovanej elektriny:

Kde m– hmotnosť elektrokonvertovanej látky, g; Q– množstvo elektriny vynaložené na elektrickú premenu látky, C; F– Faradayovo číslo, ktoré sa rovná množstvu elektriny potrebnej na elektrickú premenu jedného molárneho ekvivalentu látky, 96 500 C/mol; M– molárna hmotnosť látky, g/mol; n– počet elektrónov zúčastňujúcich sa elektrochemickej reakcie.
Nevyhnutnou podmienkou pre uskutočnenie coulometrickej analýzy je takmer úplná spotreba elektrickej energie na premenu stanovovanej látky, to znamená, že elektrochemická reakcia musí prebiehať bez vedľajších procesov so 100% prúdovou účinnosťou.
V praxi sa coulometrická analýza realizuje v dvoch verziách – pri konštantnom potenciáli ( potenciostatická coulometria) a pri konštantnom prúde ( amperostatická coulometria).
Potenciostatická coulometria používa priamy coulometrických meraní, keď sa stanovovaná látka priamo podrobuje elektrolýze. V tomto prípade potenciál pracovnej elektródy potenciostaty sa udržiava konštantná a jej hodnota sa volí na základe polarizačných kriviek v oblasti medzného prúdu stanovovanej látky. Počas procesu elektrolýzy pri konštantnom potenciáli sa prúd znižuje v súlade s poklesom koncentrácie elektroaktívnej látky podľa exponenciálneho zákona:

Kde Ι – aktuálna sila v danom okamihu t A; Ι 0 – sila prúdu v počiatočnom momente elektrolýzy, A; k– konštantná v závislosti od podmienok elektrolýzy.
Elektrolýza sa vykonáva, kým sa nedosiahne zvyškový prúd Ι , ktorého hodnota je určená požadovanou presnosťou - pre prípustnú chybu 0,1% možno elektrolýzu považovať za ukončenú pri. Ι = 0,001Ι 0 Aby sa skrátil čas elektrolýzy, mala by sa použiť elektróda s veľkým povrchom za intenzívneho miešania analyzovaného roztoku.
Celkové množstvo elektriny Q, potrebný na elektrickú transformáciu analytu, je určený rovnicou:

Množstvo elektriny možno určiť meraním plochy pod krivkou prúd-čas pomocou mechanických alebo elektronických integrátorov alebo pomocou chemických coulometrov. Coulometer je elektrolytický článok, v ktorom prebieha elektrochemická reakcia známej stechiometrie so 100% prúdovou účinnosťou. Coulometer je zapojený do série so skúmaným coulometrickým článkom, takže pri elektrolýze preteká oboma článkami rovnaké množstvo elektriny. Ak sa na konci elektrolýzy meria množstvo (hmotnosť) látky vytvorenej v coulometri, potom podľa Faradayovho zákona možno vypočítať množstvo elektriny. Najčastejšie používané sú strieborné, medené a plynové coulometre.
Amperostatická coulometria používa coulometrická titrácia pri konštantnom prúde, počas ktorého analyt reaguje s titračnou látkou, ktorá vzniká ako výsledok elektrochemickej reakcie na pracovnej elektróde, a preto tzv. elektrogenerovaný titračný prostriedok.
Pre zaistenie 100% prúdovej účinnosti je potrebný výrazný nadbytok pomocnej látky, z ktorej sa titračné činidlo generuje, čím sa eliminuje vznik konkurenčných reakcií na pracovnej elektróde. V tomto prípade sa titrant generuje v množstve ekvivalentnom analytu a množstvo elektriny vynaložené na výrobu titrantu sa môže použiť na výpočet obsahu analytu.
Množstvo elektriny Q v coulometrii pri konštantnom prúde Ι vypočítané podľa vzorca:

Kde t– čas elektrolýzy, na určenie, ktoré takmer všetky metódy stanovenia koncového bodu v titrimetrii sú vhodné (vizuálne - indikátory, prístrojové - potenciometria, ampérometria, fotometria). Pomocou prúdu v ampéroch a času elektrolýzy v sekundách získame množstvo elektriny v coulombách (príklad).
Príklad. Coulometrická titrácia roztoku kyseliny askorbovej jódom generovaného z jodidu draselného prúdom 5,00 mA trvala 8 min 40 s. Vypočítajte hmotnosť kyseliny askorbovej v analyzovanom roztoku. Navrhnite spôsob stanovenia koncového bodu titrácie.
Riešenie. Množstvo elektriny vynaloženej na oxidáciu jodidu a teda kyseliny askorbovej sa rovná:
Q = ja t= 5,00∙10-3 ∙520 = 2,60 Cl.
Kyselina askorbová sa oxiduje jódom na kyselinu dehydroaskorbovú za uvoľnenia dvoch elektrónov (C 6 H 8 O 6 - 2 e→ C 6 H 6 O 6 + 2H +), potom podľa Faradayovho zákona:

Konečný bod titrácie je určený výskytom nadbytku jódu v roztoku. Následne je možné ho detegovať vizuálne pomocou škrobu pridaného do analyzovaného roztoku (výskyt modrej farby), amperometricky pomocou kvapkajúcej ortuťovej alebo platinovej mikroelektródy objavením sa limitujúceho prúdu jódu alebo potenciometricky prudkým zvýšením potenciálu platinovú elektródu.
Voltametria
Voltametrická metóda analýzy je založený na využití fenoménu polarizácie mikroelektród, získavaní a interpretácii prúdovo-napäťových (polarizačných) kriviek odrážajúcich závislosť prúdu od priloženého napätia. Krivka prúdu a napätia (voltamogram) umožňuje súčasne získať kvalitatívne a kvantitatívne informácie o látkach, ktoré sú redukované alebo oxidované na mikroelektróde (depolarizátory), ako aj o povahe elektródového procesu. Moderná voltametria je vysoko citlivá a rýchla metóda na stanovenie látok, vhodná na analýzu rôznych predmetov anorganickej a organickej povahy, vrátane liečiv. Minimálna detekovateľná koncentrácia vo voltametrii dosahuje hodnoty 10 -8 mol/l s chybou metódy menšou ako 5%. Voltametria za optimálnych experimentálnych podmienok umožňuje v analyzovanom roztoku stanoviť niekoľko zložiek súčasne.
Vo voltametrii sa používajú dve elektródy - pracovník polarizovateľná elektróda s malým povrchom (indikačná mikroelektróda) a pomocný nepolarizovateľná elektróda s veľkým povrchom (referenčná elektróda). Pracovné elektródy sú mikroelektródy vyrobené z ortuti (ortuťová kvapkacia elektróda, RCE), platiny (PE) a vodivých uhlíkových materiálov (grafit, sklený uhlík).
Keď cez elektrolytický článok prechádza jednosmerný prúd, proces je charakterizovaný vzťahom (Ohmov zákon pre roztok elektrolytu):
E = Ea – Ek + IR
Kde E– privedené vonkajšie napätie; Ea– anódový potenciál; Ek– katódový potenciál; ja– prúd v obvode; R– vnútorný odpor elektrolytického článku.
Pri voltametrických meraniach obsahuje analyzovaný roztok indiferentný (pozaďový) elektrolyt vysokej koncentrácie (100-krát alebo viackrát vyššej ako koncentrácia analyzovanej látky - odpor roztoku je nízky) a prúd vo voltametrii nepresahuje 10-5 A, teda pokles napätia v článku IR možno zanedbať.
Keďže pri voltametrii jedna z elektród (pomocná) nie je polarizovaná a potenciál pre ňu zostáva konštantný (možno ho považovať za rovný nule), napätie aplikované na článok sa prejaví zmenou potenciálu iba pracovnej elektródy a potom E = Ea pre pracovnú mikroanódu ( anodická polarizácia) A E =-Ek pre pracovnú mikrokatódu ( katódovej polarizácie). Zaznamenaná krivka prúd-napätie teda odráža elektrochemický proces vyskytujúci sa iba na pracovnej elektróde. Ak roztok obsahuje látky, ktoré sa dajú elektrochemicky redukovať alebo oxidovať, potom keď sa na článok aplikuje lineárne sa meniace napätie, voltamogram má tvar vlny 1 (pri absencii elektrochemickej reakcie je závislosť prúdu od napätia lineárna 2 v v súlade s Ohmovým zákonom):

Nazýva sa úsek voltametrie, v ktorom je pracovnou mikroelektródou RCE polarografia, na počesť českého elektrochemika J. Heyrovského, ktorý túto metódu v roku 1922 navrhol. Voltamogramy získané v článku s kvapkajúcou ortuťovou elektródou sa nazývajú polarogramy.
Pre záznam klasických polarogramov je článok s RCE (pracovná elektróda) a nasýtenou kalomelovou elektródou (pomocná elektróda, referenčná elektróda) pripojený na zdroj konštantného napätia a potenciál sa mení rýchlosťou 2-5 mV/s.
Ortuťová kvapkacia elektróda je takmer dokonale polarizovateľná v širokom rozsahu potenciálov, obmedzených v anodickej oblasti elektródovými reakciami oxidácie ortuti (+0,4 V) a v katódovej oblasti redukciou vodíkových iónov (z -1 na - 1,5 V v závislosti od kyslosti média) alebo katiónov pozadia (od -2 V pre katióny alkalických kovov do -2,5 V pre R 4 N +). To umožňuje študovať a určovať na RCE látky, ktoré sú redukované pri veľmi vysokých negatívnych potenciáloch, čo je nemožné na elektródach vyrobených z iných materiálov. Je potrebné poznamenať, že tu a nižšie sú hodnoty potenciálu uvedené vo vzťahu k nasýtenej kalomelovej elektróde a v prípade potreby sa môžu prepočítať vzhľadom na inú referenčnú elektródu, napríklad elektródu nasýteného chloridu strieborného.
Pred zaznamenaním polarogramu na RKE je potrebné odstrániť rozpustený kyslík, pretože je elektroaktívny v oblasti záporného potenciálu, čo dáva dve vlny redukcie pri -0,2 a -0,9 V. To sa dá dosiahnuť nasýtením roztoku inertným plyn (dusík, argón, hélium). Kyslík sa odstraňuje z alkalických roztokov pomocou siričitanu sodného (O 2 + 2Na 2 SO 3 → 2Na 2 SO 4).
Klasický polarogram (polarografická vlna) v idealizovanej forme je uvedený nižšie:

Hlavnými charakteristikami polarografickej vlny sú veľkosť difúzneho prúdu ( ja d, μA), polvlnový potenciál ( E 1/2, V) – potenciál, pri ktorom sa prúd rovná polovici difúzneho prúdu a sklon stúpajúcej časti (0,059/ n– sklon funkcie elektródy). Tieto parametre umožňujú použitie polarografie ako metódy analýzy (sila prúdu je úmerná koncentrácii) a výskumu (polvlnový potenciál a funkcia elektród závisí od povahy látky).
V počiatočnom úseku polarografickej vlny (A-B) sa prúd zvyšuje veľmi pomaly so zmenou potenciálu – ide o tzv. zvyškový prúd (ja ost) . Hlavný príspevok k zvyškovému prúdu pochádza z vytvorenia dvojitej elektrickej vrstvy ( nabíjací prúd), ktoré nemožno vylúčiť a ktorých veľkosť sa zvyšuje so zvyšujúcim sa potenciálom. Druhým členom zvyškového prúdu je prúd spôsobený elektroaktívnymi nečistotami, ktorý je možné znížiť použitím čistých činidiel a vody.
Po dosiahnutí bodu B ( uvoľňovací potenciál– pri redukcii na katóde sa volá uvoľňovací potenciál potenciál zotavenia E vos, počas oxidácie na anóde – oxidačný potenciál E ok) na elektróde začína elektrochemická reakcia, do ktorej vstupuje elektroaktívna látka (depolarizátor), v dôsledku čoho sa prúd prudko zvyšuje (sekcia B-C) na určitú hraničnú hodnotu, potom zostáva takmer konštantná (sekcia B-D). Prúd zodpovedajúci tejto sekcii sa nazýva limitný prúd(ja pr) a rozdiel medzi obmedzujúcim a zvyškovým prúdom je difúzny prúd (ja d = ja atď - ja ost). V úseku V-G s rastúcim potenciálom mierne narastajú obmedzovacie a zvyškové prúdy a hodnota difúzneho prúdu zostáva konštantná. Nárast prúdu v bode G je spôsobený novou elektrochemickou reakciou (napríklad redukciou katiónov elektrolytu pozadia).
Difúzny prúd dostal svoj názov vďaka tomu, že v tejto potenciálovej oblasti v dôsledku elektrochemickej reakcie v blízkej elektródovej vrstve takmer úplne chýba depolarizátor a dochádza k jeho obohateniu látkou v dôsledku difúzie. depolarizátora z hĺbky roztoku, kde jeho koncentrácia zostáva konštantná. Pretože rýchlosť difúzie za týchto špecifických podmienok zostáva konštantná, difúzny prúd tiež zostáva konštantný vo svojej hodnote.
Závislosť veľkosti difúzneho prúdu od koncentrácie depolarizátora pre r.k.e. vyjadrené Ilkovičovou rovnicou:
I d = 605 nD 1/2 m 2/3 t 1/6 s
kde D je koeficient difúzie elektroaktívneho iónu; n – počet elektrónov zúčastňujúcich sa reakcie; m 2/3 t 1/6 – charakteristika kapiláry, z ktorej vyteká ortuť; c je koncentrácia analytu (depolarizátora).
Pri práci s tou istou kapilárou a depolarizátorom je hodnota 605nD 1/2 m 2/3 t 1/6 = konšt., preto existuje lineárny vzťah medzi výškou vlny a koncentráciou látky.
Kvantitatívna polarografická analýza je založená na tomto lineárnom vzťahu. Vzťah medzi elektródovým potenciálom a výsledným prúdom je opísaný polarografickou vlnovou rovnicou (Ilkovich-Heyrovského rovnica):

kde E a I sú potenciálna a prúdová hodnota pre daný bod polarografickej krivky; I d je veľkosť difúzneho prúdu; E 1/2 – polvlnový potenciál.
E 1/2 je potenciál, pri ktorom sa dosiahne hodnota prúdu rovnajúca sa polovici I d. Nezávisí od koncentrácie depolarizátora. E 1/2 je veľmi blízka normálnemu redoxnému potenciálu systému (Eo), to znamená, že ide o kvalitatívnu charakteristiku určenú len povahou redukčných iónov a podľa ktorej je možné určiť kvalitatívne zloženie analyzovaného roztoku.
Polarogram (voltamogram) obsahuje cenné analytické informácie - polvlnový potenciál E 1/2 je kvalitatívna charakteristika depolarizátora (kvalitatívne analytický signál), zatiaľ čo difúzny prúd ja d je lineárne úmerný koncentrácii analytu v objeme analyzovaného roztoku (kvantitatívny analytický signál) – ja d = KS.
Rozsah E 1/2 možno vypočítať z rovnice polarografickej vlny alebo určiť graficky:

Nájdená hodnota E 1/2, berúc do úvahy použitý elektrolyt pozadia, umožňuje identifikovať depolarizátor na základe tabuľkových údajov. Ak analyzovaný roztok obsahuje niekoľko látok, ktorých polvlnové potenciály sa líšia o viac ako 0,2 V, potom polarogram neukáže jednu vlnu, ale niekoľko v závislosti od počtu elektroaktívnych častíc. Treba mať na pamäti, že redukcia (oxidácia) viacnásobne nabitých častíc môže prebiehať postupne, pričom vzniká niekoľko vĺn.
Aby sa vylúčil pohyb látky k elektróde v dôsledku tepelnej a mechanickej konvekcie (miešanie), meranie sa vykonáva v termostatovanom roztoku a bez miešania. Eliminácia elektrostatickej príťažlivosti depolarizátora elektródovým poľom (migrácia) je uľahčená veľkým prebytkom elektroneaktívneho elektrolytu pozadia, ktorého ióny clonia elektródový náboj, čím sa hnacia sila migrácie znižuje takmer na nulu.
Pri použití ortuťovej kvapkajúcej elektródy ukazuje polarogram prúdové oscilácie(jeho periodický mierny nárast a pokles). Každá takáto oscilácia zodpovedá vzniku, rastu a oddeleniu ortuťovej kvapky z mikroelektródovej kapiláry. Polarografy sú vybavené zariadeniami na elimináciu kmitov.
Polarogramy môžu byť skreslené v dôsledku polarografické maximá– prudký nárast prúdu nad jeho limitnú hodnotu, po ktorom nasleduje pokles:

Vzhľad maxima je spôsobený miešaním roztoku v dôsledku pohybu povrchu kvapky ortuti v dôsledku nerovnomerného rozloženia náboja, a teda aj povrchového napätia (maxima prvého druhu). ako vznik vírov, keď ortuť vyteká z kapiláry (maxima druhého druhu). Maxima deformujú polarogram a sťažujú jeho rozlúštenie. Na odstránenie maxima typu I sa zavádza povrchovo aktívna látka (napríklad agar-agar, želatína, gáfor, fuchsín, syntetické povrchovo aktívne látky), ktorá po adsorbovaní na povrchu ortuťovej kvapky vyrovnáva povrchové napätie a eliminuje pohyb povrchových vrstiev. ortuti. Na odstránenie maxím typu II stačí znížiť tlak ortuti v kapiláre znížením výšky ortuťového stĺpca.
Voltametria s pevnými pracovnými elektródami sa líši od polarografie s použitím RCE v inom rozsahu polarizácie mikroelektródy. Ako je uvedené vyššie, ortuťovú kvapkajúcu elektródu je možné v dôsledku vysokého vodíkového prepätia použiť v oblasti vysokých záporných potenciálov, ale vzhľadom na anodické rozpúšťanie ortuti pri +0,4 V ju nemožno použiť na výskum v oblasti pozitívnych potenciálov. Na grafite a platine dochádza k vybíjaniu vodíkových iónov oveľa ľahšie, takže oblasť ich polarizácie je obmedzená na výrazne nižšie záporné potenciály (-0,4 a -0,1 V). Zároveň v oblasti anodických potenciálov sú vhodné platinové a grafitové elektródy do potenciálu +1,4 V (vtedy začína elektrochemická reakcia oxidácie vodného kyslíka 2H 2 O - 4 e→ O 2 + 4H +), čo ich robí vhodnými na výskum v rozsahu pozitívnych potenciálov.
Na rozdiel od RCE sa počas zaznamenávania voltamogramu povrch pevnej mikroelektródy neobnovuje a je ľahko kontaminovaný produktmi elektródovej reakcie, čo vedie k zníženiu reprodukovateľnosti a presnosti výsledkov, preto pred záznamom každého voltamogramu , povrch mikroelektródy by sa mal vyčistiť.
Stacionárne pevné elektródy nenašli široké uplatnenie vo voltampérometrii kvôli pomalému zavedeniu obmedzujúceho prúdu, čo vedie k skresleniu tvaru voltamogramu; rotujúce mikroelektródy vo vrstve blízkej elektróde vznikajú podmienky pre stacionárnu difúziu, takže sila prúdu sa rýchlo vytvorí a voltamogram má rovnaký tvar ako v prípade RCE.
Veľkosť limitného difúzneho prúdu na rotujúcej kotúčovej elektróde (bez ohľadu na materiál) je opísaná rovnicou konvekčnej difúzie (Levich):
I d = 0,62 nFSD 2/3 w 1/2 n -1/6 s
kde n je počet elektrónov zúčastňujúcich sa na elektródovom procese;
F – Faradayovo číslo (96500 coulombov);
S - oblasť elektród;
D – koeficient difúzie depolarizátora;
w je uhlová rýchlosť otáčania elektródy;
n je kinematická viskozita skúmaného roztoku;
c je koncentrácia depolarizátora, mol/l.
Ak sa vyskytnú ťažkosti s dešifrovaním polarogramov, použije sa metóda „svedka“ - po zaznamenaní polarogramu analyzovaného roztoku sa do elektrolytického článku jeden po druhom pridávajú štandardné roztoky očakávaných zlúčenín. Ak bol predpoklad správny, výška vlny zodpovedajúcej látky sa zvyšuje, ak je predpoklad nesprávny, objaví sa ďalšia vlna s iným potenciálom.
Koncentráciu depolarizátora v analyzovanom roztoku je možné určiť pomocou metódy kalibračného grafu, štandardnej (porovnávacej) metódy a aditívnej metódy. Vo všetkých prípadoch by sa mali použiť štandardné roztoky, ktorých zloženie je čo najbližšie k zloženiu analyzovaného roztoku a podmienky na zaznamenávanie polarogramov by mali byť rovnaké. Metódy sú použiteľné v koncentračnom rozsahu, kde sa prísne dodržiava priamo úmerná závislosť difúzneho prúdu od koncentrácie depolarizátora. V praxi sa pri kvantitatívnych určovaniach spravidla nezaznamenáva hodnota difúzneho prúdu v μA, ale meria sa výška polarografickej vlny. h, ako je uvedené na predchádzajúcom obrázku, čo je tiež lineárna funkcia koncentrácie h = KC.
Autor: metóda kalibračnej krivky zaznamenajte polarogramy série štandardných roztokov a vytvorte kalibračný graf v súradniciach h ÷ C(alebo ja d ÷ S), podľa ktorého za zistenú hodnotu h x v analyzovanom roztoku nájdite koncentráciu analytu v ňom S X.
IN štandardná (porovnávacia) metóda za rovnakých podmienok zaznamenajte polarogramy analyzovaných a štandardných roztokov analytu s koncentráciami S x a S st, potom:

Použitím aditívna metóda Najprv zaznamenajte polarogram analyzovaného roztoku s objemom V x so sústredením S x a zmerajte výšku vlny h X. Potom sa do elektrolytickej cely k analyzovanému roztoku pridá určitý objem štandardného roztoku analytu. V d s koncentráciou S d (najlepšie V x>> V d a S X<S d), zaznamenajte polarogram roztoku s koncentráciou S x+d a zmerajte výšku prijatej vlny h x+d. Jednoduché transformácie umožňujú použiť tieto údaje na výpočet koncentrácie analytu v analyzovanom roztoku (príklad).
Príklad. Pri polarografii 10,0 ml roztoku nikotínamidu sa získala výška vlny 38 mm. Po pridaní 1,50 ml štandardného roztoku obsahujúceho 2,00 mg/ml nikotínamidu k tomuto roztoku sa vlnová dĺžka zvýšila na 80,5 mm. Vypočítajte obsah liečiva (mg/ml) v analyzovanom roztoku.
Riešenie. Výška vlny nikotínamidu v analyzovanom roztoku h x podľa Ilkovičovej rovnice sa rovná:

a po pridaní štandardného roztoku ( h x+d):

Ak vydelíme prvú rovnicu člen po člen druhým, dostaneme:

Riešenie rovnice pre S x a dosadením hodnôt veličín z problémových podmienok.
Popis práce
Moderné odvetvia výroby a spoločenského života ľudí kladú svoje špecifické úlohy fyzikálnym a chemickým metódam analýzy na kontrolu kvality výrobkov. Jednou z hlavných fyzikálno-chemických metód analýzy sú elektrochemické metódy analýzy.
Tieto metódy dokážu rýchlo a pomerne presne určiť mnohé ukazovatele kvality produktu.
Elektrochemické metódy na analýzu zloženia hmoty sú široko používané v rôznych priemyselných odvetviach. Umožňujú vám automatizovať príjem výsledkov o kvalite produktov a napraviť porušenia bez zastavenia výroby. V potravinárskom priemysle tieto metódy určujú acidobázickú rovnováhu produktu, prítomnosť škodlivých a toxických látok a ďalšie ukazovatele, ktoré ovplyvňujú nielen kvalitu, ale aj bezpečnosť potravín.
Zariadenia určené na elektrochemickú analýzu sú relatívne lacné, dostupné a ľahko sa používajú. Preto sú tieto metódy široko používané nielen v špecializovaných laboratóriách, ale aj v mnohých priemyselných odvetviach.
V tomto smere je cieľom tohto ku
ÚVOD 2
TEORETICKÁ ČASŤ 3
1.1 Všeobecné charakteristiky fyzikálno-chemických metód analýzy 3
1.2 Charakteristika elektrochemických metód 4
1.3 Klasifikácia elektrochemických metód analýzy 5
2 EXPERIMENTÁLNO-PRAKTICKÁ ČASŤ 15
ZÁVER 21
REFERENCIE 22
Elektrochemické metódy na meranie koncentrácie využívajú elektrochemický článok. Najjednoduchší článok pozostáva z dvojice elektród ponorených do roztoku elektrolytu. Roztok elektrolytu je umiestnený v jednej alebo dvoch nádobách, ktoré sú navzájom spojené mostíkom s elektrolytom (prenosový článok). Elektródy môžu byť navzájom spojené priamo vodičom (vnútorná elektrolýza) alebo vodičmi cez zdroj energie (vonkajšia elektrolýza).
Mechanizmus prenosu elektriny v rôznych častiach elektrického obvodu je odlišný. Elektrický náboj sa prenáša cez vodiče elektrónmi a v roztoku iónmi. Na fázovom rozhraní dochádza k zmene mechanizmu vodivosti v dôsledku výskytu heterogénnej redoxnej reakcie. Nazýva sa to elektrochemická alebo elektródová reakcia, to znamená reakcia spojená s výmenou nábojov medzi chemickými zlúčeninami umiestnenými v rôznych fázach - tuhá látka (povrch elektródy) a kvapalina (roztok elektrolytu).
V roztoku sú chemické zlúčeniny, ktoré ľahko darujú elektróny elektróde vyrobenej z určitého materiálu, ako je platina alebo grafit, to znamená, že na nej oxidujú. Takáto elektróda sa nazýva anóda. Na povrchu anódy sa vytvára oxidačné činidlo, ktoré na nej môže zostať (adsorbovať), rozpúšťať sa v materiáli anódy (ortuťová anóda) alebo difundovať do roztoku elektrolytu vplyvom difúznych síl (koncentračný gradient).
Napríklad v roztoku CuCl2
2Cl--2 e=Cl2
(Červená 1 - nie= vôl 1)
Roztok Pt elektródy
Cl - → ←Cl 2
Plynný Cl2 vytvorený na povrchu platinovej elektródy bude difundovať do roztoku elektrolytu.
V roztoku sú aj chemické zlúčeniny, ktoré ľahko prijímajú elektróny z elektródy, t.j. sú na ňom obnovené. Takáto elektróda sa nazýva katóda. Na povrchu katódy sa vytvára redukčné činidlo, ktoré na nej môže zostať (adsorbovať), rozpúšťať sa v materiáli anódy (ortuťová katóda) alebo difundovať do roztoku elektrolytu vplyvom difúznych síl.
Napríklad v roztoku CuCl2
Cu2+- + 2e = Cu 0
(Ox 2 + ne = Červená 2)
Roztok Hg elektródy
Cu 2+ → Cu 0 → Cu 0 (Hg)
Atómy medi vytvorené na povrchu ortuťovej elektródy budú difundovať hlboko do ortuti, pričom sa v nej rozpustia za vzniku amalgámu.
Na anóde aj na katóde vznikajú nové chemické zlúčeniny, ktoré predtým v roztoku neboli. Ak dôjde k prenosu náboja z jednej fázy do druhej, potom sa na rozhraní vytvorí elektrický potenciál (energia).
Ak sú elektródy spojené vodičom, tak pri dostatočnom potenciálovom rozdiele medzi elektródami sa prekoná odpor roztoku voči pohybu nábojov a roztokom bude pretekať elektrický prúd (pohyb náboja). Tento prúd je možné merať.
Elektrochemické metódy chemickej analýzy sú založené na využití javov a procesov vyskytujúcich sa na povrchu elektródy, vo vrstve blízkej elektróde alebo v roztoku elektrolytu, spojených s chemickou povahou a obsahom zložiek v roztoku.
Merajú sa elektrické vlastnosti systému elektróda-elektrolyt (potenciál elektródy, elektrický prúd, množstvo elektriny, elektrická vodivosť atď.) Všetky uvažované elektrické veličiny závisia od koncentrácie akýchkoľvek zložiek roztoku elektrolytu. V dôsledku toho môže ktorýkoľvek z nich - elektrická vodivosť elektrolytu, potenciál elektródy, sila elektrického prúdu, kapacita dvojitej elektrickej vrstvy a iné, slúžiť ako analytický signál, ak je funkčne spojený s koncentráciou. zložky, ktorá sa analyzuje v analyzovanom roztoku, a môže sa merať. Namerané hodnoty elektrických vlastností sa používajú na kvantitatívnu a niekedy aj kvalitatívnu chemickú analýzu zloženia látky.
Existujú rôzne klasifikácie elektrochemických metód na stanovenie koncentrácie zložky. Napríklad metódy možno klasifikovať nasledovne.
1. Metódy založené na výskyte elektródovej reakcie.
1.1. Metódy založené na prechode elektrického prúdu cez elektrochemický článok:
-- voltampérometria– metóda, na základe merania sily difúzneho prúdu elektrooxidácie alebo elektroredukcie súčiastky sa určuje pri určitej hodnote potenciálu indikačnej elektródy;
-- coulometria– metóda, založené na meraní množstva elektriny (Faradayov zákon) vynaloženej na elektrochemickú reakciu určovanej zložky;
-- elektrogravimetria– metóda, založené na meraní hmotnosti určovanej zložky uvoľnenej na elektróde pri prechode elektrického prúdu cez roztok elektrolytu (Faradayov zákon);
1.2. Metódy založené na meraní potenciálneho rozdielu medzi párom elektród, keď v roztoku tečú zanedbateľné prúdy:
-- potenciometria– metóda, založené na meraní potenciálneho rozdielu medzi indikačnou elektródou a referenčnou elektródou;
2. Metódy nesúvisiace s elektródovou reakciou:
-- konduktometria– metóda, založené na meraní mernej elektrickej vodivosti roztoku, ktorá závisí od povahy a koncentrácie zložiek v ňom rozpustených.
Koncentrácia stanovovanej zložky vo vzorke látky predmetu chemickej analýzy sa zisťuje, ako pri každej inej fyzikálnej metóde chemickej analýzy, z kalibračného grafu.
Pozornosť. Prostriedky na meranie elektrických vlastností látok sa používajú aj v chemických metódach kvantitatívnej chemickej analýzy, ako je titrimetria, aby sa zaznamenal ekvivalentný objem titrantu počas chemickej reakcie. Ide o takzvanú inštrumentálnu (bez indikátora) metódu stanovenia bodu ekvivalencie. Pomocou prostriedkov na meranie elektrických vlastností látok sa meria zodpovedajúca elektrická vlastnosť stanovovanej zložky, ktorá sa mení s pridaním každej časti titrantu. V bode ekvivalencie sa intenzita meranej vlastnosti prudko mení a tento moment je možné zaznamenať zostrojením a grafickým spracovaním titračnej krivky vynesenej v súradniciach “ nameraná hodnota elektrickej vlastnosti – pridaný objem titrantu“. Koncentrácia stanovovanej zložky sa zistí zo zákona ekvivalentov. To rozširuje možnosti titrimetrických metód pri analýze farebných, zakalených roztokov, agresívnych médií atď., kde nie je možné použiť farebné indikátory na stanovenie bodu ekvivalencie. Titračné metódy sa v tomto prípade nazývajú: potenciometrická titračná metóda, konduktometrická titračná metóda, amperometrická titračná metóda atď. Podľa metódy porovnávania so štandardom patria tieto metódy medzi chemické metódy kvantitatívnej chemickej analýzy.
Charakteristickými výhodami elektrochemických metód chemickej analýzy sú nízka medza stanovenia, rýchla analýza, jednoduchosť merania meracími prístrojmi, možnosť automatizácie a kontinuita chemickej analýzy. Procesy vyskytujúce sa v elektrochemických článkoch sú však pomerne ťažké pochopiť a interpretovať získané výsledky z dôvodu ich nejednoznačnosti, preto je pomocou týchto metód takmer nemožné vykonať kvalitatívnu analýzu vzorky látky, čo obmedzuje možnosti elektrochemických metód. na chemickú analýzu látok.
Nevýhodou elektrochemických metód analýzy v porovnaní s chemickými metódami kvantitatívnej analýzy je ich relatívne nízka presnosť (chyba analýzy ~ 10%), avšak niektoré metódy (coulometria, elektrogravimetria) sú vysoko presné (chyba analýzy ~ 0,01%).
Elektrochemické metódy analýzy sú súborom metód kvalitatívnej a kvantitatívnej analýzy založených na elektrochemických javoch vyskytujúcich sa v skúmanom médiu alebo na rozhraní a spojených so zmenami v štruktúre, chemickom zložení alebo koncentrácii analytu.
Elektrochemické metódy analýzy (ECMA) sú založené na procesoch prebiehajúcich na elektródach alebo v medzielektródovom priestore. Ich výhodou je vysoká presnosť a porovnateľná jednoduchosť zariadení aj metód analýzy. Vysoká presnosť je určená veľmi presnými vzormi používanými v ECMA. Veľkou vymoženosťou je, že táto metóda využíva elektrické vplyvy a skutočnosť, že výsledok tohto vplyvu (odozva) sa získava aj vo forme elektrického signálu. To zaisťuje vysokú rýchlosť a presnosť čítania a otvára široké možnosti pre automatizáciu. ECMA sa vyznačujú dobrou citlivosťou a selektivitou, v niektorých prípadoch ich možno klasifikovať ako mikroanalýzu, pretože niekedy na analýzu stačí menej ako 1 ml roztoku.
Podľa typov analytických signálov sa delia na:
1) konduktometria - meranie elektrickej vodivosti testovaného roztoku;
2) potenciometria - meranie bezprúdového rovnovážneho potenciálu indikačnej elektródy, pre ktorý je testovaná látka potenciodeterminujúca;
3) coulometria – meranie množstva elektriny potrebnej na úplnú transformáciu (oxidáciu alebo redukciu) skúmanej látky;
4) voltampérometria – meranie stacionárnych alebo nestacionárnych polarizačných charakteristík elektród pri reakciách s testovanou látkou;
5) elektrogravimetria - meranie hmotnosti látky uvoľnenej z roztoku počas elektrolýzy.
27. Potenciometrická metóda.
potenciometria - meranie bezprúdového rovnovážneho potenciálu indikačnej elektródy, pre ktorý je testovaná látka potenciačne určujúca.
A) štandardná (referenčná elektróda) - má konštantný potenciál, nezávislý od vonkajších vplyvov. Podmienky
B) jednotlivá elektróda - jej potenciál závisí od koncentrácie látky.
Potenciál závisí od koncentrácie: E = f(c)
Neristova rovnica E= E° + lna kat
E° - štandardný. Electron. Potenciál (konšt)
R- Univerzum. Plynová konštantakonšt)
T – absolútna teplota (t)- +273 °
.п – počet zúčastnených elektrónov. Pri oxidácii/redukcii Reakcie
. a – aktívna koncentrácia
Potenciometrická metóda
Ionometrická potenciometria (do výskumného roztoku sa pridáva malý roztok. Po častiach sa pridáva štandardný roztok (titran), po každom pridaní sa meria potenciál. - E)
Bod ekvivalencie
EСх Vх = l t *Vt
28. Konduktometrická metóda.
konduktometria - meranie elektrickej vodivosti skúšobného roztoku.
Konduktometrická titrácia
Konduktometer (prístroj)
Konduktometrická analýza (konduktometria) je založená na využití vzťahu medzi elektrickou vodivosťou (elektrickou vodivosťou) roztokov elektrolytov a ich koncentráciou.
Elektrická vodivosť roztokov elektrolytov - vodičov druhého typu - sa posudzuje na základe merania ich elektrického odporu v elektrochemickom článku, čo je sklenená nádoba (sklo) s dvoma prispájkovanými elektródami, medzi ktorými sa nachádza skúšobný roztok elektrolytu. Nachádza. Cez článok prechádza striedavý elektrický prúd. Elektródy sa najčastejšie vyrábajú z kovovej platiny, ktorá sa pre zväčšenie povrchu elektród potiahne vrstvou hubovitej platiny elektrochemickým nanášaním zlúčenín platiny z roztokov (platinované platinové elektródy).
29.Polarografia.
Polarografia je metóda kvalitatívnej a kvantitatívnej chemickej analýzy založená na získavaní kriviek prúdu verzus napätie v obvode pozostávajúcom zo skúmaného roztoku a elektród v ňom ponorených, z ktorých jedna je vysoko polarizovateľná a druhá prakticky nepolarizovateľná. Takéto krivky - polarogramy - sa získajú pomocou polarografov.
Polarografická metóda sa vyznačuje vysokou citlivosťou. Na vykonanie analýzy zvyčajne postačuje 3 – 5 ml testovacieho roztoku. Analýza pomocou polarografu s automatickým záznamom trvá len asi 10 minút. Polarografia slúži na zisťovanie obsahu toxických látok v predmetoch biologického pôvodu (napríklad zlúčeniny ortuti, olova, tália a pod.), na zisťovanie stupňa nasýtenia krvi kyslíkom, na štúdium zloženia vydychovaného vzduchu, na zisťovanie obsahu toxických látok v predmetoch biologického pôvodu (napr. a škodlivých látok v ovzduší priemyselných podnikov.Polarografická metóda analýzy je vysoko citlivá a umožňuje stanoviť látky vo veľmi nízkych (do 0,0001%) koncentráciách v roztoku.
30. Klasifikácia metód spektrálnej analýzy. Koncept spektra.
Spektrálna analýza je súbor metód na určenie kvality a kvantity. Zloženie, ako aj štruktúra hmoty (na základe interakcie skúmaného objektu s rôznymi druhmi žiarenia.)
Všetky spektroskopické metódy sú založené na interakcii atómov, molekúl alebo iónov, ktoré tvoria analyzovanú látku, s elektromagnetickým žiarením. Táto interakcia sa prejavuje absorpciou alebo emisiou fotónov (kvant). V závislosti od povahy interakcie vzorky s elektromagnetickým žiarením sa rozlišujú dve skupiny metód:
Emisie a absorpcia. V závislosti od toho, ktoré častice tvoria analytický signál, sa rozlišuje medzi metódami atómovej spektroskopie a metódami molekulovej spektroskopie.
Emisie
Pri emisných metódach analyzovaná vzorka emituje fotóny ako výsledok svojej excitácie.
absorpcie
Pri absorpčných metódach žiarenie z externého zdroja prechádza cez vzorku a niektoré kvantá sú selektívne absorbované atómami alebo molekulami.
Rozsah- rozdelenie hodnôt fyzikálnej veličiny (zvyčajne energie, frekvencie alebo hmotnosti). Grafické znázornenie takéhoto rozdelenia sa nazýva spektrálny diagram. Spektrum sa zvyčajne vzťahuje na elektromagnetické spektrum - spektrum frekvencií (alebo to isté ako kvantové energie) elektromagnetického žiarenia.
1.odraz svetla
2. rotácia svetelného lúča (defrakcia)
3.rozptyl svetla: nefelometria, turbidimetria
4.absorpcia svetla
5reemisia
A) fosforescencia (trvá dlho)
B) fluorescencia (veľmi krátka)
Podľa charakteru rozloženia hodnôt fyzikálnych veličín môžu byť spektrá diskrétne (čiarové), spojité (plné) a predstavujú aj kombináciu (superpozíciu) diskrétnych a spojitých spektier.
Príklady čiarových spektier zahŕňajú hmotnostné spektrá a spektrá viazaných elektrónových prechodov atómu; príklady spojitých spektier sú spektrum elektromagnetického žiarenia zahriatej pevnej látky a spektrum voľných voľných elektrónových prechodov atómu; príkladmi kombinovaných spektier sú emisné spektrá hviezd, kde chromosférické absorpčné čiary alebo väčšina zvukových spektier sú superponované na spojité spektrum fotosféry.
31. Fotometria: princíp metódy, uplatnenie vo forenznom výskume.
Fotometria - spektrálna metóda založená na absorpcii elektromagnetického žiarenia vo viditeľnom a blízkom ultrafialovom pásme (metóda je založená na absorpcii svetla)
Molekulárna atómová
Spektroskopická spektroskopia (v elektrónovej analýze)
Kyveta - cez ňu prechádza svetlo
l
I (výstupná intenzita svetla)
I° je intenzita dopadajúceho svetla.
Fotometria je sekcia fyzikálnej optiky a meracej techniky venovaná metódam štúdia energetických charakteristík optického žiarenia v procese jeho emisie, šírenia sa v rôznych prostrediach a interakcie s telesami. Fotometria sa vykonáva v rozsahu infračerveného (vlnové dĺžky - 10 -3 ... 7 10 -7 m), viditeľného (7 10 -7 ... 4 10 -7 m) a ultrafialového (4 10 -7 ... 10 -8 m) optického žiarenia. Pri šírení elektromagnetického žiarenia optického rozsahu v biologickom prostredí sa pozoruje celý rad hlavných efektov: absorpcia a rozptyl žiarenia atómami a molekulami prostredia, rozptyl nehomogenít prostredia časticami, depolarizácia žiarenia. Zaznamenaním údajov o interakcii optického žiarenia s médiom je možné určiť kvantitatívne parametre spojené s medicínskymi a biologickými charakteristikami skúmaného objektu. Na meranie fotometrických veličín sa používajú prístroje nazývané fotometre. Z fotometrického hľadiska je svetlo žiarenie schopné vyvolať pocit jasu, keď je vystavené ľudskému oku. Základom fotometrie ako vedy je teória svetelného poľa, ktorú vypracoval A. Gershun.
Existujú dve všeobecné metódy fotometrie: 1) vizuálna fotometria, ktorá využíva schopnosť ľudského oka vnímať rozdiely v jase vyrovnávaním jasu dvoch porovnávacích polí mechanickými alebo optickými prostriedkami; 2) fyzikálna fotometria, pri ktorej sa na porovnanie dvoch svetelných zdrojov používajú rôzne svetelné prijímače rôzneho druhu – vákuové fotobunky, polovodičové fotodiódy atď.
32. Bouguer-Lambert-Beerov zákon, jeho využitie v kvantitatívnej analýze.
Fyzikálny zákon, ktorý určuje zoslabenie paralelného monochromatického lúča svetla pri jeho šírení v absorbujúcom prostredí.
Zákon je vyjadrený nasledujúcim vzorcom:
![]() ,
,

kde je intenzita prichádzajúceho lúča, je hrúbka vrstvy látky, cez ktorú svetlo prechádza, je index absorpcie (nezamieňať s bezrozmerným indexom absorpcie, ktorý súvisí so vzorcom, kde je vlnová dĺžka) .
Index absorpcie charakterizuje vlastnosti látky a závisí od vlnovej dĺžky λ absorbovaného svetla. Táto závislosť sa nazýva absorpčné spektrum látky.
Pre roztoky absorbujúcich látok v rozpúšťadlách, ktoré neabsorbujú svetlo, možno index absorpcie zapísať ako
kde je koeficient charakterizujúci interakciu molekuly absorbujúcej látky so svetlom s vlnovou dĺžkou λ, je koncentrácia rozpustenej látky, mol/l.
Výrok, od ktorého nezávisí, sa nazýva Beerov zákon (nemýliť si s Beerovým zákonom). Tento zákon predpokladá, že schopnosť molekuly absorbovať svetlo nie je ovplyvnená inými okolitými molekulami tej istej látky v roztoku. Pozorujú sa však početné odchýlky od tohto zákona, najmä vo všeobecnosti.
Ak svetelný tok intenzity I prechádza určitou vrstvou roztoku alebo plynu hrúbky I, potom podľa Lambert-Beerovho zákona bude množstvo absorbovaného svetla úmerné intenzite /, koncentrácii c látky absorbujúcej svetlo a hrúbka VRSTVY) zákon BMB, ktorý dáva do súvisu intenzitu svetla dopadajúceho na látku a látku, ktorá cez ňu prešla, s koncentráciou látky a hrúbkou absorbujúcej vrstvy. to isté ako refrakcia, len útlm v látke. Ktorý absorbuje svetlo v určitom percente. To znamená, že zvyšok svetelného výkonu je
33.IR spektroskopia.
Táto analytická metóda je založená na zaznamenávaní infračerveného absorpčného spektra látky. Absorpcia hmotou v infračervenej oblasti nastáva v dôsledku vibrácií atómov v molekulách. Vibrácie sa delia na naťahovacie (keď sa pri vibrácii menia vzdialenosti medzi atómami) a vibračné (keď sa pri vibrácii menia uhly medzi väzbami). Prechody medzi rôznymi vibračnými stavmi v molekulách sú kvantované, vďaka čomu má absorpcia v IR oblasti formu spektra, kde každá vibrácia má svoju vlnovú dĺžku. Je jasné, že vlnová dĺžka každej vibrácie závisí od toho, ktoré atómy sa jej zúčastňujú, a navyše málo závisí od ich prostredia.
Metóda IR spektroskopie nie je separačná metóda, to znamená, že pri štúdiu akejkoľvek látky sa môže ukázať, že to, čo sa skutočne skúmalo, bola zmes viacerých látok, čo samozrejme značne skreslí výsledky dešifrovania spektra. Nie je úplne správne hovoriť o jednoznačnej identifikácii látky pomocou metódy IR spektroskopie, pretože metóda skôr umožňuje identifikovať určité funkčné skupiny, než ich množstvo v zlúčenine a spôsob ich vzájomnej komunikácie.
Metóda IR spektroskopie sa používa na výskum polymérnych materiálov, vlákien, náterov a omamných látok (pri identifikácii plniva sa často používajú sacharidy vrátane polysacharidov). Metóda je obzvlášť nepostrádateľná pri štúdiu mazív, pretože umožňuje súčasne určiť povahu mazacieho základu a prípadných prísad (aditív) do tohto základu.
34. Röntgenová fluorescenčná analýza.
(XRF) je jednou z moderných spektroskopických metód na štúdium látky s cieľom získať jej elementárne zloženie, teda jej elementárnu analýzu. Môže sa použiť na analýzu rôznych prvkov od berýlia (Be) po urán (U). Metóda XRF je založená na zbere a následnej analýze spektra získaného vystavením študovaného materiálu röntgenovému žiareniu. Pri ožiarení atóm prechádza do excitovaného stavu, ktorý spočíva v prechode elektrónov na vyššie energetické hladiny. Atóm zostáva v excitovanom stave extrémne krátky čas, rádovo jednu mikrosekundu, po ktorej sa vráti do pokojnej polohy (základný stav). V tomto prípade elektróny z vonkajších obalov buď zaplnia vzniknuté voľné miesta a prebytočná energia sa vyžaruje vo forme fotónu, alebo sa energia prenesie na iný elektrón z vonkajších obalov (Augerov elektrón).
Ekológia a ochrana životného prostredia: stanovenie ťažkých kovov v pôdach, sedimentoch, vode, aerosóloch a pod.
Geológia a mineralógia: kvalitatívny a kvantitatívny rozbor pôd, minerálov, hornín a pod.
Hutnícky a chemický priemysel: kontrola kvality surovín, výrobného procesu a hotových výrobkov
Priemysel farieb a lakov: analýza olovených farieb
35. Atómová emisná spektroskopia.
Atómová emisná spektrálna analýza je súbor metód elementárnej analýzy založený na štúdiu emisných spektier voľných atómov a iónov v plynnej fáze. Typicky sa emisné spektrá zaznamenávajú v najvhodnejšom rozsahu optických vlnových dĺžok od 200 do 1000 nm.
AES (atómová emisná spektrometria) je metóda stanovenia elementárneho zloženia látky z optických emisných spektier atómov a iónov analyzovanej vzorky, excitovaných vo svetelných zdrojoch. Ako zdroje svetla na analýzu atómovej emisie sa používa plameň horáka alebo rôzne druhy plazmy, vrátane elektrickej iskrovej alebo oblúkovej plazmy, laserovej iskrovej plazmy, indukčne viazanej plazmy, žeravého výboja atď. AES je najbežnejšia expresná, vysoko citlivá metóda pre identifikácia a kvantifikácia prvkov nečistôt v plynných, kvapalných a pevných látkach, vrátane vysoko čistých.
Oblasti použitia:
Metalurgia: analýza zloženia kovov a zliatin,
Ťažobný priemysel: štúdium geologických vzoriek a nerastných surovín,
Ekológia: analýza vody a pôdy,
Vybavenie: analýza motorových olejov a iných technických kvapalín na kovové nečistoty,
Biologický a lekársky výskum.
Princíp fungovania.
Princíp činnosti atómového emisného spektrometra je pomerne jednoduchý. Vychádza z toho, že atómy každého prvku môžu vyžarovať svetlo určitých vlnových dĺžok – spektrálnych čiar, pričom tieto vlnové dĺžky sú pre rôzne prvky rôzne. Aby atómy začali vyžarovať svetlo, musia byť excitované – teplom, elektrickým výbojom, laserom alebo nejakým iným spôsobom. Čím viac atómov daného prvku je prítomných v analyzovanej vzorke, tým jasnejšie bude žiarenie zodpovedajúcej vlnovej dĺžky.
Intenzita spektrálnej čiary analyzovaného prvku, okrem koncentrácie analyzovaného prvku, závisí od veľkého množstva rôznych faktorov. Z tohto dôvodu nie je možné teoreticky vypočítať vzťah medzi intenzitou čiary a koncentráciou zodpovedajúceho prvku. Preto sú na analýzu potrebné štandardné vzorky, ktoré majú podobné zloženie ako analyzovaná vzorka. Tieto štandardné vzorky sú najskôr vystavené (spálené) na zariadení. Na základe výsledkov týchto prepalov je pre každý analyzovaný prvok zostavený kalibračný graf, t.j. závislosť intenzity spektrálnej čiary prvku od jeho koncentrácie. Následne pri analýze vzoriek sa tieto kalibračné grafy použijú na prepočet nameraných intenzít na koncentrácie.
Príprava vzoriek na analýzu.
Treba mať na pamäti, že v skutočnosti sa analyzuje niekoľko miligramov vzorky z jej povrchu. Preto na získanie správnych výsledkov musí byť vzorka homogénna v zložení a štruktúre a zloženie vzorky musí byť identické so zložením analyzovaného kovu. Pri analýze kovu v zlievarni alebo tavení sa odporúča použiť špeciálne formy na odlievanie vzoriek. V tomto prípade môže byť tvar vzorky ľubovoľný. Je len potrebné, aby mala analyzovaná vzorka dostatočnú plochu a mohla byť upnutá v stojane. Na analýzu malých vzoriek, ako sú tyče alebo drôty, je možné použiť špeciálne adaptéry.
Výhody metódy:
bezkontaktne,
Možnosť súčasného kvantitatívneho stanovenia veľkého počtu prvkov,
Vysoká presnosť,
Nízke limity detekcie,
jednoduchosť prípravy vzorky,
Nízke náklady.
36. Atómová absorpčná spektroskopia.
metóda kvantitatívneho stanovenia elementárneho zloženia skúmanej látky pomocou atómových absorpčných spektier, založená na schopnosti atómov selektívne absorbovať elektromagnetické žiarenie v rozklade. časti spektra. A.-a.a. vykonávané na špeciálnych prístroje - absorpcia spektrofotometre. Vzorka analyzovaného materiálu sa rozpustí (zvyčajne s tvorbou solí); roztok vo forme aerosólu sa privádza do plameňa horáka. Pod vplyvom plameňa (3000°C) sa molekuly soli disociujú na atómy, ktoré môžu absorbovať svetlo. Potom cez plameň horáka prechádza lúč svetla, v spektre ktorého sú spektrálne čiary zodpovedajúce jednému alebo druhému prvku. Sledované spektrálne čiary sú izolované z celkového žiarenia pomocou monochromátora a ich intenzita je zaznamenávaná záznamovou jednotkou. Matematika. spracovanie sa vykonáva podľa vzorca: J = J0 * e-kvI,
kde J a J0 sú intenzity prechádzajúceho a dopadajúceho svetla; kv – koeficient absorpcia v závislosti od jej frekvencie; I - hrúbka absorbujúcej vrstvy
citlivejšie ako jadrové elektrárne
37. Nefelometria a turbidimetrie.
S = log (I°/I) intenzita klesá. V roztoku (I°) vydeľte intenzitou odchádzajúceho roztoku (I) =
k-konštantný zákal
b – dĺžka dráhy svetelného lúča
N je počet častíc na jednotku. Riešenie
Nefelometrická a turbidimetrická analýza využíva fenomén rozptylu svetla pevnými časticami suspendovanými v roztoku.
Nefelometria je metóda na stanovenie disperzie a koncentrácie koloidných systémov podľa intenzity svetla, ktoré rozptýli. Nefelometria, merania sa robia v špeciálnom prístroji, nefelometri, ktorého činnosť je založená na porovnávaní intenzity svetla rozptýleného skúmaným médiom s intenzitou svetla rozptýleného iným médiom, ktoré slúži ako štandard. Teóriu rozptylu svetla koloidnými systémami, v ktorých veľkosti častíc nepresahujú polovičnú vlnovú dĺžku dopadajúceho svetla, vypracoval anglický fyzik J. Rayleigh v roku 1871. Podľa Rayleighovho zákona intenzita svetla I rozptýleného v smere kolmom na dopadajúci lúč je vyjadrený vzorcom I = QNvlk - kde q je intenzita dopadajúceho svetla, N je celkový počet častíc na jednotku objemu, alebo čiastočná koncentrácia, v je objem jednej častice, \ je vlnová dĺžka dopadajúce svetlo, k je konštanta v závislosti od indexov lomu koloidných častíc a disperzného prostredia, ktoré ich obklopuje, vzdialenosti od svetelného zdroja, ako aj od akceptovaných jednotiek merania
Turbidimetrie je metóda na analýzu zakalených médií založená na meraní intenzity svetla, ktoré absorbujú. Turbidimetrické merania sa uskutočňujú v prechádzajúcom svetle pomocou vizuálnych turbidimetrov alebo fotoelektrických kolorimetrov. Technika merania je podobná kolorimetrickej a je založená na aplikovateľnosti Bouguer-Lambertovho zákona na zakalené médiá, čo v prípade suspenzií platí len pre veľmi tenké vrstvy alebo pri výrazných riedeniach. Turbidimetria vyžaduje starostlivé dodržanie podmienok pre vznik dispergovanej fázy, podobne ako podmienky pozorované pri nefelometrii. Významným zlepšením v turbidimetrii je použitie turbidimetrickej titrácie vrcholu turbidity pomocou fotoelektrických kolorimetrov. Turbidimetrie sa úspešne používa na analytické stanovenie síranov, fosforečnanov, chloridov, kyanidov, olova, zinku atď.
Hlavnou výhodou nefelometrických a turbidimetrických metód je ich vysoká citlivosť, ktorá je cenná najmä vo vzťahu k prvkom alebo iónom, pre ktoré neexistujú žiadne farebné reakcie. V praxi sa vo veľkej miere využíva napríklad nefelometrické stanovenie chloridov a síranov v prírodných vodách a podobných objektoch. Z hľadiska presnosti sú turbidimetrie a nefelometria horšie ako fotometrické metódy, čo je spôsobené najmä ťažkosťami pri získavaní suspenzií s rovnakými veľkosťami častíc, stabilitou v čase atď. k nedostatočnej reprodukovateľnosti chemických analytických metód sa pridávajú vlastnosti suspenzií.
Nefelometria a turbidimetria sa používa napríklad na stanovenie SO4 vo forme suspenzie BaSO4, Cl- vo forme suspenzie AgCl, S2- vo forme suspenzie CuS z dna. limity detekovateľného obsahu sú ~ 0,1 μg/ml. Na štandardizáciu podmienok analýzy v experimentoch je potrebné prísne kontrolovať teplotu, objem suspenzie, koncentráciu činidiel, rýchlosť miešania a čas meraní. Zrážanie musí prebiehať rýchlo a vyzrážané častice musia mať malú veľkosť a nízke pH. Aby sa zabránilo koagulácii veľkých častíc, často sa do roztoku pridáva napríklad stabilizátor. želatína, glycerín.
38. Chromatografia: história vzniku, princíp metódy, uplatnenie na súde. Výskum.
Chromatografia je dynamická sorpčná metóda na separáciu a analýzu zmesí látok, ako aj na štúdium fyzikálno-chemických vlastností látok. Je založená na distribúcii látok medzi dve fázy – stacionárnu (tuhá fáza alebo kvapalina viazaná na inertnom nosiči) a mobilnú (plynná alebo kvapalná fáza, eluent). Názov metódy sa spája s prvými experimentmi v chromatografii, počas ktorých vývojár metódy Michail Tsvet separoval pestrofarebné rastlinné pigmenty.
Chromatografickú metódu prvýkrát použil ruský botanik Michail Semenovič Tsvet v roku 1900. Na oddelenie rastlinných pigmentov použil kolónu naplnenú uhličitanom vápenatým. Prvú správu o vývoji chromatografickej metódy urobil Tsvet 30. decembra 1901 o hod XI kongres prírodovedcov a lekárov v Petrohrade. Prvá tlačená práca o chromatografii bola publikovaná v roku 1903 v časopise Zborník varšavskej spoločnosti prírodovedcov. Prvý termín chromatografia sa objavil v dvoch tlačených dielach Color v roku 1906, publikovaných v nemeckom časopise Berichte der Deutschen Botanischen Gesellschaft. V roku 1907 Tsvet demonštruje svoju metódu Nemecká botanická spoločnosť.
V rokoch 1910-1930 bola metóda nezaslúžene zabudnutá a prakticky sa nerozvinula.
V roku 1931 R. Kuhn, A. Winterstein a E. Lederer pomocou chromatografie izolovali frakcie α a β v kryštalickej forme zo surového karoténu, čím preukázali preparatívnu hodnotu metódy.
V roku 1941 vyvinuli A. J. P. Martin a R. L. M. Singh nový typ chromatografie, ktorý bol založený na rozdiele distribučných koeficientov separovaných látok medzi dvoma nemiešateľnými kvapalinami. Metóda sa volala „ deliaca chromatografia».
V roku 1947 T. B. Gapon, E. N. Gapon a F. M. Shemyakin vyvinuli metódu „ionexovej chromatografie“.
V roku 1952 dostali J. Martin a R. Singh Nobelovu cenu za chémiu za vytvorenie metódy deliacej chromatografie.
Od polovice 20. storočia až po súčasnosť sa chromatografia intenzívne rozvíjala a stala sa jednou z najpoužívanejších analytických metód.
Klasifikácia: Plyn, Kvapalina
Základy chromatografie proces. Na uskutočnenie chromatografie separácia látok alebo stanovenie ich fyzikálno-chemických vlastností. charakteristiky sa zvyčajne používajú špeciálne. zariadenia - chromatografy. Základné chromatografické jednotky - chromatografické. kolóna, detektor a zariadenie na vstrekovanie vzorky. Kolóna obsahujúca sorbent plní funkciu separácie analyzovanej zmesi na jednotlivé zložky a detektor plní funkciu separácie ich množstiev. definície. Detektor umiestnený na výstupe z kolóny automaticky nepretržite určuje koncentráciu separovaných zlúčenín. v prúde mobilnej fázy Po zavedení analyzovanej zmesi s prúdom mobilnej fázy do kolóny sa zóny všetkých látok nachádzajú na začiatku chromatografie. stĺpci (obr. 1). Pod vplyvom toku mobilnej fázy sa zložky zmesi začnú pohybovať pozdĺž kolóny s rozkladom. rýchlosti, ktorých hodnoty sú nepriamo úmerné distribučným koeficientom K chromatografovaných komponentov. Dobre sorbované látky, ktorých distribučné konštanty sú veľké, sa pohybujú pozdĺž vrstvy sorbentu pozdĺž kolóny pomalšie ako zle sorbované látky. Preto najrýchlejšie opúšťa kolónu zložka A, potom zložka B a posledná, ktorá opúšťa kolónu, je zložka C (K A<К Б <К В). Сигнал детектора, величина к-рого пропорциональна концентрации определяемого в-ва в потоке элюента, автоматически непрерывно записывается и регистрируется (напр., на диаграммной ленте). Полученная хроматограмма отражает расположение хроматографич. зон на слое сорбента или в потоке подвижной фазы во времени.

Ryža. 1. Separácia zmesi troch zložiek (A, B a C) na chromatografickej kolóne K s detektorom D: a - poloha chromatografických zón separovaných zložiek v kolóne v určitých časových intervaloch; b - chromatogram (C - signál, t - čas) .
S chromatografiou na plochej vrstve Pri separácii sa do chromatografie vloží hárok papiera alebo doska s vrstvou sorbentu s nanesenými vzorkami skúmanej látky. fotoaparát. Po oddelení sa zložky určia akoukoľvek vhodnou metódou.
39. Klasifikácia chromatografických metód.
Chromatografia je metóda separácie a analýzy látok založená na distribúcii analytu. Rozdiel medzi 2 fázami: mobilná a stacionárna
Roztok zmesi látok, ktoré sa majú oddeliť, prechádza cez sklenenú trubicu (Adsorpčná kolóna) naplnenú adsorbentom. V dôsledku toho sú zložky zmesi zadržané v rôznych výškach stĺpca adsorbenta vo forme oddelených zón (vrstiev). Vec je lepšia ako adsorbir. Sú v hornej časti kolóny a horšie sa adsorbujú v spodnej časti kolóny. Látky, ktoré sa nedajú adsorbovať, prechádzajú kolónou bez zastavenia a zachytávajú sa vo filtri.
Klasifikácia:
1. Podľa stavu agregácie fáz.
1) Pohyblivé
A) plyn (inertné plyny: hélium, argón, azón)
B) kvapalina
2. podľa spôsobu realizácie
1) na rovine (rovinnej); tenkovrstvový papier
2) stĺpcový
A) plnená (plná kolóna naplnená sorbentom)
B) kapilára (tenká sklenená/kremenná kapilára, na ktorej vnútornom povrchu je nanesená stacionárna fáza)
Môžete def. Položky v malom množstve.
Prchavé látky sa oddelia.
40. Chromatogram. Základné parametre píku chromatografu.
Chromatogram je výsledkom zaznamenávania závislosti koncentrácie zložiek na výstupe z kolóny od času.
H S
Každý pík v chromatograme je charakterizovaný dvoma hlavné parametre
1. Retenčný čas ( t R) je čas od okamihu vloženia analyzovanej vzorky do zaznamenania maxima chromatografického píku. Závisí od povahy látky a je kvalitatívnou charakteristikou.
2. Výška ( h) alebo oblasť ( S) vrchol
S = ½ ω × h. (4)
Výška a plocha píku závisí od množstva látky a ide o kvantitatívne charakteristiky.
Retenčný čas sa skladá z dvoch zložiek - času zotrvania látok v mobilnej fáze ( t m) a čas zotrvania v stacionárnej fáze ( t s):
Identifikácia píkov neznámych zložiek analyzovanej zmesi sa uskutočňuje porovnaním (porovnaním). hodnoty určené priamo z chromatogramu so zodpovedajúcimi tabuľkovými údajmi pre známe zlúčeniny. Pri identifikácii v chromatografii je spoľahlivý iba negatívny. odpoveď; napríklad pík i nie je položkou A, ak sa retenčné časy píku i a položky A nezhodujú. Koincidencia retenčných časov píku i a látky A je nevyhnutnou, ale nie postačujúcou podmienkou na záver, že pík i je látka A.
V praktickej práci je výber jedného alebo druhého parametra na kvantitatívnu interpretáciu chromatogramov určený kombinovaným vplyvom niekoľkých faktorov: rýchlosť a jednoduchosť výpočtu, tvar (široký, úzky) a stupeň asymetrie chromatografického píku, účinnosť použitej kolóny, úplnosť separácie zložiek zmesi, prítomnosť potrebných automatizovaných zariadení (integrátory, počítačové systémy na spracovanie chromatografických údajov).
Stanovený parameter chromatografického píku zmeria operátor manuálne na chromatograme na konci cyklu separácie zložiek analyzovanej zmesi.
Stanovený parameter chromatografického píku sa meria automaticky pomocou digitálnych voltmetrov, integrátorov alebo špecializovaných počítačov súčasne so separáciou zložiek analyzovanej zmesi v kolóne a záznamom chromatogramu
Keďže technika dekódovania chromatogramov spočíva v meraní parametrov chromatografických píkov sledovanej zlúčeniny a štandardnej zlúčeniny, chromatografické podmienky by mali zabezpečiť ich úplnú separáciu, ako je to len možné; všetky ostatné zložky pôvodnej vzorky za akceptovaných analytických podmienok môžu nesmú byť od seba oddelené alebo sa dokonca na chromatograme vôbec neobjavujú (toto je výhoda metódy vnútorného štandardu oproti metóde vnútornej normalizácie)
41.Kvalitatívna chromatografická analýza.
Pri dostatočnej dĺžke kolóny je možné dosiahnuť úplné oddelenie zložiek akejkoľvek zmesi. A po elúcii oddelených zložiek do oddelených frakcií (eluátov) určiť počet zložiek zmesi (zodpovedá počtu eluátov), stanoviť ich kvalitatívne zloženie, určiť množstvo každej z nich pomocou vhodných metód kvantitatívnej analýzy .
Kvalitatívna chromatografická analýza, t.j. identifikáciu látky podľa jej chromatogramu je možné vykonať porovnaním chromatografických charakteristík, najčastejšie zadržaného objemu (t.j. objemu mobilnej fázy prejdenej kolónou od začiatku vstupu zmesi do objavenia sa tejto zložky na výstupe). stĺpca), zistené za určitých podmienok pre zložky analyzovaných zmesí látok a pre štandard.
42. Kvantitatívna chromatografická analýza.
Kvantitatívna chromatografická analýza sa zvyčajne vykonáva na chromatografe. Metóda je založená na meraní rôznych parametrov chromatografického píku v závislosti od koncentrácie chromatografovaných látok - výšky, šírky, plochy a zadržaného objemu alebo súčinu zadržaného objemu a výšky píku.
V kvantitatívnej plynovej chromatografii sa používajú metódy absolútnej kalibrácie a vnútornej normalizácie, prípadne normalizácie. Používa sa aj metóda vnútorného štandardu. Pri absolútnej kalibrácii sa experimentálne určí závislosť výšky alebo plochy píku od koncentrácie látky a zostrojia sa kalibračné grafy alebo sa vypočítajú zodpovedajúce koeficienty. Potom sa stanovia rovnaké charakteristiky píkov v analyzovanej zmesi a koncentrácia analytu sa zistí z kalibračného grafu. Táto jednoduchá a presná metóda je hlavnou metódou na stanovenie stopových nečistôt.
Pri použití metódy vnútornej normalizácie sa súčet všetkých parametrov píkov, napríklad súčet výšok všetkých píkov alebo súčet ich plôch, berie ako 100 %. Potom pomer výšky jednotlivého píku k súčtu výšok alebo pomer plochy jedného píku k súčtu plôch pri vynásobení 100 bude charakterizovať hmotnostný zlomok (%) zložky v zmes. Pri tomto prístupe je potrebné, aby závislosť hodnoty meraného parametra od koncentrácie bola rovnaká pre všetky zložky zmesi.
43. Planárna chromatografia. Použitie tenkovrstvovej chromatografie na analýzu atramentu.
Prvou formou použitia celulózy v chromatografii na tenkej vrstve bola papierová chromatografia. Dostupné TLC a vysokovýkonné TLC platne umožňujú separáciu zmesí polárnych látok s použitím aspoň ternárnych zmesí vody, nemiešateľného organického rozpúšťadla a vo vode rozpustného rozpúšťadla, ktoré podporuje tvorbu jednej fázy ako eluentov.ү oxid /( [ obnoviť] ү obnovené)),
R - univerzálna plynová konštanta rovná 8,31 J/(mol. K); T - absolútna teplota; F - Faradayova konštanta (96500 C/mol); n - počet elektrónov zúčastňujúcich sa elektródovej reakcie; a oxid, a obnoviť- aktivita oxidovaných a redukovaných foriem redoxného systému;[ oxid] A[ obnoviť] - ich molárne koncentrácie; ү oxid, ү obnoviť - koeficienty aktivity; E° je štandardný potenciál redoxného systému.
Nahrádzanie T= 298,15 K a číselné hodnoty konštánt v rovnici, dostaneme:
E = E°+ (0,059 / n) lg (a oxid/a obnoviť)
E = E°+ (0,059 / n) lg ([ oxid] ү oxid / ([ obnoviť] ү obnovené))
Metódy priamej potenciometrie sú založené na aplikácii Nernstovej rovnice na zistenie aktivity alebo koncentrácie účastníka elektródovej reakcie z experimentálne nameraného EMF obvodu alebo elektródového potenciálu. Medzi priamymi potenciometrickými metódami je najrozšírenejšia metóda na stanovenie pH, no nedávny vznik spoľahlivo fungujúcich iónovo selektívnych elektród výrazne rozšíril praktické možnosti priamych metód. Hodnota pH sa meria aj potenciometrickou titráciou.
Na stanovenie pH sa najčastejšie používa sklenená elektróda. Hlavnými výhodami sklenenej elektródy sú jednoduchá obsluha, rýchle nastolenie rovnováhy a možnosť stanovenia pH v redoxných systémoch. Nevýhody zahŕňajú krehkosť materiálu elektród a náročnosť práce pri prechode na silne zásadité a silne kyslé roztoky.
Okrem koncentrácie vodíkových iónov možno priamou potenciometrickou metódou s iónovo selektívnymi elektródami určiť obsah niekoľkých desiatok rôznych iónov.
Potenciometrická titrácia na základe určenia bodu ekvivalencie na základe výsledkov potenciometrických meraní. V blízkosti bodu ekvivalencie nastáva prudká zmena (skok) potenciálu indikačnej elektródy. Rovnako ako v iných titračný metódy potenciometrickej titrácie musia prebiehať striktne stechiometricky, majte vysokú rýchlosť a prejdite na koniec.
Pre potenciometrickú titráciu je obvod zostavený z indikačnej elektródy v analyzovanom roztoku a referenčnej elektródy. Ako referenčné elektródy sa najčastejšie používajú kalomelové alebo chloridové elektródy.
Typ indikačnej elektródy použitej na potenciometrickú titráciu závisí od vlastností titračný zmes a jej interakcia s elektródou. Pri acidobázickej titrácii sa používa sklenená elektróda, pri redoxnej titrácii inertná (platinová) elektróda alebo elektróda, ktorá je reverzibilná vzhľadom na jeden z iónov obsiahnutých v titračný zmesi; v zrážacej elektróde - strieborná elektróda; V komplexometrické- kovová elektróda reverzibilná na titrovaný kovový ión.
Na nájdenie bodu ekvivalencie sa často zostrojí diferenciálna krivka v súradniciach D E/ D V-V . Bod ekvivalencie je označený maximom výslednej krivky a odčítanie pozdĺž osi x zodpovedajúca tomuto maximu udáva objem titrantu, vynaložené na titráciu do bodu ekvivalencie. Určenie bodu ekvivalencie k diferenciálnej krivke je oveľa presnejšie ako použitie jednoduchej závislosti E - V.
Hlavnými výhodami metódy potenciometrickej titrácie je vysoká presnosť a schopnosť vykonávať stanovenia v zriedených roztokoch, v zakalených a farebných médiách, ako aj stanoviť niekoľko látok v jednom roztoku bez predchádzajúcej separácie. Rozsah praktickej aplikácie potenciometrickej titrácie pri použití nevodných rozpúšťadiel sa výrazne rozširuje. Umožňujú analyzovať viaczložkové systémy, ktoré nie je možné stanoviť vo vodnom roztoku, analyzovať látky, ktoré sú nerozpustné alebo sa vo vode rozkladajú atď. Potenciometrickú titráciu je možné jednoducho automatizovať. Priemysel vyrába niekoľko typov autotitrátorov s použitím potenciometrických senzorov.
Nevýhody potenciometrickej titrácie zahŕňajú nie vždy rýchle stanovenie potenciálu po pridaní titračného činidla a potrebu v mnohých prípadoch vykonať počas titrácie veľké množstvo odčítaní.
Pri potenciometrickej analýze sú hlavnými meracími prístrojmi potenciometre rôznych typov. Sú určené na meranie EMF systému elektród. Keďže EMF závisí od aktivity zodpovedajúcich iónov v roztoku, mnohé potenciometre vám tiež umožňujú priamo merať hodnotu pX - záporný logaritmus aktivity iónu X. Takéto potenciometre, doplnené o zodpovedajúcu iónovo selektívnu elektródu , sa volajú ionoméry. Ak sú potenciometer a elektródový systém navrhnuté len na meranie aktivity vodíkových iónov, prístroj sa nazýva pH meter.A.A. Vikharev, S.A. Zuikova, N.A. Chemeris, N.G. Domina