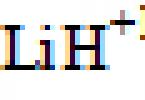Chemický prvok hélium bol prvýkrát objavený na Slnku a až potom na Zemi.
Kľúčovú úlohu v histórii objavu hélia zohral Norman Lockyer, zakladateľ jednej z popredných svetových vedeckých publikácií – časopisu Príroda. Pri príprave časopisu sa zoznámil s londýnskym vedeckým establishmentom a začal sa zaujímať o astronómiu. Bolo to obdobie, keď astronómovia, inšpirovaní objavom Kirchhoff-Bunsen, práve začínali študovať spektrum svetla vyžarovaného hviezdami. Samotnému Lockyerovi sa podarilo urobiť množstvo dôležitých objavov – predovšetkým ako prvý ukázal, že slnečné škvrny sú chladnejšie ako zvyšok slnečného povrchu a tiež ako prvý poukázal na to, že Slnko má vonkajší obal, tzv. to chromosféra. V roku 1868, keď študoval svetlo vyžarované atómami na výbežkoch – obrovské výrony plazmy z povrchu Slnka – Lockyer si všimol množstvo dovtedy neznámych spektrálnych čiar ( cm. Spektroskopia). Pokusy získať rovnaké línie v laboratóriu zlyhali, z čoho Lockyer usúdil, že objavil nový chemický prvok. Lockyer to nazval hélium, z gréčtiny helios- "Slnko".
Vedci boli zmätení, ako reagovať na objavenie sa hélia. Niektorí naznačovali, že pri interpretácii spektier protuberancií došlo k chybe, ale tento názor získal čoraz menej priaznivcov, pretože stále viac astronómov bolo schopných pozorovať Lockyerove línie. Iní tvrdili, že Slnko obsahuje prvky, ktoré na Zemi neexistujú – čo, ako už bolo spomenuté, je v rozpore s hlavným bodom o zákonoch prírody. Ďalší (existovala menšina) verili, že jedného dňa sa na Zemi nájde hélium.
Koncom 90. rokov 19. storočia lord Rayleigh a Sir William Ramsay uskutočnili sériu experimentov, ktoré viedli k objavu argónu. Ramsay upravil svoje nastavenie tak, aby ho používal na štúdium plynov uvoľňovaných minerálmi obsahujúcimi urán. Ramsay objavil neznáme čiary v spektre týchto plynov a poslal vzorky niekoľkým kolegom na analýzu. Po prijatí vzorky Lockyer okamžite rozpoznal čiary, ktoré pozoroval na slnečnom svetle pred viac ako štvrťstoročím. Záhada hélia bola vyriešená: plyn sa nepochybne nachádza na Slnku, ale existuje aj tu na Zemi. V súčasnosti je tento plyn v každodennom živote najznámejší ako plyn na nafukovanie vzducholodí a balónov ( cm. Grahamov zákon) a vo vede - vďaka jeho aplikácii v kryogenika, technológie na dosiahnutie ultranízkych teplôt.
Korónium a nebulium
Otázka, či niekde vo vesmíre existujú chemické prvky, ktoré sa nenachádzajú na Zemi, nestratila v 20. storočí na aktuálnosti. Pri štúdiu vonkajšej slnečnej atmosféry - slnečnej korún, pozostávajúce z horúcej, veľmi riedkej plazmy, astronómovia objavili spektrálne čiary, ktoré nedokázali identifikovať so žiadnym zo známych pozemských prvkov. Vedci navrhli, že tieto čiary patria novému prvku, ktorý je tzv korónium. A pri štúdiu spektier niektorých hmloviny- vzdialené nahromadenie plynov a prachu v Galaxii - boli objavené ďalšie záhadné čiary. Boli pripísané inému „novému“ prvku - hmlovina. V tridsiatych rokoch 20. storočia americký astrofyzik Ira Sprague Bowen (1898-1973) dospel k záveru, že hmloviny v skutočnosti patria kyslíku, ale tento vzhľad nadobudli v dôsledku extrémnych podmienok na Slnku a v hmlovinách a tieto podmienky sa nedajú reprodukovať. v pozemských laboratóriách. Korónium sa ukázalo ako vysoko ionizované železo. A tieto riadky dostali meno zakázané linky.
Jozef Norman LOCKYER
Joseph Norman Lockyer, 1836-1920
Anglický vedec. Narodil sa v meste Rugby v rodine vojenského lekára. Lockyer prišiel k vede nezvyčajným spôsobom, svoju kariéru začal ako úradník na ministerstve vojny. Aby si privyrobil, využil záujem verejnosti o vedu a začal vydávať populárno-vedecký časopis. Prvé číslo časopisu vyšlo v roku 1869 Príroda a 50 rokov zostal Lockyer jeho redaktorom. Zúčastnil sa mnohých expedícií pozorujúcich úplné zatmenie Slnka. Jedna z týchto výprav ho priviedla k objavu hélia. Lockyer je známy aj ako zakladateľ archeoastronómie – vedy, ktorá študuje astronomický význam starovekých štruktúr, ako je Stonehenge – a ako autor mnohých populárno-vedeckých kníh.
Všetci poznáme hélium, veľmi ľahký plyn, ktorý pomáha balónom a vzducholodiam stúpať do vzduchu. Hélium má veľmi dôležitú bezpečnostnú výhodu – nehorí ani neexploduje ako vodík. Tento plyn je tiež neoddeliteľnou súčasťou zmesí vzduchu na použitie pri dýchaní hlbokomorskými potápačmi - na rozdiel od dusíka je takmer nerozpustný v krvi alebo lipidoch (tukové zložky) aj za podmienok veľmi vysokého tlaku.
Hélium vám pomôže zaobísť sa bez neho dusíková narkóza, v ktorom je nervový systém (ktorý je zo 60 % lipidov) naplnený dusíkom, takže potápači majú pocit, že si dali jedno martini v hĺbke 30 metrov. Tento plyn tiež pomáha predchádzať nástupu dekompresnej choroby, známej aj ako dekompresná choroba. Ide o bolestivý a nebezpečný stav, pri ktorom sa v krvi, nervovom systéme, kĺboch a pod kožou potápača tvoria bubliny dusíka, keď tlak príliš rýchlo klesá, keď potápač stúpa k hladine. Zmes hélia a kyslíka (nazývaná heliox) spôsobuje, že hlas je veľmi piskľavý – je to spôsobené tým, že zvuk sa héliom šíri oveľa rýchlejšie ako vzduchom a práve táto vlastnosť hélia z neho robí obľúbený vtip počas sviatkov. keď sa balóny nafúknu héliom.
Hélium je druhý najľahší chemický prvok, ktorého je veľa úžasné vlastnosti. Tento plyn dostal svoje meno, pretože bol prvýkrát zistený na svetelnom obrázku na slnku (v gréčtine helios) predtým, ako bol objavený na Zemi. Všetky plyny, keď sú dostatočne ochladené, kondenzujú do kvapalného stavu a hélium má najnižšiu kondenzačnú teplotu zo všetkých známych látok (–269 °C alebo –452 °F). Na rozdiel od iných chemických prvkov hélium nikdy nezamrzne, bez ohľadu na to, aké je chladné, s výnimkou veľmi vysokého tlaku. Okrem toho tekutá forma hélia, keď sa ochladí na teplotu pod –271 °C (-456 °F), vytvorí jedinečnú fázu nazývanú supratekutina – toto supratekutý Tečie perfektne, bez akéhokoľvek odporu (viskozity).
Predpokladá sa, že hélium na slnku bolo tvorené jadrovej fúzie . Ide o proces, pri ktorom sa jadrá vodíka, najľahšieho prvku, spájajú do hélia, pričom sa uvoľňuje obrovské množstvo energie.
Na Zemi sa tento plyn tvorí hlavne v dôsledku rádioaktivity alfa(a) - rozpad. Renomovaný novozélandský fyzik Ernest Rutherford (1871–1937) prvýkrát objavil, že častice alfa sú vlastne jadrá atómov hélia. Tak vzniká hélium rádioaktívnymi prvkami obsiahnutými v hornine, ako je urán či tórium, a z nich sa dostáva do ovzdušia.
Vedci dokážu určiť, ako rýchlo sa hélium tvorí, ako rýchlo opúšťa horninu a koľko z neho vstupuje do vzduchu a koľko hélia sa môže stratiť zo vzduchu do vesmíru. Môžu tiež merať množstvo hélia v hornine a vzduchu. Na základe toho vedia vedci vypočítať maximálny vek hornín a vzduchu. Výsledky sú záhadné pre tých, ktorí veria v miliardy rokov. Samozrejme, všetky takéto výpočty sú založené na tvrdeniach o minulosti, ako sú predpoklady o počiatočných podmienkach a konštantných koeficientoch rôznych procesov. Nikdy sa im to nepodarí dokázať vek niečoho. Na to potrebujete očitého svedka, ktorý všetko videl na vlastné oči ( pozri Jób 38:4 ).
Hélium v atmosfére
Vzduch pozostáva hlavne z dusíka (78,1 %) a kyslíka (20,1 %). Množstvo hélia v ňom je veľmi malé (0,0005 %). Ale to je stále veľa hélia, konkrétne 3,71 miliardy ton. Avšak, keďže každú sekundu Keďže 67 gramov hélia vstupuje do atmosféry zo zemskej kôry, akumulácia hélia existujúceho v dnešnej atmosfére by si vyžadovala približne dva milióny rokov , aj keď na úplnom začiatku to tam vôbec nebolo.
Evolucionisti veria, že naša Zem je 2500-krát staršia, teda ona 4,5 miliardy rokov. Samozrejme, že Zem mohla byť vytvorená s väčšinou pozorovaného hélia, takže sú to dva milióny rokov maximálny vek . (Tento vek môže byť oveľa nižší, napríklad 6000 rokov.)
Okrem toho je potrebné poznamenať, že v minulosti by tvorba hélia prebiehala rýchlejšie ako v súčasnosti, pretože rádioaktívne zdroje sa rozpadali. To by ešte viac znížilo vekové rozpätie Zeme.
Jediný spôsob, ako odstrániť tento problém, je predpokladať, že hélium jednoducho uniká do vesmíru. Aby sa to však stalo, atómy hélia sa musia pohybovať dostatočne rýchlo, aby unikli zemskej gravitácii (to znamená rýchlosťou vyššou ako úniková rýchlosť). Zrážky medzi atómami spomaľujú ich pohyb, ale nad kritickú výšku ( exobase), približne 500 kilometrov nad zemou, dochádza k zrážkam veľmi zriedkavo. Atómy, ktoré prekročia túto výšku, majú šancu uniknúť, ak budú cestovať dostatočne rýchlo - aspoň 10,75 kilometra za sekundu. Všimnite si, že hoci hélium v balóne bude plávať, keď sa otvorí, jednoducho sa rovnomerne zmieša so všetkými ostatnými plynmi, ako je to v prípade všetkých normálnych plynov.
Priemernú rýchlosť atómov možno vypočítať, ak je známa teplota, pretože priamo súvisí s priemernou energiou atómov alebo molekúl. Renomovaný fyzik (a kreacionista) James Clerk Maxwell vypočítal, koľko atómov plynu (alebo molekúl) by malo danú rýchlosť pri akejkoľvek teplote a hmotnosti. Týmto spôsobom môžeme vypočítať, koľko atómov by prešlo exobázou pomerne rýchlo, aby unikli do vesmíru.
Exobase je veľmi horúca. Ale aj keď predpokladáme teplotu 1500 K (1227 °C alebo 2241 °F), ktorá je vyššia ako priemerná teplota, najbežnejšia rýchlosť atómov hélia je iba 2,5 kilometra za sekundu (5625 m/h) alebo menej. ako štvrtina prietoku. Len málo atómov sa pohybuje rýchlejšie, ako je priemerná rýchlosť, a napriek tomu je množstvo hélia, ktoré prúdi do vesmíru, približne 1/40 množstva hélia ktorý vstupuje do atmosféry. Iné únikové mechanizmy tiež nepočítajú s malým množstvom hélia vo vzduchu, čo je asi 1/2000 množstva, ktoré by bolo prítomné vo vzduchu po očakávaných miliardách rokov.
Toto je nevyriešený problém pre atmosférického fyzika, ktorý verí v dlhé epochy dejín Zeme, K.G. Walker, ktorý povedal nasledovné: "...s ohľadom na úroveň hélia v atmosfére, tu stojíme pred problémom". Ďalší špecialista, D.W. Chamberlain tiež povedal, že tento problém sa týka akumulácie hélia „... neodíde sama od seba a zostane nevyriešená“.
Evolučná komunita sa zúfalo snaží nájsť iné vysvetlenia tohto nedostatku hélia, ale žiadne z nich nie je vhodné. Jednoduché riešenie problému možno nájsť, ak pripustíme, že Zem vôbec nie je taká stará, ako veria evolucionisti! Kreacionista, vedec Larry Vardiman, ktorý študoval atmosféru, študoval túto problematiku hlbšie a napísal podrobnejšiu štúdiu o tejto problematike.
Hélium v skalách
Ako sme už povedali, väčšina hélia na Zemi vzniká v dôsledku rádioaktívneho rozpadu v horninách. Malé atómy hélia voľne prúdia z hornín do atmosféry.
Vyššie sme tiež povedali, že bola stanovená rýchlosť, ktorou hélium vstupuje do atmosféry. Ale môžeme tiež merať rýchlosť, akou hélium vyteká z hornín. Tento proces prebieha rýchlejšie v teplejších horninách a čím hlbšie sa dostanete do zeme, tým sú horniny horúcejšie.
Fyzik stvorenia Robert Gentry skúmal hlboko položenú žulu ako možný spôsob, ako bezpečne uložiť nebezpečný rádioaktívny odpad z jadrových elektrární. Bezpečné skladovanie vyžaduje, aby prvky neprechádzali skalou príliš rýchlo.
Žula obsahuje minerálne kryštály tzv zirkóny(kremičitan zirkoničitý, ZrSiO 4), ktoré často obsahujú rádioaktívne prvky. To znamená, že musia vytvárať hélium, ktoré musí prúdiť do atmosféry.
Ale Gentry zistil, že aj hlboko uložené zirkóny (197 °C alebo 387 °F) obsahujú príliš veľa hélia- teda ak by mali miliardy rokov do odtekania.
Ak však v skutočnosti prešlo len niekoľko tisíc rokov, počas ktorých toto hélium vstúpilo do atmosféry, potom sa nemožno čudovať, že tam zostalo toľko hélia.
[Novinky z októbra 2002: Pozri údaje o zrýchlenom jadrovom rozpade v článku Jadrový rozpad: Dôkazy svetovej mládeže , ktorú napísal kreacionistický jadrový fyzik Dr Russell Humphreys .]
Záver
Množstvo hélia vo vzduchu a v horninách je úplne v rozpore s predstavou, že naša Zem je stará miliardy rokov, ako tvrdia evolucionisti a pokrokoví kreacionisti. Toto množstvo hélia je skôr vedecký dôkaz malého veku, ako je jasne a jasne uvedené v knihe Genezis.
hélium(lat. Hélium), symbol He, chemický prvok skupiny VIII periodickej sústavy, označuje inertné plyny; poradové číslo 2, atómová hmotnosť 4,0026; plyn bez farby a zápachu. Prírodné hélium pozostáva z 2 stabilných izotopov: 3 He a 4 He (ostro prevažuje obsah 4 He).
Historický odkaz. Prvýkrát bolo hélium objavené nie na Zemi, kde je ho málo, ale v atmosfére Slnka. V roku 1868 študovali Francúz J. Jansen a Angličan J. N. Lockyer spektroskopické zloženie slnečných protuberancií. Snímky, ktoré získali, obsahovali jasne žltú čiaru (tzv. čiaru D3), ktorú nebolo možné pripísať žiadnemu z v tom čase známych prvkov. V roku 1871 Lockyer vysvetlil jeho vznik prítomnosťou nového prvku v Slnku, ktorý sa volal hélium (z gréckeho helios – Slnko). Na Zemi hélium prvýkrát izoloval v roku 1895 Angličan W. Ramsay z rádioaktívneho minerálu kleveit. Spektrum plynu uvoľneného pri zahrievaní kleveitu vykazovalo rovnakú čiaru.
Distribúcia hélia v prírode. Na Zemi je málo hélia: 1 m 3 vzduchu obsahuje iba 5,24 cm 3 hélia a každý kilogram pozemského materiálu obsahuje 0,003 mg hélia. Pokiaľ ide o hojnosť vo vesmíre, hélium je na druhom mieste po vodíku: hélium tvorí asi 23 % kozmickej hmoty.
Na Zemi sa hélium (presnejšie izotop 4 He) neustále tvorí pri rozpade uránu, tória a iných rádioaktívnych prvkov (celkovo obsahuje zemská kôra asi 29 rádioaktívnych izotopov, ktoré produkujú 4 He).
Približne polovica všetkého hélia je sústredená v zemskej kôre, najmä v jej žulovom obale, ktorý nahromadil hlavné zásoby rádioaktívnych prvkov. Obsah hélia v zemskej kôre je nízky - 3·10 -7% hmotnosti. Hélium sa hromadí vo voľných plynových akumuláciách v podpovrchovej vrstve av rope; Takéto ložiská dosahujú priemyselné rozmery. Maximálne koncentrácie hélia (10-13%) boli zistené vo voľných plynoch a plynoch z uránových baní a (20-25%) v plynoch spontánne uvoľnených z podzemných vôd. Čím starší je vek plynonosných sedimentárnych hornín a čím vyšší je obsah rádioaktívnych prvkov v nich, tým viac hélia je v zložení zemných plynov. Sopečné plyny sa zvyčajne vyznačujú nízkym obsahom hélia.
Hélium sa vyrába v priemyselnom meradle z prírodných a ropných plynov s uhľovodíkovým a dusíkovým zložením. Na základe kvality surovín sa ložiská hélia delia na: bohaté (obsah He > 0,5 % objemu); obyčajný (0,10-0,50) a chudobný (<0,10). В СССР природный Гелий содержится во многих нефтегазовых месторождениях. Значительные его концентрации известны в некоторых месторождениях природного газа Канады, США (штаты Канзас, Техас, Нью-Мексико, Юта).
Izotopy, atóm a molekula hélia. V prírodnom héliu akéhokoľvek pôvodu (atmosférického, z prírodných plynov, z rádioaktívnych minerálov, meteoritu atď.) prevláda izotop 4 He. Obsah 3 He je zvyčajne nízky (v závislosti od zdroja hélia sa pohybuje od 1,3·10 -4 do 2·10 -8 %) a iba v héliu izolovanom z meteoritov dosahuje 17-31,5 %. Rýchlosť tvorby 4 He pri rádioaktívnom rozpade je nízka: v 1 tone žuly obsahujúcej napríklad 3 g uránu a 15 g tória sa za 7,9 milióna rokov vytvorí 1 mg hélia; keďže však tento proces prebieha neustále, musela by počas existencie Zeme zabezpečiť obsah hélia v atmosfére, litosfére a hydrosfére výrazne prevyšujúci ten existujúci (je to asi 5 10 14 m 3 ). Tento nedostatok hélia sa vysvetľuje jeho neustálym vyparovaním z atmosféry. Ľahké atómy hélia, padajúce do horných vrstiev atmosféry, tam postupne nadobúdajú rýchlosť vyššiu ako je druhá kozmická rýchlosť a tým získavajú možnosť prekonať gravitačné sily. Súčasná tvorba a prchanie hélia vedie k tomu, že jeho koncentrácia v atmosfére je takmer konštantná.
Najmä izotop 3 He vzniká v atmosfére počas β-rozpadu ťažkého izotopu vodíka - trícia (T), ktorý zase vzniká interakciou neutrónov z kozmického žiarenia s dusíkom vo vzduchu:
14 7 N + 3 0 n → 12 6 C + 3 1 T.
Jadrá atómu 4 He (pozostávajúce z 2 protónov a 2 neutrónov), nazývané častice alfa alebo hélióny, sú najstabilnejšie spomedzi zložených jadier. Väzbová energia nukleónov (protónov a neutrónov) v 4 He má maximálnu hodnotu v porovnaní s jadrami iných prvkov (28,2937 MeV); preto vznik jadier 4 He z jadier vodíka (protónov) 1 H sprevádza uvoľnenie obrovského množstva energie. Predpokladá sa, že táto jadrová reakcia je:
4 1 H = 4 He + 2p + + 2n
[súčasne so 4 He vznikajú dva pozitróny (β +) a dve neutrína (ν)] slúži ako hlavný zdroj energie pre Slnko a ďalšie jemu podobné hviezdy. Vďaka tomuto procesu sa vo vesmíre hromadia veľmi významné zásoby hélia.
Fyzikálne vlastnosti hélia. Za normálnych podmienok je hélium monatomický plyn, bez farby a zápachu. Hustota 0,17846 g/l, teplota varu -268,93°C, teplota topenia -272,2°C. Tepelná vodivosť (pri 0°C) 143,8·10 -3 W/(cm·K). Polomer atómu hélia stanovený rôznymi metódami sa pohybuje od 0,85 do 1,33 Á. Asi 8,8 ml hélia sa rozpustí v 1 litri vody pri 20°C. Primárna ionizačná energia hélia je väčšia ako energia akéhokoľvek iného prvku - 39,38·10 -13 J (24,58 eV); Hélium nemá afinitu k elektrónom. Kvapalné hélium, pozostávajúce iba zo 4 He, vykazuje množstvo jedinečných vlastností.
Chemické vlastnosti hélia. Doteraz sa pokusy získať stabilné chemické zlúčeniny hélia skončili neúspechom.
Získanie hélia. V priemysle sa hélium získava zo zemných plynov obsahujúcich hélium (v súčasnosti sa využívajú najmä ložiská s obsahom > 0,1 % hélia). Hélium sa oddeľuje od ostatných plynov hlbokým chladením, pričom sa využíva skutočnosť, že skvapalňuje ťažšie ako všetky ostatné plyny.
Aplikácia hélia. Vďaka svojej inertnosti je hélium široko používané na vytvorenie ochrannej atmosféry pri tavení, rezaní a zváraní aktívnych kovov. Hélium je menej elektricky vodivé ako iný inertný plyn, argón, a preto elektrický oblúk v atmosfére hélia vytvára vyššie teploty, čo výrazne zvyšuje rýchlosť oblúkového zvárania. Vďaka nízkej hustote v kombinácii s nehorľavosťou sa hélium používa na plnenie stratosférických balónov. Vysoká tepelná vodivosť hélia, jeho chemická inertnosť a extrémne nízka schopnosť vstúpiť do jadrovej reakcie s neutrónmi umožňuje použitie hélia na chladenie jadrových reaktorov. Kvapalné hélium je najchladnejšia kvapalina na Zemi a slúži ako chladivo v rôznych vedeckých výskumoch. Jedna z metód na určenie ich absolútneho veku je založená na stanovení obsahu hélia v rádioaktívnych mineráloch. Vzhľadom na to, že hélium je veľmi zle rozpustné v krvi, používa sa ako zložka umelého vzduchu dodávaného na dýchanie potápačom (náhrada dusíka héliom zabraňuje vzniku dekompresnej choroby). Študujú sa aj možnosti využitia hélia v atmosfére kabíny kozmickej lode.
Hélium je tekuté. Relatívne slabá interakcia atómov hélia spôsobuje, že zostáva plynné pri nižších teplotách ako ktorýkoľvek iný plyn. Maximálna teplota, pod ktorou je možné ho skvapalniť (jeho kritická teplota Tk) je 5,20 K. Kvapalné hélium je jediná nemrznúca kvapalina: pri normálnom tlaku zostáva hélium kvapalné pri ľubovoľne nízkych teplotách a tuhne až pri tlakoch nad 2. 5 Mn /m2 (25 at).
Hélium je chemický prvok so symbolom He a atómovým číslom 2. Je to bezfarebný, bez zápachu, bez chuti, netoxický, inertný, monatomický plyn, prvý v skupine vzácnych plynov v periodickej tabuľke. Jeho bod varu je najnižší zo všetkých prvkov. Po vodíku je hélium druhým najľahším a druhým najrozšírenejším prvkom v pozorovateľnom vesmíre, ktorý tvorí približne 24 % celkovej hmotnosti prvkov, čo je viac ako 12-násobok hmotnosti všetkých ťažších prvkov dohromady. Jeho hojnosť je spôsobená veľmi vysokou jadrovou väzbovou energiou (na nukleón) hélia-4 v porovnaní s nasledujúcimi tromi prvkami po héliu. Táto väzbová energia hélia-4 tiež vysvetľuje, prečo je hélium produktom jadrovej fúzie a rádioaktívneho rozpadu. Väčšina hélia vo vesmíre je vo forme hélia-4 a predpokladá sa, že vzniklo počas Veľkého tresku. Veľké množstvo nového hélia vzniká jadrovou fúziou vodíka vo hviezdach. Hélium je pomenované po gréckom bohu slnka Héliovi. Hélium bolo prvýkrát objavené ako neznáma žltá spektrálna čiara v slnečnom svetle počas zatmenia Slnka v roku 1868 Georgesom Rayetom, kapitánom C.T. Haig, Norman R. Pogson a poručík John Herschel.
Toto pozorovanie následne potvrdil francúzsky astronóm Jules Janssen. Janssenovi sa často pripisuje objav tohto prvku spolu s Normanom Lockyerom. Janssen zaznamenal spektrálnu čiaru hélia počas zatmenia Slnka v roku 1868, zatiaľ čo Lockyer pozoroval jav z Británie. Lockyer ako prvý naznačil, že táto línia je spojená s novým prvkom, ktorému dal názov hélium. Formálny objav prvku urobili v roku 1895 dvaja švédski chemici, Per Theodor Cleave a Niels Abraham Langlet, ktorí objavili hélium pochádzajúce z kleveitu uránovej rudy. V roku 1903 boli v niektorých častiach USA objavené veľké zásoby hélia v ložiskách zemného plynu. Dnes sú USA najväčším dodávateľom plynu. Kvapalné hélium sa používa v kryogenike (jeho najväčšie jednorazové použitie, spotrebuje asi štvrtinu produkcie), najmä pri chladení supravodivých magnetov, pričom hlavné komerčné využitie je v MRI skeneroch. Ďalšie priemyselné využitie hélia je ako tlakový a čistiaci plyn, ako ochranná atmosféra pri oblúkovom zváraní a v procesoch, ako je rast kryštálov na výrobu kremíkových plátkov. Známe, ale menej významné využitie hélia je ako zdvíhací plyn pre balóny a vzducholode. Ako pri každom plyne, ktorého hustota sa líši od hustoty vzduchu, vdýchnutie malého objemu hélia dočasne zmení farbu a kvalitu ľudského hlasu. Vo vedeckom výskume je správanie dvoch kvapalných fáz hélia-4 (hélium I a hélium II) dôležité pre výskumníkov, ktorí študujú kvantovú mechaniku (najmä vlastnosť supratekutosti) a pre vedcov, ktorí študujú javy, ako je supravodivosť v hmote blízko absolútnej nuly. . Na Zemi je hélium pomerne zriedkavé – 5,2 ppm. podľa objemu v atmosfére. Dnes sa väčšina hélia prítomného na Zemi vytvára prirodzeným rádioaktívnym rozpadom ťažkých rádioaktívnych prvkov (tória a uránu, hoci existujú aj iné príklady), keďže alfa častice emitované takýmito rozpadmi sú zložené z jadier hélia-4. Toto rádiogénne hélium sa zachytáva v zemnom plyne v koncentráciách do 7 % objemu, z ktorého sa komerčne získava nízkoteplotnou separáciou nazývanou frakčná destilácia. Pozemské hélium bývalo neobnoviteľným zdrojom, pretože po uvoľnení do atmosféry mohlo ľahko cestovať do vesmíru a predpokladalo sa, že prvok je čoraz vzácnejší. Nedávny výskum však naznačuje, že hélium, ktoré vzniklo na Zemi z rádioaktívneho rozpadu, sa môže zhromažďovať v zásobách zemného plynu vo väčších množstvách, ako sa očakávalo, v niektorých prípadoch sa uvoľňuje vulkanickou činnosťou.
Príbeh
Vedecké objavy
Prvý dôkaz o existencii hélia bol urobený 18. augusta 1868. V spektre slnečnej chromosféry bola pozorovaná jasne žltá čiara s vlnovou dĺžkou 587,49 nanometrov. Túto čiaru objavil francúzsky astronóm Jules Janssen počas úplného zatmenia Slnka v Gunture v Indii. Táto línia bola pôvodne považovaná za sodík. 20. októbra toho istého roku anglický astronóm Norman Lockyer pozoroval žltú čiaru v spektre Slnka, ktorú nazval Fraunhoferova čiara D3, pretože bola blízko k známym čiaram sodíka D1 a D2. Vedec dospel k záveru, že túto líniu spôsobil prvok Slnka, na Zemi neznámy. Lockyer a anglický chemik Edward Frankland pomenovali prvok z gréckeho slova pre slnko, ἥλιος (helios). V roku 1881 taliansky fyzik Luigi Palmieri prvýkrát objavil na Zemi hélium prostredníctvom jeho spektrálnej čiary D3, pričom analyzoval materiál, ktorý sublimoval počas erupcie Vezuvu. 26. marca 1895 škótsky chemik Sir William Ramsay izoloval hélium na Zemi tak, že minerál cleveit (rozsah uraninitov s najmenej 10 % prvkov vzácnych zemín) ošetril minerálnymi kyselinami. Ramsay hľadal argón, ale po oddelení dusíka a kyslíka od plynu produkovaného kyselinou sírovou si všimol jasne žltú čiaru, ktorá sa zhodovala s čiarou D3 v spektre Slnka. Tieto vzorky identifikoval Lockyear a britský fyzik William Crookes ako hélium. Hélium nezávisle izolovali z kleveitu v tom istom roku chemici Per Theodor Kleve a Abraham Langlet v Uppsale vo Švédsku, ktorí zhromaždili dostatok plynu na presné určenie jeho atómovej hmotnosti. Hélium pred Ramseyho objavom izoloval aj americký geochemik William Francis Hillebrand, keď si pri testovaní vzorky minerálu uraninit všimol nezvyčajné spektrálne čiary. Hillebrand však tieto čiary pripisoval dusíku. V roku 1907 Ernest Rutherford a Thomas Royds demonštrovali, že častice alfa sú jadrá hélia tým, že časticiam umožnili preniknúť cez tenkú sklenenú stenu vákuovej trubice a potom v trubici vytvorili výboj na štúdium spektier nového plynu vo vnútri. V roku 1908 hélium prvýkrát skvapalnil holandský fyzik Heike Kamerlingh Onnes ochladením plynu na teplotu nižšiu ako jeden kelvin. Pokúsil sa spevniť plyn ďalším znižovaním teploty, ale nepodarilo sa mu to, pretože hélium nestuhne pri atmosférickom tlaku. Onnesov študent, Willem Hendrik Keesom, nakoniec dokázal v roku 1926 spôsobiť stuhnutie 1 cm3 hélia pridaním dodatočného vonkajšieho tlaku. V roku 1938 ruský fyzik Pyotr Leonidovič Kapitsa zistil, že hélium-4 nemá prakticky žiadnu viskozitu pri teplotách blízkych absolútnej nule, jav, ktorý sa dnes nazýva supratekutosť. Tento jav je spojený s Bose-Einsteinovou kondenzáciou. V roku 1972 bol rovnaký jav pozorovaný pre hélium-3, ale pri teplotách oveľa bližších absolútnej nule, americkí fyzici Douglas D. Osheroff, David M. Lee a Robert C. Richardson. Predpokladá sa, že jav v héliu-3 je spôsobený párovaním fermiónov hélia-3 za vzniku bozónov, analogických Cooperovým párom elektrónov, ktoré produkujú supravodivosť.
Extrakcia a použitie
Po ťažbe ropy v roku 1903 vyrobil Dexter v Kansase plynový gejzír, ktorý nehorel, a štátny geológ z Kansasu, Erasmus Haworth, zozbieral vzorky unikajúceho plynu a odviezol ich na Kansaskú univerzitu v Lawrence, kde s pomocou chemikov Hamiltona Cadyho a Davida McFarlanda zistil, že plyn pozostáva zo 72 % dusíka, 15 % metánu (percento horľavosti s dostatkom kyslíka), 1 % vodíka a 12 % neidentifikovateľného plynu. Po ďalšej analýze Cady a McFarland zistili, že 1,84 % vzorky plynu bolo hélium. To ukázalo, že napriek svojej všeobecnej vzácnosti na Zemi sa hélium koncentrovalo vo veľkých množstvách pod americkými Veľkými pláňami, ktoré bolo k dispozícii na ťažbu ako vedľajší produkt zemného plynu. To umožnilo Spojeným štátom stať sa popredným svetovým dodávateľom hélia. Na základe návrhu Sira Richarda Threlfalla, námorníctvo Spojených štátov amerických sponzorovalo počas prvej svetovej vojny tri malé experimentálne héliové závody. Cieľom bolo dodať barážovým balónom nehorľavý plyn ľahší ako vzduch. Počas tohto programu sa vyrobilo 5 700 m3 (200 000 kubických stôp) 92 % hélia, hoci predtým sa vyrobilo menej ako jeden kubický meter tohto plynu. Časť tohto plynu bola použitá v prvej héliovej vzducholodi na svete, C-7 amerického námorníctva, ktorá uskutočnila svoju prvú plavbu z Hampton Roads vo Virgínii na Bolling Field vo Washingtone, D.C., 1. decembra 1921, takmer dva roky pred tým. bola postavená prvá tuhá vzducholoď naplnená héliom v septembri 1923 v závode Shenandoah. Hoci v tom čase nebol vyvinutý proces extrakcie pomocou nízkoteplotného skvapalňovania plynu, výroba pokračovala aj počas 1. svetovej vojny. Hélium sa primárne používalo ako nosný plyn v lietadlách ľahších ako vzduch. Počas druhej svetovej vojny vzrástol dopyt po héliu ako zdvíhacom plyne a po zváraní v ochrannej atmosfére. Héliový hmotnostný spektrometer mal veľký význam aj v projekte Manhattan (kódový názov pre prácu na vytvorení prvej atómovej bomby v USA počas druhej svetovej vojny). Vláda Spojených štátov amerických zriadila Národnú rezervu hélia v roku 1925 v Amarille v Texase na účely zásobovania vojenských vzducholodí v čase vojny a komerčných vzducholodí v čase mieru. Kvôli zákonu o kontrole hélia (1927), ktorý zakazoval vývoz vzácneho hélia, na ktorého výrobu mali vtedy monopol Spojené štáty americké, spolu s prohibičnou cenou plynu, bol Hindenburg, rovnako ako všetky nemecké zeppeliny, nútený používať vodík ako zdvíhací plyn. Trh s héliom bol po 2. svetovej vojne potlačený, ale v 50. rokoch boli zásoby rozšírené, aby poskytovalo tekuté hélium ako chladivo na výrobu kyslíkovodíkového raketového paliva (okrem iného použitia) počas vesmírnych pretekov a studenej vojny. Spotreba hélia v Spojených štátoch v roku 1965 bola viac ako osemnásobkom najvyššej spotreby počas vojny. Na základe dodatkov k zákonu o héliu z roku 1960 (Public Law 86-777) založil Úrad Spojených štátov amerických päť súkromných závodov na získavanie hélia zo zemného plynu. Pre tento program ochrany hélia úrad postavil 425-míľový (684-kilometrový) plynovod z Bushtonu v Kansase, aby spojil tieto elektrárne s čiastočne vyčerpaným vládnym plynovým poľom Cliffside neďaleko Amarillo v Texase. Táto zmes hélia a dusíka sa vstrekovala a skladovala v plynovom poli Cliffside, kým to nebolo potrebné, počas tejto doby sa ďalej čistila. Do roku 1995 sa vyzbierala miliarda kubických metrov plynu a rezerva predstavovala dlh vo výške 1,4 miliardy dolárov, čo prinútilo Kongres Spojených štátov rezervu v roku 1996 odstrániť. Zákon o privatizácii hélia z roku 1996 (Public Law 104-273) núti Ministerstvo vnútra Spojených štátov amerických uvoľniť rezervu a začať predaj v roku 2005. Hélium vyrobené v rokoch 1930 až 1945 malo približne 98,3 % čistotu (2 % dusíka), čo postačovalo pre vzducholode. V roku 1945 sa vyrábalo malé množstvo 99,9% hélia na zváranie. Do roku 1949 boli dostupné komerčné množstvá 99,95 % hélia triedy A. Spojené štáty americké dlhé roky vyrábali viac ako 90 % komerčne využívaného hélia na svete, zvyšok vyrábali banské závody v Kanade, Poľsku, Rusku a ďalších krajinách. V polovici 90. rokov začal fungovať nový závod v Argeve v Alžírsku s produkciou 17 miliónov kubických metrov (600 miliónov kubických stôp hélia) s dostatočnou produkciou na pokrytie všetkých potrieb Európy. Medzitým sa do roku 2000 spotreba hélia v Spojených štátoch zvýšila na viac ako 15 miliónov kg ročne. V rokoch 2004-2006 boli postavené ďalšie závody v Ras Laffan v Katare a Skikda v Alžírsku. Alžírsko sa rýchlo stalo druhým popredným výrobcom hélia. Počas tejto doby sa zvýšila spotreba hélia aj náklady na výrobu hélia. Od roku 2002 do roku 2007 Ceny hélia sa zdvojnásobili. Od roku 2012 predstavovala americká národná rezerva hélia 30 percent svetových zásob hélia. Očakáva sa, že rezerva sa vyčerpá v roku 2018. Napriek tomu by navrhovaná legislatíva v Senáte Spojených štátov umožnila rezerve pokračovať v predaji plynu. Ďalšie veľké zásoby hélia sa nachádzali v štáte Hugoton v Kansase v USA a v neďalekých plynových poliach v Kansase, ako aj v Texase a Oklahome. Nové héliové závody sa mali otvoriť v roku 2012 v Katare, Rusku a americkom štáte Wyoming, neočakávalo sa však, že by zmiernili nedostatok hélia. V roku 2013 sa začala výstavba najväčšieho závodu na výrobu hélia na svete v Katare. Rok 2014 bol po rokoch nedostatku hélia všeobecne považovaný za rok nadmernej ponuky v odvetví hélia.
Charakteristika
Atóm hélia
Hélium v kvantovej mechanike
Z hľadiska kvantovej mechaniky je hélium po atóme vodíka druhým najjednoduchším atómom na modelovanie. Hélium pozostáva z dvoch elektrónov v atómových orbitáloch obklopujúcich jadro obsahujúce dva protóny a (zvyčajne) dva neutróny. Rovnako ako v newtonovskej mechanike, žiadny systém pozostávajúci z viac ako dvoch častíc nemožno vyriešiť pomocou presného analytického matematického prístupu a hélium nie je výnimkou. Preto sú potrebné numerické matematické metódy, dokonca aj na riešenie systému pozostávajúceho z jedného jadra a dvoch elektrónov. Takéto techniky výpočtovej chémie sa použili na vytvorenie kvantovo-mechanického obrazu elektronickej väzby hélia, ktorý je presný na menej ako 2 % správnej hodnoty vo viacerých výpočtových krokoch. Takéto modely ukazujú, že každý elektrón v héliu čiastočne chráni jedno jadro pred druhým, takže efektívny jadrový náboj Z, ktorý každý elektrón vidí, je asi 1,69 jednotiek, a nie 2 náboj klasického „nahého“ jadra hélia.
Relatívna stabilita jadra hélia-4 a elektrónového obalu
Jadro atómu hélia-4 je identické s časticou alfa. Experimenty s vysokoenergetickým rozptylom elektrónov ukazujú, že jeho náboj exponenciálne klesá od maxima v centrálnom bode, rovnako ako hustota náboja vlastného elektrónového oblaku hélia. Táto symetria odráža podobnú základnú fyziku: pár neutrónov a pár protónov v jadre hélia sa riadi rovnakými kvantovými mechanickými pravidlami ako pár elektrónov hélia (hoci jadrové častice podliehajú odlišnému jadrovému väzbovému potenciálu), takže všetky z týchto fermiónov úplne zaberajú 1s orbitály v pároch a ani jeden z nich nemá orbitálnu hybnosť a každý z nich ruší svoj vlastný spin. Pridanie ktorejkoľvek inej z týchto častíc by vyžadovalo uhlovú hybnosť a uvoľnilo by podstatne menej energie (v skutočnosti žiadne jadro s piatimi nukleónmi nie je stabilné). Takže táto schéma je energeticky extrémne stabilná pre všetky tieto častice a táto stabilita vysvetľuje veľa dôležitých faktov o héliu v prírode. Napríklad stabilita a nízky energetický stav elektrónového oblaku v héliu vysvetľuje chemickú inertnosť prvku, ako aj nedostatočnú vzájomnú interakciu atómov hélia, čím sa vytvárajú najnižšie teploty topenia a varu zo všetkých prvkov. Podobne špeciálna energetická stabilita jadra hélia-4, vytvorená podobnými účinkami, vysvetľuje jednoduchosť výroby hélia-4 v atómových reakciách, ktoré zahŕňajú buď uvoľňovanie ťažkých kovov alebo ich syntézu. Určité stabilné hélium-3 (2 protóny a 1 neutrón) sa vyrába pri fúznych reakciách z vodíka, ale toto množstvo je veľmi malé v porovnaní s vysoko citlivou energiou hélia-4. Nezvyčajná stabilita jadra hélia-4 je dôležitá aj z kozmologického hľadiska: vysvetľuje skutočnosť, že v prvých minútach po Veľkom tresku, počas vytvárania „zápary voľných protónov a neutrónov“, ktoré pôvodne vznikali v pomere asi 6:1, ochladené do takej miery, že bola možná jadrová väzba, takmer všetky vytvorené prvé zložené atómové jadrá boli jadrá hélia-4. Väzba hélia-4 bola taká tesná, že produkcia hélia-4 spotrebovala takmer všetky voľné neutróny v priebehu niekoľkých minút predtým, ako sa mohli beta-rozpadnúť, pričom zostalo len málo na vytvorenie ťažších atómov, ako je lítium, berýlium alebo bór. Jadrová väzba hélia-4 na nukleón je silnejšia ako u ktoréhokoľvek z týchto prvkov, a preto, keď sa hélium vytvorilo, neexistovala žiadna energetická hnacia sila na vytvorenie prvkov 3, 4 a 5. Pre hélium bolo málo energeticky prospešné fúzovať do ďalšieho prvku s menšou energiou na nukleón, uhlíka. Avšak kvôli nedostatku medziľahlých prvkov si tento proces vyžaduje, aby sa tri jadrá hélia navzájom takmer súčasne zrazili. V minútach po Veľkom tresku teda nebol čas na to, aby sa vytvorilo značné množstvo uhlíka, kým sa skorý expandujúci vesmír ochladil na teplotu a tlak, pri ktorých by fúzia hélia s uhlíkom nebola možná. Z tohto dôvodu mal raný vesmír pomer vodík/hélium podobný dnešnému (hmotnostné 3 diely vodíka na 1 diel hélia-4), pričom takmer všetky neutróny vo vesmíre zachytilo hélium-4. Všetky ťažšie prvky (vrátane prvkov potrebných pre skalnaté planéty ako Zem a pre formy života na báze uhlíka alebo iné formy života) teda vznikli po Veľkom tresku vo hviezdach, ktoré boli dostatočne horúce na to, aby roztavili samotné hélium. Všetky prvky okrem vodíka a hélia dnes tvoria len 2 % hmotnosti atómovej hmoty vo vesmíre. Naproti tomu hélium-4 tvorí asi 23 % bežnej hmoty vesmíru – takmer všetku obyčajnú hmotu, ktorá nie je vodíkom.
Plynná a plazmová fáza
Hélium je druhý najmenej reaktívny vzácny plyn po neóne, a preto druhý najmenej reaktívny zo všetkých prvkov. Je inertný a monoatomický za všetkých štandardných podmienok. Kvôli relatívne nízkej molárnej (atómovej) hmotnosti hélia sú jeho tepelná vodivosť, merná tepelná kapacita a rýchlosť zvuku v plynnej fáze väčšie ako u akéhokoľvek iného plynu okrem vodíka. Z týchto dôvodov a kvôli malej veľkosti molekúl monoatomického hélia hélium difunduje pevnými časticami rýchlosťou, ktorá je trikrát väčšia ako rýchlosť vzduchu a asi 65 % rýchlosti vodíka. Hélium je vo vode najmenej rozpustný monatomický plyn a jeden z menej vo vode rozpustných plynov (CF4, SF6 a C4F8 majú nižšie molárne rozpustnosti: 0,3802, 0,4394 a 0,2372 x2/10-5 v porovnaní s 0,70797 x2/10-5 5 pre hélium ), okrem toho je index lomu hélia bližšie k jednotke ako index lomu akéhokoľvek iného plynu. Hélium má negatívny Joule-Thomsonov koeficient pri normálnych teplotách okolia, čo znamená, že sa zahrieva, keď sa nechá voľne expandovať. Tesne pod svojou teplotou Joule-Thomsonovej inverzie (asi 32 až 50 K pri 1 atmosfére) sa hélium ochladzuje, keď sa voľne rozpína. Po podchladení pod túto teplotu môže byť hélium skvapalnené chladením. Väčšina mimozemského hélia je v plazmovom stave a má vlastnosti úplne odlišné od vlastností atómového hélia. V plazme nie sú elektróny hélia viazané na jeho jadro, čo vedie k veľmi vysokej elektrickej vodivosti, aj keď je plyn len čiastočne ionizovaný. Nabité častice sú silne ovplyvnené magnetickými a elektrickými poľami. Napríklad v slnečnom vetre spolu s ionizovaným vodíkom častice interagujú s magnetosférou Zeme, čo vedie k Birkelandovým prúdom a polárnej žiare.
Kvapalné hélium
Na rozdiel od akéhokoľvek iného prvku zostane hélium pri normálnom tlaku kvapalné až do absolútnej nuly. Toto je priamy vplyv kvantovej mechaniky: najmä energia nulového bodu systému je príliš vysoká na to, aby umožnila zmrazenie. Pevné hélium vyžaduje teplotu 1-1,5 K (asi -272 °C alebo -457 °F) pri tlaku asi 25 barov (2,5 MPa). Často je ťažké rozlíšiť pevné od tekutého hélia, pretože index lomu týchto dvoch fáz je takmer rovnaký. Pevná látka má zreteľnú teplotu topenia a kryštalickú štruktúru, ale je vysoko stlačiteľná; tlak v laboratóriu môže znížiť jeho objem o viac ako 30%. S objemovým modulom približne 27 MPa je hélium 100-krát stlačiteľnejšie ako voda. Pevné hélium má hustotu 0,214 ± 0,006 g/cm3 pri 1,15 K a 66 atm; predpokladaná hustota pri 0 K a 25 baroch (2,5 MPa) je 0,187 ± 0,009 g/cm3. Pri vyšších teplotách hélium pri dostatočnom tlaku stuhne. Pri izbovej teplote to vyžaduje asi 114 000 atm.
Stav hélia I
Izotopové hélium-4 pod bodom varu 4,22 kelvina a nad jeho bodom lambda 2,1768 kelvina existuje v normálnom bezfarebnom kvapalnom stave nazývanom hélium I. Podobne ako iné kryogénne kvapaliny, hélium I vrie, keď sa zahrieva a sťahuje sa, keď jeho teplota klesá. . Avšak pod bodom lambda hélium nevrie a pri ďalšom poklese teploty sa rozpína. Hélium I má plynný index lomu 1,026, vďaka čomu je jeho povrch tak ťažko viditeľný, že na zobrazenie jeho povrchu sa často používajú vyskakovacie polystyrénové peny. Táto bezfarebná kvapalina má veľmi nízku viskozitu a hustotu 0,145-0,125 g/ml (asi 0-4 K), čo je len štvrtina hodnoty očakávanej z klasickej fyziky. Na vysvetlenie tejto vlastnosti je potrebná kvantová mechanika, a preto sa oba stavy kvapalného hélia (hélium I a hélium II) nazývajú kvantové kvapaliny, čo znamená, že v makroskopickom meradle vykazujú atómové vlastnosti. Môže to byť spôsobené tým, že bod varu hélia je tak blízko absolútnej nule, že bráni náhodnému molekulárnemu pohybu (tepelnej energii) maskovať jeho atómové vlastnosti.
Stav hélia II
Kvapalné hélium pod bodom lambda (nazývané hélium II) má veľmi nezvyčajné vlastnosti. Vďaka vysokej tepelnej vodivosti pri vare nebublá, ale vyparuje sa priamo z povrchu. Hélium-3 má tiež supratekutú fázu, ale len pri oveľa nižších teplotách; v dôsledku toho sa o vlastnostiach tohto izotopu vie len málo. Hélium II je supratekutá kvapalina a kvantovo-mechanický stav so zvláštnymi vlastnosťami. Napríklad, keď preteká kapilárami s hrúbkou 10-7 až 10-8 m, nemá merateľnú viskozitu. Keď sa však merania uskutočnili medzi dvoma pohyblivými diskami, pozorovala sa viskozita porovnateľná s viskozitou plynného hélia. Súčasná teória to vysvetľuje pomocou dvojkvapalného modelu pre hélium II. V tomto modeli sa predpokladá, že kvapalné hélium pod bodom lambda obsahuje časť atómov hélia v základnom stave, ktoré sú supratekuté a prúdia s nulovou viskozitou, a časť atómov hélia v excitovanom stave, ktoré sa správajú ako obyčajná kvapalina. V tryskacom efekte je skonštruovaná komora, ktorá je spojená so zásobníkom hélia II sintrovaným kotúčom, cez ktorý ľahko preteká supratekuté hélium, ale ktorým neprejde nesupertekuté hélium. Ak sa vnútro nádoby zahreje, supratekuté hélium sa zmení na nesupertekuté hélium. Aby sa udržal rovnovážny podiel supratekutého hélia, supratekuté hélium prúdi a zvyšuje tlak, čo spôsobuje uvoľnenie kvapaliny z nádoby. Tepelná vodivosť hélia II je väčšia ako u ktorejkoľvek inej známej látky, miliónkrát väčšia ako u hélia I a niekoľko stokrát väčšia ako u medi. Je to spôsobené tým, že k tepelnej vodivosti dochádza vďaka výnimočnému kvantovému mechanizmu. Väčšina materiálov, ktoré vedú teplo, má valenčný pás voľných elektrónov, ktoré slúžia na prenos tepla. Hélium II nemá taký valenčný pás, no napriek tomu dobre vedie teplo. Tepelný tok je určený rovnicami, ktoré sú podobné vlnovej rovnici používanej na charakterizáciu šírenia zvuku vo vzduchu. Keď je vystavený teplu, pohybuje sa rýchlosťou 20 metrov za sekundu pri 1,8 K cez hélium II vo forme vĺn v jave známom ako druhý zvuk. Hélium II má tiež plazivý účinok. Keď povrch prechádza cez hladinu hélia II, hélium II sa pohybuje po povrchu proti gravitácii. Hélium II opustí neutesnenú nádobu a bude sa posúvať po stranách, kým nedosiahne teplejšiu oblasť, kde sa odparí. Pohybuje sa v 30 nm hrubom filme bez ohľadu na povrchový materiál. Tento film sa nazýva Rollin film na počesť vedca, ktorý ako prvý charakterizoval túto vlastnosť, Bernarda W. Rollina. V dôsledku tohto "plazivého" správania a schopnosti Hélia II rýchlo pretekať malými otvormi je veľmi ťažké udržať tekuté hélium. Ak nádoba nie je starostlivo skonštruovaná, hélium II sa bude plaziť po povrchu a cez ventily, až kým nedosiahne teplejšiu oblasť, kde sa odparí. Vlny šíriace sa Rollinovým filmom sa riadia rovnakou rovnicou ako gravitačné vlny v plytkej vode, ale namiesto gravitácie je vratnou silou van der Waalsova sila. Tieto vlny sú známe ako tretí zvuk.
Izotopy
Existuje deväť známych izotopov hélia, ale iba hélium-3 a hélium-4 sú stabilné. V zemskej atmosfére je jeden atóm 3He na milión atómov 4He. Na rozdiel od väčšiny prvkov sa izotopové zastúpenie hélia značne líši v dôsledku rôznych procesov tvorby. Najbežnejší izotop, hélium-4, vzniká na Zemi alfa rozpadom ťažších rádioaktívnych prvkov; výsledné alfa častice sú plne ionizované jadrá hélia-4. Hélium-4 je neobvykle stabilné jadro, pretože jeho nukleóny sú usporiadané v úplných obaloch. Vznikol tiež vo veľkých množstvách pri nukleosyntéze veľkého tresku. Hélium-3 je na Zemi prítomné len v stopových množstvách; Väčšina hélia-3 je prítomná od sformovania Zeme, hoci niektoré skončia na Zemi zachytené v kozmickom prachu. Stopové množstvá hélia vznikajú aj rozpadom beta trícia. Horniny v zemskej kôre majú izotopové pomery, ktoré sa menia desaťkrát, a tieto pomery možno použiť na štúdium pôvodu hornín a zloženia zemského plášťa. 3Je oveľa bežnejší vo hviezdach ako produkt jadrovej fúzie. V medzihviezdnom prostredí je teda pomer 3He ku 4He približne 100-krát vyšší ako na Zemi. Mimoplanetárny materiál, ako je lunárny a asteroidný regolit, obsahuje stopové množstvá hélia-3 z bombardovania slnečnými vetrom. Povrch Mesiaca obsahuje hélium-3 v koncentráciách rádovo 10 ppm, čo je oveľa viac ako približne 5 ppm v zemskej atmosfére. Niekoľko vedcov, počnúc Geraldom Kulcinskim v roku 1986, navrhlo preskúmať Mesiac, zbierať lunárny regolit a použiť hélium-3 na fúziu. Kvapalné hélium-4 možno ochladiť na približne 1 kelvin pomocou chladenia odparovaním v nádobe, ktorá dosahuje 1 K. Podobné ochladenie hélia-3 s nižšou teplotou varu môže dosiahnuť približne 0,2 kelvina v chladničke s héliom-3. Rovnaké zmesi kvapalného 3He a 4He s teplotami pod 0,8 K sa v dôsledku svojej odlišnosti rozdelia na dve nemiešateľné fázy (majú rozdielnu kvantovú štatistiku: atómy hélia-4 sú bozóny, zatiaľ čo atómy hélia-3 sú fermióny). V chladiacich strojoch pracujúcich na zmesi kryogénnych látok sa táto nemiešateľnosť využíva na dosiahnutie teplôt niekoľkých milikelvinov. Je možné produkovať exotické izotopy hélia, ktoré sa rýchlo rozpadajú na iné látky. Najkratší ťažký izotop hélia je hélium-5 s polčasom rozpadu 7,6 × 10-22 s. Hélium-6 sa rozpadá vyžarovaním beta častice a má polčas rozpadu 0,8 sekundy. Hélium-7 tiež vyžaruje beta častice, ako aj gama žiarenie. Hélium-7 a hélium-8 vznikajú pri niektorých jadrových reakciách. Je známe, že hélium-6 a hélium-8 majú jadrové halo.
Zlúčeniny hélia
Hélium má valenciu 0 a je chemicky neaktívne za všetkých normálnych podmienok. Hélium je elektrický izolant, pokiaľ nie je ionizované. Rovnako ako iné vzácne plyny, hélium má metastabilné úrovne energie, ktoré mu umožňujú zostať ionizované v elektrickom výboji pri napätí pod jeho ionizačným potenciálom. Hélium môže vytvárať nestabilné zlúčeniny známe ako exciméry s volfrámom, jódom, fluórom, sírou a fosforom, keď je vystavené žeravému výboju, elektrónovému bombardovaniu alebo iným spôsobom redukované na plazmu. Takto vznikli molekulárne zlúčeniny HeNe, HgHe10 a WHe2 a molekulárne ióny He+2, He2+2, HeH+ a HeD+. HeH+ je stabilný aj v základnom stave, ale je extrémne reaktívny – je to najsilnejšia Brønstedova kyselina, a preto môže existovať iba izolovane, pretože protónuje akúkoľvek molekulu alebo protianión, s ktorým príde do kontaktu. Táto metóda tiež vytvorila neutrálnu molekulu He2, ktorá má veľký počet pásových systémov, a HgHe, ktorá sa zdá byť držaná pohromade iba polarizačnými silami. Van der Waalsove héliové zlúčeniny sa môžu tvoriť aj s kryogénnym héliovým plynom a atómami inej látky, ako je LiHe a He2. Je teoreticky možné, že existujú aj iné skutočné zlúčeniny, ako je fluorohydrid hélium (HHeF), ktorý by bol podobný HArF objavenému v roku 2000. Výpočty ukazujú, že dve nové zlúčeniny obsahujúce väzbu hélium-kyslík môžu byť stabilné. Dva nové molekulárne druhy predpovedané pomocou teórie, CsFHeO a N(CH3)4FHeO, sú deriváty metastabilného aniónu FHeO, ktorý prvýkrát navrhla v roku 2005 skupina na Taiwane. Ak sa to potvrdí experimentom, jediným zostávajúcim prvkom bez známych stabilných zlúčenín bude neón. Atómy hélia boli vložené do molekúl dutých uhlíkových štruktúr (fullerénov) zahrievaním pod vysokým tlakom. Vytvorené endoedrické molekuly fullerénu sú stabilné pri vysokých teplotách. Keď sa tvoria chemické deriváty týchto fullerénov, hélium zostáva vo vnútri. Ak sa použije hélium-3, dá sa ľahko pozorovať pomocou héliovej nukleárnej magnetickej rezonančnej spektroskopie. Bolo hlásených veľa fullerénov obsahujúcich hélium-3. Hoci atómy hélia nie sú spojené kovalentnými alebo iónovými väzbami, tieto látky majú určité vlastnosti a určité zloženie, ako všetky stechiometrické chemické zlúčeniny. Pri vysokých tlakoch môže hélium vytvárať zlúčeniny s rôznymi ďalšími prvkami. Kryštály klatrátu hélium-dusík (He(N2)11) rástli pri teplote miestnosti pri tlakoch cca. 10 GPa vo vysokotlakovej komore s diamantovými nákovami. Ukázalo sa, že izolačný elektrolyt Na2He je termodynamicky stabilný pri tlakoch nad 113 GPa. Má fluoritovú štruktúru.
Pôvod a výroba
Prirodzená hojnosť
Aj keď je hélium na Zemi zriedkavé, je to druhý najrozšírenejší prvok v známom vesmíre (po vodíku), ktorý predstavuje 23 % jeho baryónovej hmoty. Prevažná väčšina hélia vznikla nukleosyntézou veľkého tresku jednu až tri minúty po veľkom tresku. Merania jeho množstva teda prispievajú ku kozmologickým modelom. Vo hviezdach vzniká hélium jadrovou fúziou vodíka v protón-protónových reťazových reakciách a CNO cykle, ktorý je súčasťou nukleosyntézy hviezd. V zemskej atmosfére je objemová koncentrácia hélia len 5,2 dielov na milión. Koncentrácia je nízka a pomerne konštantná napriek nepretržitej produkcii nového hélia, pretože väčšina hélia v zemskej atmosfére vstupuje do vesmíru niekoľkými procesmi. V zemskej heterosfére sú najrozšírenejšími prvkami časť hornej atmosféry, hélium a iné ľahšie plyny. Väčšina hélia na Zemi je výsledkom rádioaktívneho rozpadu. Hélium sa vo veľkom množstve nachádza v uránových a tóriových mineráloch vrátane kleveitu, živice, karnotitu a monazitu, pretože uvoľňujú častice alfa (jadrá hélia, He2+), s ktorými sa elektróny okamžite viažu, len čo časticu zastaví kameň. V celej litosfére sa tak vytvorí asi 3000 metrických ton hélia. V zemskej kôre je koncentrácia hélia 8 častí na miliardu. V morskej vode je koncentrácia iba 4 diely na bilión. Malé množstvá hélia sú prítomné aj v minerálnych prameňoch, sopečnom plyne a meteorickom železe. Pretože hélium je zachytené v zemi za podmienok, ktoré zachytávajú aj zemný plyn, najväčšie prirodzené koncentrácie hélia na planéte sa nachádzajú v zemnom plyne, z ktorého sa získava väčšina komerčného hélia. Koncentrácie hélia sa značne líšia, od niekoľkých ppm až po viac ako 7 % v malom plynovom poli v San Juan County v Novom Mexiku. V roku 2011 sa celosvetové zásoby hélia odhadovali na 40 miliárd kubických metrov, pričom štvrtina z týchto zásob sa nachádzala v oblasti plynovo-kondenzátu South Pars/North Dome, ktoré spoločne vlastnia Katar a Irán. V rokoch 2015 a 2016 boli vyhlásené pravdepodobnejšie zásoby v severoamerických Skalistých horách a vo východnej Afrike.
Moderná výroba a distribúcia
Pre použitie vo veľkom sa hélium získava frakčnou destiláciou zo zemného plynu, ktorý môže obsahovať až 7 % hélia. Pretože hélium má nižší bod varu ako ktorýkoľvek iný prvok, nízka teplota a vysoký tlak sa používajú na skvapalnenie takmer všetkých ostatných plynov (hlavne dusíka a metánu). Výsledné surové hélium sa čistí postupnými krokmi znižovania teploty, pričom sa z plynnej zmesi vyzráža takmer všetok zvyšný dusík a iné plyny. Aktívne uhlie sa používa ako konečný krok čistenia, pričom sa typicky vyrába hélium triedy A s čistotou 99,995 %. Hlavnou nečistotou v héliu triedy A je neón. V záverečnej fáze výroby je väčšina vyrobeného hélia skvapalnená kryogénnym procesom. To je nevyhnutné pre aplikácie vyžadujúce tekuté hélium a tiež umožňuje dodávateľom hélia znížiť náklady na prepravu hélia na veľké vzdialenosti, pretože najväčšie kontajnery na tekuté hélium majú viac ako päťkrát väčšiu kapacitu ako najväčšie plynové héliové prívesy. V roku 2008 bolo približne 169 miliónov štandardných metrov kubických hélia vyťažených zo zemného plynu alebo stiahnutých zo zásob hélia, približne 78 % zo Spojených štátov, 10 % z Alžírska a väčšina zvyšku z Ruska, Poľska a Kataru. Do roku 2013 zvýšená produkcia hélia v Katare (RasGas pod Air Liquide) zvýšila podiel Kataru na globálnej produkcii hélia na 25 % a urobila z krajiny druhého najväčšieho vývozcu hélia po Spojených štátoch. Odhaduje sa, že v Tanzánii bolo v roku 2016 objavených asi 54 miliárd kubických stôp (1,5 × 109 m3) hélia. V Spojených štátoch sa väčšina hélia získava zo zemného plynu v Hugotone a neďalekých plynových poliach v Kansase, Oklahoma a Panhandle v Texase. Veľká časť tohto plynu bola kedysi privádzaná potrubím do národnej rezervy hélia, ale táto rezerva bola od roku 2005 vyčerpaná a rozpredaná a očakáva sa, že do roku 2021 bude z veľkej časti vyčerpaná, podľa zákona o zodpovednom héliu a správcovstve, ktorý bol prijatý v októbri 2013 (HR 527). Difúzia surového zemného plynu cez špeciálne polopriepustné membrány a iné bariéry je ďalším spôsobom získavania a čistenia hélia. V roku 1996 Spojené štáty objavili zásoby hélia v takýchto komplexoch plynových vrtov, asi 147 miliárd štandardných kubických stôp (4,2 miliardy SCM). Pri vtedajšom tempe používania (72 miliónov SCM ročne v USA) by v USA bolo dosť hélia, ktoré by vydržalo asi 58 rokov, a menej (možno 80 % času) vo svete, ale faktory ovplyvňujúce ekonomiku a spracovanie ovplyvňujú efektívne ukazovatele rezerv. Hélium sa musí získavať zo zemného plynu, pretože je to len zlomok podielu neónu vo vzduchu, no dopyt po ňom je oveľa väčší. Odhaduje sa, že ak by sa všetky neónové produkty premenili na sklad hélia, pokrylo by sa 0,1 % svetového dopytu po héliu. Podobne len 1 % svetovej potreby hélia možno pokryť preinštalovaním všetkých zariadení na destiláciu vzduchu. Hélium možno syntetizovať bombardovaním lítia alebo bóru vysokorýchlostnými protónmi alebo bombardovaním lítia deuterónmi, ale tieto procesy sú úplne neekonomické. Hélium je komerčne dostupné buď v kvapalnej alebo plynnej forme. Ako kvapalina sa môže dodávať v malých izolovaných nádobách nazývaných dewars, ktoré pojmú až 1 000 litrov hélia, alebo vo veľkých nádobách ISO, ktoré majú nominálnu kapacitu až 42 m3 (asi 11 000 amerických galónov). V plynnej forme sa malé množstvá hélia predávajú vo vysokotlakových fľašiach s objemom až 8 m3 (asi 282 štandardných kubických stôp) hélia, zatiaľ čo veľké množstvá vysokotlakového plynu sa dodávajú v rúrkových návesoch s kapacitou 4 860 m3. (asi 172 000 štandardných kubických stôp) hélia. kubických stôp).
Héliová bezpečnostná ochrana
Podľa zástancov ochrany hélia, akým je napríklad fyzik Robert Coleman Richardson, nositeľ Nobelovej ceny, píšuci v roku 2010, cena hélia na voľnom trhu prispela k jeho „plytvaniu“ využívaním (napríklad v prípade héliových balónov). V roku 2000 boli ceny znížené rozhodnutím Kongresu USA predať veľké zásoby hélia v krajine do roku 2015. Cena by sa musela vynásobiť 20, aby sa eliminovalo nadmerné vyčerpanie hélia, povedal Richardson. Nuttall, Clarke & Glowacki (2012) vo svojej knihe The Future of Helium as a Natural Resource (Routledge, 2012) tiež navrhli vytvorenie Medzinárodnej agentúry pre hélium (IHA), ktorá by vytvorila udržateľný trh pre túto vzácnu komoditu.
Oblasti použitia
Zatiaľ čo balóny sú možno najznámejším spôsobom využitia hélia, tvoria malú časť všetkého použitia hélia. Hélium sa používa na mnohé účely, ktoré si vyžadujú niektoré z jeho jedinečných vlastností, ako je nízky bod varu, nízka hustota, nízka rozpustnosť, vysoká tepelná vodivosť alebo inertnosť. Z celkovej svetovej produkcie hélia v roku 2014, asi 32 miliónov kg (180 miliónov štandardných metrov kubických) hélia ročne, sa najväčšie využitie (asi 32 % z celkovej produkcie v roku 2014) využíva v kryogénnych aplikáciách, z ktorých väčšina zahŕňa chladenie supravodivých magnetov v medicíne. MRI skenery a NMR spektrometre. Ďalšími hlavnými aplikáciami boli tlakové a preplachovacie systémy, zváranie, udržiavanie kontrolovanej atmosféry a detekcia netesností. Ostatné použitia podľa kategórie predstavovali relatívne malé časti.
Riadené atmosféry
Hélium sa používa ako ochranný plyn pri pestovaní kryštálov kremíka a germánia, pri výrobe titánu a zirkónu a v plynovej chromatografii, pretože je inertné. Pre svoju inertnosť, tepelnú a kaloricky dokonalú povahu, vysokú rýchlosť zvuku a vysoký pomer tepelnej kapacity je použiteľný aj v nadzvukových aerodynamických tuneloch a impulzných elektrárňach.
Zváranie plynovým volfrámovým oblúkom
Hélium sa používa ako ochranný plyn pri procesoch oblúkového zvárania materiálov, ktoré sú pri teplotách zvárania znečistené a oslabené vzduchom alebo dusíkom. Oblúkové zváranie plynovým volfrámom používa celý rad inertných ochranných plynov, ale namiesto lacného argónu používa hélium, najmä pre zváracie materiály s vyššou tepelnou vodivosťou, ako je hliník alebo meď.
Menej bežné použitie
Priemyselná detekcia úniku
Jedným z priemyselných využití hélia je detekcia netesností. Pretože hélium difunduje cez pevné látky trikrát rýchlejšie ako vzduch, používa sa ako sledovací plyn na detekciu únikov vo vysokovákuových zariadeniach (ako sú kryogénne nádrže) a vysokotlakových nádobách. Testovaná látka sa umiestni do komory, ktorá sa potom evakuuje a naplní héliom. Hélium, ktoré prejde netesnosťou, je detekované citlivým zariadením (héliový hmotnostný spektrometer) už pri rýchlosti úniku 10-9 mbar l/s (10-10 Pa m3/s). Postup merania sa zvyčajne vykonáva automaticky a nazýva sa integrálny héliový test. Jednoduchým postupom je naplniť testovaný objekt héliom a hľadať netesnosti manuálne pomocou ručného zariadenia. Únik hélia cez trhliny by sa nemal zamieňať s prienikom plynu cez sypký materiál. Zatiaľ čo hélium má zdokumentované konštanty permeácie (teda odhadované rýchlosti permeácie) cez sklá, keramiku a syntetické materiály, vzácne plyny, ako je hélium, nepreniknú cez väčšinu veľkých kovov.
Lietanie
Pretože hélium je ľahšie ako vzduch, vzducholode a balóny sú čerpané týmto plynom, aby ich zdvihli do vzduchu. Zatiaľ čo plynný vodík je schopnejší priľnúť k povrchu a preniká membránou pomalšie, hélium má tú výhodu, že je nehorľavé a skutočne spomaľuje horenie. Ďalšie menšie využitie hélia je v raketách, kde sa hélium používa ako vzduchový vankúš na nahradenie paliva a oxidačných činidiel v skladovacích nádržiach a na kondenzáciu vodíka a kyslíka na výrobu raketového paliva. Používa sa tiež na čistenie paliva a okysličovadla z pozemných podporných zariadení pred štartom a na predchladenie kvapalného vodíka na kozmickej lodi. Napríklad raketa Saturn V použitá v programe Apollo potrebovala na štart asi 370 000 m3 (13 miliónov kubických stôp) hélia.
Menšie komerčné a rekreačné využitie
Hélium ako dýchací plyn nemá žiadne narkotické vlastnosti, preto sa na hĺbkové potápanie používajú héliové zmesi ako Trimix, Heliox a Heliair, aby sa znížili účinky anestézie, ktoré sa s narastajúcou hĺbkou zhoršujú. So zvyšujúcim sa tlakom v hĺbke sa zvyšuje aj hustota dýchacieho plynu a nízka molekulová hmotnosť hélia výrazne znižuje námahu pri dýchaní, čím sa znižuje hustota zmesi. Tým sa znižuje počet Reynoldsových prúdov, čo má za následok menej turbulentné prúdenie a viac laminárne prúdenie, ktoré vyžaduje menej práce na dýchanie. V hĺbkach pod 150 metrov (490 stôp) potápači inhalujúci zmesi hélia a kyslíka začínajú pociťovať chvenie a zníženú psychomotorickú funkciu, nervový syndróm spôsobený vysokým krvným tlakom. Do určitej miery môže byť tento účinok uľahčený pridaním niektorých narkotických plynov, ako je vodík alebo dusík, do zmesi hélia a kyslíka. Hélium-neónové lasery, typ nízkovýkonného plynového lasera, ktorý vytvára červený lúč, mali rôzne praktické aplikácie, vrátane čítačiek čiarových kódov a laserových ukazovátok, predtým, než boli takmer všeobecne nahradené lacnejšími diódovými lasermi. Kvôli svojej inertnosti a vysokej tepelnej vodivosti, priehľadnosti neutrónov a nedostatočnej tvorbe rádioaktívnych izotopov v podmienkach reaktora sa hélium používa ako chladivo v niektorých plynom chladených jadrových reaktoroch. Hélium zmiešané s ťažším plynom, ako je xenón, je užitočné na termoakustické chladenie kvôli výslednému vysokému koeficientu tepelnej kapacity a nízkemu Prandtlovmu číslu. Zotrvačnosť hélia má environmentálne výhody v porovnaní s tradičnými chladiacimi systémami, ktoré prispievajú k poškodzovaniu ozónovej vrstvy alebo globálnemu otepľovaniu. Hélium sa používa aj v niektorých pevných diskoch.
Vedecké aplikácie
Použitie hélia znižuje skresľujúce účinky teplotných zmien v priestore medzi šošovkami v niektorých ďalekohľadoch kvôli jeho extrémne nízkemu indexu lomu. Táto metóda sa používa najmä v solárnych teleskopoch, kde by vákuovo izolovaná trubica ďalekohľadu bola príliš ťažká. Hélium je široko používaný nosný plyn pre plynovú chromatografiu. Vek hornín a minerálov obsahujúcich urán a tórium možno odhadnúť meraním hladín hélia v procese známom ako héliové datovanie. Hélium pri nízkych teplotách sa používa v kryogenike a niektorých kryogenických aplikáciách. Ako príklady takýchto aplikácií sa kvapalné hélium používa na chladenie niektorých kovov na extrémne nízke teploty potrebné pre supravodivosť, ako napríklad v supravodivých magnetoch na zobrazovanie magnetickou rezonanciou. Veľký hadrónový urýchľovač v CERN používa 96 metrických ton tekutého hélia na udržanie teploty 1,9 kelvina.
Inhalácia a bezpečnosť
Účinky
Neutrálne hélium je za štandardných podmienok netoxické, nehrá žiadnu biologickú úlohu a nachádza sa v stopových množstvách v ľudskej krvi. Rýchlosť zvuku v héliu je takmer trojnásobkom rýchlosti zvuku vo vzduchu. Pretože základná frekvencia plynom naplnenej dutiny je úmerná rýchlosti zvuku v plyne, pri vdychovaní hélia dochádza k zodpovedajúcemu zvýšeniu rezonančných frekvencií vokálneho traktu. Základná frekvencia (niekedy nazývaná tón) sa nemení, pretože k tomu dochádza prostredníctvom priamej vibrácie hlasiviek, ktorá sa nemení. Vyššie rezonančné frekvencie však spôsobujú zmenu zafarbenia, výsledkom čoho je tenký zvuk podobný kačici. Opačný efekt, zníženie rezonančných frekvencií, možno dosiahnuť vdychovaním hustého plynu, ako je fluorid sírový alebo xenón.
Nebezpečenstvá
 Vdychovanie nadmerného množstva hélia môže byť nebezpečné, pretože hélium je jednoduchý dusivý prostriedok, ktorý vytláča kyslík potrebný na normálne dýchanie. Boli hlásené úmrtia vrátane mladého muža, ktorý sa udusil vo Vancouveri v roku 2003, a dvoch dospelých, ktorí sa udusili na južnej Floride v roku 2006. V roku 1998 Austrálčanka (jej vek neznámy) z Viktórie upadla do bezvedomia a dočasne zmodrela po vdýchnutí celého obsahu héliovej nádrže. Vdychovanie hélia priamo z tlakových fliaš alebo dokonca plniacich ventilov fliaš je mimoriadne nebezpečné, pretože vysoké prietoky a tlaky môžu spôsobiť barotraumu, smrteľné poškodenie pľúcneho tkaniva. Smrť spôsobená héliom je zriedkavá. Prvým hláseným prípadom bol prípad 15-ročného texaského dievčaťa, ktoré zomrelo v roku 1998 na vdýchnutie hélia na kamarátovej párty. V Spojených štátoch boli v rokoch 2000 až 2004 hlásené len dve úmrtia, vrátane muža, ktorý zomrel v Severnej Karolíne na barotraumu v roku 2002. Mladý muž sa v roku 2003 udusil vo Vancouveri a 27-ročný muž v Austrálii dostal embóliu po vdýchnutí plynu z tlakovej fľaše v roku 2000. Odvtedy sa na južnej Floride v roku 2006 udusili dvaja dospelí, v rokoch 2009 a 2010 bolo hlásených niekoľko prípadov, jeden zahŕňal kalifornského mladíka, ktorého našli s vakom cez hlavu pripevnený k héliovej nádrži, a ďalší zahŕňal tínedžera v Severnom Írsku. udusenia. V Eagle Point v Oregone zomrelo v roku 2012 dospievajúce dievča na barotraumu na párty. Dievča z Michiganu zomrelo na hypoxiu neskôr v tom roku. 4. februára 2015 vyšlo najavo, že 28. januára počas nahrávania televíznej show japonskej dievčenskej skupiny 3B Junior utrpela 12-ročná členka skupiny (ktorej meno bolo utajené) embóliu, stratila vedomie a upadol do kómy v dôsledku vzduchových bublín blokujúcich prietok krvi v mozgu.po vdýchnutí obrovského množstva hélia. Incident bol zverejnený až nasledujúci týždeň. Zamestnanci TV Asahi usporiadali núdzovú tlačovú konferenciu, na ktorej oznámili, že dievča previezli do nemocnice a že vykazuje známky zotavovania, ako sú pohyby očí a končatín, no jej vedomie sa ešte úplne nezotavilo. Polícia začala vyšetrovanie pre zanedbanie bezpečnostných opatrení. Obavy o bezpečnosť pri kryogénnom héliu sú podobné ako pri kvapalnom dusíku; jeho extrémne nízke teploty môžu spôsobiť popáleniny za studena a jeho pomer expanzie kvapaliny a plynu môže spôsobiť výbuch, pokiaľ nie sú nainštalované zariadenia na zníženie tlaku. S nádobami s plynným héliom pri 5-10 K by sa malo zaobchádzať, ako keby obsahovali tekuté hélium v dôsledku rýchlej a významnej tepelnej rozťažnosti, ku ktorej dochádza, keď sa plynné hélium s teplotou nižšou ako 10 K zahreje na izbovú teplotu. Pri vysokých tlakoch (viac ako asi 20 atm alebo 2 MPa) môže zmes hélia a kyslíka (heliox) viesť k vysokotlakovému nervovému syndrómu, čo je druh reverzného anestetického účinku; pridanie malého množstva dusíka do zmesi môže problém zmierniť.
Vdychovanie nadmerného množstva hélia môže byť nebezpečné, pretože hélium je jednoduchý dusivý prostriedok, ktorý vytláča kyslík potrebný na normálne dýchanie. Boli hlásené úmrtia vrátane mladého muža, ktorý sa udusil vo Vancouveri v roku 2003, a dvoch dospelých, ktorí sa udusili na južnej Floride v roku 2006. V roku 1998 Austrálčanka (jej vek neznámy) z Viktórie upadla do bezvedomia a dočasne zmodrela po vdýchnutí celého obsahu héliovej nádrže. Vdychovanie hélia priamo z tlakových fliaš alebo dokonca plniacich ventilov fliaš je mimoriadne nebezpečné, pretože vysoké prietoky a tlaky môžu spôsobiť barotraumu, smrteľné poškodenie pľúcneho tkaniva. Smrť spôsobená héliom je zriedkavá. Prvým hláseným prípadom bol prípad 15-ročného texaského dievčaťa, ktoré zomrelo v roku 1998 na vdýchnutie hélia na kamarátovej párty. V Spojených štátoch boli v rokoch 2000 až 2004 hlásené len dve úmrtia, vrátane muža, ktorý zomrel v Severnej Karolíne na barotraumu v roku 2002. Mladý muž sa v roku 2003 udusil vo Vancouveri a 27-ročný muž v Austrálii dostal embóliu po vdýchnutí plynu z tlakovej fľaše v roku 2000. Odvtedy sa na južnej Floride v roku 2006 udusili dvaja dospelí, v rokoch 2009 a 2010 bolo hlásených niekoľko prípadov, jeden zahŕňal kalifornského mladíka, ktorého našli s vakom cez hlavu pripevnený k héliovej nádrži, a ďalší zahŕňal tínedžera v Severnom Írsku. udusenia. V Eagle Point v Oregone zomrelo v roku 2012 dospievajúce dievča na barotraumu na párty. Dievča z Michiganu zomrelo na hypoxiu neskôr v tom roku. 4. februára 2015 vyšlo najavo, že 28. januára počas nahrávania televíznej show japonskej dievčenskej skupiny 3B Junior utrpela 12-ročná členka skupiny (ktorej meno bolo utajené) embóliu, stratila vedomie a upadol do kómy v dôsledku vzduchových bublín blokujúcich prietok krvi v mozgu.po vdýchnutí obrovského množstva hélia. Incident bol zverejnený až nasledujúci týždeň. Zamestnanci TV Asahi usporiadali núdzovú tlačovú konferenciu, na ktorej oznámili, že dievča previezli do nemocnice a že vykazuje známky zotavovania, ako sú pohyby očí a končatín, no jej vedomie sa ešte úplne nezotavilo. Polícia začala vyšetrovanie pre zanedbanie bezpečnostných opatrení. Obavy o bezpečnosť pri kryogénnom héliu sú podobné ako pri kvapalnom dusíku; jeho extrémne nízke teploty môžu spôsobiť popáleniny za studena a jeho pomer expanzie kvapaliny a plynu môže spôsobiť výbuch, pokiaľ nie sú nainštalované zariadenia na zníženie tlaku. S nádobami s plynným héliom pri 5-10 K by sa malo zaobchádzať, ako keby obsahovali tekuté hélium v dôsledku rýchlej a významnej tepelnej rozťažnosti, ku ktorej dochádza, keď sa plynné hélium s teplotou nižšou ako 10 K zahreje na izbovú teplotu. Pri vysokých tlakoch (viac ako asi 20 atm alebo 2 MPa) môže zmes hélia a kyslíka (heliox) viesť k vysokotlakovému nervovému syndrómu, čo je druh reverzného anestetického účinku; pridanie malého množstva dusíka do zmesi môže problém zmierniť.
:Značky
Zoznam použitej literatúry:
Rayet, G. (1868) "Analyse spectral des protuberances observées, pendant l"éclipse totale de Soleil viditeľné le 18 août 1868, à la presqu"île de Malacca" (Spektrálna analýza protuberancií pozorovaných počas celkového slnečného žiarenia 18. augusta 1868, z polostrova Malacca), Comptes rendus…, 67: 757–759. Od p. 758: "... je vis immédiatement une série de neuf lignes brillantes qui... me semblent devoir être assimilées aux lignes principales du specter solaire, B, D, E, b, une ligne inconnue, F, et deux lignes du groupe G." (... Okamžite som videl sériu deviatich jasných čiar, ktoré... sa mi zdalo, že by mali byť klasifikované ako hlavné čiary slnečného spektra, B, D, E, b, neznáma čiara, F a dve čiary skupina G.
Hélium je prvok druhého rádu periodickej sústavy chemických prvkov D.I.Mendelejeva s atómovým číslom 2. Nachádza sa v hlavnej podskupine ôsmej skupiny, prvej periódy periodickej sústavy. Vedie skupinu vzácnych plynov v periodickej tabuľke. Označuje sa symbolom He (lat. Helium). Jednoduchá látka hélium (číslo CAS: 7440-59-7) je inertný monatomický plyn bez farby, chuti a zápachu. Hélium je jedným z najbežnejších prvkov vo vesmíre, hneď po vodíku. Hélium je tiež druhým najľahším chemickým prvkom (po vodíku). Hélium sa získava zo zemného plynu procesom nízkoteplotnej separácie – takzvanou frakčnou destiláciou
18. augusta 1868 francúzsky vedec Pierre Jansen počas úplného zatmenia Slnka v indickom meste Guntur prvýkrát preskúmal chromosféru Slnka. Jansenovi sa podarilo nakonfigurovať spektroskop tak, aby sa spektrum slnečnej koróny dalo pozorovať nielen počas zatmenia, ale aj v bežných dňoch. Hneď nasledujúci deň spektroskopia slnečných protuberancií spolu s vodíkovými čiarami - modrou, zeleno-modrou a červenou - odhalila veľmi jasnú žltú čiaru, ktorú pôvodne nasnímal Jansen a ďalší astronómovia, ktorí ju pozorovali ako sodíkovú D čiaru. Jansen o tom okamžite napísal do Francúzskej akadémie vied. Následne sa zistilo, že jasne žltá čiara v slnečnom spektre sa nezhoduje s čiarou sodíka a nepatrí k žiadnemu z predtým známych chemických prvkov.
O dva mesiace neskôr, 20. októbra, vykonal výskum slnečného spektra aj anglický astronóm Norman Lockyer, ktorý nevedel o vývoji svojho francúzskeho kolegu. Po objavení neznámej žltej čiary s vlnovou dĺžkou 588 nm (presnejšie 587,56 nm) ju označil ako D3, pretože bola veľmi blízka Fraunhoferovým čiaram D 1 (589,59 nm) a D 2 (588,99 nm) sodíka. O dva roky neskôr Lockyer spolu s anglickým chemikom Edwardom Franklandom, s ktorým spolupracoval, navrhol dať novému prvku názov „hélium“ (zo starogréckeho ἥλιος – „slnko“).
Zaujímavosťou je, že listy od Jansena a Lockyera prišli do Francúzskej akadémie vied v ten istý deň – 24. októbra 1868, no Lockyerov list napísaný o štyri dni skôr prišiel o niekoľko hodín skôr. Na druhý deň boli oba listy prečítané na stretnutí akadémie. Na počesť novej metódy štúdia prominencií sa Francúzska akadémia rozhodla raziť medailu. Na jednej strane medaily boli portréty Jansena a Lockyera cez skrížené vavrínové konáre a na druhej bol obraz bájneho boha Slnka Apolóna, ktorý poháňal voz so štyrmi koňmi cválajúcimi plnou rýchlosťou.
V roku 1881 Talian Luigi Palmieri publikoval správu o svojom objave hélia v sopečných plynoch (fumaroly). Skúmal svetložltú olejovú látku, ktorá sa usadzovala z prúdov plynu na okrajoch krátera Vezuvu. Palmieri kalcinoval tento vulkanický produkt v plameni Bunsenovho horáka a pozoroval spektrum uvoľnených plynov. Vedecké kruhy privítali túto správu s nedôverou, pretože Palmieri opísal svoju skúsenosť nejasne. O mnoho rokov neskôr sa vo fumarolách skutočne našlo malé množstvo hélia a argónu.
Len 27 rokov po svojom prvotnom objave bolo na Zemi objavené hélium – v roku 1895 škótsky chemik William Ramsay pri skúmaní vzorky plynu získaného rozkladom minerálu kleveit objavil v jeho spektre tú istú žiarivo žltú čiaru, ktorá sa našla skôr v r. slnečné spektrum. Vzorka bola odoslaná na ďalší výskum slávnemu anglickému spektroskopovi Williamovi Crookesovi, ktorý potvrdil, že žltá čiara pozorovaná v spektre vzorky sa zhoduje s čiarou D3 hélia. Ramsay poslal 23. marca 1895 správu o svojom objave hélia na Zemi Kráľovskej spoločnosti v Londýne, ako aj Francúzskej akadémii prostredníctvom slávneho chemika Marcelina Berthelota.
V roku 1896 Heinrich Kaiser, Siegbert Friedländer a o dva roky neskôr Edward Beley konečne dokázali prítomnosť hélia v atmosfére.
Ešte pred Ramsayom hélium izoloval aj americký chemik Francis Hillebrand, ale mylne sa domnieval, že získal dusík a v liste Ramsaymu uznal svoju prioritu objavu.
Ramsay pri skúmaní rôznych látok a minerálov zistil, že hélium v nich sprevádza urán a tórium. Ale až oveľa neskôr, v roku 1906, Rutherford a Royds zistili, že častice alfa rádioaktívnych prvkov sú jadrá hélia. Tieto štúdie položili základ modernej teórie atómovej štruktúry.
Až v roku 1908 sa holandskému fyzikovi Heike Kamerlinghovi Onnesovi podarilo získať tekuté hélium škrtením (pozri Joule-Thomsonov efekt) po predchladení plynu v kvapalnom vodíku vriacom vo vákuu. Pokusy o získanie pevného hélia zostali dlho neúspešné aj pri teplote 0,71 K, čo sa podarilo žiakovi Kamerlingha Onnesa, nemeckému fyzikovi Willemovi Hendrikovi Keesomovi. Až v roku 1926 aplikovaním tlaku nad 35 atm a ochladzovaním stlačeného hélia v tekutom héliu vriacom za riedenia sa mu podarilo kryštály izolovať.
V roku 1932 Keesom študoval povahu zmeny tepelnej kapacity kvapalného hélia s teplotou. Zistil, že okolo 2,19 K pomalý a postupný nárast tepelnej kapacity ustúpi prudkému poklesu a krivka tepelnej kapacity nadobúda tvar gréckeho písmena λ (lambda). Teplota, pri ktorej dochádza k skoku v tepelnej kapacite, sa preto nazýva „bod λ“. Presnejšia hodnota teploty v tomto bode, stanovená neskôr, je 2,172 K. V bode λ dochádza k hlbokým a náhlym zmenám základných vlastností kvapalného hélia - jedna fáza kvapalného hélia je v tomto bode nahradená druhou, bez uvoľnenia latentné teplo; dochádza k fázovému prechodu druhého rádu. Nad teplotou bodu λ je takzvané hélium-I a pod ním hélium-II.
V roku 1938 objavil sovietsky fyzik Pyotr Leonidovič Kapitsa fenomén supratekutosti tekutého hélia-II, ktorý spočíva v prudkom poklese koeficientu viskozity, v dôsledku čoho hélium tečie prakticky bez trenia. To napísal v jednej zo svojich správ o objave tohto fenoménu.
pôvod mena
Z gréčtiny ἥλιος - „Slnko“ (pozri Helios). Je zvláštne, že názov prvku používal koncovku „-i“, charakteristickú pre kovy (v latinčine „-um“ - „Helium“), pretože Lockyer predpokladal, že prvok, ktorý objavil, bol kov. Analogicky s inými vzácnymi plynmi by bolo logické dať mu názov „Helion“. V modernej vede sa názov „helion“ priraďuje jadru ľahkého izotopu hélia - hélia-3.
Prevalencia
Vo Vesmíre
Hélium je vo vesmíre na druhom mieste po vodíku – asi 23 % hmotnosti. Hélium je však na Zemi zriedkavé. Takmer všetko hélium vo vesmíre vzniklo v prvých minútach po Veľkom tresku, počas prvotnej nukleosyntézy. V modernom vesmíre sa takmer všetko nové hélium tvorí ako výsledok termonukleárnej fúzie z vodíka vo vnútri hviezd (pozri protón-protónový cyklus, uhlík-dusíkový cyklus). Na Zemi vzniká v dôsledku alfa rozpadu ťažkých prvkov (alfa častice emitované pri rozpade alfa sú jadrá hélia-4). Časť hélia, ktorá sa objavuje počas rozpadu alfa a presakuje cez horniny zemskej kôry, je zachytená zemným plynom, ktorého koncentrácia hélia môže dosiahnuť 7 % objemu a viac.
zemská kôra
V rámci ôsmej skupiny je hélium na druhom mieste v obsahu zemskej kôry (po argóne). Obsah hélia v atmosfére (vzniknutého rozpadom Ac, Th, U) je 5,27 × 10-4 % objemových, 7,24 × 10-5 % hmotnostných. Zásoby hélia v atmosfére, litosfére a hydrosfére sa odhadujú na 5×1014 m³. Prírodné plyny s obsahom hélia zvyčajne obsahujú do 2 % objemu hélia. Mimoriadne zriedkavé sú akumulácie plynov, ktorých obsah hélia dosahuje 8 - 16%. Priemerný obsah hélia v suchozemskej hmote je 3 g/t. Najvyššia koncentrácia hélia je pozorovaná v mineráloch obsahujúcich urán, tórium a samárium: kleveit, fergusonit, samarskit, gadolinit, monazit (monazitové piesky v Indii a Brazílii), thorianit. Obsah hélia v týchto mineráloch je 0,8 - 3,5 l/kg a v thorianite dosahuje 10,5 l/kg.
Definícia
Hélium sa určuje kvalitatívne analýzou emisných spektier (charakteristické čiary 587,56 nm a 388,86 nm), kvantitatívne metódami hmotnostnej spektrometrie a chromatografie, ako aj metódami založenými na meraní fyzikálnych vlastností (hustota, tepelná vodivosť atď.).
Chemické vlastnosti
Hélium je najmenej chemicky aktívny prvok z ôsmej skupiny periodickej tabuľky (inertné plyny). Mnohé zlúčeniny hélia existujú iba v plynnej fáze vo forme takzvaných excimerových molekúl, v ktorých sú excitované elektrónové stavy stabilné a základný stav je nestabilný. Hélium tvorí dvojatómové molekuly He 2 +, fluorid HeF, chlorid HeCl (molekuly excimeru vznikajú pôsobením elektrického výboja alebo ultrafialového žiarenia na zmes hélia s fluórom alebo chlórom). Chemická zlúčenina hélia LiHe je známa (možno bola myslená zlúčenina LiHe 7
Potvrdenie
V priemysle sa hélium získava zo zemných plynov obsahujúcich hélium (v súčasnosti sa využívajú najmä ložiská s obsahom > 0,1 % hélia). Hélium sa oddeľuje od ostatných plynov hlbokým chladením, pričom sa využíva skutočnosť, že sa skvapalňuje ťažšie ako všetky ostatné plyny. Chladenie sa vykonáva škrtením v niekoľkých stupňoch, pričom sa čistí od CO 2 a uhľovodíkov. Výsledkom je zmes hélia, neónu a vodíka. Táto zmes, tzv. surové hélium (He - 70-90% obj.) sa čistí z vodíka (4-5%) pomocou CuO pri 650-800 K. Konečné čistenie sa dosiahne ochladením zostávajúcej zmesi varom N2 vo vákuu a adsorpciou nečistôt na aktívnom uhlík v adsorbéroch, tiež chladený kvapalným N2. Vyrábajú hélium technickej čistoty (99,80 % objemových hélia) a vysokej čistoty (99,985 %). V Rusku sa hélium získava z prírodných a ropných plynov. V súčasnosti sa hélium získava v héliovom závode Gazprom Dobycha Orenburg LLC v Orenburgu z plynu s nízkym obsahom hélia (do 0,055 % obj.), takže ruské hélium má vysoké náklady. Naliehavým problémom je vývoj a komplexné spracovanie zemných plynov z veľkých ložísk východnej Sibíri s vysokým obsahom hélia (0,15-1 % obj.), čo výrazne zníži jeho náklady. USA vedú v produkcii hélia (140 miliónov m³ ročne), nasledované Alžírskom (16 miliónov m³). Rusko je na treťom mieste na svete – 6 miliónov m³ ročne. Svetové zásoby hélia dosahujú 45,6 miliárd m³.