Medzi organickými látkami obsahujúcimi dusík sú zlúčeniny s dvojitou funkciou. Z nich sú obzvlášť dôležité aminokyseliny.
V bunkách a tkanivách živých organizmov sa nachádza asi 300 rôznych aminokyselín, ale iba 20 ( a-aminokyseliny ) z nich slúžia ako jednotky (monoméry), z ktorých sa budujú peptidy a proteíny všetkých organizmov (preto sa nazývajú proteínové aminokyseliny). Sekvencia umiestnenia týchto aminokyselín v proteínoch je zakódovaná v nukleotidovej sekvencii zodpovedajúcich génov. Zvyšné aminokyseliny sa nachádzajú ako vo forme voľných molekúl, tak aj vo viazanej forme. Mnohé z aminokyselín sa nachádzajú iba v určitých organizmoch a existujú ďalšie, ktoré sa nachádzajú iba v jednom z veľkého množstva opísaných organizmov. Väčšina mikroorganizmov a rastlín syntetizuje aminokyseliny, ktoré potrebujú; Zvieratá a ľudia nie sú schopní produkovať takzvané esenciálne aminokyseliny získané z potravy. Aminokyseliny sa podieľajú na metabolizme bielkovín a sacharidov, na tvorbe zlúčenín dôležitých pre organizmy (napríklad purínové a pyrimidínové zásady, ktoré sú neoddeliteľnou súčasťou nukleových kyselín), sú súčasťou hormónov, vitamínov, alkaloidov, pigmentov. , toxíny, antibiotiká atď.; Niektoré aminokyseliny slúžia ako sprostredkovatelia pri prenose nervových vzruchov.
Aminokyseliny- organické amfotérne zlúčeniny, ktoré zahŕňajú karboxylové skupiny - COOH a aminoskupiny -NH 2 .
Aminokyseliny možno považovať za karboxylové kyseliny, v molekulách ktorých je atóm vodíka v zvyšku nahradený aminoskupinou.
KLASIFIKÁCIA
Aminokyseliny sú klasifikované podľa ich štruktúrnych charakteristík.1. Podľa vzájomnej polohy amino a karboxylových skupín sa aminokyseliny delia na α-, β-, γ-, δ-, ε- atď.
2. Podľa počtu funkčných skupín sa rozlišujú kyslé, neutrálne a zásadité skupiny.
3. Na základe povahy uhľovodíkového radikálu rozlišujú alifatické(tučný), aromatické, obsahujúce síru A heterocyklický aminokyseliny. Vyššie uvedené aminokyseliny patria do tukovej série.
Príkladom aromatickej aminokyseliny je kyselina para-aminobenzoová:
Príkladom heterocyklickej aminokyseliny je tryptofán, esenciálna a-aminokyselina.
NOMENKLATURA
Podľa systematického názvoslovia sa názvy aminokyselín tvoria z názvov zodpovedajúcich kyselín pridaním predpony amino a označenie polohy aminoskupiny vo vzťahu ku karboxylovej skupine. Číslovanie uhlíkového reťazca od atómu uhlíka karboxylovej skupiny.
Napríklad:
Často sa používa aj iná metóda konštrukcie názvov aminokyselín, podľa ktorej sa predpona pridáva k triviálnemu názvu karboxylovej kyseliny. amino označujúci polohu aminoskupiny písmenom gréckej abecedy.
Príklad:
Pre α-aminokyselinyR-CH(NH2)COOH
Ktoré zohrávajú mimoriadne dôležitú úlohu v životných procesoch zvierat a rastlín, používajú sa triviálne názvy.
Tabuľka.
|
Aminokyselina |
Skrátené označenie |
Štruktúra radikálu (R) |
|
Glycín |
Gly |
H- |
|
alanín |
ala (Ala) |
CH 3 - |
|
Valin |
Val |
(CH 3) 2 CH - |
|
Leucín |
leu (lei) |
(CH 3) 2 CH – CH 2 - |
|
Serin |
Ser |
OH-CH2- |
|
tyrozín |
Tyr (strelnica) |
HO – C 6 H 4 – CH 2 - |
|
Kyselina asparágová |
Asp |
HOOC – CH 2 – |
|
Kyselina glutámová |
Glu |
HOOC – CH 2 – CH 2 - |
|
cysteín |
Cys (Cis) |
HS – CH 2 – |
|
Asparagín |
Asn (Asn) |
O = C – CH 2 – │ NH2 |
|
lyzín |
Lys (Liz) |
NH 2 - CH 2 - CH 2 - CH 2 - |
|
fenylalanín |
Phen |
C 6H 5 – CH 2 - |
Ak molekula aminokyseliny obsahuje dve aminoskupiny, potom sa v jej názve použije predponadiamino-, tri NH 2 skupiny – triamino- atď.
Príklad:
Prítomnosť dvoch alebo troch karboxylových skupín sa odráža v názve príponou –diovy alebo - kyselina triová:
IZOMERIA
1. Izoméria uhlíkového skeletu
2. Izoméria polohy funkčných skupín
3. Optická izoméria
a-aminokyseliny, okrem glycínu NH 2-CH2-COOH.
FYZIKÁLNE VLASTNOSTI
Aminokyseliny sú kryštalické látky s vysokými (nad 250°C) bodmi topenia, ktoré sa medzi jednotlivými aminokyselinami málo líšia, a preto sú necharakteristické. Topenie je sprevádzané rozkladom látky. Aminokyseliny sú vysoko rozpustné vo vode a nerozpustné v organických rozpúšťadlách, čo ich robí podobnými anorganickým zlúčeninám. Mnoho aminokyselín má sladkú chuť.
PRIJÍMANIE
3. Mikrobiologická syntéza. Je známe, že mikroorganizmy počas svojich životných procesov produkujú α - aminokyseliny bielkovín.
CHEMICKÉ VLASTNOSTI
Aminokyseliny sú amfotérne organické zlúčeniny, vyznačujú sa acidobázickými vlastnosťami.
ja . Všeobecné vlastnosti
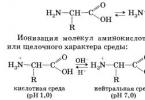
1. Intramolekulárna neutralizácia → vzniká bipolárny zwitterión:
Vodné roztoky sú elektricky vodivé. Tieto vlastnosti sú vysvetlené skutočnosťou, že molekuly aminokyselín existujú vo forme vnútorných solí, ktoré sa tvoria prenosom protónu z karboxylu na aminoskupinu:
zwitterion
Vodné roztoky aminokyselín majú neutrálne, kyslé alebo zásadité prostredie v závislosti od počtu funkčných skupín.
APLIKÁCIA
1) aminokyseliny sú v prírode široko rozšírené;
2) molekuly aminokyselín sú stavebnými kameňmi, z ktorých sú postavené všetky rastlinné a živočíšne bielkoviny; aminokyseliny potrebné na stavbu telesných bielkovín získavajú ľudia a zvieratá ako súčasť potravinových bielkovín;
3) aminokyseliny sú predpísané pri silnom vyčerpaní po ťažkých operáciách;
4) používajú sa na kŕmenie chorých;
5) aminokyseliny sú potrebné ako liek na niektoré choroby (napr. kyselina glutámová sa používa na nervové choroby, histidín na žalúdočné vredy);
6) niektoré aminokyseliny sa používajú v poľnohospodárstve na kŕmenie zvierat, čo má pozitívny vplyv na ich rast;
7) majú technický význam: kyseliny aminokaprónová a aminoenantová tvoria syntetické vlákna - kaprón a enant.
O ÚLOHE AMINOKYSELÍN
Výskyt v prírode a biologická úloha aminokyselín
Nález v prírode a biologická úloha aminokyselín
>> Chémia: Aminokyseliny
Všeobecný vzorec najjednoduchších aminokyselín možno napísať takto:
H2N-CH-COOH
ja
R
Pretože aminokyseliny obsahujú dve rôzne funkčné skupiny, ktoré sa navzájom ovplyvňujú, ich reakcie sa líšia od charakteristických vlastností karboxylových kyselín a amínov.
Potvrdenie
Aminokyseliny možno získať z karboxylových kyselín nahradením atómu vodíka v ich zvyšku halogénom a potom aminoskupinou pri reakcii s amoniakom. Zmes aminokyselín sa zvyčajne získava kyslou hydrolýzou bielkovín.
Vlastnosti
Aminoskupina -NH2 určuje základné vlastnosti aminokyselín, pretože je schopná pripojiť k sebe vodíkový katión prostredníctvom mechanizmu donor-akceptor v dôsledku prítomnosti voľného elektrónového páru na atóme dusíka.
Skupina -COOH (karboxylová skupina) určuje kyslé vlastnosti týchto zlúčenín. Preto sú aminokyseliny amfotérne organické zlúčeniny.
S alkáliami reagujú ako kyseliny. So silnými kyselinami - ako amínové zásady.
Okrem toho aminoskupina v molekule aminokyseliny interaguje s karboxylovou skupinou zahrnutou v jej zložení a vytvára vnútornú soľ: 
Keďže aminokyseliny vo vodných roztokoch sa správajú ako typické amfotérne zlúčeniny, v živých organizmoch plnia úlohu tlmivých látok, ktoré udržujú určitú koncentráciu vodíkových iónov.
Aminokyseliny sú bezfarebné kryštalické látky, ktoré sa topia a rozkladajú pri teplotách nad 200 °C. Sú rozpustné vo vode a nerozpustné v éteri. V závislosti od zloženia R-radikálu môžu byť sladké, horké alebo bez chuti.
Aminokyseliny sú opticky aktívne, pretože obsahujú atómy uhlíka (asymetrické atómy) naviazané na štyri rôzne substituenty (výnimkou je kyselina aminooctová - glycín). Asymetrický atóm uhlíka je označený hviezdičkou.
Ako už viete, opticky aktívne látky sa vyskytujú vo forme párov antipodálnych izomérov, ktorých fyzikálne a chemické vlastnosti sú rovnaké, s výnimkou jedinej - schopnosti otáčať rovinu polarizovaného lúča v opačných smeroch. Smer otáčania roviny polarizácie je označený znamienkom (+) - pravá rotácia, (-) - ľavá rotácia.
Existujú D-aminokyseliny a L-aminokyseliny. Umiestnenie aminoskupiny NH2 v projekčnom vzorci vľavo zodpovedá L-konfigurácii a vpravo - D-konfigurácii. Znamienko rotácie nesúvisí s tým, či spoj patrí do série L alebo D. L-ce-rín má teda rotačné znamienko (-) a L-alanín má rotačné znamienko (+).
Aminokyseliny sa delia na prírodné (nachádzajú sa v živých organizmoch) a syntetické. Z prírodných aminokyselín (asi 150) sa rozlišujú proteinogénne aminokyseliny (asi 20), ktoré sú súčasťou bielkovín. Sú v tvare písmena L. Asi polovica týchto aminokyselín sa považuje za esenciálne, keďže sa v ľudskom tele nesyntetizujú. Esenciálne aminokyseliny sú valín, leucín, izoleucín, fenylalalín, lyzín, treonín, cysteín, metionín, histidín, tryptofán. Tieto látky vstupujú do ľudského tela s jedlom (tabuľka 7). Ak je ich množstvo v potrave nedostatočné, dochádza k narušeniu normálneho vývoja a fungovania ľudského tela. Pri niektorých ochoreniach telo nie je schopné syntetizovať niektoré iné aminokyseliny. Pri fenylketonúrii sa teda tyrozín nesyntetizuje.
Najdôležitejšou vlastnosťou aminokyselín je schopnosť vstúpiť do molekulárnej kondenzácie s uvoľňovaním vody a tvorbou amidovej skupiny -NH-CO-, napr.
H2N-(CH2)5-COOH + H-NH-(CH2)5-COOH ->
kyselina aminokaprónová
H2N-(CH2)5-CO-NH-(CH2)5-COOH + H20
Vysokomolekulárne zlúčeniny získané touto reakciou obsahujú veľké množstvo amidových fragmentov a preto sa nazývajú polyamidy.
Tieto, okrem vyššie uvedeného syntetického vlákna nylonu, zahŕňajú napríklad enant, ktorý vzniká pri polykondenzácii kyseliny aminoenantovej. Aminokyseliny s aminoskupinami a karboxylovými skupinami na koncoch molekúl sú vhodné na výrobu syntetických vlákien (zamyslite sa prečo).
Tabuľka 7. Denná potreba ľudského tela na aminokyseliny
Polyamidy a-aminokyselín sa nazývajú peptidy. V závislosti od počtu aminokyselinových zvyškov sa rozlišujú dipeptidy, tripeptidy a polypeptidy. V takýchto zlúčeninách sa skupiny -NP-CO- nazývajú peptidové skupiny.
Izoméria a nomenklatúra
Izoméria aminokyselín je určená odlišnou štruktúrou uhlíkového reťazca a polohou aminoskupiny. Názvy aminokyselín, v ktorých sú polohy aminoskupiny označené písmenami gréckej abecedy, sú tiež rozšírené. Kyselina 2-aminobutánová sa teda môže nazývať aj kyselina a-aminomaslová: 
Na biosyntéze bielkovín v živých organizmoch sa podieľa 20 aminokyselín, pre ktoré sa často používajú historické názvy. Tieto názvy a pre ne prijaté ruské a latinské písmenové označenia sú uvedené v tabuľke 8.

1. Napíšte rovnice reakcií kyseliny aminopropiónovej; kyselinou sírovou a hydroxidom sodným, ako aj metylalkoholom. Uveďte názvy všetkých látok podľa medzinárodnej nomenklatúry.
2. Prečo sú aminokyseliny heterofunkčné zlúčeniny?
3. Aké štruktúrne vlastnosti by mali mať aminokyseliny používané na syntézu vlákien a aminokyseliny podieľajúce sa na biosyntéze bielkovín v bunkách živých organizmov?
4. Ako sa líšia polykondenzačné reakcie od polymerizačných reakcií? Aké sú ich podobnosti?
5. Ako sa získavajú aminokyseliny? Napíšte reakčné rovnice na výrobu kyseliny aminopropiónovej z propánu.
Obsah lekcie poznámky k lekcii podporná rámcová lekcia prezentácia akceleračné metódy interaktívne technológie Prax úlohy a cvičenia autotest workshopy, školenia, prípady, questy domáce úlohy diskusia otázky rečnícke otázky študentov Ilustrácie audio, videoklipy a multimédiá fotografie, obrázky, grafika, tabuľky, diagramy, humor, anekdoty, vtipy, komiksy, podobenstvá, výroky, krížovky, citáty Doplnky abstraktyčlánky triky pre zvedavcov jasličky učebnice základný a doplnkový slovník pojmov iné Zdokonaľovanie učebníc a vyučovacích hodínoprava chýb v učebnici aktualizácia fragmentu v učebnici, prvky inovácie v lekcii, nahradenie zastaraných vedomostí novými Len pre učiteľov perfektné lekcie kalendárny plán na rok, metodické odporúčania, diskusný program Integrované lekcieDEFINÍCIA
Aminokyseliny- sú to zložité organické zlúčeniny, ktoré vo svojej molekule súčasne obsahujú aminoskupinu a karboxylovú skupinu.
Aminokyseliny sú kryštalické pevné látky vyznačujúce sa vysokou teplotou topenia a pri zahrievaní sa rozkladajú. Dobre sa rozpúšťajú vo vode. Tieto vlastnosti sa vysvetľujú možnosťou existencie aminokyselín vo forme vnútorných solí (obr. 1).
Ryža. 1. Vnútorná soľ kyseliny aminooctovej.
Získanie aminokyselín
Východiskovými zlúčeninami na výrobu aminokyselín sú často karboxylové kyseliny, do ktorých molekuly je zavedená aminoskupina. Napríklad ich získavanie z halogénovaných kyselín
CH3-C(Br)H-COOH + 2NH3 ->CH3-C(NH2)H-COOH + NH4Br.
Okrem toho môžu aldehydy (1), nenasýtené kyseliny (2) a nitrozlúčeniny (3) slúžiť ako východiskové materiály na výrobu aminokyselín:
CH3-C(0)H + NH3 + HCN -» CH3-C(NH2)H-C=H + H20;
CH3-C(NH2)H-C=H + H20 (H+) -> CH3-C(NH2)H-COOH + NH3 (1).
CH2=CH-COOH + NH3 -> H2N-CH2-CH2-COOH (2);
02N-C6H4-COOH + [H] ->H2N-C6H4-COOH (3).
Chemické vlastnosti aminokyselín
Aminokyseliny ako heterofunkčné zlúčeniny vstupujú do väčšiny reakcií charakteristických pre karboxylové kyseliny a amíny. Prítomnosť dvoch rôznych funkčných skupín v molekulách aminokyselín vedie k objaveniu sa množstva špecifických vlastností.
Aminokyseliny sú amfotérne zlúčeniny. Reagujú s kyselinami aj zásadami:
NH2-CH2-COOH + HCl -> Cl
NH2-CH2-COOH + NaOH→ NH2-CH2-COONa + H20
Vodné roztoky aminokyselín majú neutrálne, zásadité a kyslé prostredie v závislosti od počtu funkčných skupín. Napríklad kyselina glutámová tvorí kyslý roztok, pretože obsahuje dve karboxylové skupiny a jednu aminoskupinu, a lyzín tvorí zásaditý roztok, pretože obsahuje jednu karboxylovú skupinu a dve aminoskupiny.
Dve molekuly aminokyselín môžu navzájom interagovať. V tomto prípade sa odštiepi molekula vody a vznikne produkt, v ktorom sú fragmenty molekuly navzájom spojené peptidovou väzbou (-CO-NH-). Napríklad:

Výsledná zlúčenina sa nazýva dipeptid. Látky zložené z mnohých aminokyselinových zvyškov sa nazývajú polypeptidy. Peptidy sú hydrolyzované kyselinami a zásadami.
Aplikácia aminokyselín
Ľudia aj zvieratá získavajú aminokyseliny potrebné na stavbu tela z potravinových bielkovín.
Kyselina γ-aminomaslová sa používa v medicíne (aminalón/gamalon) na duševné choroby; Na jej základe je vytvorený celý rad nootropík, t.j. ovplyvňovanie procesov myslenia.
Kyselina ε-aminokaprónová sa používa aj v medicíne (hemostatické činidlo) a okrem toho ide o veľkosériový priemyselný produkt, ktorý sa používa na výrobu syntetického polyamidového vlákna - nylonu.
Kyselina antranilová sa používa na syntézu farbív, ako je indigová modrá, a podieľa sa aj na biosyntéze heterocyklických zlúčenín.
Príklady riešenia problémov
PRÍKLAD 1
| Cvičenie | Napíšte rovnice pre reakcie alanínu s: a) hydroxidom sodným; b) hydroxid amónny; c) kyselina chlorovodíková. V dôsledku akých skupín vykazuje vnútorná soľ kyslé a zásadité vlastnosti? |
| Odpoveď | Aminokyseliny sú často zobrazované ako zlúčeniny obsahujúce aminoskupinu a karboxylovú skupinu, ale niektoré ich fyzikálne a chemické vlastnosti nie sú v súlade s touto štruktúrou. Štruktúra aminokyselín zodpovedá bipolárnemu iónu: H3N+-CH(R)-COO-. Napíšme vzorec alanínu ako vnútornej soli: H3N+-CH(CH3)-COO-. Na základe tohto štruktúrneho vzorca napíšeme reakčné rovnice: a) H3N + -CH(CH3)-COO- + NaOH = H2N-CH(CH3)-COONa + H20; b) H3N + -CH(CH3)-COO- + NH3 x H20 = H2N-CH(CH3)-COONH4 + H20; c) H3N+-CH(CH3)-COO- + HCl = Cl-. Vnútorná soľ aminokyseliny reaguje so zásadami ako kyselina a s kyselinami ako zásada. Kyslá skupina je N + H 3, hlavná skupina je COO -. |
PRÍKLAD 2
| Cvičenie | Keď sa roztok 9,63 g neznámej monoaminokarboxylovej kyseliny vystavil nadbytku kyseliny dusitej, získalo sa 2,01 l dusíka pri 748 mm. rt. čl. a 20 o C. Určte molekulový vzorec tejto zlúčeniny. Môže byť táto kyselina jednou z prirodzených aminokyselín? Ak áno, o aký druh kyseliny ide? Molekula tejto kyseliny neobsahuje benzénový kruh. |
| Riešenie | Napíšeme reakčnú rovnicu: H2NC x H2 x COOH + HONO = HO-C x H2 x -COOH + N2 + H20. Nájdite množstvo dusíkatej látky na nulovej úrovni pomocou Clapeyronovej-Mendelejevovej rovnice. Za týmto účelom vyjadrujeme teplotu a tlak v jednotkách SI: T = 273 + 20 = 293 K; P = 101,325 x 748/760 = 99,7 kPa; n(N2) = 99,7 x 2,01 / 8,31 x 293 = 0,082 mol. Pomocou reakčnej rovnice zistíme množstvo aminokyselinovej látky a jej molárnu hmotnosť. Podľa rovnice n(H 2 NC x H 2 x COOH) = n(N 2) = 0,082 mol. M(H2NC x H2 x COOH) = 9,63 / 0,082 = 117 g/mol. Definujme aminokyselinu. Vytvorme rovnicu a nájdime x: 14x + 16 + 45 = 117; H2NC4H8COOH. Z prírodných kyselín môže tomuto zloženiu zodpovedať valín. |
| Odpoveď | Táto aminokyselina je valín. |
Aminokyseliny sú organické zlúčeniny obsahujúce funkčné skupiny v molekule: amino a karboxyl.
Názvoslovie aminokyselín. Podľa systematickej nomenklatúry sú názvy aminokyselín tvorené názvami zodpovedajúcich karboxylových kyselín a pridaním slova „amino“. Poloha aminoskupiny je označená číslami. Počítanie je z uhlíka karboxylovej skupiny.
Izoméria aminokyselín. Ich štruktúrna izoméria je určená polohou aminoskupiny a štruktúrou uhlíkového radikálu. V závislosti od polohy skupiny NH 2 sa rozlišujú -, - a -aminokyseliny.

Proteínové molekuly sú postavené z α-aminokyselín.
Vyznačujú sa tiež izomériou funkčnej skupiny (medzitriedne izoméry aminokyselín môžu byť estery aminokyselín alebo amidy hydroxykyselín). Napríklad pre kyselinu 2-aminopropánovú CH3 – CH(NH)2 – COOH sú možné nasledujúce izoméry

Fyzikálne vlastnosti α-aminokyselín
Aminokyseliny sú bezfarebné kryštalické látky, neprchavé (nízky tlak nasýtených pár), topiace sa s rozkladom pri vysokých teplotách. Väčšina z nich je vysoko rozpustná vo vode a slabo rozpustná v organických rozpúšťadlách.
Vodné roztoky jednosýtnych aminokyselín majú neutrálnu reakciu. -Aminokyseliny možno považovať za vnútorné soli (bipolárne ióny): + NH 3 CH 2 COO . V kyslom prostredí sa správajú ako katióny, v zásaditom ako anióny. Aminokyseliny sú amfotérne zlúčeniny, ktoré vykazujú kyslé aj zásadité vlastnosti.
Spôsoby získania a-aminokyselín
1. Vplyv amoniaku na soli chlórovaných kyselín.
Cl
CH 2
COONH4 + NH3  NH2
CH2COOH
NH2
CH2COOH
2. Vplyv amoniaku a kyseliny kyanovodíkovej na aldehydy.

3. Hydrolýzou bielkovín vzniká 25 rôznych aminokyselín. Ich oddelenie nie je veľmi jednoduchá úloha.
Spôsoby získavania -aminokyselín
1. Pridanie amoniaku k nenasýteným karboxylovým kyselinám.
CH 2 = CH COOH + 2NH3 NH2 CH 2 CH 2 COONH 4.
2. Syntéza na báze dvojsýtnej kyseliny malónovej.
Chemické vlastnosti aminokyselín
1. Reakcie na karboxylovej skupine.
1.1. Tvorba éterov pôsobením alkoholov.
2. Reakcie na aminoskupine.
2.1. Interakcia s minerálnymi kyselinami.
NH2 CH 2 COOH + HCl H 3 N + CH 2 COOH + Cl
2.2. Interakcia s kyselinou dusitou.
NH2 CH 2 COOH + HNO 2 HO CH 2 COOH + N2 + H20
3. Konverzia aminokyselín pri zahrievaní.
3 .1.-aminokyseliny tvoria cyklické amidy.
.1.-aminokyseliny tvoria cyklické amidy.
3![]() .2.-aminokyseliny odstraňujú aminoskupinu a atóm vodíka atómu uhlíka y.
.2.-aminokyseliny odstraňujú aminoskupinu a atóm vodíka atómu uhlíka y.
Jednotliví zástupcovia
Glycín NH2CH2COOH (glykol). Jedna z najbežnejších aminokyselín v bielkovinách. Za normálnych podmienok - bezfarebné kryštály s Tm = 232236С. Ľahko rozpustný vo vode, nerozpustný v absolútnom alkohole a éteri. Vodíkový index vodného roztoku6,8; pKa = 1,510 10; рК × = 1,710 12.
α-alanín – kyselina aminopropiónová
Široko rozšírený v prírode. Voľne sa nachádza v krvnej plazme a vo väčšine bielkovín. T pl = 295296С, vysoko rozpustný vo vode, slabo rozpustný v etanole, nerozpustný v éteri. pKa (COOH) = 2,34; pKa (NH  )
= 9,69.
)
= 9,69.
-alanín NH 2 CH 2 CH 2 COOH – malé kryštály s teplotou topenia = 200°C, dobre rozpustný vo vode, slabo v etanole, nerozpustný v éteri a acetóne. pKa (COOH) = 3,60; pKa (NH  ) = 10,19; chýba v bielkovinách.
) = 10,19; chýba v bielkovinách.
Complexons. Tento výraz sa používa na pomenovanie série a-aminokyselín obsahujúcich dve alebo tri karboxylové skupiny. Najjednoduchšie:

N  Najbežnejším komplexónom je kyselina etyléndiamíntetraoctová.
Najbežnejším komplexónom je kyselina etyléndiamíntetraoctová.
Jeho disodná soľ, Trilon B, je extrémne široko používaná v analytickej chémii.
Väzby medzi zvyškami a-aminokyselín sa nazývajú peptidové väzby a samotné výsledné zlúčeniny sa nazývajú peptidy.
Dva a-aminokyselinové zvyšky tvoria dipeptid, tri - tripeptid. Mnohé zvyšky tvoria polypeptidy. Polypeptidy, podobne ako aminokyseliny, sú amfotérne; každý má svoj vlastný izoelektrický bod. Proteíny sú polypeptidy.
Akákoľvek zlúčenina, ktorá obsahuje karboxylovú aj aminoskupinu, je aminokyselina . Častejšie sa však tento výraz používa na označenie karboxylových kyselín, ktorých aminoskupina je v a-polohe ku karboxylovej skupine.
Aminokyseliny sú spravidla súčasťou polymérov - bielkoviny. V prírode sa vyskytuje viac ako 70 aminokyselín, ale iba 20 hrá dôležitú úlohu v živých organizmoch. Nepostrádateľný sa nazývajú aminokyseliny, ktoré si telo nedokáže syntetizovať z látok dodávaných potravou v množstve dostatočnom na uspokojenie fyziologických potrieb organizmu. Esenciálne aminokyseliny sú uvedené v tabuľke. 1. Pre pacientov s fenylketonúriou je tiež esenciálna aminokyselina tyrozín (pozri tabuľku 1).
stôl 1
Esenciálne aminokyseliny R-CHNH2COOH
Aminokyseliny sú zvyčajne pomenované ako náhrady za zodpovedajúce karboxylové kyseliny, označujúce polohu aminoskupiny písmenami gréckej abecedy. Pre najjednoduchšie aminokyseliny sa zvyčajne používajú triviálne názvy (glycín, alanín, izoleucín atď.). Izoméria aminokyselín je spojená s usporiadaním funkčných skupín a štruktúrou uhľovodíkového skeletu. Aminokyselinová molekula môže obsahovať jednu alebo viac karboxylových skupín a podľa toho sa aminokyseliny líšia v zásaditosti. Molekula aminokyseliny môže tiež obsahovať rôzny počet aminoskupín.
SPÔSOBY ZÍSKANIA AMINOKYSELÍN
1. Hydrolýzou bielkovín možno získať asi 25 aminokyselín, ale výsledná zmes sa ťažko separuje. Zvyčajne sa jedna alebo dve kyseliny získajú v oveľa väčších množstvách ako ostatné a tieto kyseliny sa dajú celkom jednoducho izolovať - pomocou iónomeničových živíc.
2. Z halogénovaných kyselín. Jedna z najbežnejších metód syntézy a-aminokyseliny zahŕňajú amonolýzu a-halogénovaná kyselina, ktorá sa zvyčajne získava Gel-Volhard-Zelinsky reakciou:
Táto metóda môže byť modifikovaná na výrobu kyseliny a-brómovej prostredníctvom esteru kyseliny malónovej:

Aminoskupina sa môže zaviesť do esteru a-halogénovanej kyseliny pomocou ftalimidu draselného ( Gabriel syntéza):

3. Z karbonylových zlúčenín ( Streckerova syntéza). Streckerova syntéza a-aminokyselín pozostáva z reakcie karbonylovej zlúčeniny so zmesou chloridu amónneho a kyanidu sodného (toto zlepšenie metódy navrhli N.D. Zelinsky a G.L. Stadnikov).

Adično-eliminačné reakcie zahŕňajúce amoniak a karbonylovú zlúčeninu produkujú imín, ktorý reaguje s kyanovodíkom za vzniku a-aminonitrilu. V dôsledku jeho hydrolýzy vzniká a-aminokyselina.

Chemické vlastnosti aminokyselín
Všetky a-aminokyseliny, okrem glycínu, obsahujú chirálny a-uhlíkový atóm a môžu sa vyskytovať vo forme enantioméry :

Bolo dokázané, že takmer všetky prirodzene sa vyskytujúce a-aminokyseliny majú rovnakú relatívnu konfiguráciu na a-atóme uhlíka. Atóm a-uhlíka (-)-serínu bol priradený konvenčne L-konfigurácia a a-atóm uhlíka (+)-serínu - D- konfigurácia. Navyše, ak je Fischerova projekcia a-aminokyseliny napísaná tak, že karboxylová skupina je umiestnená hore a R dole, potom L-aminokyseliny, aminoskupina bude vľavo, a D- aminokyseliny - vpravo. Fischerova schéma na určenie konfigurácie aminokyselín platí pre všetky a-aminokyseliny, ktoré majú chirálny a-uhlíkový atóm.

Z obrázku je zrejmé, že L-aminokyselina môže byť pravotočivá (+) alebo ľavotočivá (-) v závislosti od povahy radikálu. Prevažná väčšina a-aminokyselín nachádzajúcich sa v prírode je klasifikovaná ako L-riadok. ich enantiomorfy, t.j. D-aminokyseliny sú syntetizované len mikroorganizmami a sú tzv „neprirodzené“ aminokyseliny .
Podľa (R,S) nomenklatúry má väčšina "prírodných" alebo L-aminokyselín S konfiguráciu.

L-izoleucín a L-treonín, z ktorých každý obsahuje dve chirálne centrá na molekulu, môžu byť ľubovoľným členom páru diastereomérov v závislosti od konfigurácie na atóme b-uhlíka. Správne absolútne konfigurácie týchto aminokyselín sú uvedené nižšie.

KYSLO-BÁZICKÉ VLASTNOSTI AMINOKYSELÍN
Aminokyseliny sú amfotérne látky, ktoré môžu existovať vo forme katiónov alebo aniónov. Táto vlastnosť sa vysvetľuje prítomnosťou oboch kyslých ( -COUN) a hlavné ( - N.H. 2 ) skupiny v tej istej molekule. Vo veľmi kyslých roztokoch N.H. 2 Skupina kyseliny je protónovaná a kyselina sa stáva katiónom. V silne alkalických roztokoch sa karboxylová skupina aminokyseliny deprotonizuje a kyselina sa premení na anión.
V pevnom stave existujú aminokyseliny vo forme obojaké (bipolárne ióny, vnútorné soli). V zwitteriónoch sa protón prenáša z karboxylovej skupiny na aminoskupinu:

Ak umiestnite aminokyselinu do vodivého média a spustíte tam pár elektród, potom v kyslých roztokoch bude aminokyselina migrovať na katódu a v alkalických roztokoch na anódu. Pri určitej hodnote pH charakteristickej pre danú aminokyselinu sa nepohne ani k anóde, ani ku katóde, pretože každá molekula je vo forme zwitteriónu (nesie kladný aj záporný náboj). Táto hodnota pH sa nazýva izoelektrický bod(pl) danej aminokyseliny.
REAKCIE AMINOKYSELÍN
Väčšina reakcií, ktorým aminokyseliny prechádzajú v laboratóriu ( v in vitro), charakteristické pre všetky amíny alebo karboxylové kyseliny.
1. tvorba amidov na karboxylovej skupine. Keď karbonylová skupina aminokyseliny reaguje s aminoskupinou amínu, paralelne prebieha polykondenzačná reakcia aminokyseliny, ktorá vedie k tvorbe amidov. Aby sa zabránilo polymerizácii, blokuje sa aminoskupina kyseliny, takže reaguje iba aminoskupina amínu. Na tento účel sa používa karbobenzoxychlorid (karbobenzyloxychlorid, benzylchlórformiát). drhne-butoxykarboxazid atď. Pri reakcii s amínom sa karboxylová skupina aktivuje pôsobením etylchlórformiátu. Ochranná skupina potom sa odstráni katalytickou hydrogenolýzou alebo pôsobením studeného roztoku bromovodíka v kyseline octovej.

2. tvorba amidov na aminoskupine. Keď sa aminoskupina a-aminokyseliny acyluje, vytvorí sa amid.

Reakcia prebieha lepšie v zásaditom prostredí, pretože to zabezpečuje vysokú koncentráciu voľného amínu.
3. tvorba esterov. Karboxylová skupina aminokyseliny sa ľahko esterifikuje bežnými metódami. Napríklad metylestery sa pripravujú prechodom suchého plynného chlorovodíka cez roztok aminokyseliny v metanole:

Aminokyseliny sú schopné polykondenzácie, čo vedie k tvorbe polyamidu. Polyamidy pozostávajúce z a-aminokyselín sú tzv peptidy alebo polypeptidy . Amidová väzba v takýchto polyméroch je tzv peptid komunikácia. Polypeptidy s molekulovou hmotnosťou najmenej 5000 sa nazývajú bielkoviny . Proteíny obsahujú asi 25 rôznych aminokyselín. Keď sa daný proteín hydrolyzuje, všetky tieto aminokyseliny alebo niektoré z nich sa môžu vytvoriť v určitých pomeroch charakteristických pre jednotlivý proteín.
Jedinečná sekvencia aminokyselinových zvyškov v reťazci inherentná danému proteínu sa nazýva primárna proteínová štruktúra . Nazývajú sa znaky krútenia reťazcov proteínových molekúl (vzájomné usporiadanie fragmentov v priestore). sekundárna štruktúra bielkovín . Polypeptidové reťazce proteínov môžu byť navzájom spojené za vzniku amidových, disulfidových, vodíkových a iných väzieb v dôsledku aminokyselinových bočných reťazcov. V dôsledku toho sa špirála skrúti do klbka. Táto štrukturálna vlastnosť je tzv terciárna štruktúra proteínu . Aby niektoré proteíny vykazovali biologickú aktivitu, musia najskôr vytvoriť makrokomplex ( oligoproteín), pozostávajúce z niekoľkých kompletných proteínových podjednotiek. Kvartérna štruktúra určuje stupeň asociácie takýchto monomérov v biologicky aktívnom materiáli.
Proteíny sú rozdelené do dvoch veľkých skupín - fibrilárne (pomer dĺžky molekuly k šírke je väčší ako 10) a guľovitý (pomer menší ako 10). Fibrilárne proteíny zahŕňajú kolagén , najrozšírenejší proteín u stavovcov; tvorí takmer 50 % suchej hmotnosti chrupavky a asi 30 % pevnej hmoty kostí. Vo väčšine regulačných systémov rastlín a živočíchov katalýzu uskutočňujú globulárne proteíny, ktoré sú tzv enzýmy .