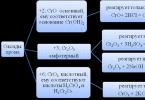
Compusul anorganic hidroxid de fier 3 are formula chimică Fe(OH)2. Aparține unui număr de compuși amfoteri în care predomină proprietățile caracteristice bazelor. În aparență, această substanță sunt cristale albe, care se întunecă treptat atunci când sunt lăsate în aer liber pentru o lungă perioadă de timp. Există opțiuni pentru cristale cu o nuanță verzuie. În viața de zi cu zi, toată lumea poate observa substanța sub forma unei acoperiri verzui pe suprafețele metalice, ceea ce indică începutul procesului de rugină - hidroxidul de fier 3 acționează ca una dintre etapele intermediare ale acestui proces.
În natură, compusul se găsește sub formă de amakinit. Acest mineral cristalin, pe lângă fierul în sine, conține și impurități de magneziu și mangan, toate aceste substanțe dau amakinitei diferite nuanțe - de la galben-verde până la verde pal, în funcție de procentul unui anumit element. Duritatea mineralului este de 3,5-4 unități pe scara Mohs, iar densitatea este de aproximativ 3 g/cm³.
Proprietățile fizice ale substanței ar trebui să includă, de asemenea, solubilitatea sa extrem de scăzută. Când hidroxidul de fier 3 este încălzit, se descompune.
Această substanță este foarte activă și interacționează cu multe alte substanțe și compuși. De exemplu, având proprietățile unei baze, interacționează cu diverși acizi. În special, sulful de fier 3 în timpul reacției conduce la producerea de (III). Deoarece această reacție poate avea loc prin calcinare convențională în aer liber, acest sulfat ieftin este utilizat atât în laboratoare, cât și în medii industriale.
În timpul reacției, rezultatul este formarea clorurii de fier (II).
În unele cazuri, hidroxidul de fier 3 poate prezenta și proprietăți acide. De exemplu, la interacțiunea cu o soluție foarte concentrată (concentrația trebuie să fie de cel puțin 50%) de hidroxid de sodiu, se obține tetrahidroxoferat de sodiu (II), care precipită. Adevărat, pentru ca o astfel de reacție să aibă loc, este necesar să se asigure condiții destul de complexe: reacția trebuie să aibă loc în condiții de fierbere a soluției într-un mediu atmosferic de azot.
După cum sa menționat deja, atunci când este încălzită, substanța se descompune. Rezultatul acestei descompunere este (II) și, în plus, fierul metalic și derivații săi se obțin sub formă de impurități: oxid de difer (III), a cărui formulă chimică este Fe3O4.
Cum se produce hidroxid de fier 3, a cărui producție este asociată cu capacitatea sa de a reacționa cu acizii? Înainte de a începe experimentul, trebuie să vă asigurați că vă amintiți regulile de siguranță atunci când efectuați astfel de experimente. Aceste reguli se aplică tuturor cazurilor de manipulare a soluțiilor acido-bazice. Principalul lucru aici este de a oferi o protecție fiabilă și de a evita contactul picăturilor de soluție cu membranele mucoase și pielea.
Deci, hidroxidul poate fi obținut printr-o reacție în care reacționează clorura de fier (III) și KOH - hidroxid de potasiu. Această metodă este cea mai comună pentru formarea bazelor insolubile. Când aceste substanțe interacționează, are loc o reacție normală de schimb, rezultând un precipitat maro. Acest precipitat este substanța dorită.
Utilizarea hidroxidului de fier în producția industrială este destul de răspândită. Cea mai comună este utilizarea sa ca substanță activă în bateriile fier-nichel. În plus, compusul este utilizat în metalurgie pentru a produce diferite aliaje metalice, precum și în producția de galvanizare și industria auto.
Compuși feroși
eu . Hidroxid de fier (II).
Formată prin acțiunea soluțiilor alcaline asupra sărurilor de fier (II) fără acces la aer:
FeCl 2 + 2 KOH = 2 KCl + F e (OH) 2 ↓
Fe(OH)2 este o bază slabă, solubilă în acizi tari:
Fe(OH)2 + H2S04 = FeS04 + 2H2O
Fe(OH)2 + 2H + = Fe2+ + 2H2O
Material suplimentar:
Fe(OH) 2 – prezintă, de asemenea, proprietăți amfotere slabe, reacționează cu alcalii concentrați:
Fe( OH) 2 + 2 NaOH = N / A 2 [ Fe( OH) 4 ]. se formează sare tetrahidroxoferat ( II) sodiu
Când Fe(OH) 2 este calcinat fără acces la aer, se formează oxid de fier (II) FeO -conexiune neagră:
Fe(OH)2 t˚C → FeO + H2O
În prezența oxigenului atmosferic, precipitatul alb Fe(OH) 2, oxidându-se, devine maro - formând hidroxid de fier (III) Fe(OH) 3:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 ↓
Material suplimentar:
Compușii de fier (II) au proprietăți reducătoare, sunt ușor transformați în compuși de fier (III) sub influența agenților oxidanți:
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 = 5Fe 2 (SO 4) 3 + K 2 SO 4 + 2MnSO 4 + 8H 2 O
6FeSO 4 + 2HNO 3 + 3H 2 SO 4 = 3Fe 2 (SO 4) 3 + 2NO + 4H 2 O
Compușii de fier sunt predispuși la formarea complexului:
FeCl2 + 6NH3 = CI2
Fe(CN) 2 + 4KCN = K 4 (sare galbenă din sânge)
Reacție calitativă la Fe 2+
Când în acțiune hexacianoferat de potasiu (III) K 3 (sare roșie din sânge) pe soluţii de săruri bivalente de fier se formează precipitat albastru (Turnboole blue):
3 Fe 2+ Cl 2 + 3 K 3 [ Fe 3+ ( CN) 6 ] → 6 KCl + 3 KFe 2+ [ Fe 3+ ( CN) 6 ]↓
(Turnboole blue - hexacianoferat ( III ) fier ( II )-potasiu)
Turnbull albastru proprietățile sale sunt foarte asemănătoare cu albastrul prusac și a servit și ca colorant. Numit după unul dintre fondatorii companiei scoțiane de vopsire Arthur și Turnbull.
Compuși ferici
eu . Oxid de fier (III).
Formată prin arderea sulfurilor de fier, de exemplu, prin prăjirea piritei:
4 FeS 2 + 11 O 2 t ˚ C → 2 Fe 2 O 3 + 8 SO 2
sau la calcinarea sărurilor de fier:
2FeSO 4 t˚C → Fe 2 O 3 + SO 2 + SO 3
Fe 2 O 3 - oxid culoare roșu-brun, prezentând într-o mică măsură proprietăți amfotere
Fe 2 O 3 + 6HCl t˚C → 2FeCl 3 + 3H 2 O
Fe 2 O 3 + 6H + t˚C → 2Fe 3+ + 3H 2 O
Fe 2 O 3 + 2 NaOH + 3 H 2 O t ˚ C → 2 Na [ Fe (OH ) 4 ],se formează o sare - tetrahidroxoferat ( III) sodiu
Fe 2 O 3 + 2OH - + 3H 2 O t˚C → 2 -
Atunci când sunt topite cu oxizi bazici sau carbonați ai metalelor alcaline, se formează ferite:
Fe 2 O 3 + Na 2 O t˚C → 2NaFeO 2
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
II. hidroxid de fier ( III )
Format prin acțiunea soluțiilor alcaline asupra sărurilor de fier feric: precipită sub formă de precipitat roșu-brun
Fe(NO 3) 3 + 3KOH = Fe(OH) 3 ↓ + 3KNO 3
Fe 3+ + 3OH - = Fe(OH) 3 ↓
În plus:
Fe(OH)3 este o bază mai slabă decât hidroxidul de fier (II).
Acest lucru se explică prin faptul că Fe 2+ are o sarcină ionică mai mică și o rază mai mare decât Fe 3+ și, prin urmare, Fe 2+ reține ionii de hidroxid mai slabi, adică. Fe(OH) 2 se disociază mai ușor.
În acest sens, sărurile de fier (II) sunt ușor hidrolizate, iar sărurile de fier (III) sunt hidrolizate foarte puternic.
Hidroliza explică și culoarea soluțiilor de săruri Fe(III): în ciuda faptului că ionul Fe 3+ este aproape incolor, soluțiile care îl conțin sunt colorate galben-maro, ceea ce se explică prin prezența hidroxoionilor de fier sau Fe(OH) 3 molecule, care se formează ca urmare a hidrolizei:
Fe 3+ + H 2 O ↔ 2+ + H +
2+ + H 2 O ↔ + + H +
+ + H 2 O ↔ Fe(OH) 3 + H +
Când este încălzită, culoarea se întunecă, iar când se adaugă acizi devine mai deschisă datorită suprimării hidrolizei.
Fe(OH) 3 are proprietăți amfotere slabe: se dizolvă în acizi diluați și soluții alcaline concentrate:
Fe(OH)3 + 3HCI = FeCI3 + 3H2O
Fe(OH)3 + 3H + = Fe3+ + 3H2O
Fe(OH)3 + NaOH = Na
Fe(OH) 3 + OH - = -
Material suplimentar:
Compușii de fier (III) sunt agenți de oxidare slabi, reacţionează cu agenți reducători puternici:
2Fe +3 Cl 3 + H 2 S -2 = S 0 ↓ + 2Fe +2 Cl 2 + 2HCl
FeCl 3 + KI = I 2 ↓ + FeCl 2 + KCl
Reacții calitative la Fe 3+
Experienţă
1) În timpul acțiunii hexacianoferat de potasiu (II) K 4 (sare galbenă din sânge) pe soluţii de săruri ferice de fier se formează precipitat albastru (albastru prusac):
4 Fe 3+ Cl 3 + 4 K 4 [ Fe 2+ ( CN) 6 ] → 12 KCl + 4 KFe 3+ [ Fe 2+ ( CN) 6 ]↓
(Albastru de Prusia - hexacianoferat ( II ) fier ( III )-potasiu)
albastru de Prusia a fost obţinută întâmplător la începutul secolului al XVIII-lea la Berlin de către vopsitorul Diesbach. Disbach a cumpărat o potasiu neobișnuit (carbonat de potasiu) de la un comerciant: o soluție a acestui potasiu atunci când a fost adăugată cu săruri de fier a devenit albastră. La verificarea potasiului, s-a dovedit că a fost calcinat cu sânge de bou. Vopseaua s-a dovedit a fi potrivită pentru țesături: strălucitoare, durabilă și ieftină. Curând a devenit cunoscută rețeta de fabricare a vopselei: potasa a fost topită cu sânge de animal uscat și pilitură de fier. Prin leșierea unui astfel de aliaj s-a obținut sare galbenă de sânge. În prezent, albastrul prusac este folosit pentru a produce cerneală de imprimare și polimeri de nuanță.
S-a stabilit că albastrul prusac și albastrul Turnboole sunt aceeași substanță, deoarece complexele formate în reacții sunt în echilibru între ele:
KFeIII[ FeII( CN) 6 ] ↔ KFe II[ Fe III( CN) 6 ]
2) Când se adaugă tiocianat de potasiu sau de amoniu la o soluție care conține ioni de Fe 3+, apare o culoare roșie intensă a sângelui soluţie tiocianat de fier (III):
2FeCl3 + 6KCNS = 6KCI + Fe III[ Fe III( SNC) 6 ]
(atunci cand interactioneaza cu tiocianati, ioni Fe 2+, solutia ramane aproape incolora).
Echipament de antrenament
Trainer Nr. 1 - Recunoașterea compușilor care conțin ion Fe (2+).
Trainer Nr. 2 - Recunoașterea compușilor care conțin ion Fe (3+).
Sarcini pentru consolidare
№1.
Efectuați transformările:
FeCl2 -> Fe(OH)2 -> FeO -> FeSO4
Fe -> Fe(NO 3) 3 -> Fe(OH) 3 -> Fe 2 O 3 -> NaFeO 2
nr. 2. Scrieți ecuațiile de reacție care pot fi folosite pentru a obține:
a) săruri de fier (II) și săruri de fier (III);
b) hidroxid de fier (II) și hidroxid de fier (III);
c) oxizi de fier.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Oxid de fier (III) Fe2O3 - pulbere brună, insolubilă în apă.
Oxidul de fier (III) se obține prin descompunerea hidroxidului de fier (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Oxidul de fier (III) prezintă proprietăți amfotere:
Reacționează cu acizi și alcaline solide NaOH și KOH, precum și cu carbonați de sodiu și potasiu la temperaturi ridicate:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH - = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Ferită de sodiu
Hidroxid de fier (III). obţinute din sărurile de fier (III) prin reacţia lor cu alcalii:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl,
Hidroxidul de fier (III) este o bază mai slabă decât Fe(OH)2 și prezintă proprietăți amfotere (cu predominarea celor principale). Când interacționează cu acizii diluați, Fe(OH)3 formează cu ușurință sărurile corespunzătoare:
Fe(OH)3 + 3HCI = FeCI3 + H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Reacțiile cu soluții concentrate de alcali apar numai la încălzire prelungită:
Fe(OH)3 + KOH = K
Compuși cu stare de oxidare a fierului +3 prezinta proprietati oxidante , întrucât sub influența agenților reducători Fe+3 se transformă în Fe+2: Fe+3 + 1e = Fe+2.
De exemplu, clorura de fier (III) oxidează iodura de potasiu în iod liber:
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I20
Crom.
Cromul se află în subgrupul secundar al grupului VI al Tabelului periodic. Structura învelișului electronic al cromului: Cr 3d54s1. Stările de oxidare variază de la +1 la +6, dar cele mai stabile sunt +2, +3, +6.
Fracția de masă a cromului din scoarța terestră este de 0,02%. Cele mai importante minerale care alcătuiesc minereurile de crom sunt cromitul sau minereul de crom de fier și soiurile sale în care fierul este parțial înlocuit cu magneziu și cromul cu aluminiu.
Cromul este un metal gri argintiu. Cromul pur este destul de ductil, iar cromul tehnic este cel mai dur dintre toate metalele.
Cromul este inactiv din punct de vedere chimic . În condiții normale, reacționează numai cu fluor (din nemetale), formând un amestec de fluoruri. La temperaturi ridicate (peste 600°C) interactioneaza cu oxigen, halogeni, azot, siliciu, bor, sulf, fosfor:
4Cr + 3O2 = 2Cr2O3
2Cr + 3Cl2 = 2CrCl3
2Cr + N2 = 2CrN
2Cr + 3S = Cr2S3
Se pasivează în acizi azotic și sulfuric concentrat, acoperit cu o peliculă de oxid protector. Se dizolvă în acizi clorhidric și sulfuric diluat, iar dacă acidul este complet eliberat de oxigenul dizolvat se obțin săruri de crom(II), iar dacă reacția are loc în aer se obțin săruri de crom(III): Cr + 2HCl = CrCl2 + H2; 2 Cr + 6 HCl + O 2 = 2 CrCl 3 + 2 H 2 O + H 2

MANGAN
 Mn, element chimic cu număr atomic 25, masă atomică 54,9. Simbol chimic pentru elementul Mn
pronunțat la fel ca și numele elementului însuși. Manganul natural este format numai din nuclidul 55Mn. Configurația celor două straturi electronice exterioare ale atomului de mangan este 3s2p6d54s2. În tabelul periodic, manganul este inclus în grupa VIIB și este situat în a 4-a perioadă. Formează compuși în stări de oxidare de la +2 la +7, cele mai stabile stări de oxidare sunt +2 și +7. Manganul, ca multe alte metale de tranziție, are și compuși care conțin atomi de mangan în starea de oxidare 0.
Mn, element chimic cu număr atomic 25, masă atomică 54,9. Simbol chimic pentru elementul Mn
pronunțat la fel ca și numele elementului însuși. Manganul natural este format numai din nuclidul 55Mn. Configurația celor două straturi electronice exterioare ale atomului de mangan este 3s2p6d54s2. În tabelul periodic, manganul este inclus în grupa VIIB și este situat în a 4-a perioadă. Formează compuși în stări de oxidare de la +2 la +7, cele mai stabile stări de oxidare sunt +2 și +7. Manganul, ca multe alte metale de tranziție, are și compuși care conțin atomi de mangan în starea de oxidare 0.
Manganul în forma sa compactă este un metal dur, alb-argintiu, fragil.
Proprietăți chimice
Manganul este un metal activ.
1. Interacțiunea cu nemetale
Când manganul metalic reacționează cu diferite nemetale, se formează compuși de mangan (II):
Mn + C2 = MnCI2 (clorura de mangan (II));
Mn + S = MnS (sulfură de mangan (II));
3Mn + 2P = Mn3P2 (fosfură de mangan (II));
3Mn + N2 = Mn3N2 (nitrură de mangan (II));
2Mn + N2 = Mn2Si (silicid de mangan (II)).
2. Interacțiunea cu apa
La temperatura camerei reacționează foarte lent cu apa, când este încălzită la o viteză moderată:
Mn + 2H2O = MnO2 + 2H2
3. Interacțiunea cu acizii
În seria de tensiune electrochimică a metalelor, manganul este situat înaintea hidrogenului, înlocuiește hidrogenul din soluții de acizi neoxidanți și se formează săruri de mangan (II):
Mn + 2HCI = MnCI2 + H2;
Mn + H2S04 = MnS04 + H2;
cu acid azotic diluat formează mangan (II) azotat și oxid azotic (II):
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
Acizii azotic și sulfuric concentrați pasivează manganul. Manganul se dizolvă în ele numai atunci când este încălzit, se formează săruri de mangan (II) și produși de reducere a acidului:
Mn + 2H2S04 = MnS04 + S02 + 2H2O;
Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O
4. Recuperarea metalelor din oxizi
Manganul este un metal activ, capabil să înlocuiască metalele din oxizii lor:
5Mn + Nb2O5 = 5MnO + 2Nb.
font-size:14.0pt;color:#262626">Dacă se adaugă acid sulfuric concentrat la permanganatul de potasiu KMnO4, se formează oxidul acid Mn2O7, care are proprietăți oxidante puternice:
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Mai mulți acizi corespund manganului, dintre care cei mai importanți sunt acidul permanganic puternic instabil H2MnO4 și acidul permanganic HMnO4, ale căror săruri sunt manganații (de exemplu, manganat de sodiu Na2MnO4) și respectiv permanganați (de exemplu, permanganatul de potasiu KMnO4).
Manganații (se cunosc doar manganații de metale alcaline și de bariu) pot prezenta proprietăți ca agenți oxidanți (mai des) 2 NaI + Na 2 MnO 4 + 2 H 2 O = MnO 2 + I 2 + 4 NaOH şi agenţi reducători 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
Permanganații sunt agenți oxidanți puternici. De exemplu, permanganatul de potasiu KMnO4 într-un mediu acid oxidează dioxidul de sulf SO2 la sulfat:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4.
Aplicație:mai mult de 90% din manganul produs merge către metalurgia feroasă. Manganul este utilizat ca aditiv pentru oțeluri pentru dezoxidarea, desulfurarea acestora (aceasta elimină impuritățile nedorite din oțel - oxigen, sulf și altele), precum și pentru aliarea oțelurilor, adică îmbunătățirea proprietăților lor mecanice și de coroziune. Manganul este folosit și în aliajele de cupru, aluminiu și magneziu. Acoperirile cu mangan pe suprafețele metalice oferă protecție anticorozivă. Pentru a aplica acoperiri subțiri de mangan, se folosește decacarbonilul binuclear Mn2(CO)10, foarte volatil și instabil termic.
Conceptul de aliaje.
O trăsătură caracteristică a metalelor este capacitatea lor de a forma aliaje între ele sau cu nemetale. Pentru a crea un aliaj, un amestec de metale este de obicei topit și apoi răcit la viteze diferite, care sunt determinate de natura componentelor și de modul în care acestea interacționează cu temperatura. Uneori aliajele sunt produse prin sinterizarea pulberilor metalice fine fără a se recurge la topire (metalurgia pulberilor). Deci aliajele sunt produse ale interacțiunii chimice a metalelor.
Structura cristalină a aliajelor este în multe privințe asemănătoare metalelor pure, care, interacționând între ele în timpul topirii și cristalizării ulterioare, formează: a) compuși chimici numiți compuși intermetalici; b) solutii solide; c) un amestec mecanic de cristale componente.
Tehnologia modernă folosește un număr mare de aliaje, iar în marea majoritate a cazurilor acestea constau nu din două, ci din trei, patru sau mai multe metale. Este interesant că proprietățile aliajelor diferă adesea foarte mult de proprietățile metalelor individuale care le formează. Astfel, un aliaj care conține 50% bismut, 25% plumb, 12,5% staniu și 12,5% cadmiu se topește la doar 60,5 grade Celsius, în timp ce componentele aliajului au puncte de topire de 271, 327, 232 și 321 de grade Celsius. Duritatea bronzului de staniu (90% cupru și 10% staniu) este de trei ori mai mare decât a cuprului pur, iar coeficientul de dilatare liniară al aliajelor fier-nichel este de 10 ori mai mic decât cel al componentelor pure.
Cu toate acestea, unele impurități deteriorează calitatea metalelor și aliajelor. Se știe, de exemplu, că fonta (un aliaj de fier și carbon) nu are rezistența și duritatea caracteristice oțelului. Pe lângă carbon, proprietățile oțelului sunt afectate de adăugarea de sulf și fosfor, care cresc fragilitatea acestuia.
Dintre proprietățile aliajelor, cele mai importante pentru utilizare practică sunt rezistența la căldură, rezistența la coroziune, rezistența mecanică etc. Pentru aviație, aliajele ușoare pe bază de magneziu, titan sau aluminiu sunt de mare importanță, pentru industria metalurgică - aliaje speciale care conțin wolfram. , cobalt și nichel. În tehnologia electronică se folosesc aliaje, a căror componentă principală este cuprul. Magneții super-puternici au fost obținuți folosind produsele interacțiunii cobaltului, samariului și a altor elemente de pământuri rare, iar aliajele care supraconduc la temperaturi scăzute au fost bazate pe compuși intermetalici formați din niobiu cu staniu etc.
Sarcini de consolidare și testare a cunoștințelor
Întrebări de control:
1. Cum se determină stările de oxidare ale metalelor subgrupurilor secundare?
2. Ce stări de oxidare sunt cele mai caracteristice fierului?
3. Dați formulele oxizilor de fier și hidroxizilor corespunzători acestora.
4. Descrieți proprietățile acido-bazice ale fierului (II) și hidroxizilor de fier
(III)?
5. Ce stări de oxidare sunt caracteristice cromului? Care sunt cele mai stabile?
6. Numiți formulele oxizilor și hidroxizilor de crom și caracterizați proprietățile lor acido-bazice.
7. Cum se schimbă proprietățile redox ale compușilor de crom
O creștere a stării sale de oxidare?
8. Scrieți formulele acizilor cromic și dicromic.
9. Ce stări de oxidare prezintă manganul în compuși? Care sunt cele mai stabile?
10. Scrieți formulele oxizilor și hidroxizilor de crom și caracterizați proprietățile lor acido-bazice și proprietățile redox.
11. Cum se modifică proprietățile redox ale compușilor de mangan odată cu creșterea gradului de oxidare a acestuia?
Deoarece Fe2+ este ușor oxidat la Fe+3:
Fe+2 – 1e = Fe+3
Astfel, un precipitat verzui proaspăt obținut de Fe(OH)2 în aer își schimbă foarte repede culoarea - devine maro. Schimbarea culorii este explicată prin oxidarea Fe(OH)2 la Fe(OH)3 de către oxigenul atmosferic:
4Fe+2(OH)2 + O2 + 2H2O = 4Fe+3(OH)3.
Sărurile divalente de fier prezintă, de asemenea, proprietăți reducătoare, în special atunci când sunt expuse la agenți oxidanți într-un mediu acid. De exemplu, sulfatul de fier (II) reduce permanganatul de potasiu într-un mediu de acid sulfuric la sulfat de mangan (II):
10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe+32(SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O.
Reacție calitativă la cationul de fier (II).
Reactivul pentru determinarea cationului de fier Fe2+ este ferat hexaciano(III) de potasiu (sare roșie din sânge) K3:
3FeSO4 + 2K3 = Fe32¯ + 3K2SO4.
Când ionii 3- interacționează cu cationii de fier Fe2+, se formează un precipitat albastru închis - Turnbull albastru:
3Fe2+ +23- = Fe32¯
Compuși de fier (III).
Oxid de fier (III) Fe2O3– pulbere brună, insolubilă în apă. Oxidul de fier (III) se obține:
A) descompunerea hidroxidului de fier (III):
2Fe(OH)3 = Fe2O3 + 3H2O
B) oxidarea piritei (FeS2):
4Fe+2S2-1 + 11O20 = 2Fe2+3O3 + 8S+4O2-2.
Fe+2 – 1e ® Fe+3
2S-1 – 10e ® 2S+4
O20 + 4e® 2O-2 11e
Oxidul de fier (III) prezintă proprietăți amfotere:
A) interacționează cu alcaline solide NaOH și KOH și cu carbonați de sodiu și potasiu la temperaturi ridicate:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH- = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Ferită de sodiu
Hidroxid de fier (III). obţinute din sărurile de fier (III) prin reacţia lor cu alcalii:
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl,
Fe3+ + 3OH- = Fe(OH)3¯.
Hidroxidul de fier (III) este o bază mai slabă decât Fe(OH)2 și prezintă proprietăți amfotere (cu predominarea celor bazice). Când interacționează cu acizii diluați, Fe(OH)3 formează cu ușurință sărurile corespunzătoare:
Fe(OH)3 + 3HCI « FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 « Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3H+ « Fe3+ + 3H2O
Reacțiile cu soluții concentrate de alcali apar numai la încălzire prelungită. În acest caz, se obțin hidrocomplexuri stabile cu un număr de coordonare de 4 sau 6:
Fe(OH)3 + NaOH = Na,
Fe(OH)3 + OH- = -,
Fe(OH)3 + 3NaOH = Na3,
Fe(OH)3 + 3OH- = 3-.
Compușii cu starea de oxidare a fierului +3 prezintă proprietăți oxidante, deoarece sub influența agenților reducători, Fe+3 este transformat în Fe+2:
Fe+3 + 1e = Fe+2.
De exemplu, clorura de fier (III) oxidează iodura de potasiu în iod liber:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + 2KCl + I20
Reacții calitative la cationul de fier (III).
A) Reactivul pentru detectarea cationului Fe3+ este feratul hexaciano(II) de potasiu (sare galbenă din sânge) K2.
Când 4-ionii interacționează cu ionii Fe3+, se formează un precipitat albastru închis – albastru de Prusia:
4FeCl3 + 3K4 « Fe43¯ +12KCl,
4Fe3+ + 34- = Fe43¯.
B) Cationii Fe3+ sunt ușor de detectat folosind tiocianat de amoniu (NH4CNS). Ca urmare a interacțiunii ionilor CNS-1 cu cationii de fier (III) Fe3+, se formează tiocianat de fier (III) cu disociere scăzută de culoare roșie sânge:
FeCl3 + 3NH4CNS « Fe(CNS)3 + 3NH4Cl,
Fe3+ + 3CNS1- « Fe(CNS)3.
Aplicarea și rolul biologic al fierului și al compușilor săi.
Cele mai importante aliaje de fier - fonta și oțelul - sunt principalele materiale structurale în aproape toate ramurile producției moderne.
Clorura de fier (III) FeCl3 este utilizată pentru purificarea apei. În sinteza organică, FeCl3 este utilizat ca catalizator. Nitratul de fier Fe(NO3)3 9H2O este utilizat pentru vopsirea țesăturilor.
Fierul este unul dintre cele mai importante microelemente din corpul uman și animal (corpul uman adult conține aproximativ 4 g de Fe sub formă de compuși). Face parte din hemoglobină, mioglobină, diferite enzime și alte complexe complexe fier-proteine care se găsesc în ficat și splină. Fierul stimulează funcția organelor hematopoietice.
Lista literaturii folosite:
1. „Chimie. Indemnizație de tutore.” Rostov-pe-Don. „Phoenix”. 1997
2. „Manual pentru solicitanții la universități.” Moscova. „Școala superioară”, 1995.
3. E.T. Oganesyan. „Ghid de chimie pentru candidații la universitate.” Moscova. 1994
Corpul uman conține aproximativ 5 g de fier, cea mai mare parte (70%) face parte din hemoglobina din sânge.
Proprietăți fizice
În stare liberă, fierul este un metal alb-argintiu cu o tentă cenușie. Fierul pur este ductil și are proprietăți feromagnetice. În practică, aliajele de fier - fontă și oțel - sunt de obicei folosite.
Fe este cel mai important și mai abundent element dintre cele nouă d-metale ale subgrupului VIII. Împreună cu cobaltul și nichelul formează „familia fierului”.
Atunci când formează compuși cu alte elemente, folosește adesea 2 sau 3 electroni (B = II, III).
Fierul, ca aproape toate elementele d din grupa VIII, nu prezintă o valență mai mare, egală cu numărul grupului. Valenta sa maxima ajunge la VI si apare extrem de rar.
Cei mai tipici compuși sunt cei în care atomii de Fe sunt în stări de oxidare +2 și +3.
Metode de obținere a fierului
1. Fierul tehnic (aliat cu carbon și alte impurități) se obține prin reducerea carbotermică a compușilor săi naturali conform următoarei scheme:

Recuperarea are loc treptat, în 3 etape:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3FeO + CO 2
3) FeO + CO = Fe + CO 2
Fonta rezultată în urma acestui proces conține mai mult de 2% carbon. Ulterior, fonta este folosită pentru a produce aliaje oțel - fier care conțin mai puțin de 1,5% carbon.
2. Fierul foarte pur se obține în unul dintre următoarele moduri:
a) descompunerea Fe pentacarbonilului
Fe(CO)5 = Fe + 5СО
b) reducerea FeO pur cu hidrogen
FeO + H2 = Fe + H2O
c) electroliza soluţiilor apoase de săruri de Fe +2
FeC2O4 = Fe + 2CO2
oxalat de fier (II).
Proprietăți chimice
Fe este un metal cu activitate medie și prezintă proprietăți generale caracteristice metalelor.
O caracteristică unică este capacitatea de a „rugini” în aer umed:
În absența umidității cu aer uscat, fierul începe să reacționeze vizibil doar la T > 150°C; la calcinare, se formează „calamă de fier” Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
Fierul nu se dizolvă în apă în absența oxigenului. La temperaturi foarte ridicate, Fe reacționează cu vaporii de apă, înlocuind hidrogenul din moleculele de apă:
3 Fe + 4H20(g) = 4H2
Mecanismul ruginirii este coroziunea electrochimică. Produsul de rugină este prezentat într-o formă simplificată. De fapt, se formează un strat liber dintr-un amestec de oxizi și hidroxizi cu compoziție variabilă. Spre deosebire de filmul de Al 2 O 3, acest strat nu protejează fierul de distrugerea ulterioară.
Tipuri de coroziune

Protejarea fierului de coroziune

1. Interacțiunea cu halogenii și sulful la temperaturi ridicate.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 = FeI 2
Se formează compuși în care predomină tipul ionic de legătură.
2. Interacțiunea cu fosforul, carbonul, siliciul (fierul nu se combină direct cu N2 și H2, ci le dizolvă).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = Fe x Si y
Se formează substanțe cu compoziție variabilă, cum ar fi berhollide (natura covalentă a legăturii predomină în compuși)
3. Interacțiune cu acizi „neoxidanți” (HCl, H 2 SO 4 dil.)
Fe 0 + 2H + → Fe 2+ + H 2
Deoarece Fe este situat în seria de activitate la stânga hidrogenului (E° Fe/Fe 2+ = -0,44 V), este capabil să înlocuiască H 2 din acizii obișnuiți.
Fe + 2HCI = FeCI2 + H2
Fe + H2S04 = FeS04 + H2
4. Interacțiunea cu acizii „oxidanți” (HNO 3, H 2 SO 4 conc.)
Fe 0 - 3e - → Fe 3+
HNO 3 concentrat și H 2 SO 4 „pasivează” fierul, astfel încât la temperaturi obișnuite metalul nu se dizolvă în ele. La încălzire puternică, are loc dizolvarea lentă (fără a elibera H 2).
In sectiunea Fierul HNO 3 se dizolvă, intră în soluție sub formă de cationi Fe 3+ și anionul acid este redus la NO*:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Foarte solubil într-un amestec de HCI și HNO3
5. Relația cu alcalii
Fe nu se dizolvă în soluții apoase de alcalii. Reacționează cu alcalii topiți numai la temperaturi foarte ridicate.
6. Interacțiunea cu sărurile metalelor mai puțin active
Fe + CuSO 4 = FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Interacțiunea cu monoxidul de carbon gazos (t = 200°C, P)
Fe (pulbere) + 5CO (g) = Fe 0 (CO) 5 pentacarbonil de fier
Compuși Fe(III).
Fe 2 O 3 - oxid de fier (III).
pudră roșu-brun, n. R. în H 2 O. În natură - „minereu de fier roșu”.
Modalitati de obtinere:
1) descompunerea hidroxidului de fier (III).
2Fe(OH)3 = Fe2O3 + 3H2O
2) arderea piritei
4FeS 2 + 11O 2 = 8SO 2 + 2Fe 2 O 3
3) descompunerea nitraților
Proprietăți chimice
Fe 2 O 3 este un oxid bazic cu semne de amfoteritate.
I. Principalele proprietăți se manifestă în capacitatea de a reacționa cu acizii:
Fe2O3 + 6H + = 2Fe3+ + ZH2O
Fe2O3 + 6HCI = 2FeCl3 + 3H2O
Fe 2 O 3 + 6HNO 3 = 2Fe(NO 3) 3 + 3H 2 O
II. Proprietăți acide slabe. Fe 2 O 3 nu se dizolvă în soluții apoase de alcalii, dar atunci când sunt topite cu oxizi solizi, alcalii și carbonați, ferite formează:
Fe 2 O 3 + CaO = Ca(FeO 2) 2
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Fe 2 O 3 + MgCO 3 = Mg(FeO 2) 2 + CO 2
III. Fe 2 O 3 - materie primă pentru producția de fier în metalurgie:
Fe 2 O 3 + ZS = 2Fe + ZSO sau Fe 2 O 3 + ZSO = 2Fe + ZSO 2
Fe(OH) 3 - hidroxid de fier (III).
Modalitati de obtinere:
Obținut prin acțiunea alcalinelor asupra sărurilor solubile de Fe 3+:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
În momentul preparării, Fe(OH)3 este un sediment mucos-amorf roșu-brun.
Hidroxidul de Fe(III) se formează și în timpul oxidării Fe și Fe(OH)2 în aerul umed:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
4Fe(OH) 2 + 2H 2 O + O 2 = 4Fe(OH) 3
Hidroxidul de Fe(III) este produsul final al hidrolizei sărurilor Fe3+.
Proprietăți chimice
Fe(OH)3 este o bază foarte slabă (mult mai slabă decât Fe(OH)2). Prezintă proprietăți acide vizibile. Astfel, Fe(OH)3 are un caracter amfoter:
1) reacțiile cu acizii apar ușor:
2) precipitatul proaspăt de Fe(OH)3 se dizolvă în conc. soluții de KOH sau NaOH cu formarea de complecși hidroxo:
Fe(OH)3 + 3KOH = K3
Într-o soluție alcalină, Fe(OH)3 poate fi oxidat la ferați (săruri ale acidului de fier H 2 FeO 4 care nu sunt eliberate în stare liberă):
2Fe(OH) 3 + 10KOH + 3Br 2 = 2K 2 FeO 4 + 6KBr + 8H 2 O
Săruri de Fe 3+
Cele mai importante practic sunt: Fe 2 (SO 4) 3, FeCl 3, Fe(NO 3) 3, Fe(SCN) 3, K 3 4 - sare galbenă de sânge = Fe 4 3 albastru prusac (precipitat albastru închis)
b) Fe 3+ + 3SCN - = Fe(SCN) 3 tiocianat Fe(III) (soluție de roșu sânge)