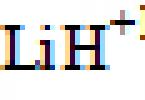Unul dintre conceptele de bază în chimie, utilizat pe scară largă în elaborarea ecuațiilor reacțiilor redox, este starea de oxidare atomi.
În scopuri practice (când se compun ecuații pentru reacțiile redox), este convenabil să se reprezinte sarcinile atomilor din moleculele cu legături polare ca numere întregi egale cu sarcinile care ar apărea pe atomi dacă electronii de valență ar fi transferați complet la atomi mai electronegativi, adică e. dacă legăturile erau complet ionice. Aceste valori de sarcină se numesc stări de oxidare. Starea de oxidare a oricărui element dintr-o substanță simplă este întotdeauna 0.
În moleculele substanțelor complexe, unele elemente au întotdeauna o stare de oxidare constantă. Majoritatea elementelor se caracterizează prin stări de oxidare variabile, care diferă atât ca semn, cât și ca mărime, în funcție de compoziția moleculei.
Adesea, starea de oxidare este egală cu valența și diferă de aceasta doar prin semn. Dar există compuși în care starea de oxidare a unui element nu este egală cu valența acestuia. După cum sa menționat deja, în substanțele simple starea de oxidare a unui element este întotdeauna zero, indiferent de valența acestuia. Tabelul compară valențele și stările de oxidare ale unor elemente din diverși compuși.
Starea de oxidare a unui atom (element) într-un compus este sarcina condiționată calculată în ipoteza că compusul este format numai din ioni. Când se determină starea de oxidare, se presupune în mod convențional că electronii de valență dintr-un compus sunt transferați la mai mulți atomi electronegativi și, prin urmare, compușii constau din ioni încărcați pozitiv și negativ. În realitate, în cele mai multe cazuri, nu există o donație completă de electroni, ci doar o deplasare a unei perechi de electroni de la un atom la altul. Apoi putem da o altă definiție: starea de oxidare este sarcina electrică care ar apărea asupra unui atom dacă perechile de electroni cu care este conectat la alți atomi din compus ar fi transferate la mai mulți atomi electronegativi, iar perechile de electroni care leagă atomi identici ar fi fost împărțit între ei.
La calcularea stărilor de oxidare, se utilizează o serie de reguli simple:
1 . Starea de oxidare a elementelor din substanțele simple, atât monoatomice cât și moleculare, este zero (Fe 0, O 2 0).
2 . Starea de oxidare a unui element sub forma unui ion monoatomic este egală cu sarcina acestui ion (Na +1, Ca +2, S –2).
3 . În compușii cu o legătură polară covalentă, o sarcină negativă se referă la atomul mai electronegativ, iar o sarcină pozitivă la atomul mai puțin electronegativ, iar stările de oxidare ale elementelor iau următoarele valori:
Starea de oxidare a fluorului în compuși este întotdeauna -1;
Starea de oxidare a oxigenului din compuși este -2 (); cu excepția peroxizilor, unde este formal egal cu -1 (), fluorură de oxigen, unde este egală cu +2 (), precum și a superoxizilor și ozonidelor, în care starea de oxidare a oxigenului este -1/2;
Starea de oxidare a hidrogenului în compuși este +1 (), cu excepția hidrurilor metalice, unde este -1 ( ![]() );
);
Pentru elementele alcaline și alcalino-pământoase, stările de oxidare sunt +1 și, respectiv, +2.
Majoritatea elementelor pot prezenta stări de oxidare variabile.
4 . Suma algebrică a stărilor de oxidare într-o moleculă neutră este egală cu zero, într-un ion complex este egală cu sarcina ionului.
Pentru elementele cu stare de oxidare variabilă, valoarea acesteia este ușor de calculat, cunoscând formula compusului și folosind regula nr. 4. De exemplu, este necesar să se determine gradul de oxidare a fosforului în acidul fosforic H 3 PO 4. Deoarece oxigenul are CO = –2, iar hidrogenul are CO = +1, atunci pentru ca fosforul să aibă o sumă zero, starea de oxidare trebuie să fie +5:
De exemplu, în NH 4 Cl, suma stărilor de oxidare ale tuturor atomilor de hidrogen este 4×(+1), iar starea de oxidare a clorului este -1, prin urmare, starea de oxidare a azotului trebuie să fie egală cu -3. În ionul SO 4 2– sulfat, suma stărilor de oxidare ale celor patru atomi de oxigen este -8, deci sulful trebuie să aibă o stare de oxidare de +6 pentru ca sarcina totală a ionului să fie -2.
Conceptul de stare de oxidare pentru majoritatea compușilor este condiționat, deoarece nu reflectă sarcina efectivă reală a unui atom, dar acest concept este foarte utilizat în chimie.
Maximul, iar pentru nemetale, starea minimă de oxidare are o dependență periodică de numărul de serie din D.I. Mendeleev, care se datorează structurii electronice a atomului.
| Element | Valori ale stării de oxidare și exemple de compuși |
| F | –1 (HF, KF) |
| O | –2 (H2O, CaO, CO2); –1 (H2O2); +2 (DIN 2) |
| N | –3 (NH3); –2(N2H4); –1 (NH2OH); +1 (N20); +2 (NU); +3 (N203, HNO2); +4 (NO 2); +5 (N2O5, HNO3) |
| Cl | –1 (HCl, NaCl); +1 (NaCIO); +3 (NaCl02); +5 (NaCI03); +7 (Cl2O7, NaClO4) |
| Br | –1 (KBr); +1 (BrF); +3 (BrF3); +5 (KBrO 3) |
| eu | –1 (HI); +1 (ICl); +3 (IC13); +5 (I2O5); +7 (IO 3 F, K 5 IO 6) |
| C | –4 (CH4); +2 (CO); +4 (CO2, CCl4) |
| Si | –4 (Ca 2 Si); +2 (SiO); +4 (SiO2, H2SiO3, SiF4) |
| H | –1 (LiH); +1 (H20, HCI) |
| S | –2 (H2S, FeS); +2 (Na2S2O3); +3 (Na2S2O4); +4 (S02, Na2S03, SF4); +6 (SO3, H2SO4, SF6) |
| Se, Te | –2 (H2Se, H2Te); +2 (SeCl2, TeCI2); +4 (Se02, Te02); +6 (H2SeO4, H2TeO4) |
| P | –3 (PH 3); +1 (H3P02); +3 (H3P03); +5 (P2O5, H3PO4) |
| Ca, Sb | –3 (GaAs, Zn3Sb2); +3 (AsCI3, Sb203); +5 (H3AsO4, SbCl5) |
| Li, Na, K | +1 (NaCl) |
| Fii, Mg, Ca | +2 (MgO, CaCO3) |
| Al | +3 (Al2O3, AlCl3) |
| Cr | +2 (CrCI2); +3 (Cr203, Cr2(S04)3); +4 (Cr02); +6 (K 2 CrO 4, K 2 Cr 2 O 7) |
| Mn | +2 (MnS04); +3 (Mn2(S04)3); +4 (Mn02); +6 (K2Mn04); +7 (KMnO 4) |
| Fe | +2 (FeO, FeS04); +3 (Fe203, FeCI3); +4 (Na2FeO3) |
| Cu | +1 (Cu20); +2 (CuO, CuSO4, Cu2(OH)2CO3) |
| Ag | +1 (AgNO 3) |
| Au | +1 (AuCI); +3 (AuCl 3, KAuCl 4) |
| Zn | +2 (ZnO, ZnSO 4) |
| Hg | +1 (Hg2CI2); +2 (HgO, HgCl2) |
| Sn | +2 (SnO); +4 (SnO2, SnCl4) |
| Pb | +2 (Pb0, PbS04); +4 (PbO2) |
În reacțiile chimice trebuie îndeplinită regula păstrării sumei algebrice a stărilor de oxidare ale tuturor atomilor. În ecuația completă a unei reacții chimice, procesele de oxidare și de reducere trebuie să se compenseze exact între ele. ecuații ale reacțiilor redox, în al doilea rând, pentru a prezice proprietățile redox ale elementelor dintr-un compus.
Multe elemente se caracterizează prin mai multe valori ale stărilor de oxidare, iar prin calcularea stării de oxidare a acesteia se pot prezice proprietăți redox: un element în starea de oxidare negativă cea mai înaltă poate doar dona electroni (oxida) și poate fi un agent reducător, în cea mai mare stare de oxidare. stare de oxidare pozitivă poate accepta doar electroni (reduce) și poate fi un agent oxidant, în stări intermediare de oxidare - atât oxidează, cât și reduc.
Oxido-reducerea este un proces unic, interconectat. Oxidare corespunde unei creșteri a stării de oxidare a elementului și recuperare - reducerea acestuia.
Multe manuale aderă la interpretarea oxidării ca pierdere de electroni și a reducerii ca câștig al acestora. Această abordare, propusă de omul de știință rus Pisarzhevsky (1916), este aplicabilă proceselor electrochimice pe electrozi și se referă la descărcarea (încărcarea) ionilor și moleculelor.
Cu toate acestea, explicația modificărilor stărilor de oxidare ca procese de îndepărtare și adăugare de electroni este în general incorectă. Poate fi aplicat unor ioni simpli, cum ar fi
CI--®CI0.
Pentru a schimba starea de oxidare a atomilor din ionii complecși, cum ar fi
CrO42-®Cr +3
o scădere a stării de oxidare pozitivă a cromului de la +6 la +3 corespunde unei creșteri reale mai mici a sarcinii pozitive (pe Cr în CrO 4 2 - sarcină reală „+0,2 sarcină de electroni, iar pe Cr +3 - de la +2 la +1,5 în diferite conexiuni).
Transferul de sarcină de la agentul de reducere la agentul de oxidare, egal cu schimbarea stării de oxidare, are loc cu participarea altor particule, de exemplu, ionii H +:
Cr042- + 8H + + 3®Cr +3 + 4H2O.
Intrarea prezentată se numește semireacții .
Informații conexe.
M.A.AKHMETOV
Note de curs
în chimia generală
Continuare. Vezi începutul în№ 8, 12, 13, 20, 23, 25-26, 40/2004
Capitolul 5.
Redox
reactii
5.1. Determinarea stării de oxidare
Reacțiile redox sunt reacții care implică transferul de electroni de la un atom la altul. Transferul de electroni este judecat prin modificările stărilor de oxidare ale atomilor. Dacă starea de oxidare a unui atom se schimbă, atunci se schimbă și mediul său electronic. Există două moduri de a determina stările de oxidare ale atomilor: primul– prin formula bruta
, al doilea– conform formulei structurale
.
La determinarea stărilor de oxidare ale atomilor în primul mod, se utilizează următoarea regulă: suma stărilor de oxidare ale tuturor atomilor care formează o particulă este egală cu sarcina particulei
. Pentru o moleculă această sumă este egală cu zero, iar pentru un ion este egală cu sarcina sa.
Ca o ilustrare, să determinăm starea de oxidare a atomilor din tiosulfatul de sodiu Na 2 S 2 O 3 folosind prima metodă. Dintre elementele care formează o particulă, oxigenul este cel mai electronegativ - va accepta electroni. Deoarece oxigenul se află în subgrupul principal al grupului VI, îi lipsesc doi electroni pentru a completa stratul de electroni. Prin urmare, atomul de oxigen va prelua doi electroni și va dobândi o stare de oxidare de –2. Cel mai electropozitiv atom este sodiul, care are doar un electron la nivelul său electronic exterior (sodiul îl va elibera). Aceste considerații, ținând cont de formula tiosulfatului de sodiu, ne permit să creăm ecuația:
2 (+1) + 2X + 3 (–2) = 0,
a cărei soluție va da valoarea stării de oxidare a atomului de sulf (+2).
Puteți determina stările de oxidare ale atomilor din ionii complecși. Ca exemplu, luați în considerare anionul. În el, cel mai electronegativ atom de oxigen acceptă doi electroni și are o stare de oxidare de –2. Starea de oxidare a atomului de crom este determinată din ecuația:
2X + 7 (–2) = –2
și este egal cu +6.
A doua modalitate de a găsi stările de oxidare ale atomilor - folosind formula structurală - se bazează pe definiția: starea de oxidare
– Aceasta este sarcina întreagă convențională care ar fi pe un atom dacă toate legăturile sale covalente polare ar deveni ionice. Desenarea formulei structurale a tiosulfatului de sodiu

Să determinăm starea de oxidare a atomilor săi.
Atomii de sodiu legați prin legături simple la mai mulți atomi de oxigen electronegativi își vor ceda în mod natural electronii exteriori acestora, fiecare dobândind o stare de oxidare de +1. Atomii de oxigen care au două legături cu mai mulți atomi electropozitivi vor accepta condiționat doi electroni și vor avea o stare de oxidare de –2. Din formula structurală este clar că compusul conține doi atomi de sulf în medii diferite. Unul dintre atomii de S este conectat doar printr-o legătură dublă la un alt atom de S, iar starea sa de oxidare este zero. Al doilea atom de sulf are patru legături cu încă trei atomi de oxigen electronegativi și, prin urmare, are o stare de oxidare de +4.
Starea medie de oxidare a atomilor de sulf, ca la determinarea ei în primul mod, este +2 ((+4+0)/2).
Atomul de oxigen nu are întotdeauna o stare de oxidare de –2. De exemplu, în combinația sa cu atomi de fluor are o stare de oxidare pozitivă. La peroxizi, starea de oxidare a fiecărui atom de oxigen este egală cu , la superoxizi este doar , iar la ozonide este egală cu . De asemenea, starea de oxidare a unui atom de sulf poate fi –1, de exemplu în disulfuri. La unii oxizi, de exemplu Fe 3 O 4 și Pb 3 O 4, stările de oxidare ale atomilor sunt determinate pe baza faptului că acești oxizi sunt amestecați: Fe 2 O 3 FeO și respectiv PbO 2 2PbO.
5.2. Scrierea ecuațiilor
reacții redox
Selectarea coeficienților în ecuațiile reacțiilor redox se realizează prin întocmirea unei balanțe electronice. Metoda de selecție, care se rezumă la numărarea numărului de atomi din partea dreaptă și stângă a ecuației, nu garantează întotdeauna determinarea corectă a coeficienților. Astfel, cele trei ecuații de mai jos pentru oxidarea trietilaminei cu acid azotic conțin un număr egal de atomi de carbon, hidrogen, oxigen și azot pe partea stângă și dreaptă, dar numai unul dintre ei este realizat:
4(C2H5)3N + 36HNO3 = 24CO2 + 48H2O + 6NO2 + 17N2,
2(C2H5)3N + 78HNO3 = 12CO2 + 54H2O + 78NO2 + N2,
(C2H5)3N + 11HNO3 = 6CO2 + 13H2O + 4NO2 + 4N2.
Teoria procesului redox implică transferul de electroni de la atomii de agent reducător la atomii de agent de oxidare. Conform legii conservării materiei, numărul total de electroni cedați de agentul reducător este egal cu numărul total de electroni acceptați de agentul oxidant. Această idee simplă ghidează compilarea ecuațiilor pentru reacțiile redox. Sarcina este de a selecta coeficienții de proporționalitate la care se realizează echilibrul electronic.
Să ne uităm la un exemplu de oxidare a unei molecule de etilbenzen cu permanganat de potasiu într-un mediu acid când este încălzită. Să notăm ecuația reacției și să indicăm stările de oxidare ale acelor atomi care au schimbat-o și să le determinăm stările de oxidare în moleculele de etilbenzen și acid benzoic folosind formulele structurale corespunzătoare:

Atomul de carbon legat direct de inelul benzenic își va schimba starea de oxidare de la –2 la +3 (cedând 5 electroni). Atomul de carbon al grupării metil va schimba starea de oxidare de la –3 la +4 în dioxid de carbon (cedând 7 electroni). În total, molecula de etilbenzen va ceda 12 electroni. Atomul de mangan își va schimba starea de oxidare de la +7 la +2 (ocupând 5 electroni). În acest caz avem ecuația:
12X = 5y,
ale căror soluții întregi pozitive minime sunt egale cu X = 5, la = 12.
Selectarea coeficienților din ecuații prin reacția de disproporționare folosind metoda echilibrului electronic trebuie efectuată în partea dreaptă a acestora. De exemplu, să ne uităm la disproporționarea sării Berthollet (fără catalizator):
![]()
Din modificările stărilor de oxidare ale atomilor în timpul reacției, rezultă că a acceptat 6 electroni, dar se presupune că a cedat 2 electroni.
Apoi
(КCl) = 3(КClО 4).
Prin urmare, este necesar să se pună un coeficient de 3 în fața percloratului de potasiu KClO 4:
4KClO3 = KCl + 3KClO4.
5.3. Electroliză
Descompunerea unui electrolit (în soluție sau topitură) atunci când un curent electric trece prin el se numește electroliză
.
Instrumentarea procesului de electroliză se reduce la faptul că doi electrozi conectați la o sursă de curent sunt coborâți într-un vas cu o soluție sau electrolit topit (Fig. 5.1).
Se numește un electrod încărcat negativ catod
(cationii sunt atrași de acesta), iar electrodul încărcat pozitiv - anod
(atrage anionii). Circuitul electric este închis din cauza proceselor redox care au loc la electrozi. Reducerea cationilor are loc la catod, iar oxidarea anionilor are loc la anod.
Să începem să luăm în considerare procesul cu cel mai simplu caz - electroliza topiturii.În timpul electrolizei topiturii la catod cationii metalici se reduc la metal pur și la anod Anionii simpli sunt oxidați la o substanță simplă, de exemplu:
2Сl – – 2 e= CI2,
S 2 – – 2 e= S.
Dacă anionul are o structură complexă, atunci în acest caz are loc un proces care necesită cea mai mică cantitate de energie. Dacă sarea este rezistentă la căldură și atomul elementului din anion este în starea sa cea mai ridicată de oxidare, atunci oxigenul este de obicei oxidat la o substanță simplă:
– 2e= SO 3 + 1/2O 2.
Dacă un atom al unui element se află într-o stare intermediară de oxidare, atunci este cel mai probabil ca în acest caz să nu fie oxigenul care va fi oxidat, ci un atom al altui element din anion, de exemplu:
– e= NU 2 .
Electroliza în soluții este mai complexă în ceea ce privește determinarea produselor. Acest lucru se datorează apariției unei alte componente - apa. Metalele cu potențiale standard ale electrodului de la –1,67 V (Al) și mai jos (situate la stânga manganului în seria tensiunilor metalice) nu sunt, de regulă, reduse din soluțiile apoase. În astfel de sisteme, hidrogenul este eliberat la catod. Acest lucru se datorează în primul rând faptului că aceste metale (inclusiv magneziu și aluminiu fără peliculă de oxid protector) reacționează cu apa. Dar asta nu înseamnă că electrodul procesează, cum ar fi
Na++ e= Na
nu apar în soluții apoase. Una dintre modalitățile de obținere a sodiului metalic este electroliza unei soluții apoase de NaCl (saramură). Secretul acestui proces constă în utilizarea unui catod de mercur. Atomii de sodiu redusi sunt absorbiti de un strat de mercur, care ii protejeaza de contactul cu apa. Separarea ulterioară în componente ale amalgamului de sodiu rezultat (amalgamul este un aliaj, unul dintre componentele căruia este mercurul) se realizează prin rectificare. Mercurul eliberat este apoi readus la ciclul de funcționare.
Imposibilitatea obținerii de metale care interacționează cu apa prin electroliza soluțiilor apoase ale electroliților corespunzători este evidențiată și de următorul raționament. Lăsați să se reducă calciul în timpul electrolizei unei soluții apoase la catod:
Ca 2+ + 2 e=Ca.
Metalul, după ce s-a recuperat, va reacționa cu apa:
Ca + 2H2O = Ca(OH)2 + H2.
În consecință, în loc de metal, hidrogenul va fi eliberat la catod.
Metalele cu potențiale standard ale electrodului în intervalul de la –1,05 V la 0 V (situate în seria electrochimică între aluminiu și hidrogen) sunt reduse din soluții apoase în paralel cu hidrogenul. Raportul dintre produse (metal și hidrogen) este determinat de concentrația soluției, aciditatea acesteia și alți factori (prezența altor săruri, în special complexe, în soluție; materialul din care este fabricat electrodul). Cu cât concentrația de sare este mai mare, cu atât este mai mare proporția de metal eliberat. Cu cât mediul este mai acid, cu atât este mai probabilă evoluția metalelor cu electrod standard pozitiv
potențialele (situate în seria tensiunilor metalice din dreapta hidrogenului) sunt eliberate în primul rând în timpul electrolizei soluțiilor. De exemplu:
Ag++ e= Ag.
La anod, în timpul electrolizei soluțiilor apoase, toți anionii simpli sunt oxidați, cu excepția fluorului. De exemplu:
2I – – 2 e= I 2 .
Fluorul nu poate fi obţinut prin electroliza soluţiilor apoase, deoarece reactioneaza cu apa:
F2 + H20 = 2HF + 1/2O2.
Dacă sarea supusă electrolizei conține un anion complex în care heteroatom (nu oxigenul) se află în cea mai mare stare de oxidare, atunci la anod se formează oxigen, adică. are loc descompunerea apei:
H2O – 2 e= 2H + + 1/2O2.
Anionul complex în sine poate servi și ca sursă de oxigen:
– 2e= SO 3 + 1/2O 2.
Anhidrida acidă rezultată va reacționa imediat cu apa:
SO3 + H2O = H2SO4.
Când un heteroatom este într-o stare intermediară de oxidare, heteroatom este cel care este oxidat, nu atomul de oxigen. Un exemplu de astfel de proces este oxidarea ionului sulfit sub influența curentului electric:
![]()
Anhidrida sulfurică SO3 rezultată reacţionează imediat cu apa.
Anionii acizilor carboxilici sunt decarboxilați ca rezultat al electrolizei, formând hidrocarburi:
2R–COO – – 2 e= R–R + 2CO2.
5.4. Direcția oxidativă-
procesele de recuperare
și influența acidității mediului asupra acestuia
O măsură a capacității redox a substanțelor din soluții apoase sunt potențialele redox sau standard ale electrodului. Să determinăm, de exemplu, dacă cationul de fier Fe 3+ poate oxida anionii de halogen în KCl, KBr și KI. Cunoscând potențialele standard ale electrodului ( 0), putem calcula forța electromotoare (EMF) a procesului. Este definită ca diferența dintre potențialele agentului de oxidare și ale agentului reducător, iar reacția are loc la o valoare EMF pozitivă:
![]()
Tabelul 5.1
Determinarea posibilității de scurgere
procese redox
bazat pe potențialele standard ale electrodului
Masa 5.1 arată că doar unul dintre procesele studiate este posibil. Într-adevăr, dintre toate halogenurile de potasiu de mai sus, numai KI reacționează cu triclorura de fier:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl.
Există o altă modalitate simplă de a determina direcția procesului. Dacă scriem două ecuații de semireacție ale procesului una sub alta, astfel încât potențialul standard al electrodului semireacției superioare să fie mai mic decât cel al celei inferioare, atunci litera Z scrisă între ele (Fig. 5.2) va indica cu capetele sale direcţiile etapelor procesului permis (regula Z).
Din aceleași substanțe, prin modificarea pH-ului mediului se pot obține diferite produse. De exemplu, anionul permanganat într-un mediu acid este redus pentru a forma un compus de mangan (II):
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = K 2 SO 4 + 2MnSO 4 + 5Na 2 SO 4 + 3H 2 O.
Într-un mediu neutru, se formează dioxid de mangan MnO 2:
2KMnO 4 + 3Na 2 SO 3 + H 2 O = 2KOH + 2MnO 2 + 3Na 2 SO 4.
Într-un mediu alcalin, anionul permanganat este redus la anionul manganat:
2КМnО 4 + Na 2 SO 3 + 2KOH = 2К 2 MnO 4 + Na 2 SO 4 + H 2 O.
5.5. Exerciții
1. Determinaţi stările de oxidare ale atomilor din următorii compuşi: BaO 2, CsO 2, RbO 3, F 2 O 2, LiH, F 2, C 2 H 5 OH, toluen, benzaldehidă, acid acetic.
Elementul chimic dintr-un compus, calculat din ipoteza că toate legăturile sunt ionice.
Stările de oxidare pot avea o valoare pozitivă, negativă sau zero, prin urmare suma algebrică a stărilor de oxidare ale elementelor dintr-o moleculă, ținând cont de numărul de atomi ai acestora, este egală cu 0, iar într-un ion - sarcina ionului .
1. Stările de oxidare ale metalelor din compuși sunt întotdeauna pozitive.
2. Cea mai mare stare de oxidare corespunde numărului grupului din tabelul periodic în care se află elementul (excepțiile sunt: Au +3(eu grup), Cu +2(II), din grupa VIII starea de oxidare +8 poate fi găsită doar în osmiu Osși ruteniu Ru.
3. Starile de oxidare ale nemetalelor depind de atomul la care este conectat:
- dacă cu un atom de metal, atunci starea de oxidare este negativă;
- dacă există un atom nemetal, atunci starea de oxidare poate fi fie pozitivă, fie negativă. Depinde de electronegativitatea atomilor elementelor.
4. Cea mai mare stare de oxidare negativă a nemetalelor poate fi determinată scăzând din 8 numărul grupului în care se află elementul, adică. cea mai mare stare de oxidare pozitivă este egală cu numărul de electroni din stratul exterior, care corespunde numărului de grup.
5. Stările de oxidare ale substanțelor simple sunt 0, indiferent dacă este un metal sau un nemetal.
Elemente cu stari de oxidare constante.
|
Element |
Stare de oxidare caracteristică |
Excepții |
|
Hidruri metalice: LIH -1 |
||
|
Starea de oxidare numită sarcină condiționată a unei particule în ipoteza că legătura este complet ruptă (are un caracter ionic). H- Cl = H + + Cl - , Legătura acidului clorhidric este covalent polar. Perechea de electroni este mai deplasată spre atom Cl - , deoarece este un element mai electronegativ. Cum se determină starea de oxidare?Electronegativitatea este capacitatea atomilor de a atrage electroni din alte elemente. Numărul de oxidare este indicat deasupra elementului: Br 2 0 , Na 0 , O +2 F2 -1 ,K + Cl - etc. Poate fi negativ și pozitiv. Starea de oxidare a unei substanțe simple (nelegat, stare liberă) este zero. Starea de oxidare a oxigenului pentru majoritatea compușilor este -2 (excepția sunt peroxizii H2O2, unde este egal cu -1 și compuși cu fluor - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Stare de oxidare a unui ion monoatomic simplu este egal cu sarcina lui: N / A + , Ca +2 . Hidrogenul din compușii săi are o stare de oxidare de +1 (excepțiile sunt hidrurile - N / A + H - și tip conexiuni C +4 H 4 -1 ). În legăturile metal-nemetal, starea de oxidare negativă este atomul care are electronegativitate mai mare (datele despre electronegativitate sunt date în scara Pauling): H + F - , Cu + Br - , Ca +2 (NU 3 ) - etc. Reguli pentru determinarea gradului de oxidare în compușii chimici.Să luăm legătura KMnO 4 , este necesar să se determine starea de oxidare a atomului de mangan. Raţionament:
K+Mn X O 4 -2 Lăsa X- starea de oxidare a manganului necunoscută nouă. Numărul de atomi de potasiu este 1, mangan - 1, oxigen - 4. S-a dovedit că molecula în ansamblu este neutră din punct de vedere electric, deci sarcina sa totală trebuie să fie zero. 1*(+1) + 1*(X) + 4(-2) = 0, X = +7, Aceasta înseamnă că starea de oxidare a manganului în permanganat de potasiu = +7. Să luăm un alt exemplu de oxid Fe2O3. Este necesar să se determine starea de oxidare a atomului de fier. Raţionament:
2*(X) + 3*(-2) = 0, Concluzie: starea de oxidare a fierului în acest oxid este +3. Exemple. Determinați stările de oxidare ale tuturor atomilor din moleculă. 1. K2Cr2O7. Starea de oxidare K +1, oxigen O -2. Indici dati: O=(-2)×7=(-14), K=(+1)×2=(+2). Deoarece suma algebrică a stărilor de oxidare ale elementelor dintr-o moleculă, ținând cont de numărul atomilor lor, este egală cu 0, atunci numărul stărilor de oxidare pozitive este egal cu numărul celor negative. Stări de oxidare K+O=(-14)+(+2)=(-12). De aici rezultă că atomul de crom are 12 puteri pozitive, dar există 2 atomi în moleculă, ceea ce înseamnă că există (+12) per atom: 2 = (+6). Răspuns: K2 + Cr2 +607-2. 2.(AsO4) 3-. În acest caz, suma stărilor de oxidare nu va mai fi egală cu zero, ci cu sarcina ionului, adică. - 3. Să facem o ecuație: x+4×(- 2)= - 3 . Răspuns: (Ca +504-2) 3-. |
Pentru a plasa corect stări de oxidare, trebuie să ții cont de patru reguli.
1) Într-o substanță simplă, starea de oxidare a oricărui element este 0. Exemple: Na 0, H 0 2, P 0 4.
2) Ar trebui să vă amintiți elementele care sunt caracteristice stari de oxidare constante. Toate sunt enumerate în tabel.
3) Cea mai mare stare de oxidare a unui element, de regulă, coincide cu numărul grupului în care se află elementul (de exemplu, fosforul este în grupa V, cel mai mare s.d. al fosforului este +5). Excepții importante: F, O.
4) Căutarea stărilor de oxidare ale altor elemente se bazează pe o regulă simplă:
Într-o moleculă neutră, suma stărilor de oxidare ale tuturor elementelor este zero, iar într-un ion - sarcina ionului.
Câteva exemple simple pentru determinarea stărilor de oxidare
Exemplul 1. Este necesar să se găsească stările de oxidare ale elementelor din amoniac (NH 3).
Soluţie. Știm deja (vezi 2) că art. BINE. hidrogenul este +1. Rămâne de găsit această caracteristică pentru azot. Fie x starea de oxidare dorită. Creăm cea mai simplă ecuație: x + 3 (+1) = 0. Soluția este evidentă: x = -3. Răspuns: N-3H3+1.
Exemplul 2. Indicați stările de oxidare ale tuturor atomilor din molecula de H 2 SO 4.
Soluţie. Sunt deja cunoscute stările de oxidare ale hidrogenului și oxigenului: H(+1) și O(-2). Creăm o ecuație pentru a determina starea de oxidare a sulfului: 2 (+1) + x + 4 (-2) = 0. Rezolvând această ecuație, găsim: x = +6. Răspuns: H +1 2 S +6 O -2 4.
Exemplul 3. Calculați stările de oxidare ale tuturor elementelor din molecula de Al(NO 3) 3.
Soluţie. Algoritmul rămâne neschimbat. Compoziția „moleculei” de azotat de aluminiu include un atom de Al (+3), 9 atomi de oxigen (-2) și 3 atomi de azot, a căror stare de oxidare trebuie să o calculăm. Ecuația corespunzătoare este: 1 (+3) + 3x + 9 (-2) = 0. Răspuns: Al +3 (N +5 O -2 3) 3.
Exemplul 4. Determinați stările de oxidare ale tuturor atomilor din ionul (AsO 4) 3-.
Soluţie. În acest caz, suma stărilor de oxidare nu va mai fi egală cu zero, ci cu sarcina ionului, adică -3. Ecuația: x + 4 (-2) = -3. Răspuns: As(+5), O(-2).
Ce trebuie făcut dacă stările de oxidare a două elemente sunt necunoscute
Este posibil să se determine stările de oxidare ale mai multor elemente deodată folosind o ecuație similară? Dacă luăm în considerare această problemă din punct de vedere matematic, răspunsul va fi negativ. O ecuație liniară cu două variabile nu poate avea o soluție unică. Dar rezolvăm mai mult decât o ecuație!
Exemplul 5. Determinați stările de oxidare ale tuturor elementelor din (NH 4 ) 2 SO 4.
Soluţie. Sunt cunoscute stările de oxidare ale hidrogenului și oxigenului, dar sulful și azotul nu sunt. Un exemplu clasic de problemă cu două necunoscute! Vom considera sulfatul de amoniu nu ca o singură „moleculă”, ci ca o combinație de doi ioni: NH 4 + și SO 4 2-. Încărcăturile ionilor ne sunt cunoscute, fiecare dintre ele conține doar un atom cu o stare de oxidare necunoscută. Folosind experiența acumulată în rezolvarea problemelor anterioare, putem găsi cu ușurință stările de oxidare ale azotului și sulfului. Răspuns: (N-3H4+1)2S+6O4-2.
Concluzie: dacă o moleculă conține mai mulți atomi cu stări de oxidare necunoscute, încercați să „împarți” molecula în mai multe părți.
Cum să aranjezi stările de oxidare în compușii organici
Exemplul 6. Indicați stările de oxidare ale tuturor elementelor din CH 3 CH 2 OH.
Soluţie. Găsirea stărilor de oxidare în compușii organici are propriile sale specificități. În special, este necesar să se găsească separat stările de oxidare pentru fiecare atom de carbon. Puteți raționa după cum urmează. Luați în considerare, de exemplu, atomul de carbon din grupa metil. Acest atom de C este conectat la 3 atomi de hidrogen și un atom de carbon vecin. De-a lungul legăturii C-H, densitatea electronilor se deplasează către atomul de carbon (deoarece electronegativitatea lui C depășește EO a hidrogenului). Dacă această deplasare ar fi completă, atomul de carbon ar dobândi o sarcină de -3.
Atomul de C din grupa -CH 2 OH este legat de doi atomi de hidrogen (o schimbare a densității electronilor către C), un atom de oxigen (o schimbare a densității electronilor către O) și un atom de carbon (se poate presupune că deplasarea în densitatea electronică în acest caz nu se întâmplă). Starea de oxidare a carbonului este -2 +1 +0 = -1.
Răspuns: C-3H+13C-1H+12O-2H+1.
Nu confundați conceptele de „valență” și „stare de oxidare”!
Numărul de oxidare este adesea confundat cu valența. Nu face această greșeală. Voi enumera principalele diferențe:
- starea de oxidare are semn (+ sau -), valența nu;
- starea de oxidare poate fi zero chiar și într-o substanță complexă, valență egală cu zero înseamnă, de regulă, că un atom al unui element dat nu este conectat la alți atomi (nu vom discuta despre niciun fel de compuși de incluziune și alte „exotice”; Aici);
- starea de oxidare este un concept formal care capătă sens real numai în compușii cu legături ionice conceptul de „valență”, dimpotrivă, este cel mai convenabil aplicat în raport cu compușii covalenti;
Starea de oxidare (mai precis, modulul său) este adesea egală numeric cu valența, dar și mai des aceste valori NU coincid. De exemplu, starea de oxidare a carbonului din CO2 este +4; valența lui C este de asemenea egală cu IV. Dar în metanol (CH 3 OH), valența carbonului rămâne aceeași, iar starea de oxidare a lui C este egală cu -1.
Un scurt test pe tema „Starea de oxidare”
Acordați câteva minute pentru a verifica înțelegerea dvs. despre acest subiect. Trebuie să răspunzi la cinci întrebări simple. Noroc!