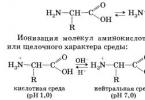
У розділі питання досвід Штерна? розкажіть коротко найголовніше заданий автором Невропатологнайкраща відповідь це Досвід Штерна – досвід, вперше проведений німецьким фізиком Отто Штерном у 1920 році. Досвід став одним із перших практичних доказів спроможності молекулярно-кінетичної теорії будови речовини. У ньому були безпосередньо виміряні швидкості теплового руху молекул та підтверджено наявність розподілу молекул газів за швидкостями.
Для проведення досвіду Штерном був підготовлений прилад, що складається з двох циліндрів різного радіусу, вісь яких збігалася і на ній розташовувався дріт з нанесеним шаром срібла. У просторі всередині циліндрів за допомогою безперервного відкачування повітря підтримувався досить низький тиск. При пропущенні електричного струму через дріт досягалася температура плавлення срібла, через що атоми починали випаровуватися і летіли до внутрішньої поверхні малого циліндра рівномірно і прямолінійно зі швидкістю v, що відповідає напрузі, що подається на кінці нитки. У внутрішньому циліндрі була пророблена вузька щілина, якою атоми могли безперешкодно пролітати далі. Стінки циліндрів спеціально охолоджувалися, що сприяло «осіданню» атомів, що потрапляють на них. У такому стані на внутрішній поверхні великого циліндра утворювалася досить вузька смуга срібного нальоту, розташована прямо навпроти щілини малого циліндра. Потім всю систему починали обертати з якоюсь досить великою кутовою швидкістю ω. При цьому смуга нальоту зміщувалась у бік, протилежний напрямку обертання, і втрачала чіткість. Вимірявши зміщення найбільш темної частини смуги від її положення, коли система спочивала, Штерн визначив час польоту, через який знайшов швидкість руху молекул:
,
де s – зміщення смуги, l – відстань між циліндрами, а u – швидкість руху точок зовнішнього циліндра.
Знайдена таким чином швидкість руху атомів срібла збіглася зі швидкістю, розрахованою за законами молекулярно-кінетичної теорії, а той факт, що смужка, що вийшла, була розмитою, свідчив на користь того, що швидкості атомів різні і розподілені за деяким законом - законом розподілу Максвелла: атоми, що рухалися швидше, зміщувалися щодо смуги, отриманої в стані спокою, на менші відстані, ніж ті, що рухалися повільніше
Ключник
Профі
(641)
вибирати треба, а ти що хотів?
У другій половині ХІХ століття дослідження броунівського (хаотичного) руху молекул викликало гострий інтерес у багатьох фізиків-теоретиків того часу. Розроблена шотландським ученим Джеймсом речовини хоч і була загальновизнаною в європейських наукових колах, але існувала лише у гіпотетичному вигляді. Жодного практичного її підтвердження тоді не було. Рух молекул залишався недоступним безпосередньому спостереженню, а вимір їх швидкості здавався просто нерозв'язною науковою проблемою.
Саме тому експерименти, здатні на практиці довести сам факт молекулярної будови речовини та визначити швидкість руху її невидимих частинок, спочатку сприймалися як фундаментальні. Вирішальне значення таких експериментів для фізичної науки було очевидним, оскільки дозволяло отримати практичне обґрунтування та доказ справедливості однієї з найпрогресивніших теорій того часу – молекулярно-кінетичної.
На початку двадцятого століття світова наука досягла достатнього розвитку для появи реальних можливостей експериментальної перевірки теорії Максвелла. Німецький фізик Отто Штерн в 1920 році, застосувавши метод молекулярних пучків, який був винайдений французом Луї Дюнойє в 1911 році, зумів виміряти швидкість руху газових молекул срібла. Досвід Штерна незаперечно довів справедливість закону. Результати цього експерименту підтвердили вірність оцінки атомів, яка випливала з гіпотетичних припущень, зроблених Максвеллом. Щоправда, про характер швидкісної градації досвід Штерна зміг дати лише дуже приблизні відомості. Докладнішої інформації науці довелося чекати ще дев'ять років.

З більшою точністю закон розподілу вдалося перевірити Ламмерту в 1929-му році, дещо вдосконалив досвід Штерна шляхом пропускання молекулярного пучка крізь пару дисків, що обертаються, мали радіальні отвори і зміщених відносно один одного на певний кут. Змінюючи швидкість обертання агрегату і кут між отворами, Ламмерт зміг виділити з пучка окремі молекули, які мають різні швидкісні показники. Але саме досвід Штерна започаткував експериментальні дослідження в галузі молекулярно-кінетичної теорії.

У 1920-му році було створено першу експериментальну установку, необхідну для проведення експериментів такого роду. Вона складалася з кількох циліндрів, сконструйованих особисто Штерном. Всередину приладу був поміщений тонкий платиновий стрижень зі срібним напиленням, яке випаровувалося при нагріванні осі електрикою. В умовах вакууму, які були створені всередині установки, вузький пучок атомів срібла проходив свозь поздовжню щілину, прорізану на поверхні циліндрів і осідав на спеціальному зовнішньому екрані. Зрозуміло, агрегат перебував у русі, і тоді, поки атоми досягали поверхні, встигав повернутися на певний кут. У такий спосіб Штерн і визначив швидкість їхнього руху.
Але це єдине наукове досягнення Отто Штерна. Через рік він разом з Вальтер Герлах провів експеримент, що підтвердив наявність у атомів спина і доказав факт їхнього просторового квантування. Досвід Штерна-Герлаха вимагає створення спеціальної експериментальної установки з потужним в її основі. Під впливом магнітного поля, що генерується цим потужним компонентом, відхилялися згідно з орієнтацією їх власного магнітного спина.
Лекція 5
В результаті численних зіткнень молекул газу між собою (~10 9 зіткнень за 1 секунду) і зі стінками судини встановлюється деякий статистичний розподіл молекул за швидкостями. У цьому напрями векторів швидкостей молекул виявляються рівноймовірними, а модулі швидкостей та його проекції на координатні осі підпорядковуються певним закономірностям.
При зіткненнях швидкості молекул змінюються випадковим чином. Може виявитися, що одна з молекул у ряді зіткнень отримуватиме енергію від інших молекул і її енергія буде значно більшою за середнє значення енергії при даній температурі. Швидкість такої молекули буде велика, проте вона матиме кінцеве значення, оскільки максимально можлива швидкість – швидкість світла - 3·10 8 м/с. Отже, швидкість молекули взагалі може мати значення від 0 до деякої υ max. Можна стверджувати, що дуже великі швидкості в порівнянні з середніми значеннями зустрічаються рідко, так само як і дуже малі.
Як показують теорія та досліди розподіл молекул за швидкостями не випадковий, а цілком певний. Визначимо скільки молекул, або яка частина молекул має швидкості, що лежать у деякому інтервалі поблизу заданої швидкості.
Нехай у цій масі газу міститься Nмолекул, при цьому dNмолекул мають швидкості, укладені в інтервалі від υ до υ +dυ. Очевидно, що це число молекул dNпропорційно до загальної кількості молекул Nта величині заданого інтервалу швидкості dυ
де a- Коефіцієнт пропорційності.
Також очевидно, що dNзалежить і від величини швидкості υ , Так як в однакових за величиною інтервалах, але при різних абсолютних значеннях швидкості число молекул буде різним (приклад: порівняйте число 20 – 21 рік і 99 – 100 років). Це означає, що коефіцієнт aу формулі (1) має бути функцією швидкості.
![]()
З урахуванням цього перепишемо (1) у вигляді
![]() (2)
(2)
З (2) отримаємо
 (3)
(3)
Функція f(υ ) називається функцією розподілу. Її фізичний зміст випливає із формули (3)
 якщо (4)
якщо (4)
Отже, f(υ ) дорівнює відносній частці молекул, швидкості яких укладені в одиничному інтервалі швидкостей поблизу швидкості υ . Більш точно функція розподілу має сенс ймовірності будь-якої молекули газу мати швидкість, укладену в одиничному інтерваліпоблизу швидкості υ . Тому її називають щільністю ймовірності.
Проінтегрувавши (2) за всіма значеннями швидкостей від 0 до отримаємо
 (5)
(5)
З (5) випливає, що
 (6)
(6)
Рівняння (6) називається умовою нормуванняфункції. Воно визначає ймовірність того, що молекула має одне із значень швидкості від 0 до . Швидкість молекули має якесь значення: ця подія достовірна та її ймовірність дорівнює одиниці.
Функція f(υ ) була знайдена Максвеллом у 1859 році. Вона була названа розподілом Максвелла:
 (7)
(7)
де A- Коефіцієнт, який не залежить від швидкості, m- Маса молекули, T- Температура газу. Використовуючи умову нормування (6), можна визначити коефіцієнт A:

Взявши цей інтеграл, отримаємо A:

З урахуванням коефіцієнта Афункція розподілу Максвелла має вигляд:
 (8)
(8)
У разі зростання υ множник (8) змінюється швидше, ніж росте υ 2 . Тому функція розподілу (8) починається на початку координат, досягає максимуму за деякого значення швидкості, потім зменшується, асимптотично наближаючись до нуля (рис.1).

Рис.1. Максвелівський розподіл молекул
за швидкостями. T 2 > T 1
Використовуючи криву розподілу Максвелла, можна графічно знайти відносне число молекул, швидкості яких лежать у заданому інтервалі швидкостей від υ до dυ(Рис.1, площа заштрихованої смужки).
Очевидно, що вся площа під кривою дає загальну кількість молекул N. З рівняння (2) з урахуванням (8) знайдемо число молекул, швидкості яких лежать в інтервалі від υ до dυ
 (9)
(9)
З (8) також видно, що конкретний вид функції розподілу залежить від роду газу (маса молекули m) і від температури і не залежить від тиску та об'єму газу.
Якщо ізольовану систему вивести зі стану рівноваги і надати собі, то через деякий проміжок часу вона повернеться в стан рівноваги. Цей проміжок часу називається часом релаксації. Для різних систем він різний. Якщо газ перебуває у рівноважному стані, то розподіл молекул за швидкостями не змінюється з часом. Швидкості окремих молекул безперервно змінюються, однак кількість молекул dN, швидкості яких лежать в інтервалі від υ до dυпостійно залишається постійним.
Максвелловское розподіл молекул за швидкостями завжди встановлюється, коли система входить у стан рівноваги. Рух молекул газу хаотичний. Точне визначення хаотичності теплових рухів таке: рух молекул повністю хаотичний, якщо швидкості молекул розподілені за Максвеллом. Звідси випливає, що температура визначається середньою кінетичною енергією саме хаотичних рухів. Якою б великою була швидкість сильного вітру, вона не зробить його «гарячим». Вітер навіть найсильніший, може бути холодним і теплим, тому що температура газу визначається не спрямованою швидкістю вітру, а швидкістю хаотичного руху молекул.
p align="justify"> З графіка функції розподілу (рис.1) видно, що число молекул, швидкості яких лежать в однакових інтервалах d υ , але поблизу різних швидкостей υ більше, якщо швидкість υ наближається до швидкості, що відповідає максимуму функції f(υ ). Ця швидкість υ н називається найімовірнішою (найвірогіднішою).
Продиференціюємо (8) і прирівняємо похідну до нуля:

Так як  ,
,
то остання рівність виконується коли:

 (10)
(10)
Рівняння (10) виконується за умови:
І 
Перші два корені відповідають мінімальним значенням функції. Тоді швидкість, що відповідає максимуму функції розподілу, знайдемо з умови:

З останнього рівняння:
 (11)
(11)
де R- Універсальна газова постійна, μ - Молярна маса.
З урахуванням (11) із (8) можна отримати максимальне значення функції розподілу
 (12)
(12)
З (11) та (12) випливає, що при підвищенні Tабо при зменшенні mмаксимум кривий f(υ ) зсувається вправо і стає меншим, проте площа під кривою залишається постійною (рис.1).
Для вирішення багатьох завдань зручно користуватися розподілом Максвелла у наведеному вигляді. Введемо відносну швидкість:
де υ - Ця швидкість, υ н- Найімовірніша швидкість. З урахуванням цього рівняння (9) набуває вигляду:
 (13)
(13)
(13) – універсальне рівняння. У такому вигляді функція розподілу не залежить від роду газу, ні від температури.
Крива f(υ ) асиметрична. З графіка (рис.1) видно, що більшість молекул має швидкості більші, ніж υ н. Асиметрія кривої означає, що середня арифметична швидкість молекул не дорівнює υ н. Середня арифметична швидкість дорівнює сумі швидкостей всіх молекул, поділена на їх число:

Врахуємо, що згідно (2)
![]()
 (14)
(14)
Підставивши в (14) значення f(υ ) з (8) отримаємо середню арифметичну швидкість:
 (15)
(15)
Середній квадрат швидкості молекул отримаємо, обчисливши відношення суми квадратів швидкостей всіх молекул до їх числа:

Після підстановки f(υ ) з (8) отримаємо:

З останнього виразу знайдемо середню квадратичну швидкість:
 (16)
(16)
Зіставляючи (11), (15) і (16) можна дійти невтішного висновку, що, і однаково залежить від температури і відрізняються лише чисельними значеннями: (рис.2).

Рис.2. Розподіл Максвелла за абсолютними значеннями швидкостей
Розподіл Максвелла справедливо для газів, що знаходяться в стані рівноваги, число молекул, що розглядається, має бути досить великим. Для небагатьох молекул можуть спостерігатися значні відхилення від розподілу Максвелла (флуктуації).
Перше дослідне визначення швидкостей молекул провів Штерн 1920 року. Прилад Штерна складався із двох циліндрів різних радіусів, закріплених на одній осі. Повітря з циліндрів було відкачено до глибокого вакууму. Уздовж осі натягувалась платинова нитка, вкрита тонким шаром срібла. При пропусканні нитки електричного струму вона нагрівалася до високої температури (~1200 про З), що призводило до випаровування атомів срібла.

У стінці внутрішнього циліндра була зроблена вузька поздовжня щілина, через яку проходили атоми срібла, що рухаються. Облягаючись на внутрішній поверхні зовнішнього циліндра, вони утворювали тонку смужку, що добре спостерігається, прямо навпроти прорізу.

Циліндри починали обертати з постійною кутовою швидкістю. Тепер атоми, що пройшли крізь проріз, осідали вже не навпроти щілини, а зміщувалися на деяку відстань, тому що за час їхнього польоту зовнішній циліндр встигав повернутись на деякий кут. При обертанні циліндрів з постійною швидкістю положення смужки, утвореної атомами на зовнішньому циліндрі, зміщувалося на деяку відстань l.

У точці 1 осідають частинки, коли установка нерухома, при обертанні установки частинки осідають у точці 2.

Отримані значення швидкостей підтвердили теорію Максвелла. Проте характер розподілу молекул за швидкостями цей метод давав приблизні відомості.
Більш точно розподіл Максвелла було перевірено дослідами Ламмерта, Істермана, Елдріджа та Коста. Ці досліди досить точно підтвердили теорію Максвелла.
Прямі вимірювання швидкості атомів ртуті в пучку були виконані 1929 року Ламмертом. Спрощена схема цього експерименту показано на рис. 3.

Рис.3. Схема досвіду Ламмерта
1 - диски, що швидко обертаються, 2 - вузькі щілини, 3 - піч, 4 - коліматор, 5 - траєкторія молекул, 6 - детектор
Два диски 1, насаджені на загальну вісь, мали радіальні прорізи 2, зсунуті один щодо одного на кут φ . Навпроти щілин була піч 3, в якій нагрівався до високої температури легкоплавкий метал. Розігріті атоми металу, в даному випадку ртуті, вилітали з печі та за допомогою коліматора 4 направлялися в необхідному напрямку. Наявність двох щілин у коліматорі забезпечувало рух частинок між дисками прямолінійної траєкторії 5. Далі атоми, що пройшли прорізи в дисках, реєструвалися за допомогою детектора 6. Вся описана установка поміщалася в глибокий вакуум.
При обертанні дисків з постійною кутовою швидкістю ω через їх прорізи безперешкодно проходили тільки атоми, які мали деяку швидкість υ . Для атомів, що проходять обидві щілини, має виконуватися рівність:

де Δ t 1 - час прольоту молекул між дисками, Δ t 2 – час повороту дисків на кут φ . Тоді:
Змінюючи кутову швидкість обертання дисків, можна було виділяти з пучка молекули, що мають певну швидкість. υ , і по інтенсивності, що реєструється детектором судити про відносний зміст їх у пучку.
У такий спосіб вдалося експериментально перевірити Максвеллівський закон розподілу молекул за швидкостями.
Документальні учбові фільми. Серія "Фізика".
Наявність в атомів магнітних моментів та їх квантування було доведено прямими дослідами Штерна і Герлаха (1889-1979) у 1921 р. У посудині з високим вакуумом створювався за допомогою діафрагм різко обмежений атомний пучок досліджуваного елемента, що випаровується в печі К. Пучок. поле Н
між полюсними наконечниками N та S електромагніту. Один із наконечників (N) мав вигляд призми з гострим ребром, а вздовж іншого (S) була виточена канавка. Завдяки такій конструкції полюсних наконечників магнітне поле виходило дуже неоднорідним. Після проходження через магнітне поле пучок потрапляв на фотопластинку Р та залишав на ній слід.
Розрахуємо поведінку атомного пучка спочатку з класичної погляду, припускаючи, що ніякого квантування магнітних моментів немає. Якщо m-магнітний момент атома, то на атом у неоднорідному магнітному полі діє сила
Направимо вісь Z вздовж магнітного поля (тобто від N до S перпендикулярно до полюсних наконечників). Тоді проекція сили у цьому напрямі буде
Перші два складові в цьому виразі не відіграють ролі.
Справді, за класичними уявленнями атом у магнітному полі робить прецесію навколо осі Z, обертаючись із ларморівською частотою
(Заряд електрона позначений -е). Тому проекції роблять коливання з тією самою частотою, стаючи поперемінно то позитивними, то негативними. Якщо кутова швидкість прецесії досить велика, силу fz можна усереднити за часом. При цьому перші два члени у виразі для fz звернуться у нуль, і можна написати
Щоб скласти уявлення про ступінь допустимості такого усереднення, зробимо чисельну оцінку. Період ларморівської прецесії дорівнює
де поле Н вимірюється у гаусах. Наприклад, за Н = 1000 Гс отримуємо с. Якщо швидкість атомів у пучку дорівнює = 100 м/с = см/с, то цей час атом пролітає відстань див, зневажливо мале проти всіма характерними розмірами установки. Це і доводить застосування проведеного усереднення.
Але формула може бути виправдана і з квантового погляду. Справді, включення сильного магнітного поля вздовж осі Z призводить до стану атома лише з однією певною складовою магнітного моменту, а саме. Інші дві складові у цьому стані не можуть мати певних значень. При вимірах у цьому стані отримали різні значення і до того ж їх середні дорівнювали б нулю. Тому і за квантового розгляду усереднення виправдане.
Проте слід очікувати різних результатів досвіду з класичної та квантової точок зору. У дослідах Штерна та Герлаха спочатку виходив слід атомного пучка при вимкненому магнітному полі, а потім при включеному. Якби проекція могла набувати різноманітних безперервних значень, як вимагає класична теорія, то сила fz також приймала б всілякі безперервні значення. Включення магнітного поля призводило б лише розширення пучка. Не те слід очікувати за квантовою теорією. У цьому випадку проекція mz, а з нею і середня сила fz квантовані, тобто можуть набувати лише ряду дискретних обраних значень. Якщо орбітальне квантове число атома дорівнює I, то за теорією при розщепленні вийде пучків (тобто воно дорівнює числу можливих значень, які може приймати квантове число m). Таким чином, залежно від значення числа Iслід було б очікувати, що пучок розщепиться на 1, 3, 5, ... складових. Очікувана кількість складових мала б бути завжди непарною.
Досліди Штерна та Герлаха довели квантування проекції. Однак їх результати не завжди відповідали теорії, викладеній вище. У початкових дослідах застосовувалися пучки атомів срібла. У магнітному полі пучок розщеплювався на дві складові. Те саме виходило для атомів водню. Для атомів інших хімічних елементів виходила й складніша картина розщеплення, проте число розщеплених пучків виходило як непарним, що потрібно теорією, а й парним, що суперечило їй. У теорію потрібно було внести корективи.
До цього слід додати результати дослідів Ейнштейна та де Гааза (1878–1966), а також дослідів Барнета (1873–1956) щодо визначення гіромагнітного відношення. Для заліза, наприклад, виявилося, що гіромагнітне відношення дорівнює т. е. удвічі більше, ніж потрібно за теорією.
Нарешті виявилося, що спектральні терми лужних металів мають так звану дублетну структуру, тобто складаються з двох близько розташованих рівнів. Для опису цієї структури трьох квантових чисел n, I m виявилося недостатньо-потрібне четверте квантове число. Це було головним мотивом, що послужили Уленбеку (нар. 1900) і Гаудсміту (1902-1979) в 1925 р. запровадження гіпотези про спину електрона. Сутність цієї гіпотези полягає в тому, що у електрона є не тільки момент кількості руху та магнітний момент, пов'язані з переміщенням цієї частки як цілого. Електрон має також власний або внутрішній механічний момент кількості руху, нагадуючи у цьому відношенні класичний дзига. Цей момент кількості руху і називається спином (від англійського слова to spin - крутитися). Відповідний магнітний момент називається спиновим магнітним моментом. Ці моменти позначаються відповідно через на відміну від орбітальних моментів Спін частіше позначають просто через s.
У дослідах Штерна і Герлаха атоми водню перебували в s-стані, т. е. не мали орбітальних моментів. Магнітний момент ядра дуже малий. Тому Уленбек та Гаудсміт припустили, що розщеплення пучка обумовлено не орбітальним, а спіновим магнітним моментом. Те саме стосується дослідів з атомами срібла. Атом срібла має єдиний зовнішній електрон. Атомний кістяк через його симетрію спиновим і магнітним моментами не має. Весь магнітний момент атома срібла створюється лише одним зовнішнім електроном. Коли атом перебуває у нормальному, т. е. s-стані, то орбітальний момент валентного електрона дорівнює нулю - весь є спиновим.
Самі Уленбек та Гаудсміт припускали, що спин виникає через обертання електрона навколо власної осі. Існуюча на той час модель атома отримала ще більшу схожість із Сонячною системою. Електрони (планети) як обертаються навколо ядра (Сонця), а й навколо власних осей. Однак одразу ж з'ясувалась неспроможність такого класичного уявлення про спину. Паулі систематично ввів спин у квантову механіку, але виключив будь-яку можливість класичного тлумачення цієї величини. У 1928 р. Дірак показав, що спін електрона автоматично міститься у його теорії електрона, що ґрунтується на релятивістському хвильовому рівнянні. Теорія Дірака міститься також і спиновий магнітний момент електрона, причому для гіромагнітного відношення виходить значення, що узгоджується з досвідом. При цьому про внутрішню структуру електрона нічого не говорилося - останній розглядався як точкова частка, що має лише заряд і масу. Таким чином, спин електрона виявився квантово-релятивістським ефектом, що не має класичного тлумачення. Потім концепція спина, як внутрішнього моменту кількості руху, була поширена на інші елементарні та складні частинки та знайшла підтвердження та широкі застосування у сучасній фізиці.
Зрозуміло, у загальному курсі фізики немає можливості вдаватися до докладної і суворої теорії спини. Ми приймемо як вихідне положення, що спину s відповідає векторний оператор проекції якого задовольняють таким самим перестановочним співвідношенням, як і проекції оператора орбітального моменту, тобто.
З них випливає, що певні значення в тому самому стані можуть мати квадрат повного спина і одна з його проекцій на певну вісь (приймається зазвичай за вісь Z). Якщо максимальне значення проекції sz (в одиницях ) дорівнює s, то число всіх можливих проекцій, відповідних даному s, буде рівним 2s + 1. Досліди Штерна і Герлаха показали, що для електрона це число дорівнює 2, тобто 2s + 1 = 2, звідки s = 1/2. Максимальне значення, яке може приймати проекція спина на обраний напрямок (в одиницях ), тобто число s, і приймається значення спина частинки.
Спин частки може бути або цілим або напівцілим. Для електрона таким чином спин дорівнює 1/2. З перестановних співвідношень слід, що квадрат спина частки дорівнює , а електрона (в одиницях 2).
Вимірювання проекції магнітного моменту методом Штерна і Герлаха показали, що з атомів водню і срібла величина дорівнює магнетону Бора , т. е. . Таким чином, гіромагнітне відношення для електрона
Муніципальна загальноосвітня установа гімназія №1
Центрального району м. Волгограда
Урок фізики на тему
Рух молекул. Дослідне визначення швидкостей руху молекул
10 клас
Підготувала: учитель фізики вищої категорії
Петрухіна
Марина Анатоліївна.
УМК: Н. С. Пуришева,
Н. Є. Важеєвська,
Д. А. Ісаєв
«Фізика – 10», робочий зошит до цього підручника та мультимедійний додаток до підручника.
Волгоград, 2015
Урок на тему
Рух молекул.
Дослідне визначення швидкостей руху молекул
10 клас
Анотація.
Розуміння найважливіших питань сучасної фізики неможливе без деяких, хоча б найпростіших уявлень про статистичні закономірності. Розгляд газу як системи, що складається з величезної кількості частинок, дозволяє в доступній формі дати уявлення про ймовірність, статистичний характер закономірностей таких систем, про статистичні розподіли, що вказують, з якою ймовірністю частки системи мають те чи інше значення параметрів, що визначають їх стан, і на На основі цього викладають основні положення класичної теорії газів. До одного з уроків, які дозволяють сформувати дану виставу, відноситься представлений урок з УМК видавництва «Дрофа»: підручник фізики Н. С. Пуришева, Н. Є. Важеєвська, Д. А. Ісаєв, робочий зошит до цього підручника та мультимедійний додаток до підручнику.
Пояснювальна записка.
Цей урок можна провести у процесі вивчення теми «Основи МКТ будови речовини» у 10 класі.
Новий матеріал уроку дозволяє поглибити знання учнів про основи кінетичної теорії газів і використовувати його під час вирішення завдань визначення швидкостей молекул різних газів.
Кожен етап уроку супроводжується показом тематичного слайду мультимедійної програми та відеофрагментом.
Мета уроку:
Діяльність: формування в учнів нових способів діяльності (уміння ставити та відповідати на дієві питання; обговорення проблемних ситуацій; вміння оцінювати свою діяльність та свої знання).
Завдання уроку:
Навчальна: формування вміння аналізувати, порівнювати, переносити знання у нові ситуації, планувати свою діяльність при побудові відповіді, виконанні завдань та пошукової діяльності через фізичні поняття (найбільш ймовірна швидкість, середня швидкість, середня квадратична швидкість), активізувати розумову діяльність учнів.
Виховує: виховання дисциплінованості при виконанні групових завдань, створення умови для позитивної мотивації щодо фізики, використовуючи різноманітні прийоми діяльності, повідомляючи цікаві відомості; виховувати почуття поваги до співрозмовника, індивідуальної культури спілкування.
Розвиваюча: розвивати вміння будувати самостійні висловлювання в мовленні на основі засвоєного навчального матеріалу, розвиток логічного мислення, розвиток вміння єдиного математичного підходу для кількісного опису фізичних явищ на основі молекулярних уявлень при вирішенні завдань.
Тип уроку: урок вивчення нового матеріалу
Методи навчання: евристичний, пояснювально – ілюстративний, проблемний, демонстрації та практичні завдання, розв'язання задачі фізичного змісту.
Очікувані результати:
вміти робити висновок з урахуванням експерименту;
виробляти правила дискусії та дотримуватися їх;
розуміти сенс обговорюваних питань та виявляти інтерес до цієї теми.
Підготовчий етап: знання основних рівнянь, залежностей на цю тему (теоретичний блок на тему знаходиться у кожного учня у вигляді лекції - конспекту)
Обладнання: прилад демонстрації досвіду Штерна;
комп'ютер та проектор для демонстрації презентації та відеофрагменту «Досвід Штерна».
Етапи уроку.
Організаційний етап (вітання, перевірка готовності до уроку, емоційного настрою), (1 хвилина)
Етап постановки мети, завдань уроку та проблеми про спосіб вимірювання швидкості молекул, (4 хвилини)
Етап вивчення нового навчального матеріалу, показ слайдів презентації з коментарями учнів, що дозволяє створити зорове враження про тему, активізувати зорову пам'ять (перевірити рівень засвоєння системи понять на цю тему), (20хвилин)
Етап закріплення набутих знань під час вирішення завдань (застосування знань практично їх вторинне осмислення), (8хвилин)
Етап узагальнення та підбиття підсумків уроку (дати аналіз успішності оволодіння знаннями та способами діяльності), (4хвилини)
Інформація про домашнє завдання (спрямовано подальший розвиток знань), (1хвилина)
Рефлексія, (2 хвилини)
Сценарій уроку.
Діяльність вчителя фізики
Діяльність учня
Організаційний етап.
Здрастуйте, хлопці! Я рада вітати вас на уроці, на якому ми продовжимо відкривати сторінки у пізнанні класичної теорії газів. Поперед нас чекають цікаві відкриття. Вітайте один одного.
Тоді приступимо…
Цілепокладання та мотивація.
Минулого уроці ми познайомилися з основними положеннями молекулярно-кінетичної теорії ідеального газу. Беручи участь у безперервному хаотичному русі, молекули постійно стикаються один з одним, при цьому кількість часток, що стикаються. їх швидкостіу кожний момент часу різні.
Як ви вважаєте, яка тема уроку «очікує» нас сьогодні?
Так, дійсно, ціль, яку ми ставимо сьогодні перед собою: познайомимося з одним із методів визначення швидкості руху молекул – методом молекулярних пучків, запропонованим німецьким фізиком Отто Штерном у 1920 році.
Відкрили зошити, записали число та тему сьогодення: Рух молекул. Досвідчене визначення швидкостей руху молекул.
Згадаймо, чому дорівнює швидкість теплового руху молекул?
Розрахуємо швидкість молекул срібла Аg при випаровуванні із поверхні, T =1500К.
Нагадаю, швидкість звуку 330м/с, а швидкість молекул срібла 588м/с порівняйте.
Розрахуємо швидкість молекул водню Н 2 за нормальної температури, близької до абсолютному нулю T=28К.
Наприклад: швидкість пасажирського літака – 900м/с, швидкість руху Місяця навколо Землі – 1000м/с.
А тепер поставте себе на місце вчених 19 століття, коли були отримані ці дані, виникли сумніви щодо правильності самої кінетичної теорії. Адже відомо, що запахи поширюються досить повільно: потрібен час близько десятків секунд, щоб запах парфумів, пролитих в одному кутку кімнати, поширюються на інший кут.
Тому постає питання: яка насправді швидкість молекул?
Коли запах парфумів поширюється, чи заважає молекулам парфумів?
Як це впливає швидкість спрямованого руху молекул?
Розрахуємо швидкість молекул водню Н 2 за нормальної температури, близької до кімнатної T=293К.
Тоді, це швидкість яка? Чого?
А як її виміряти, визначити її значення практично? Давайте вирішимо наступне завдання:
Нехай є одна молекула. Потрібно визначити швидкість вільного пробігу молекул. Як рухаються молекули між зіткненнями?
Нехай молекула проходить 1 метр, час знайдемо за швидкості водню 1911м/с, вийшло 0,00052с.
Як видно, час дуже маленький.
Виникає знову проблема!
Етап вивчення нового навчального матеріалу.
Вирішити цю проблему в шкільних умовах неможливо, за нас це зробив у 1920 р. Отто Штерн (1888-1970), замінивши поступальний рух на обертальний.
Подивимося невеликий відеофрагмент і обговоримо деякі питання.
Що представляла установка, якою користувався О. Штерн?
Як було здійснено досвід?
Значення швидкостей виходили близькими до швидкості, обчисленої за формулою:
 ,
,  ,
де
,
де  - Лінійна швидкість точок поверхні циліндра В.
- Лінійна швидкість точок поверхні циліндра В.
 , то
, то
 , що у згоді з молекулярно – кінетичної теорією. Швидкість молекул збігається з розрахованою, отриманою на основі МКТ, це було одним із підтвердженням її справедливості.
, що у згоді з молекулярно – кінетичної теорією. Швидкість молекул збігається з розрахованою, отриманою на основі МКТ, це було одним із підтвердженням її справедливості.
З досвіду О. Штерна було виявлено, що з температурі 120 0 З швидкості більшості атомів срібла лежать у межах від 500м/с до 625м/с. При зміні умов досвіду, наприклад, температури речовини, з якої зроблено дріт, виходять інші значення швидкостей, але характер розподілу атомів у напиленому шарі не змінюється.
Чому в досвіді Штерна смужка срібла зміщена та розмита по краях, крім того, неоднорідна за товщиною?
Який висновок можна зробити про розподіл атомів та молекул за швидкостями?
Розглянемо таблицю №12 підручника на стор. 98 молекул азоту. Що видно із таблиці?
Англійський фізик Д. До. Максвелл теж вважав неймовірним, що це молекули рухаються з однією швидкістю. На його думку, при кожній заданій температурі більшість молекул має швидкості, що лежать у досить вузьких межах, але деякі молекули можуть рухатися з більшою або меншою швидкістю. Більше того, вважав учений, у кожному обсязі газу при тій чи іншій температурі є молекули, що мають як дуже малі, так і дуже великі швидкості. Зіткнувшись між собою, одні молекули збільшують швидкість, інші зменшують. Але якщо газ перебуває в стаціонарному стані, то число молекул, які мають ту чи іншу швидкість, залишається постійним. Виходячи з такого уявлення, Д. Максвелл досліджував питання розподіл молекул за швидкостями у газі, що у стаціонарному стані.
Цю залежність він установив задовго до дослідів О. Штерна. Результати роботи Д. К. Максвела отримали загальне визнання, але при цьому не були підтверджені експериментально. Це зробив О. Штерн.
Подумайте? Яка заслуга О. Штерна?
Розглянемо рис. 64 на стор. 99 підручника та досліджуємо характер самого розподілу молекул за швидкостями.
Вид функції розподілу молекул за швидкістю руху, яку Д. Максвелл визначив теоретичним шляхом, якісно збігся з профілем нальоту атомів срібла на латунній платівці у досвіді О.Штерна.
Вивчення профілю смужки срібла дозволило вченому зробити висновок про існування найбільш ймовірною середньою швидкістю руху частинок (тобто швидкості з якою рухається найбільше молекул).
Куди зміщується максимум кривої розподілу у разі підвищення температури?
Крім найбільш ймовірної та середньої швидкостей, рух молекул характеризується середнім квадратом швидкості:
 , А квадратний корінь із цієї величини – є середня квадратична швидкість.
, А квадратний корінь із цієї величини – є середня квадратична швидкість.
Давайте ще раз подивимося, як відбувалося пізнання щодо питання про швидкості руху молекул?
Етап закріплення набутих знань під час вирішення завдань.
Зробимо математичні розрахунки та перевіримо теорію у конкретній ситуації.
Завдання №1
Яка швидкість мала молекула парів срібла, якщо її кутове зміщення в досвіді Штерна становило 5,4º при частоті обертання приладу 150 с?? Відстань між внутрішнім та зовнішнім циліндрами дорівнює 2 см.
Етап узагальнення та підбиття підсумків уроку
Сьогодні на уроці ми познайомилися з одним із методів визначення швидкості руху молекул – методом молекулярних пучків, запропонованим німецьким фізиком Отто Штерном.
Яке значення досвіду О. Штерна у розвитку уявлень про будову речовини?
Інформація про домашнє завдання.
Рефлексія.
У ході нашого уроку ви показали себе спостережливими теоретиками, здатними не лише помічати навколо себе все нове та цікаве, а й самостійно проводити наукове дослідження.
Наш урок добіг кінця.
Давайте відповімо на запитання: Що вам сподобалося на уроці? і «Чим вам запам'ятався урок?»
А я на закінчення хочу процитувати слова Вірея:
«Всі відкриття в науках і у філософії походять часто від узагальнень або від додатків факту до інших подібних фактів»
Дякую, хлопці, за спільну роботу. Я рада була зустрітися з вами. До зустрічі!
Тема уроку: Визначення швидкості руху молекул.
(учні записують у зошит число і тему уроку)
(Відповіді кількох учнів)
 , з іншого боку
, з іншого боку
 знаючи що
знаючи що  , звідси
, звідси
 , або
, або  , де
, де
 - Універсальна газова постійна,
- Універсальна газова постійна,  8,31
8,31 
Швидкість молекул срібла надзвукова.
590м/с, така ж! Не може бути!
Яку швидкість знаходити та вимірювати?
Заважають молекули повітря.
Вона зменшується.
Ми отримали велику швидкість і нічого не заважає рухатися молекулам?
Швидкість вільного пробігу молекул.
Поступово.
Як його виміряти?
(перегляд відео)
Установка складалася з: платинової нитки, покритої тонким шаром срібла, яка розташовувалася вздовж осі всередині циліндра радіусом  та зовнішнього циліндра
та зовнішнього циліндра  . З циліндра відкачено насосом повітря.
. З циліндра відкачено насосом повітря.
При пропущенні електричного струму через дріт вона розігрівалася до температури вище температури плавлення срібла 961,9 0 С. Стінки зовнішнього циліндра охолоджувалися, щоб молекули срібла краще осідали на шляху екрана. Установку приводили у обертання з кутовою швидкістю 2500 – 2700 об/хв.

Смужка срібла при обертанні приладу набула іншого вигляду тому, якби всі атоми, що вилітають з нитки, мали однакову швидкість, то зображення щілини на екрані не змінилося б за формою та розміром, а лише трохи змістилося б убік. Розмитість смужки зі срібла говорить про те, що атоми, що вилітають з розпеченої нитки, рухаються з різними швидкостями. Атоми, що рухаються швидко, зміщуються менше, ніж атоми, що рухаються з меншою швидкістю.
Розподіл атомів і молекул за швидкостями є певною закономірністю, що характеризує їх рух.
З таблиці видно, що найбільше молекул азоту мають швидкості від 300м/с до 500м/с.
91% молекул мають швидкості, включені в інтервал від 100м/с до 700м/с.
9% молекул мають швидкості, менших 100м/с та більших 700м/с.
О. Штерн, скориставшись методом молекулярних пучків, винайденим французьким фізиком Луї Дюнойє (1911) виміряв швидкість газових молекул і на досвіді підтвердив отриманий Д. К. Максвеллом розподіл молекул газу за швидкостями. Результати досвіду Штерна підтвердили правильність оцінки середньої швидкості атомів, що випливає із розподілу Максвелла.
 За графіком можна було визначити зсув для середини зображення щілини і, відповідно, обчислити середню швидкість
рухи атомів.
За графіком можна було визначити зсув для середини зображення щілини і, відповідно, обчислити середню швидкість
рухи атомів.
 При Т 2 Т 1 максимум кривої розподілу зміщується в область більших значень швидкостей.
При Т 2 Т 1 максимум кривої розподілу зміщується в область більших значень швидкостей.
Н. С. Пуришева, Н. Є. Важеєвська, Д. А. Ісаєв, підручник «Фізика - 10», робочий зошит до цього підручника.
Фізика: 3800 завдань для школярів та вступників ВНЗ. - М.: Дрофа, 2000р.
Римкевич А.П. Збірник завдань із фізики. 10-11 кл. - М.: Дрофа, 2010.
Л. А. Кирик "Самостійні та контрольні роботи з фізики". 10 клас. М.: Ілекса, Харків: Гімназія, 1999.
Енциклопедія для дітей Техніка. М: Аванта +, 1999.
Енциклопедія для дітей фізика. Ч. I. М.: Аванта +, 1999.
Енциклопедія для дітей фізика. Ч. П. М.: Аванта +, 1999.
Фізичний експеримент у школе./ Упоряд. Г. П. Мансветова, В. Ф. Гудкова. - М: Просвітництво, 1981.
Техніка в курсі фізики середньої школи. М: Просвітництво, 1977.
Спочатку було висловлено гіпотезу у тому, що молекули рухаються з різними швидкостями.
Ці швидкості пов'язані з температурою і існує певний закон розподілу молекул за швидкостями, що випливало зі спостережень, зокрема броунівського руху.
Досвід належить до фундаментальних фізичних експериментів. В даний час атомно-молекулярне вчення підтверджено численними дослідами і є загальновизнаним.
Рефлексія навчальних процесів.
Сьогодні я дізнався…
Було цікаво…
Було важко…
Я зрозумів, що…Я навчився…
Мене здивувало…
Використовувана література:
Електронні програми:
Л. Я. Боревський «Курс фізики XXI століття», базовий + для школярів та абітурієнтів. Медіахауз. 2004 рік.
Інтерактивний курс фізики для 7-11 класів. ТОВ "Фізікон", 2004 рік. Російська версія «Жива фізика», Інститут нових технологій
Фізика, Х-ХІ класи. Мультимедійний курс-М.: ТОВ «Розсобить Паблішинг».-2004 (http://www.russobit-m.ru/)
Відкрита фізика. О 2 год. (CD) / За ред. С.М. Козела. - М.: ТОВ «Фізікон». - 2002 (http://www.physicon.ru/.)