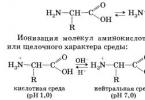
Серед азотовмісних органічних речовин є сполуки з двоїстою функцією. Особливо важливими з них є амінокислоти.
У клітинах і тканинах живих організмів зустрічається близько 300 різних амінокислот, але лише 20 ( α-амінокислоти ) їх служать ланками (мономерами), у тому числі побудовані пептиди і білки всіх організмів (тому їх називають білковими амінокислотами). Послідовність розташування цих амінокислот у білках закодована у послідовності нуклеотидів відповідних генів. Інші амінокислоти зустрічаються як у вигляді вільних молекул, так і у зв'язаному вигляді. Багато з амінокислот зустрічаються лише в певних організмах, а є й такі, які виявляються тільки в одному з безлічі описаних організмів. Більшість мікроорганізмів та рослини синтезують необхідні їм амінокислоти; тварини і людина не здатні до утворення про незамінних амінокислот, одержуваних з їжею. Амінокислоти беруть участь в обміні білків і вуглеводів, в утворенні важливих для організмів сполук (наприклад, пуринових та піримідинових основ, що є невід'ємною частиною нуклеїнових кислот), входять до складу гормонів, вітамінів, алкалоїдів, пігментів, токсинів, антибіотиків і т.д. деякі амінокислоти є посередниками при передачі нервових імпульсів.
Амінокислоти- органічні амфотерні сполуки, до складу яких входять карбоксильні групи - СООН та аміногрупи -NH 2 .
Амінокислоти можна розглядати як карбонові кислоти, у молекулах яких атом водню в радикалі заміщений аміногрупою.
КЛАСИФІКАЦІЯ
Амінокислоти класифікують за структурними ознаками.1. Залежно від взаємного розташування аміно- та карбоксильної груп амінокислоти поділяють на α-, β-, γ-, δ-, ε- і т.д.
2. Залежно від кількості функціональних груп розрізняють кислі, нейтральні та основні.
3. За характером вуглеводневого радикалу розрізняють аліфатичні(жирні), ароматичні, сірковмісніі гетероциклічніамінокислоти. Наведені вище амінокислоти відносяться до жирного ряду.
Прикладом ароматичної амінокислоти може служити пара-амінобензойна кислота:
Прикладом гетероциклічної амінокислоти може бути триптофан – незамінна α-амінокислота
НОМЕНКЛАТУРА
За систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот додаванням приставки аміно-та зазначенням місця розташування аміногрупи по відношенню до карбоксильної групи. Нумерація вуглецевого ланцюга з атома вуглецю карбоксильної групи.
Наприклад:
Часто використовується також інший спосіб побудови назв амінокислот, згідно з яким до тривіальної назви карбонової кислоти додається приставка аміно-із зазначенням положення аміногрупи літерою грецького алфавіту.
Приклад:
Для α-амінокислотR-CH(NH 2)COOH
Які грають винятково важливу роль у процесах життєдіяльності тварин та рослин, застосовуються тривіальні назви.
Таблиця.
|
Амінокислота |
Скорочене позначення |
Будова радикала (R) |
|
Гліцин |
Gly (Глі) |
H - |
|
Аланін |
Ala (Ала) |
CH 3 - |
|
Валін |
Val (Вал) |
(CH 3) 2 CH - |
|
Лейцин |
Leu (Лей) |
(CH 3) 2 CH - CH 2 - |
|
Серін |
Ser (Сір) |
OH-CH 2 - |
|
Тирозін |
Tyr (Тир) |
HO – C 6 H 4 – CH 2 - |
|
Аспарагінова кислота |
Asp (АСП) |
HOOC - CH 2 - |
|
Глутамінова кислота |
Glu (Глу) |
HOOC - CH 2 - CH 2 - |
|
Цистеїн |
Cys (Цис) |
HS - CH 2 - |
|
Аспарагін |
Asn (Асн) |
O = C - CH 2 - │ NH 2 |
|
Лізін |
Lys (Ліз) |
NH 2 - CH 2 - CH 2 - CH 2 - |
|
Фенілаланін |
Phen (Фен) |
C 6 H 5 - CH 2 - |
Якщо молекулі амінокислоти міститься дві аміногрупи, то її назві використовується приставкадіаміно-, три групи NH 2 – тріаміно-і т.д.
Приклад:
Наявність двох або трьох карбоксильних груп відображається у назві суфіксом -діоваабо -тріова кислота:
ІЗОМЕРІЯ
1. Ізомерія вуглецевого скелета
2. Ізомерія положення функціональних груп
3. Оптична ізомерія
α-амінокислоти, крім гліцину NН 2 -CH 2 -COOH.
ФІЗИЧНІ ВЛАСТИВОСТІ
Амінокислоти є кристалічними речовинами з високими (вище 250°С) температурами плавлення, які мало відрізняються в індивідуальних амінокислот і тому нехарактерні. Плавлення супроводжується розкладанням речовини. Амінокислоти добре розчиняються у воді і нерозчинні в органічних розчинниках, чим вони схожі на неорганічні сполуки. Багато амінокислот мають солодкий смак.
ОТРИМАННЯ
3. Мікробіологічний синтез. Відомі мікроорганізми, які в процесі життєдіяльності продукують - амінокислоти білків.
ХІМІЧНІ ВЛАСТИВОСТІ
Амінокислоти амфотерні органічні сполуки, їм характерні кислотно-основні властивості.
I . Загальні властивості
1. Внутрішньомолекулярна нейтралізація → утворюється біполярний цвіттер-іон:
Водні розчини електропровідні. Ці властивості пояснюються тим, що молекули амінокислот існують у вигляді внутрішніх солей, які утворюються за рахунок перенесення протону від карбоксилу до аміногрупи:
цвіттер-іон
Водні розчини амінокислот мають нейтральне, кисле або лужне середовище в залежності від кількості функціональних груп.
ЗАСТОСУВАННЯ
1) амінокислоти широко поширені у природі;
2) молекули амінокислот – це ті цеглинки, з яких побудовано всі рослинні та тваринні білки; амінокислоти, необхідні для побудови білків організму, людина та тварини одержують у складі білків їжі;
3) амінокислоти прописуються при сильному виснаженні після важких операцій;
4) їх використовують для харчування хворих;
5) амінокислоти необхідні як лікувальний засіб при деяких хворобах (наприклад, глутамінова кислота використовується при нервових захворюваннях, гістидин – при виразці шлунка);
6) деякі амінокислоти застосовуються у сільському господарстві для підживлення тварин, що позитивно впливає на їх зростання;
7) мають технічне значення: амінокапронова та аміноенантова кислоти утворюють синтетичні волокна – капрон та енант.
ПРО РОЛІ АМІНОКИСЛОТ
Знаходження в природі та біологічна роль амінокислот
Знаходження в природі і біологічна роль амінокислот
>> Хімія: Амінокислоти
Загальну формулу найпростіших амінокислот можна записати так:
Н2N-СН-СООН
I
R
Так як амінокислоти містять дві різні функціональні групи, які впливають одна на одну, їх реакції відрізняються від характерних властивостей карбонових кислот та амінів.
Отримання
Амінокислоти можна одержати з карбонових кислот, замінивши в їхньому радикалі атом водню на галоген, а потім на аміногрупу при взаємодії з аміаком. Суміш амінокислот зазвичай одержують кислотним гідролізом білків.
Властивості
Аміногрупа -NН2 визначає основні властивості амінокислот, оскільки здатна приєднувати себе катіон водню по донорно-акцепторному механізму з допомогою наявності вільної електронної пари в атома азоту.
Група -СООН (карбоксильна група) визначає кислотні властивості цих сполук. Отже, амінокислоти – це амфотерні органічні сполуки.
З лугами вони реагують як кислоти. З сильними кислотами - як основи-аміни.
Крім того, аміногрупа в молекулі амінокислоти вступає у взаємодію з карбоксильною групою, що входить до її складу, утворюючи внутрішню сіль: 
Оскільки амінокислоти у водних розчинах поводяться як типові амфотерні сполуки, то живих організмах вони грають роль буферних речовин, підтримують певну концентрацію іонів водню.
Амінокислоти є безбарвними кристалічними речовинами, що плавляться з розкладанням при температурі вище 200 °С. Вони розчиняються у воді і нерозчинні в ефірі. Залежно від складу радикала R- вони можуть бути солодкими, гіркими або несмачними.
Амінокислоти мають оптичну активність, оскільки містять атоми вуглецю (асиметричні атоми), пов'язані з чотирма різними замісниками (виняток становить аміно-оцтова кислота - гліцин). Асиметричний атом вуглецю позначають зірочкою.
Як ви вже знаєте, оптично активні речовини зустрічаються у вигляді пар антиподів-ізомерів, фізичні та хімічні властивості яких однакові, за винятком одного – здатності обертати площину поляризованого променя у протилежні сторони. Напрямок обертання площини поляризації позначається знаком (+) – праве обертання, (-) – ліве обертання.
Розрізняють D-амінокислоти та L-амінокислоти. Розташування аміногрупи NH2 у проекційній формулі зліва відповідає L-конфігурації, а праворуч - D-конфігурації. Знак обертання не пов'язаний із належністю з'єднання до L- або D-ряду. Так, L-ce-рин має знак обертання (-), а L-аланін - (+).
Амінокислоти поділяють на природні (виявлені в живих організмах) та синтетичні. Серед природних амінокислот (близько 150) виділяють протеїногенні амінокислоти (близько 20), що входять до складу білків. Вони є L-форми. Приблизно половина цих амінокислот ставляться до незамінним, оскільки де вони синтезуються у людини. Незамінними є такі амінокислоти, як валін, лейцин, ізолейцин, фенілалалін, лізин, треонін, цистеїн, метіонін, гістидин, триптофан. В організм людини ці речовини надходять з їжею (табл. 7). Якщо їх кількість у їжі буде недостатньою, нормальний розвиток та функціонування організму людини порушуються. При окремих захворюваннях організм не в змозі синтезувати деякі інші амінокислоти. Так, при фенілкетонурії не синтезується тирозин.
Найважливішою властивістю амінокислот є здатність вступати в молекулярну конденсацію з виділенням води та утворенням амідного угруповання-NH-СО-, наприклад:
H2N-(СН2)5-СООН + Н-NH-(СН2)5-СООН ->
амінокапронова кислота
H2N-(СН2)5-СО-NH-(СН2)5-СООН + Н20
Високомолекулярні сполуки, що виходять в результаті такої реакції, містять велику кількість амідних фрагментів і тому отримали назву поліамідів.
До них, крім названого вище синтетичного волокна капрон, відносять, наприклад, енант, що утворюється при поліконденсації аміноенантової кислоти. Для отримання синтетичних волокон придатні амінокислоти з розташуванням аміно- та карбоксильної груп на кінцях молекул (подумайте чому).
Таблиця 7. Добова потреба організму людини в амінокислотах
Поліаміди а-амінокислот називаються пептидами. Залежно від кількості залишків амінокислот розрізняють дипептиди, трипептиди, поліпептиди. У таких сполуках групи -NР-ЗІ- називають пептидними.
Ізомерія та номенклатура
Ізомерія амінокислот визначається різною будовою вуглецевого ланцюга та положенням аміногрупи. Широко поширені також назви амінокислот, у яких положення аміногрупи позначаються літерами грецького алфавіту. Так, 2-амінобутанову кислоту можна назвати також а-аміномасляною кислотою: 
У біосинтезі білка в живих організмах беруть участь 20 амінокислот, для яких найчастіше застосовують історичні назви. Ці назви та прийняті для них російські та латинські літерні позначення наведені в таблиці 8.

1. Запишіть рівняння реакцій амінопропіонової кислоти; ти із сірчаною кислотою та гідроксидом натрію, а також з метиловим спиртом. Всім речовин дайте назви з міжнародної номенклатури.
2. Чому амінокислоти є гетерофункціональними сполуками?
3. Якими особливостями будови повинні мати амінокислоти, що використовуються для синтезу волокон, та амінокислоти, що беруть участь у біосинтезі білків у клітинах живих організмів?
4. Чим відрізняються реакції поліконденсації від реакцій полімеризації? У чому їхня схожість?
5. Як одержують амінокислоти? Запишіть рівняння реакцій одержання амінопропіонової кислоти з пропану.
Зміст уроку конспект урокуопорний каркас презентація уроку акселеративні методи інтерактивні технології Практика завдання та вправи самоперевірка практикуми, тренінги, кейси, квести домашні завдання риторичні питання від учнів Ілюстрації аудіо-, відеокліпи та мультимедіафотографії, картинки графіки, таблиці, схеми гумор, анекдоти, приколи, комікси притчі, приказки, кросворди, цитати Доповнення рефератистатті фішки для допитливих шпаргалки підручники основні та додаткові словник термінів інші Удосконалення підручників та уроківвиправлення помилок у підручникуоновлення фрагмента у підручнику елементи новаторства на уроці заміна застарілих знань новими Тільки для вчителів ідеальні урокикалендарний план на рік методичні рекомендації програми обговорення Інтегровані урокиВИЗНАЧЕННЯ
Амінокислоти- це складні органічні сполуки, які у своїй молекулі одночасно містять аміногрупу та карбоксильну групу.
Амінокислоти є твердими кристалічними речовинами, що характеризуються високими температурами плавлення і розкладаються при нагріванні. Вони добре розчиняються у воді. Ці властивості пояснюються можливістю існування амінокислот у вигляді внутрішніх солей (рис. 1).
Мал. 1. Внутрішня сіль амінооцтової кислоти.
Отримання амінокислот
Вихідними сполуками для отримання амінокислот часто є карбонові кислоти, в молекулу яких вводиться аміногрупа. Наприклад, одержання їх з галогензаміщених кислот
CH 3 -C(Br)H-COOH + 2NH 3 →CH 3 -C(NH 2)H-COOH + NH 4 Br.
Крім цього вихідною сировиною для отримання амінокислот можуть служити альдегіди (1), ненасичені кислоти (2) і нітросполуки (3):
CH 3 -C(O)H + NH 3 + HCN → CH 3 -C(NH 2)H-C≡H + H 2 O;
CH 3 -C(NH 2)H-C≡H + H 2 O (H +) → CH 3 -C(NH 2)H-COOH + NH 3 (1).
CH 2 =CH-COOH + NH 3 → H 2 N-CH 2 -CH 2 -COOH (2);
O 2 N-C 6 H 4 -COOH + [H] →H 2 N-C 6 H 4 -COOH (3).
Хімічні властивості амінокислот
Амінокислота як гетерофункціональні сполуки вступають у більшість реакцій, характерних для карбонових кислот та амінів. Наявність у молекулах амінокислот двох різних функціональних груп призводить до появи низки специфічних властивостей.
Амінокислоти – амфотерні сполуки. Вони реагують як з кислотами, так і з основами:
NH 2 -CH 2 -COOH + HCl→Cl
NH 2 -CH 2 -COOH + NaOH → NH 2 -CH 2 -COONa + H 2 O
Водні розчини амінокислот мають нейтральне, лужне та кислотне середовище в залежності від кількості функціональних груп. Наприклад, глутамінова кислота утворює кислий розчин, оскільки в її складі дві карбоксильні групи та одна аміногрупа, а лізин - лужний розчин, т.к. у її складі одна карбоксильна група та дві аміногрупи.
Дві молекули амінокислоти можуть взаємодіяти одна з одною. При цьому відбувається відщеплення молекули води та утворюється продукт, у якому фрагменти молекули пов'язані між собою пептидним зв'язком (-CO-NH-). Наприклад:

Отриману сполуку називають дипептидом. Речовини, побудовані з багатьох залишків амінокислот, називаються поліпептидами. Пептиди гідролізуються під дією кислот та основ.
Застосування амінокислот
Амінокислоти, необхідні для побудови організму як людина, так і тварини отримують з білків їжі.
γ-аміномасляна кислота використовується в медицині (аміналон / гаммалон) при психічних захворюваннях; її основі створено низку ноотропних препаратів, тобто. які впливають на процеси мислення.
ε-Амінокапронова кислота також використовується в медицині (кровоспинний засіб), а також являє собою великотоннажний промисловий продукт, що використовується для отримання синтетичного поліамідного волокна - капрону.
Антранілова кислота використовується для синтезу барвників, наприклад, синього індиго, а також бере участь у біосинтезі гетероциклічних сполук.
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | Напишіть рівняння реакцій аланіну з: а) гідроксидом натрію; б) гідроксидом амонію; в) соляною кислотою. За рахунок яких груп внутрішня сіль виявляє кислотні та основні властивості? |
| Відповідь | Амінокислоти часто зображують як сполуки, що містять аміногрупу та карбоксильну групу, проте з такою структурою не узгоджуються деякі їх фізичні та хімічні властивості. Будова амінокислот відповідає біполярному іону: H 3 N + -CH(R)-COO - . Запишемо формулу аланіну як внутрішньої солі: H 3 N + -CH(CH 3)-COO - . Виходячи з цієї структурної формули, напишемо рівняння реакцій: а) H 3 N + -CH(CH 3)-COO - + NaOH = H 2 N-CH(CH 3)-COONa + H 2 O; б) H 3 N + -CH(CH 3)-COO - + NH 3 × H 2 O = H 2 N-CH (CH 3)-COONH 4 + H 2 O; в) H 3 N + -CH(CH 3)-COO - + HCl = Cl -. Внутрішня сіль амінокислоти реагує з основами як кислота, із кислотами - як основа. Кислотна група - N + H 3 , основна - COO -. |
ПРИКЛАД 2
| Завдання | При дії на розчин 9,63 г невідомої моноамінокарбонової кислоти надлишком азотистої кислоти отримано 2,01 л азоту при 748 мм. рт. ст. і 20 o С. Визначте молекулярну формулу цієї сполуки. Чи може ця кислота бути однією з природних амінокислот? Якщо так, то яка це кислота? До складу молекули цієї кислоти не входить бензольна кільце. |
| Рішення | Напишемо рівняння реакції: H 2 NC x H 2 x COOH + HONO = HO-C x H 2 x -COOH + N 2 + H 2 O. Знайдемо кількість речовини азоту при н.у., застосовуючи рівняння Клапейрона-Менделєєва. Для цього температуру та тиск виражаємо в одиницях СІ: T = 273 + 20 = 293 K; P = 101,325 × 748/760 = 99,7 кПа; n(N 2) = 99,7 × 2,01/8,31 × 293 = 0,082 моль. За рівнянням реакції знаходимо кількість речовини амінокислоти та її молярну масу. За рівнянням n(H 2 NC x H 2 x COOH) = n(N 2) = 0,082 моль. M(H 2 NC x H 2 x COOH) = 9,63/0,082 = 117 г/моль. Визначимо амінокислоту. Складемо рівняння та знайдемо x: 14x + 16 + 45 = 117; H 2 NC 4 H 8 COOH. З природних кислот такому складу може відповідати валін. |
| Відповідь | Ця амінокислота – валін. |
Амінокислотами називаються органічні сполуки, що містять у молекулі функціональні групи: аміно- та карбоксильну.
Номенклатура амінокислот. За систематичною номенклатурою назви амінокислот утворюються із назв відповідних карбонових кислот та додавання слова «аміно». Положення аміногрупи вказують цифрами. Відлік ведеться від вуглецю карбоксильної групи.
Ізомерія амінокислот. Їх структурна ізомерія визначається положенням аміногрупи та будовою вуглецевого радикала. Залежно від положення NH 2 -групи розрізняють -, - та -амінокислоти.

З -амінокислот будуються молекули білка.
Їх також характерна ізомерія функціональної групи (міжкласовими ізомерами амінокислот можуть бути складні ефіри амінокислот або аміди гідроксикислот). Наприклад, для 2-амінопропанової кислоти СН 3 – СН(NH) 2 – COOHможливі наступні ізомери

Фізичні властивості α-амінокислот
Амінокислоти – безбарвні кристалічні речовини, нелеткі (малий тиск насиченої пари), що плавляться з розкладанням за високих температур. Більшість їх добре розчиняється у воді і погано в органічних розчинниках.
Водні розчини одноосновних амінокислот мають нейтральну реакцію. -Амінокислоти можна розглядати як внутрішні солі (біполярні іони): + NH 3 CH 2 COO - . У кислому середовищі вони поводяться як катіони, у лужному – як аніони. Амінокислоти є амфотерними сполуками, що виявляють одночасно кислотні та основні властивості.
Способи одержання -амінокислот
1. Дія аміаку на солі хлорзаміщених кислот.
Cl
CH 2
COONH 4 + NH 3  NH 2
CH 2 COOH
NH 2
CH 2 COOH
2. Дія аміаку та синильної кислоти на альдегіди.

3. Гідролізом білків одержують 25 різних амінокислот. Поділ їх – дуже непросте завдання.
Способи одержання -амінокислот
1. Приєднання аміаку до ненасичених карбонових кислот.
СН 2 = СН СООН + 2NH 3 NH 2 CH 2 CH 2 COONH 4 .
2. Синтез з урахуванням двоосновної малонової кислоти.
Хімічні властивості амінокислот
1. Реакції з карбоксильної групи.
1.1. Освіта ефірів під час дії спиртів.
2. Реакції з аміногрупи.
2.1. Взаємодія із мінеральними кислотами.
NH 2 CH 2 COOH + HCl H 3 N + CH 2 COOH + Cl -
2.2. Взаємодія із азотистою кислотою.
NH 2 CH 2 COOH + HNO 2 HO CH 2 COOH + N 2 + H 2 O
3. Перетворення амінокислот під час нагрівання.
3 .1.-амінокислоти утворюють циклічні аміди.
.1.-амінокислоти утворюють циклічні аміди.
3![]() .2.-амінокислоти відщеплюють аміногрупу та атом водню у-вуглецевого атома.
.2.-амінокислоти відщеплюють аміногрупу та атом водню у-вуглецевого атома.
Окремі представники
Гліцин NH 2 CH 2 COOH(глікокол). Одна з найпоширеніших амінокислот, що входять до складу білків. За звичайних умов – безбарвні кристали з Тпл = 232-236С. Добре розчинна у воді, нерозчинна в абсолютному спирті та ефірі. Водневий показник водного розчину 6,8; рК а = 1,510 10; рК = 1,710 12 .
-аланін – амінопропіонова кислота
Широко поширена у природі. Зустрічається у вільному вигляді у плазмі крові та у складі більшості білків. Т пл = 295-296С, добре розчинна у воді, погано в етанолі, нерозчинна в ефірі. рК а (СООН) = 2,34; рК а (NH  )
= 9,69.
)
= 9,69.
-аланін NH 2 CH 2 CH 2 COOH– дрібні кристали з Т пл = 200С, добре розчинна у воді, погано в етанолі, нерозчинна в ефірі та ацетоні. рК а (СООН) = 3,60; рК а (NH  ) = 10,19; у білках відсутня.
) = 10,19; у білках відсутня.
Комплексони. Цей термін використовують для назви ряду -амінокислот, що містять дві або три карбоксильні групи. Найбільш прості:

Н  Найбільш поширений комплексон - етилендіамінтетраоцтова кислота.
Найбільш поширений комплексон - етилендіамінтетраоцтова кислота.
Її динатрієва сіль – трилон Б – надзвичайно широко застосовується в аналітичній хімії.
Зв'язок між залишками -амінокислот називають пептидною, а самі сполуки, що утворюються, пептидами.
Два залишки -амінокислот утворюють дипептид, три – трипептид. Багато залишків утворюють поліпептиди. Поліпептиди, як і амінокислоти, амфотерні, кожному властива своя ізоелектрична точка. Білки – поліпептиди.
Будь-яка сполука, яка містить одночасно карбоксильну та аміногрупу, є амінокислотою . Однак частіше цей термін застосовується для позначення карбонових кислот, аміногрупа яких знаходиться в a-положенні до карбоксильної групи.
Амінокислоти, як правило, входять до складу полімерів. білків. У природі зустрічається понад 70 амінокислот, але лише 20 відіграють важливу роль у живих організмах. Незамінними називаються амінокислоти, які можуть бути синтезовані організмом з речовин, які з їжею, у кількостях, достатніх у тому, щоб задовольнити фізіологічні потреби організму. Незамінні амінокислоти наводяться у табл. 1. Для хворих на фенілкетонурію незамінною амінокислотою є також тирозин (Див. табл. 1).
Таблиця 1
Незамінні амінокислоти R-CHNH2 COOH
Амінокислоти називають зазвичай як заміщені відповідними карбоновими кислотами, позначаючи положення аміногрупи літерами грецького алфавіту. Для найпростіших амінокислот зазвичай застосовуються тривіальні назви (гліцин, аланін, ізолейцин тощо). Ізомерія амінокислот пов'язана з розташуванням функціональних груп та будовою вуглеводневого скелета. Молекула амінокислоти може містити одну або кілька карбоксильних груп і відповідно амінокислоти розрізняються по основності. Також у молекулі амінокислоти може бути різна кількість аміногруп.
СПОСОБИ ОТРИМАННЯ АМІНОКИСЛОТ
1. Гідроліз білків можна отримати близько 25 амінокислот, але отриману суміш важко розділити. Зазвичай одна або дві кислоти виходять у значно більших кількостях, ніж решта, і ці кислоти вдається виділити досить легко – за допомогою іонообмінних смол.
2. З галогензаміщених кислот. Один із найпоширеніших методів синтезу a-амінокислот полягає в амонолізі a-галогензаміщеної кислоти, яку зазвичай отримують за реакцією Геля-Фольгарда-Зелінського:
Цей метод можна модифікувати, отримуючи a-бромзаміщену кислоту через малоновий ефір:

Ввести аміногрупу в ефір a-галогензаміщеної кислоти можна за допомогою фталіміду калію ( синтез Габріеля):

3. З карбонільних сполук ( синтез Штрекера). Синтез a-амінокислот по Штреккер полягає в реакції карбонільного з'єднання з сумішшю хлориду амонію і ціаністого натрію (це удосконалення методу запропоновано Н.Д. Зелінським і Г.Л. Стадниковим).

Реакції приєднання - відщеплення за участю аміаку та карбонільного з'єднання дають імін, який реагує з ціаністим воднем, утворюючи a-амінонітрил. В результаті гідролізу утворюється a-амінокислота.

Хімічні властивості амінокислот
Усі a-амінокислоти, крім гліцину, містять хіральний a-вуглецевий атом і можуть зустрічатися у вигляді енантіомерів :

Було доведено, що майже всі природні a-амінокислоти мають одну і ту ж відносну конфігурацію при a-вуглецевому атомі. a-Вуглецевому атому (-)-серину була умовно приписана L-конфігурація, а a-вуглецевому атому (+)-серину - D-Конфігурація. При цьому якщо проекція a-амінокислоти по Фішеру написана так, що карбоксильна група розташована зверху, а R - внизу, у L-амінокислоти аміногрупа буде знаходитися зліва, а у D-амінокислоти – праворуч. Схема Фішера для визначення конфігурації амінокислоти застосовна до всіх a-амінокислот, що мають хіральний a-вуглецевий атом.

З малюнка видно, що L-амінокислота може бути правообертальної (+) або лівообертальної (-) в залежності від природи радикала. Переважна більшість a-амінокислот, що зустрічаються в природі, відноситься до L-Ряд. Їх енантіоморфи, тобто. D-амінокислоти, синтезуються тільки мікроорганізмами та називаються "неприродними" амінокислотами .
Згідно з номенклатурою (R,S), більшість «природних» або L-амінокислот має S-конфігурацію.

L-Ізолейцин і L-треонін, що містять по два хіральні центри в молекулі, можуть бути будь-якими членами пари діастереомерів залежно від конфігурації при b-вуглецевому атомі. Нижче наводяться правильні абсолютні зміни цих амінокислот.

КИСЛОТНО-ОСНОВНІ ВЛАСТИВОСТІ АМІНОКИСЛОТ
Амінокислоти – амфотерні речовини, які можуть існувати у вигляді катіонів або аніонів. Ця властивість пояснюється наявністю як кислотної ( -СООН), і основний ( - NH 2 ) групи в одній і тій же молекулі. У дуже кислих розчинах NH 2 -група кислоти протонується і кислота стає катіоном У сильнолужних розчинах карбоксильна група амінокислоти депротонується і кислота перетворюється на аніон.
У твердому стані амінокислоти існують у вигляді цвіттер-іонів (біполярних іонів, внутрішніх солей). У цвіттер-іонах протон переноситься від карбоксильної групи до аміногрупи:

Якщо помістити амінокислоту в середовище, що має провідність, і опустити туди пару електродів, то в кислих розчинах амінокислота мігруватиме до катода, а в лужних розчинах - до анода. При деякому значенні рН, характерному для даної амінокислоти, вона не пересуватиметься ні до анода, ні до катода, оскільки кожна молекула знаходиться у вигляді цвіттер-іона (несе і позитивний, і негативний заряд). Це значення рН називається ізоелектричною точкою(pI) цієї амінокислоти.
РЕАКЦІЇ АМІНОКИСЛОТ
Більшість реакцій, у які амінокислоти вступають у лабораторних умовах ( in vitro), властиві всім амінам чи карбоновим кислотам.
1. утворення амідів по карбоксильній групі. При реакції карбонільної групи амінокислоти з аміногрупою аміну паралельно протікає реакція поліконденсації амінокислоти, що призводить до утворення амідів. Щоб запобігти полімеризації, аміногрупу кислоти блокують для того, щоб в реакцію вступала тільки аміногрупа аміну. З цією метою використовують карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформіат), трет-бутоксикарбоксазид та ін. Для реакції з аміном карбоксильну групу активують, впливаючи на неї етилхлорформіатом. захисну групупотім видаляють шляхом каталітичного гідрогенолізу або дією холодного розчину бромистого водню в оцтовій кислоті.

2. утворення амідів за аміногрупою. При ацилуванні аміногрупи a-амінокислоти утворюється амід.

Реакція краще йде в основному середовищі, тому що при цьому забезпечується висока концентрація вільного аміну.
3. освіту складних ефірів. Карбоксильна група амінокислоти легко етерифікується звичайними методами. Наприклад, метилові ефіри одержують, пропускаючи сухий газоподібний хлористий водень через розчин амінокислоти в метанолі:

Амінокислоти здатні до поліконденсації, у результаті якої утворюється поліамід. Поліаміди, що складаються з a-амінокислот, називаються пептидами або поліпептидами . Амідний зв'язок у таких полімерах називається пептидний зв'язком. Поліпептиди з молекулярною масою не менше 5000 називають білками . До складу білків входить близько 25 різних амінокислот. При гідролізі білка можуть утворюватися всі ці амінокислоти або деякі з них у певних пропорціях, характерних для окремого білка.
Унікальна послідовність амінокислотних залишків у ланцюгу, властива даному білку, називається первинною структурою білка . Особливості скручування ланцюгів білкових молекул (взаємне розташування фрагментів у просторі) називаються вторинною структурою білків . Поліпептидні ланцюги білків можуть з'єднуватися між собою з утворенням амідних, дисульфідних, водневих та інших зв'язків за рахунок бічних ланцюгів амінокислот. Внаслідок цього відбувається закручування спіралі в клубок. Ця особливість будови називається третинною структурою білка . Для прояву біологічної активності деякі білки повинні спочатку утворити макрокомплекс ( олігопротеїн), що складається з декількох повноцінних білкових субодиниць. Четвертична структура визначає ступінь асоціації таких мономерів у біологічно активному матеріалі.
Білки діляться на дві великі групи. фібрилярні (відношення довжини молекули до ширини більше 10) та глобулярні (Ставлення менше 10). До фібрилярних білків відноситься колаген найбільш поширений білок хребетних; на його частку припадає майже 50% сухої ваги хрящів та близько 30% твердої речовини кістки. У більшості регуляторних систем рослин і тварин каталіз здійснюється глобулярними білками, які мають назву ферментів .