Teplota a reakčná rýchlosť
Pri pevnej teplote je možná reakcia, ak interagujúce molekuly majú určité množstvo energie. Arrhenius to nazval prebytočnou energiou aktivačnej energie a samotné molekuly aktivovaný.
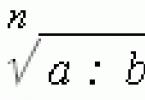
Podľa Arrhenia rýchlostná konštanta k a aktivačnej energie E a súvisia vzťahom nazývaným Arrheniova rovnica:
Tu A je predexponenciálny faktor, R je univerzálna plynová konštanta, T je absolútna teplota.
Pri konštantnej teplote teda určuje rýchlosť reakcie E a. Viac E a, témy menšie číslo aktívnych molekúl a tým pomalšie reakcia prebieha. Pri znižovaní E a rýchlosť sa zvyšuje a E a= 0 reakcia prebieha okamžite.
Hodnota E a charakterizuje charakter reagujúcich látok a určuje sa experimentálne zo závislosti k = f(T). Zistíme, že rovnicu (5.3) zapíšeme v logaritmickom tvare a vyriešime pre konštanty pri dvoch teplotách E a:
γ je teplotný koeficient rýchlosti chemická reakcia. Van't Hoffovo pravidlo má obmedzenú aplikáciu, pretože hodnota γ závisí od teploty a mimo oblasti E a= 50–100 kJ ∙ mol–1 toto pravidlo nie je vôbec splnené.
Na obr. 5.4 je vidieť, že energia vynaložená na prenos počiatočných produktov do aktívneho stavu (A * - aktivovaný komplex) je potom úplne alebo čiastočne reemitovaná pri prechode na finálne produkty. Rozdiel medzi energiami počiatočného a konečné produkty určuje Δ H reakcia, ktorá nezávisí od aktivačnej energie.
Systém teda na ceste z počiatočného stavu do konečného stavu musí prekonať energetickú bariéru. Iba aktívne molekuly majú v momente zrážky potrebný energetický prebytok rovný E a, môže prekonať túto bariéru a vstúpiť do chemickej interakcie. So stúpajúcou teplotou sa zvyšuje podiel aktívnych molekúl v reakčnom médiu.
Preexponenciálny multiplikátorA charakterizuje celkový počet kolízie. Pre reakcie s jednoduchými molekulami A blízko teoretickej zrážkovej veľkosti Z, t.j. A = Z vypočítané z kinetickej teórie plynov. Pre zložité molekuly A ≠ Z, preto je potrebné zaviesť stérický faktor P:
Tu Z je počet všetkých kolízií, P je podiel priestorovo priaznivých zrážok (nadobúda hodnoty od 0 do ), je podiel aktívnych, t.j. energeticky priaznivých zrážok.
Dimenzia rýchlostnej konštanty sa získa zo vzťahu
Analýzou výrazu (5.3) dospejeme k záveru, že existujú dve základné možnosti na urýchlenie reakcie:
a) zvýšenie teploty,
b) pokles aktivačnej energie.
Úlohy a testy na tému "Chemická kinetika. Teplota a reakčná rýchlosť"
- Rýchlosť chemickej reakcie. Katalyzátory - Klasifikácia chemických reakcií a ich priebeh 8.–9. ročník
Lekcie: 5 Úlohy: 8 Kvízy: 1
Rýchlosť chemickej reakcie závisí od teploty a so stúpajúcou teplotou sa rýchlosť reakcie zvyšuje. Holandský vedec Van't Hoff ukázal, že keď teplota stúpne o 10 stupňov, rýchlosť väčšiny reakcií sa zvýši 2-4 krát;
VT 2 = VT 1 *y (T2-T1)/10
Kde VT2 a VT1 sú reakčné rýchlosti pri teplotách T2 a Ti; y je teplotný koeficient rýchlosti reakcie, ktorý ukazuje, koľkokrát sa rýchlosť reakcie zvýšila so zvýšením teploty o 10 K.
Pri koncentrácii reaktantu 1 mol/l sa rýchlosť reakcie číselne rovná rýchlostnej konštante k. Potom rovnica ukazuje, že rýchlostná konštanta závisí od teploty rovnakým spôsobom ako rýchlosť procesu.
3. Napíšte variant reakcie eliminácie (eliminácie) s uvoľňovaním halogenovodíka.
C2H5CI \u003d C2H4 + HCl
Lístok číslo 4
1. Čo je " atómová hmotnosť», « molekulová hmotnosť““, „mól látky“ a čo sa považuje za jednotku atómovej hmotnosti (am.m.u.)?
ATÓMOVÁ HMOTNOSŤ - hmotnosť atómu v jednotkách atómovej hmotnosti (am.m.u.). na jednotku a. e. m. je akceptovaná 1/12 hmotnosti izotopu uhlíka-12.
a.u.m. \u003d 1/12 m 12 6 C \u003d 1,66 * 10 -24
MOLEKULÁRNA HMOTNOSŤ - molárna hmotnosť zlúčeniny uvádzaná ako 1/12 molárna hmota atóm uhlíka-12.
MOL - množstvo látky obsahujúcej rovnaký počet častíc alebo štruktúrnych jednotiek (atómov, iónov, molekúl, radikálov, elektrónov, ekvivalentov atď.) ako v 12a. e.m. izotop uhlík-12.
Vzorec na zvýšenie rýchlosti reakcie v prítomnosti katalyzátora.
Pomocou katalyzátorov môžete zmeniť hodnotu Ea (aktivačná energia). Látky, ktoré sa zúčastňujú reakčného procesu, ale nie sú spotrebované, sa nazývajú katalyzátory. Tento jav sa nazýva katalýza. Zvýšenie rýchlosti reakcie v prítomnosti katalyzátora je určené vzorcom
V závislosti od toho, či je katalyzátor v rovnakej fáze ako reaktanty alebo tvorí nezávislú fázu, hovoríme o homogénnej alebo heterogénnej katalýze. Mechanizmus katalytického pôsobenia u nich nie je rovnaký, avšak v oboch prípadoch je reakcia zrýchlená v dôsledku poklesu Ea. Existuje množstvo špecifických katalyzátorov – inhibítorov, ktoré znižujú rýchlosť reakcie.
kde sú parametre katalytického procesu, V, k, Ea- nekatalytický proces.
Napíšte reakcie horenia uhlíka anorganické látky v kyslíku s uvedením oxidačného činidla a redukčného činidla, ako aj oxidačného stavu uhlíka pred a po reakcii.
C - redukčné činidlo, oxidačný proces
O - oxidačné činidlo, redukčný proces
Lístok číslo 5
1. Čo je to „elektronegativita“, „valencia“, „oxidačný stav“ prvku a aké sú základné pravidlá na ich určenie?
OXIDAČNÝ STAV - podmienený náboj atómu prvku, získaný za predpokladu, že zlúčenina pozostáva z iónov. Môže byť kladný, záporný, nulový, zlomkový a je označený arabskou číslicou so znamienkom „+“ alebo „-“ vo forme indexu v pravom hornom rohu symbolu prvku: C 1-, O 2-, H + , Mg2+, N3-, N5+, Cr6+.
Na určenie oxidačného stavu (s.o.) prvku v zlúčenine (ióne) sa používajú nasledujúce pravidlá:
1 V jednoduché látky(H2, S8, P4) s. o. rovná sa nule.
2 Konštantná p. o. majú alkalické (E+) prvky a prvky alkalických zemín (E2+), ako aj fluór P-.
3 Vodík vo väčšine zlúčenín má s. o. H+ (H20, CH4, HC1), v hydridoch - H-(-NaH, CaH2); s. o. kyslík sa spravidla rovná -2 (O2-), v peroxidoch (-O-O-) - 1 (O-).
4 V binárnych zlúčeninách nekovov, zápor s. o. priradené k prvku vpravo).
5 Algebraický súčet str. o. molekula je nula, ión - jeho náboj.
Schopnosť atómu pripojiť alebo nahradiť určitý počet iných atómov sa nazýva VALENCIA. Mierou valencie je počet atómov vodíka alebo kyslíka pripojených k prvku za predpokladu, že vodík je jednomocný a kyslík je dvojmocný.
Zvýšenie rýchlosti reakcie so zvyšujúcou sa teplotou je zvyčajne charakterizované teplotným koeficientom rýchlosti reakcie, číslom, ktoré ukazuje, koľkokrát sa rýchlosť danej reakcie zvyšuje so zvýšením teploty systému o 10 ° C. Teplotný koeficient rôzne reakcie sú rôzne. Pri bežných teplotách je jeho hodnota pre väčšinu reakcií v rozmedzí 2 ... 4.
Teplotný koeficient sa určuje v súlade s takzvaným „van't Hoffovým pravidlom“, ktoré je matematicky vyjadrené rovnicou
v 2 /v 1 = g ( T 2 – T 1)/10 ,
kde v 1 a v 2 – reakčné rýchlosti pri teplotách T 1 a T 2; g je teplotný koeficient reakcie.
Takže napríklad, ak g = 2, potom pre T 2 - T 1 = 50 °С v 2 /v 1 = 2 5 = 32, t.j. reakcia sa zrýchlila 32-krát a toto zrýchlenie v žiadnom prípade nezávisí od absolútnych hodnôt T 1 a T 2, ale len na ich rozdiel.
aktivačná energia, rozdiel medzi hodnotami priemernej energie častíc (molekúl, radikálov, iónov atď.) vstupujúcich do elementárneho aktu chemickej reakcie a priemernou energiou všetkých častíc v reagujúcom systéme. Pre rôzne chemické reakcie E. a. sa značne líši - od niekoľkých po ~ 10 j./mol. Pre rovnakú chemickú reakciu je hodnota E. a. závisí od typu distribučných funkcií molekúl z hľadiska energií ich translačného pohybu a vnútorných stupňov voľnosti (elektronické, vibračné, rotačné). Ako štatistickú hodnotu E. a. treba odlíšiť od prahovej energie alebo energetickej bariéry – minimálnej energie, ktorú musí mať jeden pár zrážajúcich sa častíc, aby prebehla daná elementárna reakcia.
Arrheniova rovnica, teplotná závislosť rýchlostnej konštanty do elementárna chem. reakcie:
kde A je preexponenciálny faktor (rozmer je rovnaký ako rozmer k), E a-aktivačná energia, zvyčajne prijímajúca pozitívnu. hodnoty, T-abs. teplota, k-Boltzmannova konštanta. Je zvykom citovať E a na molekulu. a na počte častíc N A\u003d 6,02 * 10 23 (Avogadrova konštanta) a vyjadrené v kJ / mol; v týchto prípadoch v Arrheniovej rovnici hodnota k vymeňte plynovú konštantu R. Graf 1k verzus 1 /kT(Arrhenius graf) - priamka, ktorej negatívny sklon je určený aktivačnou energiou E a a charakterizuje pozitívne. teplotná závislosť do.
Katalyzátor - Chemická látka, ktorý urýchľuje reakciu, ale nie je súčasťou reakčných produktov. Množstvo katalyzátora sa na rozdiel od iných činidiel po reakcii nemení. Je dôležité pochopiť, že katalyzátor sa podieľa na reakcii. Poskytovanie viac rýchla trať pri reakcii katalyzátor reaguje s východiskovým materiálom, výsledná medziproduktová zlúčenina podlieha transformáciám a nakoniec sa rozdelí na produkt a katalyzátor. Potom katalyzátor opäť reaguje s východiskovým materiálom a tento katalytický cyklus sa mnohokrát (až miliónkrát) opakuje [ zdroj?] sa opakuje.
Katalyzátory sa delia na homogénne a heterogénne. Homogénny katalyzátor je v rovnakej fáze s reaktantmi, heterogénny tvorí nezávislú fázu oddelenú rozhraním od fázy, v ktorej sa nachádzajú reaktanty. Typickými homogénnymi katalyzátormi sú kyseliny a zásady. Ako heterogénne katalyzátory sa používajú kovy, ich oxidy a sulfidy.
Reakcie rovnakého typu môžu prebiehať s homogénnymi aj heterogénnymi katalyzátormi. Takže spolu s kyslými roztokmi, ktoré majú kyslé vlastnosti tuhý Al 2 O 3, TiO 2, ThO 2, hlinitokremičitany, zeolity. Heterogénne katalyzátory so základnými vlastnosťami: CaO, BaO, MgO.
Heterogénne katalyzátory majú spravidla vysoko vyvinutý povrch, pre ktorý sú distribuované na inertnom nosiči (silikagél, oxid hlinitý, aktívne uhlie atď.).
Pre každý typ reakcie sú účinné len určité katalyzátory. Okrem už spomínaných acidobázická, existujú katalyzátory redox; sú charakterizované prítomnosťou prechodného kovu alebo jeho zlúčeniny (Co +3, V 2 O 5 + MoO 3). V tomto prípade sa katalýza uskutočňuje zmenou oxidačného stavu prechodného kovu.
Disperzný systém- sú to útvary dvoch alebo viacerých fáz (telies), ktoré sa vôbec alebo prakticky nemiešajú a navzájom chemicky nereagujú. Prvá z látok dispergovaná fáza) je jemne rozložená v druhej ( disperzné médium). Ak existuje viacero fáz, možno ich od seba fyzicky oddeliť (odstreďovaním, separáciou a pod.).
Dispergované systémy sú zvyčajne koloidné roztoky, sóly. Dispergované systémy zahŕňajú aj prípad pevného dispergovaného média, v ktorom sa nachádza dispergovaná fáza.
Väčšina všeobecná klasifikácia rozptýlené systémy na základe rozdielu v stav agregácie disperzné médium a dispergovaná fáza. Kombinácie troch typov agregátneho stavu umožňujú rozlíšiť deväť typov rozptýlených systémov. Pre stručnosť sa zvyčajne označujú zlomkom, ktorého čitateľ označuje dispergovanú fázu a menovateľ označuje disperzné médium, napríklad pre systém „plyn v kvapaline“ sa používa označenie G/L.
koloidné roztoky. Koloidný stav je charakteristický pre mnohé látky, ak ich častice majú veľkosť 1 až 500 nm. Je ľahké to ukázať celkový povrch tieto častice sú obrovské. Ak predpokladáme, že častice majú tvar gule s priemerom 10 nm, potom s celkovým objemom týchto častice 1 cm 3 budú mať
plocha cca 10 m2. Ako už bolo spomenuté, povrchová vrstva sa vyznačuje povrchovou energiou a schopnosťou adsorbovať určité častice vrátane iónov
z roztoku. Charakteristickým znakom koloidných častíc je prítomnosť náboja na ich povrchu v dôsledku selektívnej adsorpcie iónov. Koloidná častica má zložitú štruktúru. Zahŕňa jadro, adsorbované ióny, protiíny a rozpúšťadlo. Existujú lyofilné (guid.
rofilné) koloidy, v ktorých rozpúšťadlo interaguje s jadrami častíc, ilnofóbne (hydrofóbne) koloidy, v ktorých rozpúšťadlo neinteraguje s jadrami
častice. Rozpúšťadlo je zahrnuté v kompozícii hydrofóbnych častíc len ako solvátovaný obal adsorbovaných iónov alebo v prítomnosti stabilizátorov (tenzidov) s lyofóbnymi a lyofilnými časťami.
Tu je niekoľko príkladov koloidných častíc:
Ako. možno vidieť, že jadro pozostáva z elektricky neutrálneho agregátu častíc s adsorbovanými iónmi prvkov, ktoré tvoria jadro (v týchto príkladoch ióny Ag +, HS-, Fe3+). Koloidná častica má okrem jadra protiióny a molekuly rozpúšťadla. Adsorbované ióny a protiióny tvoria adsorbovanú vrstvu s rozpúšťadlom. Celkový náboj častice sa rovná rozdielu medzi nábojmi adsorbovaných iónov a protiiónov. Okolo častíc je difúzna vrstva iónov, ktorých náboj sa rovná číslu koloidnej častice. Koloidné častice a difúzne vrstvy tvoria elektricky neutrálnu micelu
Micely(zdrobnenina lat. sľuda- častica, zrno) - častice v koloidných systémoch, pozostávajú z veľmi malého jadra nerozpustného v danom prostredí, obklopeného stabilizačným obalom adsorbovaných iónov a molekúl rozpúšťadla. Napríklad micela sulfidu arzénu má štruktúru:
((As 2 S 3) m nHS − (n-x)H+) X- xH+
Priemerná veľkosť micely od 10 -5 do 10 -7 cm.
Koagulácia- rozdelenie koloidného roztoku na dve fázy - rozpúšťadlo a želatínovú hmotu, alebo zahustenie roztoku v dôsledku zhrubnutia častíc rozpustenej látky
Peptizácia je proces prechodu koloidnej zrazeniny alebo gélu na koloidný roztok pôsobením kvapaliny alebo látok do nej pridaných, ktoré sú zrazeninou alebo gélom dobre adsorbované, v tomto prípade nazývané peptizéry (napríklad peptizácia tukov pod pôsobenie žlče).
Peptizácia - oddelenie zhlukov častíc gélov (rôsol) alebo voľných sedimentov pod vplyvom určitých látok - peptizérov po koagulácii koloidných roztokov. V dôsledku peptizácie prechádza zrazenina (alebo gél) do suspendovaného stavu.
RIEŠENIA, jednofázové systémy pozostávajúce z dvoch alebo viacerých komponentov. Podľa ich stavu agregácie môžu byť roztoky pevné, kvapalné alebo plynné.
Rozpustnosť, schopnosť látky vytvárať s inou látkou (alebo látkami) homogénne zmesi s rozptýleným rozložením zložiek (pozri Roztoky). Zvyčajne sa za rozpúšťadlo považuje látka, ktorá existuje vo svojej čistej forme v rovnakom stave agregácie ako výsledný roztok. Ak boli pred rozpustením obe látky v rovnakom stave agregácie, za rozpúšťadlo sa považuje látka prítomná v zmesi vo výrazne väčšom množstve.
Rozpustnosť je určená fyzikálnou a chemickou afinitou molekúl rozpúšťadla a rozpustenej látky, pomerom energií interakciou homogénnych a nepodobných zložiek roztoku. Spravidla sú navzájom dobre rozpustné, fyzikálne podobné. a chem. vlastnosti hmoty (empirické pravidlo „podobné sa rozpúšťa v podobnom“). Najmä látky obsahujúce polárne molekuly a látky s iónový typ prípojky studne sol. v polárnych rozpúšťadlách (voda, etanol, kvapalný amoniak), a nepolárne látky sú dobre sol. v nepolárnych rozpúšťadlách (benzén, sírouhlík).
Rozpustnosť danej látky závisí od teploty a tlaku zodpovedá všeobecnému princípu posunu rovnováh (pozri Le Chatelier-Brownov princíp). Koncentrácia nasýteného roztoku za daných podmienok číselne určuje R. látky v danom rozpúšťadle a je aj tzv. rozpustnosť. Presýtené roztoky obsahujú väčšie množstvo rozpustenej látky, ako zodpovedá jej rozpustnosti, existencia presýtených roztokov je daná kinetikou. ťažkosti s kryštalizáciou (pozri Vznik novej fázy). Na charakterizáciu rozpustnosti slabo rozpustných látok sa používa súčin aktivít PA (pri roztokoch blízkych svojimi vlastnosťami ideálu súčin rozpustnosti PR).
Z kvalitatívnych úvah je zrejmé, že rýchlosť reakcií by sa mala zvyšovať so zvyšujúcou sa teplotou, od r v tomto prípade sa zvyšuje energia zrážajúcich sa častíc a zvyšuje sa pravdepodobnosť, že pri zrážke dôjde k chemickej premene. Pre kvantitatívny popis účinkov teploty v chemickej kinetike sa používajú dva základné vzťahy – van't Hoffovo pravidlo a Arrheniova rovnica.
Van't Hoffovo pravidlo spočíva v tom, že pri zahriatí na 10 ° C sa rýchlosť väčšiny chemických reakcií zvýši 2-4 krát. Matematicky to znamená, že rýchlosť reakcie mocninným spôsobom závisí od teploty:
![]() , (4.1)
, (4.1)
kde je teplotný koeficient rýchlosti ( = 24). Van't Hoffovo pravidlo je veľmi hrubé a je použiteľné len vo veľmi obmedzenom teplotnom rozsahu.
Oveľa presnejšie je Arrheniova rovnica popis teplotnej závislosti rýchlostnej konštanty:
![]() , (4.2)
, (4.2)
kde R- univerzálna plynová konštanta; A- predexponenciálny faktor, ktorý nezávisí od teploty, ale je určený iba typom reakcie; E A - aktivačnej energie, ktorú možno charakterizovať ako nejakú prahovú energiu: zhruba povedané, ak je energia zrážaných častíc menšia ako E A, potom k reakcii pri zrážke nedôjde, ak energia presiahne E A, dôjde k reakcii. Aktivačná energia nezávisí od teploty.
Grafická závislosť k(T) nasledovne:

Pri nízkych teplotách sa chemické reakcie takmer nevyskytujú: k(T) 0. Pri veľmi vysokých teplotách má rýchlostná konštanta tendenciu k limitnej hodnote: k(T)A. To zodpovedá skutočnosti, že všetky molekuly sú chemicky aktívne a každá zrážka vedie k reakcii.
Aktivačnú energiu je možné určiť meraním rýchlostnej konštanty pri dvoch teplotách. Rovnica (4.2) znamená:
![]() . (4.3)
. (4.3)
Presnejšie povedané, aktivačná energia sa určuje z hodnôt rýchlostnej konštanty pri niekoľkých teplotách. Na tento účel je Arrheniova rovnica (4.2) napísaná v logaritmickom tvare
![]()
a zapíšte experimentálne údaje do súradníc ln k - 1/T. Tangenta sklonu výslednej priamky je - E A / R.
Pri niektorých reakciách predexponenciálny faktor závisí od teploty len mierne. V tomto prípade ide o tzv experimentálna aktivačná energia:
![]() . (4.4)
. (4.4)
Ak je preexponenciálny faktor konštantný, potom sa experimentálna aktivačná energia rovná Arrheniusovej aktivačnej energii: E op = E A.
Príklad 4-1. Pomocou Arrheniovej rovnice odhadnite, pri akých teplotách a aktivačných energiách platí van't Hoffovo pravidlo.
Riešenie. Predstavme si van't Hoffovo pravidlo (4.1) ako mocninnú závislosť rýchlostnej konštanty:
![]() ,
,
kde B - konštantný. Porovnajme tento výraz s Arrheniovou rovnicou (4.2) s hodnotou ~ e = 2.718:
![]() .
.
Zoberme si prirodzený logaritmus oboch častí tejto približnej rovnosti:
![]() .
.
Diferencovaním získaného vzťahu vzhľadom na teplotu nájdeme požadovaný vzťah medzi aktivačnou energiou a teplotou:
Ak aktivačná energia a teplota približne spĺňajú tento vzťah, potom možno na odhad účinku teploty na rýchlosť reakcie použiť van't Hoffovo pravidlo.
Príklad 4-2. Reakcia prvého poriadku pri 70 °C je na 40 % dokončená za 60 minút. Pri akej teplote bude reakcia na 80 % ukončená za 120 minút, ak je aktivačná energia 60 kJ/mol?
Riešenie. Pre reakciu prvého rádu je rýchlostná konštanta vyjadrená ako stupeň konverzie takto:
![]() ,
,
kde a = X/a- stupeň premeny. Túto rovnicu píšeme pri dvoch teplotách, berúc do úvahy Arrheniovu rovnicu:
kde E A= 60 kJ/mol, T 1 = 343 tis., t 1 = 60 minút, a 1 = 0,4, t 2 = 120 minút, a2 = 0,8. Rozdeľte jednu rovnicu druhou a urobte logaritmus:

Dosadením vyššie uvedených veličín do tohto výrazu zistíme T 2 \u003d 333 K \u003d 60 °C.
Príklad 4-3. Rýchlosť bakteriálnej hydrolýzy svalov rýb sa zdvojnásobí pri prechode z teploty -1,1 o C na teplotu +2,2 o C. Odhadnite aktivačnú energiu tejto reakcie.
Riešenie. Dvojnásobné zvýšenie rýchlosti hydrolýzy je spôsobené zvýšením rýchlostnej konštanty: k 2 = 2k jeden . Aktivačnú energiu vo vzťahu k rýchlostným konštantám pri dvoch teplotách možno určiť z rovnice (4.3) s T 1 = t 1 + 273,15 = 272,05 tis T 2 = t 2 + 273,15 = 275,35 tis.:
![]() 130 800 J/mol = 130,8 kJ/mol.
130 800 J/mol = 130,8 kJ/mol.
4-1. Pomocou van't Hoffovho pravidla vypočítajte, pri akej teplote sa reakcia skončí po 15 minútach, ak pri 20 °C trvá 2 hodiny.Teplotný koeficient rýchlosti je 3. (odpoveď)
4-2. Polčas rozpadu látky pri 323 K je 100 minút a pri 353 K je 15 minút. Určte teplotný koeficient rýchlosti. (Odpoveď)
4-3. Aká by mala byť aktivačná energia, aby sa rýchlosť reakcie zvýšila 3-krát so zvýšením teploty o 10 0 С a) pri 300 K; b) pri 1000 K? (odpoveď)
4-4. Reakcia prvého rádu má aktivačnú energiu 25 kcal/mol a preexponenciálny faktor 5 . 1013 s-1. Pri akej teplote bude polčas tejto reakcie: a) 1 min; b) 30 dní? (odpoveď)
4-5. V ktorom z týchto dvoch prípadov sa zvyšuje rýchlostná konštanta reakcie viac krát: pri zahriatí z 0 o C na 10 o C alebo pri zahriatí z 10 o C na 20 o C? Svoju odpoveď zdôvodnite pomocou Arrheniovej rovnice. (Odpoveď)
4-6. Aktivačná energia niektorej reakcie je 1,5-krát väčšia ako aktivačná energia inej reakcie. Pri zahriatí z T 1 až T 2 sa rýchlostná konštanta druhej reakcie zvýšila a raz. Koľkokrát sa zvýšila rýchlostná konštanta prvej reakcie pri zahrievaní z T 1 až T 2? (odpoveď)
4-7. Rýchlostná konštanta komplexnej reakcie je vyjadrená pomocou rýchlostných konštánt základných krokov takto:
Vyjadrite aktivačnú energiu a preexponenciálny faktor komplexnej reakcie pomocou zodpovedajúcich veličín vzťahujúcich sa na elementárne stupne. (Odpoveď)
4-8. AT nezvratná reakcia 1. rádu 20 min pri 125 o C, stupeň premeny východiskovej látky bol 60 % a pri 145 o C sa rovnaký stupeň premeny dosiahol za 5,5 min. Nájdite rýchlostné konštanty a aktivačnú energiu tejto reakcie. (Odpoveď)
4-9. Reakcia 1. rádu pri teplote 25 °C je ukončená o 30 % za 30 minút. Pri akej teplote bude reakcia na 60 % dokončená za 40 minút, ak je aktivačná energia 30 kJ/mol? (Odpoveď)
4-10. Reakcia 1. rádu pri teplote 25 °C je ukončená na 70 % za 15 minút. Pri akej teplote bude reakcia na 50 % dokončená za 15 minút, ak je aktivačná energia 50 kJ/mol? (Odpoveď)
4-11. Rýchlostná konštanta reakcie prvého rádu je 4,02. 10-4 s-1 pri 393 K a 1,98 . 10 -3 s -1 pri 413 K. Vypočítajte pre-exponenciálny faktor pre túto reakciu. (Odpoveď)
4-12. Pre reakciu H 2 + I 2 2HI je rýchlostná konštanta pri teplote 683 K 0,0659 l / (mol. min) a pri teplote 716 K - 0,375 l / (mol. min). Nájdite aktivačnú energiu tejto reakcie a rýchlostnú konštantu pri teplote 700 K. (Odpoveď)
4-13. Pre reakciu 2N 2 O 2N 2 + O 2 je rýchlostná konštanta pri teplote 986 K 6,72 l / (mol. min) a pri teplote 1165 K - 977,0 l / (mol. min). Nájdite aktivačnú energiu tejto reakcie a rýchlostnú konštantu pri teplote 1053,0 K. (Odpoveď)
4-14. Trichlóracetátový ión v ionizujúcich rozpúšťadlách obsahujúcich H + sa rozkladá podľa rovnice
H+ + CCI3COO-C02 + CHCI3
Krok určujúci rýchlosť je monomolekulárne štiepenie väzby C-C v trichlóracetátovom ióne. Reakcia prebieha v prvom poradí a rýchlostné konštanty majú nasledujúce hodnoty: k= 3,11. 10-4 s-1 pri 90 °C, k= 7,62. 10 -5 s -1 pri 80 o C. Vypočítajte a) aktivačnú energiu, b) rýchlostnú konštantu pri 60 o C. (odpoveď)
4-15. Pre reakciu CH 3 COOC 2 H 5 + NaOH * CH 3 COONa + C 2 H 5 OH je rýchlostná konštanta pri teplote 282,6 K 2,307 l / (mol. min) a pri teplote 318,1 K - 21,65 l /(mol. min). Nájdite aktivačnú energiu tejto reakcie a rýchlostnú konštantu pri teplote 343 K. (Odpoveď)
4-16. Pre reakciu C 12 H 22 O 11 + H 2 O C 6 H 12 O 6 + C 6 H 12 O 6 je rýchlostná konštanta pri teplote 298,2 K 0,765 l / (mol. min) a pri teplote 328,2 K - 35,5 l/(mol min). Nájdite aktivačnú energiu tejto reakcie a rýchlostnú konštantu pri teplote 313,2 K. (Odpoveď)
4-17. Látka sa rozkladá v dvoch paralelných dráhach s rýchlostnými konštantami k 1 a k 2. Aký je rozdiel medzi aktivačnými energiami týchto dvoch reakcií, ak pri 10 o C k 1 /k 2 = 10 a pri 40 °C k 1 /k 2 = 0,1? (odpoveď)
4-18. Pri dvoch reakciách rovnakého rádu je rozdiel v aktivačných energiách E 2 - E 1 = 40 kJ/mol. Pri teplote 293 K je pomer rýchlostných konštánt k 1 /k 2 \u003d 2. Pri akej teplote sa budú rýchlostné konštanty rovnať? (Odpoveď)
4-19. Rozklad kyseliny acetóndikarboxylovej vo vodnom roztoku je reakciou prvého poriadku. Rýchlostné konštanty tejto reakcie boli merané pri rôznych teplotách:
Vypočítajte aktivačnú energiu a preexponenciálny faktor. Aký je polčas rozpadu pri 25 °C?
Problém 336.
Pri 150 °C je určitá reakcia dokončená za 16 minút. Ak vezmeme teplotný koeficient rýchlosti reakcie rovný 2,5, vypočítame, ako dlho táto reakcia skončí, ak sa uskutoční: a) pri 20 0 °С; b) pri 80 °C.
Riešenie:
Podľa van't Hoffovho pravidla je závislosť rýchlosti od teploty vyjadrená rovnicou:
vt a kt - rýchlosť a rýchlostná konštanta reakcie pri teplote t°C; v (t + 10) ak (t + 10) rovnaké hodnoty pri teplote (t + 10 0 C); - teplotný koeficient rýchlosti reakcie, ktorého hodnota pre väčšinu reakcií leží v rozmedzí 2 - 4.
a) Vzhľadom na to, že rýchlosť chemickej reakcie pri danej teplote je nepriamo úmerná dĺžke jej priebehu, dosadíme údaj uvedený v podmienke úlohy do vzorca, ktorý kvantitatívne vyjadruje van't Hoffovo pravidlo, dostaneme :

b) Keďže táto reakcia prebieha s poklesom teploty, potom je pri danej teplote rýchlosť tejto reakcie priamo úmerná dobe jej priebehu, dosadíme údaje uvedené v podmienke úlohy do vzorca, ktorý kvantitatívne vyjadruje van't Hoffovo pravidlo, dostaneme:

Odpoveď: a) pri 200 0 С t2 = 9,8 s; b) pri 80 0 С t3 = 162 h 1 min 16 s.
Problém 337.
Zmení sa hodnota konštanty rýchlosti reakcie: a) pri výmene jedného katalyzátora za iný; b) keď sa zmenia koncentrácie reaktantov?
Riešenie:
Reakčná rýchlostná konštanta je hodnota, ktorá závisí od povahy reaktantov, od teploty a od prítomnosti katalyzátorov a nezávisí od koncentrácie reaktantov. Môže sa rovnať rýchlosti reakcie v prípade, keď sa koncentrácie reaktantov rovnajú jednotke (1 mol/l).
a) Keď je jeden katalyzátor nahradený iným, rýchlosť danej chemickej reakcie sa zmení, alebo sa zvýši. Ak sa použije katalyzátor, rýchlosť chemickej reakcie sa zvýši, potom sa podľa toho zvýši aj hodnota konštanty rýchlosti reakcie. Zmena hodnoty konštanty reakčnej rýchlosti nastane aj vtedy, keď sa jeden katalyzátor nahradí iným, čo zvýši alebo zníži rýchlosť tejto reakcie v porovnaní s pôvodným katalyzátorom.
b) Keď sa zmení koncentrácia reaktantov, hodnoty reakčnej rýchlosti sa zmenia a hodnota konštanty reakčnej rýchlosti sa nezmení.
Problém 338.
Závisí tepelný účinok reakcie od jej aktivačnej energie? Odpoveď zdôvodnite.
Riešenie:
Tepelný účinok reakcie závisí len od počiatočného a konečného stavu systému a nezávisí od medzistupňov procesu. Aktivačná energia je nadbytočná energia, ktorú musia mať molekuly látok, aby ich zrážka viedla k vytvoreniu novej látky. Aktivačná energia sa môže meniť zvýšením alebo znížením teploty, prípadne jej znížením alebo zvýšením. Katalyzátory znižujú aktivačnú energiu, zatiaľ čo inhibítory ju znižujú.
Zmena aktivačnej energie teda vedie k zmene rýchlosti reakcie, ale nie k zmene reakčného tepla. Tepelný účinok reakcie je konštantná hodnota a nezávisí od zmeny aktivačnej energie pre danú reakciu. Napríklad reakcia na tvorbu amoniaku z dusíka a vodíka je:
Táto reakcia je exotermická, > 0). Reakcia prebieha s poklesom počtu mólov reagujúcich častíc a počtu mólov plynné látky, čím sa systém dostáva z menej stabilného stavu do stabilnejšieho, entropia klesá,< 0. Данная реакция в обычных условиях не протекает (она возможна только при достаточно низких температурах). В присутствии катализатора энергия активации уменьшается, и скорость реакции возрастает. Но, как до применения катализатора, так и в присутствии его тепловой эффект реакции не изменяется, реакция имеет вид:
Problém 339.
Pre ktorú reakciu, priamu alebo reverznú, je aktivačná energia väčšia, ak priama reakcia prebieha s uvoľňovaním tepla?
Riešenie:
Rozdiel medzi aktivačnými energiami priamych a reverzných reakcií sa rovná tepelnému účinku: H \u003d E a (pr.) - E a (arr.) . Táto reakcia prebieha za uvoľnenia tepla, t.j. je exotermický,< 0 Исходя из этого, энергия активации прямой реакции имеет меньшее значение, чем энергия активации обратной реакции:
E a (napr.)< Е а(обр.) .
odpoveď: E a (napr.)< Е а(обр.) .
Problém 340.
Koľkokrát sa zvýši rýchlosť reakcie prebiehajúcej pri 298 K, ak sa jej aktivačná energia zníži o 4 kJ/mol?
Riešenie:
Označme pokles aktivačnej energie Ea a rýchlostné konštanty reakcie pred a po poklese aktivačnej energie k a k. Pomocou Arrheniovej rovnice dostaneme:

Ea je aktivačná energia, k a k" sú konštanty rýchlosti reakcie, T je teplota v K (298).
Dosadením údajov úlohy do poslednej rovnice a vyjadrením aktivačnej energie v jouloch vypočítame zvýšenie rýchlosti reakcie:
![]()
Odpoveď: 5-krát.