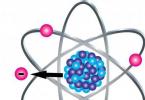
Astăzi vom desfășura o lecție nu numai de modelare, ci și de chimie și vom realiza modele de molecule din plastilină. Bilele de plastilină pot fi reprezentate ca atomi, iar chibriturile obișnuite sau scobitorii vor ajuta la arătarea conexiunilor structurale. Această metodă poate fi folosită de profesori atunci când explică materiale noi în chimie, de părinți când verifică și studiază temele și de copiii înșiși care sunt interesați de subiect. Probabil că nu există o modalitate mai ușoară și mai accesibilă de a crea material vizual pentru vizualizarea mentală a micro-obiectelor.
Iată ca exemple reprezentanți din lumea chimiei organice și anorganice. Prin analogie cu ele, se pot face și alte structuri, principalul lucru este să înțelegem toată această diversitate.
Materiale pentru lucru:
- plastilină din două sau mai multe culori;
- formulele structurale ale moleculelor din manual (dacă este necesar);
- chibrituri sau scobitori.
1. Pregătiți plastilină pentru modelarea atomilor sferici din care se vor forma molecule, precum și potriviri pentru a reprezenta legăturile dintre ei. Desigur, este mai bine să arătați atomi de diferite tipuri într-o culoare diferită, astfel încât să fie mai clar să vă imaginați un obiect specific al microlumii.
2. Pentru a face bile, prindeți numărul necesar de porții de plastilină, frământați în mâini și rulați în forme în palme. Pentru a sculpta molecule de hidrocarburi organice, puteți folosi bile roșii mai mari - acestea vor fi carbon și bile albastre mai mici - hidrogen.

3. Pentru a forma o moleculă de metan, introduceți patru chibrituri în bila roșie, astfel încât acestea să îndrepte spre vârfurile tetraedrului.

4. Pune bile albastre pe capetele libere ale meciurilor. Molecula de gaz natural este gata.

5. Pregătește două molecule identice pentru a-i explica copilului tău cum poate fi obținută molecula următoarei hidrocarburi, etanul.

6. Conectați cele două modele îndepărtând un chibrit și două bile albastre. Ethan este gata.

7. Apoi, continuați activitatea interesantă și explicați cum se formează o legătură multiplă. Scoateți cele două bile albastre și dublați legătura dintre carboni. În mod similar, puteți modela toate moleculele de hidrocarburi necesare lecției.

8. Aceeași metodă este potrivită pentru sculptarea moleculelor lumii anorganice. Aceleași bile de plastilină vă vor ajuta să vă realizați planurile.

9. Luați atomul de carbon central - bila roșie. Introduceți două chibrituri în el, definind forma liniară a moleculei; atașați două bile albastre, care în acest caz reprezintă atomi de oxigen, la capetele libere ale chibriturilor. Astfel, avem o moleculă de dioxid de carbon cu structură liniară.

10. Apa este un lichid polar, iar moleculele sale sunt formațiuni unghiulare. Ele constau dintr-un atom de oxigen și doi atomi de hidrogen. Structura unghiulară este determinată de perechea singură de electroni de pe atomul central. Poate fi reprezentat și ca două puncte verzi.

Acestea sunt genul de lecții creative interesante pe care cu siguranță ar trebui să le practicați cu copiii dvs. Elevii de orice vârstă vor deveni interesați de chimie și vor înțelege mai bine subiectul dacă, pe parcursul procesului de învățare, li se oferă un ajutor vizual realizat de ei înșiși.

GBPOU NSO „Colegiul Agrar Kolyvan”
Harta tehnologică instrucțională Nr. 1
conform OUD. unsprezece Chimie
profesii 35.01.23 Stăpână a moșiei, 19.01.04 Brutar
Secțiunea 1: Chimie organică
Subiectul 1.1: Concepte de bază ale chimiei organice și teoria structurii compușilor organici.
Denumirea funcției : Realizarea de modele de molecule - reprezentanți ai diferitelor clase de compuși organici.
Scopul lucrării:
generalizarea și sistematizarea cunoștințelor studenților despre teoria structurii compușilor organici;
consolidarea capacității de a compune formule structurale ale hidrocarburilor;
Elevul trebuie să obțină următoarele rezultate:
personal:
− un sentiment de mândrie și respect pentru istoria și realizările științei chimice autohtone; comportament chimic competent în activități profesionale și acasă la manipularea substanțelor chimice, materialelor și proceselor;
− disponibilitatea de a continua educația și formarea avansată în activitatea profesională aleasă și conștientizarea obiectivă a rolului competențelor chimice în aceasta;
− capacitatea de a folosi realizările științei chimice moderne și tehnologiilor chimice pentru a îmbunătăți propria dezvoltare intelectuală în activitatea profesională aleasă;
meta-subiect:
− utilizarea diferitelor tipuri de activitate cognitivă și operații intelectuale de bază (enunțarea problemei, formularea de ipoteze, analiza și sinteza, compararea, generalizarea, sistematizarea, identificarea relațiilor cauză-efect, căutarea analogilor, formularea concluziilor) rezolvarea problemei, utilizarea metodelor de bază de cunoaștere (observare, experiment științific) pentru a studia diverse aspecte ale obiectelor și proceselor chimice care trebuie întâlnite în domeniul profesional;
− utilizarea diverselor surse pentru obținerea de informații chimice, capacitatea de a evalua fiabilitatea acesteia pentru a obține rezultate bune în domeniul profesional;
subiect :
− formarea ideilor despre locul chimiei în tabloul științific modern al lumii;
Înțelegerea rolului chimiei în modelarea orizontului unei persoane și a alfabetizării funcționale pentru rezolvarea problemelor practice;
− stăpânirea conceptelor, teoriilor, legilor și modelelor chimice fundamentale;
Utilizarea cu încredere a terminologiei și simbolurilor chimice;
− stapanirea metodelor de baza ale cunoasterii stiintifice utilizate in chimie: observatie, descriere, masurare, experiment;
Abilitatea de a procesa, explica rezultatele experimentelor și trage concluzii;
− disponibilitatea și capacitatea de a aplica metode cognitive în rezolvarea problemelor practice;
− abilități dezvoltate de a da estimări cantitative și de a face calcule folosind formule și ecuații chimice;
− cunoașterea regulilor de siguranță atunci când se utilizează substanțe chimice;
− formarea propriei poziții în raport cu informațiile chimice obținute din diverse surse.
Forma de studiu : individual
Timp standard: 2 ore
Echipamente la locul de muncă : Un set de modele de molecule cu bile și băț, tabel „Hidrocarburi saturate”, tabel periodic, carduri cu tehnologie de instruire, caiete
Literatură:
Mijloace de educatie: verbal (verbal), vizual
Măsuri de siguranță: familiarizat cu regulile de securitate la locul de muncă și la birou.
Instrucțiuni
Hidrocarburile sunt substanțe organice formate din atomi de carbon și hidrogen. Atomul de carbon din toți compușii organici este tetravalent. Atomii de carbon pot forma lanțuri drepte, ramificate și închise. Proprietățile substanțelor depind nu numai de compoziția calitativă și cantitativă, ci și de ordinea în care atomii sunt legați între ei. Substanțele care au aceeași formulă moleculară, dar structuri diferite se numesc izomeri. Prefixele indică cantitateadi - Două,Trei - Trei,tetra - patru;ciclo - înseamnă închis.
Sufixele din numele hidrocarburilor indică prezența unei legături multiple:
ro
legătură simplă între atomi de carbon(C - C);
ro
legătură dublă între atomii de carbon(C = C);
în
triplă legătură între atomii de carbon(CU
=
CU);
diene
două legături duble între atomi de carbon(C = C - C = C);
Radicali:metil -CH 3 ; etil -C 2 N 5 ; clor -Cl; brom -Br.
Exemplu. Faceți un model al unei molecule de propan.
Moleculă de propanC 3 H 8 conține trei atomi de carbon și opt atomi de hidrogen. Atomii de carbon sunt legați între ei. Sufix– ro indică prezența unei singure legături între atomii de carbon. Atomii de carbon sunt localizați la un unghi de 109 28 minute.
Molecula are forma unei piramide. Desenați atomii de carbon ca cercuri negre, atomii de hidrogen ca cercuri albe și atomii de clor ca cercuri verzi.
Când desenați modele, observați raportul dintre dimensiunile atomice.
Aflați masa molară folosind tabelul periodic
DOMNIȘOARĂ 3 N 8 ) = 12 · 3 + 1 · 8 = 44 g/mol.
Pentru a numi o hidrocarbură trebuie să:
Alegeți cel mai lung lanț.
Număr care începe de la marginea de care radicalul sau legătura multiplă este cea mai apropiată.
Indicați radicalul dacă sunt indicați mai mulți radicali fiecare. (Numărul înaintea numelui).
Numiți radicalul, începând cu cel mai mic radical.
Numiți cel mai lung lanț.
Indicați poziția obligațiunii multiple. (Număr după nume).
Exemplu

Când compuneți formule după nume, trebuie să:
Determinați numărul de atomi de carbon din lanț.
Determinați poziția legăturii multiple. (Număr după nume).
Determinați poziția radicalilor. (Numărul înaintea numelui).
Scrieți formulele radicalilor.
În cele din urmă, determinați numărul și aranjamentul atomilor de hidrogen.
Comandă de lucru
Sarcina nr. 1 . Faceți modele de molecule:
1) un număr de alcani: metan, etan, butan, pentan, hexan, heptan, octan, nonan și decan;
2) Cicloalcani: ciclopropan,cicloetan
3) 2-metilpropan,
4) 1,2-dicloretan.
Desenați modele moleculare în caiet. Scrieți formulele structurale ale acestor substanțe. Găsiți greutățile moleculare ale acestora.
Sarcina nr. 2. Denumiți substanțele:

Sarcina nr. 3. Compune structural formule de substante:
a) buten-2, scrieți izomerul său;
b) 3,3 - dimetilpentină-1.
Întrebări de control
Dați formula generală pentru hidrocarburile saturate.
Ce substanțe se numesc omologi și care sunt izomeri?
Profesor: Rachkovskaya A.I.
7.1. Figura prezintă un experiment care ilustrează faptul că corpurile se extind atunci când sunt încălzite. Cu un stilou, încercuiți în imagine obiectul care a fost încălzit în acest experiment - o minge sau un inel. Justificati raspunsul.
7.2. Alegeți afirmația corectă.
Conform ideilor moderne, atunci când un balon cu apă se răcește, nivelul apei din tub scade pentru că... . 
7.3. Substanțele sunt formate din particule minuscule. Ce fenomene și experimente confirmă acest lucru?
7.4. Tabelul prezintă date exacte despre modificarea volumului de apă V în funcție de timpul t în timpul încălzirii.
Răspunde la întrebările.
a) Se poate spune că pe tot timpul de observare apa din balon a fost încălzită uniform? Explică-ți răspunsul.
b) Cum s-a modificat volumul de apă la încălzire?

8.1. Alegeți afirmația corectă.
Dacă încălzești o unghie, aceasta se alungește și devine mai groasă. Acest lucru se întâmplă pentru că atunci când este încălzit... . 
8.2. Scrie cuvintele moleculă, picătură, atom într-o astfel de ordine încât fiecare element următor să facă parte din cel anterior.
8.3. Figura prezintă modele de molecule de apă, oxigen și dioxid de carbon. Toate moleculele conțin un atom de oxigen (negru). Completați spațiile libere din text.

8.4. Măsurați lungimea brațului de la cot la degetul mic și comparați măsurarea cu dimensiunea unei molecule de apă.
9.1. Completați spațiile libere din text. „În ____, botanistul englez Robert Brown, privind printr-un microscop...”

9.2. Figura prezintă schematic moleculele lichide care înconjoară un grăunte de vopsea plasat în acest lichid. Săgețile indică direcția de mișcare a moleculelor lichide la un anumit moment în timp.

9.3. Marcați acele fenomene care sunt exemple de mișcare browniană.
9.4. Figura arată o linie întreruptă de-a lungul căreia o bucată de praf s-a mișcat în aer timp de câteva secunde.

a) Explicați de ce firul de praf și-a schimbat de multe ori direcția mișcării în timpul observării acestuia.
Datorită coliziunilor cu moleculele de aer și alte particule de praf.
b) În figură, indicați punctele în care particula de praf a fost afectată de moleculele care o înconjoară.
10.1. Se toarnă apă pură într-un cilindru de sticlă de sus și o soluție de sulfat de cupru este turnată în fund printr-un tub îngust. Cilindrul este în repaus când temperatura constanta. Arată în figură cum va arăta conținutul cilindrului la diferite intervale.

10.2. Două bile de cauciuc identice sunt conectate printr-un furtun transparent (vezi figura), iar bila din stânga în ambele cazuri este umplută cu hidrogen (colorează albastru hidrogen), cea din dreapta este goală în figura a și este umplută cu aer în figura b (colorează aerul în verde). Furtunul este prins între bile.

10.3. Trimite unul dintre cuvintele evidențiate pentru a completa explicația corectă a experimentului descris.

10.4. Experiment acasă.
Se pune o bucată de zahăr pe fundul unui pahar cu apă rece, dar nu se amestecă. Scrieți cât timp v-a luat pentru a detecta prezența moleculelor de zahăr pe suprafața apei din pahar și ce „dispozitiv” ați folosit.
11.1. Completați golurile din text folosind cuvintele: mai puternic; mai slab; atracţie; repulsie.

11.2. Conectați fenomenele și explicațiile corespunzătoare cu linii.

11.3. Trimite unul dintre cuvintele evidențiate pentru a completa explicația corectă a experimentului descris.

11.4. Completați propoziția pentru a obține explicația corectă a fenomenului.
11.5. Completați spațiile libere din text. „În viața de zi cu zi, întâlnim adesea fenomenele de umezire și neumezire.”

12.1. Ce stare a materiei este caracterizată de caracteristicile enumerate?
Chimie organica.
2.1.Subiect: " Teoria structurii compușilor organici"
2.1.1. Principii de bază ale teoriei structurii compușilor organici și clasificării compușilor organici.
1. Substanțe organice naturale și sintetice. Un pic din istoria chimiei organice. Proprietăți generale ale substanțelor organice (compoziție, tip de legătură chimică, structură cristalină, solubilitate, relație cu încălzirea în prezența oxigenului și fără acesta).
2. Teoria structurii compușilor organici de A.M.Butlerov. Dezvoltarea teoriei și semnificația ei.
3. Clasificarea substanţelor organice.
Substanțele organice și-au primit numele deoarece primele dintre substanțele studiate din acest grup făceau parte din organismele vii. Majoritatea substanțelor organice cunoscute în prezent nu se găsesc în organismele vii, ele sunt obținute (sintetizate) în laborator. Prin urmare, se face o distincție între substanțele organice naturale (naturale) (deși majoritatea pot fi obținute acum în laborator) și substanțele organice care nu există în natură - substanțele organice sintetice. Acestea. Denumirea „substanțe organice” este istorică și nu are prea multă semnificație. Toți compușii organici sunt compuși de carbon. Substanțele organice includ compușii carbonului, cu excepția substanțelor simple formate din carbon, oxizii săi, acidul carbonic și sărurile sale studiate în cursul chimiei anorganice. Cu alte cuvinte: chimia organică este chimia compușilor de carbon.
Scurt istoric al dezvoltării chimiei organizaționale:
Berzelius, 1827, primul manual de chimie organică. Vitaliști. Doctrina „forței vieții”.
Primele sinteze organice. Wöhler, 1824, sinteza acidului oxalic și a ureei. Kolbe, 1845, acid acetic. Berthelot, 1845, gras. Butlerov, 1861, substanță zaharoasă.
Dar ca știință, chimia organică a început cu crearea unei teorii a structurii compușilor organici. O contribuție semnificativă la aceasta a fost adusă de omul de știință german F.A. Kekule și de scoțianul A.S. Cooper. Dar contribuția decisivă îi aparține, fără îndoială, chimistului rus A.M. Butlerov.
Dintre toate elementele, carbonul se remarcă prin capacitatea sa de a forma compuși stabili în care atomii săi sunt legați între ei în lanțuri lungi de diverse configurații (liniare, ramificate, închise). Motivul acestei abilități: aproximativ aceeași energie de legătură a C-C și C-O (pentru alte elemente energia celui de-al doilea este mult mai mare). În plus, un atom de carbon poate fi într-unul din cele trei tipuri de hibridizare, formând legături simple, duble sau triple, nu numai unul cu celălalt, ci și cu atomii de oxigen sau azot. Adevărat, mult mai des (aproape întotdeauna) atomii de carbon sunt legați de atomii de hidrogen. Dacă un compus organic conține doar carbon și hidrogen, compușii se numesc hidrocarburi. Toți ceilalți compuși pot fi considerați derivați ai hidrocarburilor în care unii atomi de hidrogen sunt înlocuiți cu alți atomi sau grupuri de atomi. Prin urmare, o definiție mai precisă: Compușii organici sunt hidrocarburile și derivații acestora.
Există o mulțime de compuși organici - mai mult de 10 milioane (aproximativ 500 de mii anorganici). Compoziția, structura și proprietățile tuturor substanțelor organice au multe în comun.
Substanțele organice au o compoziție calitativă limitată. Neapărat C și H, adesea O sau N, mai rar halogeni, fosfor, sulf. Alte elemente sunt incluse foarte rar. Dar numărul de atomi dintr-o moleculă poate ajunge la milioane, iar greutatea moleculară poate fi foarte mare.
Structura compușilor organici. Deoarece compoziție - nemetale. => Legatura chimica: covalenta. Nepolar și polar. Ionic foarte rar. => Rețea cristalină cel mai adesea molecular.
Proprietăți fizice generale: punct de fierbere și de topire scăzut. Substanțele organice includ gaze, lichide și solide fuzibile. Adesea volatil și poate avea miros. De obicei incolor. Majoritatea substanțelor organice sunt insolubile în apă.
Proprietăți chimice generale:
1) atunci când sunt încălzite fără acces la aer, toate substanțele organice devin „carbonizate”, adică. în acest caz, se formează cărbune (mai precis, funingine) și alte substanțe anorganice. Legăturile covalente sunt rupte, mai întâi polare, apoi nepolare.
2) Când sunt încălzite în prezența oxigenului, toate substanțele organice sunt ușor oxidate, iar produsele finale de oxidare sunt dioxidul de carbon și apa.
Caracteristicile cursului reacțiilor organice. Reacțiile organice implică molecule; în timpul reacției, unele legături covalente trebuie rupte, iar altele trebuie formate. Prin urmare, reacțiile chimice care implică compuși organici se desfășoară de obicei foarte lent; necesită utilizarea de temperatură, presiune și catalizatori ridicate. Reacțiile anorganice implică de obicei ioni; reacțiile decurg foarte repede, uneori instantaneu, la temperatură normală. Reacțiile organice duc rareori la randamente mari (de obicei mai puțin de 50%). Ele sunt adesea reversibile; în plus, pot apărea nu una, ci mai multe reacții, concurând între ele, ceea ce înseamnă că produsele de reacție vor fi un amestec de diferiți compuși. Prin urmare, forma de înregistrare a reacțiilor organice este, de asemenea, oarecum diferită. Acestea. nu folosesc ecuatii chimice, ci scheme de reactii chimice in care nu exista coeficienti, dar conditiile de reactie sunt indicate in detaliu. De asemenea, este obișnuit să scrieți numele organizației sub ecuație. substanțe și tip de reacție.
Dar, în general, substanțele și reacțiile organice se supun legilor generale ale chimiei, iar substanțele organice se transformă în anorganice sau se pot forma din cele anorganice. Ceea ce subliniază încă o dată unitatea lumii din jurul nostru.
Principiile de bază ale teoriei structurii chimice, expuse de tânărul A.M. Butlerov la congresul internațional al oamenilor de știință naturală din 1861.
1). Atomii din molecule sunt legați între ei într-o anumită ordine, în conformitate cu valența lor. Secvența combinației de atomi se numește structură chimică .
Valența este capacitatea atomilor de a forma un anumit număr de legături (covalente). Valența depinde de numărul de electroni nepereche din atomul unui element, deoarece legăturile covalente se formează prin împărțirea perechilor de electroni atunci când electronii sunt perechi. Carbonul din toate substanțele organice este tetravalent. Hidrogen - 1, oxigen - P, azot - Ш, sulf - P, clor - 1.
Metode de reprezentare a moleculelor organice.
O formulă moleculară este o reprezentare convențională a compoziției unei substanțe. H2C03 - acid carbonic, C12H22O11 - zaharoză. Astfel de formule sunt convenabile pentru calcule. Dar ele nu oferă informații despre structura și proprietățile substanței. Prin urmare, chiar și formulele moleculare din organice sunt scrise într-un mod special: CH 3 OH. Dar mult mai des folosesc formule structurale. Formula structurală reflectă ordinea în care atomii sunt conectați într-o moleculă (adică structura chimică).Și la baza oricărei molecule organice se află Scheletul de carbon este un lanț de atomi de carbon interconectați prin legături covalente.
Formule electronice ale moleculelor - legăturile dintre atomi sunt prezentate în perechi de electroni.
Formula structurală completă arată toate conexiunile cu liniuțe. O legătură chimică formată dintr-o pereche de electroni se numește legătură simplă și este reprezentată de o singură linie în formula structurală. O legătură dublă (=) este formată din două perechi de electroni. Triplul (≡) este format din trei perechi de electroni. Și numărul total al acestor legături trebuie să corespundă cu valența elementului.
 Într-o formulă structurală condensată, liniuțele legăturilor simple sunt omise, iar atomii asociați cu unul sau altul atom de carbon sunt scrieți imediat după acesta (uneori între paranteze).
Într-o formulă structurală condensată, liniuțele legăturilor simple sunt omise, iar atomii asociați cu unul sau altul atom de carbon sunt scrieți imediat după acesta (uneori între paranteze).
Formulele scheletice sunt și mai prescurtate. Dar sunt folosite mai rar. De exemplu:

Formulele structurale reflectă doar ordinea unirii atomilor. Dar moleculele de compuși organici au rareori o structură plată. Imaginea tridimensională a unei molecule este importantă pentru înțelegerea multor reacții chimice. Imaginea unei molecule este descrisă folosind concepte precum lungimea legăturii și unghiul de legătură. În plus, este posibilă rotația liberă în jurul legăturilor simple. Modelele moleculare oferă o reprezentare vizuală.
Figura prezintă modele de molecule a patru substanțe chimice. Câte elemente chimice formează aceste substanțe? Notați simbolurile acestor elemente.prima este o moleculă de apă, a doua este o moleculă de dioxid de carbon, a treia este o moleculă de metan, a patra este o moleculă de dioxid de sulf.
Bună ziua, vă rog să mă ajutați să rezolv testul 2 la chimieclasa a 8-a
pe tema „Substanţe simple. Cantitate de substanță."
Opțiunea 1.
A1. Semnul elementului care formează o substanță simplă – un nemetal:
1) Na 2) C 3) K 4) Al
A2. Substanță simplă – metal:
1) oxigen 2) cupru 3) fosfor 4) sulf
A3. Starea fizică a substanței simple mercur la normal
conditii:
1) solid 2) lichid 3) gazos
A4. Legătura chimică este covalentă nepolară
în substanță:
1) fier de călcat 2) clor 3) apă 4) cupru
A5. Modificarea alotropică a oxigenului:
1) grafit 2) fosfor alb 3) ozon 4) cărbune
A6. Notația 3O2 înseamnă:
1) 2 molecule de oxigen
2) 3 molecule de oxigen
3) 5 atomi de oxigen
4) 6 atomi de oxigen
A7. Masa a 3 moli de hidrogen sulfurat H2S este egală cu:
1) 33 2) 34 3) 99 4) 102
A8. Volumul ocupat de 2 moli dintr-o substanță gazoasă cu
formula SO2 (n.s):
1)22,4 l. 2) 33,6 l. 3) 44,8 l. 4) 67,2 l.
A9. Un grup de substanțe cu o legătură chimică de tip ionic:
1) CI2, H2, O2 2) KCI, NaBr, CaI2
3) H2O, CO2, NaCI 4) K2O, MgO, Nal
A10. Volumul molar este. . .
1) volumul oricărui gaz la nr. 2) volum de 2 g de orice gaz la zero
3) volum de 1 mol de orice gaz la nr.4) volum de 12 * 1023 molecule la nr.
A11. 3 molecule de clor:
1)3Cl2 2)3Cl 3)Cl2 4)6Cl
Î1. Identificați o substanță tare, moale, care lasă urme pe hârtie, are un luciu metalic ușor și este conducătoare de electricitate:
1) diamant 2) cărbune 3) grafit 4) fosfor alb
LA 2. Numărul de molecule în 2 mmol de apă este:
1) 12*1023. 2) 12*1020. 3) 18*1020 4) 12*1018
LA 3. Substanțe dispuse în ordine crescătoare a nemetalicelor
proprietati:
1) K, Na, Rb, Li 2) Li, Na K, Rb 3) Rb, K, Na, Li 4) Na, Rb, K, Li
C1. Calculați volumul de 140 kg. azot N2 la nr.
A.Na B.C C.K D.Al
2) Substanță simplă - metal:
A. oxigen B. Cupru C. Fosfor D. Sulf
3) Starea fizică a substanței simple mercur în condiții normale:
A. Solid B. Lichid C. Gazos
4) Legătura chimică este covalentă nepolară într-o substanță:
A. Fier B. Lichid C. Gazos
5) Modificarea alotropică a oxigenului:
A. Grafit B. Ozon
B. Fosfor alb D. Diamant
6) Un atom al unui element care formează o substanță simplă - metal, corespunde unei diagrame electronice:
A. +18))) B. +3)) C. +6)) D. +15)))
288 21 24 285
7) Intrarea ZO2 înseamnă:
A. 2 molecule de oxigen
B. 3 molecule de oxigen
B. 5 atomi de oxigen
D. 3 atomi de oxigen
8) Masa a 3 moli de hidrogen sulfurat H2S este egală cu: (cu soluție)
A. 33 g. B. 34 g. C. 99 g. D. 102 g.
9) Volumul ocupat de 2 moli dintr-o substanță gazoasă cu formula SO2 (n.s.): (cu soluție)
A. 22,4 l. B. 33,6 l. H. 44,8 l. G. 67,2 l.
10) cantitatea de dioxid de carbon CO2, care conține 36*10(23) molecule, este egală cu: (cu soluție)
11) Potrivire:
Tip de legătură chimică:
1. Ionic B. Covalent polar C. Metalic
Formula chimică a substanței:
A.CI2 B.K C.NaCI D.Fe D.NH3
12) Calculați volumul de oxigen O2 cu masa de 160 g (nr.) (cu soluție)
13) Completați definiția: „Alotropia este un fenomen...”
14) Selectați proprietățile care caracterizează grafitul.
A. Solid
B. Moale, lasă urme pe hârtie.
B. Incolor, transparent.
D. Are un luciu metalic usor
D. Conductiv electric.
electroni de nivelul 3?
1) Mg și Al 2) O și S 3) N și S 4) B și Al
2. Un atom al unui element care formează o substanță simplă – un nemetal – îi corespunde
circuit electronic?
1) +11)2)8)1 2) +8)2)6 3) +12)2)8)2 4) +4)2)2
3. Azotul prezintă cel mai înalt grad de oxidare atunci când este combinat cu formula:
1) NO2 2)NO 3)NH3 4)N2O5
4. Ce substanță are o legătură covalentă nepolară?
1) O2 2) H2O 3) CaCl2 4) Ba
5. Formula electronică 1s2 2s2 2p1 corespunde atomului:
1) beriliu 2) siliciu 3) carbon 4) bor
6. Cu o creștere a sarcinii nucleelor atomilor din seria F -Cl - Br -I, nemetalice
proprietăți?
1) intensifică 2) slăbește 3) nu se schimbă 4) schimbă periodic
7. indicați formula unui compus cu o legătură chimică polară covalentă:
1) H2 2) NH3 3) Ca3N2 4) C
8. Gradul de oxidare a fosforului în compușii P2O5, PH3, respectiv Ca3P2
egal?
1) +3, -3, +5 2) -3, +3, +5 3) +5, +5, -3 4) +5, -3, -3
9. Sunt adevărate următoarele afirmații?
A. În perioada, proprietățile metalice ale atomilor elementelor cu ordine crescătoare
cifrele sunt din ce în ce mai puternice.
B. În perioada, proprietățile metalice ale atomilor elementelor cu ordine crescătoare
cifrele slăbesc.
1) doar A este adevărat 2) ambele judecăți sunt adevărate 3) doar B este adevărat 4) ambele judecăți nu sunt
sunt adevărate
10. Un element chimic în atomul căruia electronii sunt distribuiți între straturi după cum urmează:
2,8,8,2, în tabelul periodic există:
A) în perioada a 4-a, grupa a 2-a, subgrupa secundară
B) în perioada a 4-a, grupa a 2-a a subgrupului principal
B) în perioada a 3-a, grupa a 5-a a subgrupului principal
D) în perioada a 3-a, grupa a 5-a, subgrupa secundară