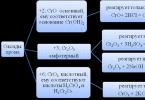
Неорганічна сполука гідроксиду заліза 3 має хімічну формулу Fe(OH)2. Воно належить до ряду амфотерних, в яких переважають властивості, характерні для основ. На вигляд ця речовина є кристалами білого кольору, які при тривалому перебуванні на відкритому повітрі поступово темніють. Є варіанти кристалів зеленого відтінку. У повсякденному житті речовина може спостерігати кожен у вигляді зеленого нальоту на металевих поверхнях, що свідчить про початок процесу іржавлення - гідроксид заліза 3 виступає як одна з проміжних стадій цього процесу.
У природі з'єднання знаходять у вигляді амакініту. Цей кристалічний мінерал, крім власне заліза, містить у собі ще домішки магнію і марганцю, всі ці речовини надають амакініт різні відтінки - від жовто-зеленого до блідо-зеленого, залежно від відсоткового вмісту того чи іншого елемента. Твердість мінералу становить 3,5-4 одиниці за шкалою Моосу, а густина дорівнює приблизно 3 г/см³.
До фізичних властивостей речовини слід також віднести вкрай слабку розчинність. У тому випадку, коли гідроксид заліза піддається нагріванню, він розкладається.
Ця речовина дуже активно і взаємодіє з багатьма іншими речовинами та сполуками. Так, наприклад, володіючи властивостями основи, воно вступає з різними кислотами. Зокрема, сірчана залоза 3 у ході реакції ведуть до одержання (III). Так як ця реакція може відбуватися шляхом звичайного прожарювання на відкритому повітрі, такий недорогий сульфату використовується як у лабораторних, так і в промислових умовах.
У результаті реакції з її результатом є утворення хлориду заліза (II).
В деяких випадках гідроксид заліза 3 може виявляти кислотні властивості. Так, наприклад, при взаємодії з сильно концентрованим (концентрація повинна бути не менше 50%) розчином натрію гідроксиду виходить тетрагидроксоферрат (II) натрію, що випадає у вигляді осаду. Правда, для перебігу такої реакції необхідно забезпечити досить складні умови: реакція має відбуватися в умовах кипіння розчину в азотному атмосферному середовищі.
Як мовилося раніше, при нагріванні речовина розкладається. Результатом цього розкладання виступає (II), а, крім того, у вигляді домішок виходять металеве залізо та його похідні: оксид діжелеза (III), хімічна формула якого Fe3O4.
Як зробити гідроксид заліза 3, одержання якого пов'язане з його здатністю вступати в реакції з кислотами? Перш ніж приступити до проведення досвіду, слід обов'язково нагадати про правила безпеки при проведенні таких досвідів. Ці правила застосовні всім випадків поводження з кислотно-лужними розчинами. Головне тут - забезпечити надійний захист та уникати попадання крапель розчинів на слизові оболонки та шкіру.
Отже, отримати гідроксид можна в ході проведення реакції, в якій взаємодіють хлорид заліза (III) і KOH калію гідроксид. Даний метод - найпоширеніший для утворення нерозчинних основ. При взаємодії цих речовин протікає нормальна реакція обміну, внаслідок якої виходить осад бурого кольору. Цей осад і є потрібна речовина.
Застосування гідроксиду заліза у промисловому виробництві досить широко. Найбільш поширеним є його використання як активна речовина в акумуляторах залізо-нікелевого типу. Крім того, з'єднання використовується в металургії для одержання різних металосплавів, а також у гальванічному виробництві, авомобілебудуванні.
З'єднання двовалентного заліза
I . Гідроксид заліза (II)
Утворюється при дії лужних розчинів на солі заліза (II) без доступу повітря:
FeCl 2 + 2 KOH = 2 KCl + F е(OH ) 2 ↓
Fe(OH) 2 - слабка основа, розчинна в сильних кислотах:
Fe(OH) 2 + H 2 SO 4 = FeSO 4 + 2H 2 O
Fe(OH) 2 + 2H + = Fe 2+ + 2H 2 O
Додатковий матеріал:
Fe(OH) 2 – виявляє і слабкі амфотерні властивості, що реагує з концентрованими лугами:
Fe( OH) 2 + 2 NaOH = Na 2 [ Fe( OH) 4]. утворюється сіль тетрагідроксоферрат ( II) натрію
При прожарюванні Fe(OH) 2 без доступу повітря утворюється оксид заліза (II) FeO -з'єднання чорного кольору:
Fe(OH) 2 tC → FeO + H 2 O
У присутності кисню повітря білий осад Fe(OH) 2 , окислюючись, буріє – утворюючи гідроксид заліза (III) Fe(OH) 3:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 ↓
Додатковий матеріал:
З'єднання заліза (II) мають відновлювальні властивості, вони легко перетворюються на сполуки заліза (III) під дією окислювачів:
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 = 5Fe 2 (SO 4) 3 + K 2 SO 4 + 2MnSO 4 + 8H 2 O
6FeSO 4 + 2HNO 3 + 3H 2 SO 4 = 3Fe 2 (SO 4) 3 + 2NO + 4H 2 O
З'єднання заліза схильні до комплексоутворення:
FeCl 2 + 6NH 3 = Cl 2
Fe(CN) 2 + 4KCN = K 4 (жовта кров'яна сіль)
Якісна реакція на Fe 2+
При дії гексаціаноферату (III) калію K 3 (червоної кров'яної солі)на розчини солей двовалентного заліза утворюється синій осад (турнбулева синь):
3 Fe 2+ Cl 2 + 3 K 3 [ Fe 3+ ( CN) 6 ] → 6 KCl + 3 KFe 2+ [ Fe 3+ ( CN) 6 ]↓
(Турнбулева синь - гексаціаноферрат ( III ) заліза ( II )-калію)
Турнбульова синь дуже схожа за властивостями на берлінську блакитність і теж служила барвником. Названа на ім'я одного із засновників шотландської фірми з виробництва барвників «Артур та Турнбуль».
З'єднання тривалентного заліза
I . Оксид заліза (III)
Утворюється при спалюванні сульфідів заліза, наприклад, при випаленні піриту:
4 FeS 2 + 11 O 2 t ˚ C → 2 Fe 2 O 3 + 8 SO 2
або при прожарюванні солей заліза:
2FeSO 4 tC → Fe 2 O 3 + SO 2 + SO 3
Fe 2 O 3 - оксид до різно-коричневого кольору, що незначною мірою виявляє амфотерні властивості
Fe 2 O 3 + 6HCl t˚C → 2FeCl 3 + 3H 2 O
Fe 2 O 3 + 6H + t˚C → 2Fe 3+ + 3H 2 O
Fe 2 O 3 + 2 NaOH + 3 H 2 O t ˚ C → 2 Na [ Fe (OH ) 4 ],утворюється сіль - тетрагідроксоферрат ( III) натрію
Fe 2 O 3 + 2OH - + 3H 2 O t˚C → 2 -
При сплавленні з основними оксидами або карбонатами лужних металів утворюються ферити:
Fe 2 O 3 + Na 2 O t˚C → 2NaFeO 2
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
ІІ. Гідроксид заліза ( III )
Утворюється при дії розчинів лугів на солі тривалентного заліза: випадає у вигляді червоно-бурого осаду
Fe(NO 3) 3 + 3KOH = Fe(OH) 3 ↓ + 3KNO 3
Fe 3+ + 3OH - = Fe(OH) 3 ↓
Додатково:
Fe(OH) 3 – слабша основа, ніж гідроксид заліза (II).
Це тим, що з Fe 2+ менше заряд іона і більше його радіус, ніж в Fe 3+ , тому, Fe 2+ слабше утримує гідроксид-іони, тобто. Fe(OH) 2 легше дисоціює.
У зв'язку з цим солі заліза (II) незначно гідролізуються, а солі заліза (III) - дуже сильно.
Гідролізом пояснюється і колір розчинів солей Fe(III): незважаючи на те, що іон Fe 3+ майже безбарвний, розчини, що містять його, пофарбовані в жовто-бурий колір, що пояснюється присутністю гідроксоїонів заліза або молекул Fe(OH) 3 , які утворюються завдяки гідролізу :
Fe 3+ + H 2 O ↔ 2+ + H +
2+ + H 2 O ↔ + + H +
+ + H 2 O ↔ Fe(OH) 3 + H +
При нагріванні забарвлення темніє, а при додаванні кислот стає світлішим внаслідок придушення гідролізу.
Fe(OH) 3 має слабо виражену амфотерність: він розчиняється в розведених кислотах і в концентрованих розчинах лугів:
Fe(OH) 3 + 3HCl = FeCl 3 + 3H 2 O
Fe(OH) 3 + 3H + = Fe 3+ + 3H 2 O
Fe(OH) 3 + NaOH = Na
Fe(OH) 3 + OH - = -
Додатковий матеріал:
З'єднання заліза (III) - слабкі окислювачі, що реагують із сильними відновниками:
2Fe +3 Cl 3 + H 2 S -2 = S 0 ↓ + 2Fe +2 Cl 2 + 2HCl
FeCl 3 + KI = I 2 ↓ + FeCl 2 + KCl
Якісні реакції на Fe 3+
Досвід
1) При дії гексаціаноферату (II) калію K 4 (жовтої кров'яної солі)на розчини солей тривалентного заліза утворюється синій осад (берлінська блакить):
4 Fe 3+ Cl 3 + 4 K 4 [ Fe 2+ ( CN) 6 ] → 12 KCl + 4 KFe 3+ [ Fe 2+ ( CN) 6 ]↓
(берлінська блакить - гексаціаноферрат ( II ) заліза ( III )-калію)
Берлінська блакить була отримана випадково на початку 18 століття в Берліні фарбуючих справ майстром Дісбахом. Дисбах купив у торговця незвичайний поташ (карбонат калію): розчин цього поташу при додаванні солей заліза виходив синім. Під час перевірки поташу виявилося, що він був прожарений з бичачою кров'ю. Фарба виявилася придатною для тканин: яскравою, стійкою та недорогою. Незабаром став відомий і рецепт отримання фарби: поташ сплавляли з висушеною кров'ю тварин і залізною тирсою. Вилуговуванням такого сплаву отримували жовту кров'яну сіль. Зараз берлінську блакит використовують для отримання друкарської фарби та підфарбовування полімерів.
Встановлено, що берлінська блакит і турнбулева синь – одне й те саме речовина, оскільки комплекси, що утворюються у реакціях перебувають у рівновазі:
KFe III[ Fe II( CN) 6 ] ↔ KFe II[ Fe III( CN) 6 ]
2) При додаванні до розчину, що містить іони Fe 3+ роданистого калію або амонію з'являється інтенсивне криваво-червоне забарвлення розчинуроданіду заліза(III):
2FeCl 3 + 6KCNS = 6KCl + Fe III[ Fe III( CNS) 6 ]
(При взаємодії з роданідами іонів Fe 2+ розчин залишається практично безбарвним).
Тренажери
Тренажер №1 - Розпізнавання з'єднань, що містять іон Fe (2+)
Тренажер №2 - Розпізнавання з'єднань, що містять іон Fe (3+)
Завдання для закріплення
№1.
Здійсніть перетворення:
FeCl 2 -> Fe(OH) 2 -> FeO -> FeSO 4
Fe -> Fe(NO 3) 3 -> Fe(OH) 3 -> Fe 2 O 3 -> NaFeO 2
№2. Складіть рівняння реакцій, за допомогою яких можна отримати:
а) солі заліза (II) та солі заліза (III);
б) гідроксид заліза (II) та гідроксид заліза (III);
в) оксиди заліза.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Оксид заліза (III) Fe2O3 - порошок бурого кольору, що не розчиняється у воді.
Оксид заліза (III) одержують розкладанням гідроксиду заліза (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Оксид заліза (III) виявляє амфотерні властивості:
Взаємодіє з кислотами та твердими лугами NaOH та KOH, а також з карбонатами натрію та калію при високій температурі:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH - = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Ферріт натрію
Гідроксид заліза (III) одержують із солей заліза (III) при взаємодії їх із лугами:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl,
Гідроксид заліза (III) є слабшою основою, ніж Fe(OH)2, і виявляє амфотерні властивості (З переважанням основних). При взаємодії з розведеними кислотами Fe(OH)3 легко утворює відповідні солі:
Fe(OH)3 + 3HCl = FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Реакції з концентрованими розчинами лугів протікають лише при тривалому нагріванні.
Fe(ОН)3 + КОН = К
З'єднання зі ступенем окиснення заліза +3 виявляють окисні властивості , оскільки під дією відновників Fe+3 перетворюється на Fe+2: Fe+3 + 1e = Fe+2.
Так, наприклад, хлорид заліза (III) окислює йодид калію до вільного йоду:
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I20
Хром.
Хром знаходиться у побічній підгрупі VI групи Періодичної системи. Будова електронної оболонки хрому: Cr 3d54s1. Ступені окиснення від +1 до +6, але найбільш стійкі +2, +3, +6.
Масова частка хрому у земній корі становить 0,02%. Найважливішими мінералами, що входять до складу хромових руд, є хроміт, або хромистий залізняк, та його різновиди, в яких залізо частково замінено на магній, а хром - на алюміній.
Хром - сріблясто-сірий метал. Чистий хром досить пластичний, а технічний найтвердіший з усіх металів.
Хром хімічно малоактивний . У звичайних умовах він реагує лише з фтором (з неметалів), утворюючи суміш фторидів. При високих температурах (вище 600°C) взаємодіє з киснем, галогенами, азотом, кремнієм, бором, сіркою, фосфором:
4Cr + 3O2 = 2Cr2O3
2Cr + 3Cl2 = 2CrCl3
2Cr + N2 = 2CrN
2Cr + 3S = Cr2S3
В азотній та концентрованій сірчаній кислотах він пасивує, покриваючись захисною оксидною плівкою. У хлороводневій та розведеній сірчаній кислотах розчиняється, при цьому, якщо кислота повністю звільнена від розчиненого кисню, виходять солі хрому(II), а якщо реакція протікає на повітрі - солі хрому (III): Cr + 2HCl = CrCl2 + H2 ; 2 Cr + 6 HCl + O 2 = 2 CrCl 3 + 2 H 2 O + H 2

МАРГАНЕЦЬ
 Mn, хімічний елемент із атомним номером 25, атомна маса 54,9. Хімічний символ елемент Mn
вимовляється так само, як і назва самого елемента. Природний марганець складається лише з нукліду 55Mn. Конфігурація двох зовнішніх електронних шарів атома марганцю 3S2P6D54S2. У періодичній системі марганець входить у групу VIIВ, і розташовується у 4-му періоді. Утворює сполуки в ступенях окиснення від +2 до +7, найбільш стійкі ступеня окиснення +2 і +7. У марганцю, як і в багатьох інших перехідних металів, відомі також сполуки, що містять атоми марганцю ступенем окислення 0.
Mn, хімічний елемент із атомним номером 25, атомна маса 54,9. Хімічний символ елемент Mn
вимовляється так само, як і назва самого елемента. Природний марганець складається лише з нукліду 55Mn. Конфігурація двох зовнішніх електронних шарів атома марганцю 3S2P6D54S2. У періодичній системі марганець входить у групу VIIВ, і розташовується у 4-му періоді. Утворює сполуки в ступенях окиснення від +2 до +7, найбільш стійкі ступеня окиснення +2 і +7. У марганцю, як і в багатьох інших перехідних металів, відомі також сполуки, що містять атоми марганцю ступенем окислення 0.
Марганець у компактному вигляді – твердий сріблясто-білий, тендітний метал.
Хімічні властивості
Марганець – активний метал.
1. Взаємодія з неметалами
При взаємодії металевого марганцю з різними неметалами утворюються сполуки марганцю (II):
Мn + С2 = МnСl2 (хлорид марганцю (II));
Mn + S = МnS (cул'фід марганцю (II));
3Мn + 2 Р = Мn3Р2 (фосфід марганцю (II));
3Mn + N2 = Мn3N2 (нітрид марганцю (II));
2Mn + N2 = Мn2Si (силіцид марганцю (II)).
2. Взаємодія з водою
При кімнатній температурі дуже повільно взаємодіє з водою при нагріванні з помірною швидкістю:
Mn + 2H2O = MnO2 + 2H2
3. Взаємодія з кислотами
В електрохімічному ряду напруг металів марганець знаходиться до водню , він витісняє водень з розчинів кислот, що не окислюють, при цьому утворюються солі марганцю (II):
Mn + 2HCl = MnCl2 + H2;
Mn + H2SO4 = MnSO4 + H2;
з розведеною азотною кислотою утворює нітрат марганцю (II) та оксид азоту (II):
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
Концентрована азотна та сірчана кислоти пасивують марганець. Марганець розчиняється в них лише при нагріванні, утворюються солі марганцю (II) та продукти відновлення кислоти:
Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O;
Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O
4. Відновлення металів із оксидів
Марганець - активний метал, здатний витісняти метали з їх оксидів:
5Mn+Nb2O5=5MnO+2Nb.
Якщо до перманганату калію KMnO4 додати концентровану сірчану кислоту, то утворюється кислотний оксид Mn2O7, що володіє сильними окисними властивостями:
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Марганцю відповідає кілька кислот, з яких найбільш важливими є сильні нестійкі марганцева кислота H2MnO4 і марганцева кислота HMnO4, солі яких - відповідно, манганати (наприклад, манганат натрію Na2MnO4) та перманганати (наприклад, перманганат калію KMnO4).
Манганати (відомі манганати тільки лужних металів і барію) можуть проявляти властивості як окислювачів (частіше). NaI + Na 2 MnO 4 + 2 H 2 O = MnO 2 + I 2 + 4 NaOH , і відновників 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
Перманганати – сильні окислювачі. Наприклад, перманганат калію KMnO4 у кислому середовищі окислює сірчистий газ SO2 до сульфату:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4.
Застосування:більше 90% марганцю, що виробляється, йде в чорну металургію. Марганець використовують як добавку до сталей для їх розкислення, десульфурації (при цьому відбувається видалення зі сталі небажаних домішок - кисню, сірки та інших), а також для легування сталей, тобто поліпшення їх механічних та корозійних властивостей. Марганець застосовується також у мідних, алюмінієвих та магнієвих сплавах. Покриття з марганцю на металевих поверхнях забезпечують їхній антикорозійний захист. Для нанесення тонких покриттів з марганцю використовують легко леткий та термічно нестабільний біядерний декакарбоніл Mn2(CO)10.
Поняття про метали.
Характерною особливістю металів є їхня здатність утворювати один з одним або з неметалами сплави. Щоб отримати сплав, суміш металів зазвичай піддають плавленню, а потім охолоджують з різною швидкістю, яка визначається природою компонентів та зміною характеру їхньої взаємодії в залежності від температури. Іноді сплави одержують спіканням тонких порошків металів, не вдаючись до плавлення (порошкова металургія). Отже сплави – це продукти хімічної взаємодії металів.
Кристалічна структура сплавів багато в чому подібна до чистих металів, які, взаємодіючи один з одним при плавленні та подальшій кристалізації, утворюють: а) хімічні сполуки, які називаються інтерметалідами; б) тверді розчини; в) механічну суміш кристалів компонентів.
Сучасна техніка використовує величезну кількість сплавів, причому в переважній більшості випадків вони складаються не з двох, а з трьох, чотирьох та більшої кількості металів. Цікаво, що властивості сплавів часто різко відрізняються від властивостей індивідуальних металів, якими вони утворені. Так, сплав, що містить 50% вісмуту, 25% свинцю, 12,5% олова і 12,5% кадмію, плавиться всього при 60,5 градусах Цельсія, в той час як компоненти сплаву мають відповідно температури плавлення 271, 327, 232 321 градус Цельсія. Твердість олов'яної бронзи (90% міді та 10% олова) втричі більша, ніж у чистої міді, а коефіцієнт лінійного розширення сплавів заліза та нікелю в 10 разів менше, ніж у чистих компонентів.
Однак деякі домішки погіршують якість металів та сплавів. Відомо, наприклад, що чавун (сплав заліза та вуглецю) не має тієї міцності та твердості, які характерні для сталі. Крім вуглецю, на властивості сталі впливають добавки сірки та фосфору, що збільшують її крихкість.
Серед властивостей сплавів найбільш важливими для практичного застосування є жароміцність, корозійна стійкість, механічна міцність та ін. Для авіації велике значення мають легкі сплави на основі магнію, титану або алюмінію, для металообробної промисловості – спеціальні сплави, що містять вольфрам, кобальт, нікель. В електронній техніці використовують сплави, основним компонентом яких є мідь. Надпотужні магніти вдалося отримати, використовуючи продукти взаємодії кобальту, самарію та інших рідкісноземельних елементів, а надпровідні при низьких температурах сплави - на основі інтерметалідів, що утворюються ніобієм з оловом та ін.
Завдання для закріплення та перевірки знань
Контрольні питання:
1. Як визначити ступеня окиснення металів побічних підгруп?
2. Які ступені окислення найбільш характерні для заліза?
3. Назвіть формули оксидів та відповідних їм гідроксидів заліза.
4. Охарактеризуйте кислотно-основні властивості гідроксидів заліза (II) та заліза
(III)?
5. Які ступені окислення характерні для хрому? Які їх найбільш стійкі?
6. Назвіть формули оксидів та гідроксидів хрому та охарактеризуйте їх кислотно-основні властивості.
7. Як змінюються окислювально-відновні властивості сполук хрому з
Збільшенням ступеня його окиснення?
8. Напишіть формули хромової та дихромової кислот.
9. Які ступені окислення виявляє марганець у сполуках? Які їх найбільш стійкі?
10. Напишіть формули оксидів та гідроксидів хрому та охарактеризуйте їх кислотно-основні властивості та окисно-відновні властивості.
11. Як змінюються окислювально-відновні властивості сполук марганцю зі збільшенням ступеня його окиснення?
Оскільки Fe2+ легко окислюються до Fe+3:
Fe+2 – 1e = Fe+3
Так, свіжоотриманий зелений осад Fe(OH)2 повітря дуже швидко змінює забарвлення – буріє. Зміна забарвлення пояснюється окисленням Fe(OH)2 Fe(OH)3 киснем повітря:
4Fe+2(OH)2 + O2 + 2H2O = 4Fe+3(OH)3.
Відновлювальні властивості виявляють і солі двовалентного заліза, особливо при дії окислювачів у кислотному середовищі. Наприклад, сульфат заліза (II) відновлює перманганат калію в сірчанокислотному середовищі до сульфату марганцю (II):
10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe+32(SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O.
Якісна реакція на катіон заліза (ІІ).
Реактивом для визначення катіону заліза Fe2+ є гексаціано (III) феррат калію (червона кров'яна сіль).
3FeSO4 + 2K3 = Fe32 + 3K2SO4.
При взаємодії іонів 3 з катіонами заліза Fe2+ утворюється темно-синій осад – турнбулева синь:
3Fe2+ +23- = Fe32¯
З'єднання заліза (III)
Оксид заліза (III) Fe2O3– порошок бурого кольору, що не розчиняється у воді. Оксид заліза (III) одержують:
А) розкладанням гідроксиду заліза (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Б) окисленням піриту (FeS2):
4Fe+2S2-1 + 11O20 = 2Fe2+3O3 + 8S+4O2-2.
Fe+2 – 1e ® Fe+3
2S-1 – 10e ® 2S+4
O20 + 4e ® 2O-2 11e
Оксид заліза (III) виявляє амфотерні властивості:
А) взаємодіє з твердими лугами NaOH та KOH та з карбонатами натрію та калію при високій температурі:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH- = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Ферріт натрію
Гідроксид заліза (III)одержують із солей заліза (III) при взаємодії їх із лугами:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl,
Fe3+ + 3OH- = Fe(OH)3.
Гідроксид заліза (III) є слабшою основою, ніж Fe(OH)2, і виявляє амфотерні властивості (з переважанням основних). При взаємодії з розведеними кислотами Fe(OH)3 легко утворює відповідні солі:
Fe(OH)3 + 3HCl « FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 « Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3H+ « Fe3+ + 3H2O
Реакції з концентрованими розчинами лугів протікають лише за тривалого нагрівання. При цьому виходять стійкі гідрокомплекси з координаційним числом 4 або 6:
Fe(OH)3 + NaOH = Na,
Fe(OH)3 + OH- = -,
Fe(OH)3 + 3NaOH = Na3,
Fe(OH)3 + 3OH- = 3-.
З'єднання зі ступенем окислення заліза +3 виявляють окислювальні властивості, оскільки під дією відновників Fe+3 перетворюється на Fe+2:
Fe+3 + 1e = Fe+2.
Так, наприклад, хлорид заліза (III) окислює йодид калію до вільного йоду:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + 2KCl + I20
Якісні реакції на катіон заліза (III)
А) Реактивом для виявлення катіону Fe3+ є гексаціано (II) феррат калію (жовта кров'яна сіль) K2.
При взаємодії іонів 4 з іонами Fe3+ утворюється темно-синій осад – берлінська блакить:
4FeCl3 + 3K4 «Fe43¯ +12KCl,
4Fe3+ + 34- = Fe43¯.
Б) Катіони Fe3+ легко виявляються за допомогою роданіду амонію (NH4CNS). В результаті взаємодії іонів CNS-1 з катіонами заліза (III) Fe3+ утворюється роданід заліза (III), що малодисоціює, криваво-червоного кольору:
FeCl3 + 3NH4CNS « Fe(CNS)3 + 3NH4Cl,
Fe3+ + 3CNS1- «Fe(CNS)3.
Застосування та біологічна роль заліза та його сполук.
Найважливіші сплави заліза – чавуни та сталі – є основними конструкційними матеріалами практично у всіх галузях сучасного виробництва.
Хлорид заліза (III) FeCl3 застосовується для очищення води. В органічному синтезі FeCl3 застосовується як каталізатор. Нітрат заліза Fe(NO3)3 · 9H2O використовують при фарбуванні тканин.
Залізо є одним із найважливіших мікроелементів в організмі людини та тварин (в організмі дорослої людини міститься у вигляді сполук близько 4 г Fe). Воно входить до складу гемоглобіну, міоглобіну, різних ферментів та інших складних залізобілкових комплексів, що знаходяться в печінці та селезінці. Залізо стимулює функцію кровотворних органів.
Список використаної литературы:
1. «Хімія. Посібник репетитор». Ростов-на-Дону. "Фенікс". 1997 рік.
2. «Довідник для вступників до вузів». Москва. "Вища школа", 1995 рік.
3. Е.Т. Оганесян. «Керівництво з хімії вступників до вузів». Москва. 1994 рік.
В організмі людини міститься близько 5 г заліза, більшість його (70%) входить до складу гемоглобіну крові.
Фізичні властивості
У вільному стані залізо – сріблясто-білий метал із сіруватим відтінком. Чисте залізо пластично, має феромагнітні властивості. На практиці зазвичай використовуються сплави заліза – чавуни та сталі.
Fe - найголовніший і найпоширеніший елемент дев'яти d-металів побічної підгрупи VIII групи. Разом із кобальтом та нікелем утворює «родина заліза».
При утворенні з'єднань з іншими елементами частіше використовує 2 або 3 електрони (В = II, III).
Залізо, як і багато d-елементи VIII групи, не виявляє вищу валентність, рівну номеру групи. Його максимальна валентність досягає VI і виявляється вкрай рідко.
Найбільш характерними є сполуки, в яких атоми Fe знаходяться в ступенях окислення +2 і +3.
Способи отримання заліза
1. Технічне залізо (у сплаві з вуглецем та іншими домішками) отримують карботермічним відновленням його природних сполук за схемою:

Відновлення відбувається поступово, у 3 стадії:
1) 3Fe 2 O 3 + СО = 2Fe 3 O 4 + СО 2
2) Fe 3 O 4 + СО = 3FeO +С 2
3) FeO + СО = Fe + СО 2
Чавун, що утворюється в результаті цього процесу, містить більше 2% вуглецю. Надалі з чавуну одержують сталі - сплави заліза, що містять менше 1,5% вуглецю.
2. Дуже чисте залізо одержують одним із способів:
а) розкладання пентакарбонілу Fe
Fe(CO) 5 = Fe + 5СО
б) відновлення воднем чистого FeO
FeO + Н 2 = Fe + Н 2 O
в) електроліз водних розчинів солей Fe+2
FeC 2 O 4 = Fe + 2С 2
оксалат заліза (II)
Хімічні властивості
Fe – метал середньої активності, виявляє загальні властивості, характерні для металів.
Унікальною особливістю є здатність до «іржавіння» у вологому повітрі:
За відсутності вологи із сухим повітрям залізо починає помітно реагувати лише за Т > 150°С; при прожарюванні утворюється «залізна окалина» Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
У воді без кисню залізо не розчиняється. За дуже високої температури Fe реагує з водяною парою, витісняючи з молекул води водень:
3 Fe + 4Н2O(г) = 4H2
Процес іржавлення за своїм механізмом є електрохімічною корозією. Продукт іржавлення представлений у спрощеному вигляді. Насправді утворюється пухкий шар суміші оксидів та гідроксидів змінного складу. На відміну від плівки Аl 2 Про 3 цей шар не оберігає залізо від подальшого руйнування.
Види корозії

Захист заліза від корозії

1. Взаємодія з галогенами та сіркою за високої температури.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 = FeI 2
Утворюються сполуки, у яких переважає іонний тип зв'язку.
2. Взаємодія з фосфором, вуглецем, кремнієм (з N 2 і Н 2 залізо безпосередньо не з'єднується, але розчиняє їх).
Fe + Р = Fe x P y
Fe + C = Fe x C y
Fe + Si = Fe x Si y
Утворюються речовини змінного складу, тому що бертоліди (у сполуках переважає ковалентний характер зв'язку)
3. Взаємодія з «неокислюючими» кислотами (HCl, H 2 SO 4 розб.)
Fe 0 + 2Н + → Fe 2+ + Н 2
Оскільки Fe розташовується в ряду активності лівіше водню (Е° Fe/Fe 2+ = -0,44В), воно здатне витісняти Н 2 із звичайних кислот.
Fe + 2HCl = FeCl 2 + Н 2
Fe + H 2 SO 4 = FeSO 4 + Н 2
4. Взаємодія з «окисними» кислотами (HNO 3 , H 2 SO 4 конц.)
Fe 0 - 3e - → Fe 3+
Концентровані HNO 3 і H 2 SO 4 пасивують залізо, тому при звичайній температурі метал в них не розчиняється. При сильному нагріванні відбувається повільне розчинення (без виділення Н2).
У розб. HNO 3 залізо розчиняється, переходить у розчин у вигляді катіонів Fe 3+ а аніон кислоти відновлюється до NO*:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2Н 2 O
Дуже добре розчиняється в суміші НСl та HNO 3
5. Ставлення до луг
У водних розчинах лугів Fe не розчиняється. З розплавленими лугами реагує лише за дуже високих температур.
6. Взаємодія із солями менш активних металів
Fe + CuSO 4 = FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Взаємодія з газоподібним монооксидом вуглецю (t = 200°C, P)
Fe(порошок) + 5CO(г) = Fe 0(CO) 5 пентакарбоніл заліза
З'єднання Fe(III)
Fe 2 O 3 – оксид заліза (III).
Червоно-бурий порошок, н. нар. в Н 2 O. У природі – «червоний залізняк».
Способи отримання:
1) розкладання гідроксиду заліза (III)
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
2) випал піриту
4FeS 2 + 11O 2 = 8SO 2 + 2Fe 2 O 3
3) розкладання нітрату
Хімічні властивості
Fe 2 O 3 – основний оксид з ознаками амфотерності.
I. Основні властивості проявляються у здатності реагувати з кислотами:
Fe 2 Про 3 + 6Н + = 2Fe 3+ + ДТ 2 Про
Fe 2 Про 3 + 6HCI = 2FeCI 3 + 3H 2 O
Fe 2 Про 3 + 6HNO 3 = 2Fe(NO 3) 3 + 3H 2 O
ІІ. Слабокислотні властивості. У водних розчинах лугів Fe 2 O 3 не розчиняється, але при сплавленні з твердими оксидами, лугами та карбонатами відбувається утворення феритів:
Fe 2 Про 3 + СаО = Ca(FeО 2) 2
Fe 2 Про 3 + 2NaOH = 2NaFeО 2 + H 2 O
Fe 2 Про 3 + MgCO 3 = Mg(FeO 2) 2 + CO 2
ІІІ. Fe 2 Про 3 - вихідна сировина для отримання заліза в металургії:
Fe 2 Про 3 + ЗС = 2Fe + ЗСО або Fe 2 Про 3 + ЗСО = 2Fe + ЗСО 2
Fe(OH) 3 - гідроксид заліза (III)
Способи отримання:
Отримують при дії лугів на розчинні солі Fe3+:
FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl
У момент одержання Fe(OH) 3 - червоно-бурий слизово-аморфний осад.
Гідроксид Fe(III) утворюється також при окисленні на вологому повітрі Fe та Fe(OH) 2:
4Fe + 6Н 2 O + 3O 2 = 4Fe(OH) 3
4Fe(OH) 2 + 2Н 2 O + O 2 = 4Fe(OH) 3
Гідроксид Fe(III) є кінцевим продуктом гідролізу солей Fe3+.
Хімічні властивості
Fe(OH) 3 - дуже слабка основа (набагато слабша, ніж Fe(OH) 2). Виявляє помітні кислотні властивості. Таким чином, Fe(OH) 3 має амфотерний характер:
1) реакції з кислотами протікають легко:
2) свіжий осад Fe(OH) 3 розчиняється у гарячих конц. розчинах КОН або NaOH з утворенням гідроксокомплексів:
Fe(OH) 3 + 3КОН = K 3
У лужному розчині Fe(OH) 3 може бути окислений до ферратів (солей не виділеної у вільному стані залізної кислоти H 2 FeO 4):
2Fe(OH) 3 + 10КОН + 3Br 2 = 2K 2 FeO 4 + 6КВr + 8Н 2 O
Солі Fe 3+
Найбільш практично важливими є: Fe 2 (SO 4) 3 , FeCl 3 , Fe(NO 3) 3 , Fe(SCN) 3 , K 3 4- жовта кров'яна сіль = Fe 4 3 берлінська блакит (темно-синій осад)
б) Fe 3+ + 3SCN - = Fe(SCN) 3 роданід Fe(III) (р-р криваво-червоного кольору)