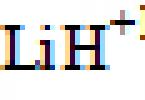Одним з основних понять у хімії, що широко використовується при складанні рівнянь окислювально-відновних реакцій, є ступінь окислення атомів.
У практичних цілях (при складанні рівнянь окислювально-відновних реакцій) заряди на атомах у молекулах з полярними зв'язками зручно представляти у вигляді цілих чисел, рівних таким зарядам, які виникли б на атомах, якби валентні електрони повністю переходили до більш негативних атомів, т.е. е. якби зв'язки були повністю іонними. Такі величини зарядів отримали назву ступенів окиснення. Ступінь окислення будь-якого елемента у простій речовині завжди дорівнює 0.
У молекулах складних речовин деякі елементи мають постійний ступінь окислення. Більшість елементів характерні змінні ступеня окислення, розрізняються як знаком, і величиною, залежно від складу молекули.
Часто ступінь окислення дорівнює валентності і відрізняється від неї лише знаком. Але зустрічаються сполуки, у яких ступінь окислення елемента не дорівнює його валентності. Як зазначалося, у простих речовинах ступінь окислення елемента завжди дорівнює нулю незалежно від його валентності. У таблиці зіставлені валентності та ступеня окислення деяких елементів у різних сполуках.
Ступінь окислення атома (елемента) у поєднанні – це умовний заряд, обчислений у припущенні, що з'єднання складається лише з іонів. При визначенні ступеня окислення умовно припускають, що валентні електрони в з'єднанні переходять до більш негативних атомів, а тому сполуки складаються з позитивно і негативно заряджених іонів. Насправді ж здебільшого відбувається повна віддача електронів, лише зміщення електронної пари від однієї атома до іншого. Тоді можна дати інше визначення: Ступінь окислення - це той електричний заряд, який виник би на атомі, якби електронні пари, якими він пов'язаний з іншими атомами в з'єднанні, перейшли до більш негативних атомів, а електронні пари, що зв'язують однакові атоми, були б між ними поділені.
При обчисленні ступенів окислення використовується низка простих правил:
1 . Ступінь окислення елементів у простих речовинах, як одноатомних, і молекулярних, дорівнює нулю (Fe 0 , O 2 0).
2 . Ступінь окислення елемента як одноатомного іона дорівнює заряду цього іона (Na +1 , Ca +2 , S –2).
3 . У з'єднаннях з ковалентним полярним зв'язком негативний заряд відноситься до більш електронегативного атома, а позитивний – до менш електронегативного атома, причому ступеня окислення елементів приймають наступні значення:
Ступінь окислення фтору в з'єднаннях завжди дорівнює -1;
Ступінь окиснення кисню в сполуках дорівнює -2(); за винятком пероксидів, де вона формально дорівнює -1(), фториду кисню, де вона дорівнює +2(), а також надпероксидів та озонідів, в яких ступінь окислення кисню дорівнює -1/2;
Ступінь окислення водню в сполуках дорівнює +1 (), за винятком гідридів металів, де вона дорівнює -1 ( ![]() );
);
Для лужних та лужноземельних елементів ступінь окислення дорівнює +1 та +2 відповідно.
Більшість елементів можуть виявляти змінний ступінь окиснення.
4 . Алгебраїчна сума ступенів окислення в нейтральній молекулі дорівнює нулю, в комплексному іоні – заряду іона.
Для елементів з непостійним ступенем окиснення її значення неважко обчислити, знаючи формулу сполуки та користуючись правилом №4. Наприклад, необхідно визначити ступінь окислення фосфору у фосфорній кислоті Н3РО4. Оскільки у кисню СО =–2, а у водню СО = +1, то для нульової суми у фосфору ступінь окислення має дорівнювати +5:
Наприклад, NH 4 Cl сума ступенів окислення всіх атомів водню дорівнює 4×(+1), а ступінь окислення хлору -1, отже, ступінь окислення азоту повинна дорівнювати-3. У сульфат-іоні SO 4 2– сума ступенів окислення чотирьох атомів кисню дорівнює -8, тому сірка повинна мати ступінь окислення +6, щоб повний заряд іона дорівнював -2.
Поняття ступеня окислення більшість сполук має умовний характер, т.к. не відбиває реальний ефективний заряд атома, проте це поняття дуже широко використовується у хімії.
Максимальна, а для неметалів та мінімальний ступінь окислення має періодичну залежність від порядкового номера у ПСХЕ Д.І. Менделєєва, що з електронним будовою атома.
| Елемент | Значення ступеня окиснення та приклади сполук |
| F | -1 (HF, KF) |
| O | -2 (H2O, CaO, CO2); -1 (H 2 O 2); +2 (OF 2) |
| N | -3 (NH 3); -2(N 2 H 4); -1 (NH 2 OH); +1 (N 2 O); +2 (NO); |
| +3 (N 2 O 3 HNO 2); +4 (NO 2); +5 (N 2 O 5 HNO 3) | Cl |
| -1 (HCl, NaCl); +1 (NaClO); +3 (NaClO 2); +5 (NaClO 3); +7 (Cl 2 O 7 , NaClO 4) | Br |
| -1 (KBr); +1 (BrF); +3 (BrF 3); +5 (KBrO 3) | I |
| -1 (HI); +1 (ICl); +3 (ICl 3); +5 (I 2 O 5); +7 (IO 3 F, K 5 IO 6) | -4 (CH 4); +2 (CO); +4 (CO 2 , CCl 4) |
| Si | -4 (Ca 2 Si); +2 (SiO); +4 (SiO 2 , H 2 SiO 3 , SiF 4) |
| H | -1 (LiH); +1 (H 2 O, HCl) |
| S | -2 (H 2 S, FeS); +2 (Na 2 S 2 O 3); +3 (Na 2 S 2 O 4); |
| +4 (SO 2 Na 2 SO 3 SF 4); +6 (SO 3 , H 2 SO 4 , SF 6) | Se, Te |
| -2 (H 2 Se, H 2 Te); +2 (SeCl 2 TeCl 2); +4 (SeO 2 TeO 2); +6 (H 2 SeO 4 , H 2 TeO 4) | P |
| -3 (PH 3); +1 (H 3 PO 2); +3 (H3PO3); +5 (P 2 O 5 , H 3 PO 4) | As, Sb |
| -3 (GaAs, Zn 3 Sb 2); +3 (AsCl 3 , Sb 2 O 3); +5 (H 3 AsO 4 , SbCl 5) | Li, Na, K |
| +1 (NaCl) | Be, Mg, Ca |
| +2 (MgO, CaCO 3) | Al |
| +3 (Al 2 O 3 AlCl 3) | Cr |
| +2 (CrCl 2); +3 (Cr 2 O 3 Cr 2 (SO 4) 3); +4 (CrO 2); +6 (K 2 CrO 4 , K 2 Cr 2 O 7) | Mn |
| +2 (MnSO 4); +3 (Mn 2 (SO 4) 3); +4 (MnO 2); +6 (K 2 MnO 4); +7 (KMnO 4) | Fe |
| +2 (FeO, FeSO 4); +3 (Fe 2 O 3 FeCl 3); +4 (Na 2 FeO 3) | Cu |
| +1 (Cu 2 O); +2 (CuO, CuSO 4 , Cu 2 (OH) 2 CO 3) | Ag |
| +1 (AgNO 3) | Au |
| +1 (AuCl); +3 (AuCl 3 , KAuCl 4) | Zn |
| +2 (ZnO, ZnSO 4) | Hg |
| +1 (Hg 2 Cl 2); +2 (HgO, HgCl 2) | Sn |
| +2 (SnO); +4 (SnO 2 , SnCl 4) | Pb |
+2 (PbO, PbSO 4); +4 (PbO 2)
У хімічних реакціях має виконуватися правило збереження алгебраїчної суми ступенів окиснення всіх атомів. У повному рівнянні хімічної реакції окислювальні і відновлювальні процеси повинні точно компенсувати один одного. для передбачення окисно-відновних властивостей елементів у поєднанні.
Для багатьох елементів характерно кілька значень ступенів окислення, і, обчисливши його ступінь окислення, можна передбачати окислювально-відновлювальні властивості: елемент у найбільшому негативному ступені окислення може тільки віддавати електрони (окислятися) і бути відновником, у найбільшому позитивному ступені окислення – тільки приймати електрони. ) і бути окислювачем, у проміжних ступенях окислення – і окислюватись, і відновлюватись. Окислення-відновлення – це єдиний, взаємопов'язаний процес. Окислення відповідає збільшенню ступеня окиснення елемента, а відновлення
- її зменшення.
Однак, пояснення зміни ступенів окислення як процесів відриву та приєднання електронів у загальному випадку неправильне. Воно може бути застосоване до деяких простих іонів типу
Cl - - Cl 0 .
Для зміни ступеня окислення атомів у складних іонах типу
CrO 4 2 - ®Cr +3
зменшенню позитивного ступеня окислення хрому з +6 до +3 відповідає менше реальне збільшення позитивного заряду (на Cr в CrO 4 2 - реальний заряд » +0,2 заряду електрона, а на Cr +3 - від +2 до +1,5 в різних з'єднаннях).
Перенесення заряду від відновника до окислювача, що дорівнює зміні ступеня окислення, відбувається при цьому за участю інших частинок, наприклад, іонів Н + :
CrO 4 2 - + 8Н + + 3 ®Cr +3 + 4Н 2 О.
Поданий запис має назву напівреакції .
Подібна інформація.
М.А.АХМЕТОВ
Конспект лекцій
із загальної хімії
Продовження. Початок див.№ 8, 12, 13, 20, 23, 25-26, 40/2004
Розділ 5.
Окисно-відновні
реакції
5.1. Визначення ступеня окиснення
Окисно-відновними називають реакції, що супроводжуються переходом електронів від одних атомів до інших. Про перехід електронів судять щодо змін ступенів окиснення атомів. Якщо ступінь окислення атома змінилася, то змінилося та його електронне оточення.– Існують два способи визначення ступенів окиснення атомів:
, перший– за брутто-формулою
.
другий за структурною формулою
При визначенні ступенів окиснення атомів першим способом використовують правило:
сума ступенів окислення всіх атомів, що утворюють частинку, дорівнює заряду частки
2 (+1) + 2. Для молекули така сума дорівнює нулю, а іона – його заряду. + 3 (–2) = 0,
Як ілюстрацію визначимо першим способом ступеня окислення атомів в тіосульфаті натрію Na 2 S 2 Про 3 . Серед елементів, що утворюють частинку, найбільш електронегативним є кисень – він і прийматиме електрони. Оскільки кисень перебуває у головній підгрупі VI групи, то завершення електронного шару йому бракує двох електронів. Отже, атом кисню прийме два електрони і набуде ступеня окислення -2.
Можна визначити ступеня окиснення атомів у складних іонах. Як приклад розглянемо аніон. У ньому найбільш електронегативний атом кисню приймає два електрони і має ступінь окислення -2. Ступінь окислення атома хрому визначається з рівняння:
2. Для молекули така сума дорівнює нулю, а іона – його заряду. + 7 (–2) = –2
і дорівнює +6.
Другий спосіб знаходження ступенів окислення атомів – за структурною формулою – ґрунтується на визначенні: ступінь окислення
– це умовний цілий заряд, який був би на атомі, якби всі його полярні ковалентні зв'язки стали іонними.Зобразивши структурну формулу тіосульфату натрію

визначимо ступеня окиснення його атомів.
Атоми натрію, з'єднані одинарними зв'язками з електронегативними атомами кисню, природно, віддадуть їм свої зовнішні електрони, знайшовши кожен ступінь окислення +1. Атоми кисню, що мають по два зв'язки з більш електропозитивними атомами, умовно приймуть по два електрони і будуть володіти ступенем окислення -2. Зі структурної формули видно, що в поєднанні знаходяться два атоми сірки в різному оточенні. Один з атомів S з'єднаний тільки подвійним зв'язком з іншим атомом S, та його ступінь окислення дорівнює нулю. Другий атом сірки має чотири зв'язки з трьома більш негативними атомами кисню і, отже, має ступінь окислення +4.
Середній ступінь окислення атомів сірки, як і щодо її першим способом, дорівнює +2 ((+4+0)/2).
Атом кисню який завжди має ступінь окислення –2. Наприклад, у його поєднанні з атомами фтору він має позитивний ступінь окислення . У пероксидах ступінь окислення кожного атома кисню дорівнює , надпероксидах – лише , а озонидах – навіть .
Також у атома сірки ступінь окислення може дорівнювати –1, наприклад у дисульфідах . У деяких оксидах, наприклад Fe 3 Про 4 і Pb 3 O 4 , ступені окислення атомів визначають, виходячи з того, що ці оксиди змішані: Fe 2 O 3 FeO і PbO 2 2PbO відповідно.
5.2. Складання рівнянь
окисно-відновних реакцій
4(З 2 Н 5)3N + 36НNО 3 = 24СО 2 + 48Н 2 О + 6NO 2 + 17N 2 ,
2(З 2 Н 5)3N + 78НNО 3 = 12СО 2 + 54Н 2 О + 78NO 2 + N 2 ,
(З 2 Н 5) 3 N + 11НNО 3 = 6СО 2 + 13Н 2 О + 4NO 2 + 4N 2 .
Теорія окислювально-відновного процесу передбачає передачу електронів від атомів відновника атомів окислювача.
Відповідно до закону збереження матерії сумарна кількість електронів, відданих відновником, дорівнює сумарній кількості електронів, прийнятих окислювачем. Цією простою ідеєю керуються при складанні рівнянь окисно-відновних реакцій. Завдання полягає у підборі коефіцієнтів пропорційності, у яких досягається електронний баланс.

Розберемо приклад окислення молекули етилбензолу перманганатом калію в кислому середовищі під час нагрівання. Запишемо рівняння реакції та вкажемо ступеня окиснення тих атомів, які змінили її, причому їх ступеня окиснення в молекулах етилбензолу та бензойної кислоти визначимо, користуючись відповідними структурними формулами:
12. Для молекули така сума дорівнює нулю, а іона – його заряду. = 5Атом вуглецю, безпосередньо пов'язаний з бензольним кільцем, змінить ступінь окислення від -2 до +3 (віддасть 5 електронів). Атом вуглецю метильної групи змінить ступінь окислення від -3 до +4 у діоксиді вуглецю (віддасть 7 електронів).,
У сумі молекула етилбензолу віддасть 12 електронів. Атом марганцю змінить ступінь окиснення від +7 до +2 (прийме 5 електронів). У такому разі маємо рівняння: . Для молекули така сума дорівнює нулю, а іона – його заряду. = 5, y = 12.
мінімальні позитивні цілочисленні рішення якого дорівнюють
![]()
у
Підбір коефіцієнтів у рівняннях реакцією диспропорціонування методом електронного балансу необхідно здійснювати правою частиною. Як приклад розберемо диспропорціонування бертолетової солі (без каталізатора):
Зі змін ступенів окислення атомів у ході реакції випливає, що прийняв 6 електронів, а нібито віддав 2 електрони.
Тоді
(КСl) = 3(КClО 4).
Отже, необхідно перед перхлоратом калію KClO 4 поставити коефіцієнт 3:
4КClО 3 = КСl + 3КClO 4 . 5.3. Електроліз
.
Розкладання електроліту (у розчині чи розплаві) під час проходження крізь нього електричного струму називають
електролізом Приладове оформлення процесу електролізу зводиться до того, що два електроди, підключені до джерела струму, опускають у посудину з розчином або розплавом електроліту (рис. 5.1).
Негативно заряджений електрод називається катодом
(Він притягує аніони). Електричний ланцюг замикається за рахунок окисно-відновних процесів, що проходять на електродах. На катоді відбувається відновлення катіонів, але в аноді – окислення аніонів.
Почнемо розгляд процесу з найпростішого випадку – електролізу розплавів.При електролізі розплавів на катодівідновлюються катіони металу до чистого металу, а на анодіпрості аніони окислюються до простої речовини, наприклад:
2Сl - - 2 е= Сl 2
S 2– – 2 е= S.
Якщо аніон має складну будову, то цьому випадку протікає процес, що вимагає найменших витрат енергії. Якщо сіль стійка до нагрівання і атом елемента в аніоні знаходиться в найвищому ступені окислення, то окислюється кисень до простої речовини:
– 2е= SO 3 + 1/2О 2 .
Якщо атом елемента знаходиться в проміжному ступені окислення, то найбільш ймовірно, що в цьому випадку окислюватиметься не кисень, а атом іншого елемента в аніоні, наприклад:
– e= NO 2.
Електроліз у розчинах складніший з погляду визначення продуктів. Пов'язано це з появою ще одного компонента води. Метали зі стандартними електродними потенціалами від -1,67 В (Al) і нижче (що знаходяться ліворуч від марганцю в ряду напруг металів) з водних розчинів, як правило, не відновлюються. У таких системах на катоді виділяється водень. Пов'язано це насамперед із тим, що зазначені метали (зокрема магній та алюміній без захисної окисної плівки) реагують із водою. Але це зовсім не означає, що електродні процеси типу
Na + + e= Na
у водяних розчинах не відбуваються. Один із способів отримання металевого натрію – електроліз водного розчину NаСl (розсолу). Секрет цього процесу полягає у використанні ртутного катода. Атоми натрію, що відновилися, поглинаються шаром ртуті, що оберігає їх від контакту з водою. Подальший поділ на компоненти амальгами натрію, що утворилася (амальгама - сплав, один з компонентів якого ртуть) досягається ректифікацією.
Звільнена ртуть потім повертається в робочий цикл.
Про неможливість отримання взаємодіючих з водою металів за допомогою електролізу водних розчинів відповідних електролітів свідчить також таке міркування. eНехай при електролізі водного розчину на катоді відбулося відновлення кальцію:
Са 2+ + 2
= Ca.
Метал, відновившись, вступить у реакцію з водою:
Метали зі стандартними електродними потенціалами в інтервалі від -1,05 до 0 В (перебувають в електрохімічному ряду між алюмінієм і воднем) з водних розчинів відновлюються паралельно з воднем.
Співвідношення продуктів (метал та водень) визначається концентрацією розчину, його кислотністю та деякими іншими факторами (наявність інших, особливо комплексних, солей у розчині; матеріал, з якого виготовлений електрод). Чим вище концентрація солі, тим більше частка металу, що виділився. Чим кисліше середовище, тим ймовірніше виділення водню.
потенціалами (що перебувають у ряді напруг металів правіше водню) виділяються при електролізі розчинів насамперед. eНаприклад:
Ag + +
= Ag. eНа аноді при електроліз водних розчинів окислюються всі прості аніони, за винятком фториду. Наприклад:
2I – – 2
= I2.
Фтор не можна отримати електроліз водних розчинів, т.к. він реагує з водою:
F 2 + Н 2 O = 2НF + 1/2О2. eЯкщо сіль, піддається електролізу, містить складний аніон, у якому гетероатом (не кисень) перебуває у найвищому ступені окислення, то цьому разі аноді утворюється кисень, тобто. відбувається розкладання води:
H 2 O – 2
– 2е= SO 3 + 1/2О 2 .
= 2H + + 1/2O 2 .
Джерелом кисню може служити сам складний аніон:
Ангідрид кислоти, що утворився при цьому, тут же прореагує з водою:
![]()
SО3 + Н2О = Н2SO4.
Коли гетероатом перебуває у проміжному ступені окислення, окислюється він, а чи не атом кисню. Прикладом такого процесу є окислення сульфіт-іону під дією електричного струму:
Сірчаний ангідрид SО 3, що утворюється при цьому, відразу реагує з водою. eАніони карбонових кислот в результаті електролізу декарбоксилюються, утворюючи вуглеводні:
2R–COO – – 2
= R-R + 2CO2.
5.4. Напрямок окислювально-
відновлювальних процесів
![]()
та вплив на нього кислотності середовища
Мірою окислювально-відновної здатності речовин у водних розчинах є окислювально-відновлювальні або стандартні електродні потенціали. Визначимо, наприклад, чи може катіон заліза Fe 3+ окислити аніони галогенів KCl, KBr і KI. Знаючи стандартні електродні потенціали (0), можна обчислити електрорушійну силу (ЕРС) процесу. Вона визначається як різниця таких потенціалів окислювача та відновника, причому реакція протікає при позитивному значенні ЕРС:
Таблиця 5.1
на основі стандартних електродних потенціалів
Табл. 5.1 показує, що лише один із досліджуваних процесів можливий. Справді, із усіх зазначених вище галогенідів калію з трихлоридом заліза реагує лише КІ:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl.
Існує і інший простий спосіб визначення напрямку процесу. Якщо записати одне під іншим два рівняння напівреакцій процесу так, щоб стандартний електродний потенціал верхньої напівреакції був менше ніж нижньої, то написана між ними буква Z (рис. 5.2) вкаже своїми кінцями напрямки стадій дозволеного процесу (правило Z).
З тих самих речовин, змінюючи рН середовища, можна отримати різні продукти.
Наприклад, перманганат-аніон у кислому середовищі відновлюється з утворенням сполуки марганцю(II):
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = K 2 SO 4 + 2MnSO 4 + 5Na 2 SO 4 + 3H 2 O.
У нейтральному середовищі утворюється діоксид марганцю МnО 2:
2КМnО 4 + 3Nа 2 SO 3 + H 2 О = 2КОН + 2МnО 2 + 3Na 2 SO 4 .
У лужному середовищі перманганат-аніон відновлюється до манганат-аніону:
2КМnО 4 + Nа 2 SO 3 + 2KOH = 2К 2 MnO 4 + Na 2 SО 4 + H 2 O.
5.5. Вправи
1. Визначте ступені окислення атомів у таких сполуках: BaO 2 , CsO 2 , RbO 3 , F 2 O 2 , LiH, F 2 , C 2 H 5 OH, толуол, бензальдегід, оцтова кислота.
Хімічний елемент у поєднанні, обчислений з припущення, що всі зв'язки мають іонний тип.
Ступені окислення можуть мати позитивне, негативне або нульове значення, тому алгебраїчна сума ступенів окислення елементів у молекулі з урахуванням числа їх атомів дорівнює 0, а в іоні – заряду іона.
1. Ступені окислення металів у з'єднаннях завжди позитивні. 2. Найвищий ступінь окислення відповідає номеру групи періодичної системи, де знаходиться даний елемент (виняток становлять: Au +3 (І група), Cu +2 (II), з VIII групи ступінь окислення +8 може бути тільки у осмію Os та рутенія.
Ru
- 3. Ступені окислення неметалів залежать від того, з яким атомом він з'єднаний:
- якщо з атомом металу, то ступінь окиснення негативна;
якщо з атомом неметалу то ступінь окислення може бути і позитивний, і негативний. Це залежить від електронегативності атомів елементів.
5. Ступені окислення простих речовин дорівнюють 0, незалежно від того метал це або неметал.
Елементи з постійними ступенями окиснення.
|
Елемент |
Характерний ступінь окислення |
Винятки |
|
Гідриди металів: LIH-1 |
||
|
Ступенем окисленняназивають умовний заряд частки у припущенні, що зв'язок повністю розірваний (має іонний характер). H- Cl = H + + Cl - , Зв'язок у соляній кислоті ковалентний полярний. Електронна пара більшою мірою зміщена у бік атома Cl - , т.к. він більш електронегативний елемент. Як визначити ступінь окиснення?Електронегативність- Це здатність атомів притягувати до себе електрони інших елементів. Ступінь окислення вказується над елементом: Br 2 0 , Na 0 , O +2 F 2 -1 ,K + Cl - і т.д. Вона може бути негативною та позитивною. Ступінь окислення простої речовини (незв'язаний, вільний стан) дорівнює нулю. Ступінь окислення кисню у більшості сполук дорівнює -2 (виняток становлять пероксиди Н 2 Про 2, де вона дорівнює -1 та з'єднання з фтором - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Ступінь окисленняпростого одноатомного іона дорівнює його заряду: Na + , Ca +2 . Водень у своїх сполуках має ступінь окислення рівну +1 (виключення становлять гідриди - Na + H - та з'єднання типу C +4 H 4 -1 ). У зв'язках «метал-неметал» негативний ступінь окислення має той атом, який має більшу електрооприцільність (дані про елекронегативність наведені в шкалі Полінга): H + F - , Cu + Br - , Ca +2 (NO 3 ) - і т.д. Правила визначення ступеня окислення у хімічних сполуках.Візьмемо з'єднання KMnO 4 , необхідно визначити ступінь окислення атома марганцю. Міркування:
До +Mn X O 4 -2 Нехай Х- невідомий нам ступінь окислення марганцю. Кількість атомів калію – 1, марганцю – 1, кисню – 4. Доведено, що молекула в цілому електронейтральна, тому її загальний заряд має дорівнювати нулю. 1*(+1) + 1*(X) + 4(-2) = 0, Х = +7, Отже, ступінь окислення марганцю перманганаті калію = +7. Візьмемо інший приклад оксиду Fe 2 O 3. Необхідно визначити рівень окислення атома заліза. Міркування:
2*(Х) + 3*(-2) = 0, Висновок: ступінь окислення заліза у цьому оксиді дорівнює +3. приклади.Визначити ступеня окиснення всіх атомів у молекулі. 1. K 2 Cr 2 O 7. Ступінь окислення До +1, кисню Про -2. Враховуючи індекси: О=(-2)×7=(-14), К=(+1)×2=(+2). Т.к. алгебраїчна сума ступенів окислення елементів у молекулі з урахуванням числа їх атомів дорівнює 0, то число позитивних ступенів окислення дорівнює числу негативних. Ступені окислення К+О=(-14)+(+2)=(-12). З цього випливає, що у атома хрому число позитивних ступенів дорівнює 12, але атомів у молекулі 2, отже, на один атом припадає (+12):2=(+6). Відповідь: До 2 + Cr 2 +6 O 7 -2. 2.(AsO 4) 3- . У разі сума ступенів окислення дорівнюватиме вже не нулю, а заряду іона, тобто. - 3. Складемо рівняння: х+4×(- 2)= - 3 . Відповідь: (As +5 O 4 -2) 3- . |
Щоб правильно розставляти ступеня окислення, необхідно пам'ятати чотири правила.
1) У простій речовині ступінь окислення будь-якого елемента дорівнює 0. Приклади: Na 0 , H 0 2 , P 0 4 .
2) Слід запам'ятати елементи, котрим характерні постійні ступені окислення. Усі вони перелічені у таблиці.
3) Вищий ступінь окислення елемента, як правило, збігається з номером групи, в якій знаходиться даний елемент (наприклад, фосфор знаходиться в V групі, вища с. о. фосфору дорівнює +5). Важливі винятки: F, O.
4) Пошук ступенів окислення інших елементів заснований на простому правилі:
У нейтральній молекулі сума ступенів окислення всіх елементів дорівнює нулю, а іоні - заряду іона.
Декілька простих прикладів на визначення ступенів окислення
Приклад 1. Необхідно знайти ступеня окиснення елементів в аміаку (NH 3).
Рішення. Ми вже знаємо (див. 2), що ст. бл. водню дорівнює +1. Залишилося знайти цю характеристику азоту. Нехай х – шуканий ступінь окислення. Складаємо найпростіше рівняння: х + 3 (+1) = 0. Рішення очевидне: х = -3. Відповідь: N-3 H3+1.
Приклад 2. Вкажіть ступінь окислення всіх атомів у молекулі H 2 SO 4 .
Рішення. Ступені окислення водню та кисню вже відомі: H(+1) та O(-2). Складаємо рівняння для визначення ступеня окислення сірки: 2 (+1) + х + 4 (-2) = 0. Вирішуючи дане рівняння, знаходимо: х = +6. Відповідь: H+12S+6O-24.
Приклад 3. Розрахуйте ступені окислення всіх елементів у молекулі Al(NO 3) 3 .
Рішення. Алгоритм залишається незмінним. До складу "молекули" нітрату алюмінію входить один атом Al(+3), 9 атомів кисню (-2) та 3 атоми азоту, ступінь окислення якого нам і належить обчислити. Відповідне рівняння: 1 (+3) + 3х + 9 (-2) = 0. Відповідь: Al +3 (N +5 O -2 3) 3 .
Приклад 4. Визначте ступеня окиснення всіх атомів в іоні (AsO 4) 3- .
Рішення. В даному випадку сума ступенів окислення дорівнюватиме вже не нулю, а заряду іона, тобто, -3. Рівняння: х + 4(-2) = -3. Відповідь: As(+5), O(-2).
Що робити, якщо невідомі ступені окислення двох елементів
А чи можна визначити ступеня окиснення відразу кількох елементів, користуючись схожим рівнянням? Якщо розглядати це завдання з погляду математики, відповідь буде негативною. Лінійне рівняння із двома змінними не може мати однозначного рішення. Але ми вирішуємо не просто рівняння!
Приклад 5. Визначте ступеня окислення всіх елементів (NH 4) 2 SO 4 .
Рішення. Ступені окислення водню та кисню відомі, сірки та азоту – ні. Класичний приклад завдання із двома невідомими! Розглянемо сульфат амонію не як єдину "молекулу", а як об'єднання двох іонів: NH 4 + і SO 4 2- . Заряди іонів нам відомі, у кожному міститься лише один атом з невідомим ступенем окислення. Користуючись досвідом, набутим під час вирішення попередніх завдань, легко знаходимо ступеня окислення азоту та сірки. Відповідь: (N -3 H 4 +1) 2 S +6 O 4 -2.
Висновок: якщо молекула містить кілька атомів з невідомими ступенями окислення, спробуйте "розділити" молекулу на кілька частин.
Як розставляти ступені окислення в органічних сполуках
Приклад 6. Вкажіть ступінь окислення всіх елементів у CH 3 CH 2 OH.
Рішення. Знаходження ступенів окислення в органічних сполук має свою специфіку. Зокрема, необхідно окремо знаходити ступеня окиснення для кожного атома вуглецю. Розмірковувати можна так. Розглянемо, наприклад, атом вуглецю у складі метильної групи. Даний атом З'єднаний з 3 атомами водню та сусіднім атомом вуглецю. У зв'язку з-Н відбувається зміщення електронної щільності у бік атома вуглецю (т. до. електронегативність З перевищує ЕО водню). Якби це усунення було повним, атом вуглецю придбав заряд -3.
Атом С у складі групи -СН 2 ВІН пов'язаний з двома атомами водню (зміщення електронної щільності у бік С), одним атомом кисню (зміщення електронної щільності у бік О) та одним атомом вуглецю (можна вважати, що зміщення ел. щільності у цьому випадку не відбувається). Ступінь окислення вуглецю дорівнює -2+1+0=-1.
Відповідь: З -3 H +1 3 C -1 H +1 2 O -2 H +1.
Не змішуйте поняття "валентність" та "ступінь окислення"!
Ступінь окислення часто плутають із валентністю. Не робіть такої помилки. Перелічу основні відмінності:
- ступінь окислення має знак (+ або -), валентність – ні;
- ступінь окислення може дорівнювати нулю навіть у складній речовині, рівність валентності нулю означає, як правило, що атом даного елемента не з'єднаний з іншими атомами (будь-якого з'єднання включення та іншу "екзотику" тут обговорювати не будемо);
- ступінь окислення - формальне поняття, яке набуває реального сенсу лише в з'єднаннях з іонними зв'язками, поняття "валентність", навпаки, найбільш зручно застосовувати по відношенню до ковалентних сполук.
Ступінь окислення (точніше, її модуль) часто чисельно дорівнює валентності, але ще частіше ці величини не збігаються. Наприклад, ступінь окислення вуглецю CO 2 дорівнює +4; валентність З також дорівнює IV. А ось у метанолі (CH 3 OH) валентність вуглецю залишається тією ж, а ступінь окислення С дорівнює -1.
Невеликий тест на тему "Ступінь окислення"
Витратьте кілька хвилин, перевірте, як ви засвоїли цю тему. Вам потрібно відповісти на п'ять нескладних питань. Успіхів!