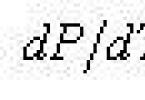К.х.н. О.В. Мосін
МОЛЕКУЛЯРНА ФІЗИКА ВОДИ У ТРИХ ЇЇ АГРЕГАТНИХ СТАНАХ
Вода, окис водню, H 2 0, найпростіша стійка в звичайних умовах хімічна сполука водню з киснем (11,19% водню та 88,81% кисню за масою). Вода - це безбарвна рідина без запаху і смаку (в товстих шарах має блакитний колір), якій належить найважливіша роль у геологічній історії Землі та виникненні життя, у формуванні фізичного та хімічного середовища, клімату та погоди на нашій планеті. Вода – обов'язковий компонент практично всіх технологічних процесів – як сільськогосподарського, так і промислового виробництва.
Вода входить до складу всіх живих організмів, причому в цілому в них міститься лише вдвічі менше води, ніж у всіх річках Землі. У живих організмах кількість води, крім насіння і суперечка, коливається між 60 і 99,7% по масі. За словами французького біолога Е. Дюбуа-Реймона, живий організм є l'eau animée (одушевлена вода). Всі води Землі постійно взаємодіють між собою, а також з атмосферою, літосферою та біосферою.
Земна куля містить близько 16 млрд. км3 води, що становить 0,25% маси всієї нашої планети. З цієї кількості частку гідросфери Землі (океани, моря, озера, річки, льодовики і підземні води) припадає 1,386 млрд. км3. Прісні поверхневі води (озера і річки) становлять лише 0,2 млн. км3, а водяна пара атмосфери - 13 тис. км3.
Загальна маса розподілених по поверхні Землі снігу і льоду досягає приблизно 2,5-3,0 x 1016 т, що становить лише 0,0004% маси всієї нашої планети. Однак, такої кількості достатньо, щоб покрити всю поверхню Земної кулі 53 метровим шаром, а якби вся ця маса раптом розтанула, перетворившись на воду, то рівень Світового Океану піднявся б у порівнянні з нинішнім приблизно на 64 метри.
Води Землі пронизують її, починаючи з найбільших висот стратосфери аж до величезних глибин земної кори, досягаючи мантії, і утворюють безперервну оболонку планети - гідросферу, що включає всю воду в рідкому, твердому, газоподібному, хімічно і біологічно зв'язному стані.
Гідросфера – водна оболонка Землі, Що включає океани, моря, озера, водосховища, річки, підземні води, грунтову вологу, становить близько 1,4-1,5 млрд. км 3 , причому частку води суші припадає лише близько 90 млн. км 3 . У тому числі підземні води становлять 60, льодовики 29, озера 0,75, грунтова волога 0,075, річки 0,0012 млн. км 3 .
Гідросфера грала і відіграє основну роль геологічної історії Землі, у формуванні фізичної і хімічної середовища, клімату та погоди, у виникненні життя на планеті. Вона розвивалася разом і в тісній взаємодії з літосферою, атмосферою, а потім живою природою.
В атмосферівода знаходиться у вигляді пари, туману та хмар, крапель дощу та кристалів снігу (всього близько 13-15 тис. км 3). Близько 10% поверхні суші постійно займають льодовики. На півночі та північному сході СРСР, на Алясці та Півночі Канади – загальною площею близько 16 млн. км 2 завжди зберігається підґрунтовий шар льоду (всього близько 0,5 млн. км 3 ).
У земній корі – літосферіміститься, за різними оцінками, від 1 до 1,3 млрд. км3 води, що близько до змісту їх у гідросфері. У земній корі значні кількості води перебувають у зв'язаному стані, входячи до складу деяких мінералів та гірських порід (гіпс, гідратовані форми кремнезему, гідросилікати та ін.). Величезні кількості води (13-15 млрд. км 3 ) зосереджено у глибших надрах мантії Землі. Вихід води, що виділялася з мантії в процесі розігріву Землі на ранніх стадіях її формування, і дав, на сучасні погляди, початок гідросфері. Щорічне надходження води з мантії та магматичних вогнищ становить близько 1 км 3 .
Є дані про те, що вода, хоча б частково, має «космічне» походження: протони, що прийшли у верхню атмосферу від Сонця, захопивши електрони, перетворюються на атоми водню, які, поєднуючись з атомами кисню, дають H 2 O.
Вода зустрічається в природних умовах у трьох станах: твердому – у вигляді льоду та снігу, рідкому – у вигляді власне води, газоподібному – у вигляді водяної пари. Ці стани води називають агрегатними станами, або відповідно твердою, рідкою та пароподібною фазами. Перехід води з однієї фази в іншу обумовлений зміною її температури та тиску. На рис. 1 наведена діаграма агрегатних станів води залежно від температури t та тиску P. З рис.1. видно, що в області I вода знаходиться тільки в твердому вигляді, в області II - тільки в рідкому, в III - тільки у вигляді водяної пари. Уздовж кривої AC вона знаходиться в стані рівноваги між твердою та рідкою фазами (плавлення льоду та кристалізація води); вздовж кривої AB - у стані рівноваги між рідкою та газоподібною фазами (випаровування води та конденсація пари); вздовж кривої AD - в рівновазі між твердою та газоподібною фазами (сублімація водяної пари та сублімація льоду).
Мал. 1. Діаграма агрегатних станів води в області потрійної точки А. I – лід. II – вода. III - водяна пара.
Рівнавага фаз по рис.1 вздовж кривих AB, АС і AD треба розуміти як динамічну рівновагу, тобто вздовж цих кривих число новоутворених молекул однієї фази строго дорівнює числу новоутворених молекул іншої фази. Якщо, наприклад, поступово охолоджувати воду при будь-якому тиску, то межі опинимося на кривій AC, де буде спостерігатися вода при відповідних температурі і тиску. Якщо поступово нагрівати лід при різному тиску, то опинимося на тій самій кривій рівноваги АС, але з боку льоду. Аналогічно матимемо воду і водяну пару, залежно від того, з якого боку підходитимемо до кривої AB.
Всі три криві агрегатного стану - АС (крива залежності температури плавлення льоду від тиску), АВ (крива залежності температури кипіння води від тиску), AD (крива залежності тиску пари твердої фази від температури) - перетинаються в одній точці A, що має назву потрійної точки . За сучасними дослідженнями, значення тиску насичувальної пари та температури в цій точці відповідно дорівнюють: P = 610,6 Па (або 6,1 гПа = 4,58 мм рт. ст.), t = 0,01°C (або T = 273,16 К). Крім потрійної точки, крива АВ проходить ще через дві характерні точки - точку, що відповідає кипінню води при нормальному тиску повітря з координатами P = 1,013 10 5 Па і t = 100 ° C, і точку з координатами P = 2,211 10 7 Па і t кр = 374,2°C, що відповідають критичній температурі - температурі, тільки нижче якої водяну пару можна перевести в рідкий стан шляхом стиснення.
Криві АС, АВ, AD, що відносяться до процесів переходу речовини з однієї фази в іншу, описуються рівнянням Клапейрона-Клаузіуса:
![]()
де T - абсолютна температура, що відповідає для кожної кривої відповідно до температури випаровування, плавлення, сублімації і т. д.; L - питома теплота відповідно до випаровування, плавлення, сублімації; V 2 - V 1 - різниця питомих обсягів відповідно при переході від води до льоду, від водяної пари до води, від водяної пари до льоду.
Безпосередній досвід показує, що природні води суходолу при нормальному атмосферному тиску переохолоджуються (крива AF) до деяких негативних значень температури, не кристалізуючись. Таким чином, вода має властивість переохолоджуватися, тобто. приймати температуру нижче за точку плавлення льоду. Переохолоджений стан води є станом метастабільним (нестійким), в якому перехід рідкої фази в тверду, що почався в будь-якій точці, триває безперервно, поки не буде ліквідовано переохолодження або поки не перетвориться на тверде тіло вся рідина. Здатність води приймати температуру нижче точки плавлення льоду було виявлено вперше Фаренгейтом ще 1724 р.
 Таким чином, льодові кристали можуть виникати лише у переохолодженій воді. Перехід переохолодженої води у твердий стан – лід, відбувається лише за наявності у ній центрів (ядер) кристалізації, як яких можуть виступати зважені частки наносів, що у воді, кристалики льоду чи снігу, які у воду з атмосфери, кристалики льоду, що утворюються в переохолоджену воду в результаті її турбулентного поступального руху, частинки інших речовин, присутніх у водній товщі.
Таким чином, льодові кристали можуть виникати лише у переохолодженій воді. Перехід переохолодженої води у твердий стан – лід, відбувається лише за наявності у ній центрів (ядер) кристалізації, як яких можуть виступати зважені частки наносів, що у воді, кристалики льоду чи снігу, які у воду з атмосфери, кристалики льоду, що утворюються в переохолоджену воду в результаті її турбулентного поступального руху, частинки інших речовин, присутніх у водній товщі.
Мал. 2. Фазова діаграма води. Ih, II – IX – форми льоду; 1 – 8 – потрійні точки.
Переохолодження води – термодинамічний стан, при якому температура води виявляється нижчою за температуру її кристалізації. Виникає цей стан в результаті зниження температури води або підвищення температури її кристалізації. Температура води може бути знижена відведенням тепла, що найчастіше зустрічається в природі, або змішуванням її із солоною, наприклад морською водою. Температура кристалізації може бути підвищена шляхом зниження тиску.
У лабораторних умовах при великому тиску та інтенсивному охолодженні дистильовану воду можна переохолодити до температури порядку – 30, а крапель – 50°С. Від глибини переохолодження води залежить швидкість її кристалізації.
Таким чином, діаграму агрегатних станів води – суцільна лінія AD на рис. 1 - слід розглядати як таку, що відноситься до дуже малих теплових навантажень, коли вплив часу на перетворення фази мало. При великих теплових навантаженнях процес фазових перетворень відбуватиметься згідно штрихової кривої AF.
Температура плавлення льоду (крива AC) дуже слабко залежить від тиску. Практично крива AC паралельна горизонтальній осі: при зміні тиску від 610,6 до 1,013·10 5 Па температура плавлення зменшується лише від 0,01 до 0°С. Однак ця температура знижується зі збільшенням тиску тільки до певного значення, потім вона підвищується і при дуже високому тиску досягає порядку 450°С (рис.1.2). Як випливає з рис. 1.2 при високому тиску лід може перебувати і при позитивній температурі. Налічують до десяти різних форм льоду. Форма льоду Ih, на яку характерне зниження температури плавлення зі збільшенням тиску, відповідає звичайному льоду, що утворюється внаслідок замерзання води за нормальних умов. Координати потрійних точок різних форм льоду, позначені на рис.1.2 арабськими цифрами 1-8, наведені в табл. 1.1. Структура та фізичні властивості всіх форм льоду суттєво відрізняються від льоду Ih.
Тверде тіло (лід), як і рідина, випаровується в широкому діапазоні значень температури і безпосередньо переходить у газоподібний стан (ліхтаря), минаючи рідку фазу, - крива AD. Зворотний процес, тобто перехід газоподібної форми безпосередньо в тверду (сублімація), здійснюється також минаючи рідку фазу. сублімація льоду і снігу грають велику роль у природі.
Будова молекули води
 Вода є складною речовиною, основною структурною одиницею якої є молекула H 2 O, що складається з двох атомів водню і одного атома кисню. Схем можливого взаємного розташування атомів H та O в молекулі H 2 O за весь період її вивчення було запропоновано кілька десятків; загальновизнана в даний час схема наведена на рис. 3.
Вода є складною речовиною, основною структурною одиницею якої є молекула H 2 O, що складається з двох атомів водню і одного атома кисню. Схем можливого взаємного розташування атомів H та O в молекулі H 2 O за весь період її вивчення було запропоновано кілька десятків; загальновизнана в даний час схема наведена на рис. 3.
Мал. 3. Схема будови молекули води: геометрія молекули та електронні орбіти
Повну кінетичну енергію триатомної молекули типу H 2 O можна описати таким виразом:
![]()
де і - швидкості відповідно поступального та обертального руху молекули; I x , I y , I z - моменти інерції молекули щодо відповідних осей обертання; m – маса молекули.
З цього рівняння видно, що повна енергія триатомної молекули типу H 2 O складається з шести частин, що відповідають шести ступеням свободи: трьох поступальних і трьох обертальних.
З курсу фізики відомо, що на кожен із цих ступенів свободи при тепловій рівновазі припадає однакова кількість енергії, що дорівнює 1/2 kT, де k=R m /NA = 1,3807·10 -23 Дж/К - постійна Больцмана; Т-абсолютна температура; N A = 6,0220 10 23 моль -1 - число Авогадро; kN A = R m = 8,3144 Дж/(моль К) - універсальна газова стала. Тоді повна кінетична енергія такої молекули дорівнює:
![]()
Повна кінетична енергія молекул, що містяться в грам-молекулі будь-якого газу (пара), складе:

Повна кінетична енергія W пов'язана з питомою теплоємністю cv при постійному обсязі формулою:

Підрахунок питомої теплоємності води за цією формулою для водяної пари дає значення 25 Дж/(моль К). За досвідченими даними, для водяної пари cv = 27,8 Дж/(моль К), тобто близько до розрахункового значення.
Вивчення молекули води за допомогою спектрографічних досліджень дозволило встановити, що вона має структуру як би рівнобедреного трикутника: у вершині цього трикутника розташований атом кисню, а на підставі його - два атоми водню. Кут при вершині становить 104 ° 27, а довжина сторони - 0,096 нм. Ці параметри належать до гіпотетичного рівноважного стану молекули без її коливань та обертань.
Відносна молекулярна маса H 2 O залежить від відносної атомної маси її складових і має різні значення, оскільки кисень та водень мають ізотопи.
Кисень має шість ізотопів: 14 O, 15 O, 16 O, 17 O, 18 O, 19 O, з яких стабільні лише три, а водень три: 1 H (протий), 2 H (дейтерій), 3 H (тритій) . Деякі з ізотопів радіоактивні, мають короткий час напіврозпаду і присутні у воді в незначних кількостях, інші отримані тільки штучним шляхом і в природі не зустрічаються.
Таким чином, з огляду на ізотопи кисню та водню, можна скласти з них декілька видів молекули H 2 O з різними відносними молекулярними масами. З них найбільш поширені молекули 1 H 2 16 O з відносними молекулярними масами 18 (звичайна вода) та молекули 2 H 2 16 O з відносними молекулярними масами 20. Останні молекули утворюють так звану важку воду. Тяжка вода за своїми фізичними властивостями значно відрізняється від звичайної води.
Молекулярно-кінетична теорія речовини та води
Структура води у трьох її агрегатних станах ще може вважатися остаточно встановленої. Існує ряд гіпотез, що пояснюють будову пари, води та льоду.
Ці гіпотези більшою чи меншою мірою спираються на молекулярно-кінетичну теорію будови речовини, основи якої було закладено ще М.В. Ломоносовим. У свою чергу, молекулярно-кінетична теорія виходить із принципів класичної механіки, в якій молекули (атоми) розглядаються як кульки правильної форми, електрично нейтральні, ідеально пружні. Такі молекули схильні лише до механічних зіткнень і не відчувають жодних електричних сил взаємодії. З цих причин використання молекулярно-кінетичної теорії може лише у першому наближенні пояснити будову речовини.
Газ - у нашому випадку водяна пара, - згідно з молекулярно-кінетичною теорією, є зібранням молекул. Відстань між ними набагато більше розмірів самих молекул. Молекули газу перебувають у безперервному безладному русі, пробігаючи шлях між стінками судин, у якому укладено газ, і зіштовхуючись друг з одним цьому шляху. Зіткнення молекул між собою відбуваються без втрати механічної енергії; вони розглядаються як зіткнення ідеально пружних кульок. Удари молекул об стінки судини, що обмежує їх, зумовлюють тиск газу на ці стінки. Швидкість руху молекул збільшується з підвищенням температури та зменшується з її падінням.
Коли температура газу, зменшуючись від вищих значень, наближається до температури кипіння рідини (для води 100°C при нормальному тиску), швидкість молекул зменшується, і при зіткненні сили тяжіння між ними стають більше сил пружних відштовхувань при ударі і тому газ конденсується в рідину .
При штучному зрідженні газу температура його має бути нижчою так званої критичної, якій відповідає і критичний тиск (п.1.1). При температурі вище за критичний газ (пар) ніяким тиском не може бути переведений в рідину.
Величина RT кр / (P кр V кр) для всіх газів, у тому числі і для водяної пари, повинна дорівнювати 8/3=2,667 (тут R - газова постійна; T кр, P кр, V кр - відповідно критичні температура, тиск, об'єм). Однак для водяної пари вона дорівнює 4,46. Це тим, що до складу пари входять як одиночні молекули, а й їх асоціації.
Рідина на відміну газу є сукупність молекул, розташованих настільки близько друг від друга, що з-поміж них проявляються сили взаємного тяжіння. Тому молекули рідини не розлітаються в різні боки, як молекули газу, а коливаються біля свого положення рівноваги. Разом з тим, так як будова рідини не цілком щільна, в ній є вільні місця - «дірки», внаслідок чого, за теорією Я.І.Френкеля, деякі молекули, які мають більшу енергію, вириваються зі свого «осілого» місця і стрибком переміщаються в сусідню «дірку», розташовану на відстані приблизно рівному розміру самої молекули. Таким чином, в рідині молекули порівняно рідко переміщуються з місця на місце, а більшу частину часу знаходяться в осілому стані, лише зазнаючи коливальних рухів. Цим, зокрема, пояснюється слабка дифузія в рідинах, порівняно з великою її швидкістю в газах. При нагріванні рідини енергія молекул збільшується, швидкість їх коливання зростає. При температурі 100°C і нормальному атмосферному тиску вода розпадається на окремі молекули H2O, швидкість яких вже може подолати взаємне тяжіння молекул, і вода перетворюється на пару.
При охолодженні рідини (води) відбувається зворотний процес. Швидкості коливального руху молекул зменшуються, структура рідини стає міцнішою, і рідина переходить у кристалічний (твердий) стан-лід. Розрізняють два види твердих тіл: кристалічні та аморфні. Основною ознакою кристалічних тіл є анізотропія їх властивостей за різними напрямками: теплового розширення, міцності, оптичних та електричних властивостей і т. п. Аморфні тіла ізотропні, тобто мають однакові властивості у всіх напрямках. Лід є кристалічним тілом.
У твердому тілі, на відміну газу і рідини, кожен атом чи молекула коливаються лише біля свого становища рівноваги, але з переміщаються. У твердому тілі відсутні дірки, в які можуть переходити окремі молекули. Тому дифузія у твердих тілах відсутня. Атоми, що становлять молекули, утворюють міцну кристалічну решітку, незмінність якої обумовлена молекулярними силами. Коли температура твердого тіла наближається до температури плавлення, кристалічні грати його руйнуються, і воно переходить у рідкий стан. На відміну від кристалізації рідин, плавлення твердих тіл відбувається порівняно повільно, без явно вираженого стрибка.
Кристалізація більшості рідин відбувається із зменшенням об'єму, а плавлення твердих тіл супроводжується збільшенням об'єму. Виняток становлять вода, сурма, парафін та деякі інші речовини, у яких тверда фаза менш щільна, ніж рідка.
Структура води у трьох її агрегатних станах
Проблема оцінки структури води поки що залишається однією з найскладніших. Розглянемо коротко дві узагальнені гіпотези про структуру води, отримали найбільше визнання, одна - у початковий період розвитку вчення структуру води, інша - нині.
Згідно з гіпотезою, запропонованою Уайтінгом (1883 р.) і що має до теперішнього часу різні інтерпретації, основною будівельною одиницею водяної пари є молекула H 2 O, звана гідроль, або моногідроль. Основною будівельною одиницею води є подвійна молекула води (H2O)2-дигідроль; лід складається з потрійних молекул (H 2 O) 3 - тригідроль. На цих уявленнях заснована так звана гідрольна теорія структури води.
Водяна пара, згідно з цією теорією, складається із зібрання найпростіших молекул моногідролю та їх асоціацій, а також з незначної кількості молекул дигідролю.
Вода в рідкому вигляді являє собою суміш молекул моногідролю, дигідролю та тригідролю. Співвідношення числа цих молекул у воді по-різному і залежить від температури. Відповідно до цієї гіпотези, співвідношення кількості молекул води пояснює одну з основних її аномалій - найбільшу щільність води при 4°С.
Оскільки молекула води несиметрична, то центри тяжкості позитивних і негативних зарядів її збігаються. Молекули мають два полюси - позитивний і негативний, що створюють, як магніт, молекулярні силові поля. Такі молекули називають полярними або диполями, а кількісну характеристику полярності визначають електричним моментом диполя, що виражається добутком відстані l між електричними центрами тяжкості позитивних і негативних зарядів молекули на заряд e в абсолютних електростатичних одиницях:
Для води дипольний момент дуже високий: p = 6,13 · 10 -29 км. Полярністю молекул моногідролю і пояснюється утворення дигідролю та тригідролю. Разом з тим, так як власні швидкості молекул зростають з підвищенням температури, цим можна пояснити поступовий розпад тригідролю в дигідроль і далі моногідроль відповідно при таненні льоду, нагріванні і кипінні води.
Інша гіпотеза будови води, що розроблялася у XX столітті (моделі О.Я.Самойлова, Дж.Попла, Г.Н.Зацепіної та ін.), заснована на уявленні, що лід, вода та водяна пара складаються з молекул H 2 O, об'єднаних у групи з допомогою про водневих зв'язків (Дж.Бернал і Р.Фаулер, 1933г.). Ці зв'язки виникають внаслідок взаємодії атомів водню однієї молекули з атомом кисню сусідньої молекули (з сильно електронегативним елементом). Така особливість водневого обміну в молекулі води обумовлюється тим, що віддаючи свій єдиний електрон на утворення ковалентного зв'язку з киснем, він залишається у вигляді ядра, майже позбавленого електронної оболонки. Тому атом водню не відчуває відштовхування від електронної оболонки кисню сусідньої молекули води, а, навпаки, притягується нею, і може вступити з нею у взаємодію. Згідно з цією гіпотезою, можна припустити, що сили, що утворюють водневий зв'язок, є суто електростатичними. Однак, згідно з методом молекулярних орбіталей, водневий зв'язок утворюється за рахунок дисперсійних сил, ковалентного зв'язку та електростатичної взаємодії.
У табл.1 показаний молекулярний склад води, льоду та водяної пари з різних літературних джерел.
Таблиця 1.1
Молекулярний склад льоду, води та водяної пари, %

Таким чином, в результаті взаємодії атомів водню однієї молекули води з негативними зарядами кисню іншої молекули утворюються чотири водневі зв'язки для кожної молекули води. При цьому молекули, як правило, поєднуються в групи - асоціати: кожна молекула виявляється оточеною чотирма іншими (рис. 4). Така щільна упаковка молекул характерна для води в замерзлому стані (лід Ih) і призводить до відкритої кристалічної структури, що належить до гексогональних симетрій. При цій структурі утворюються «порожнечі – канали» між фіксованими молекулами, тому щільність льоду менша за щільність води.
 Підвищення температури льоду до його плавлення та вище призводить до розриву водневих зв'язків. При рідкому стані води достатньо навіть звичайних теплових рухів молекул, щоб ці зв'язки зруйнувати.
Підвищення температури льоду до його плавлення та вище призводить до розриву водневих зв'язків. При рідкому стані води достатньо навіть звичайних теплових рухів молекул, щоб ці зв'язки зруйнувати.
Мал. 4. Схема взаємодії молекул води. 1 - кисень, 2 - водень, 3 - хімічний зв'язок, 4 - водневий зв'язок.
При підвищенні температури води до 4°С упорядкованість розташування молекул кристалічного типу з характерною структурою для льоду до певної міри зберігається. Наявні в цій структурі зазначені вище порожнечі заповнюються молекулами води, що звільнилися. Внаслідок цього густина рідини збільшується до максимальної при температурі 3,98°С. Подальше зростання температури призводить до спотворення та розриву водневих зв'язків, а, отже, і руйнування груп молекул, аж до окремих молекул, що характерно для пари.
Тож у чому полягають загадкові, незвичайні властивості звичної всім рідкої води? Перш за все, в тому, що практично всі властивості води аномальні, а багато з них не підкоряються логіці законів фізики, які керують іншими речовинами.
Молекули води під час конденсації формує рідку речовину дивовижної складності. У першу чергу це пов'язано з тим, що молекули води мають унікальну властивість об'єднуватися в кластери (групи) (Н 2 О)x. Під кластером зазвичай розуміють групу атомів або молекул, об'єднаних фізичною взаємодією в єдиний ансамбль, але які зберігають усередині нього індивідуальну поведінку. Можливості прямого спостереження кластерів обмежені, тому експериментатори компенсують апаратурні недоліки інтуїцією і теоретичними побудовами.
При кімнатній температурі ступінь асоціації X для води становить, за сучасними даними, від 3 до 6. Це означає, що формула води не просто Н2О, а середнє між Н6О3 і Н12О6. Іншими словами, вода - складна рідина, "складена" з повторюваних груп, що містять від трьох до шести одиночних молекул. Внаслідок цього вода має аномальні значення температури замерзання та кипіння порівняно з гомологами. Якби вода підкорялася загальним правилам, вона мала замерзати при температурі порядку -100 о З і закипати за нормальної температури близько +10 про З.
Якби вода при випаровуванні залишалася у вигляді Н6О3, Н8О4 або Н12О6, то водяна пара була б набагато важчою за повітря, в якому домінують молекули азоту і кисню. І тут поверхню всієї Землі було б покрита вічним шаром туману. Уявити життя на такій планеті практично неможливо.
Людям пощастило: кластери води при випаровуванні розпадаються, і вода перетворюється практично на простий газ з хімічною формулою Н 2 О (виявлене останнім часом у парі незначна кількість димерів Н 4 О 2 погоди не робить). Щільність газоподібної води менша за щільність повітря, і тому вода здатна насичувати своїми молекулами земну атмосферу,створюючи комфортні для людини погодні умови.
На Землі немає інших речовин, наділених здатністю бути рідиною при температурах існування людини і при цьому утворювати газ не тільки легше за повітря, але й здатний повертатися до її поверхні у вигляді опадів.
К.х.н. О.В. Мосін
Вступ
1. Будова молекул води
2. Структура води у трьох її агрегатних станах
3. Різновиди води
4. Аномальні властивості води
5. Фазові перетворення та діаграма стану води
6. Моделі структури води та льоду
7. Агрегатні види льоду
Висновок
Список літератури
Вступ
Вода це найважливіша речовина на Землі без якого не може існувати жоден живий організм і не можуть протікати жодні біологічні, хімічні реакції, та технологічні процеси.
Води (оксид водню) – це рідина без запаху, смаку та кольору (в товстих шарах блакитна); Н 2 О, мовляв. м. 18,016, найпростіше стійке з'єдн. водню з киснем.
Вода одна із найпоширеніших у природі речовин. Вона покриває близько 3/4 всієї земної поверхні, становлячи основу океанів, морів, озер, річок, фунтових вод і боліт. Велика кількість води також знаходиться в атмосфері. Рослини та живі організми містять у своєму складі 50-96 % води.
Молекули води виявлені у міжзоряному просторі. Вода входить до складу комет, більшості планет сонячної системи та їх супутників. Кількість води на пов-сті Землі оцінюється в 1,39 * 10 18 т, більшість її міститься в морях і океанах. Кількість доступних для використання прісних вод у річках, озерах, болотах і водосховищах становить 2*10 4 т. Маса льодовиків Антарктики, Антарктиди та високогірних районів 2,4*10 16 т (загальна маса розподілених по поверхні Землі снігу та льоду досягає приблизно 2,5-3,010 16 т, що становить лише 0,0004% маси всієї нашої планети, однак такої кількості достатньо, щоб покрити всю поверхню Земної кулі 53 метровим шаром, а якби вся ця маса раптом розтанула, перетворившись на воду, то рівень Світового Океану піднявся б у порівнянні з нинішнім приблизно на 64 метри.), приблизно стільки ж є підземних вод, причому лише невелика їх частина – прісні. В атмосфері знаходиться прибл. 1,3 * 10 13 т води. Вода входить до складу багатьох мінералів та гірських порід (глина, гіпс та ін.), присутня у ґрунті, є обов'язковим компонентом усіх живих організмів.
Щільність H 2 O = 1 г/см3 (при 3,98 градусів), t пл. = 0 градусів, а t кіп = 100 градусів. Теплоємність води становить 4,18 Дж/(г/К) Mr(H 2 O) = 18 і відповідає її найпростішій формулі. Однак молекулярна маса рідкої води, яка визначається шляхом вивчення її розчинів в інших розчинниках виявляється більш високою. Це свідчить про те, що в рідкій воді відбувається асоціація молекул, тобто з'єднання їх у складніші агрегати. Вода - це єдина речовина в природі, яка в земних умовах існує у всіх трьох агрегатних станах: Багато води знаходиться в газоподібному стані у вигляді пари в атмосфері; у вигляді величезних мас снігу та льоду лежить вона цілий рік на вершинах високих гір та в полярних країнах. У надрах землі також знаходиться вода, що просочує грунт та гірські породи
Від води залежить клімат. Геофізики стверджують, що Земля давно б охолола і перетворилася на млявий шматок каменю, якби не вода. У неї дуже велика теплоємність. Нагріваючись, вона поглинає тепло; остигаючи, віддає його. Земна вода і поглинає, і повертає дуже багато тепла і тим самим вирівнює клімат. А від космічного холоду оберігає Землю ті молекули води, які розсіяні в атмосфері – у хмарах та у вигляді пар… без води обійтися не можна – це найважливіша речовина на Землі.
Вода – речовина звична та незвичайна. Відомий радянський вчений
академік І. В. Петрянов свою науково-популярну книгу про воду назвав "найзвичайніша речовина у світі". А "Цікава фізіологія", написана доктором біологічних наук Б. Ф. Сергєєвим, починається з глави про воду - "Речовина, яка створила нашу планету".
1. Будова молекули води
З усіх поширених рідин вода – найбільш універсальний розчинник, рідина з максимальними величинами поверхневого натягу, діелектричної постійної, теплоти пароутворення та найвищою (після аміаку) теплотою плавлення. На відміну більшості речовин вода, замерзаючи при низькому тиску, розширюється.
Ці специфічні властивості води пов'язані з особливою будовою її молекули. Хімічна формула води Н20 оманливо проста. У молекулі води ядра атомів водню розташовані несиметрично по відношенню до ядра атома кисню та електронів. Якщо атом кисню знаходиться в центрі тетраедра, центри мас двох атомів водню будуть у кутах тетраедра, а центри зарядів двох пар електронів займуть два інші кути (рис.1.1). Таким чином, чотири електрони розташовуються на можливо найбільшій відстані від ядра атома кисню, так і від ядер атомів водню, при якому вони ще притягуються ядром атома кисню. Інші шість електронів молекули води розташовані так: чотири електрони перебувають у положенні, що забезпечує хімічний зв'язок між ядрами атомів кисню та водню, а два інших розташовані поблизу ядра атома кисню.
Асиметричне розташування атомів молекули води зумовлює нерівномірне розподілення електричних зарядів у ній, що робить молекулу води полярною. Така будова молекули води зумовлює тяжіння молекул води одна до одної внаслідок утворення між ними водневих зв'язків. Розташування атомів водню і кисню, всередині агрегатів, що утворилися, молекул води подібно з розстановкою атомів кремнію і кисню в кварці. Це відноситься до льоду і меншою мірою до рідкої води, агрегати молекул якої завжди знаходяться в стадії перерозподілу. При охолодженні води її молекули групуються в агрегати, які поступово збільшуються і стають все більш стійкими при наближенні до температури 4° С, коли вода досягає максимальної щільності. При цій температурі вода ще не має жорсткої структури і поряд із довгими ланцюжками її молекул існує велика кількість окремих молекул води. При подальшому охолодженні ланцюжка молекул води зростають за рахунок приєднання до них вільних молекул, у результаті щільність води зменшується. Коли вода перетвориться на лід, всі її молекули входять у більш менш жорстку структуру у вигляді незамкнутих ланцюжків, що утворюють кристали.
Рис.1.1 Будова молекули води
Взаємне проникнення атомів водню та кисню. Ядра двох атомів водню та дві пари електронів перебувають у кутах тетраедра: у центрі розташоване ядро атома кисню.
Високі величини поверхневого натягу та теплоти пароутворення води пояснюються тим, що для відокремлення молекули води від групи молекул потрібна відносно велика витрата енергії. Прагнення молекул води встановлювати водневі зв'язки та їх полярність пояснюють надзвичайно високу розчинну здатність води. Деякі сполуки, такі як цукри та спирти, утримуються в розчині завдяки водневим зв'язкам. З'єднання, що володіють високим ступенем іонізації вводі, наприклад, хлористий натрій, утримуються в розчині внаслідок того, що іони з протилежними зарядами нейтралізуються групами орієнтованих молекул води.
Інша особливість молекули води полягає в тому, що атоми водню, так і атоми кисню можуть мати різні маси при однаковому заряді ядра. Різновиди хімічного елемента із різними атомними вагами називаються ізотопами цього елемента. Молекула води зазвичай утворюється воднем з атомною вагою 1 (Н 1) та киснем з атомною вагою 16 (Про 16). Більше 99% атомів води відноситься до цих ізотопів. Крім того, існують наступні ізотопи: Н 2 , H 3 , 14 , 15 , 17 18 , 19 . Багато хто з них накопичується у воді в результаті її часткового випаровування і внаслідок своєї великої маси. Ізотопи Н 3, Про 14, Про 15, Про 19 радіоактивні. Найбільш поширений з них тритій Н 3 утворюється у верхніх шарах атмосфери під впливом космічних променів. Цей ізотоп накопичився також внаслідок ядерних вибухів за останні кілька років. На підставі цих та інших фактів щодо ізотопів шляхом аналізу ізотопного складу води можна частково розкрити історію деяких природних вод. Так, вміст важких ізотопів у поверхневих водах свідчить про тривале випаровування води, яке відбувається, наприклад, у Мертвому морі, Великому Солоному озері та інших безстічних водоймах. Підвищений вміст тритію в підземних водах міг би означати, що ці води метеорного походження з великою швидкістю циркуляції, тому що період напіврозпаду цього ізотопу лише 12,4 років. На жаль, ізотопний аналіз занадто дорогий і тому не може бути широко застосований у дослідженнях природних вод
Молекула води H 2 Про побудована як трикутника: кут між двома зв'язками кисень – водень 104 градуси. Але оскільки обидва водневі атоми розташовані з одного боку від кисню, електричні заряди у ній розосереджуються. Молекула води є полярною, що є причиною особливої взаємодії між різними її молекулами.
Атоми водню у молекулі H 2 Про, маючи позитивний частковий заряд, взаємодіють із електронами атомів кисню сусідніх молекул. Такий хімічний зв'язок називається водневим. Вона поєднує молекули H 2 Про своєрідні полімери просторової будови; площина, в якій розташовані водневі зв'язки, перпендикулярні площині атомів тієї ж молекули H 2 О. Взаємодія між молекулами води і пояснюються в першу чергу незакономірно високі температури її плавлення і кипіння. Потрібно підвести додаткову енергію, щоб розхитати, а потім зруйнувати водневі зв'язки. І ця енергія дуже значна. Ось чому така велика теплоємність води.
Як і більшість речовин, вода складається з молекул, а останні атомів.
Ідея древніх філософів у тому, що у природі утворюють чотири елементи (стихії): земля, повітря, вогонь і вода, проіснувала до Середніх століть. У 1781 р. Кавендіш повідомив про отримання ним води під час спалювання водню, але не оцінив повною мірою важливості свого відкриття. Пізніше (1783)А.Лавуазьє довів, що вода зовсім не елемент, а з'єднання водню та кисню. Й.Берцеліус і П.Дюлонг (1819), а також Ж.Дюма і Ж.Стас (1842) встановили ваговий склад води, пропускаючи водень через оксид міді, взятий у строго певній кількості, і зважуючи мідь і воду, що утворилися. З цих даних, вони визначили ставлення Н:Про води. Крім того, у 1820-х роках Ж.Гей-Люссак виміряв обсяги газоподібних водню та кисню, які при взаємодії давали воду: вони співвідносилися між собою як 2:1, що, як ми тепер знаємо, відповідає формулі Н 2 Про. Поширеність. Вода покриває 3/4 Землі. Тіло людини складається з води приблизно на 70%, яйце – на 74%, а деякі овочі – це майже одна вода. Так, в кавуні її 92%, у стиглих томатах - 95%.Вода в природних резервуарах ніколи не буває однорідною за складом: вона проходить через гірські породи, стикається з ґрунтом та повітрям, а тому містить розчинені гази та мінеральні речовини. Чистішою є дистильована вода.
Морська вода . Склад морської води відрізняється у різних регіонах залежить від припливу прісних вод, швидкості випаровування, кількості опадів, танення айсбергів тощо.Див. такожОКЕАН.Мінеральна вода. Мінеральна вода утворюється при просочуванні звичайної води крізь породи, що містять сполуки заліза, літію, сірки та інших елементів.М'яка та жорстка вода. Жорстка вода містить у великих кількостях солі кальцію та магнію. Вони розчиняються у воді при протіканні по породах, складених гіпсом (С aSO 4 ), вапняком (СаСО 3 ) або доломітом (карбонати Mg та Са). У м'якій воді цих солей мало. Якщо вода містить сульфат кальцію, то кажуть, що вона має постійну (некарбонатну) жорсткість. Її можна пом'якшити додаванням карбонату натрію; це призведе до осадження кальцію у вигляді карбонату, а розчині залишиться сульфат натрію. Солі натрію не вступають у реакцію з милом, і витрата його буде меншою, ніж у присутності солей кальцію та магнію.Вода, що має тимчасову (карбонатну) жорсткість, містить бікарбонати кальцію і магнію; її можна пом'якшити декількома способами: 1) нагріванням, що призводить до розкладання бікарбонатів на карбонати нерозчинні; 2) додаванням вапняної води (гідроксиду кальцію), в результаті чого бікарбонати перетворюються на нерозчинні карбонати; 3) з допомогою обмінних реакцій.
Молекулярна структура. Аналіз даних, отриманих із спектрів поглинання, показав, що три атоми в молекулі води утворюють рівнобедрений трикутник з двома атомами водню в основі та киснем у вершині:Валентний кут НОН дорівнює 104,31° , довжина зв'язку ПРОН становить 0,99Å (1 Å = 10 8 см), а відстань НН дорівнює 1,515 Å . Атоми водню так глибоко «впроваджено» в атом кисню, що молекула виявляється майже сферичною; її радіус 1,38Å . ВОДА Фізичні властивості. Завдяки сильному тяжінню між молекулами у води високі температури плавлення (0°С) та кипіння (100° З). Товстий шар води має блакитний колір, що обумовлюється не лише її фізичними властивостями, а й присутністю завислих частинок домішок. Вода гірських річок зелена через зважених частинок карбонату кальцію, що містяться в ній. Чиста вода - поганий провідник електрики, її питома електропровідність дорівнює 1,5Ч 10 8 Ом 1 Ч см 1 при 0 ° С. Стисність води дуже мала: 43Ч 10 6 см 3 на мегабар при 20° Щільність води максимальна при 4° З; це пояснюється властивостями водневих зв'язків її молекул.Тиск пари. Якщо залишити воду у відкритій ємності, то вона поступово випарується - всі її молекули перейдуть у повітря. У той самий час вода, що у щільно закупореному посудині, випаровується лише частково, тобто. при певному тиску водяної пари між водою і повітрям, що знаходиться над нею, встановлюється рівновага. Тиск пари в рівновазі залежить від температури і називається тиском насиченої пари (або її пружністю). Коли тиск насиченої пари порівнюється із зовнішнім тиском, вода закипає. При нормальному тиску 760 мм рт.ст. вода кипить при 100° З, але в висоті 2900 м вище над рівнем моря атмосферний тиск падає до 525 мм рт.ст. і температура кипіння виявляється рівною 90° З.Випаровування відбувається навіть із поверхні снігу та льоду, саме тому висихає на морозі мокру білизну.
В'язкість води зі зростанням температури швидко зменшується і при 100
° З виявляється у 8 разів менше, ніж при 0°С. Хімічні властивості. Каталітична дія. Дуже багато хімічних реакцій протікають тільки в присутності води. Так, окислення киснем немає у сухих газах, метали не реагують з хлором тощо.Гідрати. Багато сполук завжди містять певну кількість молекул води і називаються тому гідратами. Природа зв'язків, що утворюються при цьому, може бути різною. Наприклад, у пентагідраті сульфату міді, або мідному купоросі CuSO 4 Ч 5H 2 O чотири молекули води утворюють координаційні зв'язки з іоном сульфату, що руйнуються при 125° З; п'ята молекула води пов'язана так міцно, що відривається лише при температурі 250° С. Ще один стабільний гідрат - сірчана кислота; вона існує у двох гідратних формах, SO 3 Ч H 2 O та SO 2 (OH) 2 між якими встановлюється рівновага. Іони у водних розчинах теж часто бувають гідратовані. Так, Н + завжди знаходиться у вигляді іона гідроксонію Н 3 Про + або Н 5 Про 2 + ; іон літію у вигляді Li (H 2 O) 6 + і т.д. Елементи як такі рідко перебувають у гідратованій формі. Виняток становлять бром та хлор, які утворюють гідрати. Br 2 Ч 10 H 2 O та Cl 2 Ч 6H 2 Про . Деякі звичайні гідрати містять кристалізаційну воду, наприклад, хлорид барію. BaCl 2 год 2H 2 O , англійська сіль (сульфат магнію) MgSO 4 Ч 7H 2 O , питна сода (карбонат натрію) Na 2 CO 3 10 H 2 O , глауберова сіль (сульфат натрію) Na 2 SO 4 10 H 2 O. Солі можуть утворювати кілька гідратів; так, сульфат міді існує у вигляді CuSO 4 Ч 5H 2 O, CuSO 4 Ч 3H 2 O та CuSO 4 Ч H 2 O . Якщо тиск насиченої пари гідрату більший, ніж атмосферний тиск, то сіль втрачатиме воду. Цей процес називаєтьсявицвітанням (вивітрюванням). Процес, у якому сіль поглинає воду, називаєтьсярозпливанням . Гідроліз. Гідроліз - це реакція подвійного розкладання, в якій одним з реагентів є вода; трихлорид фосфору PCl 3 легко вступає в реакцію з водою: PCl 3 + 3H 2 O = P(OH) 3 + 3HCl Аналогічним чином гідролізуються жири з утворенням жирних кислот та гліцерину.Сольватація. Вода - полярна сполука, а тому охоче вступає в електростатичну взаємодію з частинками (іонами або молекулами) розчинених у ній речовин. Молекулярні групи, що утворилися в результаті сольватації, називаються сольватами. Шар молекул води, пов'язаний із центральною частинкою сольвату силами тяжіння, становить сольватну оболонку. Вперше поняття сольватації було запроваджено 1891 І.А.Каблуковим.Тяжка вода. У 1931 р. Юрі показав, що при випаровуванні рідкого водню його останні фракції виявляються важчими за звичайний водень внаслідок вмісту в них вдвічі більш важкого ізотопу. Цей ізотоп називається дейтерієм і позначається символом D . За своїми властивостями вода, що містить замість звичайного водню його важкий ізотоп, суттєво відрізняється від звичайної води.У природі на кожні 5000 масових частин Н
2 Про доводиться одна частина D 2 O . Це співвідношення однаково для річкової, дощової, болотної води, підземних вод чи кристалізаційної води. Тяжка вода використовується як мітка при дослідженні фізіологічних процесів. Так, у сечі людини співвідношення між Н та D теж одно 5000:1. Якщо дати пацієнтові випити воду з великим вмістом D 2 O , то, послідовно вимірюючи частку цієї води у сечі, можна визначити швидкість виведення води з організму. Виявилося, що близько половини випитої води залишається в організмі навіть через 15 діб. Тяжка вода, вірніше, дейтерій, що входить до її складу, важливий учасник реакцій ядерного синтезу.Третій ізотоп водню - тритій, що позначається символом Т. На відміну від перших двох він радіоактивний і виявлений у природі лише в малих кількостях. У прісноводних озерах співвідношення між ним та звичайним воднем дорівнює 1:10
18 , у поверхневих водах 1:10 19 У глибинних водах він відсутній.Див. такожВОДОРОД. ЛІД Лід, тверда фаза води, використовується в основному як холодоагент. Він може перебувати в рівновазі з рідкою та газоподібною фазами або тільки з газоподібною фазою. Товстий шар льоду має блакитний колір, що пов'язано з особливостями заломлення ним світла. Стиснення льоду дуже низька.Лід при нормальному тиску існує лише за температури 0
° З або нижче і має меншу щільність, ніж холодна вода. Саме тому айсберги плавають у воді. При цьому, оскільки відношення щільностей льоду та води при 0° З постійно, лід завжди виступає з води на певну частину, а саме на 1/5 свого обсягу.Див. такожАЙСБЕРГИ. ПАР Пара газоподібна фаза води. Всупереч загальноприйнятій думці, він невидимий. Той «пар», який виривається з киплячого чайника, це насправді безліч дрібних крапельок води. Пара має властивості, дуже важливі для підтримки життя на Землі. Добре відомо, наприклад, що під дією сонячного тепла вода з поверхні морів та океанів випаровується. Водяні пари, що утворюються, піднімаються в атмосферу і конденсуються, а потім випадають на землю у вигляді дощу і снігу. Без такого кругообігу води наша планета давно перетворилася б на пустелю.Пара має безліч застосувань. З одними ми добре знайомі, про інших лише чули. Серед найбільш відомих пристроїв і механізмів, що працюють із застосуванням пари, праски, паровози, пароплави, парові котли. Пара обертає турбіни генераторів на теплових електростанціях.
Див. такожКОТЕЛЬ ПАРОВИЙ; ДВИГУН ТЕПЛОВИЙ;ТЕПЛОТА; Термодинаміка.ЛІТЕРАТУРА Ейзенберг Д., Кауцман Ст.Структура та властивості води . Л., 1975Зацепіна Г.М. Фізичні властивості та структура води . М., 1987
Тривимірний стан рідкої води важко дослідити, але багато чого було вивчено шляхом аналізу структури кристалів льоду. Чотири сусідні атоми кисню з водневою взаємодією займають вершини тетраедра (тетра = чотири, гедрон = площина). Середня енергія, необхідна для руйнування такого зв'язку в льоду, оцінюється в 23 кДж/моль-1.
Здатність молекул води утворювати цю кількість водневих ланцюгів, а також зазначена міцність створює надзвичайно високу температуру плавлення. Коли він тане, то утримується рідкою водою, структура якої нерегулярна. Більшість водневих зв'язків спотворюється. Для руйнування кристалічних ґрат льоду з водневим зв'язком потрібна велика маса енергії у вигляді тепла.
Особливості появи льоду (Ih)
Багато хто з обивателів задають питання про те, які кристалічні грати біля льоду. Слід зазначити, що щільність більшості речовин зростає при заморожуванні, коли молекулярні рухи уповільнюються і утворюються щільно упаковані кристали. Щільність води також збільшується, коли вона остигає до досягнення максимуму при 4°C (277K). Потім, коли температура опускається нижче за це значення, вона розширюється.
Це збільшення обумовлено утворенням відкритого воднево-зв'язаного кристала льоду з його гратами і меншою щільністю, в якому кожна молекула води жорстко пов'язана зазначеним вище елементом і чотирма іншими значеннями, і при цьому рухається досить швидко, щоб мати більшу масу. Оскільки відбувається подібна дія, рідина замерзає зверху донизу. Це має важливі біологічні результати, внаслідок яких шар льоду на ставку ізолює живих істот подалі від сильного холоду. Крім того, дві додаткові властивості води пов'язані з його водневими характеристиками: питомою теплоємністю та випаром.
Детальний опис структур
Перший критерій є кількість, необхідне підвищення температури 1 грама речовини на 1°С. Для підвищення градусів води потрібно відносно більша частина тепла, тому що кожна молекула бере участь у численних водневих зв'язках, які повинні бути зруйновані, щоб кінетична енергія збільшувалася. До речі, велика кількість H 2 O у клітинах і тканинах всіх великих багатоклітинних організмів означає, що флуктуація температури всередині клітин зведена до мінімуму. Ця особливість має вирішальне значення, оскільки швидкість більшості біохімічних реакцій є чутливою.
Також значно вища, ніж у багатьох інших рідин. Для перетворення цього тіла на газ потрібна велика кількість тепла, тому що водневі зв'язки повинні бути зруйновані, щоб молекули води могли дислокуватися одна від одної та увійти у вказану фазу. Змінювані тіла є постійні диполі і можуть взаємодіяти з іншими подібними сполуками і тими, що іонізуються і розчиняються.
Інші речовини, зазначені вище, можуть вступати в контакт лише за наявності полярності. Саме така сполука бере участь у будові цих елементів. Крім того, воно може вирівнюватись навколо цих частинок, утворених з електролітів, так що негативні атоми кисню молекул води орієнтовані на катіони, а позитивні іони та атоми водню, орієнтовані на аніони.
Утворюються, як правило, молекулярні кристалічні решітки та атомні. Тобто, якщо йод побудований таким чином, що в ньому присутній I 2 , то в твердому діоксиді вуглецю, тобто в сухому льоді, у вузлах кристалічної решітки знаходяться молекули CO 2 . При взаємодії з подібними речовинами, іонні кристалічні грати має лід. Графіт, наприклад, що володіє атомною структурою, в основі якої вуглець, не здатний її змінювати, так само як і алмаз.
Що відбувається, коли кристал столової солі розчиняється у воді: полярні молекули притягуються до заряджених елементів у кристалі, що призводить до утворення подібних частинок натрію та хлориду на його поверхні, в результаті ці тіла дислокуються один від одного, і він починає розчинятися. Звідси можна спостерігати, що крига має кристалічну решітку з іонним зв'язком. Кожен розчинений Na + притягує негативні кінці кількох молекул води, тоді як кожен розчинений Cl притягує позитивні кінці. Оболонка, що оточує кожен іон, називається сферою порятунку і зазвичай містить кілька шарів частинок розчинника.

Кажуть, що змінні чи іон, оточені елементами, є сульфатованими. Коли розчинником є вода, такі частинки гідратуються. Таким чином, будь-яка полярна молекула має тенденцію до сольватації елементами рідкого тіла. У сухого льоду тип кристалічних ґрат утворює в агрегатному стані атомні зв'язки, які незмінні. Інша річ кристалічний лід (заморожена вода). Іонні органічні сполуки, такі як карбоксилази та протоновані аміни, повинні мати розчинність у гідроксильній та карбонільній групах. Частинки, які у таких структурах, рухаються між молекулами, причому їх полярні системи утворюють водневі зв'язку з цим тілом.
Звичайно, кількість останніх зазначених груп у молекулі впливає на її розчинність, яка також залежить від реакції різних структур в елементі: наприклад, одно-, дво- і трьох вуглецеві спирти змішуються з водою, але більші вуглеводні з одиночними гідроксильними сполуками набагато менш розбавляються в рідини.
Шестикутний Ih схожий формою з атомною кристалічною решіткою. Біля льоду та всього природного снігу на Землі вона виглядає саме так. Про це свідчить симетрія кристалічних ґрат льоду, вирощена з водяної пари (тобто сніжинок). Знаходиться в космічній групі P 63/мм із 194; D 6h, класу Лауе 6/мм; аналогічний β-, що має кратну 6-ти гвинтову вісь (обертання навколо на додаток до зсуву вздовж неї). Він має досить відкриту структуру з низькою щільністю, де ефективність низька (~ 1/3) порівняно з простими кубічними (~ 1/2) або гранецентрованими кубічними (~ 3/4) структурами.
Порівняно зі звичайним льодом, кристалічні грати сухого льоду, пов'язані молекулами CO 2 , статичні і змінюються лише за розпаду атомів.

Опис решіток та елементів, що входять до них
Кристали можна розглядати як кристалічні моделі, що складаються з листів, розташованих один над одним. Водневий зв'язок упорядкований, тоді як насправді він випадковий, оскільки протони можуть переміщатися між молекулами води (льоду) при температурах вище приблизно 5 К. Дійсно, цілком ймовірно, що протони поводяться як квантова рідина в постійному тунельованому потоці. Це посилюється розсіюванням нейтронів, що показують щільність їхнього розсіювання на півдорозі між атомами кисню, що вказує на локалізацію та узгоджений рух. Тут спостерігається схожість льоду з атомними, молекулярними кристалічними ґратами.
Молекули мають ступінчасте розташування водневого ланцюга по відношенню до трьох своїх сусідів у площині. Четвертий елемент має затьмарене розташування водневого зв'язку. Існує невелике відхилення від ідеальної шестикутної симетрії як на 0,3% коротше в напрямку цього ланцюга. Усі молекули відчувають однакові молекулярні середовища. Усередині кожної "коробки" достатньо місця для утримання частинок інтерстиціальної води. Хоча це, як правило, не вважається, нещодавно вони були ефективно виявлені нейтронною дифракцією порошкоподібними кристалічними гратами льоду.
Зміна речовин
Шестикутне тіло має потрійні точки з рідкою та газоподібною водою 0,01°C, 612 Па, твердими елементами - три -21,985°C, 209,9 МПа, одинадцять та два -199,8°C, 70 МПа, а також -34 ,7 ° C, 212,9 МПа. Діелектрична проникність гексагонального льоду становить 97,5.
Крива плавлення цього елемента надається МПа. Рівняння стану доступні, крім них, деякі прості нерівності, що пов'язують зміну фізичних властивостей з температурою гексагонального льоду та його водних суспензій. Твердість коливається в залежності від градусів, що зростають приблизно від або нижче гіпсу (≤2) при 0°С, до рівня польового шпату (6 за -80°С, аномально велика зміна абсолютної твердості (> 24 рази)).
Шестикутна кристалічна решітка льоду утворює гексагональні пластини і стовпці, де верхня і нижня грані є базальними площинами (0 0 0 1) з ентальпією 5,57 мкДж · см -2 а інші еквівалентні бічні називаються частинами призми (1 0 -1 0 5,94 мкДж · см -2. Вторинні поверхні (1 1 -2 0) з 6.90 μJ - см -2 можуть бути сформовані по площинах, утвореними сторонами структур.
Подібна будова показує аномальне зменшення теплопровідності зі збільшенням тиску (як кубічний, і аморфний лід низької щільності), але відрізняється від більшості кристалів. Це пов'язано із зміною водневого зв'язку, що зменшує поперечну швидкість звуку в кристалічній решітці льоду та води.
Існують методи, що описують, як підготувати великі зразки кристала та будь-яку бажану поверхню льоду. Передбачається, що водневий зв'язок на поверхні гексагонального досліджуваного тіла буде більш упорядкованим, ніж усередині об'ємної системи. Варіаційна спектроскопія з генерацією по частоті коливань з фазовими гратами показала, що існує структурна асиметрія між двома верхніми шарами (L1 і L2) в підповерхневому ланцюгу HO базальної поверхні гексагонального льоду. Прийняті водневі зв'язки у верхніх шарах шестикутниках (L1O···HO L2) сильніше, ніж прийняті у другому шарі до верхнього накопичення (L1OH···OL2). Доступні інтерактивні структури гексагонального льоду.

Особливості розвитку
Мінімальна кількість молекул води, необхідних для зародження льоду, приблизно 275 ± 25, як і для повного ікосаедричного кластера 280. Освіта відбувається з коефіцієнтом 1010 на поверхні розділу повітря-вода, а не в об'ємній воді. Зростання кристалів льоду залежить від різних темпів зростання різних енергій. Вода повинна бути захищена від замерзання при кріоконсервуванні біологічних зразків, їжі та органів.
Зазвичай це досягається швидкими швидкостями охолодження, використанням невеликих зразків та кріо консерватора, а також збільшенням тиску для утворення зародків льоду та запобігання пошкодженню клітин. Вільна енергія льоду/рідини збільшується від ~ 30 мДж/м 2 при атмосферному тиску до 40 мДж/м -2 при 200 МПа, що вказує на причину, через яку відбувається подібний ефект.
Як альтернатива, вони можуть рости швидше з поверхонь призми (S2), на випадково порушеній поверхні швидкозаморожених або схвильованих озер. Зростання від граней (1 1 -2 0), по крайнього заходу, той самий, але перетворює в підстави призми. Дані розвитку кристала льоду були повністю досліджені. Відносні швидкості зростання елементів різних граней залежать від здатності утворювати велику міру спільної гідратації. Температура (низька) навколишньої води визначає ступінь розгалуження кристалі льоду. Зростання часток обмежується швидкістю дифузії за низького ступеня переохолодження, тобто<2 ° C, что приводит к большему их количеству.

Але обмежено кінетикою розвитку за більш високих рівнях зниження градусів >4°C, що зумовлює голчастому зростанню. Ця форма схожа з будовою сухого льоду (має кристалічну решітку із шестикутною структурою), різними характеристиками розвитку поверхні та температурою навколишньої (переохолодженої) води, яка знаходиться за плоскими формами сніжинок.
Зародження льоду в атмосфері глибоко впливає на утворення та властивості хмар. Польові шпати, виявлені в пустельному пилу, який потрапляє в атмосферу мільйонами тонн на рік, є важливими утворювачами. Комп'ютерне моделювання показало, що це зародження площин призматичних кристалів льоду на площинах поверхні високих енергій.
Деякі інші елементи та решітки
Розчинені речовини (за винятком дуже невеликого гелію та водню, які можуть входити до міжвузля) не можуть бути включені до структури Ih при атмосферному тиску, але витісняються на поверхню або аморфний шар між частинками мікрокристалічного тіла. У вузлах кристалічних ґрат сухого льоду знаходяться деякі інші елементи: хаотропні іони, такі як NH 4 + і Cl - , які включені в легше заморожування рідини, ніж інші коробопні, такі як Na + і SO 4 2- , тому видалення їх неможливе, через те, що вони утворюють тонку плівку з рідини, що залишилася між кристалами. Це може призвести до електричної зарядки поверхні через дисоціацію поверхневої води, що врівноважує заряди, що залишилися (що також може призвести до магнітного випромінювання) і зміни рН залишкових рідких плівок, наприклад, NH 4 2 SO 4 стає більш кислим і NaCl стає більш лужним.
Вони перпендикулярні граням кристалічних ґрат льоду, що показує приєднаний наступний шар (з атомами О-чорний). Їм характерна базальна поверхня, що повільно зростає (0 0 0 1), де прикріплюються тільки ізольовані молекули води. Поверхня призми, що швидко зростає (1 0 -1 0), де пари новоприєднаних частинок можуть зв'язуватися один з одним воднем (одна його зв'язок/дві молекули елемента). Грань, що найбільш швидко зростає (1 1 -2 0) (вторинна призматика), де ланцюжки знову приєднаних частинок можуть взаємодіяти один з одним водневим зв'язком. Один її ланцюжок/молекула елемента - це форма, що утворює хребти, які ділять і заохочують перетворення на дві сторони призми.

Ентропія нульової точки
k Bˣ Ln ( N
Вчені та їх праці у цій сфері
Може бути визначена як S 0 = k Bˣ Ln ( N E0), де k B - це стала Больцмана, N E - це число змін при енергії E, а E0 - найменша енергія. Це значення для ентропії гексагонального льоду при нульовому кельвіні не порушує третій закон термодинаміки «Ентропія ідеального кристала при абсолютному нулі рівно дорівнює нулю», оскільки ці елементи і частинки не ідеальні, мають неупорядковане водневе зв'язування.
У цьому тілі водневий зв'язок є випадковим і швидко змінюється. Ці структури не точно рівні за енергією, а поширюються на дуже велику кількість енергетично близьких станів, підкоряються «правилам льоду». Ентропія нульової точки - це безлад, який залишався б, навіть якщо матеріал міг би бути охолоджений до абсолютного нуля (0 K = -273,15°C). Породжує експериментальну плутанину для гексагонального льоду 3,41 (± 0,2) - моль -1 - K -1 . Теоретично, можна було б обчислити нульову ентропію відомих крижаних кристалів зі значно більшою точністю (нехтуючи дефектами та розкидом енергетичних рівнів), ніж визначити її експериментально.

Хоча порядок протонів в об'ємному льоду не впорядкований, поверхня, ймовірно, віддає перевагу порядку зазначених частинок у вигляді смуг Н-атомів, що звисають, і О-одинакових пар (нульова ентропія з упорядкованими водневими зв'язками). Знайдено безлад нульової точки ZPE, J mol -1 K -1 та інших. З усього вищевикладеного видно і зрозуміло, які типи кристалічних ґрат характерні для льоду.
Варіант №1.
1. Чи відрізняються одна від одної молекули льоду та води?
1) вони однакові; 2) молекула льоду холодніша; 3) молекула льоду менша;
4) молекула води менша
2. Що таке дифузія?
Молекулами іншого; 3) хаотичний рух молекул речовини;
4) перемішування речовин
4. При охолодженні речовини молекули рухаються:
Роду речовини
5. Швидкість руху молекул водню збільшилась. При цьому
Температура …
Відповіді немає
6. Якщо перелити воду зі склянки у тарілку, то …
Форма та обсяг
7. У якій воді дифузія відбувається швидше?
Відбувається
8. У яких речовинах дифузія відбувається повільніше при оді-
На яких умовах?
Усі речовини
9. Молекули речовини розташовані на великих відстанях,
Сильно притягуються та коливаються біля положення рівноваги
Ця речовина …
1) газоподібне; 2) рідке; 3) тверде; 4) такої речовини не існує
Варіант №2.
1. Чи відрізняються одна від одної молекули льоду та водяної пари?
1) молекула льоду холодніша; 2) вони однакові; 3) молекула льоду
Менше; 4) молекула льоду більша
2. Дифузія – це …
1) проникнення молекул однієї речовини в молекули іншої;
2) проникнення молекул однієї речовини у проміжки між
Молекулами іншого; 3) хаотичний рух молекул реч-
; 4) перемішування речовин
3. Між молекулами будь-якої речовини існує:
1) взаємне тяжіння; 2) взаємне відштовхування; 3) взаємне
Притягнення та відштовхування; 4) у різних речовин по-різному
4. При нагріванні води молекули рухаються:
1) з тією самою швидкістю; 2) повільніше; 3) швидше; 4) залежить від
Роду речовини
5. Швидкість руху молекул кисню зменшилась. При цьому
Температура …
1) не змінилася; 2) знизилася; 3) підвищилася; 4) правильного
Відповіді немає
6. Якщо перелити воду з тарілки у склянку, то …
1) зміниться форма та обсяг води; 2) форма зміниться, обсяг зі-
Зберігається; 3) форма збережеться, обсяг зміниться; 4) збережеться
Обсяг та форма
7. У якій воді дифузія відбувається повільніше?
1) у холодній; 2) у гарячій; 3) однаково; 4) дифузія у воді не
Відбувається
8. У яких речовинах дифузія відбувається швидше при однаково-
Вих умовах?
1) у газоподібних; 2) у рідких; 3) у твердих; 4) однаково
Усі речовини
9. Молекули речовини розташовані на малих відстанях, сильно
Притягуються та коливаються біля положення рівноваги. Це
Речовина.
1) газоподібне; 2) рідке; 3) тверде; 4) такої речовини не
Існує
В. В. Махрова, ГС(К)ОУ С(К)ОШ (VII виду) N 561, Санкт - Петербург