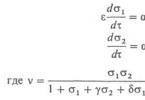kde a n , b n sú expanzné koeficienty funkcie c(t) v rad (amplitúdy jednotlivých harmonických zložiek), A n sú komplexné amplitúdy, w - frekvencia kmitov (i - imaginárna jednotka). Vo všeobecnosti sa amplitúdy a frekvencie kmitov môžu meniť v čase (utlmené, rastúce, modulované kmity). výkyvy medzi nimi. spoj. môžu byť neperiodické alebo mať spojité spektrum.
výkyvy medzi nimi. spoj. - pomerne zriedkavý jav pozorovaný v priebehu niektorých zložitých p-ónov. Elementárna chem. okresy sú relaxaty. procesy, ktoré poskytujú monotónnu aproximáciu reagujúceho systému k termodynamickému stavu. . Pre výskyt kmitov počas homog. izotermický r-tion musí mať interval. spoj. a interakciu medzi nimi. Existujú stacionárne stavy, v ktorých c(i) i-tého intervalu. spoj. nezávisí od času (s i =c 0 i). Pre malé odchýlky systému od stacionárneho stavu je zmena c i opísaná súčtom exponenciál s komplexnými ukazovateľmi:
Hodnoty l i = g i + i w volal som charakteristický čísla. V neochvejnom. trvalo udržateľných systémov l som negatívny a skutočný ( gi<0,
w
i=0). V týchto prípadoch zvyčajne namiesto l používam časy ti = 1/1 ja Ak je stacionárny stav dostatočne blízky termodynamickému stavu. (vzťahy Onsagerovej reciprocity platia, pozri ), potom všetko l som skutočný a negatívny (). V tomto prípade sa systém približuje k stacionárnemu stavu bez oscilácií. V silne nerovnovážnych systémoch l i sa môžu stať komplexnými číslami, čo zodpovedá výskytu oscilácií v blízkosti stacionárneho stavu. Pri určitých hodnotách parametrov silne nerovnovážneho systému (počiatočný, t-ry atď.) môže stacionárny stav stratiť stabilitu. Strata stability stacionárneho stavu je špeciálnym prípadom bifurkácie, t.j. sa mení pri určitej (rozdvojenosti) hodnote c.-l. číslo alebo typ parameter diff. kinetická systémové režimy. Existujú dva najjednoduchšie prípady bifurkácie stabilného stacionárneho stavu. V prvom prípade jeden l stávam sa pozitívnym. Zároveň v bode rozdvojenia ( l i = 0) pôvodne stabilný stav sa stáva nestabilným alebo sa spája s nestabilným stacionárnym stavom a zmizne a systém prechádza do nového stabilného stavu. V priestore parametrov sa v blízkosti tejto bifurkácie nachádza oblasť, kde má systém aspoň tri stacionárne stavy, z ktorých dva sú stabilné a jeden nestabilný. Funguje to v druhom prípade. súčasťou jednej komplexnej charakteristiky. čísla sa stanú kladnými. V tomto prípade vznikajú stabilné kmity v blízkosti stacionárneho stavu, ktorý stratil svoju stabilitu. Po prejdení bifurkačného bodu s ďalšou zmenou parametra kvantity sa charakteristiky kmitov (frekvencia, amplitúda atď.) môžu výrazne zmeniť, ale kvality. typ správania systému je zachovaný. V chem. systémy nestability môžu vzniknúť v dôsledku zrýchlenia okresu jeho produktmi alebo inými druhmi, substrátom alebo krížovou inhibíciou (pozri), konkurenciou počiatočného in-in pre interval. spoj. a tak ďalej. V neizotermických systémov, príčinou nestability môže byť exotermické samozrýchľovanie. etapách okresu, a v elektrochemickom. p-tions exponenciálna závislosť rýchlosti p-tionu od . Vzhľad najjednoduchších nestabilít a zodpovedajúca kinetika. je vhodné vysvetliť stavy systému na príklade enzymatického p-tionu s dvojkou
S1 a S2, z ktorých jeden je napr. S1 inhibuje E:
S 01 D S 1 S 02 D S 2 S 1 +E 1 D S 1 E S 1 E+S 2 D S 1 E :
P S 1 E+S 1 D S 1 S 1 E
Si a S2 môžu vstúpiť do systému zvonku (napr. v dôsledku prítoku v prietokovom reaktore alebo cez) alebo sa môžu vytvoriť ako výsledok pomalého homogovania. p-tions S 0i D Si (i=1,2); prebieha aj odvoz produktu P, ktorý neovplyvňuje chod revíru. S1E, S1S2E a S1S1E - komplexy enzým-substrát; vzniká v dôsledku tvorby neaktívneho komplexu S 1 S 1 E. V tomto systéme je 6 dynamických. premenné: a , [E] a dekomp. formy komplexov enzým-substrát a [E] + ++=e - úplné. Zvyčajne napr<< и e<<, поэтому можно применить и представить фермент-субстратных комплексов как алгебраич. ф-ции . В результате поведение системы можно описать двумя дифференц. ур-ниями относительно и . Удобно использовать безразмерные переменные
s1 =/K1 a s2 =/K 2 (K 1 a K 2 - Michaelis), parametre a 1 a a 2 - miery príchodu, ako aj bezrozmerné kombinácie základných etáp e, b, g, d, ( a bezrozmerný čas t . Potom dif. ur-niya má podobu:

Zoberme si prípad, keď má tento systém dva stabilné stacionárne stavy - bistabilný systém alebo spúšťač. Ak a 2 >> a 1 / e , t.j. rýchlosť p-tion S 02 D S 2 je veľmi veľký v porovnaní s rýchlosťou p-tionu S 01 D S 1 a rýchlosť enzymatického p-tiónu, potom je konštantná a rovná sa . V tomto prípade je správanie systému opísané iba jednou rovnicou (3.1). Závislosti d s l / d t od s 1 pri rôznych hodnotách a 1 sú znázornené na obr. 1, a. Bodkované krivky zodpovedajú rozdvojeniu. hodnoty parametrov a-a" 1 a a : 1 a medzi nimi uzavreté krivky pretínajú os x trikrát. Priesečníky zodpovedajú stacionárnym stavom s 1 01, s 1 02 a s 1 03 , ktorých priemer s 1 02 je nestabilný a oddeľuje príťažlivé oblasti stabilných štátov s 1 01 
Ryža. 1. Enzymatický systém s tromi stacionárnymi stavmi (biochemický spúšťač): a závislosť od rýchlosti d s 1 /d t zmena bezrozmerného S 1 od jeho hodnoty ( s 1 ) pri rozdiele rýchlosti ( 1 ) príjmy ; bodkovaná čiara označuje krivky zodpovedajúce bifurkáciám. hodnoty a "1 a "" 1; 6 - závislosť stacionárnych hodnôt s 01 od 1; s 1 01 a s 1 0 3 sú stabilné, s 1 0 2 - nestabilné stacionárne stavy.
a s 10 3. Na krivke závislosti stacionár s 1 0 od 1 (obr. 1, b) oblasť s tromi stacionárnymi stavmi leží v intervale ( a "1, a "" 1). S pomalou zmenou parametra vpred a vzad 1 systém sa pohybuje po rôznych trajektóriách, t.j. hysteréza. Treba si uvedomiť, že opísanú bistabilitu možno získať v systéme s jednosubstrátovým p-tionom, ktorý sa správa podobne ako dvojsubstrátový p-tion s fixom. jeden z .
Aby sa systém s jednou premennou a bistabilitou stal oscilačným, je potrebné zmeniť parameter na pomalú premennú. V enzymatickom systéme s dvoma takýmito parametrami je samozrejme druhý s 2. V tomto prípade musia byť na opis systému použité obe rovnice (3). Relatívne zmeny S 2 ( D /) bude pomalý v porovnaní s relatívnymi zmenami v S l, ak >>. Pri prechode na bezrozmerné parametre má táto podmienka nasledujúcu podobu: a 1 ~ a 2 ~ 1, napr <<1. На фазовой плоскости с координатами
s1,s 2 správanie systému je kvalitatívne určené vzájomným usporiadaním nula-izoklinických kriviek, na ktorých sú derivácie d s1/dt a ds2/dt sú rovné 0 (obr. 2, a). Priesečníky s nulovou izoklinou zodpovedajú stacionárnym stavom systému. Bodkovaná čiara znázorňuje polohu nulovej izokliny d s 1 /d t = 0 pri bifurkácii sprevádzanej objavením sa stabilných kmitov (samooscilácií) s malou amplitúdou. Tieto oscilácie zodpovedajú uzavretej trajektórii systému – tzv. limitný cyklus. Plné čiary znázorňujú nulové izokliny v situácii ďaleko od bifurkácie, keď jediný stacionárny stav systému (bod O na obr. 2, a) je vysoko nestabilný a je obklopený limitným cyklom ABCD. Pohyb systému pozdĺž tohto limitného cyklu zodpovedá vlastným osciláciám s 1 a s 2 s veľkou amplitúdou (pozri obr. 2, b).

Ryža. 2. Vlastné kmity (stabilné kmity) v modelovom enzymatickom systéme: rovina a-fázy v súradniciach s 1 - s 2 s nulovými izoklinami d s 1 /d t \u003d 0, d s 2 /d t =0; bodkovaná čiara znázorňuje polohu nulovej izokliny d s 1 /d t =0, čo zodpovedá kolísaniu. bifurkácie a malý limitný cyklus obklopujúci nestabilný stacionárny stav O, ABCD veľký limitný cyklus; b - vlastné oscilácie s 1 a s 2 zodpovedajúce veľkému limitnému cyklu ABCD.
Počas oscilácie pozorované periodické. kolísanie dif. tvary: sínusový, pílový, pravouhlý atď.; modulované, kváziperiodické a stochastické. Periódy väčšiny oscilácií ležia v rozmedzí od zlomkov sekundy až po desiatky minút. K osciláciám v kvapalnej fáze patria napríklad H 2 O 2 a S 2 O 4 2-, rozklad. vo vnútri halogén-kyslíkových zlúčenín a. Belousov-Zhabotinsky je dobre študovaný, ide vo vodnom roztoku, kde HBrO 3 oxiduje rozpad s premennou. org. najmä kyselina malónová.
Oscilačné v plynnej fáze boli objavené a študované pre , CO a iné zlúčeniny. Vo všetkých prípadoch ide o objemové stupne p-tionu, ako aj o pretrhnutie a nukleáciu reťazcov na stenách reaktora, ako aj o zrýchlenie p-tiónov v dôsledku zahrievania systému v dôsledku
exotermický etapy (tepelné). Možné čisto termokinetické. samooscilácie, kedy tepelná je jednota, príčina nestability. Najjednoduchší model termokinetiky oscilácie v prietokovom reaktore majú tvar: В 0:
IN :
P + Q. Tu in-in B vstupuje do ideálneho prietokového reaktora, kde nastáva monomolekulárna exotermická reakcia. p-tion rozpadu; uvoľnené teplo sa odvádza cez stenu reaktora. Kinetika tohto okresu je opísaná dvoma diferenciálmi. ur-niami vo vzťahu k B a t-ry T vo vnútri reaktora:

kde [B 0 ] - dané na vstupe do reaktora, T 0 - t-ra steny reaktora, k - koeficient. rýchlosť aktualizácie reakcie zmes v reaktore, h - koeficient. rýchlosť, Q - tepelný účinok p-tionu, C p - pri konštante, r - hustota, E a A -
Vibračné chemické reakcie
V tejto semestrálnej práci sa budem zaoberať špeciálnym prípadom problematického experimentu, oscilačnými chemickými reakciami. Oscilačné reakcie sú celou triedou oxidačných reakcií organických látok za účasti katalyzátora s redoxnými vlastnosťami. Tento proces prebieha cyklicky, to znamená, že pozostáva z viacerých opakovaní.
Vibračné chemické reakcie objavil a vedecky zdôvodnil v roku 1951 sovietsky vedec Boris Petrovič Belousov. B.P. Belousov študoval oxidáciu kyseliny citrónovej počas jej reakcie s bromičnanom sodným v roztoku kyseliny sírovej. Na zvýšenie reakcie pridal do roztoku soľ céru. Cér je kov s premenlivou mocnosťou (3+ alebo 4+), preto môže byť katalyzátorom redoxných premien. Reakciu sprevádza uvoľňovanie bublín CO 2, a preto sa zdá, že celá reakčná zmes "vrie". A na pozadí tohto varu si B.P. Belousov všimol úžasnú vec: farba roztoku sa pravidelne menila - stala sa buď žltou alebo bezfarebnou. Belousovová do roztoku pridala komplex fenantrolínu so železnatým železom (feroínom) a farba roztoku sa začala periodicky meniť z purpurovo-červenej na modrú a späť.
Tak bola objavená reakcia, ktorá sa stala slávnou. Teraz je známa po celom svete, nazýva sa to Belousov-Zhabotinsky reakcia. A. M. Zhabotinsky urobil veľa pre pochopenie tohto úžasného fenoménu. Odvtedy bolo objavených veľké množstvo podobných reakcií.
História objavu oscilačných reakcií.
IP Belousov objavil oscilačnú chemickú reakciu v snahe vytvoriť jednoduchý chemický model niektorých štádií systému kľúčových biochemických premien karboxylových kyselín v bunke. Prvá správa o jeho objavení však nebola zverejnená. Recenzent chemického časopisu pochyboval o zásadnej možnosti reakcie opísanej v článku. Väčšina chemikov v tých rokoch verila, že neexistujú čisto chemické oscilácie, hoci existenciu oscilačných reakcií predpovedal v roku 1910 A. Lotkoy na základe matematickej teórie periodických procesov.
Druhý pokus o zverejnenie výsledkov štúdie urobil vedec v roku 1957 a opäť bol odmietnutý, napriek práci belgického fyzika a fyziochemika I. R. Prigozhina, ktorá sa v tom čase objavila. V týchto prácach bola ukázaná možnosť a pravdepodobnosť oscilačných chemických reakcií.
Až v roku 1959 bol v málo známej publikácii „Collection of Abstracts on Radiation Medicine“ publikovaný krátky abstrakt o objave periodicky pôsobiacej oscilačnej chemickej reakcie B. P. Belousova.
A vec sa má tak, že keď B.P. Belousov urobil svoj objav, periodické zmeny v koncentrácii činidiel sa zdali byť porušením zákonov termodynamiky. V skutočnosti, ako môže ísť reakcia vpred alebo v opačnom smere? Nie je možné si predstaviť, že celý obrovský počet molekúl v nádobe bol v jednom stave, potom v inom (buď všetky „modré“, potom všetky „červené“ ...).
Smer reakcie je určený chemickým (termodynamickým) potenciálom - reakcie prebiehajú v smere pravdepodobnejších stavov, v smere znižovania voľnej energie systému. Keď je reakcia v danom smere ukončená, znamená to, že jej potenciál je vyčerpaný, je dosiahnutá termodynamická rovnováha a bez vynaloženia energie samovoľne nemôže ísť proces opačným smerom. A potom ... reakcia ide jedným alebo druhým smerom.
V tejto reakcii však k porušeniu zákonov nedošlo. Dochádzalo k výkyvom - periodickým zmenám - v koncentráciách medziproduktov, a nie v počiatočných reaktantoch alebo konečných produktoch. CO 2 sa pri tejto reakcii nepremení na kyselinu citrónovú, to je vlastne nemožné. Recenzenti nebrali do úvahy, že hoci systém má ďaleko od rovnováhy, môže sa v ňom udiať veľa úžasných vecí. Podrobné trajektórie systému od jeho počiatočného stavu po konečný stav môžu byť veľmi zložité. Až v posledných desaťročiach sa termodynamika systémov vzdialených od rovnováhy začala zaoberať týmito problémami. Táto nová veda sa stala základom novej vedy – synergetiky (teória samoorganizácie).
Belousovovu reakciu, ako bolo uvedené vyššie, podrobne študoval A. M. Zhabotinsky a jeho kolegovia. Kyselinu citrónovú nahradili kyselinou malónovou. Oxidácia kyseliny malónovej nie je sprevádzaná tvorbou bublín CO 2, takže zmena farby roztoku môže byť zaznamenaná bez rušenia fotoelektrickými zariadeniami. Neskôr sa ukázalo, že ako katalyzátor tejto reakcie slúži feroín bez céru. B. P. Belousov si už v prvých pokusoch všimol ďalšiu pozoruhodnú vlastnosť svojej reakcie: pri zastavení miešania sa zmena farby v roztoku šíri vo vlnách. Toto šírenie chemických vibrácií vo vesmíre sa stalo obzvlášť evidentným, keď v roku 1970 A. M. Zhabotinsky a A. N. Zaikin naliali tenkú vrstvu reakčnej zmesi do Petriho misky. V pohári sa tvoria bizarné obrazce - sústredné kruhy, špirály, "víry" šíriace sa rýchlosťou asi 1 mm/min. Chemické vlny majú množstvo nezvyčajných vlastností. Takže keď sa zrazia, zhasnú a nemôžu prejsť cez seba.
Ministerstvo školstva, vedy, mládeže a športu
Teoretické lýceum Petru Movilă
oddelenie
"Schopnosť, práca, talent"
Cvičenie z chémie na tému:
"Vibračné chemické reakcie"
Vyplnil: žiak ročníka 12A
Bolyubash Irina
Prednáša: Snidchenko M.A.
* Kišiňov, 2007 *
1. Úvod:
a) Redoxné reakcie
b) Vibračné chemické reakcie
2. História objavu oscilačných reakcií:
a) Štúdie kolísania koncentrácie pred objavom
reakcie B. P. Belousovovej
3. Teoretická časť:
a) Matematický model A. Lotku
b) Štúdium mechanizmu oscilačných reakcií
4. Experimentálna časť
5. Záver
6. Aplikácia:
a) Recepty na niektoré oscilačné reakcie
b) Ilustrácie uskutočnených experimentov
7. Literatúra
Úvod.
Chémia je experimentálna veda. A preto experiment ako metóda vedeckého bádania dlhodobo pevne zaujíma popredné miesto medzi metódami prírodných vied. Experiment je najdôležitejším spôsobom, ako prepojiť teóriu s praxou vo vyučovaní chémie a premeniť vedomosti na presvedčenia. Preto je odhalenie kognitívneho významu každej skúsenosti hlavnou požiadavkou na chemický experiment.
Prebieha experiment (otlat. "experiment" - "skúška") pochopiť pozorovanie skúmaného javu za určitých podmienok, čo vám umožní sledovať priebeh tohto javu a zopakovať ho za týchto podmienok. Chemický experiment zaujíma dôležité miesto vo vyučovaní chémie, keďže prostredníctvom pozorovaní a experimentov sa pozná rôznorodosť povahy látok, zhromažďujú sa fakty na porovnávanie, zovšeobecňovanie a závery.
Vykonávaním experimentov a pozorovaním chemických premien za rôznych podmienok sme presvedčení, že zložité chemické procesy je možné kontrolovať, že v javoch nie je nič tajomné, riadia sa prírodnými zákonmi, ktorých znalosť umožňuje široké využitie chemických premien v praktickej ľudskej činnosti. .
Výsledky niektorých chemických experimentov sú však neočakávané a nezapadajú do tradičných predstáv o vlastnostiach látok či vzorcoch chemických reakcií. Takéto chemické transformácie sa nazývajú problémové experimenty.
Už v dobe antiky filozofi verili, že každé poznanie začína prekvapením. Prekvapenie spôsobené novým vedie k rozvoju zvedavosti (citlivosti na problémy v okolitom svete) s následným formovaním stabilného záujmu o niečo. Prekvapenie a po ňom túžba po poznaní - to je úrodná pôda pre štúdium problémového experimentu, formovanie dialektického a systémového myslenia a odhalenie tvorivého potenciálu.
Rovnaký stav môže spôsobiť jasný, pôsobivý chemický experiment (problémový experiment). V chémii sú príčinou problematických experimentov najčastejšie redoxné reakcie.
Redoxné reakcie
Existuje mnoho kritérií na klasifikáciu chemických reakcií. Jedným z najdôležitejších je znak zmeny oxidačných stavov prvkov. V závislosti od toho, či sa oxidačné stavy prvkov menia alebo zostávajú, možno chemické reakcie rozdeliť na redoxné reakcie a tie, ktoré prebiehajú bez zmeny oxidačných stavov.
Reakcie, ktoré sa vyskytujú pri zmene oxidačných stavov prvkov (redox), sú všeobecne známe. Zohrávajú dôležitú úlohu v technike a prírode, sú základom látkovej premeny v živých organizmoch, súvisia s procesmi oxidácie, hniloby, fermentácie, fotosyntézy. Procesy oxidácie (a redukcie) sa vyskytujú pri spaľovaní paliva, korózii kovov, elektrolýze, s ich pomocou sa získavajú kovy, amoniak, alkálie a mnoho ďalších cenných produktov. Preto štúdium redoxných reakcií zabezpečujú školské kurzy anorganickej a organickej chémie.
Pripomeňme si hlavné ustanovenia spojené s konceptom redoxných reakcií.
Oxidačný stav zodpovedá náboju, ktorý by sa objavil na atóme daného prvku v chemickej zlúčenine za predpokladu, že všetky elektrónové páry, cez ktoré je tento atóm spojený s inými, sú úplne vytesnené do atómov prvkov s väčšou elektronegativitou.
Oxidačné činidlo- látka obsahujúca atómy alebo ióny, ktoré prijímajú elektróny: Xm (oxidačné činidlo) + ne- = X(m-n) , kde m je oxidačný stav prvku vo východiskovej látke, n je počet elektrónov.
Redukčné činidlo- látka obsahujúca atómy alebo ióny, ktoré darujú elektróny: Ym (redukčné činidlo) - ne-= Y(m+n) .
Oxidácia- proces odovzdávania elektrónov atómom, molekulou alebo iónom, pričom sa zvyšuje oxidačný stav prvku.
zotavenie- proces prijímania elektrónov atómom, molekulou alebo iónom, pričom oxidačný stav prvku klesá.
Oxidácia a redukcia sú konjugované procesy, počet elektrónov daný redukčným činidlom v procese jeho oxidácie sa vždy rovná počtu elektrónov prijatých oxidačným činidlom v procese jeho redukcie.
Vibračné chemické reakcie
V tejto semestrálnej práci sa budem zaoberať špeciálnym prípadom problematického experimentu, oscilačnými chemickými reakciami. Oscilačné reakcie sú celou triedou oxidačných reakcií organických látok za účasti katalyzátora s redoxnými vlastnosťami. Tento proces prebieha cyklicky, to znamená, že pozostáva z viacerých opakovaní.
Vibračné chemické reakcie objavil a vedecky zdôvodnil v roku 1951 sovietsky vedec Boris Petrovič Belousov. B.P. Belousov študoval oxidáciu kyseliny citrónovej počas jej reakcie s bromičnanom sodným v roztoku kyseliny sírovej. Na zvýšenie reakcie pridal do roztoku soľ céru. Cér je kov s premenlivou mocnosťou (3+ alebo 4+), preto môže byť katalyzátorom redoxných premien. Reakciu sprevádza uvoľňovanie bublín CO2, a preto sa zdá, že celá reakčná zmes „vrie“. A na pozadí tohto varu si B.P. Belousov všimol úžasnú vec: farba roztoku sa pravidelne menila - stala sa buď žltou alebo bezfarebnou. Belousovová do roztoku pridala komplexfenantrolín so železnatým železom (feroínom) a farba roztoku sa začala periodicky meniť z fialovočervenej na modrú a späť.
Tak bola objavená reakcia, ktorá sa stala slávnou. Teraz je známa po celom svete, nazýva sa to Belousov-Zhabotinsky reakcia. A. M. Zhabotinsky urobil veľa pre pochopenie tohto úžasného fenoménu. Odvtedy bolo objavených veľké množstvo podobných reakcií.
História objavu oscilačných reakcií.
I. P. Belousov uskutočnil objav oscilačnej chemickej reakcie pri pokuse o vytvorenie jednoduchého chemického modelu niektorých štádií systému kľúčových biochemických premien karboxylových kyselín v bunke. Prvá správa o jeho objavení však nebola zverejnená. Recenzent chemického časopisu pochyboval o zásadnej možnosti reakcie opísanej v článku. Väčšina chemikov v tých rokoch verila, že neexistujú čisto chemické oscilácie, hoci existenciu oscilačných reakcií predpovedal v roku 1910 A. Lotkoy na základe matematickej teórie periodických procesov.
Druhý pokus o zverejnenie výsledkov štúdie urobil vedec v roku 1957 a opäť bol odmietnutý, napriek práci belgického fyzika a fyziochemika I. R. Prigozhina, ktorá sa v tom čase objavila. Tieto práce ukázali možnosť a pravdepodobnosť oscilačných chemických reakcií.
Až v roku 1959 bol uverejnený krátky abstrakt o objave periodicky pôsobiacej oscilačnej chemickej reakcie B. P. Belousova v málo známom vydaní Zbierka abstraktov o radiačnej medicíne.
A vec sa má tak, že keď B. P. Belousov urobil svoj objav, periodické zmeny v koncentrácii činidiel sa zdali byť porušením zákonov termodynamiky. V skutočnosti, ako môže reakcia prebiehať buď vpred alebo v opačnom smere? Nie je možné si predstaviť, že celý obrovský počet molekúl v nádobe bol v jednom stave, potom v inom (buď všetky „modré“, potom všetky "červená"...).
Smer reakcie je určený chemickým (termodynamickým) potenciálom - reakcie prebiehajú v smere pravdepodobnejších stavov, v smere znižovania voľnej energie systému. Keď je reakcia v tomto smere ukončená, znamená to, že jej potenciál je vyčerpaný, je dosiahnutá termodynamická rovnováha a bez vynaloženia energie samovoľne nemôže ísť proces opačným smerom. A potom ... reakcia ide jedným alebo druhým smerom.
V tejto reakcii však k porušeniu zákonov nedošlo. Dochádzalo ku kolísaniu - periodickým zmenám - koncentrácií medziproduktov, a nie počiatočných činidiel alebo konečných produktov. CO2 sa pri tejto reakcii nepremení na kyselinu citrónovú, to je vlastne nemožné. Recenzenti nebrali do úvahy, že hoci systém má ďaleko od rovnováhy, môže sa v ňom udiať veľa úžasných vecí.Detailné trajektórie systému od počiatočného stavu po konečný stav môžu byť veľmi zložité. Až v posledných desaťročiach sa termodynamika systémov vzdialených od rovnováhy začala zaoberať týmito problémami. Táto nová veda sa stala základom novej vedy – synergetiky (teória samoorganizácie).
Belousovovu reakciu, ako bolo uvedené vyššie, podrobne študoval A. M. Zhabotinsky a jeho kolegovia. Kyselinu citrónovú nahradili kyselinou malónovou. Oxidácia kyseliny malónovej nie je sprevádzaná tvorbou bublín CO2, preto je možné zmenu farby roztoku zaznamenať bez rušenia fotoelektrickými zariadeniami.Neskôr sa ukázalo, že feroín aj bez céru slúži ako katalyzátor pre túto reakciu. B. P. Belousov si už v prvých pokusoch všimol ďalšiu pozoruhodnú vlastnosť svojej reakcie: pri zastavení miešania sa zmena farby v roztoku šíri vo vlnách. Toto rozloženie chemických vibrácií vo vesmíre sa stalo obzvlášť evidentným, keď v roku 1970 A. M. Zhabotinsky a A. N. Zaikin nalial reakčnú zmes v tenkej vrstve do Petriho misky. V pohári sa tvoria bizarné obrazce - sústredné kruhy, špirály, "víry", ktoré sa šíria rýchlosťou asi 1 mm/min. Chemické vlny majú množstvo nezvyčajných vlastností. Takže keď sa zrazia, zhasnú a nemôžu prejsť cez seba.
Koncentračné štúdie
oscilácie pred objavením reakcie B. P. Belousovom
Ale ako sa hovorí, objav B. P. Belousova nebol ani zďaleka prvým vo svetovej vede. Ukázalo sa, že jedna z prvých publikácií o chemických vibráciách pochádza z roku 1828. T. Fechner v nej načrtol výsledky štúdie oscilácií elektrochemickej reakcie.v tme vyžaruje dosť intenzívne svetlo. Na samotnom fakte žiary fosforu nebolo nič prekvapivé, no zaujímavý bol fakt, že táto žiara sa pravidelne opakovala každú siedmu sekundu. O štyridsať rokov neskôr v týchto pokusoch s „blikavou bankou“ pokračoval Francúz M. Joubert (1874). Podarilo sa mu v skúmavke pozorovať periodický vznik „svetelných oblakov“. O dvadsať rokov neskôr študoval vplyv tlaku vzduchu na periodické záblesky fosforu aj nemecký vedec A. Tsentnershwer. V jeho experimentoch začala perióda záblesku pri 20 s a klesala s klesajúcim tlakom.
Obzvlášť jasná stránka v histórii chemických vibrácií je spojená s takzvanými Liesegangovými prstencami. V roku 1896 nemecký chemik R. Liesegang pri experimentovaní s fotochemikáliami zistil, že ak kvapnete lapis na sklenenú platňu pokrytú želatínou obsahujúcou vrchol chrómu, produkt reakcie, vyzrážaný, sa nachádza na platni v sústredných kruhoch. Liesegang bol fascinovaný týmto fenoménom a študoval ho takmer pol storočia. Našlo aj praktické využitie. V úžitkovom umení sa Liesegangove prstene používali na zdobenie rôznych výrobkov imitáciou jaspisu, malachitu, achátu atď. Liesegang sám navrhol technológiu výroby umelých perál.
V zozname takýchto príkladov by sa dalo pokračovať. Na základe vyššie uvedeného boli objavené oscilačné reakcie na rozhraní medzi dvoma fázami. Z nich najznámejšie sú reakcie na rozhraní kov-roztok, ktoré dostali špecifické názvy – „železný nerv“ a „ortuťové srdce“. Prvá z nich - reakcia rozpúšťania železa (drôtu) v kyseline dusičnej - dostala svoje meno kvôli vonkajšej podobnosti s dynamikou vzrušeného nervu, ktorú si všimol V. F. Ostwald. Druhým, alebo skôr jedným z jeho variantov, je rozkladná reakcia H2O2 na povrchu kovovej ortuti. Pri reakcii dochádza k periodickej tvorbe a rozpúšťaniu oxidového filmu na povrchu ortuti. Kolísanie povrchového napätia ortuti spôsobuje rytmické pulzovanie kvapky, pripomínajúce tlkot srdca. Všetky tieto reakcie však nepritiahli veľkú pozornosť chemikov, pretože predstavy o priebehu chemickej reakcie boli stále dosť nejasné.
Až v druhej polovici XIX storočia. vznikla termodynamika a chemická kinetika, ktoré položili základ pre špecifický záujem o vibračné reakcie a metódy ich analýzy.
Matematický model od A. Lotkoya
Matematickú teóriu kmitov v systémoch podobných chemickým reakciám publikoval ešte v roku 1910 A. Lotka - napísal sústavu diferenciálnych rovníc, z ktorej vyplývala možnosť periodických režimov. Lotka uvažovala o interakcii „koristi“, napríklad bylinožravcov, a „predátorov“, ktorí ich požierajú (X a Y). Dravce požierajú korisť a rozmnožujú sa – koncentrácia Y sa zvyšuje, no do určitej hranice, keď počet koristi prudko klesá a dravce umierajú od hladu, koncentrácia Y klesá. Potom sa obete, ktoré prežili, začnú množiť – koncentrácia X rastie. Preživší predátori sa po tomto tiež množia, koncentrácia Y opäť rastie a tak ďalej mnohokrát. Pozorujú sa periodické výkyvy v koncentrácii činidiel. Je jasné, že podmienkou takýchto netlmených (dlhodobých) výkyvov je dostatok trávy – potravy obetí. Lotkine rovnice vylepšil V. Volterra. A modernú teóriu oscilácií vyvinuli ruskí fyzici L. I. Mandelstamm, A. A. Andronov, A. A. Witt, S. E. Khaikin, D. A. Frank-Kamenetsky. Takže pre fyzikov a matematikov bol Belousovaneov objav taký úžasný.
Štúdium mechanizmu oscilačných reakcií.
Podrobný mechanizmus Belousovovej reakcie stále nie je úplne známy. V prvých prácach sa zdalo, že počet medziproduktov je malý. Na vysvetlenie podstaty vibrácií si stačilo predstaviť, ako najskôr z kyseliny ismalovej vzniká kyselina brómmalónová a pri ďalšej reakcii sa KBrO3 premieňa na KBr. Anión Br-- inhibuje ďalšiu oxidáciu kyseliny brómmalónovej a oxidovaná forma katalyzátora (štvormocný cér alebo trojmocné železo v kombinácii s fenantrolínom) sa hromadí. V dôsledku toho sa akumulácia Br zastaví a oxidácia kyseliny brómmalónovej sa obnoví... Teraz je jasné, že takýto mechanizmus nie je ani zďaleka dokončený. Počet medziproduktov dosiahol štyridsať a štúdia pokračuje.
V roku 1972 R. Noyes a kolegovia ukázali, že Belousov-Žabotinského reakcia je výsledkom najmenej desiatich reakcií, ktoré možno spojiť do troch skupín - A, B a C.
Najprv (reakčná skupina A) interaguje bromičnanový ión s bromidovým iónom v prítomnosti H+ za vzniku kyseliny brómovej a bromnej:
BrO-3+ Br- + 2H+ = HBr02 + HOBr (A1)
kyselina bromová:
HBr02+ Br- + H+ = 2HOBr (A2)
Kyselina bromová zasa reaguje s bromidovým iónom a vytvára voľný bróm:
HOBr + Br-+ H+ = Br2 + H2O (A3)
Kyselina malónová sa brómuje voľným brómom:
Br2+ CH2(COOH)2 = BrCH(COOH)2 + Br-+ H+ (A4)
V dôsledku všetkých týchto reakcií sa kyselina malónová brómuje voľným brómom:
BrO-3+ 2Br- + 3CH2(COOH)2 + 3H+ = 3BrCH(COOH)2 + 3H20 (A)
Chemický význam tejto skupiny reakcií je dvojaký: deštrukcia bromidového iónu a syntéza kyseliny brómmalónovej.
Reakcie skupiny B sú možné len v neprítomnosti (nízka koncentrácia) bromidového iónu. Keď bromičnanový ión reaguje s kyselinou brómovou, vzniká radikál BrO2.
BrO-3+ HBrO2 + H+ > 2BrO2 + H2O (B1)
BrO2 reaguje s cérom (III), oxiduje ho na cér (IV) a sám sa redukuje na kyselinu brómovú:
BrO2+ Ce3+ + H+ > HВrO2 + Ce4+ (B2)
Kyselina brómová sa rozkladá na bromičnanový ión a kyselinu bromnú:
2HBr02> BrO-3 + HOBr + H+ (B3)
Kyselina bromová bromuje kyselinu malónovú:
HOBr + CH2(COOH)2 > BrCH(COOH)2 + H2O (B4)
V dôsledku reakcií skupiny B vzniká kyselina brómmalónová a štvormocný cér.
Kolísanie koncentrácií hlavných zložiek reakcie: bromidu a ferínu - vo fázovom priestore je znázornené ako uzavretá čiara (limitný cyklus).
BrO-3+ 4Ce3+ + CH2(COOH)2 + 5H+ > BrCH(COOH)2 + 4Ce4+ + 3H20 (B)
Cer (IV) vznikajúci pri týchto reakciách (reakcie skupiny B):
6Ce4++ CH2(COOH)2 + 2H20 > 6Ce3+ +HCOOH + 2CO2 +6H+ (IN1)
4Ce4++ BrCH(COOH)2 + 2H20 > Br- + 4Ce3++ HCOOH + 2CO2 + 5H+ (IN2)
Chemickým významom tejto skupiny reakcií je tvorba bromidového iónu, ktorá je tým intenzívnejšia, čím vyššia je koncentrácia kyseliny brómmalónovej. Zvýšenie koncentrácie bromidového iónu vedie k zastaveniu (dramatickému spomaleniu) oxidácie céru (III) na cér (IV). V nedávnych štúdiách sa cér zvyčajne nahrádza feroínom.
Tento (neúplný) sled krokov v reakcii Belousov-Žabotinský ukazuje, aký zložitý je tento systém. Stačí teda vziať do úvahy zmenu koncentrácie všetkých troch základných medziproduktov reakcie HВrO2 (kyselina brómová), Br-- a feroínu (alebo céru).
Prvý krok v reakcii - v dôsledku autokatalytickej reakcie vzniká kyselina brómová (rýchly proces podobný výbuchu), feroín sa premieňa na ferriín (oxidovaná forma feroínu).
Druhý krok– v dôsledku interakcie s organickou zložkou sa ferín začína pomaly premieňať späť na feroín a zároveň sa začína vytvárať bromidový ión.
Tretí krok– bromidový ión je účinným inhibítorom autokatalytickej reakcie (1. krok). V dôsledku toho sa zastaví tvorba kyseliny brómovej a rýchlo sa rozkladá.
Štvrtý krok– proces rozpadu ferriínu, začatý v 2. kroku, je dokončený; bromidový ión sa odstráni zo systému. V dôsledku toho sa systém vráti do stavu, v ktorom bol pred 1. krokom, a proces sa periodicky opakuje. Existuje niekoľko matematických modelov (systémov diferenciálnych rovníc), ktoré opisujú túto reakciu, kolísanie koncentrácie jej činidiel a vzorce šírenia koncentračných vĺn.
Experimentálna časť:
Interakcia kyseliny citrónovej s bromičnanom draselným:
Činidlá:
1. KMnO4(manganistan draselný).
2. KBrO3(bromid draselný alebo bromičnan draselný).
3. H2SO4(koncentrovaný).
4. Kyselina citrónová.
5. Destilovaná voda.
Pokrok: Odvážená časť kyseliny citrónovej (2 g) sa rozpustila v 6 ml H20. K výslednému roztoku sa pridala odvážená dávka bromidu draselného - 0,2 g a pridalo sa 0,7 ml koncentrovanej kyseliny sírovej. Potom sa pridalo 0,04 g manganistanu draselného a objem výsledného roztoku sa doplnil destilovanou vodou na 10 ml. Dôkladne premiešajte až do úplného rozpustenia činidiel.
Pripomienky: Ihneď po pridaní KMnO4 roztok sfialovel a začal "vrieť". Po 25 s pri rýchlom vare sa farba roztoku začala meniť na hnedú. V priebehu reakcie sa roztok postupne rozjasňuje - až do svetložltej farby. Po 3 min 45 s začne roztok prudko tmavnúť (podobne ako pri difúzii kvapaliny s vysokou hustotou) a po 40 s roztok opäť úplne zhnedne. Potom sa všetko opakuje s intervalom 4,5 minúty - 5 minút. Po dosť dlhom čase sa reakcia začne spomaľovať, potom sa úplne zastaví (žltý roztok).
/>Vibračné redoxné reakcie:
Činidlá:
1. FeSO4. 7H20 kryštalický heptahydrát síranu železnatého alebo
Fe(NH4)2(S04)2.6H2O (Mohrova soľ) hexahydrát síranu diamónneho -
železo (II)
2. Ce(N03)3.6H20 hexahydrát dusičnanu ceritého
3. KBr vodný roztok bromidu draselného (2 mol/l alebo 12 g na 50 ml vody)
4. KBrO3 nasýtený roztok bromičnanu draselného (asi 10 g na 100 ml vody)
5. H2SO4 koncentrovaná kyselina sírová
6. CH2(COOH)2 vodný roztok kyseliny malónovej (5 mol/l alebo 52 g in
100 ml vody)
7. C12H8N2(fen) o-fenantrolín
8. destilovaná voda
Riad a príbory: Polylux so sitom, sklenená doska 25x25 cm, Petriho miska, odmerná banka 100 ml, Erlenmeyerova banka 250 ml so zabrúsenou zátkou, šesť pipiet, byreta, sklenená tyčinka, podložka, filtračný papier.
Popis zážitku: Na demonštráciu experimentu sú predbežne pripravené roztoky A a B.
Riešenie A – roztok feroínu, komplex železa(II) s o-fenantrolínom (fen). Do 100 ml odmernej banky sa pridá 0,70 g heptahydrátu síranu železnatého (alebo 0,99 g Mohrovej soli) a 1,49 g o-fenantrolínu, objem roztoku sa upraví vodou po značku a premieša sa. Roztok získava červenú farbu v dôsledku tvorby fenantrolínového komplexu železa (II):
Fe2++ 3 fen = 2+
Riešenie B - roztok kyseliny brómmalónovej (pripravený bezprostredne pred demonštráciou). Do Erlenmeyerovej banky so zabrúsenou zátkou sa vloží 3,3 ml roztoku bromidu draselného, 5 ml roztoku kyseliny malónovej a 5 ml koncentrovanej kyseliny sírovej. Výsledný roztok sa titruje z byrety nasýteným roztokom bromičnanu draselného za miešania po pridaní každej dávky titračného činidla, čím sa dosiahne vymiznutie hnedej farby v dôsledku uvoľnenia brómu v paralelnej prepínacej reakcii:
Br03–+ 5Br– + 6H+ = 3Br2 + 3H20
3Br2+ 2CH2(COOH)2 + 2H2O = BrCH(COOH)2+ HCOOH + CO2 + 5HBr
Celkový objem roztoku bromičnanu draselného použitého na titráciu by mal byť asi 7,5 ml Výsledná kyselina brómmalónová je nestabilná, ale môže sa určitý čas skladovať pri teplote 510 °C.
Na priamu demonštráciu experimentu sa Petriho miska umiestni na sklenenú platňu zakrývajúcu okienko polylux light, do ktorej sa postupne pridá 10 ml nasýteného roztoku bromičnanu draselného, 4 ml roztoku kyseliny brómmalónovej a 1,5 ml roztoku feroínu pomocou pipety. V priebehu niekoľkých minút sa na červenom pozadí objavia modré škvrny v dôsledku tvorby fenantrolínového komplexu železa (III) 3+ ako výsledok oxidácie zodpovedajúceho komplexu železa (II):
62++ 6H3O+ + BrO3– = 63++ 9H2O + Br–
Tento proces sa sám urýchľuje. Výsledný komplex 3+ oxiduje kyselinu brómmalónovú za tvorby bromidových iónov:
43++ BrCH(COOH)2 + 7H20 =
= 2CO2+ 5H3O+ + Br– + HCOOH + 42+
Uvoľnené bromidové ióny sú inhibítormi oxidačnej reakcie komplexov železa (II) s iónmi bromičnanu.Len keď koncentrácia komplexných iónov 2+ sa dostatočne zvýši, inhibičná aktivita bromidových iónov sa prekoná a roztok sa zmení na modrý v dôsledku tvorby komplexu trojmocného železa. Proces sa opakuje znova a znova, takže farba roztoku sa periodicky mení z modrej na ružovú alebo naopak. Zmena farby začína objavením sa modrých škvŕn na ružovom pozadí, z ktorých sa koncentrické vlny farieb rozchádzajú vo všetkých smeroch. V priebehu času sa rýchlosť zmeny farby znižuje a nakoniec proces vybledne. V tomto prípade možno na obrazovke pozorovať výskyt „čiernych bodiek“ - projekcie bublín uvoľneného oxidu uhličitého.
Paletu farieb je možné rozšíriť pridaním niekoľkých kryštálov hexahydrátu dusičnanu ceritého do Petriho misky. Ce(N03)3. 6H20. Potom okrem modrej a ružovej farby možno pozorovať žltú (kvôli tvorbe zlúčenín céru (IV)) alebo zelenú farbu (kvôli prekrývaniu žltej a modrej):
6Ce3++ BrO3– + 15H2O = 62++ Br– + 6H3O+
42++ BrCH(COOH)2 + 3H30+ =
= 2CO2+ Br– + HCOOH + 4Ce3++ 9H2O
Pri zahrievaní sa rýchlosť reakcie zvyšuje a zmena farby sa zrýchľuje.
Poznámka. Fenantrolín je heterocyklická zlúčenina s dvoma atómami dusíka, ktoré majú osamelé páry elektrónov a sú schopné koordinácie. V komplexných zlúčeninách so železom O-fenantrolín hrá úlohu bidentátneho ligandu a tvorí silné komplexy chelátového typu.
Záver.
Do dnešného dňa zaujala Belousov-Žabotinského reakcia svoje právoplatné miesto vo svetovej vede. Každoročne sa vo svete koná niekoľko medzinárodných konferencií o dynamike lineárnych chemických systémov a slová „BZ-reaction“ (skratka: Belousov-Žabotinského reakcie) zaznievajú na desiatkach ďalších konferencií venovaných problémom fyziky, chémie, a biológie.
Štúdium Belousovovej-Žabotinského reakcie, ako som sa presvedčil, má veľký význam, pretože našla uplatnenie v rôznych oblastiach vedy a techniky. Táto reakcia sa používa ako model pre štúdium hrozivého porušenia srdca - arytmií a fibrilácií. A nedávno sa začali experimenty so svetlocitlivou modifikáciou tejto reakcie, kedy dynamika v tomto systéme závisí od intenzity svetla. Ukázalo sa, že takáto reakcia môže byť použitá ako počítač na ukladanie a spracovanie obrázkov. Svetlocitlivá modifikácia reakcie Belousova-Žabotinského môže slúžiť ako prototyp výpočtového komplexu, ktorý môže nahradiť počítač.
Na druhej strane, oscilačné chemické reakcie sú názorným príkladom samoorganizácie v neživej prírode a v tomto zmysle majú nielen prírodovedný, ale aj filozofický význam. Zásadné zmeny v prírodných vedách, ktoré viedli k takzvanej teórii samoorganizácie, sú do značnej miery spôsobené počiatočným impulzom, ktorý jej dali ruskí vedci na prelome 50. – 60. rokov, keď Belousov objavil redoxnú chemickú reakciu. od formovania galaxií po tornáda, cyklóny a hru svetla na reflexných povrchoch sú v skutočnosti procesy samoorganizácie. Môžu mať veľmi odlišnú povahu: chemickú, mechanickú, optickú, elektrickú atď.
Aplikovaný výskum tak nadobúda čoraz väčší význam napríklad v oblasti modelovania alternatívnych prostriedkov spracovania informácií (najmä analýza zložitých mozaík s gradáciou jasu objektov). Ďalším novým smerom aplikovaného výskumu je štúdium vlastností polymerizácie v systéme BZh alebo jemu podobnom.
Komplexná časopriestorová organizácia vykazovaná systémom BZ v neprítomnosti miešania sa postupom času našli analógie v prírode, v biologických systémoch (napríklad: periodické procesy bunkového metabolizmu, vlny aktivity v srdcovom tkanive a mozgových tkanivách , procesy prebiehajúce na úrovni neekologických systémov), v jej novej oblasti - synergetika (teória a samoorganizácia), ako aj experimentálne práce iniciovali rozvoj modernej teórie dynamických systémov. Hoci v súčasnosti je už väčšina takýchto reakcií pochopená, príčiny, ktoré spôsobujú oscilačné chemické procesy, zostávajú až do konca nejasné.
V súčasnosti je kinetika oscilačných reakcií rýchlo sa rozvíjajúcim odvetvím poznania, ktoré vzniklo na priesečníku chémie, biológie, medicíny, fyziky a matematiky. Bolo pre mňa veľmi zaujímavé zoznámiť sa s takými nezvyčajnými a na prvý pohľad nemožnými vlastnosťami živej hmoty. Ale ešte viac som bol prekvapený, že taký neuveriteľný význam, pôsobivý objav po mnoho rokov ostatní nevnímali a jednoducho ho nepochopili veľké mysle tej doby. Tento objav prešiel tŕnistou cestou a nakoniec zaujal svoje právoplatné miesto vo svetovej vede. Asama, možnosť takejto reakcie opäť dokazuje, že v našom svete je ešte veľa neznámeho a neprebádaného.
Aplikácia.
Recepty na niektoré oscilačné reakcie
Recept 1: Je potrebné pripraviť roztoky nasledujúcich látok na základe ich konečných koncentrácií: kyselina malónová 0,2 M; bromičnan sodný 0,3 M; kyselina sírová 0,3 M; ferroin 0,005 M. Feroin je možné nahradiť dvojmocným mangánom alebo trojmocným síranom céru, ale intenzita farby bude oveľa slabšia. Asi 5 ml roztoku všetkých zložiek sa musí naliať do Petriho misky tak, aby hrúbka vrstvy kvapaliny bola 0,5-1 mm. Po 3-8 minútach (prechodné obdobie) možno pozorovať oscilácie a chemické vlny.
Recept 2: Nalejte nasledujúce roztoky do plochej priehľadnej kyvety vo vrstvách (1 ml):
- KBrO3(0,2 mol/l)
- kyselina malónová (0,3 mol/l)
- ferroín (0,003 mol/l)
- H2SO4(0,3 mol/l)
Umiestnite kyvetu na list bieleho papiera. Rýchlosť reakcie sa môže zmeniť pridaním zásady alebo kyseliny.
Recept 3: Požadované riešenia:
- kyselina citrónová (40 g v 160 ml H2O)
- H2SO4(1:3).
A tiež závesy:
- KBrO3(16 g)
- Ce2(SO4)3(3-3,5 g)
Roztok kyseliny citrónovej zahrejte na 40°-50°C, potom vylejte vzorku KBrO3. Položte kadičku na list bieleho papiera a pridajte vzorku Ce2(SO4)3 a niekoľko ml H2SO4. Okamžite začne dochádzať k striedaniu farieb: žltá > bezfarebná > žltá, s periódou 1-2 minút.
Recept 4: Požadované riešenia:
- H2O2(50 ml 30 %)
- KIO3(7,17 g v 50 ml H2O)
- HClO4(30 ml zriedeného roztoku)
- kyselina malónová (3 g v 50 ml H2O) a vzorky:
- MnSO4(1 g) a trochu škrobu.
Všetko nalejte do jedného pohára (200-250 ml), pridajte odvážené porcie, premiešajte sklenenou tyčinkou. Dochádza k striedaniu farby: bezfarebná > žltá > modrá.
Bibliografia.
1. Aliev R., Shnol S. E. "Vibračné chemické reakcie". Kinetika a katalýza. 1998. č. 3. S. 130-133.
2. Shnol S.E. Vedomosti sú sila. 1994. Číslo 3. s. 62-71.
3. Zhabotinsky A. M. Samooscilácie koncentrácie. Moskva: Nauka, 1974.
4. Garel D., Garel O. Vibračné chemické reakcie / Per. z angličtiny. M.:
5. Dubnishcheva T. Ya. Koncepty moderných prírodných vied. Novosi-
birsk: YuKEA, 1997, s. 683 – 697.
6. Pojmy moderných prírodných vied. Ed. V. N. Lavrinenko,
V. P. Ratniková, M.: UNITI-DANA, 1999, S. 78 - 87.
7. VavilinB.V."Vlastné oscilácie v chemických systémoch v kvapalnej fáze".
Príroda, 2000, č. 5, s. 19–25.
Ministerstvo školstva, vedy, mládeže a športu
Teoretické lýceum Petru Movilă
oddelenie
"Schopnosť, práca, talent"
Cvičenie z chémie na tému:
"Vibračné chemické reakcie"
Vyplnil: žiak ročníka 12A
Bolyubash Irina
Prednáša: Snidchenko M.A.
* Kišiňov 2007 *
1. Úvod:
a) Redoxné reakcie
b) Vibračné chemické reakcie
2. História objavu oscilačných reakcií:
a) Štúdie kolísania koncentrácie pred objavom
reakcie B. P. Belousovovej
3. Teoretická časť:
a) Matematický model A. Lotku
b) Štúdium mechanizmu oscilačných reakcií
4. Experimentálna časť
5. Záver
6. Aplikácia:
a) Recepty na niektoré oscilačné reakcie
b) Ilustrácie uskutočnených experimentov
7. Literatúra
Úvod.
Chémia je experimentálna veda. A tak experiment ako metóda vedeckého výskumu dlhodobo a pevne zaujíma popredné miesto medzi metódami prírodných vied. Experiment je najdôležitejším spôsobom, ako prepojiť teóriu s praxou vo vyučovaní chémie a premeniť vedomosti na presvedčenia. Preto je odhalenie kognitívneho významu každého experimentu hlavnou požiadavkou na chemický experiment.
V rámci experimentu (z lat. "experiment" - "skúška") pochopiť pozorovanie skúmaného javu za určitých podmienok, čo vám umožní sledovať priebeh tohto javu a zopakovať ho za týchto podmienok. Chemický experiment zaujíma dôležité miesto vo vyučovaní chémie, pretože prostredníctvom pozorovaní a experimentov sa pozná rôznorodosť povahy látok, zhromažďujú sa fakty na porovnávanie, zovšeobecňovanie a závery.
Pri vykonávaní experimentov a pozorovaní chemických premien za rôznych podmienok sme presvedčení, že zložité chemické procesy možno kontrolovať, že v javoch nie je nič tajomné, riadia sa prírodnými zákonmi, ktorých znalosť umožňuje široké využitie chemických premien v praktickej činnosti človeka. .
Výsledky niektorých chemických experimentov sú však neočakávané a nezapadajú do tradičných predstáv o vlastnostiach látok či zákonitostiach chemických reakcií. Takéto chemické transformácie sa nazývajú problémové experimenty.
Už v dobe antiky filozofi verili, že každé poznanie začína prekvapením. Prekvapenie spôsobené novým vedie k rozvoju zvedavosti (citlivosti na problémy v okolitom svete) s následným formovaním stabilného záujmu o niečo. Prekvapenie a po ňom túžba po poznaní - to je úrodná pôda pre štúdium problematického experimentu, formovanie dialektického a systémového myslenia a odomykanie tvorivého potenciálu.
Rovnaký stav môže spôsobiť jasný, pôsobivý chemický experiment (problémový experiment). V chémii sú príčinou problematických experimentov najčastejšie redoxné reakcie.
Redoxné reakcie
Existuje mnoho kritérií na klasifikáciu chemických reakcií. Jedným z najdôležitejších je znak zmeny oxidačných stavov prvkov. V závislosti od toho, či sa oxidačné stavy prvkov menia alebo zostávajú, možno chemické reakcie rozdeliť na redoxné reakcie a tie, ktoré prebiehajú bez zmeny oxidačných stavov.
Reakcie vyskytujúce sa so zmenou oxidačných stavov prvkov (redox) sú všeobecne známe. Zohrávajú významnú úlohu v technike a prírode, sú základom látkovej premeny v živých organizmoch a sú s nimi spojené procesy oxidácie, hniloby, fermentácie, fotosyntézy. Procesy oxidácie (a redukcie) sa vyskytujú pri spaľovaní paliva, korózii kovov, elektrolýze, s ich pomocou sa získavajú kovy, amoniak, alkálie a mnoho ďalších cenných produktov. Preto štúdium redoxných reakcií zabezpečujú školské kurzy anorganickej a organickej chémie.
Pripomeňme si hlavné ustanovenia spojené s konceptom redoxných reakcií.
Oxidačný stav zodpovedá náboju, ktorý by vznikol na atóme daného prvku v chemickej zlúčenine za predpokladu, že všetky elektrónové páry, cez ktoré je tento atóm spojený s inými, sú úplne vytesnené do atómov prvkov s väčšou elektronegativitou.
Oxidačné činidlo- látka obsahujúca atómy alebo ióny, ktoré prijímajú elektróny: X m (oxidačné činidlo) + ne - \u003d X (m - n), kde m je stupeň oxidácie prvku v pôvodnej látke, n je počet elektrónov .
Redukčné činidlo- látka obsahujúca atómy alebo ióny, ktoré darujú elektróny: Y m (redukčné činidlo) - ne - = Y (m + n) .
Oxidácia- proces odovzdávania elektrónov atómom, molekulou alebo iónom, pričom sa zvyšuje oxidačný stav prvku.
zotavenie- proces prijímania elektrónov atómom, molekulou alebo iónom, pričom oxidačný stav prvku klesá.
Oxidácia a redukcia sú konjugované procesy, počet elektrónov darovaných redukčným činidlom v procese jeho oxidácie sa vždy rovná počtu elektrónov prijatých oxidačným činidlom v procese jeho redukcie.
Vibračné chemické reakcie
V tejto semestrálnej práci sa budem zaoberať špeciálnym prípadom problematického experimentu, oscilačnými chemickými reakciami. Oscilačné reakcie sú celou triedou oxidačných reakcií organických látok za účasti katalyzátora s redoxnými vlastnosťami. Tento proces prebieha cyklicky, to znamená, že pozostáva z viacerých opakovaní.
Vibračné chemické reakcie objavil a vedecky zdôvodnil v roku 1951 sovietsky vedec Boris Petrovič Belousov. B.P. Belousov študoval oxidáciu kyseliny citrónovej počas jej reakcie s bromičnanom sodným v roztoku kyseliny sírovej. Na zvýšenie reakcie pridal do roztoku soľ céru. Cér je kov s premenlivou mocnosťou (3+ alebo 4+), preto môže byť katalyzátorom redoxných premien. Reakciu sprevádza uvoľňovanie bublín CO 2, a preto sa zdá, že celá reakčná zmes "vrie". A na pozadí tohto varu si B.P. Belousov všimol úžasnú vec: farba roztoku sa pravidelne menila - stala sa buď žltou alebo bezfarebnou. Belousovová do roztoku pridala komplex fenantrolínu so železnatým železom (feroínom) a farba roztoku sa začala periodicky meniť z purpurovo-červenej na modrú a späť.
Tak bola objavená reakcia, ktorá sa stala slávnou. Teraz je známa po celom svete, nazýva sa to Belousov-Zhabotinsky reakcia. A. M. Zhabotinsky urobil veľa pre pochopenie tohto úžasného fenoménu. Odvtedy bolo objavených veľké množstvo podobných reakcií.
História objavu oscilačných reakcií.
IP Belousov objavil oscilačnú chemickú reakciu v snahe vytvoriť jednoduchý chemický model niektorých štádií systému kľúčových biochemických premien karboxylových kyselín v bunke. Prvá správa o jeho objavení však nebola zverejnená. Recenzent chemického časopisu pochyboval o zásadnej možnosti reakcie opísanej v článku. Väčšina chemikov v tých rokoch verila, že neexistujú čisto chemické oscilácie, hoci existenciu oscilačných reakcií predpovedal v roku 1910 A. Lotkoy na základe matematickej teórie periodických procesov.
Druhý pokus o zverejnenie výsledkov štúdie urobil vedec v roku 1957 a opäť bol odmietnutý, napriek práci belgického fyzika a fyziochemika I. R. Prigozhina, ktorá sa v tom čase objavila. V týchto prácach bola ukázaná možnosť a pravdepodobnosť oscilačných chemických reakcií.
Až v roku 1959 bol v málo známej publikácii „Collection of Abstracts on Radiation Medicine“ publikovaný krátky abstrakt o objave periodicky pôsobiacej oscilačnej chemickej reakcie B. P. Belousova.
A vec sa má tak, že keď B.P. Belousov urobil svoj objav, periodické zmeny v koncentrácii činidiel sa zdali byť porušením zákonov termodynamiky. V skutočnosti, ako môže ísť reakcia vpred alebo v opačnom smere? Nie je možné si predstaviť, že celý obrovský počet molekúl v nádobe bol v jednom stave, potom v inom (buď všetky „modré“, potom všetky „červené“ ...).
Smer reakcie je určený chemickým (termodynamickým) potenciálom - reakcie prebiehajú v smere pravdepodobnejších stavov, v smere znižovania voľnej energie systému. Keď je reakcia v danom smere ukončená, znamená to, že jej potenciál je vyčerpaný, je dosiahnutá termodynamická rovnováha a bez vynaloženia energie samovoľne nemôže ísť proces opačným smerom. A potom ... reakcia ide jedným alebo druhým smerom.
V tejto reakcii však k porušeniu zákonov nedošlo. Dochádzalo ku kolísaniu - periodickým zmenám - koncentrácií medziproduktov, a nie počiatočných činidiel alebo konečných produktov. CO 2 sa pri tejto reakcii nepremení na kyselinu citrónovú, to je vlastne nemožné. Recenzenti nebrali do úvahy, že hoci systém má ďaleko od rovnováhy, môže sa v ňom udiať veľa úžasných vecí. Podrobné trajektórie systému od jeho počiatočného stavu po konečný stav môžu byť veľmi zložité. Až v posledných desaťročiach sa termodynamika systémov vzdialených od rovnováhy začala zaoberať týmito problémami. Táto nová veda sa stala základom novej vedy – synergetiky (teória samoorganizácie).
Belousovovu reakciu, ako bolo uvedené vyššie, podrobne študoval A. M. Zhabotinsky a jeho kolegovia. Kyselinu citrónovú nahradili kyselinou malónovou. Oxidácia kyseliny malónovej nie je sprevádzaná tvorbou bublín CO 2, takže zmena farby roztoku môže byť zaznamenaná bez rušenia fotoelektrickými zariadeniami. Neskôr sa ukázalo, že ako katalyzátor tejto reakcie slúži feroín bez céru. B. P. Belousov si už v prvých pokusoch všimol ďalšiu pozoruhodnú vlastnosť svojej reakcie: pri zastavení miešania sa zmena farby v roztoku šíri vo vlnách. Toto šírenie chemických vibrácií vo vesmíre sa stalo obzvlášť evidentným, keď v roku 1970 A. M. Zhabotinsky a A. N. Zaikin naliali tenkú vrstvu reakčnej zmesi do Petriho misky. V pohári sa tvoria bizarné obrazce - sústredné kruhy, špirály, "víry", šíriace sa rýchlosťou asi 1 mm/min. Chemické vlny majú množstvo nezvyčajných vlastností. Takže keď sa zrazia, zhasnú a nemôžu prejsť cez seba.
Koncentračné štúdie
oscilácie pred objavením reakcie B. P. Belousovom
Ale ako sa hovorí, objav B. P. Belousova nebol ani zďaleka prvým vo svetovej vede. Ukázalo sa, že jedna z prvých publikácií o chemických vibráciách pochádza z roku 1828. T. Fechner v nej načrtol výsledky štúdie oscilácií elektrochemickej reakcie. Najzaujímavejšie je dielo M. Rosenskiölda z roku 1834. Jeho autor si celkom náhodou všimol, že malá banka s trochou fosforu vyžaruje v tme dosť intenzívne svetlo. Na samotnom fakte žiary fosforu nebolo nič prekvapivé, no zaujímavý bol fakt, že táto žiara sa pravidelne opakovala každú siedmu sekundu. O štyridsať rokov neskôr v týchto pokusoch s „blikavou bankou“ pokračoval Francúz M. Joubert (1874). Podarilo sa mu v skúmavke pozorovať periodický vznik „svetelných oblakov“. O dvadsať rokov neskôr študoval vplyv tlaku vzduchu na periodické záblesky fosforu aj nemecký vedec A. Zentnershwer. V jeho experimentoch začala perióda záblesku pri 20 s a klesala s klesajúcim tlakom.
Obzvlášť jasná stránka v histórii chemických vibrácií je spojená s takzvanými Liesegangovými prstencami. V roku 1896 nemecký chemik R. Liesegang pri experimentovaní s fotochemikáliami zistil, že ak kvapnete lapis na sklenenú platňu potiahnutú želatínou obsahujúcou vrchol chrómu, potom sa produkt reakcie, vyzrážaný, nachádza na platni v sústredných kruhoch. Liesegang bol fascinovaný týmto fenoménom a študoval ho takmer pol storočia. Našlo aj praktické využitie. V úžitkovom umení sa Liesegangove prstene používali na zdobenie rôznych výrobkov imitáciou jaspisu, malachitu, achátu atď. Liesegang sám navrhol technológiu výroby umelých perál.
V zozname takýchto príkladov by sa dalo pokračovať. Následne boli objavené oscilačné reakcie na rozhraní medzi dvoma fázami. Z nich sú najznámejšie reakcie na rozhraní kov-roztok, ktoré dostali špecifické názvy – „železný nerv“ a „ortuťové srdce“. Prvá z nich - reakcia rozpúšťania železa (drôtu) v kyseline dusičnej - dostala svoje meno kvôli vonkajšej podobnosti s dynamikou excitovaného nervu, ktorú si všimol VF Ostwald. Druhým, alebo skôr jedným z jeho variantov, je rozkladná reakcia H 2 O 2 na povrchu kovovej ortuti. Pri reakcii dochádza k periodickej tvorbe a rozpúšťaniu oxidového filmu na povrchu ortuti. Kolísanie povrchového napätia ortuti spôsobuje rytmické pulzovanie kvapky, pripomínajúce tlkot srdca. Všetky tieto reakcie však nepritiahli veľkú pozornosť chemikov, pretože predstavy o priebehu chemickej reakcie boli stále dosť nejasné.
Až v druhej polovici XIX storočia. vznikla termodynamika a chemická kinetika, ktoré položili základ pre špecifický záujem o vibračné reakcie a metódy ich analýzy.
Matematický model od A. Lotkoya
Matematickú teóriu kmitov v systémoch podobných chemickým reakciám publikoval ešte v roku 1910 A. Lotka - napísal sústavu diferenciálnych rovníc, z ktorej vyplývala možnosť periodických režimov. Lotka uvažovala o interakcii „koristi“, ako sú bylinožravce, a „predátorov“, ktorí ich požierajú (X a Y). Dravce požierajú korisť a množia sa – koncentrácia Y rastie, ale do určitej hranice, keď počet koristi prudko klesá a dravce umierajú od hladu – koncentrácia Y klesá. Potom sa obete, ktoré prežili, začnú množiť – koncentrácia X rastie. Preživší predátori sa po tomto tiež množia, koncentrácia Y opäť rastie a tak ďalej mnohokrát. Pozorujú sa periodické výkyvy v koncentrácii činidiel. Je jasné, že podmienkou takýchto netlmených (dlhodobých) výkyvov je dostatok trávy – potravy obetí. Lotkine rovnice vylepšil W. Volterra. A modernú teóriu oscilácií vyvinuli ruskí fyzici L. I. Mandelstamm, A. A. Andronov, A. A. Witt, S. E. Khaikin, D. A. Frank-Kamenetsky. Pre fyzikov a matematikov teda Belousovov objav až taký prekvapivý nebol.
Štúdium mechanizmu oscilačných reakcií.
Podrobný mechanizmus Belousovovej reakcie stále nie je úplne známy. V prvých prácach sa zdalo, že počet medziproduktov je malý. Na vysvetlenie povahy vibrácií si stačilo predstaviť, ako z kyseliny malónovej najskôr vzniká kyselina brómmalónová a pri ďalšej reakcii s ňou sa KBrO 3 premieňa na KBr. Anión Br - inhibuje ďalšiu oxidáciu kyseliny brómmalónovej a oxidovaná forma katalyzátora sa hromadí (štvormocný cér alebo trojmocné železo v kombinácii s fenantrolínom). V dôsledku toho sa akumulácia Br - zastaví a oxidácia kyseliny brómmalónovej sa obnoví ... Teraz je jasné, že takýto mechanizmus nie je ani zďaleka dokončený. Počet medziproduktov dosiahol štyri desiatky a štúdia pokračuje.
V roku 1972 R. Noyes a kolegovia ukázali, že Belousov-Žabotinského reakcia je výsledkom najmenej desiatich reakcií, ktoré možno spojiť do troch skupín - A, B a C.
Najprv (reakčná skupina A) interaguje bromičnanový ión s bromidovým iónom v prítomnosti H+ za vzniku bromidu a bromných kyselín:
BrO-3 + Br -- + 2H + = HBr02 + HOBr ( A 1)
kyselina bromová:
HBr02 + Br -- + H + = 2HOBr ( A 2)
Kyselina bromná zase reaguje s bromidovým iónom a vytvára voľný bróm:
HOBr + Br -- + H+ = Br2 + H20 ( A 3)
Kyselina malónová sa brómuje voľným brómom:
Br2 + CH2 (COOH) 2 \u003d BrCH (COOH) 2 + Br - + H + ( A 4)
V dôsledku všetkých týchto reakcií sa kyselina malónová brómuje voľným brómom:
BrO-3 + 2Br -- + 3CH2(COOH)2 + 3H+ = 3BrCH (COOH)2 + 3H20 ( A )
Chemický význam tejto skupiny reakcií je dvojaký: deštrukcia bromidového iónu a syntéza kyseliny brómmalónovej.
Reakcie skupiny B sú možné len v neprítomnosti (nízka koncentrácia) bromidového iónu. Keď bromičnanový ión reaguje s kyselinou brómovou, vzniká radikál Br02.
BrO-3 + HBr02 + H + > 2Br02 + H20 ( B 1)
BrO2 reaguje s cérom (III), oxiduje ho na cér (IV) a sám sa redukuje na kyselinu brómovú:
BrO2 + Ce 3+ + H+ > HВrO2 + Ce 4+ ( B 2)
Kyselina brómová sa rozkladá na bromičnatý ión a kyselinu bromovú:
2HBr02 > Br0-3 + HOBr + H+ ( B 3)
Kyselina bromová bromuje kyselinu malónovú:
HOBr + CH2(COOH)2 > BrCH (COOH)2 + H20 ( B 4)
V dôsledku reakcií skupiny B vzniká kyselina brómmalónová a štvormocný cér.
Kolísanie koncentrácií hlavných zložiek reakcie: kyseliny brómovej a ferínu - vo fázovom priestore je znázornené ako uzavretá čiara (limitný cyklus).
BrO-3 + 4Ce3+ + CH2(COOH)2 + 5H+ > BrCH(COOH)2 + 4Ce4+ + 3H20 ( B )
Cer (IV) vznikajúci pri týchto reakciách (reakcie skupiny B):
6Ce 4+ + CH2 (COOH) 2 + 2H20 > 6Ce 3+ + HCOOH + 2CO2 + 6H+ ( IN 1)
4Ce 4+ + BrCH(COOH)2 + 2H20 > Br -- + 4Ce 3+ + HCOOH + 2CO2 + 5H+ ( IN 2)
Chemickým významom tejto skupiny reakcií je tvorba bromidového iónu, ktorá je tým intenzívnejšia, čím vyššia je koncentrácia kyseliny brómmalónovej. Zvýšenie koncentrácie bromidového iónu vedie k zastaveniu (dramatickému spomaleniu) oxidácie céru (III) na cér (IV). V nedávnych štúdiách sa cér zvyčajne nahrádza feroínom.
Tento (neúplný) sled krokov v reakcii Belousov-Žabotinský ukazuje, aký zložitý je tento systém. Stačí teda vziať do úvahy zmenu koncentrácie iba troch hlavných medziproduktov reakcie HВrO 2 (kyselina brómová), Br - a feroínu (alebo céru).
Prvý krok v reakcii - v dôsledku autokatalytickej reakcie vzniká kyselina brómová (rýchly proces podobný výbuchu), feroín sa premieňa na ferriín (oxidovaná forma feroínu).
Druhý krok– v dôsledku interakcie s organickou zložkou sa ferín začína pomaly premieňať späť na feroín a zároveň sa začína vytvárať bromidový ión.
Tretí krok– bromidový ión je účinným inhibítorom autokatalytickej reakcie (1. krok). V dôsledku toho sa zastaví tvorba kyseliny brómovej a rýchlo sa rozkladá.
Štvrtý krok– proces rozpadu ferriínu, začatý v 2. kroku, je dokončený; bromidový ión sa odstráni zo systému. V dôsledku toho sa systém vráti do stavu, v ktorom bol pred 1. krokom, a proces sa periodicky opakuje. Existuje niekoľko matematických modelov (systémov diferenciálnych rovníc), ktoré popisujú túto reakciu, kolísanie koncentrácie jej činidiel a vzorce šírenia koncentračných vĺn.
Experimentálna časť:
Kyselina citrónová reaguje s bromičnanom draselným:
Činidlá:
1. K M nie 4(manganistan draselný).
2. KBrO 3(bromičnan draselný alebo bromičnan draselný).
3. H2SO4(koncentrovaný).
4. Kyselina citrónová.
5. Destilovaná voda.
Pokrok: Časť kyseliny citrónovej - 2 g sa rozpustila v 6 ml H20. K výslednému roztoku sa pridala časť bromičnanu draselného - 0,2 g a pridalo sa 0,7 ml koncentrovanej kyseliny sírovej. Potom sa pripraví 0,04 g manganistanu draselného a objem výsledného roztoku sa doplní destilovanou vodou na 10 ml. Dôkladne premiešajte až do úplného rozpustenia činidiel.
Pripomienky: Ihneď po pridaní KMnO 4 roztok sfialovel a začal "vrieť". Po 25 s pri rýchlom vare sa farba roztoku začala meniť na hnedú. V priebehu reakcie sa roztok postupne rozjasňuje - až do svetložltej farby. Po 3 min 45 s začne roztok prudko tmavnúť (podobne ako pri difúzii kvapaliny s vysokou hustotou) a po 40 s roztok opäť úplne zhnedne. Potom sa všetko opakuje s intervalom 4,5 minúty - 5 minút. Po dosť dlhom čase sa reakcia začne spomaľovať, potom sa úplne zastaví (žltý roztok).
Vibračné redoxné reakcie:
Činidlá:
1. FeSO4. 7H20 kryštalický heptahydrát síranu železnatého alebo
Fe(NH4)2(S04)2. 6H20 (Mohrova soľ) hexahydrát síranu diamónneho -
železo (II)
2. Ce(N03)3. 6H20 hexahydrát dusičnanu ceritého
3. KBr vodný roztok bromidu draselného (2 mol/l alebo 12 g na 50 ml vody)
4. KBrO 3 nasýtený roztok bromičnanu draselného (asi 10 g na 100 ml vody)
5. H2SO4 koncentrovaná kyselina sírová
6. CH2(COOH)2 vodný roztok kyseliny malónovej (5 mol/l alebo 52 g in
100 ml vody)
7. C12H8N2(fen) o-fenantrolín
8. destilovaná voda
Riad a príbory: Polylux so sitom, sklenená doska 25x25 cm, Petriho miska, odmerná banka 100 ml, Erlenmeyerova banka 250 ml so zabrúsenou zátkou, šesť pipiet, byreta, sklenená tyčinka, podložka, filtračný papier.
Popis zážitku: Na demonštráciu experimentu sú predbežne pripravené roztoky A a B.
Riešenie A – roztok feroínu, komplex železa(II) s o-fenantrolínom (fen). Do 100 ml odmernej banky sa pridá 0,70 g heptahydrátu síranu železnatého (alebo 0,99 g Mohrovej soli) a 1,49 g o-fenantrolínu, objem roztoku sa upraví vodou po značku a premieša sa. Roztok získava červenú farbu v dôsledku tvorby fenantrolínového komplexu železa (II):
Fe 2+ + 3 fen = 2+
Riešenie B - roztok kyseliny brómmalónovej (pripravený bezprostredne pred demonštráciou). Do Erlenmeyerovej banky so zabrúsenou zátkou sa vloží 3,3 ml roztoku bromidu draselného, 5 ml roztoku kyseliny malónovej a 5 ml koncentrovanej kyseliny sírovej. Výsledný roztok sa titruje z byrety nasýteným roztokom bromičnanu draselného za miešania po pridaní každej dávky titračného činidla, čím sa dosiahne vymiznutie hnedej farby v dôsledku uvoľnenia brómu v paralelnej prepínacej reakcii:
Br03- + 5Br - + 6H+ = 3Br2 + 3H20
3Br2 + 2CH2(COOH)2 + 2H20 \u003d BrCH (COOH)2 + HCOOH + CO2 + 5HBr
Celkový objem roztoku bromičnanu draselného použitého na titráciu by mal byť približne 7,5 ml. Výsledná kyselina brómmalónová je nestabilná, ale určitý čas sa môže skladovať pri teplote 510 0 C.
Na priamu demonštráciu experimentu sa na sklenenú platňu zakrývajúcu okienko polylux light položí Petriho miska, do ktorej sa postupne pridá 10 ml nasýteného roztoku bromičnanu draselného, 4 ml roztoku kyseliny brómmalónovej a 1,5 ml roztoku feroínu. pridávané pomocou pipiet. V priebehu niekoľkých minút sa na červenom pozadí objavia modré škvrny v dôsledku tvorby fenantrolínového komplexu železa (III). 3+ ako výsledok oxidácie zodpovedajúceho komplexu železa (II):
6 2+ + 6H30 + + Br03 – = 6 3+ + 9H20 + Br –
Tento proces sa sám urýchľuje. Výsledný komplex 3+ oxiduje kyselinu brómmalónovú za tvorby bromidových iónov:
43+ + BrCH(COOH)2 + 7H20 =
\u003d 2CO 2 + 5H 3 O + + Br - + HCOOH + 4 2+
Uvoľnené bromidové ióny sú inhibítormi oxidácie komplexov železa (II) bromičnanovými iónmi. Iba pri koncentrácii komplexných iónov 2+ sa dostatočne zvýši, inhibičná aktivita bromidových iónov sa prekoná a roztok sa zmení na modrý v dôsledku tvorby komplexu trojmocného železa. Proces sa opakuje znova a znova, takže farba roztoku sa periodicky mení z modrej na ružovú alebo naopak. Zmena farby začína objavením sa modrých škvŕn na ružovom pozadí, z ktorých sa koncentrické vlny farieb rozchádzajú vo všetkých smeroch. V priebehu času sa rýchlosť zmeny farby znižuje a nakoniec proces vybledne. V tomto prípade možno na obrazovke pozorovať výskyt „čiernych bodiek“ projekcie bublín uvoľneného oxidu uhličitého.
Paletu farieb je možné rozšíriť pridaním niekoľkých kryštálov hexahydrátu dusičnanu ceritého do Petriho misky. Ce(N03)3. 6H20. Potom okrem modrej a ružovej farby možno pozorovať žltú (kvôli tvorbe zlúčenín céru (IV)) alebo zelenú farbu (kvôli prekrývaniu žltej a modrej farby):
6Ce3+ + Br03 – + 15H20 = 6 2+ + Br – + 6H30 +
42+ + BrCH(COOH)2 + 3H30+ =
\u003d 2CO2 + Br - + HCOOH + 4Ce3+ + 9H20
Pri zahrievaní sa rýchlosť reakcie zvyšuje a zmena farby sa zrýchľuje.
Poznámka. Fenantrolín je heterocyklická zlúčenina s dvoma atómami dusíka, ktoré majú osamelé páry elektrónov a sú schopné koordinácie. V komplexných zlúčeninách so železom O-fenantrolín hrá úlohu bidentátneho ligandu a tvorí silné komplexy chelátového typu.
Záver.
Do dnešného dňa zaujala Belousov-Žabotinského reakcia svoje právoplatné miesto vo svetovej vede. Každoročne sa vo svete koná niekoľko medzinárodných konferencií o dynamike nelineárnych chemických systémov a slová „BZ-reaction“ (skratka: Belousov-Žabotinského reakcie) zaznievajú na desiatkach ďalších konferencií venovaných problémom fyziky, chémie, a biológie.
Štúdium Belousovovej-Žabotinského reakcie, ako som sa presvedčil, má veľký význam, pretože našla uplatnenie v rôznych oblastiach vedy a techniky. Táto reakcia sa používa ako model pre štúdium hrozivého porušenia srdca - arytmií a fibrilácií. A nedávno sa začali experimenty so svetlocitlivou modifikáciou tejto reakcie, kedy dynamika v tomto systéme závisí od intenzity svetla. Ukázalo sa, že takáto reakcia môže byť použitá ako počítač na ukladanie a spracovanie obrázkov. Svetlocitlivá modifikácia Belousovovej-Žabotinského reakcie môže slúžiť ako prototyp počítačového komplexu, ktorý môže nahradiť počítač.
Na druhej strane, oscilačné chemické reakcie sú živým príkladom samoorganizácie v neživej prírode a v tomto zmysle majú nielen prírodovedný, ale aj filozofický význam. Zásadné zmeny v prírodných vedách, ktoré viedli k takzvanej teórii samoorganizácie, sú do značnej miery spôsobené prvotným impulzom, ktorý jej dali ruskí vedci na prelome 50. – 60. rokov 20. storočia, keď Belousov objavil redoxnú chemickú reakciu. Zároveň boli objavené pozoruhodné analógie, ukázalo sa, že mnohé prírodné javy, od formovania galaxií po tornáda, cyklóny a hru svetla na reflexných povrchoch, sú v skutočnosti procesmi samoorganizácie. Môžu mať veľmi odlišnú povahu: chemickú, mechanickú, optickú, elektrickú atď.
Aplikovaný výskum tak získava čoraz väčšiu váhu napríklad v oblasti modelovania alternatívnych prostriedkov spracovania informácií (najmä analýza zložitých mozaík s gradáciou jasu objektov). Ďalším novým smerom aplikovaného výskumu je štúdium vlastností polymerizácie v systéme BZ alebo podobných.
Komplexná časopriestorová organizácia vykazovaná systémom BZ v neprítomnosti miešania nakoniec našla analógie v prírode, v biologických systémoch (napríklad: periodické procesy bunkového metabolizmu, vlny aktivity v srdcovom tkanive a mozgových tkanivách, procesy prebiehajúce pri úroveň neekologických systémov), vo svojom novom odbore - synergetika (teórie samoorganizácie), ako aj experimentálne práce iniciovali rozvoj modernej teórie dynamických systémov. Hoci v súčasnosti je už väčšina takýchto reakcií pochopená, príčiny, ktoré spôsobujú oscilačné chemické procesy, zostávajú až do konca nejasné.
V súčasnosti je kinetika oscilačných reakcií rýchlo sa rozvíjajúcim odvetvím poznania, ktoré vzniklo na priesečníku chémie, biológie, medicíny, fyziky a matematiky. Bolo pre mňa veľmi zaujímavé zoznámiť sa s takými nezvyčajnými a na prvý pohľad nemožnými vlastnosťami živej hmoty. Ale ešte viac ma zarazilo, že taký neuveriteľný význam, pôsobivý objav po mnoho rokov ostatní nevnímali a veľké mysle tej doby ho jednoducho nepochopili. Tento objav prešiel tŕnistou cestou a nakoniec zaujal svoje právoplatné miesto vo svetovej vede. A samotná možnosť takejto reakcie opäť dokazuje, že v našom svete je ešte veľa neznámeho a neprebádaného.
Aplikácia.
Recepty na niektoré oscilačné reakcie
Recept 1: Je potrebné pripraviť roztoky nasledujúcich látok na základe ich konečných koncentrácií: kyselina malónová 0,2 M; bromičnan sodný 0,3 M; kyselina sírová 0,3 M; ferroin 0,005 M. Feroin je možné nahradiť dvojmocným mangánom alebo trojmocným síranom céru, ale intenzita farby bude oveľa slabšia. Asi 5 ml roztoku všetkých zložiek sa musí naliať do Petriho misky tak, aby hrúbka vrstvy kvapaliny bola 0,5-1 mm. Po 3-8 minútach (prechodné obdobie) možno pozorovať oscilácie a chemické vlny.
Recept 2: Nalejte nasledujúce roztoky do plochej priehľadnej kyvety vo vrstvách (1 ml):
- KBrO 3(0,2 mol/l)
- kyselina malónová (0,3 mol/l)
- ferroín (0,003 mol/l)
- H2SO4(0,3 mol/l)
Umiestnite kyvetu na list bieleho papiera. Rýchlosť reakcie sa môže zmeniť pridaním zásady alebo kyseliny.
Recept 3: Požadované riešenia:
- kyselina citrónová (40 g v 160 ml H2O)
- H2SO4 (1:3).
A tiež závesy:
- KBrO 3(16 g)
- Ce 2 (SO 4) 3(3-3,5 g)
Zahrejte roztok kyseliny citrónovej na 40°-50°C, potom vylejte vzorku KBr03. Pohár položte na hárok bieleho papiera a pridajte vzorku Ce 2 (SO 4) 3 a niekoľko ml H 2 SO 4. Okamžite začne dochádzať k striedaniu farieb: žltá > bezfarebná > žltá, s periódou 1-2 minút.
Recept 4: Požadované riešenia:
- H202(50 ml 30 %)
- KIO 3(7,17 g v 50 ml H20)
- HClO 4(30 ml zriedeného roztoku)
- kyselina malónová (3 g v 50 ml H20). A vešiaky:
-MnS04(1 g) a trochu škrobu.
Všetko nalejte do jedného pohára (200-250 ml), pridajte odvážené porcie, premiešajte sklenenou tyčinkou. Dochádza k striedaniu farby: bezfarebná > žltá > modrá.
Bibliografia.
1. Aliev R., Shnol S. E. "Oscilačné chemické reakcie". Kinetika a katalýza. 1998. č. 3. S. 130-133.
2. Shnol S.E. Vedomosti sú sila. 1994. č. 3. S. 62-71.
3. Zhabotinsky A. M. Samooscilácie koncentrácie. Moskva: Nauka, 1974.
4. Garel D., Garel O. Vibračné chemické reakcie / Per. z angličtiny. M.:
5. Dubnishcheva T. Ya. Koncepty moderných prírodných vied. Novosi-
birsk: YuKEA, 1997, s. 683 – 697.
6. Pojmy moderných prírodných vied. Ed. V. N. Lavrinenko,
V. P. Ratniková, M.: UNITI-DANA, 1999, S. 78 - 87.
7. Vavilin B.V. "Auto-oscilácie v chemických systémoch v kvapalnej fáze".
Príroda, 2000, č. 5, s. 19 – 25.
VIBRAČNÉ REAKCIE- trieda redoxných periodických reakcií. Reakčný mechanizmus je podobný mechanizmu pridržiavacej západky. Po prvýkrát takéto reakcie objavil v roku 1951 moskovský chemik B. P. Belousov.
Oscilačné reakcie prebiehajú za účasti katalyzátora (prvýkrát to bolo objavené v priebehu reakcie v prítomnosti iónov céru) a zvyčajne pozostávajú z dvoch stupňov.
Nevyhnutné podmienky pre výskyt takýchto reakcií:
a) rýchlosť prvého stupňa by mala výrazne prekročiť rýchlosť druhého stupňa;
b) v druhom štádiu by sa mala objaviť zlúčenina, ktorá inhibuje priebeh prvého štádia (nazýva sa inhibítor).
Podobnú reakciu možno pozorovať pri zmiešaní vodných roztokov soli céru (III) (napríklad síranu ceritého), bromičnanu draselného KBr03 a kyseliny brómmalónovej HO (O) C - CH (Br) - C (O) OH. Reakčná hmota sa okyslí kyselinou sírovou.
V prvom stupni je trojmocný ión céru (vzniknutý pri disociácii soli céru) redukovaný bromičnanový anión (je dodávaný bromičnanom draselným). V tomto prípade sa ión Ce(III) oxiduje na Ce(IV), čo je navonok viditeľné zmenou farby reakčného roztoku - ióny Ce(III) vo vodnom roztoku sú bezfarebné a Ce(IV) sú žlté.
10Ce3+ + 2Br03 – + 12H+ = 10Ce4+ + Br2 + 6H20 (I)
V ďalšom štádiu výsledný ión Ce (IV) reaguje s kyselinou brómmalónovou a oxiduje ju:
4Ce 4+ + HO(O)C – CH(Br) – C(O)OH + 2H20 =
4Ce3+ + HC(O)OH + 2C02 + 5H++ Br - (II)
V tomto prípade sa cér opäť stáva iónom Ce (III) a môže sa opäť zúčastniť reakcie I. V tomto prípade hrá úlohu typického katalyzátora, zúčastňuje sa reakcie, ale nespotrebováva sa, napriek tomu reakcia neprebehne pokračovať bez toho. Bromičnan draselný a kyselina brómmalónová sa počas reakcie spotrebúvajú, cér iba prenáša elektróny z jedného činidla do druhého (východiskové činidlá sú označené čiernou a reakčné produkty sú červené):
Zvláštnosťou tejto reakcie je, že v štádiu II sa brómový anión Br – . Inhibuje, to znamená, že inhibuje štádium I, ale neovplyvňuje štádium II. V dôsledku toho sa v reakčnom systéme akumulujú produkty stupňa II, predovšetkým ióny Ce3+. V určitom okamihu, keď sú tieto ióny nahromadené vo veľkých množstvách, ióny brómu už nemôžu inhibovať štádium I a postupuje vysokou rýchlosťou. Ce (IV) ióny sa znovu objavia v systéme a potom sa zúčastňujú na pomalom štádiu II. Ióny brómu teda zohrávajú úlohu spúšťača, ktorý zabraňuje spusteniu prvého stupňa do určitého bodu. Navonok to vyzerá takto (ióny Ce(III) vo vodnom roztoku sú bezfarebné a Ce(IV) sú žlté): reakčná hmota okamžite zožltne a potom pomaly odfarbí (obr. 4, kadička č. 1) . Farba sa mení približne každých jeden a pol minúty, časový interval zostáva nezmenený niekoľko hodín. Ak postupne pridávate spotrebné činidlá, takéto „chemické hodiny“ budú fungovať veľmi dlho. So stúpajúcou teplotou sa časový cyklus oscilačnej odozvy skracuje.
Existujú aj ďalšie príklady oscilačných reakcií. Vo vyššie opísanom systéme môžu byť ióny céru nahradené iónmi železa. Na tento účel sa používa komplex síranu Fe (II) s tromi molekulami fenantrolínu, ktorý je vo vodnom roztoku sfarbený do červena (tento komplex je široko používaný na kvantitatívne stanovenie železa):
Podobný komplex Fe(III), ktorý vzniká oxidáciou, je sfarbený do modra, v priebehu reakcie sa modrá farba okamžite zmení na červenú, ktorá sa postupne opäť zmení na modrú (obr. 4, kadička č. 2). .
Ak kyselinu brómmalónovú nahradíme citrónovou [HOC(O)CH 2 ] 2 C(OH)C(O)OH, potom v prítomnosti katalytických množstiev solí mangánu vzniká systém, v ktorom farba pulzuje každé dve minúty (obr. 4, sklo č. Kyselina šťavelová-octová HOC(O)CH 2 C(O)C(O)OH so soľami céru počíta šesťsekundové intervaly (sklo č. 4). Časové intervaly na animovanom obrázku sú zobrazené podmienene, najdlhší interval zmeny farby je v pohári č. 3, najmenší je v pohári č. 4
Čoskoro po objavení takýchto reakcií bolo možné zistiť, že takéto procesy sú celkom bežné. V dôsledku toho bola vyvinutá všeobecná teória oscilačných procesov, ktoré zahŕňajú niektoré reakcie v plynnej fáze (napríklad oxidáciu uhľovodíkov), heterofázovú oxidáciu oxidu uhoľnatého, vodíka, amoniaku, etylénu na kovových katalyzátoroch a množstvo polymerizácií. procesy. Oscilačné reakcie určujú priebeh niektorých najdôležitejších biologických procesov: generovanie nervových impulzov a mechanizmus svalovej kontrakcie.
Michail Levický