În secțiunea despre întrebarea Experiența lui Stern? spune pe scurt cel mai important lucru cerut de autor neuropatolog cel mai bun răspuns este Experimentul Stern a fost un experiment efectuat pentru prima dată de fizicianul german Otto Stern în 1920. Experimentul a fost una dintre primele dovezi practice ale validității teoriei cinetice moleculare a structurii materiei. A măsurat direct viteza mișcării termice a moleculelor și a confirmat prezența unei distribuții a moleculelor de gaz în funcție de viteză.
Pentru a desfășura experimentul, Stern a pregătit un dispozitiv format din doi cilindri cu raze diferite, a căror axă a coincis și a fost plasat pe el un fir de platină acoperit cu un strat de argint. O presiune suficient de scăzută a fost menținută în spațiul din interiorul cilindrilor prin pomparea continuă a aerului. Când un curent electric a fost trecut prin fir, a fost atins punctul de topire al argintului, datorită căruia atomii au început să se evapore și au zburat către suprafața interioară a cilindrului mic uniform și rectiliniu cu o viteză v corespunzătoare tensiunii aplicate la capetele firului. În cilindrul interior a fost făcută o fantă îngustă, prin care atomii puteau zbura mai departe fără piedici. Pereții cilindrilor au fost special răciți, ceea ce a contribuit la „așezarea” atomilor căzuți pe ei. În această stare, pe suprafața interioară a cilindrului mare s-a format o bandă îngustă destul de clară de placă de argint, situată direct vizavi de fanta cilindrului mic. Apoi întregul sistem a început să se rotească cu o anumită viteză unghiulară suficient de mare ω. În acest caz, banda plăcii s-a deplasat în direcția opusă direcției de rotație și și-a pierdut claritatea. Măsurând deplasarea celei mai întunecate părți a benzii față de poziția sa când sistemul era în repaus, Stern a determinat timpul de zbor, după care a găsit viteza de mișcare a moleculelor:
,
unde s este deplasarea benzii, l este distanța dintre cilindri și u este viteza de mișcare a punctelor cilindrului exterior.
Viteza de mișcare a atomilor de argint găsită în acest fel a coincis cu viteza calculată după legile teoriei cinetice moleculare, iar faptul că banda rezultată a fost neclară a mărturisit faptul că vitezele atomilor sunt diferite și distribuite în funcție de o anumită lege - legea distribuției lui Maxwell: atomii, cei care se mișcă mai repede s-au deplasat față de banda obținută în repaus pe distanțe mai scurte decât cei care se mișcă mai încet
Breloc
Pro
(641)
trebuie să alegi, dar ce ai vrut?
În a doua jumătate a secolului al XIX-lea, studiul mișcării browniene (haotice) a moleculelor a trezit un interes puternic în rândul multor fizicieni teoreticieni ai vremii. Substanța dezvoltată de omul de știință scoțian James, deși a fost general acceptată în cercurile științifice europene, a existat doar într-o formă ipotetică. Atunci nu a existat nicio confirmare practică. Mișcarea moleculelor a rămas inaccesibilă observației directe, iar măsurarea vitezei lor părea pur și simplu o problemă științifică insolubilă.
De aceea, experimentele capabile să demonstreze în practică însuși faptul structurii moleculare a materiei și să determine viteza de mișcare a particulelor ei invizibile au fost inițial percepute ca fundamentale. Importanța decisivă a unor astfel de experimente pentru știința fizică a fost evidentă, deoarece a făcut posibilă obținerea unei justificări practice și a unei dovezi a validității uneia dintre cele mai progresiste teorii ale vremii - cinetica moleculară.
Până la începutul secolului al XX-lea, știința mondială a atins un nivel suficient de dezvoltare pentru apariția unor posibilități reale de verificare experimentală a teoriei lui Maxwell. Fizicianul german Otto Stern în 1920, folosind metoda fasciculului molecular, care a fost inventată de francezul Louis Dunoyer în 1911, a reușit să măsoare viteza de mișcare a moleculelor de gaz de argint. Experimentul lui Stern a dovedit irefutabil validitatea legii.Rezultatele acestui experiment au confirmat corectitudinea evaluării atomilor, care a rezultat din presupunerile ipotetice făcute de Maxwell. Adevărat, experiența lui Stern a putut oferi doar informații foarte aproximative despre însăși natura gradației vitezei. Știința a trebuit să aștepte încă nouă ani pentru informații mai detaliate.

Lammert a putut verifica legea distribuției cu o mai mare acuratețe în 1929, care a îmbunătățit oarecum experimentul lui Stern prin trecerea unui fascicul molecular printr-o pereche de discuri rotative care aveau găuri radiale și erau deplasate unul față de celălalt printr-un anumit unghi. Schimbând viteza de rotație a unității și unghiul dintre găuri, Lammert a reușit să izoleze molecule individuale din fascicul care au caracteristici de viteză diferite. Dar experiența lui Stern a pus bazele cercetării experimentale în domeniul teoriei cinetice moleculare.

În 1920, a fost creată prima instalație experimentală necesară pentru realizarea unor experimente de acest fel. Era format dintr-o pereche de cilindri proiectați personal de Stern. În interiorul dispozitivului a fost plasată o tijă subțire de platină acoperită cu argint, care s-a evaporat când axa a fost încălzită cu electricitate. În condiții de vid care au fost create în interiorul instalației, un fascicul îngust de atomi de argint a trecut printr-o fantă longitudinală tăiată pe suprafața cilindrilor și s-a așezat pe un ecran special extern. Desigur, unitatea era în mișcare, iar în timpul în care atomii au ajuns la suprafață, a reușit să se rotească printr-un anumit unghi. În acest fel, Stern a determinat viteza de mișcare a acestora.
Dar aceasta nu este singura realizare științifică a lui Otto Stern. Un an mai târziu, el, împreună cu Walter Gerlach, a efectuat un experiment care a confirmat prezența spinului în atomi și a dovedit faptul cuantizării lor spațiale. Experimentul Stern-Gerlach a necesitat crearea unei configurații experimentale speciale, cu putere în centrul său. Sub influența câmpului magnetic generat de această componentă puternică, acestea au fost deviate în funcție de orientarea propriului spin magnetic.
Cursul 5
Ca urmare a numeroaselor ciocniri ale moleculelor de gaz între ele (~10 9 ciocniri pe 1 secundă) și cu pereții vasului, se stabilește o anumită distribuție statistică a moleculelor în funcție de viteză. În acest caz, toate direcțiile vectorilor de viteză moleculară se dovedesc a fi la fel de probabile, iar modulele de viteză și proiecțiile lor pe axele de coordonate respectă anumite legi.
În timpul coliziunilor, viteza moleculelor se schimbă aleatoriu. Se poate dovedi că una dintre moleculele dintr-o serie de ciocniri va primi energie de la alte molecule și energia sa va fi semnificativ mai mare decât valoarea medie a energiei la o anumită temperatură. Viteza unei astfel de molecule va fi mare, dar va avea totuși o valoare finită, deoarece viteza maximă posibilă este viteza luminii - 3·10 8 m/s. În consecință, viteza unei molecule poate avea în general valori de la 0 la unele υ max. Se poate argumenta că vitezele foarte mari în comparație cu valorile medii sunt rare, la fel ca și cele foarte mici.
După cum arată teoria și experimentele, distribuția moleculelor în funcție de viteză nu este întâmplătoare, ci destul de definită. Să determinăm câte molecule sau ce parte din molecule au viteze care se află într-un anumit interval în apropierea unei viteze date.
Fie ca o anumită masă de gaz să conțină N molecule, în timp ce dN moleculele au viteze cuprinse între υ inainte de υ +dυ. Evident, acesta este numărul de molecule dN proporțional cu numărul total de molecule Nși valoarea intervalului de viteză specificat dυ
Unde A- coeficientul de proporţionalitate.
De asemenea, este evident că dN depinde de viteza υ , deoarece la intervale de aceeași dimensiune, dar la valori absolute diferite ale vitezei, numărul de molecule va fi diferit (exemplu: comparați numărul de oameni care trăiesc la vârsta de 20 - 21 de ani și 99 - 100 de ani). Aceasta înseamnă că coeficientul Aîn formula (1) trebuie să fie o funcție a vitezei.
![]()
Ținând cont de acest lucru, rescriem (1) sub formă
![]() (2)
(2)
Din (2) obținem
 (3)
(3)
Funcţie f(υ ) se numește funcție de distribuție. Semnificația sa fizică rezultă din formula (3)
 dacă (4)
dacă (4)
Prin urmare, f(υ ) este egală cu fracția relativă a moleculelor ale căror viteze sunt conținute într-un interval unitar de viteză în apropierea vitezei υ . Mai exact, funcția de distribuție are semnificația probabilității ca orice moleculă de gaz să aibă o viteză conținută în interval unitar aproape de viteza υ . De aceea o cheamă probabilitate densitate.
Integrând (2) peste toate valorile vitezei de la 0 până la obținem
 (5)
(5)
Din (5) rezultă că
 (6)
(6)
Ecuația (6) se numește starea de normalizare funcții. Determină probabilitatea ca o moleculă să aibă una dintre valorile vitezei de la 0 la . Viteza moleculei are o anumită semnificație: acest eveniment este de încredere și probabilitatea sa este egală cu unu.
Funcţie f(υ ) a fost găsit de Maxwell în 1859. Ea a fost numită Distribuția Maxwell:
 (7)
(7)
Unde A– coeficient care nu depinde de viteza, m- masa moleculara, T– temperatura gazului. Folosind condiția de normalizare (6) putem determina coeficientul A:

Luând această integrală, obținem A:

Ținând cont de coeficient A Funcția de distribuție Maxwell are forma:
 (8)
(8)
La crestere υ factorul din (8) se schimbă mai repede decât crește υ 2. Prin urmare, funcția de distribuție (8) începe de la origine, atinge un maxim la o anumită valoare a vitezei, apoi scade, apropiindu-se asimptotic de zero (Fig. 1).

Fig.1. Distribuția maxwelliană a moleculelor
prin viteza. T 2 > T 1
Folosind curba de distribuție Maxwell, puteți găsi grafic numărul relativ de molecule ale căror viteze se află într-un interval dat de viteză de la υ inainte de dυ(Fig. 1, zona benzii umbrite).
Evident, întreaga zonă de sub curbă oferă numărul total de molecule N. Din ecuația (2), ținând cont de (8), găsim numărul de molecule ale căror viteze se află în intervalul de la υ inainte de dυ
 (9)
(9)
Din (8) este, de asemenea, clar că forma specifică a funcției de distribuție depinde de tipul de gaz (masa moleculei m) și temperatură și nu depinde de presiunea și volumul gazului.
Dacă un sistem izolat este scos din echilibru și lăsat la dispoziție, atunci după o anumită perioadă de timp va reveni la echilibru. Această perioadă de timp se numește timp de relaxare. Este diferit pentru sisteme diferite. Dacă gazul se află într-o stare de echilibru, atunci distribuția moleculelor în funcție de viteză nu se modifică în timp. Vitezele moleculelor individuale se schimbă constant, dar numărul de molecule dN, ale căror viteze se află în intervalul de la υ inainte de dυ rămâne constantă tot timpul.
Distribuția maxwelliană a vitezei moleculelor este întotdeauna stabilită atunci când sistemul atinge o stare de echilibru. Mișcarea moleculelor de gaz este haotică. Definiția exactă a aleatoriei mișcării termice este următoarea: mișcarea moleculelor este complet haotică dacă vitezele moleculelor sunt distribuite conform lui Maxwell. Rezultă că temperatura este determinată de energia cinetică medie şi anume mişcări haotice. Indiferent cât de mare este viteza vântului puternic, acesta nu îl va face „fierbinte”. Chiar și cel mai puternic vânt poate fi atât rece, cât și cald, deoarece temperatura gazului este determinată nu de viteza direcțională a vântului, ci de viteza mișcării haotice a moleculelor.
Din graficul funcției de distribuție (Fig. 1) este clar că numărul de molecule ale căror viteze se află în aceleași intervale d υ , dar aproape de viteze diferite υ , mai mult dacă viteza υ se apropie de viteza care corespunde maximului functiei f(υ ). Această viteză υ n se numește cel mai probabil (cel mai probabil).
Să diferențiem (8) și să echivalăm derivata cu zero:

Deoarece  ,
,
atunci ultima egalitate este satisfăcută atunci când:

 (10)
(10)
Ecuația (10) este satisfăcută atunci când:
ȘI 
Primele două rădăcini corespund valorilor minime ale funcției. Apoi găsim viteza care corespunde maximului funcției de distribuție din condiția:

Din ultima ecuație:
 (11)
(11)
Unde R– constanta universală a gazului, μ - Masă molară.
Ținând cont de (11) din (8) putem obține valoarea maximă a funcției de distribuție
 (12)
(12)
Din (11) și (12) rezultă că odată cu creșterea T sau când scade m curba maxima f(υ ) se deplasează spre dreapta și devine mai mic, dar aria de sub curbă rămâne constantă (Fig. 1).
Pentru a rezolva multe probleme, este convenabil să folosiți distribuția Maxwell în forma sa redusă. Să introducem viteza relativă:
Unde υ - viteza dată, υ n- viteza cea mai probabilă. Ținând cont de acest lucru, ecuația (9) ia forma:
 (13)
(13)
(13) este o ecuație universală. În această formă, funcția de distribuție nu depinde de tipul de gaz sau de temperatură.
Curba f(υ ) este asimetric. Din grafic (Fig. 1) este clar că majoritatea moleculelor au viteze mai mari decât υ n. Asimetria curbei înseamnă că viteza medie aritmetică a moleculelor nu este egală υ n. Viteza medie aritmetică este egală cu suma vitezelor tuturor moleculelor împărțită la numărul lor:

Să luăm în considerare că conform (2)
![]()
 (14)
(14)
Înlocuind în (14) valoarea f(υ ) din (8) se obține viteza medie aritmetică:
 (15)
(15)
Pătratul mediu al vitezei moleculelor se obține prin calcularea raportului dintre suma pătratelor vitezei tuturor moleculelor și numărul lor:

După înlocuire f(υ ) din (8) obținem:

Din ultima expresie găsim viteza pătratică medie:
 (16)
(16)
Comparând (11), (15) și (16), putem concluziona că și depind în mod egal de temperatură și diferă doar în valori numerice: (Fig. 2).

Fig.2. Distribuția Maxwell pe valori absolute ale vitezei
Distribuția Maxwell este valabilă pentru gazele aflate în stare de echilibru; numărul de molecule luate în considerare trebuie să fie suficient de mare. Pentru un număr mic de molecule, pot fi observate abateri semnificative de la distribuția Maxwell (fluctuații).
Prima determinare experimentală a vitezelor moleculare a fost efectuată de rautaciosîn 1920. Dispozitivul lui Stern era format din doi cilindri cu raze diferite montați pe aceeași axă. Aerul din cilindri a fost pompat într-un vid profund. Un fir de platină acoperit cu un strat subțire de argint a fost întins de-a lungul axei. Când un curent electric a fost trecut prin filament, acesta s-a încălzit la o temperatură ridicată (~1200 o C), ceea ce a dus la evaporarea atomilor de argint.

În peretele cilindrului interior a fost făcută o fantă longitudinală îngustă, prin care au trecut atomi de argint în mișcare. Depuse pe suprafața interioară a cilindrului exterior, ele formau o bandă subțire clar vizibilă chiar în fața fantei.

Cilindrii au început să se rotească cu o viteză unghiulară constantă ω. Acum, atomii care au trecut prin fantă nu s-au mai așezat direct vizavi de fantă, ci au fost deplasați cu o anumită distanță, deoarece în timpul zborului lor cilindrul exterior a avut timp să se rotească printr-un anumit unghi. Când cilindrii se roteau cu o viteză constantă, poziția benzii formate din atomi pe cilindrul exterior s-a deplasat cu o anumită distanță l.

Particulele se depun în punctul 1 când instalația este staționară; când instalația se rotește, particulele se depun în punctul 2.

Valorile vitezei obținute au confirmat teoria lui Maxwell. Cu toate acestea, această metodă a furnizat informații aproximative despre natura distribuției vitezei moleculelor.
Distribuția Maxwell a fost verificată mai precis prin experimente Lammert, Easterman, Eldridge și Costa. Aceste experimente au confirmat destul de precis teoria lui Maxwell.
Măsurătorile directe ale vitezei atomilor de mercur dintr-un fascicul au fost făcute în 1929 Lammert. O diagramă simplificată a acestui experiment este prezentată în Fig. 3.

Fig.3. Diagrama experimentului lui Lammert
1 - discuri cu rotație rapidă, 2 - fante înguste, 3 - cuptor, 4 - colimator, 5 - traiectoria moleculelor, 6 - detector
Două discuri 1, montate pe o axă comună, aveau fante radiale 2, deplasate unul față de celălalt sub un unghi φ . Vizavi de fante se afla cuptorul 3, în care metalul fuzibil era încălzit la o temperatură ridicată. Atomi de metal încălziți, în acest caz mercur, au zburat din cuptor și, folosind colimatorul 4, au fost direcționați în direcția necesară. Prezența a două fante în colimator a asigurat mișcarea particulelor între discuri de-a lungul unui drum drept 5. În continuare, atomii care au trecut prin fantele din discuri au fost înregistrați cu ajutorul unui detector 6. Întreaga instalație descrisă a fost plasată în vid profund. .
Când discurile se roteau cu o viteză unghiulară constantă ω, numai atomii care aveau o anumită viteză treceau liber prin fante. υ . Pentru atomii care trec prin ambele fante, egalitatea trebuie îndeplinită:

unde Δ t 1 - timpul de zbor al moleculelor între discuri, Δ t 2 - timpul pentru a întoarce discurile într-un unghi φ . Apoi:
Prin modificarea vitezei unghiulare de rotație a discurilor, a fost posibilă izolarea moleculelor cu o anumită viteză din fascicul. υ , iar din intensitatea înregistrată de detector, judecă conținutul lor relativ în fascicul.
În acest fel, a fost posibil să se verifice experimental legea lui Maxwell a distribuției vitezei moleculare.
Filme documentare educaționale. Seria „Fizica”.
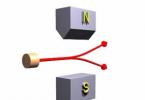
Prezența momentelor magnetice în atomi și cuantificarea lor a fost dovedită prin experimente directe ale lui Stern și Gerlach (1889-1979) în 1921. Într-un vas cu vid înalt, a fost creat un fascicul atomic puternic limitat al elementului studiat folosind diafragme, evaporându-se într-un cuptor K. Fasciculul a trecut printr-un câmp magnetic puternic N
între piesele polare N și S ale electromagnetului. Unul dintre vârfuri (N) arăta ca o prismă cu o margine ascuțită, iar de-a lungul celuilalt (S) a fost prelucrată o canelură. Datorită acestui design al pieselor polare, câmpul magnetic a fost foarte neomogen. După ce a trecut prin câmpul magnetic, fasciculul a lovit placa fotografică P și a lăsat o urmă pe ea.
Să calculăm mai întâi comportamentul unui fascicul atomic din punct de vedere clasic, presupunând că nu există o cuantificare a momentelor magnetice. Dacă momentul m-magnetic al unui atom, atunci forța acționează asupra atomului într-un câmp magnetic neuniform
Să direcționăm axa Z de-a lungul câmpului magnetic (adică de la N la S perpendicular pe piesele polare). Atunci proiecția forței în această direcție va fi
Primii doi termeni din această expresie nu joacă niciun rol.
De fapt, conform conceptelor clasice, un atom dintr-un câmp magnetic precedă în jurul axei Z, rotindu-se cu frecvența Larmor.
(sarcina electronului se notează -e). Prin urmare, proiecțiile oscilează cu aceeași frecvență, devenind alternativ pozitive și negative. Dacă viteza unghiulară a precesiei este suficient de mare, atunci forța fz poate fi mediată în timp. În acest caz, primii doi termeni din expresia pentru fz vor dispărea și putem scrie
Pentru a ne face o idee despre gradul de admisibilitate al unei astfel de medieri, să facem o evaluare numerică. Perioada precesiunii Larmor este:
unde câmpul H se măsoară în gauss. De exemplu, la H = 1000 G obținem s. Daca viteza atomilor din fascicul este = 100 m/s = cm/s, atunci in acest timp atomul parcurge o distanta de cm, ceea ce este neglijabil fata de toate dimensiunile caracteristice ale instalatiei. Aceasta dovedește aplicabilitatea medierii efectuate.
Dar formula poate fi justificată și din punct de vedere cuantic. De fapt, includerea unui câmp magnetic puternic de-a lungul axei Z duce la o stare atomică cu o singură componentă specifică a momentului magnetic și anume . Cele două componente rămase în această stare nu pot avea anumite valori. La măsurarea în această stare, am obține valori diferite și, în plus, mediile lor ar fi egale cu zero. Prin urmare, chiar și din considerente cuantice, media este justificată.
Cu toate acestea, ar trebui să ne așteptăm la rezultate experimentale diferite din punct de vedere clasic și cuantic. În experimentele lui Stern și Gerlach, o urmă a unui fascicul atomic a fost obținută mai întâi cu câmpul magnetic oprit și apoi cu acesta pornit. Dacă proiecția ar putea prelua toate valorile continue posibile, așa cum o cere teoria clasică, atunci forța fz ar lua și toate valorile continue posibile. Pornirea unui câmp magnetic ar duce doar la lărgirea fasciculului. Nu este ceea ce ne-am aștepta de la teoria cuantică. În acest caz, proiecția mz și, odată cu aceasta, forța medie fz, sunt cuantificate, adică pot lua doar un număr de valori selectate discrete. Dacă numărul cuantic orbital al unui atom este egal cu eu, apoi conform teoriei, la împărțire, rezultatul va fi fascicule (adică este egal cu numărul de valori posibile pe care le poate lua numărul cuantic m). Astfel, în funcție de valoarea numărului eu ne-am aștepta ca fasciculul să se împartă în 1, 3, 5, ... componente. Numărul așteptat de componente ar trebui să fie întotdeauna impar.
Experimentele lui Stern și Gerlach au demonstrat cuantificarea proiecției. Cu toate acestea, rezultatele lor nu corespund întotdeauna teoriei prezentate mai sus. Experimentele inițiale au folosit fascicule de atomi de argint. Într-un câmp magnetic, fasciculul a fost împărțit în două componente. La fel s-a întâmplat și cu atomii de hidrogen. Pentru atomii altor elemente chimice, s-a obținut un model de scindare mai complex, dar numărul de fascicule divizate nu a fost doar impar, ceea ce era cerut de teorie, ci și par, ceea ce îl contrazicea. A fost necesar să se facă ajustări la teorie.
La aceasta ar trebui adăugate rezultatele experimentelor lui Einstein și de Haas (1878-1966), precum și experimentele lui Barnet (1873-1956) pentru determinarea raportului giromagnetic. Pentru fier, de exemplu, s-a dovedit că raportul giromagnetic este egal cu, adică de două ori mai mare decât este cerut de teorie.
În cele din urmă, s-a dovedit că termenii spectrale ai metalelor alcaline au o așa-numită structură dubletă, adică sunt formate din două niveluri apropiate. Pentru a descrie această structură a trei numere cuantice n, eu, m s-a dovedit a fi insuficient - a fost necesar un al patrulea număr cuantic. Acesta a fost motivul principal care i-a servit lui Uhlenbeck (n. 1900) și Goudsmit (1902-1979) în 1925 pentru a introduce ipoteza spinului electronului. Esența acestei ipoteze este că electronul nu are doar moment unghiular și moment magnetic asociat cu mișcarea acestei particule în ansamblu. Electronul are și un moment unghiular mecanic propriu sau intern, care amintește în acest sens de un vârf clasic. Acest moment unghiular intrinsec se numește spin (din cuvântul englezesc to spin - to spin). Momentul magnetic corespunzător se numește momentul magnetic de spin. Aceste momente sunt notate în mod corespunzător prin, spre deosebire de momentele orbitale.Spinul este cel mai adesea notat simplu prin s.
În experimentele lui Stern și Gerlach, atomii de hidrogen erau în starea s, adică nu aveau momente orbitale. Momentul magnetic al nucleului este neglijabil. Prin urmare, Uhlenbeck și Goudsmit au sugerat că divizarea fasciculului este cauzată nu de orbital, ci de momentul magnetic de spin. Același lucru este valabil și pentru experimentele cu atomi de argint. Atomul de argint are un singur electron exterior. Datorită simetriei sale, nucleul atomic nu are spin și momente magnetice. Întregul moment magnetic al unui atom de argint este creat de un singur electron exterior. Când atomul este în stare normală, adică în starea s, atunci impulsul orbital al electronului de valență este zero - întregul impuls este spin.
Uhlenbeck și Goudsmit înșiși au presupus că spinul apare din cauza rotației electronului în jurul propriei axe. Modelul atomului care exista la acea vreme a devenit și mai asemănător cu sistemul solar. Electronii (planete) nu se rotesc doar în jurul nucleului (Soarele), ci și în jurul propriilor axe. Cu toate acestea, inconsistența unei astfel de idei clasice a spatelui a devenit imediat clară. Pauli a introdus sistematic spin în mecanica cuantică, dar a exclus orice posibilitate de interpretare clasică a acestei mărimi. În 1928, Dirac a arătat că spinul electronului era inclus automat în teoria sa despre electron, bazată pe ecuația de undă relativistă. Teoria lui Dirac conține și momentul magnetic de spin al electronului, iar pentru raportul giromagnetic se obține o valoare care este în concordanță cu experimentul. În același timp, nu s-a spus nimic despre structura internă a electronului - acesta din urmă a fost considerat ca o particulă punctuală doar cu sarcină și masă. Astfel, spinul electronului s-a dovedit a fi un efect relativist cuantic care nu are o interpretare clasică. Apoi conceptul de spin, ca moment unghiular intern, a fost extins la alte particule elementare și complexe și a găsit confirmare și aplicare largă în fizica modernă.
Desigur, într-un curs de fizică generală nu există nicio oportunitate de a intra într-o teorie detaliată și riguroasă a spinului. Luăm ca poziție inițială că spinul s corespunde unui operator vectorial ale cărui proiecții satisfac aceleași relații de comutație ca și proiecțiile operatorului moment orbital, i.e.
Din ele rezultă că pătratul spinului total și una dintre proiecțiile sale pe o anumită axă (de obicei luată ca axa Z) pot avea anumite valori în aceeași stare. Dacă valoarea maximă a proiecției sz (în unități de ) este egală cu s, atunci numărul tuturor proiecțiilor posibile corespunzătoare unui anumit s va fi egal cu 2s + 1. Experimentele lui Stern și Gerlach au arătat că pentru un electron acest număr este 2, adică 2s + 1 = 2, de unde s = 1/2. Valoarea maximă pe care o poate lua proiecția spinului pe direcția aleasă (în unități), adică numărul s, este luată ca valoare a spinului particulei.
Spinul unei particule poate fi fie întreg, fie jumătate întreg. Prin urmare, pentru un electron, spinul este 1/2. Din relațiile de comutație rezultă că spinul pătrat al unei particule este egal cu , și pentru un electron (în unități de 2).
Măsurătorile proiecției momentului magnetic folosind metoda Stern și Gerlach au arătat că pentru atomii de hidrogen și argint valoarea este egală cu magnetonul Bohr, i.e. Astfel, raportul giromagnetic pentru electron
Instituția de învățământ municipal gimnaziul nr 1
Cartierul central al Volgogradului
Lecție de fizică pe această temă
Mișcarea moleculelor. Determinarea experimentală a vitezelor moleculare
Clasa 10
Întocmită de: profesor de fizică de cea mai înaltă categorie
Petrukhina
Marina Anatolievna.
UMK: N. S. Purysheva,
N. E. Vazheevskaya,
D. A. Isaev
„Fizica - 10”, un registru de lucru pentru acest manual și o aplicație multimedia pentru manual.
Volgograd, 2015
Lecție pe tema
Mișcarea moleculelor.
Determinarea experimentală a vitezelor moleculare
Clasa 10
adnotare.
Înțelegerea celor mai importante probleme ale fizicii moderne este imposibilă fără unele, cel puțin cele mai elementare idei despre legile statistice. Considerarea unui gaz ca un sistem format dintr-un număr mare de particule ne permite să oferim într-o formă accesibilă o idee despre probabilitatea, natura statistică a legilor unor astfel de sisteme, distribuțiile statistice care indică cu ce probabilitate particulele sistemului au una sau alta valoare a parametrilor care determină starea lor, și Pe baza acesteia, conturează principalele prevederi ale teoriei clasice a gazelor. Una dintre lecțiile care ne permite să ne formăm această idee include lecția prezentată despre materialele didactice ale editurii Drofa: un manual de fizică de N. S. Purysheva, N. E. Vazheevskaya, D. A. Isaev, un caiet de lucru pentru acest manual și o aplicație multimedia pentru manual.
Notă explicativă.
Această lecție poate fi predată în timp ce studiezi subiectul „Fundamentele structurii MCT a materiei” în clasa a X-a.
Noul material de lecție permite studenților să-și aprofundeze cunoștințele de bază ale teoriei cinetice a gazelor și să-l folosească atunci când rezolvă probleme pentru a determina vitezele moleculelor diferitelor gaze.
Fiecare etapă a lecției este însoțită de un slide tematic al unei aplicații multimedia și un fragment video.
Scopul lecției:
Activitate: formarea de noi moduri de activitate la elevi (capacitatea de a pune și de a răspunde la întrebări eficiente; discutarea situațiilor problematice; capacitatea de a-și evalua activitățile și cunoștințele).
Obiectivele lecției:
Educational: dezvoltarea capacității de a analiza, compara, transfera cunoștințe în situații noi, de a-și planifica activitățile la construirea unui răspuns, de a îndeplini sarcini și de a căuta activități prin concepte fizice (viteza cea mai probabilă, viteza medie, viteza medie pătrată) și intensificarea activității mentale a elevi.
Educarea: insuflarea disciplinei în îndeplinirea sarcinilor de grup, crearea condițiilor pentru o motivație pozitivă atunci când studiază fizica, utilizarea unei varietăți de tehnici de activitate, comunicarea informațiilor interesante; cultivați un sentiment de respect față de interlocutor, o cultură individuală a comunicării.
Dezvoltare: dezvoltarea capacității de a construi enunțuri independente în vorbirea orală pe baza materialului educațional învățat, dezvoltarea gândirii logice, dezvoltarea capacității unei abordări matematice unificate pentru o descriere cantitativă a fenomenelor fizice pe baza conceptelor moleculare la rezolvarea problemelor.
Tip de lecție: lectie de invatare a materialelor noi.
Metode de predare: euristic, explicativ - ilustrativ, rezolvare de probleme, demonstrații și sarcini practice, rezolvarea problemelor de conținut fizic.
Rezultate asteptate:
să poată trage concluzii bazate pe experiment;
elaborați reguli de discuție și respectați-le;
înțelegeți semnificația problemelor discutate și manifestați interes pentru subiect.
Etapa pregătitoare: cunoștințe de ecuații de bază, dependențe de această temă (un bloc teoretic pe tema este disponibil fiecărui student sub forma unei note de curs)
Echipament: dispozitiv pentru demonstrarea experimentului lui Stern;
un computer și un proiector pentru demonstrarea prezentării și a videoclipului „The Stern Experience”.
Etapele lecției.
Etapa organizatorică (salut, verificarea pregătirii pentru lecție, starea emoțională), (1 minut)
Etapa stabilirii obiectivelor, obiectivele lecției și problemele despre metoda de măsurare a vitezei moleculelor, (4 minute)
Etapa studierii noului material educațional, afișarea diapozitivelor de prezentare cu comentariile elevilor, care vă permite să creați o impresie vizuală a subiectului, să activați memoria vizuală (verificați nivelul de stăpânire a sistemului de concepte pe această temă), (20 de minute)
Etapa de consolidare a cunoștințelor dobândite la rezolvarea problemelor (aplicarea cunoștințelor în practică și înțelegerea lor secundară), (8 minute)
Etapa de generalizare și rezumare a lecției (analiza succesului însușirii cunoștințelor și metodelor de activitate), (4 minute)
Informații despre teme (care vizează dezvoltarea ulterioară a cunoștințelor), (1 minut)
Reflecție, (2 minute)
Scriptul lecției.
Activitățile unui profesor de fizică
Activitatea elevilor
Etapa organizatorica.
Buna baieti! Mă bucur să vă urez bun venit la lecție, unde vom continua să deschidem pagini de cunoaștere a teoriei clasice a gazelor. Descoperiri interesante ne așteaptă înainte. Salutați-vă.
Atunci hai să începem...
Stabilirea obiectivelor și motivația.
În ultima lecție ne-am familiarizat cu principiile de bază ale teoriei cinetice moleculare a unui gaz ideal. Participând la mișcare haotică continuă, moleculele se ciocnesc în mod constant unele cu altele, în timp ce numărul de particule care se ciocnesc viteza lor sunt diferite în fiecare moment al timpului.
Ce crezi că ne „așteaptă” astăzi subiectul lecției?
Da, într-adevăr, scopul pe care ni l-am propus astăzi este să facem cunoștință cu una dintre metodele de determinare a vitezei de mișcare a moleculelor - metoda fasciculului molecular, propusă de fizicianul german Otto Stern în 1920.
Ne-am deschis caietele, am notat data și tema lecției de astăzi: Mișcarea moleculelor. Determinarea experimentală a vitezelor mișcării moleculare.
Să ne amintim care este viteza de mișcare termică a moleculelor?
Să calculăm viteza moleculelor de argint Ag în timpul evaporării de la suprafață, T = 1500K.
Permiteți-mi să vă reamintesc că viteza sunetului este de 330 m/s, iar viteza moleculelor de argint este de 588 m/s, comparați.
Să calculăm viteza moleculelor de hidrogen H 2 la o temperatură apropiată de zero absolut T=28K.
De exemplu: viteza unui avion de pasageri este de 900 m/s, viteza Lunii în jurul Pământului este de 1000 m/s.
Acum pune-te în locul oamenilor de știință din secolul al XIX-lea, când au fost obținute aceste date, au apărut îndoieli cu privire la corectitudinea teoriei cinetice în sine. La urma urmei, se știe că mirosurile se răspândesc destul de încet: este nevoie de timp de ordinul zecilor de secunde pentru ca mirosul de parfum vărsat într-un colț al camerei să se răspândească în alt colț.
Deci apare întrebarea: care este viteza reală a moleculelor?
Când mirosul parfumului se răspândește, există ceva care interferează cu moleculele de parfum?
Cum afectează acest lucru viteza de mișcare direcțională a moleculelor?
Să calculăm viteza moleculelor de hidrogen H 2 la o temperatură apropiată de temperatura camerei T=293K.
Atunci care este viteza? Ce?
Dar cum să-l măsori, cum să-i determinăm valoarea în practică? Să rezolvăm următoarea problemă:
Să fie 1 moleculă. Este necesar să se determine viteza drumului liber a moleculelor. Cum se mișcă moleculele între ciocniri?
Lăsați molecula să călătorească 1 metru, găsiți timpul la o viteză a hidrogenului de 1911 m/s, se dovedește a fi 0,00052 s.
După cum puteți vedea, timpul este foarte scurt.
Problema apare din nou!
Etapa de învățare a noului material educațional.
Este imposibil de rezolvat această problemă într-un cadru școlar; Otto Stern (1888-1970) a făcut-o pentru noi în 1920, înlocuind mișcarea de translație cu mișcarea de rotație.
Să urmărim un scurt videoclip și apoi să discutăm câteva probleme.
Care a fost instalația folosită de O. Stern?
Cum a fost realizat experimentul?
Valorile vitezei au fost obținute aproape de viteza calculată prin formula:
 ,
,  ,
Unde
,
Unde  – viteza liniară a punctelor de pe suprafața cilindrului B.
– viteza liniară a punctelor de pe suprafața cilindrului B.
 , Acea
, Acea
 , care este în acord cu teoria cinetică moleculară. Viteza moleculelor coincide cu cea calculată obținută pe baza MCT, aceasta a fost una dintre confirmările validității acesteia.
, care este în acord cu teoria cinetică moleculară. Viteza moleculelor coincide cu cea calculată obținută pe baza MCT, aceasta a fost una dintre confirmările validității acesteia.
Din experimentul lui O. Stern, s-a constatat că la o temperatură de 120 0 C vitezele majorității atomilor de argint se situează în intervalul de la 500 m/s la 625 m/s. Când condițiile experimentale se modifică, de exemplu, temperatura substanței din care este fabricat firul, se obțin alte valori ale vitezei, dar natura distribuției atomilor în stratul depus nu se schimbă.
De ce banda de argint din experimentul lui Stern este deplasată și neclară la margini și este, de asemenea, neuniformă ca grosime?
Ce concluzie se poate trage despre distribuția vitezei atomilor și moleculelor?
Luați în considerare tabelul nr. 12 din manualul de la pagina 98 pentru moleculele de azot. Ce se vede de pe tabel?
Fizicianul englez D.C. Maxwell a considerat, de asemenea, incredibil că toate moleculele se mișcă cu aceeași viteză. În opinia sa, la orice temperatură dată, majoritatea moleculelor au viteze care se află în limite destul de înguste, dar unele molecule se pot mișca la viteze mai mari sau mai mici. Mai mult, omul de știință credea că în fiecare volum de gaz la o anumită temperatură există molecule cu viteze atât foarte mici, cât și foarte mari. Ciocnind unele cu altele, unele molecule cresc viteza, în timp ce altele scad. Dar dacă gazul este în stare staționară, atunci numărul de molecule cu una sau alta viteză rămâne constant. Pe baza acestei idei, D. Maxwell a investigat problema distribuției vitezei moleculelor într-un gaz în stare staționară.
El a stabilit această dependență cu mult înainte de experimentele lui O. Stern. Rezultatele lucrării lui D. K. Maxwell au primit recunoaștere universală, dar nu au fost confirmate experimental. Aceasta a fost făcută de O. Stern.
Gandeste-te la asta? Care este meritul lui O. Stern?
Să ne uităm la Fig. 64 de la pagina 99 a manualului și examinați natura distribuției moleculelor după viteză.
Forma funcției de distribuție a vitezei moleculare, pe care D. Maxwell a determinat-o teoretic, a coincis calitativ cu profilul depunerii atomilor de argint pe o placă de alamă în experimentul lui O. Stern.
Studierea profilului unei benzi de argint i-a permis omului de știință să concluzioneze existența cea mai probabilă viteză medie mișcarea particulelor (adică viteza cu care se mișcă cel mai mare număr de molecule).
Unde se deplasează maximul curbei de distribuție odată cu creșterea temperaturii?
Pe lângă cele mai probabile și medii viteze, mișcarea moleculelor este caracterizată de pătratul mediu al vitezei:
 , iar rădăcina pătrată a acestei valori este viteza pătrată medie.
, iar rădăcina pătrată a acestei valori este viteza pătrată medie.
Să ne uităm din nou la modul în care a avut loc cunoașterea atunci când am studiat problema vitezei de mișcare a moleculelor?
Etapa de consolidare a cunoștințelor dobândite la rezolvarea problemelor.
Să facem calcule matematice și să testăm teoria într-o situație specifică.
Sarcina nr. 1
Ce viteză a avut molecula de vapori de argint dacă deplasarea sa unghiulară în experimentul lui Stern a fost de 5,4º la o viteză de rotație a dispozitivului de 150 sˉ¹? Distanța dintre cilindrii interior și exterior este de 2 cm.
Etapa de generalizare și rezumarea lecției
Astăzi la clasă am aflat despre una dintre metodele de determinare a vitezei de mișcare a moleculelor - metoda fasciculului molecular, propusă de fizicianul german Otto Stern.
Care este semnificația experienței lui O. Stern în dezvoltarea ideilor despre structura materiei?
Informații despre teme.
Reflecţie.
În timpul lecției noastre, v-ați arătat a fi teoreticieni observatori, capabili nu numai să observe tot ce este nou și interesant în jurul vostru, ci și să desfășoare în mod independent cercetări științifice.
Lecția noastră s-a încheiat.
Să răspundem la întrebarea: „Ce ți-a plăcut la lecție?” și „Ce ți-ai amintit despre lecție?”
Și în concluzie, vreau să citez cuvintele lui Virey:
„Toate descoperirile în științe și în filozofie provin adesea din generalizări sau din aplicarea unui fapt la alte fapte similare.”
Mulțumesc băieți pentru că lucrați împreună. M-am bucurat să te cunosc. Te văd!
Tema lecției: Determinarea vitezei de mișcare a moleculelor.
(elevii notează data și tema lecției în caiete)
(răspunsuri de la mai mulți studenți)
 , pe cealaltă parte
, pe cealaltă parte
 știind că
știind că  , de aici
, de aici
 , sau
, sau  , Unde
, Unde
 – constanta universală a gazului,
– constanta universală a gazului,  8,31
8,31 
Viteza moleculelor de argint supersonic.
590m/s, la fel!!! Nu se poate!
Ce viteză ar trebui să găsim și să măsurăm?
Moleculele de aer interferează.
Este în scădere.
Avem viteză mare și nimic nu împiedică moleculele să se miște?
Viteza pe calea liberă a moleculelor.
uniform.
Cum se măsoară?
(vizionare video)
Instalația a constat din: un fir de platină acoperit cu un strat subțire de argint, care era situat de-a lungul axei în interiorul unui cilindru cu o rază  și cilindrul exterior
și cilindrul exterior  . Aerul este pompat din cilindru.
. Aerul este pompat din cilindru.
Când un curent electric a fost trecut prin fir, acesta s-a încălzit până la o temperatură peste punctul de topire al argintului 961,9 0 C. Pereții cilindrului exterior au fost răciți astfel încât moleculele de argint să se așeze mai bine pe calea ecranului. Instalația a fost rotită cu o viteză unghiulară de 2500 – 2700 rpm.

Când dispozitivul a fost rotit, banda de argint a căpătat un aspect diferit, deoarece dacă toți atomii care zboară din fir aveau aceeași viteză, atunci imaginea fantei de pe ecran nu s-ar schimba în formă și dimensiune, ci doar s-ar schimba. ușor în lateral. Neclaritatea benzii de argint indică faptul că atomii care scapă din filamentul fierbinte se mișcă cu viteze diferite. Atomii care se mișcă rapid se mișcă mai puțin decât atomii care se mișcă cu o viteză mai mică.
Distribuția atomilor și moleculelor după viteză reprezintă un anumit tipar care caracterizează mișcarea acestora.
Tabelul arată că cel mai mare număr de molecule de azot au viteze de la 300 m/s la 500 m/s.
91% dintre molecule au viteze incluse în intervalul de la 100 m/s la 700 m/s.
9% dintre molecule au viteze mai mici de 100 m/s și mai mari de 700 m/s.
O. Stern, folosind metoda fasciculului molecular inventată de fizicianul francez Louis Dunoyer (1911), a măsurat viteza moleculelor de gaz și a confirmat experimental distribuția moleculelor de gaz după viteza obținută de D. C. Maxwell. Rezultatele experimentului lui Stern au confirmat corectitudinea estimării vitezei medii a atomilor, care rezultă din distribuția Maxwell.
 Din grafic a fost posibil să se determine deplasarea pentru mijlocul imaginii fantei și, în consecință, să se calculeze viteza medie
mișcarea atomilor.
Din grafic a fost posibil să se determine deplasarea pentru mijlocul imaginii fantei și, în consecință, să se calculeze viteza medie
mișcarea atomilor.
 La T 2 T 1 maximul curbei de distribuție se deplasează în regiunea valorilor de viteză mai mari.
La T 2 T 1 maximul curbei de distribuție se deplasează în regiunea valorilor de viteză mai mari.
N. S. Purysheva, N. E. Vazheevskaya, D. A. Isaev, manual „Fizica - 10”, manual de lucru pentru acest manual.
Fizica: 3800 de probleme pentru școlari și intră în universități. – M.: Butarda, 2000.
Rymkevich A.P. Culegere de probleme de fizică. 10-11 clase – M.: Dropia, 2010.
L.A. Kirik „Lucrări independente și de testare în fizică”. Clasa 10. M.: Ilexa, Harkov: Gimnaziul, 1999.
Enciclopedie pentru copii. Tehnică. M.: Avanta+, 1999.
Enciclopedie pentru copii. Fizică. Partea I. M.: Avanta+, 1999.
Enciclopedie pentru copii. Fizică. Ch.P.M.: Avanta+, 1999.
Experiment fizic la școală./ Comp. G. P. Mansvetova, V. F. Gudkova. - M.: Educație, 1981.
Glazunov A. T. Tehnologia la cursul de fizică de liceu. M.: Educație, 1977.
Inițial, s-a emis ipoteza că moleculele se mișcă cu viteze diferite.
Aceste viteze sunt legate de temperatură și există o anumită lege de distribuție a moleculelor după viteză, care a rezultat din observațiile, în special, ale mișcării browniene.
Experimentul este unul dintre experimentele fizice fundamentale. În prezent, predarea atomo-moleculară a fost confirmată de numeroase experimente și este general acceptată.
Reflectarea acțiunilor educaționale.
Azi am aflat...
A fost interesant…
A fost dificil…
Mi-am dat seama că... am învățat...
Am fost surprins...
Cărți folosite:
Aplicatii electronice:
L. Ya. Borevsky „Cursul de fizică al secolului XXI”, de bază + pentru școlari și solicitanți. MediaHouse. 2004
Curs interactiv de fizică pentru clasele 7-11. Physikon LLC, 2004. Versiunea rusă a „Living Physics”, Institutul de Noi Tehnologii
Fizică, clasele X-XI. Curs multimedia-M.: Russobit Publishing LLC.-2004 (http://www. russobit-m. ru/)
Fizica deschisă. În 2 ore (CD) / Ed. CM. Capră. – M.: Physikon LLC. - 2002 (http://www.physicon.ru/.)