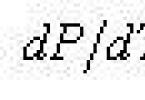Ph.D. O.V. Mosin
FIZICA MOLECULARĂ A APEI ÎN CELE ACESTE TREI STĂRI DE AGREGAT
Apă, oxid de hidrogen, H 2 0, cel mai simplu compus chimic de hidrogen și oxigen care este stabil în condiții normale (11,19% hidrogen și 88,81% oxigen în masă). Apa este un lichid incolor, inodor, fără gust (în straturi groase are o culoare albăstruie), care joacă un rol vital în istoria geologică a Pământului și apariția vieții, în formarea mediului fizic și chimic, a climei și vremea pe planeta noastră. Apa este o componentă esențială a aproape tuturor proceselor tehnologice - atât producția agricolă, cât și industrială.
Apa face parte din toate organismele vii și, în general, acestea conțin doar jumătate din cantitatea de apă decât toate râurile de pe Pământ. La organismele vii, cantitatea de apă, excluzând semințele și sporii, variază între 60 și 99,7% din greutate. Potrivit biologului francez E. Dubois-Reymond, un organism viu este l "eau animée (apa animată). Toate apele Pământului interacționează constant între ele, precum și cu atmosfera, litosfera și biosfera.
Globul conține aproximativ 16 miliarde km3 de apă, ceea ce reprezintă 0,25% din masa întregii noastre planete. Din această cantitate, hidrosfera Pământului (oceane, mări, lacuri, râuri, ghețari și apele subterane) reprezintă 1,386 miliarde km3. Apa dulce de suprafață (lacuri și râuri) este de numai 0,2 milioane km3, iar vaporii de apă atmosferici sunt de 13 mii km3.
Masa totală de zăpadă și gheață distribuite pe suprafața Pământului ajunge la aproximativ 2,5-3,0 x 1016 tone, ceea ce reprezintă doar 0,0004% din masa întregii noastre planete. Cu toate acestea, o astfel de cantitate este suficientă pentru a acoperi întreaga suprafață a Pământului cu un strat de 53 de metri și, dacă toată această masă s-a topit brusc, transformându-se în apă, atunci nivelul Oceanului Mondial ar crește cu aproximativ 64 de metri față de nivelul actual.
Apele Pământului pătrund în el, pornind de la cele mai înalte înălțimi ale stratosferei până la adâncimile enorme ale scoarței terestre, ajungând la manta, și formează o înveliș continuă a planetei - hidrosfera, care include toată apa într-un lichid, stare solidă, gazoasă, legată chimic și biologic.
Hidrosfera - învelișul apos al Pământului, inclusiv oceane, mări, lacuri, rezervoare, râuri, apele subterane, umiditatea solului, este de aproximativ 1,4-1,5 miliarde km 3, cu apa terestră reprezentând doar aproximativ 90 milioane km 3. Dintre acestea, apele subterane reprezintă 60, ghețarii 29, lacurile 0,75, umiditatea solului 0,075, râurile 0,0012 milioane km3.
Hidrosfera a jucat și continuă să joace un rol fundamental în istoria geologică a Pământului, în formarea mediului fizic și chimic, a climei și a vremii și în apariția vieții pe planeta noastră. S-a dezvoltat împreună și în strânsă interacțiune cu litosfera, atmosfera și apoi natura vie.
În atmosferă apa este sub formă de abur, ceață și nori, picături de ploaie și cristale de zăpadă (aproximativ 13-15 mii km 3 în total). Aproximativ 10% din suprafața terenului este ocupată permanent de ghețari. În nordul și nord-estul URSS, în Alaska și nordul Canadei - cu o suprafață totală de aproximativ 16 milioane km 2, se păstrează întotdeauna un strat de gheață subsol (doar aproximativ 0,5 milioane km 3.
În scoarța terestră - litosferă conţine, conform diverselor estimări, de la 1 la 1,3 miliarde de km3 de apă, care este aproape de conţinutul său din hidrosferă. În scoarța terestră, cantități importante de apă se află în stare legată, făcând parte din unele minerale și roci (gips, forme hidratate de silice, hidrosilicați etc.). Cantități uriașe de apă (13-15 miliarde km 3) sunt concentrate în adâncurile mai adânci ale mantiei Pământului. Eliberarea de apă eliberată din mantie în timpul încălzirii Pământului în primele etape ale formării sale a dat naștere, conform concepțiilor moderne, hidrosferei. Rezerva anuală de apă din manta și camerele de magmă este de aproximativ 1 km3.
Există dovezi că apa, cel puțin parțial, are o origine „cosmică”: protonii care au intrat în atmosfera superioară de la Soare, captând electroni, se transformă în atomi de hidrogen, care, combinându-se cu atomii de oxigen, dau H2O.
Apa se găsește în condiții naturale în trei stări: solidă - sub formă de gheață și zăpadă, lichidă - sub formă de apă însăși, gazoasă - sub formă de vapori de apă. Aceste stări ale apei se numesc stări agregate, sau faze solide, lichide și, respectiv, vapori. Trecerea apei de la o fază la alta este cauzată de modificările temperaturii și presiunii acesteia. În fig. Figura 1 prezintă o diagramă a stărilor de agregare a apei în funcție de temperatura t și presiunea P. Din Fig. 1. este clar că în regiunea I apa se găsește doar sub formă solidă, în regiunea II - doar sub formă lichidă, în regiunea III - doar sub formă de vapori de apă. De-a lungul curbei AC se află într-o stare de echilibru între fazele solide și lichide (topirea gheții și cristalizarea apei); de-a lungul curbei AB - în stare de echilibru între faza lichidă și cea gazoasă (evaporarea apei și condensarea aburului); de-a lungul curbei AD - în echilibru între faza solidă și cea gazoasă (sublimarea vaporilor de apă și sublimarea gheții).
Orez. 1. Diagrama stărilor agregate ale apei în regiunea punctului triplu A. I - gheață. II - apă. III - vapori de apă.
Echilibrul fazelor conform Fig. 1 de-a lungul curbelor AB, AC și AD trebuie înțeles ca echilibru dinamic, adică de-a lungul acestor curbe numărul de molecule nou formate dintr-o fază este strict egal cu numărul de molecule nou formate ale altă fază. Dacă, de exemplu, răcim treptat apa la orice presiune, atunci în limită ne vom găsi pe curba AC, unde apa va fi observată la temperatura și presiunea corespunzătoare. Dacă încălzim treptat gheața la presiuni diferite, ne vom afla pe aceeași curbă de echilibru AC, dar pe partea de gheață. În mod similar, vom avea apă și vapori de apă, în funcție de ce parte ne apropiem de curba AB.
Toate cele trei curbe ale stării de agregare - AC (curba dependenței temperaturii de topire a gheții de presiune), AB (curba dependenței punctului de fierbere al apei de presiune), AD (curba dependenței vaporilor presiunea fazei solide asupra temperaturii) - se intersectează într-un punct A, numit punct triplu . Conform cercetărilor moderne, valorile presiunii vaporilor de saturație și ale temperaturii în acest punct sunt, respectiv, egale: P = 610,6 Pa (sau 6,1 hPa = 4,58 mm Hg), t = 0,01 °C (sau T = 273,16 K). Pe lângă punctul triplu, curba AB trece prin încă două puncte caracteristice - punctul corespunzător fierberii apei la presiunea normală a aerului cu coordonatele P = 1,013 10 5 Pa și t = 100°C, iar punctul cu coordonatele P = 2,211 10 7 Pa și t cr = 374,2°C, corespunzătoare temperaturii critice - temperatura numai sub care vaporii de apă pot fi transformați în stare lichidă prin compresie.
Curbele AC, AB, AD legate de procesele de tranziție a unei substanțe de la o fază la alta sunt descrise de ecuația Clapeyron-Clausius:
![]()
unde T este temperatura absolută corespunzătoare fiecărei curbe, respectiv, temperaturii de evaporare, topire, sublimare etc.; L - caldura specifica de evaporare, respectiv de topire, de sublimare; V 2 – V 1 - diferența de volume specifice, respectiv, la trecerea de la apă la gheață, de la vapori de apă la apă, de la vapori de apă la gheață.
Experiența directă arată că apele uscate naturale la presiunea atmosferică normală se răcesc (curba AF) la anumite temperaturi negative fără a se cristaliza. Astfel, apa are proprietatea de a fi suprarăcită, adică. luați temperaturi sub punctul de topire al gheții. Starea de suprarăcire a apei este o stare metastabilă (instabilă) în care trecerea fazei lichide în faza solidă, care a început în orice moment, continuă continuu până când suprarăcirea este eliminată sau până când tot lichidul se transformă într-un solid. Capacitatea apei de a atinge temperaturi sub punctul de topire al gheții a fost descoperită pentru prima dată de Fahrenheit în 1724.
 Astfel, cristalele de gheață se pot forma doar în apă suprarăcită. Tranziția apei suprarăcite într-o stare solidă - gheață, are loc numai dacă în ea există centre (nuclee) de cristalizare, care pot fi suspendate particule de sedimente în apă, cristale de gheață sau zăpadă care intră în apă din atmosferă, cristale de gheață formate. în apa suprarăcită, ca urmare a mișcării sale de translație turbulente, particule de alte substanțe prezente în coloana de apă.
Astfel, cristalele de gheață se pot forma doar în apă suprarăcită. Tranziția apei suprarăcite într-o stare solidă - gheață, are loc numai dacă în ea există centre (nuclee) de cristalizare, care pot fi suspendate particule de sedimente în apă, cristale de gheață sau zăpadă care intră în apă din atmosferă, cristale de gheață formate. în apa suprarăcită, ca urmare a mișcării sale de translație turbulente, particule de alte substanțe prezente în coloana de apă.
Orez. 2. Diagrama de fază a apei. Ih, II - IX - forme de gheață; 1 - 8 - puncte triple.
Suprarăcirea apei este o stare termodinamică în care temperatura apei este sub temperatura de cristalizare. Această condiție apare ca urmare a scăderii temperaturii apei sau a creșterii temperaturii de cristalizare a acesteia. Temperatura apei poate fi scăzută prin îndepărtarea căldurii, care se găsește cel mai adesea în natură, sau prin amestecarea acesteia cu apă sărată, cum ar fi apa de mare. Temperatura de cristalizare poate fi crescută prin scăderea presiunii.
În condiții de laborator, cu presiune ridicată și răcire intensivă, apa distilată poate fi suprarăcită la o temperatură de ordinul - 30 și scade - 50 ° C. Viteza de cristalizare depinde și de adâncimea suprarăcirii apei.
Astfel, diagrama stărilor de agregare a apei este linia continuă AD din Fig. 1 - ar trebui considerată ca fiind legată de sarcini termice foarte scăzute, atunci când efectul timpului asupra transformării de fază este mic. La sarcini termice mari, procesul de transformări de fază va avea loc conform curbei întrerupte AF.
Temperatura de topire a gheții (curba AC) depinde foarte puțin de presiune. Aproape curba AC este paralelă cu axa orizontală: când presiunea se schimbă de la 610,6 la 1,013·10 5 Pa, punctul de topire scade doar de la 0,01 la 0°C. Cu toate acestea, această temperatură scade odată cu creșterea presiunii doar până la o anumită valoare, apoi crește și la presiune foarte mare atinge o valoare de ordinul a 450°C (Fig. 1.2). După cum rezultă din Fig. 1.2, la presiune înaltă gheața poate fi și la o temperatură pozitivă. Există până la zece forme diferite de gheață. Forma gheții Ih, care se caracterizează printr-o scădere a punctului de topire cu creșterea presiunii, corespunde gheții obișnuite formate din cauza înghețului apei în condiții normale. Coordonatele punctelor triple ale diferitelor forme de gheață, indicate în Fig. 1.2 prin cifre arabe 1-8, sunt date în tabel. 1.1. Structura și proprietățile fizice ale tuturor formelor de gheață sunt semnificativ diferite de gheața Ih.
Un solid (gheață), ca un lichid, se evaporă într-o gamă largă de temperaturi și se transformă direct în stare gazoasă (sublimare), ocolind faza lichidă - curba AD. Procesul invers, adică tranziția unei forme gazoase direct într-o formă solidă (sublimare), este efectuată, ocolind și faza lichidă. Sublimarea și sublimarea gheții și zăpezii joacă un rol important în natură.
Structura unei molecule de apă
 Apa este o substanță complexă, a cărei unitate structurală principală este molecula de H 2 O, constând din doi atomi de hidrogen și un atom de oxigen. Câteva zeci de scheme pentru posibila aranjare reciprocă a atomilor de H și O în molecula de H 2 O au fost propuse pe toată perioada studiului său; Schema general acceptată în prezent este prezentată în Fig. 3.
Apa este o substanță complexă, a cărei unitate structurală principală este molecula de H 2 O, constând din doi atomi de hidrogen și un atom de oxigen. Câteva zeci de scheme pentru posibila aranjare reciprocă a atomilor de H și O în molecula de H 2 O au fost propuse pe toată perioada studiului său; Schema general acceptată în prezent este prezentată în Fig. 3.
Orez. 3. Schema structurii unei molecule de apă: geometria moleculară și orbitele electronilor
Energia cinetică totală a unei molecule triatomice precum H2O poate fi descrisă prin următoarea expresie:
![]()
unde și sunt vitezele mișcării de translație și respectiv de rotație ale moleculei; I x , I y , I z - momentele de inerție ale moleculei față de axele de rotație corespunzătoare; m este masa moleculei.
Din această ecuație este clar că energia totală a unei molecule triatomice precum H 2 O constă din șase părți corespunzătoare la șase grade de libertate: trei de translație și trei de rotație.
Din cursul fizicii se știe că pentru fiecare dintre aceste grade de libertate în echilibru termic există aceeași cantitate de energie egală cu 1/2 kT, unde k=R m /N A = 1,3807·10 -23 J/K - constanta lui Boltzmann; T-temperatura absolută; N A = 6,0220·10 23 mol -1 - numărul lui Avogadro; kN A =R m = 8,3144 J/(mol K) - constanta universală a gazului. Atunci energia cinetică totală a unei astfel de molecule este egală cu:
![]()
Energia cinetică totală a moleculelor conținute într-o moleculă gram de orice gaz (vapor) va fi:

Energia cinetică totală W este legată de capacitatea termică specifică cv la volum constant prin formula:

Calcularea capacității termice specifice a apei folosind această formulă pentru vaporii de apă dă o valoare de 25 J/(mol K). Conform datelor experimentale, pentru vaporii de apă cv = 27,8 J/(mol K), adică aproape de valoarea calculată.
Studierea moleculei de apă folosind studii spectrografice a permis să se stabilească că aceasta are structura unui fel de triunghi isoscel: la vârful acestui triunghi se află un atom de oxigen, iar la baza lui sunt doi atomi de hidrogen. Unghiul de vârf este de 104°27, iar lungimea laturii este de 0,096 nm. Acești parametri se referă la starea ipotetică de echilibru a moleculei fără vibrațiile și rotațiile acesteia.
Masa moleculară relativă a H 2 O depinde de masa atomică relativă a componentelor sale și are valori diferite, deoarece oxigenul și hidrogenul au izotopi.
Oxigenul are șase izotopi: 14 O, 15 O, 16 O, 17 O, 18 O, 19 O, dintre care doar trei sunt stabili, iar hidrogenul are trei: 1 H (protiu), 2 H (deuteriu), 3 H ( tritiu). Unii dintre izotopi sunt radioactivi, au un timp de înjumătățire scurt și sunt prezenți în apă în cantități mici, în timp ce alții sunt obținuți numai artificial și nu se găsesc în natură.
Astfel, ținând cont de izotopii oxigenului și hidrogenului, este posibil să se compună din aceștia mai multe tipuri de molecule de H 2 O cu mase moleculare relative diferite. Dintre acestea, cele mai comune sunt molecule de 1 H 2 16 O cu o greutate moleculară relativă de 18 (apă obișnuită) și 2 molecule de H 2 16 O cu o greutate moleculară relativă de 20. Aceste din urmă molecule formează așa-numita apă grea. Apa grea diferă semnificativ în proprietățile sale fizice de apa obișnuită.
Teoria molecular-cinetică a materiei și apei
Structura apei în cele trei stări ale sale de agregare nu poate fi considerată încă definitiv stabilită. Există o serie de ipoteze care explică structura aburului, apei și gheții.
Aceste ipoteze se bazează într-o măsură mai mare sau mai mică pe teoria cinetică moleculară a structurii materiei, ale cărei baze au fost puse de M.V. Lomonosov. La rândul său, teoria cinetică moleculară se bazează pe principiile mecanicii clasice, în care moleculele (atomii) sunt considerate ca niște bile de formă regulată, neutre din punct de vedere electric, ideal elastice. Astfel de molecule sunt supuse doar ciocnirilor mecanice și nu experimentează nicio forță de interacțiune electrică. Din aceste motive, utilizarea teoriei cinetice moleculare poate explica doar structura materiei la o primă aproximare.
Gazul - în cazul nostru vapori de apă - conform teoriei cinetice moleculare, este o colecție de molecule. Distanța dintre ele este de multe ori mai mare decât dimensiunea moleculelor în sine. Moleculele de gaz se află într-o mișcare aleatorie continuă, parcurgând o cale între pereții vaselor în care este conținut gazul și ciocnând unele cu altele de-a lungul acestei căi. Ciocnirile între molecule apar fără pierderi de energie mecanică; sunt considerate ca ciocniri de bile perfect elastice. Impactul moleculelor asupra pereților recipientului limitându-le determină presiunea gazului pe acești pereți. Viteza de mișcare a moleculelor crește odată cu creșterea temperaturii și scade odată cu scăderea acesteia.
Când temperatura gazului, în scădere de la valori mai mari, se apropie de punctul de fierbere al lichidului (pentru apă 100 ° C la presiune normală), viteza moleculelor scade, iar la ciocnire, forțele de atractivitate dintre ele devin mai mari decât respingerea elastică. forțe la impact și, prin urmare, gazul se condensează într-un lichid.
La lichefierea artificială a gazului, temperatura acestuia trebuie să fie sub așa-numita temperatură critică, care corespunde și presiunii critice (clauza 1.1). La temperaturi peste critice, gazul (aburul) nu poate fi transformat în lichid prin nicio presiune.
Valoarea RT cr / (P cr V cr) pentru toate gazele, inclusiv vaporii de apă, ar trebui să fie egală cu 8/3 = 2,667 (aici R este constanta gazului; T cr, P cr, V cr sunt temperaturile critice, respectiv presiune, volum). Cu toate acestea, pentru vaporii de apă este 4,46. Acest lucru se explică prin faptul că vaporii conțin nu numai molecule unice, ci și asociațiile lor.
Un lichid, spre deosebire de un gaz, este o colecție de molecule situate atât de aproape una de cealaltă încât între ele apar forțe de atracție reciprocă. Prin urmare, moleculele lichide nu zboară în direcții diferite, precum moleculele de gaz, ci doar oscilează în jurul poziției lor de echilibru. În același timp, deoarece structura lichidului nu este complet densă, există locuri libere în el - „găuri”, în urma cărora, conform teoriei lui Ya.I. Frenkel, unele molecule cu energie mai mare se sparg. din locul lor „așezat” și se deplasează brusc într-o „găură” vecină situată la o distanță aproximativ egală cu dimensiunea moleculei în sine. Astfel, într-un lichid, moleculele se mișcă relativ rar dintr-un loc în altul și de cele mai multe ori sunt într-o stare „așezată”, suferind doar mișcări oscilatorii. Acest lucru, în special, explică difuzia slabă în lichide în comparație cu viteza mare a gazelor. Când un lichid este încălzit, energia moleculelor sale crește, iar viteza de vibrație a acestora crește. La o temperatură de 100°C și presiunea atmosferică normală, apa se descompune în molecule individuale de H2O, a căror viteză este deja capabilă să depășească atracția reciprocă a moleculelor, iar apa se transformă în abur.
La răcirea unui lichid (apa), are loc procesul invers. Viteza de mișcare vibrațională a moleculelor scade, structura lichidului devine mai puternică, iar lichidul se transformă într-o stare cristalină (solidă) - gheață. Există două tipuri de solide: cristaline și amorfe. Caracteristica principală a corpurilor cristaline este anizotropia proprietăților lor în diferite direcții: dilatare termică, rezistență, proprietăți optice și electrice etc. Corpurile amorfe sunt izotropi, adică au aceleași proprietăți în toate direcțiile. Gheața este un solid cristalin.
Într-un solid, spre deosebire de gaze și lichide, fiecare atom sau moleculă vibrează doar în jurul poziției sale de echilibru, dar nu se mișcă. Nu există „găuri” într-un solid în care pot trece molecule individuale. Prin urmare, nu există difuzie în solide. Atomii care alcătuiesc moleculele formează o rețea cristalină puternică, a cărei imuabilitate se datorează forțelor moleculare. Când temperatura unui solid se apropie de punctul său de topire, rețeaua sa cristalină este distrusă și se transformă într-o stare lichidă. Spre deosebire de cristalizarea lichidelor, topirea solidelor are loc relativ lent, fără un salt pronunțat.
Cristalizarea majorității lichidelor are loc cu o scădere a volumului, iar topirea solidelor este însoțită de o creștere a volumului. Excepție fac apa, antimoniul, parafina și alte substanțe a căror fază solidă este mai puțin densă decât cea lichidă.
Structura apei în cele trei stări de agregare
Problema evaluării structurii apei rămâne încă una dintre cele mai dificile. Să luăm în considerare pe scurt două ipoteze generalizate despre structura apei care au primit cea mai mare recunoaștere, una în perioada inițială de dezvoltare a doctrinei structurii apei, cealaltă la momentul actual.
Conform ipotezei propuse de Whiting (1883) și care are în prezent diverse interpretări, principala unitate de construcție a vaporilor de apă este molecula de H 2 O, numită hidrol, sau monohidrol. Unitatea de construcție de bază a apei este molecula dublă de apă (H2O)2-dihidrol; gheața este formată din molecule triple (H 2 O) 3 - trihidrol. Așa-numita teorie a hidrolului a structurii apei se bazează pe aceste idei.
Vaporii de apă, conform acestei teorii, constă dintr-o colecție a celor mai simple molecule de monohidrol și asocierile lor, precum și o cantitate mică de molecule de dihidrol.
Apa lichidă este un amestec de molecule de monohidrol, dihidrol și trihidrol. Raportul dintre numărul acestor molecule din apă este diferit și depinde de temperatură. Conform acestei ipoteze, raportul dintre numărul de molecule de apă explică una dintre principalele sale anomalii - cea mai mare densitate a apei la 4°C.
Deoarece molecula de apă este asimetrică, centrele de greutate ale sarcinilor sale pozitive și negative nu coincid. Moleculele au doi poli - pozitiv și negativ, creând, ca un magnet, câmpuri de forță moleculară. Astfel de molecule se numesc polare sau dipoli, iar caracteristica cantitativă a polarității este determinată de momentul electric al dipolului, exprimat prin produsul distanței l dintre centrii electrici de greutate al sarcinilor pozitive și negative ale moleculei de către sarcina e în unități electrostatice absolute:
Pentru apă, momentul dipol este foarte mare: p = 6,13·10 -29 C m. Polaritatea moleculelor de monohidrol explică formarea dihidrolului și trihidrolului. În același timp, deoarece vitezele intrinseci ale moleculelor cresc odată cu creșterea temperaturii, acest lucru poate explica descompunerea treptată a unui trihidrol într-un dihidrol și, respectiv, într-un monohidrol, atunci când gheața se topește, apa este încălzită și fierbe.
O altă ipoteză a structurii apei, dezvoltată în secolul al XX-lea (modele lui O.Ya. Samoilov, J. Pople, G.N. Zatsepina etc.), se bazează pe ideea că gheața, apa și vaporii de apă constau din H 2 O molecule unite în grupuri folosind așa-numitele legături de hidrogen (J. Bernal și R. Fowler, 1933). Aceste legături apar din interacțiunea atomilor de hidrogen ai unei molecule cu atomul de oxigen al unei molecule învecinate (cu un element foarte electronegativ). Această caracteristică a schimbului de hidrogen într-o moleculă de apă se datorează faptului că, renunțând la singurul său electron pentru a forma o legătură covalentă cu oxigenul, rămâne sub forma unui nucleu, aproape lipsit de înveliș de electroni. Prin urmare, atomul de hidrogen nu experimentează repulsie din învelișul de electroni a oxigenului moleculei de apă vecine, ci, dimpotrivă, este atras de acesta și poate interacționa cu acesta. Conform acestei ipoteze, se poate presupune că forțele care formează o legătură de hidrogen sunt pur electrostatice. Cu toate acestea, conform metodei orbitale moleculare, legăturile de hidrogen se formează prin forțe de dispersie, legătură covalentă și interacțiune electrostatică.
Tabelul 1 prezintă compoziția moleculară a apei, gheții și vaporilor de apă conform diferitelor surse din literatură.
Tabelul 1.1
Compoziția moleculară a gheții, apei și vaporilor de apă, %

Astfel, ca urmare a interacțiunii atomilor de hidrogen ai unei molecule de apă cu sarcinile negative de oxigen ale altei molecule, se formează patru legături de hidrogen pentru fiecare moleculă de apă. În acest caz, moleculele sunt de obicei combinate în grupuri - asociati: fiecare moleculă ajunge înconjurată de alte patru (Fig. 4). O astfel de împachetare densă de molecule este caracteristică apei în stare înghețată (gheață Ih) și duce la o structură cristalină deschisă aparținând simetriei hexagonale. Cu această structură, se formează „goluri - canale” între moleculele fixe, astfel încât densitatea gheții este mai mică decât densitatea apei.
 Creșterea temperaturii gheții până la topire și mai sus duce la ruperea legăturilor de hidrogen. În starea lichidă a apei, chiar și mișcările termice obișnuite ale moleculelor sunt suficiente pentru a distruge aceste legături.
Creșterea temperaturii gheții până la topire și mai sus duce la ruperea legăturilor de hidrogen. În starea lichidă a apei, chiar și mișcările termice obișnuite ale moleculelor sunt suficiente pentru a distruge aceste legături.
Orez. 4. Schema de interacțiune a moleculelor de apă. 1 - oxigen, 2 - hidrogen, 3 - legătură chimică, 4 - legătură de hidrogen.
Când temperatura apei crește la 4°C, se păstrează într-o oarecare măsură ordonarea aranjamentului moleculelor după tipul cristalin cu o structură caracteristică pentru gheață. Golurile menționate mai sus din această structură sunt umplute cu molecule de apă eliberate. Ca urmare, densitatea lichidului crește la maxim la o temperatură de 3,98°C. O creștere suplimentară a temperaturii duce la deformarea și ruperea legăturilor de hidrogen și, în consecință, la distrugerea grupurilor de molecule, până la molecule individuale, ceea ce este tipic pentru abur.
Deci, care sunt proprietățile misterioase, neobișnuite ale apei lichide familiare? În primul rând, faptul este că aproape toate proprietățile apei sunt anormale, iar multe dintre ele nu se supun logicii acelor legi ale fizicii care guvernează alte substanțe.
Când moleculele de apă se condensează, ele formează o substanță lichidă de o complexitate uimitoare. Acest lucru se datorează în primul rând faptului că moleculele de apă au proprietatea unică de a se combina în clustere (grupuri) (H 2 O)x. Un cluster este de obicei înțeles ca un grup de atomi sau molecule unite prin interacțiune fizică într-un singur ansamblu, dar păstrând comportamentul individual în cadrul acestuia. Posibilitățile de observare directă a clusterelor sunt limitate și, prin urmare, experimentatorii compensează deficiențele instrumentale cu intuiție și constructe teoretice.
La temperatura camerei, gradul de asociere X pentru apă, conform datelor moderne, este de la 3 la 6. Aceasta înseamnă că formula apei nu este doar H 2 O, ci o medie între H 6 O 3 și H 12 O 6 . Cu alte cuvinte, apa este un lichid complex „alcătuit” din grupuri repetate care conțin trei până la șase molecule simple. Ca urmare, apa are valori anormale de îngheț și punct de fierbere în comparație cu omologii săi. Dacă apa respectă regulile generale, ar trebui să înghețe la o temperatură de aproximativ -100 o C și să fiarbă la o temperatură de aproximativ +10 o C.
Dacă apa ar rămâne sub formă de H 6 O 3, H 8 O 4 sau H 12 O 6 în timpul evaporării, atunci vaporii de apă ar fi mult mai grei decât aerul, în care domină moleculele de azot și oxigen. În acest caz, suprafața întregului Pământ ar fi acoperită cu un strat etern de ceață. Este aproape imposibil să-ți imaginezi viața pe o astfel de planetă.
Oamenii sunt foarte norocoși: grupurile de apă se dezintegrează în timpul evaporării, iar apa se transformă practic într-un simplu gaz cu formula chimică H 2 O (cantitatea mică de dimeri H 4 O 2 descoperită recent în abur nu face diferența). Densitatea apei gazoase este mai mică decât densitatea aerului și prin urmare, apa este capabilă să sature atmosfera pământului cu moleculele sale, creând condiții meteorologice confortabile pentru oameni.
Nu există alte substanțe pe Pământ care să fie înzestrate cu capacitatea de a fi lichide la temperaturile existenței umane și, în același timp, să formeze un gaz care nu este doar mai ușor decât aerul, dar și capabil să revină la suprafața sa sub forma de precipitaţii.
Ph.D. O.V. Mosin
Introducere
1. Structura moleculelor de apă
2. Structura apei în cele trei stări ale ei de agregare
3. Tipuri de apă
4. Proprietăți anormale ale apei
5. Transformări de fază și diagrama de stare a apei
6. Modele ale structurii apei și gheții
7. Tipuri agregate de gheață
Concluzie
Bibliografie
Introducere
Apa este cea mai importantă substanță de pe Pământ fără de care nu poate exista niciun organism viu și nu pot avea loc reacții biologice, chimice sau procese tehnologice.
Apa (oxidul de hidrogen) este un lichid inodor, insipid și incolor (albăstrui în straturi groase); H20, mol. m. 18.016, cea mai simplă conexiune stabilă. hidrogen cu oxigen.
Apa este una dintre cele mai comune substanțe din natură. Acoperă aproximativ 3/4 din întreaga suprafață a pământului, formând baza oceanelor, mărilor, lacurilor, râurilor, apelor și mlaștinilor. O cantitate mare de apă se găsește și în atmosferă. Plantele și organismele vii conțin 50-96% apă.
Molecule de apă au fost descoperite în spațiul interstelar. Apa face parte din comete, din majoritatea planetelor din sistemul solar și din sateliții lor. Cantitatea de apă de pe suprafața Pământului este estimată la 1,39 * 10 18 tone, cea mai mare parte este conținută în mări și oceane. Cantitatea de apă dulce disponibilă pentru utilizare în râuri, lacuri, mlaștini și rezervoare este de 2 * 10 4 tone.Masa ghețarilor din Antarctica, Antarctica și regiunile muntoase înalte este de 2,4 * 10 16 tone (masa totală de zăpadă și gheață distribuită peste suprafața Pământului ajunge la aproximativ 2,5-3,010 16 tone, ceea ce reprezintă doar 0,0004% din masa întregii noastre planete. Cu toate acestea, o astfel de cantitate este suficientă pentru a acoperi întreaga suprafață a Pământului cu un strat de 53 de metri și dacă toată această masă s-ar fi topit brusc, transformându-se în apă, nivelul Oceanului Mondial ar fi crescut cu aproximativ 64 de metri față de cel actual.), există aproximativ aceeași cantitate de apă subterană și doar o mică parte din aceasta este proaspăt. În atmosferă există cca. 1,3*10 13 tone de apă. Apa face parte din multe minerale și roci (argilă, gips, etc.), este prezentă în sol și este o componentă esențială a tuturor organismelor vii.
Densitatea H2O = 1 g/cm3 (la 3,98 grade), t pl. = 0 grade și t kip = 100 de grade. Capacitatea termică a apei este de 4,18 J/(g/K) Mr (H 2 O) = 18 și corespunde celei mai simple formule ale acesteia. Cu toate acestea, greutatea moleculară a apei lichide, determinată prin studierea soluțiilor sale în alți solvenți, se dovedește a fi mai mare. Acest lucru indică faptul că în apa lichidă există o asociere de molecule, adică acestea sunt combinate în agregate mai complexe. Apa este singura substanță din natură care, în condiții terestre, există în toate cele trei stări de agregare: Multă apă este în stare gazoasă sub formă de vapori în atmosferă; se află sub formă de mase uriașe de zăpadă și gheață pe tot parcursul anului pe vârfurile munților înalți și în țările polare. În măruntaiele pământului există și apă care saturează solul și rocile
Clima depinde de apă. Geofizicienii susțin că Pământul s-ar fi răcit cu mult timp în urmă și s-ar fi transformat într-o bucată de piatră fără viață dacă nu ar fi fost apă. Are o capacitate termică foarte mare. Când este încălzit, absoarbe căldură; răcorindu-se, o dă departe. Apa Pământului absoarbe și returnează multă căldură și astfel „uniformizează” clima. Iar ceea ce protejează Pământul de frigul cosmic sunt acele molecule de apă care sunt împrăștiate în atmosferă – în nori și sub formă de vapori... Nu te poți lipsi de apă – aceasta este cea mai importantă substanță de pe Pământ.
Apa este o substanță familiară și neobișnuită. Renumit om de știință sovietic
Academicianul I.V. Petryanov a numit cartea sa de popularizare despre apă „cea mai extraordinară substanță din lume”. Și „Fiziologia distractivă”, scrisă de doctorul în științe biologice B.F. Sergeev, începe cu un capitol despre apă - „Substanța care a creat planeta noastră”.
1. Structura unei molecule de apă
Dintre toate lichidele obișnuite, apa este solventul cel mai universal, lichidul cu valorile maxime ale tensiunii superficiale, constantă dielectrică, căldură de vaporizare și cea mai mare (după amoniac) căldură de fuziune. Spre deosebire de majoritatea substanțelor, apa se extinde atunci când îngheață la presiune scăzută.
Aceste proprietăți specifice ale apei sunt asociate cu structura specială a moleculei sale. Formula chimică a apei, H 2 0, este înșelător de simplă. Într-o moleculă de apă, nucleele atomilor de hidrogen sunt situate asimetric în raport cu nucleul atomului de oxigen și al electronilor. Dacă atomul de oxigen se află în centrul tetraedrului, centrele de masă ale celor doi atomi de hidrogen se vor afla în colțurile tetraedrului, iar centrele de sarcină ale celor două perechi de electroni vor ocupa celelalte două colțuri (Fig. 1.1). Astfel, patru electroni sunt situati la cea mai mare distanta posibila atat de nucleul atomului de oxigen cat si de nucleii atomilor de hidrogen, la care sunt inca atrasi de nucleul atomului de oxigen. Ceilalți șase electroni ai moleculei de apă sunt aranjați astfel: patru electroni sunt într-o poziție care asigură o legătură chimică între nucleele atomilor de oxigen și hidrogen, iar ceilalți doi sunt localizați în apropierea nucleului atomului de oxigen.
Dispunerea asimetrică a atomilor unei molecule de apă determină o distribuție neuniformă a sarcinilor electrice în ea, ceea ce face ca molecula de apă să fie polară. Această structură a moleculei de apă determină atragerea moleculelor de apă unele față de altele ca urmare a formării legăturilor de hidrogen între ele. Dispunerea atomilor de hidrogen și oxigen în interiorul agregatelor formate de molecule de apă este similară cu aranjarea atomilor de siliciu și oxigen din cuarț. Acest lucru se aplică gheții și, într-o măsură mai mică, apei lichide, ale cărei agregate moleculare sunt întotdeauna în stadiu de redistribuire. Când apa se răcește, moleculele ei se grupează în agregate, care cresc treptat în dimensiune și devin mai stabile pe măsură ce temperatura se apropie de 4° C, când apa atinge densitatea maximă. La această temperatură, apa nu are încă o structură rigidă și, alături de lanțurile lungi ale moleculelor sale, există un număr mare de molecule individuale de apă. Odată cu răcirea ulterioară, lanțurile de molecule de apă cresc datorită adăugării de molecule libere la ele, în urma cărora densitatea apei scade. Când apa se transformă în gheață, toate moleculele ei intră într-o structură mai mult sau mai puțin rigidă sub formă de lanțuri deschise care formează cristale.
Fig. 1.1 Structura unei molecule de apă
Pătrunderea reciprocă a atomilor de hidrogen și oxigen. Nucleele a doi atomi de hidrogen și două perechi de electroni sunt situate în colțurile tetraedrului: în centru se află nucleul unui atom de oxigen.
Valorile ridicate ale tensiunii superficiale și ale căldurii de vaporizare a apei se explică prin faptul că este necesară o cheltuială relativ mare de energie pentru a separa o moleculă de apă dintr-un grup de molecule. Tendința moleculelor de apă de a forma legături de hidrogen și polaritatea lor explică solubilitatea neobișnuit de mare a apei. Unii compuși, cum ar fi zaharurile și alcoolii, sunt menținuți în soluție prin legături de hidrogen. Compușii care sunt puternic ionizați, cum ar fi clorura de sodiu, sunt menținuți în soluție deoarece ionii cu sarcini opuse sunt neutralizați de grupuri de molecule de apă orientate.
O altă caracteristică a moleculei de apă este că atât atomii de hidrogen, cât și atomii de oxigen pot avea mase diferite cu aceeași sarcină nucleară. Varietățile unui element chimic cu greutăți atomice diferite sunt numite izotopi ai acelui element. O moleculă de apă este formată de obicei din hidrogen cu greutatea atomică 1 (H 1) și oxigen cu greutatea atomică 16 (O 16). Peste 99% din atomii de apă aparțin acestor izotopi. În plus, există următorii izotopi: H 2, H 3, O 14, O 15, O 17, O 18, O 19. Multe dintre ele se acumulează în apă ca urmare a evaporării parțiale a acesteia și datorită masei lor mari. Izotopii H3, O14, O15, O19 sunt radioactivi. Cel mai comun dintre ele este tritiul H 3, format în straturile superioare ale atmosferei sub influența razelor cosmice. Acest izotop s-a acumulat și ca urmare a exploziilor nucleare din ultimii ani. Pe baza acestor și a altor fapte despre izotopi, analiza compoziției izotopice a apei poate dezvălui parțial istoria unor ape naturale. Astfel, conținutul de izotopi grei din apele de suprafață indică evaporarea pe termen lung a apei, care are loc, de exemplu, în Marea Moartă, Marele Lac Sărat și alte rezervoare închise. Nivelurile ridicate de tritiu din apele subterane ar putea însemna că aceste ape sunt de origine meteorică cu o rată de circulație mare, deoarece timpul de înjumătățire al acestui izotop este de doar 12,4 ani. Din păcate, analiza izotopilor este prea costisitoare și din acest motiv nu poate fi utilizată pe scară largă în studiile apelor naturale.
Molecula de apă H2O este construită sub forma unui triunghi: unghiul dintre cele două legături oxigen-hidrogen este de 104 grade. Dar, deoarece ambii atomi de hidrogen sunt localizați pe aceeași parte a oxigenului, sarcinile electrice din acesta sunt dispersate. Molecula de apă este polară, ceea ce este motivul interacțiunii speciale dintre diferitele sale molecule.
Atomii de hidrogen din molecula de H 2 O, având o sarcină parțială pozitivă, interacționează cu electronii atomilor de oxigen ai moleculelor învecinate. Această legătură chimică se numește legătură de hidrogen. Combină moleculele de H2O în polimeri unici cu o structură spațială; planul în care sunt situate legăturile de hidrogen este perpendicular pe planul atomilor aceleiași molecule de H 2 O. Interacțiunea dintre moleculele de apă explică în primul rând temperaturile anormal de ridicate ale topirii și fierberii acesteia. Trebuie furnizată energie suplimentară pentru a slăbi și apoi a distruge legăturile de hidrogen. Și această energie este foarte semnificativă. Acesta este motivul pentru care capacitatea de căldură a apei este atât de mare.
La fel ca majoritatea substanțelor, apa este formată din molecule, iar acestea din urmă sunt formate din atomi.
Ideea filozofilor antici că totul în natură este format din patru elemente (elemente): pământ, aer, foc și apă, a existat până în Evul Mediu. În 1781, G. Cavendish a raportat că a obținut apă prin arderea hidrogenului, dar nu a apreciat pe deplin importanța descoperirii sale. Mai târziu (1783)A. Lavoisier a demonstrat că apa nu este deloc un element, ci un compus de hidrogen și oxigen. J. Berzelius și P. Dulong (1819), precum și J. Dumas și J. Stas (1842), au stabilit compoziția în greutate a apei prin trecerea hidrogenului prin oxid de cupru, luat într-o cantitate strict definită, și cântărind cuprul rezultat. si apa. Din aceste date, au determinat raportul H:O pentru apă. În plus, în anii 1820, J. Gay-Lussac a măsurat volumele de hidrogen și oxigen gazos, care, atunci când interacționau, dădeau apă: s-au corelat între ele ca 2: 1, care, după cum știm acum, corespunde formulei. H 2 O. Prevalența. Apa acoperă 3/4 din suprafața Pământului. Corpul uman este format din aproximativ 70% apă, oul este 74%, iar unele legume sunt aproape în întregime apă. Deci, în pepene verde este de 92%, în roșii coapte - 95%.Apa din rezervoarele naturale nu este niciodată omogenă ca compoziție: trece prin roci, intră în contact cu solul și aerul și, prin urmare, conține gaze și minerale dizolvate. Apa distilată este mai pură.
Apa de mare . Compoziția apei de mare variază în diferite regiuni și depinde de afluxul de apă dulce, rata de evaporare, precipitații, topirea aisbergurilor etc.Vezi si OCEAN.Apă minerală. Apa minerală se formează atunci când apa obișnuită se infiltrează prin roci care conțin compuși de fier, litiu, sulf și alte elemente.Apă moale și dură. Apa tare conține cantități mari de săruri de calciu și magneziu. Se dizolvă în apă când curg prin roci compuse din gips (C aSO 4 ), calcar (CaCO 3 ) sau dolomit (carbonați Mg și Ca). Apa moale conține puțin din aceste săruri. Dacă apa conține sulfat de calciu, se spune că are duritate permanentă (non-carbonată). Se poate înmuia prin adăugarea de carbonat de sodiu; aceasta va determina precipitarea calciului sub formă de carbonat, lăsând sulfatul de sodiu în soluție. Sărurile de sodiu nu reacţionează cu săpunul, iar consumul acestuia va fi mai mic decât în prezenţa sărurilor de calciu şi magneziu.Apa cu duritate temporară (carbonată) conține bicarbonați de calciu și magneziu; poate fi înmuiat în mai multe moduri: 1) prin încălzire, ducând la descompunerea bicarbonaților în carbonați insolubili; 2) adăugarea apei de var (hidroxid de calciu), în urma căreia bicarbonații sunt transformați în carbonați insolubili; 3) folosind reacții de schimb.
Structura moleculară. Analiza datelor obținute din spectrele de absorbție a arătat că cei trei atomi dintr-o moleculă de apă formează un triunghi isoscel cu doi atomi de hidrogen la bază și oxigen la vârf:Unghiul de legătură al lui HOH este 104,31° , lungimea legăturii OH este de 0,99Å (1 Å = 10 8 cm), iar distanța HH este 1,515 Å . Atomii de hidrogen sunt atât de adânc încorporați în atomul de oxigen încât molecula este aproape sferică; raza sa este de 1,38Å . APĂ Proprietăți fizice. Datorită atracției puternice dintre molecule, apa are puncte de topire ridicate (0° C) și fierbere (100 ° CU). Un strat gros de apă are o culoare albastră, care este determinată nu numai de proprietățile sale fizice, ci și de prezența particulelor în suspensie de impurități. Apa râurilor de munte este verzuie din cauza particulelor de carbonat de calciu în suspensie pe care le conține. Apa pură este un conducător slab al electricității, conductivitatea sa specifică este de 1,5 H 10 8 Ohm 1 H cm 1 la 0 ° C. Compresibilitatea apei este foarte scăzută: 43 H 10 6 cm 3 pe megabar la 20° C. Densitatea apei este maximă la 4° CU; acest lucru se explică prin proprietățile legăturilor de hidrogen ale moleculelor sale.Presiunea de vapori. Dacă lăsați apă într-un recipient deschis, aceasta se va evapora treptat și toate moleculele sale vor merge în aer. În același timp, apa aflată într-un vas etanș etanș se evaporă doar parțial, adică. la o anumită presiune a vaporilor de apă se stabilește echilibrul între apă și aerul de deasupra acesteia. Presiunea vaporilor la echilibru depinde de temperatură și se numește presiunea vaporilor saturați (sau presiunea vaporilor). Când presiunea vaporilor saturați este comparată cu presiunea externă, apa fierbe. La presiune normală 760 mmHg. apa fierbe la 100° C, iar la o altitudine de 2900 m deasupra nivelului mării, presiunea atmosferică scade la 525 mm Hg. iar punctul de fierbere se dovedește a fi 90° CU.Evaporarea are loc chiar și de pe suprafața zăpezii și a gheții, motiv pentru care rufele umede se usucă la frig.
Vâscozitatea apei scade rapid odată cu creșterea temperaturii și la 100
° C se dovedește a fi de 8 ori mai mic decât la 0°C. Proprietăți chimice. Acțiune catalitică. Multe reacții chimice apar numai în prezența apei. Astfel, oxidarea cu oxigen nu are loc în gazele uscate, metalele nu reacţionează cu clorul etc.Hidratează. Mulți compuși conțin întotdeauna un anumit număr de molecule de apă și, prin urmare, sunt numiți hidrați. Natura legăturilor formate în acest caz poate fi diferită. De exemplu, în sulfat de cupru pentahidrat sau sulfat de cupru CuS04H5H2O , patru molecule de apă formează legături de coordonare cu ionul sulfat, care sunt distruse la 125° CU; a cincea moleculă de apă este legată atât de strâns încât se desprinde doar la o temperatură de 250° C. Un alt acid sulfuric hidrat stabil; există în două forme hidratate, SO3PH2O și SO2(OH)2 , intre care se stabileste echilibrul. Ionii din soluțiile apoase sunt, de asemenea, adesea hidratați. Da, N + există întotdeauna sub formă de ion hidroniu H 3O+ sau H5O2+ ; ion de litiu sub formă Li(H20)6+ etc. Elementele ca atare se găsesc rar sub formă hidratată. Excepția este bromul și clorul, care formează hidrați Br2C10H20 şi CI2C6H20. Unii hidrați obișnuiți conțin apă de cristalizare, cum ar fi clorura de bariu BaCI2H2H2O , sare Epsom (sulfat de magneziu) MgS04H7H20 , bicarbonat de sodiu (carbonat de sodiu) Na2CO3H10H2O, Sarea lui Glauber (sulfat de sodiu) Na2S04H10H2O. Sărurile pot forma mai mulți hidrați; Astfel, sulfatul de cupru există sub formă CuSO4H5H2O, CuSO4H3H2O și CuSO4HH2O . Dacă presiunea de vapori saturați a hidratului este mai mare decât presiunea atmosferică, sarea va pierde apă. Acest proces se numeștedecolorare (prin intemperii). Procesul prin care sarea absoarbe apa se numesteestompare . Hidroliză. Hidroliza este o reacție de dublă descompunere în care unul dintre reactanți este apa; triclorura de fosfor PCl 3 reacționează ușor cu apa: PCl3 + 3H20 = P (OH)3 + 3HCI Grăsimile sunt hidrolizate într-un mod similar pentru a forma acizi grași și glicerol.Solvația. Apa este un compus polar și, prin urmare, intră ușor în interacțiune electrostatică cu particulele (ioni sau molecule) de substanțe dizolvate în ea. Grupările moleculare formate ca rezultat al solvației se numesc solvați. Un strat de molecule de apă legate de particula centrală de solvat prin forțe atractive constituie învelișul de solvație. Conceptul de solvație a fost introdus pentru prima dată în 1891 de I.A. Kablukov.Apa grea. În 1931, G. Urey a arătat că atunci când hidrogenul lichid se evaporă, fracțiile sale finale se dovedesc a fi mai grele decât hidrogenul obișnuit datorită conținutului unui izotop care este de două ori mai greu. Acest izotop se numește deuteriu și este reprezentat prin simbol D . Prin proprietățile sale, apa care conține izotopul său greu în loc de hidrogen obișnuit diferă semnificativ de apa obișnuită.În natură, pentru fiecare 5000 de părți în masă N
2 Oh, există o parte D2O . Acest raport este același pentru apa de râu, ploaie, apa de mlaștină, apa subterană sau apa de cristalizare. Apa grea este folosită ca trasor în studiul proceselor fiziologice. Astfel, în urina umană raportul dintre H și D este, de asemenea, egal cu 5000:1. Dacă dați pacientului apă cu un conținut ridicat de D2O , apoi măsurând constant proporția acestei ape în urină, puteți determina rata de excreție a apei din organism. S-a dovedit că aproximativ jumătate din apa băută rămâne în organism chiar și după 15 zile. Apa grea, sau mai degrabă deuteriul care face parte din ea, este un participant important în reacțiile de fuziune nucleară.Al treilea izotop al hidrogenului este tritiul, desemnat prin simbolul T. Spre deosebire de primii doi, este radioactiv și se găsește în natură doar în cantități mici. În lacurile cu apă dulce, raportul dintre acesta și hidrogenul obișnuit este de 1:10
18 , în apele de suprafață 1:10 19 , este absent în apele adânci.Vezi si HIDROGEN. GHEAŢĂ Gheața, faza solidă a apei, este folosită în principal ca agent frigorific. Poate fi în echilibru cu faza lichidă și gazoasă sau numai cu faza gazoasă. Un strat gros de gheață are o culoare albăstruie, care se datorează modului în care refractă lumina. Compresibilitatea gheții este foarte scăzută.Gheața la presiune normală există doar la o temperatură de 0
° C sau mai mică și are o densitate mai mică decât apa rece. Acesta este motivul pentru care aisbergurile plutesc în apă. Mai mult, deoarece raportul dintre densitățile gheții și apei la 0° Cu gheața constantă iese întotdeauna din apă cu o anumită parte, și anume 1/5 din volumul acesteia.Vezi si ICEBERGS. ABURI Faza gazoasă cu abur a apei. Contrar credinței populare, el este invizibil. Acei „abur” care iese dintr-un ibric care fierbe sunt de fapt multe picături mici de apă. Aburul are proprietăți care sunt foarte importante pentru menținerea vieții pe Pământ. Este bine cunoscut, de exemplu, că, sub influența căldurii solare, apa se evaporă de pe suprafața mărilor și oceanelor. Vaporii de apă rezultați se ridică în atmosferă și se condensează, apoi cad pe pământ sub formă de ploaie și zăpadă. Fără un astfel de ciclu al apei, planeta noastră s-ar fi transformat de mult într-un deșert.Steam are multe utilizări. Pe unele le cunoaștem bine, dar am auzit doar despre altele. Printre cele mai cunoscute dispozitive și mecanisme care folosesc abur se numără fiarele de călcat, locomotivele cu abur, navele cu aburi și cazanele cu abur. Aburul rotește turbinele generatoarelor din centralele termice.
Vezi si FIERBĂTOR CU ABURI; MOTOR TERMIC; CĂLDURĂ; TERMODINAMICĂ.LITERATURĂ Eisenberg D., Kautsman V.Structura și proprietățile apei . L., 1975Zatsepina G.N. Proprietățile fizice și structura apei . M., 1987
Starea tridimensională a apei lichide este dificil de studiat, dar s-au învățat multe analizând structura cristalelor de gheață. Patru atomi de oxigen legați de hidrogen învecinați ocupă vârfurile unui tetraedru (tetra = patru, edrul = plan). Energia medie necesară pentru a rupe o astfel de legătură în gheață este estimată la 23 kJ/mol -1.
Capacitatea moleculelor de apă de a forma un anumit număr de lanțuri de hidrogen, precum și rezistența specificată, creează un punct de topire neobișnuit de ridicat. Când se topește, este ținut de apă lichidă, a cărei structură este neregulată. Majoritatea legăturilor de hidrogen sunt distorsionate. Pentru a distruge rețeaua cristalină de gheață legată de hidrogen necesită o cantitate mare de energie sub formă de căldură.
Caracteristicile aspectului de gheață (Ih)
Mulți oameni obișnuiți se întreabă ce fel de rețea cristalină are gheața. Trebuie remarcat faptul că densitatea majorității substanțelor crește la îngheț, când mișcările moleculare încetinesc și se formează cristale dens împachetate. De asemenea, densitatea apei crește pe măsură ce se răcește la maxim la 4°C (277K). Apoi, când temperatura scade sub această valoare, se extinde.
Această creștere se datorează formării unui cristal de gheață deschis legat de hidrogen, cu rețeaua sa și densitatea mai mică, în care fiecare moleculă de apă este strâns legată de elementul de mai sus și de alte patru valori și se mișcă în continuare suficient de repede pentru a avea mai multă masă. Pe măsură ce are loc această acțiune, lichidul îngheață de sus în jos. Acest lucru are consecințe biologice importante, prin care un strat de gheață pe un iaz izolează ființele vii de frigul extrem. În plus, două proprietăți suplimentare ale apei sunt legate de caracteristicile sale de hidrogen: capacitatea termică specifică și evaporarea.
Descrierea detaliată a structurilor
Primul criteriu este cantitatea necesară pentru a crește temperatura a 1 gram dintr-o substanță cu 1°C. Creșterea gradelor de apă necesită o parte relativ mare de căldură deoarece fiecare moleculă este implicată în numeroase legături de hidrogen care trebuie rupte pentru ca energia cinetică să crească. Apropo, abundența de H 2 O în celulele și țesuturile tuturor organismelor multicelulare mari înseamnă că fluctuațiile de temperatură din interiorul celulelor sunt minime. Această caracteristică este critică deoarece majoritatea reacțiilor biochimice sunt sensibile la viteză.
De asemenea, semnificativ mai mare decât multe alte lichide. Pentru a transforma acest solid într-un gaz necesită o cantitate mare de căldură, deoarece legăturile de hidrogen trebuie rupte, astfel încât moleculele de apă să se poată disloca unele de altele și să intre în faza menționată. Corpurile variabile sunt dipoli permanenți și pot interacționa cu alți compuși similari și cu cei care sunt ionizați și dizolvați.
Alte substanțe enumerate mai sus pot intra în contact numai dacă polaritatea este prezentă. Acest compus este implicat în structura acestor elemente. În plus, se poate alinia în jurul acestor particule formate din electroliți, astfel încât atomii negativi de oxigen ai moleculelor de apă să fie orientați spre cationi, iar ionii pozitivi și atomii de hidrogen să fie orientați către anioni.
De regulă, se formează rețele de cristal moleculare și cele atomice. Adică, dacă iodul este structurat în așa fel încât I 2 să fie prezent în el, atunci în dioxid de carbon solid, adică în gheață carbonică, există molecule de CO 2 la nodurile rețelei cristaline. Atunci când interacționează cu astfel de substanțe, gheața are o rețea cristalină ionică. Grafitul, de exemplu, având o structură atomică bazată pe carbon, nu este capabil să-l schimbe, la fel ca diamantul.
Ce se întâmplă atunci când un cristal de sare de masă se dizolvă în apă: moleculele polare sunt atrase de elementele încărcate din cristal, ceea ce duce la formarea de particule similare de sodiu și clorură pe suprafața sa, ca urmare, aceste corpuri se dislocă unele de altele, și începe să se dizolve. Din aceasta putem observa că gheața are o rețea cristalină cu legături ionice. Fiecare Na+ dizolvat atrage capetele negative ale mai multor molecule de apă, în timp ce fiecare Cl dizolvat - atrage capetele pozitive. Învelișul care înconjoară fiecare ion se numește sferă de evacuare și conține de obicei mai multe straturi de particule de solvent.

Se spune că variabilele sau ionul înconjurat de elemente sunt sulfatate. Când apa este solventul, astfel de particule devin hidratate. Astfel, orice moleculă polară tinde să fie solvatată de elemente ale corpului lichid. În gheața carbonică, tipul de rețea cristalină formează legături atomice în stare agregată care sunt neschimbate. Gheața cristalină (apa înghețată) este o altă problemă. Compușii organici ionici precum carboxilazele și aminele protonate trebuie să aibă solubilitate în grupări hidroxil și carbonil. Particulele conținute în astfel de structuri se deplasează între molecule, iar sistemele lor polare formează legături de hidrogen cu acest corp.
Desigur, numărul acestor din urmă grupări dintr-o moleculă afectează solubilitatea acesteia, care depinde și de reacția diferitelor structuri din element: de exemplu, alcoolii cu unul, doi și trei atomi de carbon sunt miscibili în apă, dar hidrocarburile mai mari cu compuși hidroxil unici sunt mult mai puțin diluate în lichide.
Hexagonalul Ih are formă similară cu rețeaua cristalină atomică. Pentru gheață și toată zăpada naturală de pe Pământ, arată exact așa. Acest lucru este evidențiat de simetria rețelei de cristale de gheață crescute din vapori de apă (adică fulgi de zăpadă). Situat în grupa spațială P 63/mm cu 194; D 6h, clasa Laue 6/mm; similar cu β-, care are un multiplu de 6 axe elicoidale (rotație în jurul ei în plus față de forfecare de-a lungul ei). Are o structură destul de deschisă cu densitate scăzută, unde eficiența este scăzută (~1/3) în comparație cu structurile cubice simple (~1/2) sau cubice centrate pe fețe (~3/4).
În comparație cu gheața obișnuită, rețeaua cristalină a gheții carbonizate, legată de molecule de CO 2 , este statică și se modifică numai atunci când atomii se descompun.

Descrierea rețelelor și a elementelor lor constitutive
Cristalele pot fi considerate ca modele cristaline constând din foi stivuite una peste alta. Legătura de hidrogen este ordonată atunci când, în realitate, este aleatorie, deoarece protonii se pot mișca între moleculele de apă (gheață) la temperaturi peste aproximativ 5 K. Într-adevăr, este probabil ca protonii să se comporte ca un fluid cuantic într-un flux constant de tunel. Acest lucru este îmbunătățit de împrăștierea neutronilor care arată densitatea lor de împrăștiere la jumătatea distanței dintre atomii de oxigen, indicând localizarea și mișcarea coordonată. Aici se observă asemănarea gheții cu o rețea cristalină atomică, moleculară.
Moleculele au un aranjament în trepte a lanțului de hidrogen în raport cu cei trei vecini ai lor din plan. Al patrulea element are un aranjament de legături de hidrogen eclipsat. Există o ușoară abatere de la simetria hexagonală perfectă, cu până la 0,3% mai scurtă în direcția acestui lanț. Toate moleculele experimentează același mediu molecular. Există suficient spațiu în interiorul fiecărei „cutii” pentru a reține particulele de apă interstițiale. Deși nu sunt considerate în general, acestea au fost recent detectate eficient prin difracția neutronilor din rețeaua de cristal de gheață sub formă de pulbere.
Schimbarea substanțelor
Corpul hexagonal are puncte triple cu apă lichidă și gazoasă 0,01 °C, 612 Pa, elemente solide trei -21,985 °C, 209,9 MPa, unsprezece și două -199,8 °C, 70 MPa și -34,7 °C, 212,9 MPa . Constanta dielectrică a gheții hexagonale este 97,5.
Curba de topire a acestui element este dată de MPa. Sunt disponibile ecuații de stare, pe lângă ele și câteva inegalități simple care leagă modificarea proprietăților fizice cu temperatura gheții hexagonale și suspensiile sale apoase. Duritatea variază în funcție de grade, crescând de la aproximativ sau sub gips (≤2) la 0°C, până la niveluri de feldspat (6 la -80°C, o schimbare anormal de mare a durității absolute (>24 de ori).
Rețeaua cristalină hexagonală de gheață formează plăci și coloane hexagonale, unde fețele de sus și de jos sunt planele bazale (0 0 0 1) cu o entalpie de 5,57 μJ cm -2, iar celelalte planuri laterale echivalente sunt numite părți prisme (1). 0 -1 0) cu 5,94 uJ cm -2. Suprafețele secundare (1 1 -2 0) cu 6,90 μJ ˣ cm -2 se pot forma de-a lungul planurilor formate de laturile structurilor.
Această structură prezintă o scădere anormală a conductibilității termice odată cu creșterea presiunii (cum ar fi gheața amorfă cubică și cu densitate scăzută), dar diferă de majoritatea cristalelor. Acest lucru se datorează unei modificări a legăturilor de hidrogen, care reduce viteza transversală a sunetului în rețeaua cristalină de gheață și apă.
Există metode care descriu cum se prepară mostre mari de cristale și orice suprafață de gheață dorită. Se presupune că legătura de hidrogen de pe suprafața corpului hexagonal studiat va fi mai ordonată decât în interiorul sistemului de masă. Spectroscopia variațională cu oscilație în frecvență a rețelei de fază a arătat că există o asimetrie structurală între cele două straturi superioare (L1 și L2) în lanțul HO sub suprafață al suprafeței bazale a gheții hexagonale. Legăturile de hidrogen adoptate în straturile superioare ale hexagoanelor (L1 O ··· HO L2) sunt mai puternice decât cele adoptate în al doilea strat la acumularea superioară (L1 OH ··· O L2). Structuri interactive de gheață hexagonale disponibile.

Caracteristicile dezvoltării
Numărul minim de molecule de apă necesare pentru nuclearea gheții este de aproximativ 275 ± 25, la fel ca pentru un grup icosaedric complet de 280. Formarea are loc cu un factor de 10 10 la interfața aer-apă, mai degrabă decât în apă în vrac. Creșterea cristalelor de gheață depinde de ratele de creștere diferite ale diferitelor energii. Apa trebuie protejată de îngheț în timpul crioconservarii probelor biologice, alimentelor și organelor.
Acest lucru se realizează de obicei prin viteze rapide de răcire, utilizarea de mostre mici și a unui crioconservator și creșterea presiunii pentru a nuclea gheața și a preveni deteriorarea celulelor. Energia liberă a gheții/lichidului crește de la ~30 mJ/m2 la presiunea atmosferică la 40 mJ/m2 la 200 MPa, indicând motivul pentru care apare acest efect.
Alternativ, ele pot crește mai rapid de pe suprafețele prismelor (S2), pe suprafețele perturbate aleatoriu ale lacurilor înghețate sau perturbate. Creșterea de la fețele (1 1 -2 0) este cel puțin aceeași, dar le transformă în bazele unei prisme. Datele despre dezvoltarea cristalelor de gheață au fost pe deplin explorate. Ratele relative de creștere ale elementelor diferitelor fețe depind de capacitatea de a forma un grad mai mare de hidratare a articulațiilor. Temperatura (scăzută) a apei din jur determină gradul de ramificare a cristalului de gheață. Creșterea particulelor este limitată de viteza de difuzie la grade scăzute de suprarăcire, adică<2 ° C, что приводит к большему их количеству.

Dar este limitată de cinetica dezvoltării la niveluri mai ridicate de grade de scădere > 4°C, ceea ce duce la o creștere asemănătoare unui ac. Această formă este similară cu structura gheții carbonizate (are o rețea cristalină cu o structură hexagonală), diferite caracteristici de dezvoltare a suprafeței și temperatura apei din jur (suprarăcită) care se află în spatele formelor plate de fulgi de zăpadă.
Formarea gheții în atmosferă influențează profund formarea și proprietățile norilor. Feldspații, găsiți în praful deșertului care intră în atmosferă cu milioane de tone pe an, sunt formatori importanți. Simulările pe computer au arătat că acest lucru se datorează nucleării planelor de cristale prismatice de gheață pe planuri de suprafață de înaltă energie.
Alte elemente și rețele
Solutele (cu excepția unei cantități foarte mici de heliu și hidrogen, care pot intra în interstiții) nu pot fi încorporate în structura Ih la presiunea atmosferică, ci sunt forțate la suprafață sau la un strat amorf între particulele corpului microcristalin. În locurile rețelei cristaline de gheață carbonică există și alte elemente: ionii haotropi, cum ar fi NH 4 + și Cl -, care sunt incluși în înghețarea lichidului mai ușor decât alți kosmotropi, precum Na + și SO 4 2-, deci îndepărtarea lor este imposibilă, datorită faptului că formează o peliculă subțire din lichidul rămas între cristale. Acest lucru poate duce la încărcarea electrică a suprafeței din cauza disocierii apei de suprafață echilibrând sarcinile rămase (care poate duce și la radiații magnetice) și la o modificare a pH-ului peliculelor lichide reziduale, de exemplu NH 4 2 SO 4 care devine mai mult acid și NaCl devenind mai alcalin.
Ele sunt perpendiculare pe fețele rețelei de cristal de gheață, arătând următorul strat atașat (cu atomi O-negri). Ele sunt caracterizate printr-o suprafață bazală cu creștere lentă (0 0 0 1), unde sunt atașate doar molecule izolate de apă. O suprafață cu creștere rapidă (1 0 -1 0) a unei prisme, unde perechile de particule nou atașate se pot lega între ele cu hidrogen (o legătură/două molecule ale elementului). Fața cu cea mai rapidă creștere este (1 1 -2 0) (prismatică secundară), unde lanțurile de particule nou atașate pot interacționa între ele prin legături de hidrogen. Una dintre moleculele sale de lanț/element este o formă care formează creste care împart și încurajează transformarea în două părți ale prismei.

Entropia punctului zero
kBˣ Ln ( N
Oamenii de știință și lucrările lor în acest domeniu
Poate fi definit ca S 0 = kBˣ Ln ( N E0), unde k B este constanta lui Boltzmann, N E este numărul de configurații la energia E și E0 este cea mai mică energie. Această valoare pentru entropia gheții hexagonale la zero kelvin nu încalcă a treia lege a termodinamicii, „Entropia unui cristal ideal la zero absolut este exact zero”, deoarece aceste elemente și particule nu sunt ideale și au legături de hidrogen dezordonate.
În acest corp, legăturile de hidrogen sunt aleatorii și se schimbă rapid. Aceste structuri nu sunt exact egale ca energie, dar se extind la un număr foarte mare de stări apropiate energetic și se supun „regulilor gheții”. Entropia punctului zero este dezordinea care ar rămâne chiar dacă materialul ar putea fi răcit la zero absolut (0 K = -273,15 °C). Dă naștere unei confuzii experimentale pentru gheața hexagonală 3,41 (±0,2) ˣ mol -1 ˣ K -1 . Teoretic, ar fi posibil să se calculeze entropia zero a cristalelor de gheață cunoscute cu o precizie mult mai mare (neglijând defectele și împrăștierea nivelului de energie) decât determinarea experimentală.

Deși ordinea protonilor din gheața în vrac nu este ordonată, suprafața preferă probabil ordinea particulelor menționate sub formă de benzi de atomi de H atârnați și perechi de O singure (entropie zero cu legături de hidrogen ordonate). S-a găsit tulburarea punctului zero ZPE, J ˣ mol -1 ˣ K -1 și altele. Din toate cele de mai sus, este clar și de înțeles ce tipuri de rețele cristaline sunt caracteristice gheții.
Opțiunea 1.
1. Moleculele de gheață și apă sunt diferite unele de altele?
1) sunt la fel; 2) molecula de gheață este mai rece; 3) molecula de gheață este mai mică;
4) molecula de apă este mai mică
2. Ce este difuzia?
Molecule ale altuia; 3) mișcarea haotică a moleculelor de materie;
4) amestecarea substanțelor
4. Când o substanță se răcește, moleculele se mișcă:
Un fel de substanță
5. Viteza de mișcare a moleculelor de hidrogen a crescut. în care
Temperatura …
Nici un raspuns
6. Dacă turnați apă dintr-un pahar într-o farfurie, atunci...
Forma si volum
7. În ce apă are loc difuzia mai rapid?
Se întâmplă
8. În ce substanțe difuzia are loc mai lent atunci când
In ce conditii?
Toate substanțele
9. Moleculele unei substanțe sunt situate la distanțe mari,
Sunt puternic atrași și oscilează în jurul poziției de echilibru
Această substanță...
1) gazos; 2) lichid; 3) tare; 4) o astfel de substanță nu există
Opțiunea numărul 2.
1. Moleculele de gheață și vaporii de apă sunt diferite unele de altele?
1) molecula de gheață este mai rece; 2) sunt la fel; 3) moleculă de gheață
Mai puțin; 4) molecula de gheață este mai mare
2. Difuzia este...
1) pătrunderea moleculelor unei substanțe în moleculele alteia;
2) pătrunderea moleculelor unei substanțe în spațiile dintre
Molecule ale altuia; 3) mișcarea haotică a moleculelor de substanțe
Va; 4) amestecarea substanțelor
3. Între moleculele oricărei substanțe există:
1) atracție reciprocă; 2) repulsie reciprocă; 3) reciprocă
Atractie si repulsie; 4) diferite substanțe au diferite
4. Când apa este încălzită, moleculele se mișcă:
1) cu aceeași viteză; 2) mai lent; 3) mai rapid; 4) depinde de
Un fel de substanță
5. Viteza de mișcare a moleculelor de oxigen a scăzut. în care
Temperatura …
1) nu s-a schimbat; 2) a scăzut; 3) crescut; 4) corect
Nici un raspuns
6. Dacă turnați apă dintr-o farfurie într-un pahar, atunci...
1) forma și volumul apei se vor schimba; 2) forma se va schimba, volumul se va schimba
Stocat; 3) forma va rămâne aceeași, volumul se va schimba; 4) vor fi păstrate
Volumul și forma
7. În ce apă difuzia are loc mai lent?
1) la frig; 2) fierbinte; 3) la fel; 4) difuzia în apă nu este
Se întâmplă
8. În ce substanțe difuzia are loc mai rapid în același timp
Care sunt conditiile tale?
1) în stare gazoasă; 2) în lichid; 3) în solide; 4) la fel în
Toate substanțele
9. Moleculele unei substanțe sunt situate la distanțe scurte, puternic
Ele se atrag și oscilează în jurul poziției de echilibru. Acest
Substanţă...
1) gazos; 2) lichid; 3) tare; 4) nu există o astfel de substanță
Există
V.V. Makhrova, GS(K)OU S(K)OSH (tip VII) N 561, Sankt Petersburg