Lekcija 5
Tema: Suština procesa elektrolitičke disocijacije
Ciljevi i ciljevi:
Obrazovni:formirati koncepte "elektrolita, neelektrolita, otopine, hidratacije, hidrata, kristalnih hidrata, kristalizacijske vode", otkriti bit procesa elektrolitičke disocijacije, razmotriti glavne odredbe teorije elektrolitičke disocijacije;
U razvoju: razvijati sposobnost rada s tekstom, karakterizirati proces elektrolitičke disocijacije;
Obrazovni: njegovati interes za kemiju, formirati znanstveni svjetonazor.
Oprema: sol, voda, tablica, udžbenik, bilježnice, did.kartice.
Tijekom nastave:
1) Org.trenutak
2) Provjera d.z.
Frontalni razgovor: "Glavne klase anorganskih tvari";
Pojedinac slova. kartaška anketa
Opcija 1: Dajte definicije: soli, oksidi. Dajte njihovu klasifikaciju.
Navedite primjere
Opcija 2: Dajte definicije: baze, kiseline. Dajte njihovu klasifikaciju.
Navedite primjere.
Diktat
Napiši formule kiselina, njihove kiselinske ostatke, označi njihovu valenciju.
3) Učenje novog gradiva
1.Obnavljanje znanja
I. Pokusi sa suhim tvarima, otopinama i talinama za provođenje električne struje
sl.1 str.3
Suhi NaCl, soda
Destilirana voda - ne provodi struju
Otopine NaCl, lužine, soli - provode struju
Otopine glukoze
Alkohol – ne provodi struju
Sahara
Kisik
dušik
II. Mehanizam otapanja u vodi
1) B-in s ionskom vezom
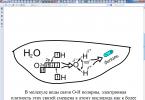
Slika 2 Na + Cl - + H-O-H
U p-re ioni su hidratizirani - okružena molekulama vode
2) In-in s kovalentnom polarnom vezom
NCl H + + Cl - hidratizirani ioni
Kovalentna veza postaje ionska
III. Supstance
Elektroliti Neelektroliti str.5
… …
Definicije
Kisik soli
Alkalijski dušik
Vodikove kiseline
S ionskom ili kovalentnom s kovalentnom nepolarnom/slabo polarnom vezom
visokopolarna veza
IV. Elektrolitička disocijacija -proces razgradnje elektrolita na ione kada se otopi u vodi ili rastali.
V. Otapanje je fizikalni i kemijski proces
V. Hidratacija iona
Kablukov i Kistyakovsky sugerirali su da kada se p-renij molekule vode vežu za ione, tvoreći hidratizira
Definicija str.6
VI. Kristohidrati i kristalizacijska voda
C.7 definicija
VII.Osnovne odredbeteorije elektrolitičke disocijacije
Sam-ali str.8-9 napamet
4) Učvršćivanje
B.1-6 str.13
5) Odraz
6) d.z.
P.1 prepričavanje, definicije i odredbe teorije napamet
Kazahstan, regija Sjeverni Kazahstan, područje nazvano po Gabitu Musrepovu, selo Sokologorovka
KSU "Sokologorovska srednja škola"
Lekcija u 9. razredu
Tema: "Suština procesa disocijacije"
Plan učenja
Predmet: Bit procesa elektrolitičke disocijacije
Ciljevi lekcije: produbiti i generalizirati znanja, osnovne pojmove o elektrolitičkoj disocijaciji; naučiti kako ih primijeniti u sastavljanju jednadžbi disocijacije; dati predodžbu o univerzalnosti teorije elektrolitičke disocijacije i njezinoj primjeni u anorganskoj kemiji.
Osnovni koncepti: elektroliti, neelektroliti, disocijacija, hidrati, kristalohidrati.
Struktura lekcije
1) Organizacijski trenutak
2) Provjera domaće zadaće
3) Učenje novog gradiva
4) Učvršćivanje novog gradiva
5) Domaća zadaća, ocjenjivanje
Tijekom nastave
1) Organizacijski trenutak (3-5 min.)
2) Provjera domaće zadaće (10 min.)
a) Odredite kovalentne polarne i nepolarne veze u sljedećim molekulama: N 2, CO 2, NH 3, SO 2, HBr.
b) Što je elektronegativnost?
c) Kako nastaju σ-veze i π-veze?
d) Koji je razlog velike razlike u fizikalnim svojstvima CO 2 i SiO 2?
e) Nabrojite vrste kemijskih veza.
3) Učenje novog gradiva (15-20 min.)
Elektroliti i neelektroliti. Značajke otapanja tvari s različitim vrstama kemijskih veza u vodi mogu se eksperimentalno proučavati proučavanjem električne vodljivosti otopina tih tvari pomoću uređaja za ispitivanje električne vodljivosti otopina.
Ako su elektrode uređaja uronjene npr. u suhu kuhinjsku sol, žarulja neće svijetliti. Isti rezultat će se dobiti ako se elektrode spuste u destiliranu vodu. Međutim, kada se elektrode urone u vodenu otopinu natrijeva klorida, žarulja počinje svijetliti. To znači da otopina natrijeva klorida provodi struju. Ostale topljive soli, lužine i kiseline ponašaju se slično natrijevom kloridu. Soli i lužine provode električnu struju ne samo u vodenim otopinama, već iu talinama. Vodene otopine, kao što su šećer, glukoza, alkohol, kisik, dušik, ne provode struju. Na temelju ovih svojstava sve tvari se dijele na npr elektroliti I neelektroliti.
Mehanizam otapanja u vodi tvari različite prirode kemijske veze. Zašto soli, lužine i kiseline u vodenoj otopini provode električnu struju iz razmatranih primjera? Da bismo odgovorili na ovo pitanje, potrebno je zapamtiti da su svojstva tvari određena njihovom strukturom. Na primjer, struktura kristala natrijeva klorida razlikuje se od strukture molekula kisika i vodika.
Za ispravno razumijevanje mehanizma otapanja tvari s ionskom vezom u vodi treba također uzeti u obzir da u molekulama vode postoje kovalentne visokopolarne veze između atoma vodika i kisika. Stoga su molekule vode polarne. Kao rezultat toga, na primjer, kada se natrijev klorid otopi, molekule vode se svojim negativnim polovima privlače svojim pozitivnim polovima - negativno nabijenim kloridnim ionima. Kao rezultat toga, veza između iona je oslabljena i kristalna rešetka je uništena. Ovaj proces također olakšava dielektrična konstanta vode, što je na 20ºS jednako 81. Kemijska veza između iona u vodi je oslabljena 81 puta u usporedbi s vakuumom.
Kada se tvari s jakom polarnom kovalentnom vezom otope u vodi, na primjer, klorovodik HCl, mijenja se priroda kemijske veze, tj. pod utjecajem polarnih molekula vode kovalentna polarna veza prelazi u ionsku, a potom i proces otcjepljenja čestica.
Tijekom taljenja elektrolita pojačavaju se oscilatorna gibanja čestica što dovodi do slabljenja veze među njima. Kao rezultat toga, kristalna rešetka je također uništena. Posljedično, kada se soli i lužine otope, te se tvari razlažu na ione.
Proces razgradnje elektrolita na ione kada se otopi u vodi ili rastali naziva se elektrolitička disocijacija.
Osnovne teorijske postavke elektrolitičke disocijacije koju je 1887. formulirao švedski znanstvenik Svante Arrhenius. Međutim, S. Arrhenius nije uspio u potpunosti otkriti složenost procesa elektrolitičke disocijacije. Nije uzeo u obzir ulogu molekula otapala i vjerovao je da su slobodni ioni prisutni u vodenoj otopini. Koncept elektrolitičke disocijacije dalje je razvijen u radovima ruskih znanstvenika I. A. Kablukova i V. A. Kistjakovskog. Da bismo razumjeli bit ideja ovih znanstvenika, upoznajmo se s fenomenima koji nastaju kada se tvari otope u vodi.
Kada se kruti natrijev hidroksid NaOH ili koncentrirana sumporna kiselina H 2 SO 4 otope u vodi, dolazi do jakog zagrijavanja. Pri otapanju sumporne kiseline potrebno je posebno paziti jer se zbog porasta temperature dio vode može pretvoriti u paru i pod svojim pritiskom izbaciti kiselinu iz posude. Da biste to izbjegli, sumporna kiselina ulijeva se u vodu u tankom mlazu (ali ne obrnuto!) uz stalno miješanje.
Ako se, na primjer, amonijev nitrat (amonijev nitrat) otopi u vodi u čaši s tankim stijenkama postavljenoj na mokru dasku, tada se opaža tako jako hlađenje da se staklo čak i smrzava. Zašto se pri otapanju tvari u nekim slučajevima opaža zagrijavanje, au drugim hlađenje?
Kada se čvrste tvari otope, njihove kristalne rešetke se uništavaju, a nastale čestice se raspoređuju između molekula otapala. pri čemu potrebna energija se apsorbira izvana i dolazi do hlađenja. Na temelju toga treba pripisati proces rastapanja fizičke pojave.
Zašto dolazi do zagrijavanja kada se neke tvari otope?
Kao što znamo, oslobađanje topline znak je kemijske reakcije. Stoga, kada se otopi, također se provode kemijske reakcije. Na primjer, molekule sumporne kiseline reagiraju s molekulama vode i nastaju spojevi sastava H 2 SO 4 ·H 2 O (sumporna kiselina monohidrat) i H 2 SO 4 ·2H 2 O (sumporna kiselina dihidrat), t.j. molekula sumporne kiseline veže jednu ili dvije molekule vode.
Međudjelovanje molekula sumporne kiseline s molekulama vode naziva se reakcija hidratacije, a tvari koje pritom nastaju nazivaju se hidrati.
Iz gornjih primjera može se vidjeti da kada se krute tvari otope u vodi, dolazi do fizičkih i kemijskih procesa. Ako se kao rezultat hidratacije oslobađa više energije nego što se troši na uništavanje kristala tvari, tada je otapanje popraćeno zagrijavanjem, ako je obrnuto - hlađenjem.
Stoga, otapanje je fizikalno-kemijski proces.
Takvo objašnjenje suštine procesa otapanja i prirode otopina prvi je teorijski potkrijepio veliki ruski znanstvenik D. I. Mendeljejev. razvili su se hidratna teorija otopina.
Proučavajući procese hidratacije, znanstvenici su imali pitanje: s kojim česticama voda reagira?
I.A.Kablukov i V.A.Kistyakovsky, neovisno jedan o drugom, predložili su da ioni elektrolita reagiraju s molekulama vode, tj. ići na hidratacija iona. Ovaj
4) Učvršćivanje novog gradiva (5-7 min.)
a) Kada su započela istraživanja sastava zraka?
b) Koje su tvari prisutne u zraku?
c) Koji je znanstvenik prvi utvrdio sastav francuskog zraka 1774. godine?
5) Domaća zadaća, ocjenjivanje (3 min.)
§26 prepričavanje str.70-72; vježbe br.3, 4,5 str.72
Sinopsis lekcije iz kemije 9. razreda
Tema lekcije "Elektrolitička disocijacija"
Vrsta lekcije: Generalizacija i sistematizacija znanja.
Cilj: učvrstiti znanje učenika o temi "Teorija elektrolitičke disocijacije"
Zadaci:
Obrazovni:
Učvrstiti znanje učenika o suštini procesa elektrolitičke disocijacije,
Pomozite učenicima da razumiju osnovne pojmove teme
Pomoći u svladavanju pojmova o mehanizmima i uvjetima procesa, koristeći pojmove elektrolit, neelektrolit;
Naučite pisati kemijske reakcije u molekularnom i ionskom obliku.
U razvoju:
produbiti i proširiti znanja o svojstvima tvari na ionskoj razini;
formirati znanstveni pogled i razvoj metoda mentalne aktivnosti;
nastaviti razvoj govornih vještina, zapažanja i sposobnosti zaključivanja na temelju pokaznog pokusa;
moći primijeniti osnovne bilješke i samostalno ih sastaviti.
Odgajatelji:
formirati znanstveni pogled na strukturu i svojstva tvari;
otkriti ideju razvoja u poznavanju fizikalnih i kemijskih procesa kako se akumuliraju nove činjenice i na temelju eksperimenta;
stvoriti uvjete za obrazovanje sa zanimanjem za učenje, raditi na formiranju stavova učenika prema kemiji kao mogućem području budućeg praktičnog djelovanja.
Struktura lekcije:
Organizacijski trenutak (2 min.);
Predstavljanje teme i svrhe lekcije (2 min.);
Formiranje motivacije (1 min.);
Obnavljanje osnovnih znanja (5 min.);
Generalizacija i sistematizacija (15 min.)
Primjena znanja i vještina (18 min.);
Sumiranje rezultata lekcije (1 min.)
Izvještavanje i komentiranje domaće zadaće (1 min.)
Tijekom nastave
U prethodnim lekcijama upoznali smo se s jednom od najvažnijih teorija na koju se oslanja kemijska znanost - to je teorija elektrolitičke disocijacije.Učenici pažljivo slušaju nastavnika
I danas u lekciji moramo generalizirati i sistematizirati znanje o ovoj teoriji i učvrstiti sposobnost sastavljanja jednadžbi disocijacije i reakcija ionske izmjene. Tijekom sata izvodit ćemo razne zadatke, za to imate radne listove sa zadacima i tablicu u koju ćete unositi rezultate na svojim tablicama. Na kraju lekcije moći ćete samostalno procijeniti svoje znanje o obrađenoj temi.
Frontalni
Prvo, prisjetimo se definicije pojma "elektrolita". Što je?
Što su "neelektroliti"?
Sada dajte definiciju "elektrolitičke disocijacije"
Supstance otopine ili taline kotoaelektroliti .
Tvari čije otopine i taline ne provode električnu struju nazivamo neelektroliti.
Proces razgradnje elektrolita u ione pri otapanju u vodi ili taljenju naziva se elektrolitička disocijacija.
Pojedinac
Sada ću zamoliti učenika da ode do ploče i pomoću predložene sheme otkrije bit EMF procesa. Dajte odgovore na pitanja: Što je disocijacija, asocijacija, hidratizirani ioni, kationi, anioni.
Kako se elektrode pune?
Kako se zovu? Zašto?
Koliki su naboji iona?
Tvari, otopine ili taline koji provode električnu struju nazivaju se elektroliti . U talinama i otopinama elektroliti se razlažu na nabijene čestice -ioni . Proces razgradnje elektrolita na ione naziva seelektrolitička disocijacija . Ovo je reverzibilan proces. Asocijacija suprotno nabijenih iona naziva seudruga .
Ioni u talinama razlikuju se od iona u otopinama po tome što su potonji okruženi hidratacijskom ljuskom. Ioni u otopinama i talinama kreću se nasumično. Pod utjecajem električne struje poprimaju usmjereno kretanje. Pozitivno nabijeni ioni gibaju se prema negativnoj elektrodi (katodi) i zato se zovukation ami, negativno nabijeni ioni kreću se u električnom polju prema anodi i nazivaju seanion ami.
Osnovne odredbe TED-a.
Elektroliti se u otopinama i talinama razlažu na ione.
Ioni imaju drugačiju strukturu od atoma.
U talini i otopini ioni se kreću nasumično, ali kada prođe električna struja, ioni se počinju kretati u smjeru: kationi - prema katodi, anioni - prema anodi.
Primjena
Pojedinac
Pomoću dijagrama opišite strukturu molekule vode.
U molekuli vode O - H veze polarne, gustoća elektrona ovih veza pomaknuta je prema atomu kisika kao elektronegativnijem. Kao rezultat, na atomu kisika javlja se djelomični negativni naboj, a na atomu vodika djelomični pozitivni naboj. Budući da je kut H-O-H 105°, atom kisika i atomi vodika nalaze se na različitim krajevima molekule, u kojoj se, takoreći, pojavljuju dva pola. Takve se molekule nazivaju dipoli.
Pojedinac
Pomoću sheme predložite mehanizam disocijacije elektrolita
Kada je ionski kristal uronjen u vodu, dipoli vode su usmjereni u odnosu na njegove ione sa suprotno nabijenim krajevima (polovima). Kao rezultat elektrostatske interakcije između iona otopljene tvari i molekula vode, ionski kristal se uništava iu otopinama hidratiziranih iona (proces disocijacije). Kada se tvari s kovalentnom polarnom vezom otope u vodi, procesu disocijacije prethodi polarizacija veze. Dipoli vode, orijentirajući se prema tome, polariziraju ovu vezu, okrećući se ona unutra ionski, nakon čega slijedi disocijacija tvari uz stvaranje hidratiziranih iona.
Takve ideje o disocijaciji u vodenim otopinama spojeva s različitim vrstama kemijskih veza (CS) nisu nastale odmah.
Frontalni
Kao što znate, postoji nekoliko teorija rješenja. Recite nam ukratko o tim teorijama i navedite njihova autora.
Zašto razrjeđivanje otopine dovodi do povećane disocijacije?
S. Arrhenius i drugi pristaše fizičke teorije, pronalazeći ione u otopinama nastalim pod djelovanjem otapala, nisu uzeli u obzir njihovu hidrataciju.
DI. Mendeleev - autor kemijske teorije otopina, izolirao hidrate sumporne kiseline pri sporomisparavanje njegove otopine i sugerirao da u otopinama nastaju nestabilni kemijski spojevi otopljene tvari i otapala (u općem slučaju solvati).
Nakon toga, I.A. Kablukov i drugi znanstvenici, kombinirajući obje teorije, pokazali su da je otapanje fizički i kemijski proces; uslijed toga nastaju hidratizirani ioni.
Kada se otopi, povećava se broj molekula vode, koje pretvaraju atome u hidratizirane ione; također, disocijacija tvari raste s porastom temperature, zbog povećanja brzine kretanja molekula
Samostalni rad
A sada sami u svojim bilježnicama pokušajte sastaviti referentni dijagram "Jaki i slabi elektroliti". Navedite 3 primjera u svakoj skupini.
U svom sažetku definirajte pojam Stupanj disocijacije i formula za njegovu definiciju
Učenici samostalno pripremaju shemu 10-15 minuta.
Kvantitativno se proces disocijacije tvari u otopini može procijeniti iz stupnja disocijacije α. Izračunava se kao omjer broja molekula elektrolita razloženih na ione prema ukupnom broju molekula otopljene tvari i izražava se u postocima.
Stupanj disocijacije α ovisi o prirodi kemijske veze u kristalima ili molekulama otopljene tvari i otapala. Što je ova veza polarnija, to je veća vrijednost α. Kada se otopine razrijede, a se povećava (vidi grafikon, gdje je c koncentracija otopine).
Ovisno o stupnju disocijacije, svi elektroliti se dijele na jake (α>30%), srednje jakosti (α od 2 do 30%), slabe (α< 1 %). Приведены их примеры.
Mislite li da smo postigli svoje ciljeve?
Koji vam je materijal zadavao probleme?
Ocjenjivanje rada u razredu
Napišite jednadžbe disocijacije tvari: Al 2 (SO 4) 3, K 2 CO 3, FeCl 3.
Prijave
shema 1
Shema 2

Shema 3

Shema 4

Shema 5


Shema 6

Sažetak
sat kemije u 8. razredu
Škola br. 16 u Saransku
Studenti 4. godine kemijskog smjera
Institut za fiziku i kemiju
Moskovsko državno sveučilište N. P. Ogareva
Tema lekcije: elektrolitička disocijacija.
Ciljevi lekcije:
Obrazovni:formirati osnovne pojmove o elektrolitima i neelektrolitima, o pisanju jednadžbi disocijacije, razmotriti mehanizam disocijacije tvari s različitim vrstama veza.
Obrazovni: Formiranje vještina timskog rada u kombinaciji s individualnim radom, povećanje kreativne aktivnosti učenika, kognitivni interes za kemiju, osjećaj odgovornosti prema svojim drugovima.
U razvoju: Razvijanje kognitivnih sposobnosti učenika, formiranje samostalnog mišljenja, sposobnosti logičkog zaključivanja, generaliziranja i zaključivanja iz stečenih znanja.
Vrsta lekcije: kombinirani.
Metode predavanja:
Su česti: eksplanatorni i ilustrativni;
Privatna: verbalno – vizualno – praktično.
Oprema i reagensi:destilirana voda, KCl (otopina i krutina), otopina saharoze, alkalije, HCl, CuSO 4 , uređaj za proučavanje električne vodljivosti otopina tih tvari, kemijska čaša.
Plan učenja:
Organizacijski trenutak 1 min.
Provjera domaće zadaće 10 min
Učenje novog gradiva 30 min
Generalizacija 3 min
Sumiranje 1min
(ocjenjivanje, domaća zadaća)
Bok dečki!
Drago mi je što vas mogu pozdraviti na lekciji.
Moji dragi prijatelji!
Čestitam svima u svoje osobno ime.
Svatko od vas je dobar na svoj način:
Za ljude, za posao, to je dobro za sve.
Dečki, nemojte biti tužni
I rješavati probleme
Hajde, slobodno leti
I dobiti zadatke.
Kartica: "Extra Solution"
Navedite “ekstra” (ispadanje iz reda) rješenje od pet predloženih. Zašto mislite da je on suvišan? Što je zajedničko ostalim četirima rješenjima?
legura bakra i cinka (mjed)
otopina joda u alkoholu (tinktura joda)
legura bakra i kositra (bronca)
legura bakra i nikla (kupronikal)
legura aluminija s bakrom (duraluminij)
Kartica "Nedostaje rješenje"
Koje biste od sljedećih rješenja (a - c) stavili umjesto upitnika u točki 5? Objasnite zašto ste odabrali ovo rješenje? Zašto druga rješenja nisu prikladna?
otopina kisika u vodi
otopina sumporne kiseline u vodi
otopina šećera u vodi
otopina dušične kiseline u vodi
a) ugljikov dioksid u zraku, b) otopina natrijeva klorida u vodi,
c) legura zlata i srebra.
U ovom trenutku postavljaju se sljedeća pitanja:
Prisjetimo se uloge otopina u prirodi i praktičnom djelovanju ljudi.
Objasniti bit fizikalne i kemijske teorije otopina. Zašto ih je potrebno kombinirati?
Dakle, što je rješenje?
Navedite dokaze za kemijsku interakciju otopljene tvari s vodom?
Što je: hidratacija, hidrati, kristalni hidrati?
Kolika je topljivost tvari u vodi?
Kako su kvantitativno definirani pojmovi "jako topljiv u vodi", "slabo topiv", "praktički netopljiv"?
Igrajmo igru "prenesi dalje":
Na ploči je napisano pitanje: Je li ova tvar klasificirana kao slabo topljiva, visoko topljiva ili praktički netopljiva? (raditi s tablicom topljivosti)
Razred je podijeljen u šest grupa (u redovima). Svaka skupina dobiva list albuma podijeljen u četiri stupca (prezime učenika i odgovori na pitanje) i onoliko redaka koliko ima igrača u ekipi.
Zadatak je smisliti vezu koja nije ista kao kod susjeda i izvršiti zadatke.
Ako učenik može odmah odgovoriti na pitanje, tada zapisuje odgovor i brzo dodaje list članu tima koji sjedi iza. A tim čiji list prvi stigne do učitelja dobiva dodatne bodove.
Da ti pročitam pjesmu:
Živio je jedan ionski kristal,
Za ione, kuća je ogromna,
Bio je zgodan i ujednačen.
Ali dogodila mu se nevolja.
Na njega je pala kap
I kristal je nestao u trenu:
Raširiti u ione
Njegova pametna voda.
Cijela obitelj bila je iznenađena:
"Što se dogodilo vani?"
A da biste odgovorili na ovo pitanje, pomoći će vam današnja tema “Elektrolitička disocijacija.” (disketa br. 1: naziv teme.) A svrha naše lekcije je uvesti nove koncepte ove teme.
Dakle, znate da postoje tvari koje dobro provode struju - to su (vodiči).
Vodiči se dijele na vodiče prve vrste - metali i vodiče druge vrste - elektroliti.
Sjećate se što je električna struja?(Ovo je usmjereno gibanje nabijenih čestica.)
Jer Radit ćemo s električnim aparatom, potrebno je pridržavati se sigurnosnih propisa. Koja pravila znaš? (ne dodirujte gole žice, elektrode rukama, posebno mokrim; kada uređaj zasvijetli isključite glavni prekidač, ne ostavljajte ga uključenog u struju; gasite pijeskom)
Napravimo pokus za proučavanje električne vodljivosti otopina određenih tvari.
Uređaj se sastoji od čaše u koju se ulije otopina ispitivane tvari. Na staklo se postavlja ploča od ebonita u koju su ugrađene dvije karbonske elektrode na čije su stezaljke pričvršćene žice. Jedan od njih je spojen na žarulju. Izlazni kontakt iz žarulje i žica s drugog terminala idu na izvor struje.
Elektrode spustimo u čašu s čvrstom kristalnom soli CuSO 4 (lampica ne svijetli), zatim u otopinu CuSO 4 (svijetli žaruljica), zatim u otopine HCl, saharoze, lužine i u destiliranu vodu.
Tijekom eksperimenta dečki ispunjavaju tablicu:
CuSO4 |
itd.
Recite mi zašto otopina kuhinjske soli provodi električnu struju, a otopina saharoze ne?(to je zbog stvaranja iona.) A što je ion? (to su najmanje nabijene čestice tvari koje određuju kemijska i fizikalna svojstva te tvari).
Dakle, prema sposobnosti provođenja električne struje tvari se dijele na elektrolite i neelektrolite.(disketa br. 1: definicije pojmova: elektroliti i neelektroliti)
Iz iskustva je vidljivo da elektroliti uključuju otopine soli, kiselina, baza, a neelektroliti - organske spojeve, krute tvari, plinove.
Koja je razlika između elektrolita i neelektrolita?(vrsta veze.). Oni. elektroliti uključuju tvari s ionskim i kovalentno-polarnim vezama.
Sposobnost elektrolita za provođenje električne struje bitno se razlikuje od sposobnosti provođenja električne struje metala. Zašto? (jer je električna vodljivost metala posljedica kretanja elektrona, a električna vodljivost elektrolita povezana je s kretanjem iona.)
Proučimo ponašanje tvari u vodenoj otopini na primjeru natrijeva klorida.
Iskustvo: spustimo elektrode u čašu s otopinom natrijevog klorida (svijetli žaruljica).
Iz rezultata pokusa zaključujemo da pod utjecajem vode dolazi do promjena tvari. Voda uzrokuje razgradnju elektrolita na ione. Taj se proces naziva disocijacija.
Ovaj proces proučavao je švedski znanstvenik Svante Arrhenius. Poslušajmo poruku tvog prijatelja iz razreda o njegovim uspjesima u kemiji (disk #2: portret Svante Arrheniusa)
Kao pristaša fizikalne teorije otopina, švedski znanstvenik Svante Arrhenius nije mogao odgovoriti na pitanje: zašto dolazi do disocijacije soli i lužina u vodenoj otopini? Odgovor na njega dali su ruski kemičari Kablukov, Kistjakovski. Bit njihovih dodataka je sljedeća (za zapisnik): razlog disocijacije elektrolita u otopini je njegova hidratacija, tj. interakcija s molekulama vode. A ioni koji nastaju tijekom disocijacije bit će hidratizirani, tj. povezani s molekulama vode, te će se njihova svojstva razlikovati od nehidratiziranih.
Što je molekula vode? Općenito, molekula vode nije nabijena. Ali unutar molekule vode, atomi kisika i vodika raspoređeni su tako da su pozitivni i negativni naboji na suprotnim krajevima molekule. Stoga je molekula vode dipol:
Razmotrimo mehanizam disocijacije natrijeva klorida nakon otapanja. Koju vrstu veze ima ova veza? (ionski).(disk №2: disocijacija tvari s ionskom strukturom).
Napominjem da najlakše disociraju elektroliti koji imaju ionsku strukturu.
Disocijacija tvari s ionskom vezom odvija se u tri faze:
isprva se nasumično gibajuće molekule vode u blizini iona kristala usmjeravaju prema njima suprotno nabijenim polovima – dolazi do orijentacije.
tada se vodeni dipoli privlače, međudjeluju s ionima površinskog sloja kristala, dolazi do hidratacije.
Kada molekula vode prijeđe u otopinu, sa sobom povlači hidratizirane ione. Dolazi do disocijacije.
A kako molekule polarnog elektrolita reagiraju s molekulama vode?
Slično, ali korak više (disk №2: disocijacija tvari s kovalentno-polarnom vezom):
orijentacija
hidratacija
ionizacija, tj. transformacija kovalentno-polarne veze u ionsku.
disocijacija
Dakle, elektrolitička disocijacija je proces razgradnje elektrolita na ione nakon otapanja.
Treba uzeti u obzir da se u otopinama elektrolita ioni koji se nasumično kreću mogu sudarati i spojiti u molekulu. Ovo je proces udruživanja.
Obratite pozornost na predznak u jednadžbi disocijacije. (disk #1: pisanje jednadžbe disocijacije). Budući da je nepoznat broj molekula vode koje ioni vežu, proces disocijacije elektrolita je pojednostavljeno prikazan: NaCl = Na+ +Cl-
Na primjer, zapišite skraćenu jednadžbu za disocijaciju nekih tvari ionske strukture: Ca (OH) 2, Na2SO4, Na3PO4, Al2 (SO4).
U današnjoj ste lekciji naučili što je elektrolitička disocijacija, mehanizam disocijacije.
Na temelju prethodno navedenog, recite koji su procesi šifrirani u pjesmi:
Živio je jedan ionski kristal,
Za ione, kuća je ogromna,
Bio je zgodan i ujednačen.
Ali dogodila mu se nevolja.
Na njega je pala kap
I kristal je nestao u trenu:
Raširiti u ione
Njegova pametna voda.
Cijela obitelj bila je iznenađena:
"Što se dogodilo vani?"
Iznenada se pojavio pored niza molekula,
Dotrčali su u bučnom roju,
Okružen gustom formacijom:
“Želimo ponuditi heroje
naše prijateljstvo zauvijek...
Vodik u anione,
hidroksid u katione,
Ne bježite od njih ioni
Ni ovamo ni tamo.
(otapanje tvari s ionskom vezom, orijentacija molekula vode, hidratacija, disocijacija)
Domaća zadaća:§ 35, br. 2,5,6 str.147.
2





7

Anioni Kationi Anoda Katoda - +

Otopina Kristal NaCl Na + + Cl H2OH2O H2OH2O Sl.4.

10 HCl otopina H + + Cl - H2OH2O H2OH2O Riža HCl Cl - H+H+ + - H+H Cl-Cl-




14 Test provjere. Opcija 1. Opcija 2. 1. Neelektroliti uključuju: 1) natrijev karbonat 2) etilni alkohol 3) klorovodičnu kiselinu 4) cink nitrat 1. Neelektroliti uključuju: 1) barijev klorid 2) šećer 3) sumpornu kiselinu 4) kalij karbonat 2 Disocira uz stvaranje metalnih kationa i aniona kiselinskog ostatka: 1). bakrov (II) hidroksid 2). natrijev hidroksid 3). aluminijev klorid 4). ugljična kiselina 2. Stvaranjem metalnih kationa i aniona kiselinskog ostatka disocira: 1) saharoza 2) natrijev hidroksid 3) aluminijev bromid 4) dušična kiselina 3. Obje tvari u skupini su elektroliti: 1). CH4, CO2 2). C2H5OH, HNO3 3). CaO, BaSO4 4). NaCl, KOH 3. Elektroliti su obje tvari u skupini: 1). glicerin, SO2 2). CuCl2, KOH 3). BaO, K2SO4 4). Fe(OH)3, H2SiO3 4. Najviše vodikovih iona nastaje tijekom disocijacije jednako: 1). BOK 2). H2CO3 3). H2S 4). H2SiO3 4. Većina vodikovih iona nastaje tijekom disocijacije jednaka: 1). H3PO4 2). H2SO4 3). HNO3 4). HF 5. Zbroj koeficijenata u jednadžbi disocijacije aluminijevog sulfata je: 1). 4 2). 6 3). 2 4) Zbroj koeficijenata u jednadžbi disocijacije natrijeva karbonata je: 1). 4 2). 3 3). 2 4). 1