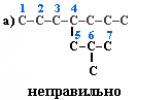
Vyberte hlavný uhlíkový reťazec v molekule. Po prvé, musí byť najdlhší. Po druhé, ak existujú dva alebo viac reťazcov rovnakej dĺžky, vyberie sa z nich ten najviac rozvetvený. Napríklad v molekule sú 2 reťazce s rovnakým počtom (7) atómov C (farebne zvýraznené):
V prípade (a) má reťazec 1 substituent a v prípade (b) má 2. Preto by sa mala zvoliť možnosť (b).
1. Očíslujte atómy uhlíka v hlavnom reťazci tak, aby atómy C spojené so substituentmi dostali najnižšie možné čísla. Preto číslovanie začína od konca reťazca najbližšieho k vetve. Napríklad:

Pomenujte všetky radikály (substituenty), pričom vpredu uveďte čísla označujúce ich umiestnenie v hlavnom reťazci. Ak existuje niekoľko rovnakých substituentov, potom pre každý z nich je napísané číslo (umiestnenie) oddelené čiarkou a ich počet je označený predponami di-, tri-, tetra-, penta- atď. (Napríklad, 2,2-dimetyl alebo 2,3,3,5-tetrametyl).
Názvy všetkých substituentov sú usporiadané v abecednom poradí (podľa najnovších pravidiel IUPAC).
Pomenujte hlavný reťazec atómov uhlíka, t.j. zodpovedajúci normálny alkán.
V názve rozvetveného alkánu je teda koreň + prípona názvom normálneho alkánu (grécka číslica + prípona „an“), predpony sú čísla a názvy uhľovodíkových radikálov. Príklad konštrukcie názvu:

Chem. alkánov svKrakovanie alkánov. Krakovanie je proces tepelného rozkladu uhľovodíkov, ktorý je založený na reakciách štiepenia uhlíkového reťazca veľkých molekúl za vzniku zlúčenín s kratším reťazcom. Izomerizácia alkánov Alkány normálnej štruktúry pod vplyvom katalyzátorov a pri zahrievaní sú schopné premeniť sa na rozvetvené alkány bez zmeny zloženia molekúl, t.j. vstupujú do izomerizačných reakcií. Tieto reakcie zahŕňajú alkány, ktorých molekuly obsahujú aspoň 4 atómy uhlíka. Napríklad izomerizácia n-pentánu na izopentán (2-metylbután) prebieha pri 100 °C v prítomnosti katalyzátora na báze chloridu hlinitého:
 Východiskový materiál a produkt izomerizačnej reakcie majú rovnaký molekulový vzorec a sú to štruktúrne izoméry (izoméria uhlíkového skeletu).
Východiskový materiál a produkt izomerizačnej reakcie majú rovnaký molekulový vzorec a sú to štruktúrne izoméry (izoméria uhlíkového skeletu).
Dehydrogenácia alkánov
Keď sa alkány zahrievajú v prítomnosti katalyzátorov (Pt, Pd, Ni, Fe, Cr 2 O 3, Fe 2 O 3, ZnO), ich katalytický dehydrogenácie– odštiepenie atómov vodíka v dôsledku prerušenia väzieb C-H.
Štruktúra produktov dehydrogenácie závisí od reakčných podmienok a dĺžky hlavného reťazca vo východiskovej molekule alkánu.
1. Nižšie alkány obsahujúce 2 až 4 atómy uhlíka v reťazci, keď sa zahrievajú na Ni-katalyzátore, odštiepujú vodík z susedný atómy uhlíka a premenia sa na alkény:
Spolu s butén-2 táto reakcia vytvára butén-1 CH2 \u003d CH-CH2-CH3. V prítomnosti katalyzátora Cr 2 O 3 /Al 2 O 3 pri 450-650 С od n-bután sa tiež dostáva butadién-1,3 CH2=CH-CH=CH2.
2. Na získanie sa používajú alkány obsahujúce viac ako 4 atómy uhlíka v hlavnom reťazci cyklický spojenia. Zároveň sa to stáva dehydrocyklizácia- dehydrogenačná reakcia, ktorá vedie k uzavretiu reťazca do stabilného cyklu.
Ak hlavný reťazec molekuly alkánu obsahuje 5 (ale nie viac) atómov uhlíka ( n-pentán a jeho alkylderiváty), potom sa pri zahrievaní na Pt katalyzátore odštiepia atómy vodíka od koncových atómov uhlíkového reťazca a vytvorí sa päťčlenný cyklus (cyklopentán alebo jeho deriváty):

Do dehydrocyklizačnej reakcie vstupujú aj alkány s hlavným reťazcom 6 a viac atómov uhlíka, ale vždy tvoria 6-členný cyklus (cyklohexán a jeho deriváty). Za reakčných podmienok tento cyklus podlieha ďalšej dehydrogenácii a mení sa na energeticky stabilnejší benzénový cyklus aromatického uhľovodíka (arén). Napríklad:

Tieto reakcie sú základom tohto procesu reformovanie– spracovanie ropných produktov s cieľom získať arény ( aromatizácia nasýtené uhľovodíky) a vodík. transformácia n- alkánov v arénach vedie k zlepšenej odolnosti benzínu voči klepaniu.
Petrohradský štátny technologický inštitút
(Technická univerzita)
Katedra organickej chémie Fakulta 4
Skupina 476
Práca na kurze
Oxidácia alkénu
Študentka……………………………………… Rytina A.I.
Prednášajúci………………………………... Piterskaya Yu.L.
Saint Petersburg
Úvod
1. Epoxidácia (reakcia N.A. Prilezhaeva, 1909)
2. Hydroxylácia
2.1anti-Hydroxylácia
2.2syn-Hydroxylácia
3. Oxidačné štiepenie alkénov
4.Ozonolýza
5. Oxidácia alkénov v prítomnosti paládiových solí
Záver
Zoznam použitých zdrojov
Úvod
Oxidácia je jednou z najdôležitejších a najrozšírenejších premien organických zlúčenín.
V organickej chémii sa oxidácia chápe ako procesy, ktoré vedú k vyčerpaniu zlúčeniny o vodík alebo jej obohateniu o kyslík. V tomto prípade sa z molekuly odstránia elektróny. V súlade s tým sa redukciou rozumie oddelenie od organickej molekuly kyslíka alebo pridanie vodíka k nej.
Pri redoxných reakciách sú oxidačné činidlá zlúčeniny s vysokou elektrónovou afinitou (elektrofily) a redukčné činidlá sú zlúčeniny, ktoré majú tendenciu darovať elektróny (nukleofily). Ľahkosť oxidácie zlúčeniny sa zvyšuje s rastom jej nukleofility.
Počas oxidácie organických zlúčenín spravidla nedochádza k úplnému prenosu elektrónov, a teda k zmene valencie atómov uhlíka. Preto pojem stupeň oxidácie - podmienený náboj atómu v molekule, vypočítaný na základe predpokladu, že molekula pozostáva iba z iónov - je len podmienený, formálny.
Pri zostavovaní rovníc redoxných reakcií je potrebné určiť redukčné činidlo, oxidačné činidlo a počet daných a prijatých elektrónov. Koeficienty sa spravidla vyberajú metódou elektrón-iónovej rovnováhy (metóda polovičnej reakcie).
Táto metóda zvažuje prechod elektrónov z jedného atómu alebo iónu na druhý, pričom sa berie do úvahy charakter prostredia (kyslé, alkalické alebo neutrálne), v ktorom reakcia prebieha. Na vyrovnanie počtu atómov kyslíka a vodíka sa zavádzajú buď molekuly vody a protóny (ak je prostredie kyslé), alebo molekuly vody a hydroxidové ióny (ak je prostredie alkalické).
Pri písaní redukčných a oxidačných polovičných reakcií sa teda musí vychádzať zo zloženia iónov skutočne prítomných v roztoku. Látky, ktoré sú slabo disociované, zle rozpustné alebo vyvíjané ako plyn, by sa mali písať v molekulárnej forme.
Ako príklad uvažujme proces oxidácie etylénu so zriedeným vodným roztokom manganistanu draselného (Wagnerova reakcia). Počas tejto reakcie sa etylén oxiduje na etylénglykol a manganistan draselný sa redukuje na oxid manganičitý. Na mieste dvojitej väzby sú pridané dva hydroxyly:
3C2H4 + 2KMnO4 + 4H20 → 3C2H602 + 2Mn02 + 2KOH
Redukčná polovičná reakcia: Mn04¯ + 2H20+ 3 e→ Mn02 + 4OH ¯ 2Oxidačná polovičná reakcia: C 2 H 4 + 2OH − − 2 e → C2H6023
Nakoniec máme v iónovej forme:
2MnO4¯ + 4H20 + 3C2H4 + 6OH¯ → 2Mn02 + 8OH¯ + 3C2H602
Po vykonaní potrebných redukcií podobných výrazov napíšeme rovnicu v molekulárnej forme:
3C2H4 + 2KMn04 + 4 H20 \u003d 3C2H602 + 2Mn02 + 2KOH.
Charakteristika niektorých oxidačných činidiel
Kyslík
Vzduchový kyslík má široké využitie v technologických procesoch, keďže je najlacnejším oxidačným činidlom. Oxidácia vzdušným kyslíkom je však spojená s ťažkosťami spojenými s riadením procesu, ktorý prebieha rôznymi smermi. Oxidácia sa zvyčajne uskutočňuje pri vysokej teplote v prítomnosti katalyzátorov.
Ozón
Ozón O 3 sa používa na získanie aldehydov a ketónov, ak je ťažké ich získať iným spôsobom. Najčastejšie sa ozón používa na vytvorenie štruktúry nenasýtených zlúčenín. Ozón vzniká pôsobením tichého elektrického výboja na kyslík. Jednou z významných výhod ozonizácie v porovnaní s chlórovaním je absencia toxínov po úprave.
Manganistan draselný
Manganistan draselný je najbežnejšie používané oxidačné činidlo. Činidlo je rozpustné vo vode (6,0 % pri 20ºC), ako aj v metanole, acetóne a kyseline octovej. Na oxidáciu sa používajú vodné (niekedy acetónové) roztoky KMnO 4 v neutrálnom, kyslom alebo alkalickom prostredí. Pri uskutočňovaní procesu v neutrálnom prostredí sa do reakčnej hmoty pridávajú soli horčíka, hliníka alebo prechádza oxidom uhličitým na neutralizáciu hydroxidu draselného uvoľňovaného počas reakcie. Oxidačná reakcia KMnO 4 v kyslom prostredí sa najčastejšie uskutočňuje v prítomnosti kyseliny sírovej. Alkalické prostredie pri oxidácii vytvára KOH vznikajúci pri reakcii, alebo sa na začiatku pridáva do reakčnej hmoty. V mierne alkalickom a neutrálnom prostredí oxiduje KMnO 4 podľa rovnice:
KMnO4+ 3 e+ 2H20 \u003d K + + MnO2 + 4OH ¯
v kyslom prostredí:
KMnO4+ 5 e+ 8H+ = K++ Mn2+ + 4H20
Manganistan draselný sa používa na získanie 1,2-diolov z alkénov, pri oxidácii primárnych alkoholov, aldehydov a alkylarénov na karboxylové kyseliny a tiež na oxidačné štiepenie uhlíkového skeletu na viacnásobných väzbách.
V praxi sa zvyčajne používa dosť veľký prebytok (viac ako 100 %) KMnO 4 . Je to spôsobené tým, že za normálnych podmienok sa KMnO 4 čiastočne rozkladá na oxid manganičitý za uvoľňovania O 2 . Výbušne sa rozkladá s koncentrovanou H 2 SO 4 pri zahrievaní v prítomnosti redukčných činidiel; výbušné sú aj zmesi manganistanu draselného s organickými látkami.
Perkyseliny
Kyseliny peroctové a permravčivé sa získavajú reakciou 25 – 90 % peroxidu vodíka so zodpovedajúcou karboxylovou kyselinou podľa nasledujúcej reakcie:
RCOOH + H202 \u003d RCOOOH + H20
V prípade kyseliny octovej sa táto rovnováha nastavuje pomerne pomaly a kyselina sírová sa zvyčajne pridáva ako katalyzátor na urýchlenie tvorby perkyseliny. Kyselina mravčia je sama o sebe dostatočne silná, aby poskytla rýchlu rovnováhu.
Ešte silnejším oxidačným činidlom je kyselina pertrifluóroctová, získaná v zmesi s kyselinou trifluóroctovou reakciou anhydridu kyseliny trifluóroctovej s 90% peroxidom vodíka. Podobne je možné kyselinu peroctovú získať z anhydridu kyseliny octovej a peroxidu vodíka.
Pevné m-kyselina chlórperbenzoová, pretože manipulácia s ňou je relatívne bezpečná, je pomerne stabilná a môže sa skladovať dlhú dobu.
Oxidácia nastáva v dôsledku uvoľneného atómu kyslíka:
RCOOOH = RCOOH + [O]
Perkyseliny sa používajú na získanie epoxidov z alkénov, ako aj laktónov z alicyklických ketónov.
Peroxid vodíka
Peroxid vodíka je bezfarebná kvapalina, miešateľná s vodou, etanolom a dietyléterom. 30 % roztok H 2 O 2 sa nazýva perhydrol. Vysoko koncentrovaný prípravok môže explozívne reagovať s organickými látkami. Pri skladovaní sa rozkladá na kyslík a vodu. Perzistencia peroxidu vodíka sa zvyšuje so zriedením. Na oxidáciu sa používajú vodné roztoky rôznych koncentrácií (od 3 do 90 %) v neutrálnom, kyslom alebo alkalickom prostredí.
H202 \u003d H20 + [O]
Pôsobením tohto činidla na α,β-nenasýtené karbonylové zlúčeniny v alkalickom prostredí sa získajú zodpovedajúce epoxyaldehydy a ketóny, oxidáciou karboxylových kyselín v kyslom prostredí sa syntetizujú perkyseliny. 30 % roztok H 2 O 2 v kyseline octovej oxiduje alkény na 1,2-dioly. Peroxid vodíka sa používa: na získanie organických a anorganických peroxidov, perboritanu sodného a peruhličitanu sodného; ako oxidačné činidlo v raketových palivách; po príjme epoxidov, hydrochinónu, pyrokatecholu, etylénglykolu, glycerínu, urýchľovačov vulkanizácie tiuramovej skupiny atď.; na bielenie olejov, tukov, kožušín, kože, textilných materiálov, papiera; na čistenie germánových a kremíkových polovodičových materiálov; ako dezinfekčný prostriedok na neutralizáciu domácich a priemyselných odpadových vôd; v medicíne; ako zdroj O 2 v ponorkách; H 2 O 2 je súčasťou Fentonovho činidla (Fe 2 + + H 2 O 2), ktoré sa používa ako zdroj voľných radikálov OH v organickej syntéze.
Ruténium a oxid osmičelý
Oxid osmičelý OsO 4 je biely až svetložltý prášok s t.t. 40,6ºС; t. kip. 131,2ºС. Sublimuje už pri izbovej teplote, je rozpustný vo vode (7,47 g v 100 ml pri 25ºС), СCl 4 (250 g v 100 g rozpúšťadla pri 20ºС). V prítomnosti organických zlúčenín sčernie v dôsledku redukcie na OsO 2 .
RuO 4 je zlatožltý hranol s tak pl. 25,4ºС, zreteľne sublimuje pri izbovej teplote. Mierne rozpustný vo vode (2,03 g v 100 ml pri 20ºС), veľmi rozpustný v CCl4. Silnejšie oxidačné činidlo ako OsO 4 . Nad 100ºС exploduje. Rovnako ako oxid osmičelý má vysokú toxicitu a vysokú cenu.
Tieto oxidačné činidlá sa používajú na oxidáciu alkénov na a-glykoly za miernych podmienok.
Pri redoxných reakciách organické látkyčastejšie vykazujú vlastnosti redukčných činidiel, pričom samy sú oxidované. Ľahkosť oxidácie organických zlúčenín závisí od dostupnosti elektrónov pri interakcii s oxidačným činidlom. Všetky známe faktory, ktoré spôsobujú zvýšenie elektrónovej hustoty v molekulách organických zlúčenín (napríklad pozitívne indukčné a mezomérne efekty), zvýšia ich schopnosť oxidácie a naopak.
Tendencia organických zlúčenín oxidovať sa zvyšuje s rastom ich nukleofilnosť, čo zodpovedá nasledujúcim riadkom:
Rast nukleofility v sérii
Zvážte redoxné reakcie zástupcovia najdôležitejších tried organickej hmoty s niektorými anorganickými oxidačnými činidlami.
Oxidácia alkénu
Pri miernej oxidácii sa alkény premieňajú na glykoly (dvojsýtne alkoholy). Redukujúce atómy v týchto reakciách sú atómy uhlíka spojené dvojitou väzbou.
Reakcia s roztokom manganistanu draselného prebieha v neutrálnom alebo mierne alkalickom prostredí takto:
3C2H4 + 2KMnO4 + 4H20 → 3CH2OH–CH2OH + 2MnO2 + 2KOH
V ťažších podmienkach oxidácia vedie k pretrhnutiu uhlíkového reťazca na dvojitej väzbe a vzniku dvoch kyselín (v silne zásaditom prostredí dve soli) alebo kyseliny a oxidu uhličitého (v silne zásaditom prostredí soľ a uhličitan):
1) 5CH 3 CH=CHCH 2 CH 3 + 8 KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8 MnSO 4 + 4K 2 SO 4 + 17 H 2 O
2) 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2S04 + 20H20
3) CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 10KOH → CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 8K 2 MnO 4
4) CH 3 CH \u003d CH 2 + 10 KMnO 4 + 13 KOH → CH 3 COOK + K 2 CO 3 + 8H 2 O + 10 K 2 MnO 4
Dvojchróman draselný v prostredí kyseliny sírovej oxiduje alkény podobne ako pri reakciách 1 a 2.
Pri oxidácii alkénov, pri ktorej atómy uhlíka v dvojitej väzbe obsahujú dva uhlíkové radikály, vznikajú dva ketóny:


Alkínová oxidácia
Alkíny oxidujú za mierne ťažších podmienok ako alkény, takže zvyčajne oxidujú tak, že trojitá väzba preruší uhlíkový reťazec. Rovnako ako v prípade alkénov sú tu redukujúce atómy atómy uhlíka spojené násobnou väzbou. V dôsledku reakcií vznikajú kyseliny a oxid uhličitý. Oxidáciu možno vykonať manganistanom alebo dvojchrómanom draselným v kyslom prostredí, napríklad:
5CH3C≡CH + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5CO2 + 8MnSO4 + 4K2S04 + 12H20

Acetylén možno oxidovať manganistanom draselným v neutrálnom prostredí na šťavelan draselný:
3CH≡CH +8KMnO4 → 3KOOC –COOK +8MnO2 +2KOH +2H2O
V kyslom prostredí oxidácia prechádza na kyselinu šťaveľovú alebo oxid uhličitý:
5CH≡CH + 8KMnO4 + 12H2SO4 → 5HOOC -COOH + 8MnSO4 + 4K2S04 + 12H20
CH≡CH + 2KMnO4 + 3H2S04 → 2CO2 + 2MnSO4 + 4H20 + K2S04
Oxidácia homológov benzénu
Benzén neoxiduje ani za dosť drsných podmienok. Benzénové homológy môžu byť oxidované roztokom manganistanu draselného v neutrálnom prostredí na benzoát draselný:
C 6 H 5 CH 3 + 2KMnO 4 → C 6H 5 COOK + 2MnO 2 + KOH + H 2 O
C 6 H 5 CH 2 CH 3 + 4 KMnO 4 → C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4 MnO 2 + KOH
Oxidácia homológov benzénu dichrómanom alebo manganistanom draselným v kyslom prostredí vedie k tvorbe kyseliny benzoovej.
5C 6 H 5 CH 3 + 6 KMnO 4 + 9 H 2 SO 4 → 5C 6 H 5 COOH + 6MnS04 + 3K2S04 + 14H20
5C 6 H 5 –C 2 H 5 + 12 KMnO 4 + 18 H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 12 MnSO 4 + 6K 2 SO 4 + 28 H 2 O


Oxidácia alkoholu
Priame produkty oxidácie primárnych alkoholov sú aldehydy, zatiaľ čo produkty sekundárnych alkoholov sú ketóny.
Aldehydy vznikajúce pri oxidácii alkoholov sa ľahko oxidujú na kyseliny, preto sa aldehydy z primárnych alkoholov získavajú oxidáciou dvojchrómanom draselným v kyslom prostredí pri teplote varu aldehydu. Aldehydy sa odparujú a nemajú čas oxidovať.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O
Pri prebytku oxidačného činidla (KMnO 4, K 2 Cr 2 O 7) v akomkoľvek prostredí sa primárne alkoholy oxidujú na karboxylové kyseliny alebo ich soli a sekundárne alkoholy na ketóny.
5C2H5OH + 4KMnO4 + 6H2S04 → 5CH3COOH + 4MnSO4 + 2K2S04 + 11H20
3CH3-CH2OH + 2K2Cr207 + 8H2SO4 → 3CH3-COOH + 2K2S04 + 2Cr2(SO4)3 + 11H20
Terciárne alkoholy sa za týchto podmienok neoxidujú, ale metylalkohol sa oxiduje na oxid uhličitý.

Dvojsýtny alkohol, etylénglykol HOCH 2 -CH 2 OH, sa pri zahrievaní v kyslom prostredí s roztokom KMnO 4 alebo K 2 Cr 2 O 7 ľahko oxiduje na kyselinu šťaveľovú a v neutrálnom prostredí na šťavelan draselný.
5CH2(OH)-CH2(OH) + 8KMnO4 + 12H2S04 → 5HOOC -COOH + 8MnSO4 + 4K2S04 + 22H20
3CH 2 (OH) - CH 2 (OH) + 8KMnO 4 → 3KOOC -COOK + 8MnO2 + 2KOH + 8H20
Oxidácia aldehydov a ketónov
Aldehydy sú pomerne silné redukčné činidlá, a preto sa ľahko oxidujú rôznymi oxidačnými činidlami, napríklad: KMnO 4, K 2 Cr 2 O 7, OH, Cu (OH) 2. Všetky reakcie prebiehajú pri zahrievaní:
3CH 3 CHO + 2KMnO 4 → CH 3 COOH + 2CH 3 COOK + 2MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2 KMnO 4 + 3 KOH → CH 3 COOK + 2 K 2 MnO 4 + 2H 2 O
5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + 2MnSO4 + K2S04 + 3H20
CH 3 CHO + Br 2 + 3NaOH → CH 3 COONa + 2NaBr + 2H 2 O

reakcia strieborného zrkadla
S amoniakovým roztokom oxidu strieborného sa aldehydy oxidujú na karboxylové kyseliny, ktoré poskytujú amónne soli v roztoku amoniaku (reakcia „strieborného zrkadla“):
CH 3 CH \u003d O + 2OH → CH 3 COONH 4 + 2Ag + H20 + 3NH 3
CH3-CH \u003d O + 2Cu (OH)2 → CH3COOH + Cu20 + 2H20
Formaldehyd (formaldehyd) sa spravidla oxiduje na oxid uhličitý:
5HCOH + 4KMnO4 (chatrč) + 6H2S04 → 4MnS04 + 2K2S04 + 5C02 + 11H20
3CH20 + 2K2Cr207 + 8H2S04 → 3CO2 + 2K2S04 + 2Cr2(SO4)3 + 11H20
HCHO + 4OH → (NH 4) 2 CO 3 + 4Ag↓ + 2H20 + 6NH3
HCOH + 4Cu(OH)2 → CO2 + 2Cu20↓+ 5H20
Ketóny sa oxidujú v náročných podmienkach silnými oxidačnými činidlami s porušením väzieb C-C a poskytujú zmesi kyselín:

karboxylové kyseliny. Spomedzi kyselín majú silné redukčné vlastnosti kyselina mravčia a šťaveľová, ktoré sa oxidujú na oxid uhličitý.
HCOOH + HgCl2 \u003d CO2 + Hg + 2HCl
HCOOH + Cl2 \u003d CO2 + 2 HCl
HOOC-COOH + Cl2 \u003d 2CO2 + 2HCl
Kyselina mravčia okrem kyslých vlastností vykazuje aj niektoré vlastnosti aldehydov, najmä redukčné. Potom sa oxiduje na oxid uhličitý. Napríklad:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
Pri zahrievaní so silnými dehydratačnými činidlami (H2SO4 (konc.) alebo P4O10) sa rozkladá:
HCOOH ->(t)CO + H2O
Katalytická oxidácia alkánov:

Katalytická oxidácia alkénov:

Oxidácia fenolu:


Zostavovanie rovníc redoxných reakcií organických látok
IN V súvislosti so zavedením jednotnej štátnej skúšky (USE) ako jedinej formy záverečnej certifikácie absolventov stredných škôl a prechodom strednej školy na špecializačné vzdelávanie sa príprava stredoškolákov na „najdrahšie“ úlohy z hľadiska tzv. body časti „C“ testu USE v chémii sú čoraz dôležitejšie. Napriek tomu, že päť úloh časti „C“ sa považuje za rozdielne: chemické vlastnosti anorganických látok, reťazce premien organických zlúčenín, výpočtové úlohy, všetky do určitej miery súvisia s redoxnými reakciami (ORR). Ak sú zvládnuté základné znalosti teórie OVR, potom je možné správne dokončiť prvú a druhú úlohu v plnom rozsahu a tretiu - čiastočne. Práve v tom je podľa nás podstatná časť úspechu pri realizácii časti „C“. Skúsenosti ukazujú, že ak študenti pri štúdiu anorganickej chémie dostatočne dobre zvládajú úlohy písania rovníc OVR, potom im podobné úlohy z organickej chémie spôsobujú veľké ťažkosti. Preto sa počas štúdia celého kurzu organickej chémie v odborných triedach snažíme rozvíjať u stredoškolákov zručnosti zostavovania rovníc OVR.
Pri štúdiu porovnávacích charakteristík anorganických a organických zlúčenín oboznamujeme študentov s využitím oxidačného stavu (s.o.) (v organickej chémii predovšetkým uhlíka) a metódami jeho stanovenia:
1) výpočet priemernej s.d. uhlík v molekule organickej hmoty;
2) definícia s.d. každý atóm uhlíka.
Objasňujeme, v ktorých prípadoch je lepšie použiť jednu alebo druhú metódu.
Článok vyšiel s podporou spoločnosti „GEO-Engineering“, ktorá na trhu prezentuje produkty pod značkou „ProfKresla“. Predmetom činnosti spoločnosti je výroba, predaj a montáž kresiel a stoličiek do rôznych predsiení. Vysoká profesionalita zamestnancov a vlastné výrobné zariadenia nám umožňujú rýchlo a efektívne realizovať projekty akejkoľvek zložitosti. Všetky produkty značky ProfKresla, či už ide o divadelné stoličky, sedačky do čakární alebo stoličky pre vzdelávacie inštitúcie, sa vyznačujú moderným a ergonomickým dizajnom, ako aj vysokou odolnosťou proti opotrebeniu, pevnosťou a pohodlím. Z obrovskej škály produktov prezentovaných v katalógu na webovej stránke profkresla.ru si vždy môžete vybrať modely, ktoré najlepšie vyhovujú firemnému štýlu prijatému vo vašej spoločnosti. Ak máte stále problémy s výberom, potom sú špecialisti spoločnosti vždy pripravení poradiť, pomôcť určiť model a potom pripraviť projekt, vykonať všetky potrebné merania a inštaláciu na mieste.
P Pri štúdiu témy „Alkány“ ukazujeme, že procesy oxidácie, spaľovania, halogenácie, nitrácie, dehydrogenácie a rozkladu sú redoxné procesy. Pri písaní rovníc pre reakcie horenia a rozkladu organických látok je lepšie použiť priemernú hodnotu s.d. uhlíka. Napríklad:
Pozornosť venujeme prvej polovici elektronickej rovnováhy: pri atóme uhlíka v zlomkovej hodnote s.d. menovateľ je 4, takže prenos elektrónov vypočítame pomocou tohto koeficientu.
V ostatných prípadoch pri štúdiu témy „Alkány“ určujeme hodnoty s.d. každý atóm uhlíka v zlúčenine, pričom pozornosť študentov upozorňujú na postupnosť substitúcie atómov vodíka na primárnych, sekundárnych a terciárnych atómoch uhlíka:


Privádzame teda študentov k záveru, že na začiatku proces substitúcie prebieha na terciárnych, potom na sekundárnych a nakoniec na primárnych uhlíkových atómoch.
P Pri štúdiu témy „Alkény“ zvažujeme oxidačné procesy v závislosti od štruktúry alkénu a reakčného média.
Keď sa alkény oxidujú koncentrovaným roztokom manganistanu draselného KMnO 4 v kyslom prostredí (tvrdá oxidácia), väzby - a - sa rozbijú za vzniku karboxylových kyselín, ketónov a oxidu uhoľnatého (IV). Táto reakcia sa používa na určenie polohy dvojitej väzby.
Ak je dvojitá väzba na konci molekuly (napríklad v buténe-1), potom jedným z oxidačných produktov je kyselina mravčia, ktorá sa ľahko oxiduje na oxid uhličitý a vodu:

Zdôrazňujeme, že ak v molekule alkénu obsahuje atóm uhlíka na dvojitej väzbe dva substituenty uhlíka (napríklad v molekule 2-metylbuténu-2), potom pri jeho oxidácii vzniká ketón, pretože premena takéhoto atómu do atómu karboxylovej skupiny nie je možné bez prerušenia väzby C-C, relatívne stabilnej za týchto podmienok:

Objasňujeme, že ak je molekula alkénu symetrická a dvojitá väzba je obsiahnutá v strede molekuly, potom počas oxidácie vzniká iba jedna kyselina:

Uvádzame, že vlastnosťou oxidácie alkénov, pri ktorej atómy uhlíka v dvojitej väzbe obsahujú dva uhlíkové radikály, je tvorba dvoch ketónov:


Vzhľadom na oxidáciu alkénov v neutrálnom alebo mierne alkalickom prostredí zameriavame pozornosť študentov stredných škôl na skutočnosť, že za takýchto podmienok je oxidácia sprevádzaná tvorbou diolov (dvojsýtnych alkoholov) a na tieto atómy uhlíka sú viazané hydroxylové skupiny. medzi ktorými bola dvojitá väzba:

IN Podobným spôsobom uvažujeme o oxidácii acetylénu a jeho homológov v závislosti od prostredia, v ktorom proces prebieha. Takže objasňujeme, že v kyslom prostredí je proces oxidácie sprevádzaný tvorbou karboxylových kyselín:

Reakcia sa používa na určenie štruktúry alkínov pomocou produktov oxidácie:

V neutrálnom a mierne alkalickom prostredí je oxidácia acetylénu sprevádzaná tvorbou zodpovedajúcich oxalátov (solí kyseliny šťaveľovej) a oxidácia homológov je sprevádzaná porušením trojitej väzby a tvorbou solí karboxylových kyselín:

IN Všetky pravidlá sú rozpracované so študentmi na konkrétnych príkladoch, čo vedie k lepšiemu osvojeniu si teoretického materiálu. Preto pri štúdiu oxidácie arénov v rôznych médiách môžu študenti nezávisle vysloviť predpoklady, že v kyslom prostredí by sa malo očakávať vytváranie kyselín a v alkalickom prostredí solí. Učiteľ bude musieť iba objasniť, ktoré produkty reakcie vznikajú v závislosti od štruktúry príslušnej arény.
Na príkladoch ukazujeme, že benzénové homológy s jedným bočným reťazcom (bez ohľadu na jeho dĺžku) sú oxidované silným oxidačným činidlom na kyselinu benzoovú na atóme uhlíka. Benzénové homológy sa pri zahrievaní oxidujú manganistanom draselným v neutrálnom prostredí za vzniku draselných solí aromatických kyselín.
5C6H5-CH3 + 6KMn04 + 9H2S04 \u003d 5C6H5COOH + 6MnS04 + 3K2S04 + 14H20,
5C6H5-C2H5 + 12KMnO4 + 18H2S04 \u003d 5C6H5COOH + 5C02 + 12MnS04 + 6K2S04 + 28H20,
C6H5-CH3 + 2KMn04 \u003d C6H5 COOK + 2Mn02 + KOH + H20.
Zdôrazňujeme, že ak je v molekule arénu niekoľko bočných reťazcov, potom sa v kyslom prostredí každý z nich oxiduje na atóme uhlíka na karboxylovú skupinu, čo vedie k tvorbe viacsýtnych aromatických kyselín:

P Získané zručnosti pri zostavovaní rovníc OVR pre uhľovodíky umožňujú ich použitie pri štúdiu časti „Zlúčeniny obsahujúce kyslík“.
Takže pri štúdiu témy „Alkoholy“ študenti nezávisle zostavujú rovnice pre oxidáciu alkoholov podľa nasledujúcich pravidiel:
1) primárne alkoholy sa oxidujú na aldehydy
3CH3-CH2OH + K2Cr207 + 4H2S04 \u003d 3CH3-CHO + K2S04 + Cr2(S04)3 + 7H20;
2) sekundárne alkoholy sa oxidujú na ketóny

3) pre terciárne alkoholy nie je oxidačná reakcia typická.
V rámci prípravy na skúšku je vhodné, aby učiteľ k týmto vlastnostiam uviedol ďalšie informácie, ktoré budú pre študentov nepochybne užitočné.
Pri oxidácii metanolu okysleným roztokom manganistanu draselného alebo dvojchrómanu draselného vzniká CO 2, primárne alkoholy pri oxidácii môžu v závislosti od reakčných podmienok vytvárať nielen aldehydy, ale aj kyseliny. Napríklad oxidácia etanolu dvojchrómanom draselným za studena končí tvorbou kyseliny octovej a pri zahrievaní acetaldehydu:
3CH3-CH2OH + 2K2Cr207 + 8H2SO4 \u003d 3CH3-COOH + 2K2S04 + 2Cr2(SO4)3 + 11H20,
3CH3-CH2OH + K2Cr207 + 4H2SO4 3CH3-CHO + K2S04 + Cr2(SO4)3 + 7H20.
Pripomeňme žiakom opäť vplyv prostredia na produkty oxidačných reakcií alkoholov, a to: horúci neutrálny roztok KMnO 4 oxiduje metanol na uhličitan draselný a zvyšné alkoholy na soli príslušných karboxylových kyselín:

Pri štúdiu témy „Aldehydy a ketóny“ zameriavame pozornosť študentov na to, že aldehydy sa ľahšie oxidujú ako alkoholy na zodpovedajúce karboxylové kyseliny nielen pôsobením silných oxidačných činidiel (vzdušný kyslík, okyslené roztoky KMnO 4 a K 2 Cr 2 O 7), ale a pod vplyvom slabého (roztok amoniaku oxidu strieborného alebo hydroxidu meďnatého):
5CH3-CHO + 2KMnO4 + 3H2S04 \u003d 5CH3-COOH + 2MnS04 + K2S04 + 3H20,
3CH3-CHO + K2Cr207 + 4H2SO4 \u003d 3CH3-COOH + Cr2(SO4)3 + K2S04 + 4H20,
CH3-CHO + 2OH CH3-COONH4 + 2Ag + 3NH3 + H20.
Osobitnú pozornosť venujeme oxidácii metanálu čpavkovým roztokom oxidu strieborného, od r v tomto prípade vzniká uhličitan amónny a nie kyselina mravčia:
HCHO + 4OH \u003d (NH4)2C03 + 4Ag + 6NH3 + 2H20.
Ako ukazujú naše dlhoročné skúsenosti, navrhovaný spôsob výučby stredoškolákov písať rovnice OVR za účasti organických látok zvyšuje ich konečný USE výsledok v chémii o niekoľko bodov.
Ako už bolo uvedené, oxidácia organickej hmoty je zavedenie kyslíka do jej zloženia a (alebo) odstránenie vodíka. Regenerácia je opačný proces (zavedenie vodíka a odstránenie kyslíka). Vzhľadom na zloženie alkánov (СnH2n+2) môžeme konštatovať, že nie sú schopné zúčastniť sa redukčných reakcií, ale môžu sa podieľať na oxidačných reakciách.
Alkány sú zlúčeniny s nízkym stupňom oxidácie uhlíka a v závislosti od reakčných podmienok môžu byť oxidované za vzniku rôznych zlúčenín.
Pri bežných teplotách alkány nereagujú ani so silnými oxidačnými činidlami (H2Cr2O7, KMnO4 a pod.). Pri vložení do otvoreného ohňa alkány horia. Zároveň sa v nadbytku kyslíka úplne oxidujú na CO2, kde uhlík má najvyšší oxidačný stav +4, a vodu. Spaľovanie uhľovodíkov vedie k porušeniu všetkých väzieb C-C a C-H a je sprevádzané uvoľňovaním veľkého množstva tepla (exotermická reakcia).
Všeobecne sa uznáva, že mechanizmus oxidácie alkánov zahŕňa proces radikálového reťazca, pretože samotný kyslík nie je veľmi reaktívny, aby bolo možné abstrahovať atóm vodíka z alkánu, je potrebná častica, ktorá iniciuje tvorbu alkylového radikálu, ktorý bude reagovať s kyslíkom za vzniku peroxyradikálu. Peroxyradikál potom môže odobrať atóm vodíka z inej molekuly alkánu za vzniku alkylhydroperoxidu a radikálu.

Alkány je možné oxidovať vzdušným kyslíkom pri 100-150 ° C v prítomnosti katalyzátora - octanu mangánu, táto reakcia sa používa v priemysle. Oxidácia nastáva, keď je prúd vzduchu vháňaný cez roztavený parafín obsahujúci mangánovú soľ.
Pretože ako výsledok reakcie sa vytvorí zmes kyselín, potom sa oddelia od nezreagovaného parafínu rozpustením vo vodnej alkálii a potom sa neutralizujú minerálnou kyselinou.
Priamo v priemysle sa táto metóda používa na získanie kyseliny octovej z n-butánu:
Oxidácia alkénu
Alkénové oxidačné reakcie sa delia do dvoch skupín: 1) reakcie, pri ktorých je zachovaný uhlíkový skelet, 2) reakcie oxidačnej deštrukcie uhlíkového skeletu molekuly pozdĺž dvojitej väzby.
Oxidačné reakcie alkénov so zachovaním uhlíkového skeletu
1. Epoxidácia (Prilezhaevova reakcia)
Acyklické a cyklické alkény pri interakcii s peroxokyselinami v nepolárnom prostredí vytvárajú epoxidy (oxirány).
Oxirány možno získať aj oxidáciou alkénov hydroperoxidmi v prítomnosti katalyzátorov obsahujúcich molybdén, volfrám a vanád:

Najjednoduchší oxirán, etylénoxid, sa priemyselne vyrába oxidáciou etylénu kyslíkom v prítomnosti striebra alebo oxidu strieborného ako katalyzátora.

2. antihydroxylácia (hydrolýza epoxidov)
Kyslá (alebo alkalická) hydrolýza epoxidov vedie k otvoreniu oxidového cyklu s tvorbou transdiolov.

V prvom stupni dochádza k protonizácii atómu kyslíka epoxidu za vzniku cyklického oxóniového katiónu, ktorý sa otvára v dôsledku nukleofilného ataku molekuly vody.
Bázou katalyzované epoxidové otváranie kruhu tiež vedie k tvorbe trans-glykolov.

3. syn-hydroxylácia
Jednou z najstarších metód oxidácie alkénov je Wagnerova reakcia (oxidácia manganistanom draselným). Spočiatku počas oxidácie vzniká cyklický ester manganistanu, ktorý sa hydrolyzuje na vicinálny diol:

Okrem Wagnerovej reakcie existuje ďalší spôsob syn-hydroxylácie alkénov pôsobením oxidu osmia (VIII), ktorý navrhol Krige. Pôsobením oxidu osmičelého na alkén v éteri alebo dioxáne vzniká čierna zrazenina cyklického esteru kyseliny osmikovej - osmát. Adícia Os04 na násobnú väzbu je však v pyridíne výrazne urýchlená. Výsledná čierna zrazenina osmátu sa ľahko rozkladá pôsobením vodného roztoku hydrosiričitanu sodného:

Manganistan draselný alebo oxid osmičelý oxidujú alkén na cis-1,2-diol.
Oxidačné štiepenie alkénov
Oxidačné štiepenie alkénov zahŕňa reakcie ich interakcie s manganistanom draselným v alkalickej alebo sírovej kyseline, ako aj oxidáciu roztokom oxidu chrómového v kyseline octovej alebo dvojchrómanu draselného a kyseliny sírovej. Konečným výsledkom takýchto premien je rozštiepenie uhlíkového skeletu v mieste dvojitej väzby a vznik karboxylových kyselín alebo ketónov.
Monosubstituované alkény s koncovou dvojitou väzbou sa štiepia na karboxylovú kyselinu a oxid uhličitý:

Ak oba atómy uhlíka v dvojitej väzbe obsahujú iba jednu alkylovú skupinu, potom sa vytvorí zmes karboxylových kyselín:

Ak je však alkén tetrasubstituovaný dvojitou väzbou ketón:

Oveľa väčší preparatívny význam nadobudla reakcia ozonolýzy alkénov. Po mnoho desaťročí táto reakcia slúžila ako hlavná metóda na určenie štruktúry východiskového alkénu. Táto reakcia sa uskutočňuje prechodom prúdu roztoku ozónu v kyslíku, roztoku alkénu v metylénchloride alebo etylacetáte pri teplote -80 ... -100 ° C. Mechanizmus tejto reakcie stanovil Krige:


Ozonidy sú nestabilné zlúčeniny, ktoré sa rozkladajú výbuchom. Existujú dva spôsoby rozkladu ozonidov – oxidačný a redukčný.
Počas hydrolýzy sa ozonidy štiepia na karbonylové zlúčeniny a peroxid vodíka. Peroxid vodíka oxiduje aldehydy na karboxylové kyseliny - ide o oxidačný rozklad:

Oveľa dôležitejšie je redukčné štiepenie ozonidov. Produkty ozonolýzy sú aldehydy alebo ketóny v závislosti od štruktúry východiskového alkénu:
Okrem vyššie uvedených metód existuje ešte jedna metóda navrhnutá v roku 1955 Lemieuxom:
Pri metóde Lemieux neexistujú žiadne časovo náročné postupy na oddeľovanie oxidu manganičitého, pretože oxid a manganistan sa opäť oxidujú jodistanom na manganistan. To umožňuje použiť iba katalytické množstvá manganistanu draselného.