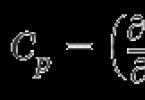La umezire, apare curbura suprafeței, care modifică proprietățile stratului de suprafață. Existența unui exces de energie liberă în apropierea unei suprafețe curbe duce la așa-numitele fenomene capilare - foarte ciudate și importante.
Să facem mai întâi o analiză calitativă pe exemplul unui balon de săpun. Dacă, în procesul de suflare a bulei, deschidem capătul tubului, vom vedea că bula situată la capătul său va scădea în dimensiune și va fi trasă în tub. Deoarece aerul de la capătul deschis comunica cu atmosfera, pentru a menține starea de echilibru a bulei de săpun, este necesar ca presiunea din interior să fie mai mare decât cea din exterior. Dacă, în același timp, un tub este conectat la un monometru, atunci se înregistrează o anumită diferență de nivel pe acesta - un exces de presiune DP în faza volumetrică a gazului din partea concavă a suprafeței bulei.
Să stabilim o relație cantitativă între DP și raza de curbură a suprafeței 1/r între două faze în vrac care sunt în echilibru și separate de o suprafață sferică. (de exemplu, o bulă de gaz într-un lichid sau o picătură de lichid într-o fază de vapori). Pentru aceasta, folosim expresia termodinamică generală pentru energia liberă în condiția T = const și absența transferului de materie de la o fază la alta dn i = 0. În starea de echilibru sunt posibile variații ale suprafeței ds și volumului dV. . Fie V să crească cu dV și s cu ds. Apoi:
dF = - P 1 dV 1 - P 2 dV 2 + sds.
În starea de echilibru dF = 0. Ținând cont de faptul că dV 1 = dV 2 , aflăm:
P 1 - P 2 \u003d s ds / dV.
Astfel P 1 > P 2 . Având în vedere că V 1 = 4/3 p r 3 , unde r este raza de curbură, obținem:
Înlocuirea dă ecuația lui Laplace:
P 1 - P 2 \u003d 2s / r. (1)
Mai general, pentru un elipsoid de revoluție cu raze principale de curbură r 1 și r 2 , legea lui Laplace este formulată:
P 1 - P 2 \u003d s / (1 / R 1 - 1 / R 2).
Pentru r 1 = r 2 se obține (1), pentru r 1 = r 2 = ¥ (plan) P 1 = P 2 .
Diferența DP se numește presiune capilară. Să luăm în considerare semnificația fizică și consecințele legii Laplace, care stă la baza teoriilor fenomenelor capilare.Ecuația arată că diferența de presiune în fazele în vrac crește cu creșterea s și cu descreșterea razei de curbură. Astfel, cu cât dispersia este mai mare, cu atât presiunea internă a unui lichid cu suprafață sferică este mai mare. De exemplu, pentru o picătură de apă în faza de vapori la r = 10 -5 cm, DP = 2. 73 . 10 5 dine / cm 2 "15 at. Astfel, presiunea din interiorul picăturii, în comparație cu vaporii, este cu 15 atm mai mare decât în faza de vapori. Trebuie reținut că, indiferent de starea de agregare a fazelor, în stare de echilibru, presiunea pe latura concavă a suprafeței este întotdeauna mai mare decât pe cea convexă.Ecuația oferă baza măsurării experimentale a lui s. prin metoda celei mai mari presiuni cu bule. Una dintre cele mai importante consecințe ale existenței presiunii capilare este creșterea lichidului în capilar.
Fenomene capilare se observă în fluide care conțin
În vase înguste, în care distanța dintre pereți este proporțională cu raza de curbură a suprafeței lichide. Curbura rezultă din interacțiunea fluidului cu pereții vasului. Specificul comportamentului unui lichid în vasele capilare depinde dacă lichidul umezește sau nu pereții vasului, mai exact, de valoarea unghiului de contact de umectare.
Să luăm în considerare poziția nivelurilor de lichid în două capilare, dintre care unul are o suprafață liofilă și, prin urmare, pereții săi sunt umezi, în timp ce celălalt are o suprafață liofilizată și nu este umezită. În primul capilar, suprafața are o curbură negativă. Presiunea suplimentară Laplace tinde să întindă fluidul. (presiunea este îndreptată spre centrul de curbură). Presiunea de sub suprafață este mai mică decât presiunea de la suprafața plană. Ca urmare, apare o forță de plutire care ridică lichidul în capilar până când greutatea coloanei echilibrează forța care acționează.În al doilea capilar, curbura suprafeței este pozitivă, presiunea suplimentară este direcționată în lichid, ca urmare, lichidul din capilar coboară.
La echilibru, presiunea laplaciană este egală cu presiunea hidrostatică a unei coloane de lichid de înălțimea h:
DP \u003d ± 2s / r \u003d (r - r o) gh, unde r, r o sunt densitățile fazei lichide și gazoase, g este accelerația gravitației, r este raza meniscului.
Pentru a raporta înălțimea ridicării capilare de caracteristica de umectare, exprimăm raza meniscului în termeni de unghiul de umectare Q și raza capilarului r 0. Este clar că r 0 = r cosQ, înălțimea creșterea capilară este exprimată ca (formula lui Jurin):
h \u003d 2scosQ / r 0 (r - r 0)g
În absența umezării Q>90 0 , сosQ< 0, уровень жидкости опускается на величину h. При полном смачивании Q = 0, сosQ = 1, в этом случае радиус мениска равен радиусу капилляра. Измерение высоты капиллярного поднятия лежит в основе одного из наиболее точных методов определения поверхностного натяжения жидкостей.
O serie de fenomene și procese binecunoscute sunt explicate prin creșterea capilară a lichidelor: impregnarea hârtiei și a țesăturilor se datorează creșterii capilare a lichidului în pori. Rezistența la apă a țesăturilor este asigurată de hidrofobicitatea lor - o consecință a creșterii capilare negative. Ridicarea apei din sol are loc datorita structurii solului si asigura existenta acoperirii vegetale a Pamantului, ridicarea apei din sol de-a lungul trunchiurilor plantelor are loc datorita structurii fibroase a lemnului, procesului de circulație a sângelui în vasele de sânge, creșterea umidității în pereții clădirii (izolarea așezării), etc.
Reactivitate termodinamică (t.r.s.).
Caracterizează capacitatea unei substanțe de a intra într-o altă stare, de exemplu, într-o altă fază, de a intra într-o reacție chimică. Indică distanța sistemului dat de starea de echilibru în condiții date. T.r.s. este determinată de afinitatea chimică, care poate fi exprimată ca o modificare a energiei Gibbs sau o diferență a potențialelor chimice.
R.s depinde de gradul de dispersie al substanței. O modificare a gradului de dispersie poate duce la o schimbare a fazei sau a echilibrului chimic.
Creșterea corespunzătoare a energiei Gibbs dG d (datorită unei modificări a dispersiei) poate fi reprezentată ca o ecuație combinată a primei și a doua legi ale termodinamicii: dG d = -S dT + V dp
Pentru o substanță individuală V = V mol și la T = const avem: dG d = V mol dp sau DG d = V mol Dp
Înlocuind relația Laplace în această ecuație, obținem dG d = s V mol ds/dV
pentru curbura sferică: dG d \u003d ± 2 s V mol / r (3)
Ecuațiile arată că creșterea reactivității datorită unei modificări a dispersiei este proporțională cu curbura suprafeței, sau dispersie.
Dacă luăm în considerare trecerea unei substanțe de la o fază condensată la una gazoasă, atunci energia Gibbs poate fi exprimată în termeni de presiune a vaporilor, luând-o ca ideală. Atunci modificarea suplimentară a energiei Gibbs asociată cu schimbarea dispersiei este:
dG d \u003d RT ln (p d / p s) (4), unde p d și p s sunt presiunea vaporilor saturați pe suprafețe curbe și uniforme.
Înlocuind (4) în (3) obținem: ln (p d / p s) = ±2 s V mol /RT r
Raportul se numește ecuația Kelvin-Thomson. Din această ecuație rezultă că, cu o curbură pozitivă, presiunea vaporilor saturati pe o suprafață curbată va fi cu atât mai mare, cu atât curbura este mai mare, adică. raza picăturii mai mică. De exemplu, pentru o picătură de apă cu raza de r = 10 -5 cm (s=73, V mol =18) p d / p s = 0,01, adică 1%. Această consecință a legii Kelvin-Thomson face posibilă prezicerea fenomenului de distilare izotremică, care constă în evaporarea celor mai mici picături și condensarea vaporilor pe picături mai mari și pe o suprafață plană.
Cu curbura negativă care apare în capilare în timpul umezării, se obține o relație inversă: presiunea vaporilor saturați peste suprafața curbată (de deasupra picăturii) scade odată cu creșterea curburii (cu scăderea razei capilare). Astfel, dacă lichidul udă capilarul, atunci condensarea vaporilor în capilar are loc la o presiune mai mică decât pe o suprafață plană. Acesta este motivul pentru care ecuațiile Kelvin sunt adesea denumite ecuația de condensare capilară.
Să luăm în considerare influența dispersiei particulelor asupra solubilității lor. Ținând cont de faptul că modificarea energiei Gibbs este exprimată prin solubilitatea unei substanțe într-o stare dispersată diferită, similar relației (4), obținem pentru neelectroliți:
ln(c d /c a) = ±2 s V mol /RT r unde c d și c a sunt solubilitatea unei substanțe în stare fin dispersată și solubilitatea în echilibru cu particule mari ale acestei substanțe
Pentru un electrolit care se disociază în soluție în n ioni, putem scrie (neglijând coeficienții de activitate):
ln(a d /a s) \u003d n ln (c d /c s) \u003d ±2 s V mol /RT r, unde a d și a s sunt activitățile electroliților în soluții saturate în raport cu starea foarte dispersată y și grosier dispersată. Ecuațiile arată că odată cu creșterea dispersiei, solubilitatea crește sau potențialul chimic al particulelor din sistemul dispersat este mai mare decât cel al unei particule mari cu 2 s V mol/r. În același timp, solubilitatea depinde de semnul curburii suprafeței, ceea ce înseamnă că dacă particulele unui solid au o formă neregulată cu curbură pozitivă și negativă și se află într-o soluție saturată, atunci zonele cu curbură pozitivă se vor dizolva și cei cu curbură negativă vor crește. Ca rezultat, particulele substanței dizolvate capătă în cele din urmă o formă bine definită corespunzătoare stării de echilibru.
Gradul de dispersie poate afecta, de asemenea, echilibrul unei reacții chimice: - DG 0 d \u003d RT ln (K d / K), unde DG 0 d este creșterea afinității chimice din cauza dispersiei, K d și K sunt echilibrul constante ale reacțiilor care implică substanțe dispersate și nedispersate .
Odată cu creșterea dispersiei, activitatea componentelor crește și, în conformitate cu aceasta, constanta de echilibru chimic se modifică într-o direcție sau alta, în funcție de gradul de dispersie a substanțelor inițiale și a produselor de reacție. De exemplu, pentru reacția de descompunere a carbonatului de calciu: CaCO 3 " CaO + CO 2
o creștere a dispersității carbonatului de calciu inițial deplasează echilibrul spre dreapta, iar presiunea dioxidului de carbon asupra sistemului crește. Creșterea dispersiei oxidului de calciu duce la rezultatul opus.
Din același motiv, odată cu creșterea dispersiei, legătura apei de cristalizare cu substanța este slăbită. Deci macrocristal de Al 2 O 3. 3 H 2 O cedează apă la 473 K, în timp ce într-un precipitat de particule de mărime coloidală, hidratul cristalin se descompune la 373 K. Aurul nu interacționează cu acidul clorhidric, iar aurul coloidal se dizolvă în el. Sulful grosier nu interacționează semnificativ cu sărurile de argint, iar sulful coloidal formează sulfură de argint.
Lăsați lichidul să fie în orice vas. Dacă distanțele dintre suprafețele care limitează lichidul sunt comparabile cu raza de curbură a suprafeței lichidului, atunci astfel de vase se numesc capilarele . Fenomenele care apar în capilare se numesc fenomene capilare . Capilarele sunt ridicare capilară lichide și aderenta capilara între suprafeţele umede.
Cele mai simple și mai frecvent utilizate capilare sunt capilarele cilindrice (Fig. 10.10). Suprafața lichidului din astfel de capilare este sferică. Fie r raza de curbură a suprafeței lichidului, R raza capilarului, θ unghiul de contact. În cazul umezirii parțiale, lichidul se va ridica prin capilar sub acțiunea presiunii Laplace până când este compensat de presiunea hidraulică a lichidului:
Unde ρ este densitatea lichidului, g este accelerația gravitației, h este înălțimea ridicării capilare. Raza de curbură a suprafeței lichide este convenabil exprimată în termeni de raza capilarului, care poate fi măsurată cu ușurință: . Înlocuind presiunea Laplace cu o expresie a suprafeței sferice (10-12), obținem:
În caz de umezire completă θ \u003d 0 o, cos θ \u003d 1, r = R iar formula pentru înălțimea creșterii capilare este:
Cu umezire completă θ=180 o, cos θ = - 1, iar înălțimea creșterii capilare va fi negativă, adică suprafața lichidului va scădea cu o cantitate h(Fig. 10.11).
Este interesant de observat că în capilarele comunicante înălțimea nivelului lichidului nu este aceeași. Cea mai mare creștere a capilarului se observă în cel mai îngust capilar, iar cea mai mică - în cel mai larg capilar (Fig. 10.12).
pentru umezirea completă. Fenomenele capilare se observă atunci când apa se ridică la suprafața solului, când se folosește hârtie de absorbție, o cârpă, când kerosenul se ridică în fitil etc.
Odată cu creșterea temperaturii, coeficientul de tensiune superficială al lichidelor scade, iar la o temperatură critică este egal cu zero. Coeficientul de tensiune superficială al lichidelor depinde și de densitatea și masa molară a lichidului. Mai mult, dependența coeficientului de tensiune superficială de temperatură este exprimată cu cât mai puternic, cu atât densitatea lichidului este mai mare și cu atât masa molară a acestuia este mai mică. Pentru a determina coeficientul de tensiune superficială, puteți utiliza formula semi-empirică:
Aici B este un coeficient constant, aproape același pentru toate lichidele, Tc este temperatura critică, ρ este densitatea lichidului, μ este masa molară a acestuia, τ este o dimensiune mică a temperaturii. Formula (10-14) nu este aplicabilă în apropierea temperaturii critice. Coeficientul de tensiune superficială al soluțiilor apoase depinde de tipul de dizolvat. Unele substanțe, de exemplu, precum alcoolul, săpunul, praful de spălat, dizolvate în apă, având o densitate mai mică decât cea a apei, duc la scăderea coeficientului de tensiune superficială și se numesc surfactanți . Surfactanții sunt utilizați ca agenți de umectare, reactivi de flotație, agenți de spumă, dispersanți de duritate, plastifianți, modificatori de cristalizare etc. O creștere a concentrației unor astfel de substanțe duce la o scădere a coeficientului de tensiune superficială. Alte substanțe dizolvate în apă, precum zahărul, sarea, duc la creșterea densității soluției și la creșterea coeficientului de tensiune superficială. O creștere a concentrației unor astfel de substanțe duce la o creștere a coeficientului de tensiune superficială. Pentru determinarea experimentală a coeficienților de tensiune superficială se folosesc mai multe metode de măsurare: metoda Rehbinder, metoda undelor capilare, metoda picăturii și bulelor etc.
Abur) în prezența curburii suprafeței. Un caz special al fenomenelor de suprafață.
În absența gravitației, un lichid de masă limitată sub influența tensiunii superficiale tinde să ocupe un volum cu o suprafață minimă, adică ia forma unei bile. Sub acțiunea gravitației, un lichid nu prea vâscos de masă suficientă ia forma unui vas în care este turnat, iar suprafața sa liberă cu o suprafață relativ mare (departe de pereții vasului) devine plată, deoarece rolul a tensiunii superficiale este mai puțin semnificativă decât cea a gravitației. Atunci când interacționează cu suprafața unui alt lichid sau solid (de exemplu, cu pereții unui vas), suprafața lichidului considerat este curbată în funcție de prezența sau absența umezării. Dacă are loc umezirea, adică moleculele lichidului 1 (Fig. 1) interacționează mai puternic cu moleculele de suprafață 3 decât cu moleculele altui lichid (sau gaz) 2, atunci sub influența diferenței de forțe de interacțiune intermoleculară, lichidul 1 se ridică de-a lungul peretelui vasului - fluidul de secțiune adiacent peretelui este îndoit. Presiunea cauzată de creșterea lichidului este echilibrată de presiunea capilară ∆p - diferența de presiune deasupra și sub interfața curbată. Valoarea presiunii capilare depinde de raza medie r a curburii suprafeței și este determinată de formula Laplace: ∆р = 2σ/r, unde σ este tensiunea superficială. Dacă interfața de fază este plată (r = ∞), atunci în condiții de echilibru mecanic al sistemului, presiunile de pe ambele părți ale interfeței sunt egale și ∆p = 0. În cazul unei suprafețe lichide concave (r< 0) давление в жидкости ниже, чем давление в граничащей с ней фазе и ∆р < 0; для выпуклой поверхности (r >0) ∆p > 0.
Dacă pereții vasului sunt apropiați unul de celălalt, zonele de curbură ale suprafeței lichidului formează un menisc - o suprafață complet curbată. Sistemul rezultat se numește capilar; în ea, în condiții de umezire, presiunea de sub menisc este scăzută și lichidul din capilar se ridică (peste nivelul suprafeței libere a lichidului din vas); greutatea unei coloane de lichid de înălțimea h echilibrează presiunea capilară ∆p. Un lichid neumeziv dintr-un capilar formează un menisc convex, presiunea deasupra căruia este mai mare, iar lichidul din acesta scade sub nivelul suprafeței libere din exteriorul capilarului. Înălțimea de ridicare (coborâre) a lichidului în capilar față de suprafața liberă (unde r = ∞ și ∆р = 0) este determinată de relația: h = 2σcosθ/∆pgr, unde θ este unghiul de contact ( unghiul dintre tangenta la suprafața meniscului și peretele capilar), ∆ p este diferența de densitate dintre lichidul 1 din capilar și mediul 2, g este accelerația de cădere liberă.
Curbura suprafeței afectează condițiile de echilibru dintre un lichid și vaporii săi saturati: conform ecuației Kelvin, presiunea vaporilor peste o picătură de lichid crește odată cu scăderea razei acesteia, ceea ce explică, de exemplu, creșterea picăturilor mari în nori datorită cei mici.
Fenomenele capilare caracteristice includ absorbția capilară, apariția și propagarea undelor capilare, mișcarea capilară a lichidului, condensarea capilară, procesele de evaporare și dizolvare în prezența unei suprafețe curbe. Absorbția capilară este caracterizată de o viteză care depinde de presiunea capilară și de vâscozitatea lichidului. Joacă un rol esențial în alimentarea cu apă a plantelor, în mișcarea apei în sol și în alte procese asociate cu mișcarea lichidelor în medii poroase. Impregnarea capilară este unul dintre procesele comune în tehnologia chimică. În sistemele cu pereți neparaleli (sau capilare de secțiune conică), curbura meniscului depinde de locația suprafețelor limită ale lichidului din ele, iar picătura de lichid de umectare din ele începe să se deplaseze spre menisc cu o rază mai mică (Fig. 2), adică în direcția în care presiunea este mai mică. Motivul mișcării capilare a unui lichid poate fi și diferența dintre forțele tensiunii superficiale din menisc, de exemplu, în prezența unui gradient de temperatură sau în adsorbția agenților tensioactivi care reduc tensiunea superficială.
 Condensarea capilară este procesul de condensare a aburului în capilare și microfisuri ale corpurilor poroase, precum și în spațiile dintre particulele solide sau corpurile apropiate. O condiție necesară pentru condensarea capilară este prezența umezirii suprafeței corpurilor (particulelor) cu un lichid de condensare. Procesul de condensare capilară este precedat de adsorbția moleculelor de vapori de către suprafața corpurilor și de formarea meniscurilor lichide. În condiții de umezire, forma meniscurilor este concavă și presiunea p vaporilor saturați deasupra acestora este mai mică decât presiunea vaporilor saturați p 0 în aceleași condiții pe o suprafață plană. Adică condensarea capilară are loc la presiuni mai mici decât p 0 .
Condensarea capilară este procesul de condensare a aburului în capilare și microfisuri ale corpurilor poroase, precum și în spațiile dintre particulele solide sau corpurile apropiate. O condiție necesară pentru condensarea capilară este prezența umezirii suprafeței corpurilor (particulelor) cu un lichid de condensare. Procesul de condensare capilară este precedat de adsorbția moleculelor de vapori de către suprafața corpurilor și de formarea meniscurilor lichide. În condiții de umezire, forma meniscurilor este concavă și presiunea p vaporilor saturați deasupra acestora este mai mică decât presiunea vaporilor saturați p 0 în aceleași condiții pe o suprafață plană. Adică condensarea capilară are loc la presiuni mai mici decât p 0 .
Curbura suprafeței lichidului poate afecta în mod semnificativ procesele de evaporare, fierbere, dizolvare, nucleare în timpul condensării vaporilor și cristalizării. Astfel, proprietățile sistemelor care conțin un număr mare de picături sau bule de gaz (emulsii, aerosoli, spume) și formarea acestora sunt în mare măsură determinate de fenomene capilare. De asemenea, ele stau la baza multor procese tehnologice: flotarea, sinterizarea pulberilor, deplasarea uleiului din rezervoare prin soluții apoase de surfactanți, separarea prin adsorbție și purificarea amestecurilor de gaze și lichide etc.
Fenomenele capilare au fost studiate pentru prima dată de Leonardo da Vinci. O observare sistematică și descriere a fenomenelor capilare în tuburi subțiri și între plăci de sticlă plane, apropiate distanțe, a fost efectuată în 1709 de F. Hawkesby, un demonstrant al Societății Regale din Londra. Bazele teoriei fenomenelor capilare au fost puse în lucrările lui T. Young, P. Laplace, iar considerația lor termodinamică a fost realizată de J. Gibbs (1876).
Lit.: Adamson A. Physical chemistry of surfaces. M., 1979; Rawlinson J., Widom B. Teoria moleculară a capilarității. M., 1986.
A. M. Emelianenko, N.V. Churaev.
FENOMENE CAPILARE- un ansamblu de fenomene cauzate de actiunea tensiunii superficiale interfaciale la interfata mediilor nemiscibile; la K. i. de obicei includ fenomene în lichide cauzate de curbura suprafeței lor, învecinate cu un alt lichid, gaz sau propriu-zis. BAC. K. Ya. este un caz special de fenomene de suprafață. În absența unui lichid, suprafața este întotdeauna curbată. Sub influență, un volum limitat de lichid tinde să ia forma unei mingi, adică să ocupe un volum cu min. suprafaţă. Forțele gravitaționale schimbă semnificativ imaginea. Un lichid cu o vâscozitate relativ scăzută ia rapid forma unui vas, în care este turnat, și suprafața sa liberă (nu adiacentă pereților vasului) în cazul unor mase suficient de mari de lichid și o suprafață mare de suprafața liberă este practic plană. Cu toate acestea, pe măsură ce masa lichidului scade, rolul tensiunii superficiale devine mai semnificativ decât forța gravitațională. Deci, de exemplu, la zdrobirea unui lichid într-un gaz (sau a unui gaz într-un lichid), se formează picături (bule) sferice. forme. Proprietățile sistemelor care conțin un număr mare de picături sau bule (emulsii, aerosoli lichizi, spume) și condițiile de formare a acestora sunt în mare măsură determinate de curbura suprafeței acestor formațiuni, adică K. I. Marele rol al lui K. I. Ele joacă, de asemenea, în nucleare în timpul condensării vaporilor, fierberii lichidului și cristalizării. Curbura suprafeței unui lichid poate apărea și ca urmare a interacțiunii acestuia cu suprafața altui lichid sau solid. În acest caz, prezența sau absența umezire lichid pe această suprafață. Dacă are loc, adică moleculele lichidului 1 (Fig. 1) interacționează mai puternic cu suprafața unui corp solid 3 decât cu moleculele altui lichid (sau gaz) 2, atunci sub influența diferenței de forțele de interacțiune intermoleculară, lichidul se ridică de-a lungul peretelui vasului și adiacent unui corp solid, o secțiune a suprafeței lichidului va fi curbată. Hidrostatic presiunea cauzată de creșterea nivelului lichidului este echilibrată presiunea capilară- diferența de presiune deasupra și sub suprafața curbată, a cărei valoare este legată de curbura locală a suprafeței lichidului. Dacă aduceți pereții plani ai vasului mai aproape de lichid, atunci zonele de curbură se vor suprapune și se formează un menisc - o suprafață complet curbată. Într-un astfel de capilar, în condiții de umezire sub un menisc concav, presiunea este scăzută, lichidul crește; greutatea coloanei de lichid. h 0 echilibrează presiunea capilară Dр. In echilibru
Tensiunea superficială este relativ ușor de determinat experimental. Există diferite metode pentru determinarea tensiunii superficiale, care sunt împărțite în statice, semi-statice și dinamice. Metodele statice se bazează pe fenomene capilare asociate cu curbura interfeței.
Odată cu apariția curburii suprafeței între faze, presiunea internă a corpului se modifică și apare o presiune suplimentară (capilară) Laplace. R, care poate crește sau scădea presiunea internă caracteristică unei suprafețe plane. Această presiune suplimentară poate fi reprezentată ca rezultanta forțelor de tensiune superficială direcționate către centrul de curbură perpendicular pe suprafață. Curbura poate fi pozitivă sau negativă (Fig. 2.2).
Orez. 2.2. Schema de formare a presiunii suplimentare pentru o suprafață cu pozitiv (a) și negativ (b) curbură
O modificare a volumului unui lichid are loc ca urmare a unei scăderi spontane a energiei de suprafață și a conversiei acesteia în energie mecanică a unei modificări a volumului corpului. În acest caz, în ecuația (2.2) pentru energia Helmholtz la constante T, n, q trebuie luate în considerare doar doi termeni. dF=-pdV+ods. La echilibru dF = 0, deci pdv=ods. În această expresie p = P- presiune suplimentară (presiunea Laplace), egală cu diferența de presiune dintre presiunea unui corp cu suprafețe plane și curbate (AR): ![]()
Raportul se numește curbura suprafeței.
Pentru o suprafață sferică. Înlocuind această expresie
în ecuația pentru presiune suplimentară, obținem ecuația Laplace:
in care G- raza de curbură; - curbură sau dispersie (Fig. 2.3).
Dacă suprafața are o formă neregulată, se utilizează conceptul de curbură medie și este ecuația lui Laplace

unde Gr / * 2 - razele principale de curbură.

Orez. 2.3. Creșterea capilară a lichidului în timpul umezirii (a) și neumezirii (O) pereții capilari
Pentru tensiunea superficială, ecuația Laplace poate fi rescrisă sub forma care arată proporționalitatea suprafeței
raza de tensiune a capilarului G si presiune R, la care o bulă de gaz iese dintr-un capilar scufundat într-un lichid. Pe această proporționalitate se bazează metoda de determinare experimentală a tensiunii superficiale a lui Rehbinder.
Metoda Rehbinder măsoară presiunea la care o bula de gaz iese dintr-un capilar care este coborât de un lichid. În momentul în care bula sare, presiunea măsurată va fi egală cu presiunea capilară, cu raza de curbură a suprafeței - cu raza capilarului. Este practic imposibil să se măsoare raza capilară în experiment, prin urmare, se efectuează măsurători relative: presiunea este determinată într-o bula de gaz care sare printr-un lichid cu o tensiune superficială cunoscută (acest lichid se numește standard), apoi presiune Rîntr-o bulă de gaz care sare printr-un lichid cu o tensiune superficială determinată. Apa distilată este de obicei folosită ca lichid standard, iar bidistilatul este utilizat pentru măsurători precise.
Raportul dintre tensiunea superficială a unui lichid standard și presiunea dintr-o bula care sare prin el se numește constantă
capilar. Cu o valoare cunoscută a tensiunii superficiale
(t 0 și presiunile măsurate și R pentru lichidul standard și investigat, tensiunea superficială a acestuia din urmă este determinată de formula principală de calcul a acestei metode:
Dacă valoarea este cunoscută cu precizie ridicată, atunci valoarea tensiunii superficiale a lichidului care se determină va fi, de asemenea, exactă. Metoda Rehbinder oferă o precizie de determinare a tensiunii superficiale de până la 0,01 mJ/m 2 .
Când se utilizează metoda de ridicare, se măsoară înălțimea creșterii (sau scăderii) lichidului în capilar și se compară cc cu înălțimea creșterii unui lichid standard a cărui tensiune superficială este cunoscută (Fig. 2.4).

Orez. 2.4.
Motivul creșterii capilare este că lichidul, umezind pereții capilarului, formează o anumită curbură a suprafeței, iar presiunea Laplace capilară rezultată ridică lichidul din capilar până când greutatea coloanei de lichid echilibrează forța care acționează. Creșterea lichidului în capilar se observă atunci când curbura suprafeței lichidului este negativă. Cu un menisc concav, presiunea Laplace tinde să întindă lichidul și să-l ridice, o astfel de creștere capilară se numește pozitivă, este tipic pentru lichidele care udă pereții capilarului (de exemplu, în sistemul de apă-sticlă). În schimb, dacă curbura suprafeței este pozitivă (un menisc convex), atunci presiunea suplimentară tinde să comprime lichidul și se observă scăderea acestuia în capilar, care se numește creștere capilară negativă. Un fenomen similar este tipic pentru cazurile în care pereții capilarului nu sunt umeziți cu lichid (de exemplu, în sistemul sticlă-mercur).
Judecând după Fig. 2.4. umezirea afectează geometria suprafeței și dacă r este raza de curbură, atunci raza capilarului însuși R legat de acesta prin relație
![]()
Unde V- unghi de contact de umectare (acut, cu condiția ca pereții capilarului să fie umeziți cu lichid). Din ultima relaţie rezultă că
Înlocuind această relație în ecuația (2.4), obținem 
Dacă luăm în considerare că presiunea coloanei de lichid din ecuație pdv=ods legat de înălțimea acestuia mgh = V(p-p^)gh, puteți obține raportul  și apoi formula Jurin:
și apoi formula Jurin:

Unde h- înălțimea creșterii lichidului în capilar; R este densitatea lichidului; ps este densitatea vaporilor săi saturati; g- accelerarea gravitației.
Cu condiția ca densitatea lichidului Rși densitatea sa de vapori saturați ps incomparabil (R » p s) pentru tensiunea superficială, putem scrie

Într-o formulă mai simplificată, se presupune, de asemenea, că pereții vasului sunt complet umeziți de lichid (cos V = 1):
^ _ 2(7
gR(p-Ps)"
În utilizarea practică a metodei, calculul tensiunii superficiale se efectuează conform formulei

unde si h- înălțimea de ridicare a capilarului lichidelor standard și de testare; p^u p- densitatea lor.
Această metodă poate fi utilizată ca o metodă exactă furnizată cos în - const, mai bine V= 0°, ceea ce este acceptabil pentru multe lichide fără condiții suplimentare. În experiment, este necesar să se utilizeze capilare subțiri care sunt bine umezite de lichid. Metoda creșterii capilare poate oferi, de asemenea, o precizie ridicată în determinarea tensiunii superficiale, până la 0,01-0,1 mJ/m