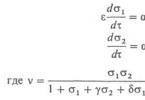unde a n , b n sunt coeficienții de expansiune ai funcției c(t) în rad (amplitudini ale componentelor armonice individuale), A n sunt amplitudini complexe, w - frecvența de oscilație (i - unitate imaginară). În cazul general, amplitudinile și frecvențele oscilațiilor se pot modifica în timp (oscilații decăzute, în creștere, modulate). fluctuații între ele. conn. pot fi neperiodice sau au un spectru continuu.
fluctuații între ele. conn. - un fenomen relativ rar observat în cursul unor p-țiuni complexe. Chimie elementară. districtele sunt relaxate. procese care asigură o aproximare monotonă a sistemului de reacţie la starea termodinamică. . Pentru apariția oscilațiilor în timpul omog. izotermic r-ţia trebuie să aibă un interval. conn. și interacțiunea dintre ele. În există stări staționare, în care c(i) al intervalului i. conn. nu depinde de timp (cu i =c 0 i). Pentru abateri mici ale sistemului de la starea staționară, modificarea în c i este descrisă de suma exponențialelor cu indicatori complecși:
Valorile l i = g i + i w am sunat caracteristică numere. În neclintit. sisteme durabile l sunt negativ si real ( gi<0,
w
i=0). În aceste cazuri, de obicei în loc de l folosesc ori t i = 1/l eu . Dacă starea staționară este suficient de apropiată de starea termodinamică. (relațiile de reciprocitate Onsager sunt valabile, vezi), apoi toate l sunt real și negativ (). În acest caz, sistemul se apropie de starea staționară fără oscilații. În sistemele puternic dezechilibrate l i pot deveni numere complexe, ceea ce corespunde apariției oscilațiilor în apropierea stării staționare. La anumite valori ale parametrilor unui sistem puternic dezechilibrat (inițial, t-ry etc.), starea staționară poate pierde stabilitatea. Pierderea stabilității stării staționare este un caz special de bifurcare, adică. se modifică la o anumită valoare (de bifurcaţie) a c.-l. număr sau tip parametru dif. cinetică moduri ale sistemului. Există două cazuri cele mai simple de bifurcare a unei stări staționare stabile. În primul caz, unul l devin pozitiv. În același timp, în punctul de bifurcare ( l i = 0) starea inițial stabilă devine instabilă sau se contopește cu starea staționară instabilă și dispare, iar sistemul trece într-o nouă stare stabilă. În spațiul parametrilor, în vecinătatea acestei bifurcări, există o regiune în care sistemul are cel puțin trei stări staționare, dintre care două sunt stabile și una instabilă. Funcționează în al doilea caz. parte a unei caracteristici complexe. numerele devin pozitive. În acest caz, oscilații stabile apar în vecinătatea stării staționare care și-a pierdut stabilitatea. După trecerea punctului de bifurcație, cu o modificare ulterioară a parametrului mărimii, caracteristicile oscilațiilor (frecvență, amplitudine etc.) se pot schimba foarte mult, dar calitățile. se păstrează tipul de comportament al sistemului. În chimie. sistemele de instabilitate pot apărea ca urmare a accelerării districtului de către produsele sale sau alte specii, substrat sau inhibiție încrucișată (vezi), competiția in-in-ului inițial pentru interval. conn. și așa mai departe. În non-izotermă sistemelor, cauza instabilității poate fi autoaccelerarea exotermă. etape ale raionului, iar în electrochimic. p-ții dependență exponențială a vitezei p-ției din . Apariția celor mai simple instabilități și cinetica corespunzătoare. este convenabil să explicăm stările sistemului folosind exemplul unei p-țiuni enzimatice cu două
S 1 şi S 2, dintre care unul, de exemplu. S 1 inhibă E:
S 01 D S 1 S 02 D S 2 S 1 +E 1 D S 1 E S 1 E+S 2 D S 1 E :
P S 1 E+S 1 D S 1 S 1 E
S 1 și S 2 pot pătrunde în sistem din exterior (de exemplu, datorită fluxului într-un reactor de curgere sau prin intermediul) sau se pot forma ca urmare a homogării lente. p-tions S 0i D Si (i=1,2); are loc şi eliminarea produsului P, care nu afectează cursul raionului. S 1 E, S 1 S 2 E şi S 1 S 1 E - complexe enzimă-substrat; apare din cauza formării unui complex inactiv S 1 S 1 E. În acest sistem sunt 6 dinamice. variabile: și , [E] și decomp. forme de complexe enzimă-substrat și [E] + ++=e - completă. De obicei e<< и e<<, поэтому можно применить и представить фермент-субстратных комплексов как алгебраич. ф-ции . В результате поведение системы можно описать двумя дифференц. ур-ниями относительно и . Удобно использовать безразмерные переменные
s 1 =/K 1 și s 2 =/K 2 (K 1 și K 2 - Michaelis), parametri a 1 si a 2 - rate de sosire, precum și combinații adimensionale de etape elementare e, b, g, d, ( și timp fără dimensiune t . Apoi dif. ur-niya ia forma:

Să luăm în considerare cazul în care acest sistem are două stări staționare stabile - un sistem bistabil sau un declanșator. Dacă a 2 >> a 1 / e , adică viteza p-tion S 02 D S 2 este foarte mare în comparație cu viteza p-tionului S 01 D S 1 și rata de p-tion enzimatică, atunci este constantă și egală cu . În acest caz, comportamentul sistemului este descris de o singură ecuație (3.1). Dependente d s l /d t de la s 1 la valori diferite A 1 sunt prezentate în fig. 1, a. Curbele punctate corespund bifurcațiilor. valorile parametrilor a-a" 1 și a : 1 , iar curbele cuprinse între ele intersectează axa x de trei ori. Punctele de intersecție corespund stărilor staționare s 1 01 , s 1 02 și s 1 03 , a căror medie s 1 02 este instabil și separă regiunile de atracție ale stărilor stabile s 1 01 
Orez. 1. Sistem enzimatic cu trei stări staționare (declanșator biochimic): A dependența de viteză d s 1 /d t modificarea adimensionalului S 1 , din valoarea sa ( s 1 ) la dif. viteze ( a 1 ) chitanțe ; linia punctată indică curbele corespunzătoare bifurcațiilor. valorile un „1 și un „” 1; 6 - dependenţa valorilor staţionare s 0 1 de la a 1 ; s 1 01 și s 1 0 3 sunt stabile, s 1 0 2 - stări staționare instabile.
și s 1 0 3 . Pe curba de dependență a staționarului s 1 0 de la un 1 (Fig. 1, b) regiunea cu trei stări staționare se află în intervalul ( a " 1 , a "" 1). Cu schimbare lentă înainte și înapoi a parametrului a 1 sistemul se deplasează de-a lungul diferitelor traiectorii, adică histerezis. Trebuie remarcat faptul că bistabilitatea descrisă poate fi obținută într-un sistem cu o p-țiune cu un singur substrat, care se comportă similar cu o p-țiune cu două substraturi cu un fix. unul dintre .
Pentru ca un sistem cu o variabilă și bistabilitate să devină oscilator, este necesar să se transforme parametrul într-o variabilă lentă. Într-un sistem enzimatic cu doi astfel de parametri, desigur, este al doilea s 2. În acest caz, ambele ecuații (3) trebuie folosite pentru a descrie sistemul. Modificări relative S 2 ( D /) va fi lent în comparație cu modificările relative în S l dacă >>. La trecerea la parametrii adimensionali, această condiție ia următoarea formă: a 1 ~ a 2 ~ 1, e <<1. На фазовой плоскости с координатами
s1,s 2 comportamentul sistemului este determinat calitativ de aranjarea reciprocă a curbelor zero-izoclinice, pe care derivatele d s 1 /d t și d s 2 / d t sunt egale cu 0 (Fig. 2, a). Punctele de intersecție zero-izoclinice corespund stărilor staționare ale sistemului. Linia punctată arată poziția izoclinei nule d s 1 /d t =0 la o bifurcație însoțită de apariția unor oscilații stabile (autooscilații) de amplitudine mică. Aceste oscilații corespund unei traiectorii închise a sistemului - așa-numita. ciclu limită. Liniile continue arată izocline nule într-o situație departe de bifurcare, când singura stare staționară a sistemului (punctul O din Fig. 2, a) este foarte instabilă și este înconjurată de ciclul limită ABCD. Mișcarea sistemului de-a lungul acestui ciclu limită corespunde auto-oscilațiilor s 1 și s 2 cu o amplitudine mare (vezi Fig. 2, b).

Orez. 2. Auto-oscilații (oscilații stabile) într-un sistem enzimatic model: plan de fază a în coordonate s 1 - s 2 cu izocline nule d s 1 /d t \u003d 0, d s 2 /d t =0; linia punctată arată poziţia izoclinei nule d s 1 /d t =0, corespunzătoare fluctuațiilor. bifurcații și un ciclu limită mic care înconjoară starea staționară instabilă O, ABCD un ciclu limită mare; b - autooscilații s 1 și s 2 corespunzător ciclului limită mare ABCD.
În timpul oscilatorii observate periodice. fluctuații dif. forme: sinusoidal, dinți de ferăstrău, dreptunghiular etc.; modulat, cvasi-periodic și stocastic. Perioadele majorității celor oscilatorii se află în intervalul de la fracțiuni de secundă la zeci de minute. Oscilaţiile în fază lichidă includ, de exemplu, H2O2 şi S2O42-, decomp. compuși halogen-oxigen in-in și. Belousov-Zhabotinsky este bine studiat, mergând într-o soluție apoasă, în care HBrO 3 oxidează degradarea cu o variabilă. org. comp., în special acid malonic.
Cele oscilatorii în fază gazoasă au fost descoperite și studiate pentru , CO și alți compuși. În toate cazurile, atât etapele vrac ale p-tion-ului, cât și ruperea și nuclearea lanțurilor pe pereții reactorului, precum și accelerarea p-tion-ului datorită încălzirii sistemului ca urmare a
exotermic etape (termice). Posibil pur termocinetic. autooscilații, când termică este unitatea, cauza instabilității. Cel mai simplu model de termocinetică oscilațiile din reactorul de curgere au forma: В 0:
ÎN :
P + Q. Aici, in-in B intră în reactorul cu flux ideal, unde are loc o exotermă monomoleculară. p-ţiune de dezintegrare; căldura degajată este îndepărtată prin peretele reactorului. Cinetica acestui district este descrisă de două diferențiale. ur-niami în raport cu B și t-ry T în interiorul reactorului:

unde [B 0 ] - dat la intrarea în reactor, T 0 - t-ra peretelui reactorului, k - coeficient. rata de actualizare a reacțiilor amestec în reactor, h - coeficient. viteza, Q - efectul termic al p-ției, C p - la o constantă, r - densitate, E și A -
Reacții chimice vibraționale
În această lucrare de termen, voi lua în considerare un caz special al unui experiment problematic, reacțiile chimice oscilatorii. Reacțiile oscilatorii reprezintă o întreagă clasă de reacții de oxidare a substanțelor organice cu participarea unui catalizator cu proprietăți redox. Acest proces se desfășoară ciclic, adică constă din mai multe repetări.
Reacțiile chimice vibraționale au fost descoperite și fundamentate științific în 1951 de omul de știință sovietic Boris Petrovici Belousov. B.P. Belousov a studiat oxidarea acidului citric în timpul reacției sale cu bromatul de sodiu într-o soluție de acid sulfuric. Pentru a îmbunătăți reacția, a adăugat sare de ceriu în soluție. Ceriul este un metal cu valență variabilă (3+ sau 4+), deci poate fi un catalizator pentru transformările redox. Reacția este însoțită de eliberarea de bule de CO 2 și de aceea se pare că întregul amestec de reacție „fierbe”. Și pe fundalul acestei fierberi, B.P. Belousov a observat un lucru uimitor: culoarea soluției s-a schimbat periodic - a devenit fie galbenă, fie incoloră. Belousov a adăugat un complex de fenantrolină cu fier feros (feroină) la soluție, iar culoarea soluției a început să se schimbe periodic de la roșu-violet la albastru și înapoi.
Astfel a fost descoperită reacția care a devenit celebră. Acum este cunoscut în întreaga lume, se numește reacția Belousov-Zhabotinsky. A. M. Zhabotinsky a făcut multe pentru a înțelege acest fenomen uimitor. De atunci, au fost descoperite un număr mare de reacții similare.
Istoria descoperirii reacțiilor oscilatorii.
IP Belousov a făcut descoperirea unei reacții chimice oscilatorii în încercarea de a crea un model chimic simplu al unor etape ale sistemului de transformări biochimice cheie ale acizilor carboxilici dintr-o celulă. Cu toate acestea, primul raport al descoperirii sale nu a fost publicat. Revizorul unui jurnal de chimie s-a îndoit de posibilitatea fundamentală a reacției descrise în articol. Majoritatea chimiștilor din acei ani credeau că nu există oscilații pur chimice, deși existența reacțiilor oscilatorii a fost prezisă în 1910 de A. Lotkoy pe baza teoriei matematice a proceselor periodice.
A doua încercare de a publica rezultatele studiului a fost făcută de om de știință în 1957 și din nou a fost refuzată, în ciuda muncii fizicianului și fizicochimistului belgian I. R. Prigozhin care a apărut la acea vreme. În aceste lucrări s-a arătat posibilitatea și probabilitatea reacțiilor chimice oscilatorii.
Abia în 1959 a fost publicat un scurt rezumat despre descoperirea de către B.P. Belousov a unei reacții chimice oscilatorii care acționează periodic în publicația puțin cunoscută „Collection of Abstracts on Radiation Medicine”.
Și lucrul este că atunci când B.P. Belousov și-a făcut descoperirea, modificările periodice ale concentrației de reactivi păreau a fi o încălcare a legilor termodinamicii. Într-adevăr, cum poate o reacție să meargă fie în direcția înainte, fie în direcția opusă? Este imposibil de imaginat că întregul număr imens de molecule din vas a fost într-o stare, apoi într-o altă stare (fie toate „albastre”, apoi toate „roșii” ...).
Direcția reacției este determinată de potențialul chimic (termodinamic) - reacțiile se desfășoară în direcția stărilor mai probabile, în direcția reducerii energiei libere a sistemului. Când o reacție într-o direcție dată este finalizată, înseamnă că potențialul ei a fost epuizat, se atinge echilibrul termodinamic, iar fără cheltuirea de energie, în mod spontan, procesul nu poate merge în direcția opusă. Și apoi... reacția merge într-o direcție sau în alta.
Cu toate acestea, nu a existat nicio încălcare a legilor în această reacție. Au existat fluctuații - modificări periodice - în concentrațiile intermediarilor, și nu reactanții inițiali sau produșii finali. CO 2 nu se transformă în acid citric în această reacție, acest lucru este de fapt imposibil. Recenziatorii nu au ținut cont de faptul că, deși sistemul este departe de echilibru, în el se pot întâmpla multe lucruri minunate. Traiectoriile detaliate ale unui sistem de la starea sa inițială până la starea sa finală pot fi foarte complexe. Abia în ultimele decenii termodinamica sistemelor departe de echilibru a început să se ocupe de aceste probleme. Această nouă știință a devenit baza unei noi științe - sinergetica (teoria auto-organizării).
Reacția lui Belousov, așa cum sa menționat mai sus, a fost studiată în detaliu de A. M. Zhabotinsky și colegii săi. Au înlocuit acidul citric cu acid malonic. Oxidarea acidului malonic nu este însoțită de formarea de bule de CO 2, astfel încât modificarea culorii soluției poate fi înregistrată fără interferențe de către dispozitivele fotoelectrice. Mai târziu s-a dovedit că feroina fără ceriu servește ca catalizator pentru această reacție. B. P. Belousov a observat deja în primele experimente o altă proprietate remarcabilă a reacției sale: atunci când agitarea este oprită, schimbarea culorii soluției se propagă în valuri. Această propagare a vibrațiilor chimice în spațiu a devenit deosebit de evidentă când, în 1970, A. M. Zhabotinsky și A. N. Zaikin au turnat un strat subțire de amestec de reacție într-o cutie Petri. În cupă se formează figuri bizare - cercuri concentrice, spirale, „vârtejuri” care se propagă cu o viteză de aproximativ 1 mm/min. Undele chimice au o serie de proprietăți neobișnuite. Deci, atunci când se ciocnesc, se sting și nu pot trece unul prin celălalt.
Ministerul Educației, Științei, Tineretului și Sportului
Liceul Teoretic Petru Movilă
Scaun
„Abilitate, muncă, talent”
Cursuri de chimie pe tema:
„Reacții chimice vibraționale”
Completat de: elev de clasa 12A
Bolyubash Irina
Lector: Snidchenko M.A.
* Chișinău, 2007 *
1. Introducere:
a) Reacții redox
b) Reacții chimice vibraționale
2. Istoria descoperirii reacțiilor oscilatorii:
a) Studii ale fluctuațiilor concentrației înainte de descoperire
reacţiile lui B. P. Belousov
3. Partea teoretică:
a) Model matematic de A. Lotka
b) Studiul mecanismului reacţiilor oscilatorii
4. Partea experimentală
5. Concluzie
6. Aplicație:
a) Reţete pentru unele reacţii oscilatorii
b) Ilustrații pentru experimentele efectuate
7. Literatură
Introducere.
Chimia este o știință experimentală. Prin urmare, experimentul ca metodă de cercetare științifică a ocupat de mult timp ferm un loc de frunte între metodele științelor naturale. Experimentul este cel mai important mod de a conecta teoria cu practica în predarea chimiei, transformând cunoștințele în convingeri. Prin urmare, dezvăluirea semnificației cognitive a fiecărei experiențe este principala cerință pentru un experiment chimic.
În experiment (otlat. "experiment" - "proces")înțelegeți observarea fenomenului studiat în anumite condiții, permițându-vă să urmăriți cursul acestui fenomen și să îl repetați în aceste condiții. Experimentul chimic ocupă un loc important în predarea chimiei, deoarece prin observații și experimente se cunoaște diversitatea naturii substanțelor, se acumulează fapte pentru comparații, generalizări și concluzii.
Efectuând experimente și observând transformări chimice în diferite condiții, suntem convinși că procesele chimice complexe pot fi controlate, că nu există nimic misterios în fenomene, ele se supun legilor naturale, a căror cunoaștere face posibilă utilizarea pe scară largă a transformărilor chimice în activitatea umană practică. .
Cu toate acestea, rezultatele unor experimente chimice sunt neașteptate și nu se încadrează în ideile tradiționale despre proprietățile substanțelor sau modelele reacțiilor chimice. Astfel de transformări chimice au fost numite experimente problematice.
Chiar și pe vremea antichității, filozofii credeau că orice cunoaștere începe cu surprinderea. Surpriza provocată de nou duce la dezvoltarea curiozității (sensibilitatea la problemele din lumea înconjurătoare) cu formarea ulterioară a unui interes stabil pentru ceva. Surpriza și, în urma acesteia, dorința de cunoaștere - acesta este un teren fertil pentru studierea experimentului cu probleme, formarea gândirii dialectice și sistemice și dezvăluirea potențialului creativ.
Aceeași stare poate fi cauzată de un experiment chimic luminos, impresionant (experiment cu probleme). În chimie, cauzele experimentelor problematice, cel mai adesea, sunt reacțiile redox.
Reacții redox
Există numeroase criterii pentru clasificarea reacțiilor chimice. Unul dintre cele mai importante este un semn al unei schimbări în stările de oxidare ale elementelor. În funcție de schimbarea sau menținerea stărilor de oxidare ale elementelor, reacțiile chimice pot fi împărțite în reacții redox și cele care au loc fără modificarea stărilor de oxidare.
Reacțiile care apar cu modificarea stărilor de oxidare ale elementelor (redox) sunt larg cunoscute. Ele joacă un rol important în tehnologie și natură, stau la baza metabolismului în organismele vii, sunt asociate cu procesele de oxidare, putrefacție, fermentație și fotosinteză. Procesele de oxidare (și reducere) au loc în timpul arderii combustibilului, coroziunii metalelor, electrolizei, cu ajutorul lor, se obțin metale, amoniac, alcali și multe alte produse valoroase. Prin urmare, studiul reacțiilor redox este asigurat de cursurile școlare de chimie anorganică și organică.
Amintiți-vă principalele prevederi asociate conceptului de reacții redox.
Starea de oxidare corespunde încărcăturii care ar apărea pe un atom al unui element dat dintr-un compus chimic, presupunând că toate perechile de electroni prin care acest atom este conectat la alții sunt complet deplasate la atomii elementelor cu electronegativitate mai mare.
Oxidant- o substanță care conține atomi sau ioni care acceptă electroni: Xm (agent oxidant) + ne- = X(m-n) , unde m este starea de oxidare a elementului din substanța inițială, n este numărul de electroni.
Agent de reducere- o substanta ce contine atomi sau ioni care doneaza electroni: Ym (agent reducător) - ne-= Y(m+n) .
Oxidare- procesul de eliberare de electroni de către un atom, moleculă sau ion, în timp ce starea de oxidare a elementului crește.
Recuperare- procesul de primire a electronilor de către un atom, moleculă sau ion, în timp ce starea de oxidare a elementului scade.
Oxidarea și reducerea sunt procese conjugate, numărul de electroni dat de agentul reducător în procesul de oxidare a acestuia este întotdeauna egal cu numărul de electroni acceptați de agentul de oxidare în procesul de reducere a acestuia.
Reacții chimice vibraționale
În această lucrare de termen, voi lua în considerare un caz special al unui experiment problematic, reacțiile chimice oscilatorii. Reacțiile oscilatorii reprezintă o întreagă clasă de reacții de oxidare a substanțelor organice cu participarea unui catalizator cu proprietăți redox. Acest proces se desfășoară ciclic, adică constă din mai multe repetări.
Reacțiile chimice vibraționale au fost descoperite și fundamentate științific în 1951 de omul de știință sovietic Boris Petrovici Belousov. B.P. Belousov a studiat oxidarea acidului citric în timpul reacției sale cu bromatul de sodiu într-o soluție de acid sulfuric. Pentru a îmbunătăți reacția, a adăugat sare de ceriu în soluție. Ceriul este un metal cu valență variabilă (3+ sau 4+), deci poate fi un catalizator pentru transformările redox. Reacția este însoțită de eliberarea de bule de CO2 și, prin urmare, se pare că întregul amestec de reacție „fierbe”. Și pe fundalul acestei fierberi, B.P. Belousov a observat un lucru uimitor: culoarea soluției s-a schimbat periodic - a devenit fie galbenă, fie incoloră. Belousov a adăugat complexfenantrolină cu fier feros (feroină) la soluție, iar culoarea soluției a început să se schimbe periodic de la roșu-violet la albastru și înapoi.
Astfel a fost descoperită reacția care a devenit celebră. Acum este cunoscut în întreaga lume, se numește reacția Belousov-Zhabotinsky. A. M. Zhabotinsky a făcut multe pentru a înțelege acest fenomen uimitor. De atunci, au fost descoperite un număr mare de reacții similare.
Istoria descoperirii reacțiilor oscilatorii.
I. P. Belousov a făcut descoperirea unei reacții chimice oscilatorii în încercarea de a crea un model chimic simplu al unor etape ale sistemului de transformări biochimice cheie ale acizilor carboxilici dintr-o celulă. Cu toate acestea, primul raport al descoperirii sale nu a fost publicat. Revizorul unui jurnal de chimie s-a îndoit de posibilitatea fundamentală a reacției descrise în articol. Majoritatea chimiștilor din acei ani credeau că nu există oscilații pur chimice, deși existența reacțiilor oscilatorii a fost prezisă în 1910 de A. Lotkoy pe baza teoriei matematice a proceselor periodice.
A doua încercare de a publica rezultatele studiului a fost făcută de om de știință în 1957 și din nou a fost refuzată, în ciuda muncii fizicianului și fizicochimistului belgian I. R. Prigozhin care a apărut la acea vreme. Aceste lucrări au arătat posibilitatea și probabilitatea reacțiilor chimice oscilatorii.
Abia în 1959 a fost publicat un scurt rezumat despre descoperirea de către B. P. Belousov a unei reacții chimice oscilatorii care acționează periodic într-o ediție puțin cunoscută a Colecției de rezumate despre medicina radiațiilor.
Și lucrul este că atunci când B. P. Belousov și-a făcut descoperirea, modificările periodice ale concentrației de reactivi păreau a fi o încălcare a legilor termodinamicii. De fapt, cum poate o reacție să meargă fie în direcția înainte, fie în direcția opusă? Este imposibil să ne imaginăm că întregul număr imens de molecule din vas au fost într-o stare, apoi în alta (fie toate „albastre”, apoi toate "roșu" ...).
Direcția reacției este determinată de potențialul chimic (termodinamic) - reacțiile se desfășoară în direcția stărilor mai probabile, în direcția reducerii energiei libere a sistemului. Când reacția în această direcție este finalizată, înseamnă că potențialul său a fost epuizat, se atinge echilibrul termodinamic, iar fără cheltuirea de energie, în mod spontan, procesul nu poate merge în direcția opusă. Și apoi... reacția merge într-o direcție sau în alta.
Cu toate acestea, nu a existat nicio încălcare a legilor în această reacție. Au existat fluctuații - modificări periodice - în concentrațiile produselor intermediare, și nu a reactivilor inițiali sau a produselor finale. CO2 nu se transformă în acid citric în această reacție, acest lucru este de fapt imposibil. Recenziatorii nu au ținut cont de faptul că, deși sistemul este departe de echilibru, în el se pot întâmpla multe lucruri minunate.Traiectoriile detaliate ale sistemului de la starea inițială la starea finală pot fi foarte complexe. Abia în ultimele decenii termodinamica sistemelor departe de echilibru a început să se ocupe de aceste probleme. Această nouă știință a devenit baza unei noi științe - sinergetica (teoria auto-organizării).
Reacția lui Belousov, așa cum sa menționat mai sus, a fost studiată în detaliu de A. M. Zhabotinsky și colegii săi. Au înlocuit acidul citric cu acid malonic. Oxidarea acidului malonic nu este însoțită de formarea de bule de CO2; prin urmare, schimbarea culorii soluției poate fi înregistrată fără interferențe de către dispozitive fotoelectrice. Ulterior s-a dovedit că feroina, chiar și fără ceriu, servește ca catalizator pentru această reacție. B. P. Belousov a observat deja în primele experimente o altă proprietate remarcabilă a reacției sale: atunci când agitarea este oprită, schimbarea culorii soluției se propagă în valuri. Această distribuție a vibrațiilor chimice în spațiu a devenit deosebit de evidentă atunci când, în 1970, A. M. Zhabotinsky și A. N. Zaikin a turnat amestecul de reacție într-un strat subțire într-o cutie Petri. În cupă se formează figuri bizare - cercuri concentrice, spirale, „vârtejuri” care se propagă cu o viteză de aproximativ 1 mm/min. Undele chimice au o serie de proprietăți neobișnuite. Deci, atunci când se ciocnesc, se sting și nu pot trece unul prin celălalt.
Studii de concentrare
oscilaţii înainte de descoperirea reacţiei de către B. P. Belousov
Dar după cum spune povestea, descoperirea lui B.P. Belousov nu a fost nicidecum prima în știința mondială. S-a dovedit că una dintre primele publicații despre vibrațiile chimice datează din 1828. În ea, T. Fechner a conturat rezultatele unui studiu al oscilațiilor unei reacții electrochimice.în întuneric emite lumină destul de intensă. Nu a fost nimic surprinzător în însuși faptul că strălucirea fosforului, dar faptul că această strălucire se repeta în mod regulat la fiecare a șaptea secundă a fost interesant. Patruzeci de ani mai târziu, aceste experimente cu „balonul pâlpâit” au fost continuate de francezul M. Joubert (1874). A reușit să observe formarea periodică a „norilor luminoși” într-o eprubetă. Douăzeci de ani mai târziu, omul de știință german A. Tsentnershwer a studiat și efectul presiunii aerului asupra fulgerelor periodice de fosfor. În experimentele sale, perioada de flash a început la 20 s și a scăzut odată cu scăderea presiunii.
O pagină deosebit de strălucitoare din istoria vibrațiilor chimice este asociată cu așa-numitele inele Liesegang. În 1896, chimistul german R. Liesegang, experimentând cu fotochimice, a descoperit că dacă lapisul este scăpat pe o placă de sticlă acoperită cu gelatină care conține un vârf de crom, produsul de reacție, precipitând, este situat pe placă în cercuri concentrice. Liesegang a devenit fascinat de acest fenomen și l-a studiat timp de aproape jumătate de secol. A găsit și aplicații practice. În arta aplicată, inelele lui Liesegang au fost folosite pentru a decora diverse produse cu imitație de jasp, malachit, agat etc. Liesegang însuși a propus o tehnologie de fabricare a perlelor artificiale.
Lista de astfel de exemple poate fi continuată. În urma celor de mai sus, s-au descoperit reacții oscilatorii la interfața dintre două faze. Dintre acestea, cele mai cunoscute sunt reacțiile de la interfața metal-soluție, care au primit denumiri specifice - „nerv de fier” și „inima de mercur”. Prima dintre ele - reacția de dizolvare a fierului (sârmă) în acid azotic - și-a primit numele datorită asemănării externe cu dinamica unui nerv excitat, observată de V.F. Ostwald. A doua, sau mai degrabă una dintre variantele sale, este reacția de descompunere a H2O2 pe suprafața mercurului metalic. În reacție, are loc formarea și dizolvarea periodică a unei pelicule de oxid pe suprafața de mercur. Fluctuațiile tensiunii superficiale a mercurului provoacă pulsații ritmice ale picăturii, asemănătoare bătăilor inimii. Dar toate aceste reacții nu au atras prea multă atenția chimiștilor, deoarece ideile despre cursul unei reacții chimice erau încă destul de vagi.
Abia în a doua jumătate a secolului al XIX-lea. a apărut termodinamica și cinetica chimică, care au pus bazele unui interes specific pentru reacțiile vibraționale și metodele de analiză a acestora.
Model matematic de A. Lotkoy
Teoria matematică a oscilațiilor în sisteme similare reacțiilor chimice a fost publicată încă din 1910 de A. Lotka - el a scris un sistem de ecuații diferențiale, din care a urmat posibilitatea unor regimuri periodice. Lotka a luat în considerare interacțiunea dintre „pradă”, de exemplu, erbivorele și „prădătorii” care le mănâncă (X și Y). Prădătorii mănâncă pradă și se reproduc - concentrația de Y crește, dar până la o anumită limită, când numărul de pradă scade brusc și prădătorii mor de foame, concentrația de Y scade. Apoi victimele supraviețuitoare încep să se înmulțească - concentrația de X crește. Prădătorii supraviețuitori după aceasta se înmulțesc și ei, concentrația de Y crește din nou și așa mai departe de multe ori. Se observă fluctuații periodice ale concentrației de reactivi. Este clar că condiția pentru astfel de fluctuații neamortizate (de mult timp) este abundența de iarbă - hrana victimelor. Ecuațiile lui Lotka au fost îmbunătățite de V. Volterra. Și teoria modernă a oscilațiilor a fost dezvoltată de fizicienii ruși L. I. Mandelstamm, A. A. Andronov, A. A. Witt, S. E. Khaikin, D. A. Frank-Kamenetsky. Deci, pentru fizicieni și matematicieni, descoperirea lui Belousovane a fost atât de uimitoare.
Studiul mecanismului reacțiilor oscilatorii.
Mecanismul detaliat al reacției Belousov nu este încă pe deplin cunoscut. În primele lucrări, se părea că numărul de produse intermediare era mic. Pentru a explica natura vibrațiilor, a fost suficient să ne imaginăm cum se formează mai întâi acidul bromomalonic din acidul ismalonic, iar în reacția ulterioară, KBrO3 este transformat în KBr. Anionul Br-- inhibă oxidarea ulterioară a acidului bromomalonic, iar forma oxidată a catalizatorului (ceriu cvadrivalent sau fier feric în combinație cu fenantrolina) se acumulează. Ca urmare, acumularea de Br-- se oprește, iar oxidarea acidului bromomalonic se reia... Acum este clar că un astfel de mecanism este departe de a fi complet. Numărul de produse intermediare a ajuns la patruzeci, iar studiul continuă.
În 1972, R. Noyes și colegii săi au arătat că reacția Belousov-Zhabotinsky este rezultatul a cel puțin zece reacții care pot fi combinate în trei grupuri - A, B și C.
Mai întâi (grupul de reacție A), ionul bromat interacționează cu ionul bromur în prezența H + pentru a forma acizi bromși și hipobromici:
BrO-3+ Br-- + 2H+ = HBrO2 + HOBr (A1)
acid hipobromic:
HBrO2+ Br-- + H+ = 2HOBr (A2)
Acidul hipobromic, la rândul său, reacționează cu ionul de bromură, formând brom liber:
HOBr + Br--+ H+ = Br2 + H2O (A3)
Acidul malonic este bromurat cu brom liber:
Br2+ CH2(COOH)2 = BrCH(COOH)2 + Br--+ H+ (A4)
Ca rezultat al tuturor acestor reacții, acidul malonic este bromurat cu brom liber:
BrO-3+ 2Br-- + 3CH2(COOH)2 + 3H+ =3BrCH(COOH)2 + 3H2O (A)
Sensul chimic al acestui grup de reacții este dublu: distrugerea ionului bromură și sinteza acidului bromomalonic.
Reacțiile din grupa B sunt posibile numai în absența (concentrație scăzută) a ionului de bromură. Când ionul bromat reacţionează cu acidul broms, se formează radicalul BrO2.
BrO-3+ HBrO2 + H+ > 2BrO2 + H2O (B1)
BrO2 reacționează cu ceriul (III), oxidându-l la ceriu (IV) și este el însuși redus la acid bromic:
BrO2+ Ce3+ + H+ > HВrO2 + Ce4+ (B2)
Acidul bromic se descompune în ion bromat și acid hipobromic:
2HBrO2> BrO-3 +HOBr + H+ (B3)
Acidul hipobromic bromează acidul malonic:
HOBr + CH2(COOH)2 > BrCH(COOH)2 + H2O (B4)
Ca rezultat al reacțiilor de grup B, se formează acid bromomalonic și ceriu tetravalent.
Fluctuațiile concentrațiilor principalelor componente ale reacției: bromură și ferină - în spațiul de fază sunt reprezentate ca o linie închisă (ciclu limită).
BrO-3+ 4Ce3+ + CH2(COOH)2 + 5H+ > BrCH(COOH)2 + 4Ce4+ + 3H2O (B)
Ceriul (IV) format în aceste reacții (reacții din grupa B):
6Ce4++ CH2(COOH)2 + 2H2O > 6Ce3+ +HCOOH + 2CO2 +6H+ (ÎN1)
4Ce4++ BrCH(COOH)2 + 2H2O > Br-- + 4Ce3++ HCOOH + 2CO2 + 5H+ (ÎN2)
Semnificația chimică a acestui grup de reacții este formarea unui ion de bromură, care este cu cât este mai intensă, cu atât concentrația de acid bromomalonic este mai mare. O creștere a concentrației ionului de bromură duce la o încetare (încetinire dramatică) a oxidării ceriului (III) la ceriu (IV). În studiile recente, ceriul este de obicei înlocuit cu feroină.
Această secvență (incompletă) de pași în reacția Belousov-Zhabotinsky arată cât de complex este acest sistem. Deci, este suficient să se țină cont de modificarea concentrației tuturor componentelor intermediare de trei bază ale reacției HВrO2 (acid bromic), Br-- și feroină (sau ceriu).
Primul pasîn reacție - ca urmare a unei reacții autocatalitice, se formează acid broms (un proces rapid, asemănător unei explozii), feroina este transformată în feriină (forma oxidată a feroinei).
Al doilea pas– ca urmare a interacțiunii cu componenta organică, ferina începe să se transforme lent înapoi în feroină și, în același timp, începe să se formeze ionul de bromură.
Al treilea pas– ionul de bromură este un inhibitor eficient al reacției autocatalitice (etapa I). Ca urmare, formarea acidului bromos se oprește și se descompune rapid.
Al patrulea pas– procesul de dezintegrare a feriinei, început la a 2-a etapă, este încheiat; ionul de bromură este îndepărtat din sistem. Ca urmare, sistemul revine la starea în care se afla înainte de primul pas, iar procesul se repetă periodic. Există mai multe modele matematice (sisteme de ecuații diferențiale) care descriu această reacție, fluctuațiile concentrației reactivilor săi și modelele de propagare a undelor de concentrație.
Partea experimentală:
Reacția de interacțiune a acidului citric cu bromatul de potasiu:
Reactivi:
1. KMnO4(permanganat de potasiu).
2. KBrO3(bromură de potasiu sau bromat de potasiu).
3. H2SO4(concentrat).
4. Acid citric.
5. Apă distilată.
Progres: O porție cântărită de acid citric (2 g) a fost dizolvată în 6 ml de H20. La soluția rezultată s-a adăugat o porție cântărită de bromură de potasiu - 0,2 g și s-au adăugat 0,7 ml de acid sulfuric concentrat, apoi s-au adăugat 0,04 g de permanganat de potasiu și volumul soluției rezultate s-a adus la 10 ml cu apă distilată. Se amestecă bine până la dizolvarea completă a reactivilor.
Observatii: Imediat după adăugarea de KMnO4, soluția a devenit violet și a început să „fierbe”. După 25 de secunde, cu fierbere rapidă, culoarea soluției a început să se schimbe în maro. Odată cu cursul reacției, soluția se luminează treptat - până la o culoare galben deschis. După 3 min 45 s, începe o întunecare ascuțită a soluției (similar cu difuzia unui lichid de înaltă densitate), iar după 40 s soluția devine din nou complet maro. Apoi totul se repetă cu o perioadă de 4,5 minute - 5 minute. După o perioadă destul de lungă de timp, reacția începe să încetinească, apoi se oprește cu totul (soluție galbenă).
/>Reacții redox vibraționale:
Reactivi:
1. FeSO4. 7H2O sulfat de fier (II) cristalin heptahidrat sau
Fe(NH4)2(SO4)2.6H2O (sare Mohr) sulfat de diamoniu hexahidrat-
fier (II)
2. Ce(N03)3,6H20 nitrat de ceriu(III) hexahidrat
3. KBr o soluție apoasă de bromură de potasiu (2 mol/l sau 12 g la 50 ml apă)
4. KBrO3 soluție saturată de bromat de potasiu (aproximativ 10 g la 100 ml apă)
5. H2SO4 acid sulfuric concentrat
6. CH2(COOH)2 o soluție apoasă de acid malonic (5 mol / l sau 52 g in
100 ml apă)
7. C12H8N2(phen) o-fenantrolină
8. apă distilată
Veselă și tacâmuri: Polylux cu ecran, placă de sticlă 25x25 cm, vas Petri, balon cotat de 100 ml, balon Erlenmeyer de 250 ml cu dop măcinat, șase pipete, biuretă, tijă de sticlă, șaibă, hârtie de filtru.
Descrierea experienței: Pentru a demonstra experimentul, soluțiile A și B sunt pregătite preliminar.
Soluţie A – o soluție de feroină, un complex de fier(II) cu o-fenantrolină (phen). Într-un balon cotat de 100 ml se adaugă 0,70 g de sulfat de fier(II) heptahidrat (sau 0,99 g de sare Mohr) și 1,49 g de o-fenantrolină, volumul de soluție se ajustează la semn cu apă și se amestecă. Soluția capătă o culoare roșie datorită formării complexului de fenantrolină de fier(II):
Fe2++ 3 phen = 2+
Soluţie B - o soluție de acid bromomalonic (preparată imediat înainte de demonstrație). Într-un balon conic cu dop măcinat se introduc 3,3 ml soluție de bromură de potasiu, 5 ml soluție de acid malonic și 5 ml acid sulfuric concentrat. Soluția rezultată este titrată dintr-o biuretă cu o soluție saturată de bromat de potasiu cu agitare după adăugarea fiecărei porțiuni de titrant, obținându-se dispariția culorii maro datorită eliberării de brom într-o reacție de comutare paralelă:
BrO3–+ 5Br– + 6H+ = 3Br2 + 3H2O
3Br2+ 2CH2(COOH)2 + 2H2O = BrCH(COOH)2+ HCOOH + CO2 + 5HBr
Volumul total al soluției de bromat de potasiu utilizat pentru titrare ar trebui să fie de aproximativ 7,5 ml.Acidul bromomalonic rezultat este instabil, dar poate fi păstrat la o temperatură de 5100C pentru ceva timp.
Pentru a demonstra direct experimentul, o placă Petri este plasată pe o placă de sticlă care acoperă fereastra luminii Polylux, în care se adaugă succesiv 10 ml de soluție saturată de bromat de potasiu, 4 ml de soluție de acid bromomalonic și 1,5 ml de soluție de feroină. pipete. În câteva minute, pe fond roșu apar pete albastre din cauza formării unui complex fenantrolin de fier (III) 3+ ca rezultat al oxidării complexului de fier (II) corespunzător:
62++ 6H3O+ + BrO3– = 63++ 9H2O + Br–
Acest proces se auto-accelerează. Complexul rezultat 3+ oxidează acidul bromomalonic cu formarea de ioni de bromură:
43++ BrCH(COOH)2 + 7H2O =
= 2CO2+ 5H3O+ + Br– + HCOOH + 42+
Ionii de bromură eliberați sunt inhibitori ai reacției de oxidare a complecșilor de fier (II) cu ionii de bromat.Numai când concentrația ionilor complecși 2+ devine suficient de mare, activitatea inhibitoare a ionilor de bromură este depășită, iar soluția devine albastră datorită formării complexului de fier (III). Procesul se repetă din nou și din nou, astfel încât culoarea soluției se schimbă periodic de la albastru la roz sau invers. Schimbarea culorii începe cu apariția unor pete albastre pe un fundal roz, din care valuri concentrice de culoare diverg în toate direcțiile. În timp, rata de schimbare a culorii scade și, în cele din urmă, procesul se estompează. În acest caz, apariția „punctelor negre” - proiecțiile bulelor de dioxid de carbon eliberat pot fi observate pe ecran.
Gama de culori poate fi extinsă prin adăugarea câtorva cristale de nitrat de ceriu (III) hexahidrat în placa Petri. Ce(NO3)3. 6H2O. Apoi, pe lângă culoarea albastră și roz, se poate observa galben (datorită formării compușilor de ceriu (IV)) sau verde (datorită suprapunerii galbenului și albastrului):
6Ce3++ BrO3– + 15H2O = 62++ Br– + 6H3O+
42++ BrCH(COOH)2 + 3H3O+ =
= 2CO2+ Br– + HCOOH + 4Ce3++ 9H2O
Când este încălzit, viteza de reacție crește, iar schimbarea culorii se accelerează.
Notă. Fenantrolina este un compus heterociclic cu doi atomi de azot care au perechi singure de electroni și sunt capabili de coordonare. În compuși complecși cu fier O-fenantrolina joaca rolul de ligand bidentat si formeaza complexe puternice de tip chelat.
Concluzie.
Până în prezent, reacția Belousov-Zhabotinsky și-a luat locul cuvenit în știința mondială. În fiecare an, în lume au loc mai multe conferințe internaționale despre dinamica sistemelor chimice liniare, iar cuvintele „reacție BZ” (abreviere: reacții Belousov-Zhabotinsky) sunt auzite la zeci de alte conferințe dedicate problemelor de fizică, chimie, și biologie.
Studiul reacției Belousov-Zhabotinsky, așa cum eram convins, este de mare importanță, deoarece a găsit aplicație în diferite domenii ale științei și tehnologiei. Această reacție este folosită ca model pentru studiul unei încălcări formidabile a inimii - aritmii și fibrilații. Și recent, au fost începute experimente cu o modificare sensibilă la lumină a acestei reacții, când dinamica acestui sistem depinde de intensitatea luminii. S-a dovedit că o astfel de reacție poate fi folosită ca computer pentru stocarea și procesarea imaginilor. Modificarea sensibilă la lumină a reacției Belousov-Zhabotinsky poate servi ca prototip al unui complex de calcul, care poate înlocui computerul.
Pe de altă parte, reacțiile chimice oscilatorii sunt un exemplu viu de auto-organizare în natura nevie, iar în acest sens există nu numai o semnificație științifică naturală, ci și o semnificație filosofică. Schimbările fundamentale din știința naturii care au dat naștere așa-numitei teorii a auto-organizării se datorează în mare măsură impulsului inițial dat de oamenii de știință ruși la începutul anilor 1950-1960, când Belousov a descoperit reacția chimică redox. , mergând de la formarea galaxiilor până la tornade, cicloane și jocul de lumină pe suprafețele reflectorizante, de fapt, sunt procese de auto-organizare. Ele pot avea o natură foarte diferită: chimică, mecanică, optică, electrică etc.
Astfel, studiile aplicative devin din ce în ce mai importante, de exemplu, în domeniul modelării mijloacelor alternative de prelucrare a informațiilor (în special, analiza mozaicurilor complexe cu gradarea luminozității obiectului). O altă direcție nouă a cercetării aplicate este studiul caracteristicilor polimerizării în sistemul BZh sau similar cu acesta.
Organizarea complexă spațio-temporală manifestată de sistemul BZ în absența amestecării, de-a lungul timpului, s-au găsit analogii în natură, în sistemele biologice (de exemplu: procese periodice de metabolism celular, valuri de activitate în țesutul cardiac și țesuturile creierului). , procese care au loc la nivelul sistemelor non-ecologice), în noul său domeniu - sinergetica (teoria și autoorganizarea), precum și munca experimentală au inițiat dezvoltarea teoriei moderne a sistemelor dinamice. Deși în prezent multe dintre astfel de reacții sunt deja înțelese, totuși, cauzele care provoacă procese chimice oscilatorii rămân neclare până la sfârșit.
În prezent, cinetica reacțiilor oscilatorii este o ramură a cunoștințelor care se dezvoltă rapid, care a apărut la intersecția dintre chimie, biologie, medicină, fizică și matematică. A fost foarte interesant pentru mine să fac cunoștință cu proprietăți atât de neobișnuite și, la prima vedere, imposibile ale materiei vii. Dar și mai mult am fost uimit de faptul că o astfel de semnificație incredibilă, o descoperire impresionantă de mulți ani nu a fost percepută de alții și pur și simplu nu a fost înțeleasă de marile minți ale vremii. Această descoperire a trecut prin calea ei spinoasă și, în cele din urmă, și-a luat locul cuvenit în știința mondială. Asama, posibilitatea unei astfel de reacții dovedește încă o dată că în lumea noastră există încă o mulțime de necunoscute și neexplorate.
Aplicație.
Rețete pentru unele reacții oscilatorii
Reteta 1: Este necesar să se pregătească soluții din următoarele substanțe pe baza concentrațiilor lor finale: acid malonic 0,2 M; bromat de sodiu 0,3 M; acid sulfuric 0,3 M; feroina 0,005 M. Feroina poate fi înlocuită cu mangan divalent sau sulfat de ceriu trivalent, dar intensitatea culorii va fi mult mai slabă. Aproximativ 5 ml dintr-o soluție din toate componentele trebuie turnați într-un vas Petri, astfel încât grosimea stratului de lichid să fie de 0,5-1 mm. După 3-8 minute (perioada de tranziție), se pot observa oscilații și unde chimice.
Reteta 2: Turnați următoarele soluții într-o cuvă plată transparentă în straturi (1 ml):
- KBrO3(0,2 mol/l)
- acid malonic (0,3 mol/l)
- feroină (0,003 mol/l)
- H2SO4(0,3 mol/l)
Așezați cuva pe o foaie de hârtie albă. Viteza de reacție poate fi modificată prin adăugarea de alcali sau acid.
Reteta 3: Solutii necesare:
- acid citric (40 g în 160 ml H2O)
- H2SO4(1:3).
Și, de asemenea, spânzurătoare:
- KBrO3(16 g)
- Ce2(SO4)3(3-3,5 g)
Se încălzește soluția de acid citric la 40°-50°C, apoi se toarnă o probă de KBrO3. Se pune paharul pe o foaie de hârtie albă și se adaugă o probă de Ce2(SO4)3 și câțiva ml de H2SO4. Alternarea culorilor începe imediat să apară: galben > incolor > galben, cu o perioadă de 1-2 minute.
Rețeta 4: Solutii necesare:
- H2O2(50 ml 30%)
- KIO3(7,17 g în 50 ml H2O)
- HClO4(30 ml soluție diluată)
- acid malonic (3 g în 50 ml H2O).Și probe:
- MnSO4(1 g) și niște amidon.
Se toarnă totul într-un pahar (200-250 ml), se adaugă porții cântărite, se amestecă cu o baghetă de sticlă. Există o alternanță de culoare: incolor > galben > albastru.
Bibliografie.
1. Aliev R., Shnol S. E. „Reacții chimice vibraționale”. Cinetică și cataliză. 1998. Nr 3. P. 130-133.
2. Shnol S.E. Cunoașterea este Putere. 1994. Nr. 3. pp. 62-71.
3. Zhabotinsky A. M. Autooscilații de concentrare. Moscova: Nauka, 1974.
4. Garel D., Garel O. Reacții chimice vibraționale / Per. din engleza. M.:
5. Dubnishcheva T. Ya. Concepte ale științelor naturale moderne. Novosi-
birsk: YuKEA, 1997, p. 683 – 697.
6. Concepte ale științelor naturale moderne. Ed. V. N. Lavrinenko,
V. P. Ratnikova, M.: UNITI-DANA, 1999, S. 78 - 87.
7. VavilinB.V.„Auto-oscilații în sistemele chimice în fază lichidă”.
Priroda, 2000, nr. 5, p. 19–25.
Ministerul Educației, Științei, Tineretului și Sportului
Liceul Teoretic Petru Movilă
Scaun
„Abilitate, muncă, talent”
Cursuri de chimie pe tema:
„Reacții chimice vibraționale”
Completat de: elev de clasa 12A
Bolyubash Irina
Lector: Snidchenko M.A.
* Chișinău 2007 *
1. Introducere:
a) Reacții redox
b) Reacții chimice vibraționale
2. Istoria descoperirii reacțiilor oscilatorii:
a) Studii ale fluctuațiilor concentrației înainte de descoperire
reacţiile lui B. P. Belousov
3. Partea teoretică:
a) Model matematic de A. Lotka
b) Studiul mecanismului reacţiilor oscilatorii
4. Partea experimentală
5. Concluzie
6. Aplicație:
a) Reţete pentru unele reacţii oscilatorii
b) Ilustrații pentru experimentele efectuate
7. Literatură
Introducere.
Chimia este o știință experimentală. Și astfel experimentul ca metodă de cercetare științifică a ocupat de mult și ferm un loc de frunte între metodele științelor naturii. Experimentul este cel mai important mod de a conecta teoria cu practica în predarea chimiei, transformând cunoștințele în convingeri. Prin urmare, dezvăluirea semnificației cognitive a fiecărui experiment este principala cerință pentru un experiment chimic.
În cadrul experimentului (din lat. "experiment" - "proces")înțelegeți observarea fenomenului studiat în anumite condiții, permițându-vă să urmăriți cursul acestui fenomen și să îl repetați în aceste condiții. Un experiment chimic ocupă un loc important în predarea chimiei, deoarece prin observații și experimente se cunoaște diversitatea naturii substanțelor, se acumulează fapte pentru comparații, generalizări și concluzii.
Efectuând experimente și observând transformări chimice în diferite condiții, suntem convinși că procesele chimice complexe pot fi controlate, că nu există nimic misterios în fenomene, ele se supun legilor naturale, a căror cunoaștere face posibilă utilizarea pe scară largă a transformărilor chimice în activitatea practică umană. .
Cu toate acestea, rezultatele unor experimente chimice sunt neașteptate și nu se încadrează în ideile tradiționale despre proprietățile substanțelor sau modelele reacțiilor chimice. Astfel de transformări chimice au fost numite experimente problematice.
Chiar și pe vremea antichității, filozofii credeau că orice cunoaștere începe cu surprinderea. Surpriza provocată de nou duce la dezvoltarea curiozității (sensibilitatea la problemele din lumea înconjurătoare) cu formarea ulterioară a unui interes stabil pentru ceva. Surpriza și, în urma acesteia, dorința de cunoaștere - acesta este un teren fertil pentru studierea unui experiment problematic, formarea gândirii dialectice și sistemice și deblocarea potențialului creativ.
Aceeași stare poate fi cauzată de un experiment chimic luminos, impresionant (experiment cu probleme). În chimie, cauzele experimentelor problematice sunt cel mai adesea reacții redox.
Reacții redox
Există numeroase criterii de clasificare a reacțiilor chimice. Unul dintre cele mai importante este un semn al unei schimbări în stările de oxidare ale elementelor. În funcție de schimbarea sau menținerea stărilor de oxidare ale elementelor, reacțiile chimice pot fi împărțite în reacții redox și cele care au loc fără modificarea stărilor de oxidare.
Reacțiile care apar cu modificarea stărilor de oxidare ale elementelor (redox) sunt larg cunoscute. Ele joacă un rol important în tehnologie și natură, ele stau la baza metabolismului în organismele vii, iar procesele de oxidare, putrefacție, fermentație și fotosinteză sunt asociate cu acestea. Procesele de oxidare (și reducere) au loc în timpul arderii combustibilului, coroziunii metalelor, electrolizei, cu ajutorul lor, se obțin metale, amoniac, alcali și multe alte produse valoroase. Prin urmare, studiul reacțiilor redox este asigurat de cursurile școlare de chimie anorganică și organică.
Amintiți-vă principalele prevederi asociate conceptului de reacții redox.
Starea de oxidare corespunde încărcăturii care ar apărea asupra unui atom al unui element dat dintr-un compus chimic, presupunând că toate perechile de electroni prin care acest atom este conectat la alții sunt complet deplasate la atomii elementelor cu electronegativitate mai mare.
Oxidant- o substanță care conține atomi sau ioni care acceptă electroni: X m (agent oxidant) + ne - \u003d X (m - n), unde m este gradul de oxidare al elementului din substanța originală, n este numărul de electroni .
Agent de reducere- o substanță care conține atomi sau ioni care donează electroni: Y m (reductor) - ne - = Y (m + n) .
Oxidare- procesul de eliberare de electroni de către un atom, moleculă sau ion, în timp ce starea de oxidare a elementului crește.
Recuperare- procesul de primire a electronilor de către un atom, moleculă sau ion, în timp ce starea de oxidare a elementului scade.
Oxidarea și reducerea sunt procese conjugate, numărul de electroni donați de agentul reducător în procesul de oxidare a acestuia este întotdeauna egal cu numărul de electroni acceptați de agentul de oxidare în procesul de reducere a acestuia.
Reacții chimice vibraționale
În această lucrare de termen, voi lua în considerare un caz special al unui experiment problematic, reacțiile chimice oscilatorii. Reacțiile oscilatorii reprezintă o întreagă clasă de reacții de oxidare a substanțelor organice cu participarea unui catalizator cu proprietăți redox. Acest proces se desfășoară ciclic, adică constă din mai multe repetări.
Reacțiile chimice vibraționale au fost descoperite și fundamentate științific în 1951 de omul de știință sovietic Boris Petrovici Belousov. B.P. Belousov a studiat oxidarea acidului citric în timpul reacției sale cu bromatul de sodiu într-o soluție de acid sulfuric. Pentru a îmbunătăți reacția, a adăugat sare de ceriu în soluție. Ceriul este un metal cu valență variabilă (3+ sau 4+), deci poate fi un catalizator pentru transformările redox. Reacția este însoțită de eliberarea de bule de CO 2 și de aceea se pare că întregul amestec de reacție „fierbe”. Și pe fundalul acestei fierberi, B.P. Belousov a observat un lucru uimitor: culoarea soluției s-a schimbat periodic - a devenit fie galbenă, fie incoloră. Belousov a adăugat un complex de fenantrolină cu fier feros (feroină) la soluție, iar culoarea soluției a început să se schimbe periodic de la roșu-violet la albastru și înapoi.
Astfel a fost descoperită reacția care a devenit celebră. Acum este cunoscut în întreaga lume, se numește reacția Belousov-Zhabotinsky. A. M. Zhabotinsky a făcut multe pentru a înțelege acest fenomen uimitor. De atunci, au fost descoperite un număr mare de reacții similare.
Istoria descoperirii reacțiilor oscilatorii.
IP Belousov a făcut descoperirea unei reacții chimice oscilatorii în încercarea de a crea un model chimic simplu al unor etape ale sistemului de transformări biochimice cheie ale acizilor carboxilici dintr-o celulă. Cu toate acestea, primul raport al descoperirii sale nu a fost publicat. Revizorul unui jurnal de chimie s-a îndoit de posibilitatea fundamentală a reacției descrise în articol. Majoritatea chimiștilor din acei ani credeau că nu există oscilații pur chimice, deși existența reacțiilor oscilatorii a fost prezisă în 1910 de A. Lotkoy pe baza teoriei matematice a proceselor periodice.
A doua încercare de a publica rezultatele studiului a fost făcută de om de știință în 1957 și din nou a fost refuzată, în ciuda muncii fizicianului și fizicochimistului belgian I. R. Prigozhin care a apărut la acea vreme. În aceste lucrări s-a arătat posibilitatea și probabilitatea reacțiilor chimice oscilatorii.
Abia în 1959 a fost publicat un scurt rezumat despre descoperirea de către B.P. Belousov a unei reacții chimice oscilatorii care acționează periodic în publicația puțin cunoscută „Collection of Abstracts on Radiation Medicine”.
Și lucrul este că atunci când B.P. Belousov și-a făcut descoperirea, modificările periodice ale concentrației de reactivi păreau a fi o încălcare a legilor termodinamicii. Într-adevăr, cum poate o reacție să meargă fie în direcția înainte, fie în direcția opusă? Este imposibil de imaginat că întregul număr imens de molecule din vas a fost într-o stare, apoi într-o altă stare (fie toate „albastre”, apoi toate „roșii” ...).
Direcția reacției este determinată de potențialul chimic (termodinamic) - reacțiile se desfășoară în direcția stărilor mai probabile, în direcția reducerii energiei libere a sistemului. Când o reacție într-o direcție dată este finalizată, înseamnă că potențialul ei a fost epuizat, se atinge echilibrul termodinamic, iar fără cheltuirea de energie, în mod spontan, procesul nu poate merge în direcția opusă. Și apoi... reacția merge într-o direcție sau în alta.
Cu toate acestea, nu a existat nicio încălcare a legilor în această reacție. Au existat fluctuații - modificări periodice - în concentrațiile produselor intermediare, și nu a reactivilor inițiali sau a produselor finale. CO 2 nu se transformă în acid citric în această reacție, acest lucru este de fapt imposibil. Recenziatorii nu au ținut cont de faptul că, deși sistemul este departe de echilibru, în el se pot întâmpla multe lucruri minunate. Traiectoriile detaliate ale unui sistem de la starea sa inițială până la starea sa finală pot fi foarte complexe. Abia în ultimele decenii termodinamica sistemelor departe de echilibru a început să se ocupe de aceste probleme. Această nouă știință a devenit baza unei noi științe - sinergetica (teoria auto-organizării).
Reacția lui Belousov, așa cum sa menționat mai sus, a fost studiată în detaliu de A. M. Zhabotinsky și colegii săi. Au înlocuit acidul citric cu acid malonic. Oxidarea acidului malonic nu este însoțită de formarea de bule de CO 2, astfel încât modificarea culorii soluției poate fi înregistrată fără interferențe de către dispozitivele fotoelectrice. Mai târziu s-a dovedit că feroina fără ceriu servește ca catalizator pentru această reacție. B. P. Belousov a observat deja în primele experimente o altă proprietate remarcabilă a reacției sale: atunci când agitarea este oprită, schimbarea culorii soluției se propagă în valuri. Această propagare a vibrațiilor chimice în spațiu a devenit deosebit de evidentă când, în 1970, A. M. Zhabotinsky și A. N. Zaikin au turnat un strat subțire de amestec de reacție într-o cutie Petri. În cupă se formează figuri bizare - cercuri concentrice, spirale, „vârtejuri”, care se propagă cu o viteză de aproximativ 1 mm/min. Undele chimice au o serie de proprietăți neobișnuite. Deci, atunci când se ciocnesc, se sting și nu pot trece unul prin celălalt.
Studii de concentrare
oscilaţii înainte de descoperirea reacţiei de către B. P. Belousov
Dar după cum spune povestea, descoperirea lui B.P. Belousov nu a fost nicidecum prima în știința mondială. S-a dovedit că una dintre primele publicații despre vibrațiile chimice datează din 1828. În ea, T. Fechner a subliniat rezultatele unui studiu al oscilațiilor unei reacții electrochimice. Cea mai interesantă este lucrarea lui M. Rosenskiöld, datând din 1834. Autorul ei a observat din întâmplare că un balon mic care conține puțin fosfor emite o lumină destul de intensă în întuneric. Nu a fost nimic surprinzător în însuși faptul că strălucirea fosforului, dar faptul că această strălucire se repeta în mod regulat la fiecare a șaptea secundă a fost interesant. Patruzeci de ani mai târziu, aceste experimente cu „balonul pâlpâit” au fost continuate de francezul M. Joubert (1874). A reușit să observe formarea periodică a „norilor luminoși” într-o eprubetă. Douăzeci de ani mai târziu, omul de știință german A. Zentnershwer a studiat și efectul presiunii aerului asupra fulgerelor periodice de fosfor. În experimentele sale, perioada de flash a început la 20 s și a scăzut odată cu scăderea presiunii.
O pagină deosebit de strălucitoare din istoria vibrațiilor chimice este asociată cu așa-numitele inele Liesegang. În 1896, chimistul german R. Liesegang, în timp ce experimenta cu fotochimice, a descoperit că dacă picăți lapis pe o placă de sticlă acoperită cu gelatină care conține vârf de crom, atunci produsul de reacție, care precipită, este situat pe placă în cercuri concentrice. Liesegang a devenit fascinat de acest fenomen și l-a studiat timp de aproape jumătate de secol. A găsit și aplicații practice. În arta aplicată, inelele lui Liesegang au fost folosite pentru a decora diverse produse cu imitație de jasp, malachit, agat etc. Liesegang însuși a propus tehnologia de realizare a perlelor artificiale.
Lista de astfel de exemple ar putea fi continuată. În urma acestora, au fost descoperite reacții oscilatorii la interfața dintre două faze. Dintre acestea, cele mai cunoscute sunt reacțiile de la interfața metal-soluție, care au primit denumiri specifice - „nerv de fier” și „inima de mercur”. Prima dintre ele - reacția de dizolvare a fierului (sârmă) în acid azotic - și-a primit numele datorită asemănării externe cu dinamica unui nerv excitat, observată de VF Ostwald. A doua, sau mai degrabă una dintre variantele sale, este reacția de descompunere a H 2 O 2 pe suprafața mercurului metalic. În reacție, are loc formarea și dizolvarea periodică a unei pelicule de oxid pe suprafața de mercur. Fluctuațiile tensiunii superficiale a mercurului provoacă pulsații ritmice ale picăturii, care amintesc de bătăile inimii. Dar toate aceste reacții nu au atras prea multă atenția chimiștilor, deoarece ideile despre cursul unei reacții chimice erau încă destul de vagi.
Abia în a doua jumătate a secolului al XIX-lea. a apărut termodinamica și cinetica chimică, care au pus bazele unui interes specific pentru reacțiile vibraționale și metodele de analiză a acestora.
Model matematic de A. Lotkoy
Teoria matematică a oscilațiilor în sisteme similare reacțiilor chimice a fost publicată încă din 1910 de A. Lotka - el a scris un sistem de ecuații diferențiale, din care a urmat posibilitatea unor regimuri periodice. Lotka a luat în considerare interacțiunea dintre „pradă”, cum ar fi erbivorele, și „prădătorii” care le mănâncă (X și Y). Prădătorii mănâncă pradă și se înmulțesc - concentrația de Y crește, dar până la o anumită limită, când numărul de pradă scade brusc, iar prădătorii mor de foame - concentrația de Y scade. Apoi victimele supraviețuitoare încep să se înmulțească - concentrația de X crește. Prădătorii supraviețuitori după aceasta se înmulțesc și ei, concentrația de Y crește din nou și așa mai departe de multe ori. Se observă fluctuații periodice ale concentrației de reactivi. Este clar că condiția pentru astfel de fluctuații neamortizate (de mult timp) este abundența de iarbă - hrana victimelor. Ecuațiile lui Lotka au fost îmbunătățite de W. Volterra. Iar teoria modernă a oscilațiilor a fost dezvoltată de fizicienii ruși L. I. Mandelstamm, A. A. Andronov, A. A. Witt, S. E. Khaikin, D. A. Frank-Kamenetsky. Deci, pentru fizicieni și matematicieni, descoperirea lui Belousov nu a fost atât de surprinzătoare.
Studiul mecanismului reacțiilor oscilatorii.
Mecanismul detaliat al reacției Belousov nu este încă pe deplin cunoscut. În primele lucrări, se părea că numărul de produse intermediare era mic. Pentru a explica natura vibrațiilor, a fost suficient să ne imaginăm cum se formează mai întâi acidul bromomalonic din acidul malonic și, după o reacție ulterioară cu acesta, KBrO3 este transformat în KBr. Anion Br - inhibă oxidarea ulterioară a acidului bromomalonic, iar forma oxidată a catalizatorului se acumulează (ceriu cvadrivalent sau fier feric în combinație cu fenantrolina). Ca urmare, acumularea de Br - se oprește, iar oxidarea acidului bromomalonic se reia... Acum este clar că un astfel de mecanism este departe de a fi complet. Numărul de produse intermediare a ajuns la patru zeci, iar studiul continuă.
În 1972, R. Noyes și colegii săi au arătat că reacția Belousov-Zhabotinsky este rezultatul a cel puțin zece reacții care pot fi combinate în trei grupuri - A, B și C.
Mai întâi (grupul de reacție A), ionul bromat interacționează cu ionul bromur în prezența H + pentru a forma acizi bromși și hipobromici:
BrO -3 + Br -- + 2H + = HBrO2 + HOBr ( A 1)
acid hipobromic:
HBrO 2 + Br -- + H + = 2HOBr ( A 2)
Acidul hipobrom, la rândul său, reacționează cu ionul de bromură, formând brom liber:
HOBr + Br -- + H + = Br 2 + H 2 O ( A 3)
Acidul malonic este bromurat cu brom liber:
Br 2 + CH 2 (COOH) 2 \u003d BrCH (COOH) 2 + Br - + H + ( A 4)
Ca rezultat al tuturor acestor reacții, acidul malonic este bromurat cu brom liber:
BrO -3 + 2Br -- + 3CH 2 (COOH) 2 + 3H + = 3BrCH (COOH) 2 + 3H 2 O ( A )
Sensul chimic al acestui grup de reacții este dublu: distrugerea ionului bromură și sinteza acidului bromomalonic.
Reacțiile din grupa B sunt posibile numai în absența (concentrație scăzută) a ionului de bromură. Când ionul bromat reacţionează cu acidul broms, se formează radicalul BrO2.
BrO -3 + HBrO 2 + H + > 2BrO 2 + H 2 O ( B 1)
BrO 2 reacționează cu ceriul (III), oxidându-l în ceriu (IV) și este el însuși redus la acid bromos:
BrO 2 + Ce 3+ + H + > HВrO 2 + Ce 4+ ( B 2)
Acidul bromic se descompune în ion bromat și acid hipobromic:
2HBrO 2 > BrO -3 + HOBr + H + ( B 3)
Acidul hipobromic bromează acidul malonic:
HOBr + CH 2 (COOH) 2 > BrCH (COOH) 2 + H 2 O ( B 4)
Ca rezultat al reacțiilor de grup B, se formează acid bromomalonic și ceriu tetravalent.
Fluctuațiile concentrațiilor principalelor componente ale reacției: acid broms și ferină - în spațiul fazelor sunt reprezentate ca o linie închisă (ciclu limită).
BrO -3 + 4Ce 3+ + CH 2 (COOH) 2 + 5H + > BrCH(COOH) 2 + 4Ce 4+ + 3H 2 O ( B )
Ceriul (IV) format în aceste reacții (reacții din grupa B):
6Ce 4+ + CH 2 (COOH) 2 + 2H 2 O > 6Ce 3+ + HCOOH + 2CO 2 + 6H + ( ÎN 1)
4Ce 4+ + BrCH(COOH) 2 + 2H 2 O > Br -- + 4Ce 3+ + HCOOH + 2CO 2 + 5H + ( ÎN 2)
Semnificația chimică a acestui grup de reacții este formarea unui ion de bromură, care este cu cât este mai intensă, cu atât concentrația de acid bromomalonic este mai mare. O creștere a concentrației ionului de bromură duce la o încetare (încetinire dramatică) a oxidării ceriului (III) la ceriu (IV). În studiile recente, ceriul este de obicei înlocuit cu feroină.
Această secvență (incompletă) de pași în reacția Belousov-Zhabotinsky arată cât de complex este acest sistem. Deci, este suficient să se ia în considerare modificarea concentrației doar a trei componente intermediare principale ale reacției HВrO 2 (acid bromos), Br - și feroină (sau ceriu).
Primul pasîn reacție - ca urmare a unei reacții autocatalitice, se formează acid broms (un proces rapid, asemănător unei explozii), feroina este transformată în feriină (forma oxidată a feroinei).
Al doilea pas– ca urmare a interacțiunii cu componenta organică, ferina începe să se transforme lent înapoi în feroină și, în același timp, începe să se formeze ionul de bromură.
Al treilea pas– ionul de bromură este un inhibitor eficient al reacției autocatalitice (etapa I). Ca urmare, formarea acidului bromos se oprește și se descompune rapid.
Al patrulea pas– procesul de dezintegrare a feriinei, început la a 2-a etapă, este încheiat; ionul de bromură este îndepărtat din sistem. Ca urmare, sistemul revine la starea în care se afla înainte de primul pas, iar procesul se repetă periodic. Există mai multe modele matematice (sisteme de ecuații diferențiale) care descriu această reacție, fluctuațiile concentrației reactivilor săi și modelele de propagare a undelor de concentrație.
Partea experimentală:
Reacția acidului citric cu bromatul de potasiu:
Reactivi:
1. K M nr 4(permanganat de potasiu).
2. KBrO 3(bromat de potasiu sau bromat de potasiu).
3. H2SO4(concentrat).
4. Acid citric.
5. Apă distilată.
Progres: O porţie de acid citric - 2 g a fost dizolvată în 6 ml de H20. O porţie de bromat de potasiu - 0,2 g a fost adăugată la soluţia rezultată şi s-a adăugat 0,7 ml de acid sulfuric concentrat. Apoi se prepară 0,04 g de permanganat de potasiu și se aduce volumul soluției rezultate la 10 ml cu apă distilată. Se amestecă bine până la dizolvarea completă a reactivilor.
Observatii: Imediat după adăugarea de KMnO 4, soluția a devenit violet și a început să „fierbe”. După 25 de secunde, cu fierbere rapidă, culoarea soluției a început să se schimbe în maro. Odată cu cursul reacției, soluția se luminează treptat - până la o culoare galben deschis. După 3 min 45 s, soluția începe să se întunece puternic (asemănător cu difuzia unui lichid de înaltă densitate), iar după 40 s soluția devine din nou complet maro. Apoi totul se repetă cu o perioadă de 4,5 minute - 5 minute. După o perioadă destul de lungă de timp, reacția începe să încetinească, apoi se oprește cu totul (soluție galbenă).
Reacții redox vibraționale:
Reactivi:
1. FeSO4. 7H2O sulfat de fier (II) cristalin heptahidrat sau
Fe (NH4)2(SO4)2. 6H 2 O (sare Mohr) sulfat de diamoniu hexahidrat-
fier (II)
2. Ce(NO3)3. 6H2O nitrat de ceriu(III) hexahidrat
3. KBr o soluție apoasă de bromură de potasiu (2 mol/l sau 12 g la 50 ml apă)
4. KBrO 3 soluție saturată de bromat de potasiu (aproximativ 10 g la 100 ml apă)
5. H2SO4 acid sulfuric concentrat
6. CH2 (COOH) 2 o soluție apoasă de acid malonic (5 mol / l sau 52 g in
100 ml apă)
7. C12H8N2(phen) o-fenantrolină
8. apă distilată
Veselă și tacâmuri: Polylux cu ecran, placă de sticlă 25x25 cm, vas Petri, balon cotat de 100 ml, balon Erlenmeyer de 250 ml cu dop măcinat, șase pipete, biuretă, tijă de sticlă, șaibă, hârtie de filtru.
Descrierea experienței: Pentru a demonstra experimentul, soluțiile A și B sunt pregătite preliminar.
Soluţie A – o soluție de feroină, un complex de fier(II) cu o-fenantrolină (phen). Într-un balon cotat de 100 ml se adaugă 0,70 g de sulfat de fier(II) heptahidrat (sau 0,99 g de sare Mohr) și 1,49 g de o-fenantrolină, volumul de soluție se ajustează la semn cu apă și se amestecă. Soluția capătă o culoare roșie datorită formării complexului de fenantrolină de fier(II):
Fe 2+ + 3 phen = 2+
Soluţie B - o soluție de acid bromomalonic (preparată imediat înainte de demonstrație). Într-un balon conic cu dop măcinat se introduc 3,3 ml soluție de bromură de potasiu, 5 ml soluție de acid malonic și 5 ml acid sulfuric concentrat. Soluția rezultată este titrată dintr-o biuretă cu o soluție saturată de bromat de potasiu cu agitare după adăugarea fiecărei porțiuni de titrant, obținându-se dispariția culorii maro datorită eliberării de brom într-o reacție de comutare paralelă:
BrO 3 - + 5Br - + 6H + = 3Br 2 + 3H 2 O
3Br 2 + 2CH 2 (COOH) 2 + 2H 2 O \u003d BrCH (COOH) 2 + HCOOH + CO 2 + 5HBr
Volumul total de soluție de bromat de potasiu utilizat pentru titrare trebuie să fie de aproximativ 7,5 ml. Acidul bromomalonic rezultat este instabil, dar de ceva timp poate fi păstrat la o temperatură de 510 0 C.
Pentru o demonstrație directă a experimentului, o placă Petri este așezată pe o placă de sticlă care acoperă fereastra luminoasă polylux, în care se află succesiv 10 ml de soluție saturată de bromat de potasiu, 4 ml de soluție de acid bromomalonic și 1,5 ml de soluție de feroină. adăugat folosind pipete. În câteva minute, pe fond roșu apar pete albastre din cauza formării complexului de fenantrolină de fier(III). 3+ ca rezultat al oxidării complexului de fier (II) corespunzător:
6 2+ + 6H 3 O + + BrO 3 – = 6 3+ + 9H 2 O + Br –
Acest proces se auto-accelerează. Complexul rezultat 3+ oxidează acidul bromomalonic cu formarea de ioni de bromură:
43+ + BrCH(COOH)2 + 7H20 =
\u003d 2CO 2 + 5H 3 O + + Br - + HCOOH + 4 2+
Ionii de bromură eliberați sunt inhibitori ai oxidării complecșilor de fier (II) de către ionii de bromat. Numai atunci când concentrația de ioni complecși 2+ devine suficient de mare, activitatea inhibitoare a ionilor de bromură este depășită, iar soluția devine albastră datorită formării complexului de fier (III). Procesul se repetă din nou și din nou, astfel încât culoarea soluției se schimbă periodic de la albastru la roz sau invers. Schimbarea culorii începe cu apariția unor pete albastre pe un fundal roz, din care valuri concentrice de culoare diverg în toate direcțiile. În timp, rata de schimbare a culorii scade și, în cele din urmă, procesul se estompează. În același timp, apariția „punctelor negre” - proiecții de bule de dioxid de carbon eliberat pot fi observate pe ecran.
Gama de culori poate fi extinsă prin adăugarea câtorva cristale de nitrat de ceriu (III) hexahidrat în placa Petri. Ce(NO3)3. 6H2O. Apoi, pe lângă culoarea albastră și roz, se poate observa galben (datorită formării compușilor de ceriu (IV)) sau verde (datorită suprapunerii culorilor galben și albastru):
6Ce 3+ + BrO 3 – + 15H 2 O = 6 2+ + Br – + 6H 3 O +
42+ + BrCH(COOH)2 + 3H3O+ =
\u003d 2CO 2 + Br - + HCOOH + 4Ce 3+ + 9H 2 O
Când este încălzit, viteza de reacție crește, iar schimbarea culorii se accelerează.
Notă. Fenantrolina este un compus heterociclic cu doi atomi de azot care au perechi singure de electroni și sunt capabili de coordonare. În compuși complecși cu fier O-fenantrolina joaca rolul de ligand bidentat si formeaza complexe puternice de tip chelat.
Concluzie.
Până în prezent, reacția Belousov-Zhabotinsky și-a luat locul cuvenit în știința mondială. În fiecare an, în lume au loc mai multe conferințe internaționale despre dinamica sistemelor chimice neliniare, iar cuvintele „reacție BZ” (abreviere: reacții Belousov-Zhabotinsky) sunt auzite la zeci de alte conferințe dedicate problemelor de fizică, chimie, și biologie.
Studiul reacției Belousov-Zhabotinsky, așa cum eram convins, este de mare importanță, deoarece a găsit aplicație în diferite domenii ale științei și tehnologiei. Această reacție este folosită ca model pentru studiul unei încălcări formidabile a inimii - aritmii și fibrilații. Și recent, au fost începute experimente cu o modificare sensibilă la lumină a acestei reacții, când dinamica acestui sistem depinde de intensitatea luminii. S-a dovedit că o astfel de reacție poate fi folosită ca computer pentru stocarea și procesarea imaginilor. O modificare sensibilă la lumină a reacției Belousov-Zhabotinsky poate servi ca prototip al unui complex de computer, care poate înlocui computerul.
Pe de altă parte, reacțiile chimice oscilatorii sunt un exemplu viu de auto-organizare în natura neînsuflețită și, în acest sens, nu există doar o semnificație științifică naturală, ci și filozofică. Schimbările fundamentale din știința naturii care au dat naștere așa-numitei teorii a auto-organizării se datorează în mare măsură impulsului inițial dat de oamenii de știință ruși la începutul anilor 1950-1960, când Belousov a descoperit reacția chimică redox. În același timp, s-au descoperit analogii uimitoare, s-a dovedit că multe fenomene naturale, de la formarea galaxiilor la tornade, cicloane și jocul luminii pe suprafețele reflectorizante, sunt, de fapt, procese de auto-organizare. Ele pot avea o natură foarte diferită: chimică, mecanică, optică, electrică etc.
Astfel, cercetarea aplicată capătă din ce în ce mai multă greutate, de exemplu, în domeniul modelării mijloacelor alternative de prelucrare a informațiilor (în special, analiza mozaicurilor complexe cu gradarea luminozității obiectului). O altă direcție nouă a cercetării aplicate este studiul caracteristicilor polimerizării în sistemul BZ sau altele similare.
Organizarea complexă spațio-temporală manifestată de sistemul BZ în absența amestecării a găsit în cele din urmă analogii în natură, în sistemele biologice (de exemplu: procese periodice ale metabolismului celular, valuri de activitate în țesutul cardiac și țesuturile creierului, procese care au loc la nivelul sistemelor non-ecologice), în noua sa zonă - sinergetica (teoriile auto-organizării), precum și munca experimentală a inițiat dezvoltarea teoriei moderne a sistemelor dinamice. Deși în prezent multe dintre astfel de reacții sunt deja înțelese, totuși, cauzele care provoacă procese chimice oscilatorii rămân neclare până la sfârșit.
În prezent, cinetica reacțiilor oscilatorii este o ramură a cunoștințelor care se dezvoltă rapid, care a apărut la intersecția dintre chimie, biologie, medicină, fizică și matematică. A fost foarte interesant pentru mine să fac cunoștință cu proprietăți atât de neobișnuite și, la prima vedere, imposibile ale materiei vii. Dar și mai mult am fost uimit de faptul că o descoperire atât de incredibilă în semnificația sa, impresionantă timp de mulți ani nu a fost percepută de alții și pur și simplu nu a fost înțeleasă de marile minți ale acelei vremuri. Această descoperire a trecut prin calea ei spinoasă și, în cele din urmă, și-a luat locul cuvenit în știința mondială. Și însăși posibilitatea unei astfel de reacții dovedește încă o dată că în lumea noastră există încă o mulțime de necunoscute și neexplorate.
Aplicație.
Rețete pentru unele reacții oscilatorii
Reteta 1: Este necesar să se pregătească soluții din următoarele substanțe pe baza concentrațiilor lor finale: acid malonic 0,2 M; bromat de sodiu 0,3 M; acid sulfuric 0,3 M; feroina 0,005 M. Feroina poate fi înlocuită cu mangan divalent sau sulfat de ceriu trivalent, dar intensitatea culorii va fi mult mai slabă. Aproximativ 5 ml dintr-o soluție din toate componentele trebuie turnați într-un vas Petri, astfel încât grosimea stratului de lichid să fie de 0,5-1 mm. După 3-8 minute (perioada de tranziție), se pot observa oscilații și unde chimice.
Reteta 2: Turnați următoarele soluții într-o cuvă plată transparentă în straturi (1 ml):
- KBrO 3(0,2 mol/l)
- acid malonic (0,3 mol/l)
- feroină (0,003 mol/l)
- H2S04(0,3 mol/l)
Așezați cuva pe o foaie de hârtie albă. Viteza de reacție poate fi modificată prin adăugarea de alcali sau acid.
Reteta 3: Solutii necesare:
- acid citric (40 g în 160 ml H2O)
- H2SO4 (1:3).
Și, de asemenea, spânzurătoare:
- KBrO 3(16 g)
- Ce 2 (SO 4) 3(3-3,5 g)
Se încălzește o soluție de acid citric la 40°-50° C, apoi se toarnă o probă de KBrO 3 . Se pune paharul pe o foaie de hârtie albă și se adaugă o probă de Ce 2 (SO 4) 3 și câțiva ml de H 2 SO 4. Alternarea culorilor începe imediat să apară: galben > incolor > galben, cu o perioadă de 1-2 minute.
Rețeta 4: Solutii necesare:
- H2O2(50 ml 30%)
- KIO 3(7,17 g în 50 ml H2O)
- HCIO4(30 ml soluție diluată)
- acid malonic (3 g în 50 ml H 2 O). Și umerase:
-MnSO4(1 g) și niște amidon.
Se toarnă totul într-un pahar (200-250 ml), se adaugă porții cântărite, se amestecă cu o baghetă de sticlă. Există o alternanță de culoare: incolor > galben > albastru.
Bibliografie.
1. Aliev R., Shnol S. E. „Reacții chimice oscilatorii”. Cinetică și cataliză. 1998. Nr 3. S. 130-133.
2. Shnol S.E. Cunoașterea este Putere. 1994. Nr 3. S. 62-71.
3. Zhabotinsky A. M. Autooscilații de concentrare. Moscova: Nauka, 1974.
4. Garel D., Garel O. Reacții chimice vibraționale / Per. din engleza. M.:
5. Dubnishcheva T. Ya. Concepte ale științelor naturale moderne. Novosi-
birsk: YuKEA, 1997, p. 683 – 697.
6. Concepte ale științelor naturale moderne. Ed. V. N. Lavrinenko,
V. P. Ratnikova, M.: UNITI-DANA, 1999, S. 78 - 87.
7. Vavilin B.V. „Auto-oscilații în sistemele chimice în fază lichidă”.
Priroda, 2000, Nr. 5, p. 19 – 25.
REACȚII VIBRAȚIONALE- o clasă de reacții periodice redox. Mecanismul de reacție este similar cu cel al unui dispozitiv de blocare de reținere. Pentru prima dată astfel de reacții au fost descoperite în 1951 de chimistul moscovit B.P. Belousov.
Reacțiile oscilatorii au loc cu participarea unui catalizator (pentru prima dată acest lucru a fost descoperit în cursul unei reacții în prezența ionilor de ceriu) și constau de obicei în două etape.
Condiții necesare pentru apariția unor astfel de reacții:
a) viteza primei trepte trebuie să depășească semnificativ viteza celei de-a doua trepte;
b) la a doua etapă ar trebui să apară un compus care inhibă cursul primei etape (se numește inhibitor).
O reacție similară poate fi observată atunci când se amestecă soluții apoase de sare de ceriu (III) (de exemplu, sulfat de ceriu), bromat de potasiu KBrO 3 și acid bromomalonic HO (O) C - CH (Br) - C (O) OH. Masa de reacție este acidulată cu acid sulfuric.
În prima etapă, ionul de ceriu trivalent (care a apărut în timpul disocierii sării de ceriu) este redus de anionul bromat (este furnizat de bromatul de potasiu). În acest caz, ionul Ce(III) este oxidat la Ce(IV), care este vizibil extern prin schimbarea culorii soluției de reacție - ionii Ce(III) într-o soluție apoasă sunt incolori și Ce(IV) sunt galbene.
10Ce 3+ + 2BrO 3 – + 12H + = 10Ce 4+ + Br 2 + 6H 2 O (I)
În următoarea etapă, ionul Ce (IV) rezultat reacționează cu acidul bromomalonic, oxidându-l:
4Ce 4+ + HO(O)C – CH(Br) – C(O)OH + 2H 2 O =
4Ce 3+ + HC(O)OH + 2CO 2 + 5H + + Br - (II)
În acest caz, ceriul devine din nou ionul Ce (III) și poate participa din nou la reacția I. În acest caz, joacă rolul unui catalizator tipic, participă la reacție, dar nu este consumat, cu toate acestea, reacția nu va procedați fără el. În timpul reacției se consumă bromatul de potasiu și acidul bromomalonic, ceriul nu transferă decât electroni de la un reactiv la altul (reactivii de pornire sunt marcați cu negru, iar produsele de reacție sunt în roșu):
Particularitatea acestei reacții este că în stadiul II, anionul brom Br – . Inhibă, adică inhibă stadiul I, dar nu afectează stadiul II. Ca urmare, produsele din stadiul II, în primul rând ionii Ce 3+, se acumulează în sistemul de reacție. La un moment dat, când acești ioni se acumulează în cantități mari, ionii de brom nu mai pot inhiba stadiul I și se desfășoară într-un ritm ridicat. Ionii Ce(IV) reapar în sistem și apoi participă la etapa II lentă. Astfel, ionii de brom joacă rolul unui declanșator care împiedică pornirea primei etape până la un anumit punct. În exterior, arată așa (ionii Ce(III) într-o soluție apoasă sunt incolori, iar Ce(IV) sunt galbeni): masa de reacție devine instantaneu galbenă și apoi încet devine incoloră (Fig. 4, paharul nr. 1) . Culoarea se schimbă aproximativ la fiecare minut și jumătate, intervalul de timp rămâne neschimbat timp de câteva ore. Dacă adăugați treptat reactivi consumabili, atunci un astfel de „ceas chimic” va funcționa foarte mult timp. Pe măsură ce temperatura crește, ciclul de timp al răspunsului oscilator se scurtează.
Există și alte exemple de reacții oscilatorii. În sistemul descris mai sus, ionii de ceriu pot fi înlocuiți cu ioni de fier. Pentru aceasta, se folosește un complex de sulfat de Fe (II) cu trei molecule de fenantrolină, care este colorat în roșu într-o soluție apoasă (acest complex este utilizat pe scară largă pentru determinarea cantitativă a fierului):
Un complex similar de Fe(III), care apare ca urmare a oxidării, este colorat în albastru; în cursul reacției, culoarea albastră devine instantaneu roșie, care se transformă treptat din nou în albastru (Fig. 4, paharul nr. 2) .
Dacă înlocuim acidul bromomalonic cu citric [HOC(O)CH 2 ] 2 C(OH)C(O)OH, atunci în prezența cantităților catalitice de săruri de mangan apare un sistem în care culoarea pulsa la fiecare două minute (Fig. 4, pahar nr. 3). Acid oxal-acetic HOC(O)CH2C(O)C(O)OH cu săruri de ceriu numără intervale de șase secunde (sticlă nr. 4). Intervalele de timp din figura animată sunt afișate condiționat, cel mai lung interval de schimbare a culorii este în sticla nr. 3, cel mai mic este în sticla nr. 4
La scurt timp după descoperirea unor astfel de reacții, a fost posibil să se stabilească că astfel de procese sunt destul de comune. Ca urmare, a fost dezvoltată o teorie generală a proceselor oscilatorii, care includ unele reacții în fază gazoasă (de exemplu, oxidarea hidrocarburilor), oxidarea heterofazică a monoxidului de carbon, hidrogen, amoniac, etilenă pe catalizatori metalici și o serie de polimerizări. proceselor. Reacțiile oscilatorii determină cursul unora dintre cele mai importante procese biologice: generarea impulsurilor nervoase și mecanismul contracției musculare.
Mihail Levitsky