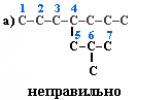
Selectați lanțul de carbon principal din moleculă. În primul rând, trebuie să fie cel mai lung. În al doilea rând, dacă există două sau mai multe lanțuri de aceeași lungime, atunci cel mai ramificat este selectat dintre ele. De exemplu, într-o moleculă există 2 lanțuri cu același număr (7) de atomi de C (evidențiate în culoare):
În cazul (a), lanțul are 1 substituent, iar în cazul (b), are 2. Prin urmare, ar trebui aleasă opțiunea (b).
1. Numerotați atomii de carbon din lanțul principal astfel încât atomii de C asociați cu substituenții să primească cele mai mici numere posibile. Prin urmare, numerotarea începe de la capătul lanțului cel mai apropiat de ramură. De exemplu:

Numiți toți radicalii (substituenții), indicând în față numerele care indică locația lor în lanțul principal. Dacă există mai mulți substituenți identici, atunci pentru fiecare dintre aceștia se scrie un număr (locație) separat prin virgulă, iar numărul lor este indicat prin prefixe di-, Trei-, tetra-, penta- etc. (De exemplu, 2,2-dimetil sau 2,3,3,5-tetrametil).
Numele tuturor substituenților sunt aranjate în ordine alfabetică (conform celor mai recente reguli IUPAC).
Numiți lanțul principal de atomi de carbon, adică. alcanul normal corespunzător.
Astfel, în numele unui alcan ramificat, rădăcina + sufixul este numele unui alcan normal (cifra grecească + sufixul „an”), prefixele sunt numere și denumiri ale radicalilor de hidrocarburi. Exemplu de construcție a numelui:

Chim. Sf. alcaniCracarea alcanilor. Cracarea este un proces de descompunere termică a hidrocarburilor, care se bazează pe reacțiile de scindare a lanțului de carbon al moleculelor mari cu formarea de compuși cu un lanț mai scurt. Izomerizarea alcanilor Alcanii cu structură normală sub influența catalizatorilor și atunci când sunt încălziți sunt capabili să se transforme în alcani ramificați fără a modifica compoziția moleculelor, de exemplu. intră în reacţii de izomerizare. Aceste reacții implică alcani ale căror molecule conțin cel puțin 4 atomi de carbon. De exemplu, izomerizarea n-pentanului la izopentan (2-metilbutan) are loc la 100°C în prezența unui catalizator de clorură de aluminiu:
 Materialul de pornire și produsul reacției de izomerizare au aceleași formule moleculare și sunt izomeri structurali (izomeria scheletului de carbon).
Materialul de pornire și produsul reacției de izomerizare au aceleași formule moleculare și sunt izomeri structurali (izomeria scheletului de carbon).
Dehidrogenarea alcanilor
Când alcanii sunt încălziți în prezența catalizatorilor (Pt, Pd, Ni, Fe, Cr 2 O 3 , Fe 2 O 3 , ZnO), cataliticul lor dehidrogenare– separarea atomilor de hidrogen din cauza ruperii legăturilor C-H.
Structura produșilor de dehidrogenare depinde de condițiile de reacție și de lungimea lanțului principal din molecula de alcan inițială.
1. Alcanii inferiori care conțin de la 2 până la 4 atomi de carbon în lanț, atunci când sunt încălziți pe un catalizator Ni, despart hidrogenul din vecine atomi de carbon și se transformă în alchene:
Împreună cu butenă-2 această reacție produce butenă-1 CH 2 \u003d CH-CH 2 -CH 3. În prezența unui catalizator Cr 2 O 3 /Al 2 O 3 la 450-650 С din n-se primeste si butan butadienă-1,3 CH2=CH-CH=CH2.
2. Pentru obţinere se folosesc alcani care conţin mai mult de 4 atomi de carbon în lanţul principal ciclic conexiuni. În același timp, se întâmplă dehidrociclizare- reacția de dehidrogenare, care duce la închiderea lanțului într-un ciclu stabil.
Dacă lanțul principal al unei molecule de alcan conține 5 (dar nu mai mulți) atomi de carbon ( n-pentanul și derivații săi alchil), apoi, atunci când sunt încălziți peste un catalizator Pt, atomii de hidrogen sunt separați de atomii terminali ai lanțului de carbon și se formează un ciclu cu cinci membri (ciclopentan sau derivații săi):

Alcanii cu un lanț principal de 6 sau mai mulți atomi de carbon intră și ei în reacția de dehidrociclizare, dar formează întotdeauna un ciclu cu 6 membri (ciclohexan și derivații săi). În condițiile de reacție, acest ciclu suferă o dehidrogenare suplimentară și se transformă într-un ciclu benzenic mai stabil din punct de vedere energetic al unei hidrocarburi aromatice (arenă). De exemplu:

Aceste reacții stau la baza procesului reformare– prelucrarea produselor petroliere în vederea obținerii de arene ( aromatizare hidrocarburi saturate) si hidrogen. transformare n- alcanii din arene duce la îmbunătățirea rezistenței la detonare a benzinei.
Institutul Tehnologic de Stat din Sankt Petersburg
(Universitate tehnica)
Departamentul de Chimie Organică Facultatea 4
Grupa 476
Lucrări de curs
Oxidarea alchenei
Student……………………………………… Rytina A.I.
Lector………………………………………... Piterskaya Yu.L.
Saint Petersburg
Introducere
1. Epoxidare (reacție de N.A. Prilezhaev, 1909)
2. Hidroxilare
2.1anti-Hidroxilare
2.2sin-Hidroxilare
3. Scindarea oxidativă a alchenelor
4.Ozonoliza
5. Oxidarea alchenelor în prezența sărurilor de paladiu
Concluzie
Lista surselor utilizate
Introducere
Oxidarea este una dintre cele mai importante și răspândite transformări ale compușilor organici.
În chimia organică, oxidarea este înțeleasă ca procese care duc la epuizarea unui compus în hidrogen sau la îmbogățirea acestuia în oxigen. În acest caz, electronii sunt îndepărtați din moleculă. Prin urmare, reducerea este înțeleasă ca desprinderea dintr-o moleculă de oxigen organic sau adăugarea de hidrogen la aceasta.
În reacțiile redox, agenții de oxidare sunt compuși cu o mare afinitate electronică (electrofili), iar agenții reducători sunt compuși care au tendința de a dona electroni (nucleofili). Ușurința de oxidare a unui compus crește odată cu creșterea nucleofilității sale.
În timpul oxidării compușilor organici, de regulă, nu are loc un transfer complet de electroni și, în consecință, o schimbare a valenței atomilor de carbon. Prin urmare, conceptul de grad de oxidare - sarcina condiționată a unui atom dintr-o moleculă, calculată pe baza presupunerii că molecula constă numai din ioni - este doar condiționată, formală.
La compilarea ecuațiilor reacțiilor redox, este necesar să se determine agentul reducător, agentul de oxidare și numărul de electroni dați și primiți. De regulă, coeficienții sunt selectați folosind metoda echilibrului electron-ion (metoda semireacției).
Această metodă are în vedere trecerea electronilor de la un atom sau ion la altul, ținând cont de natura mediului (acid, alcalin sau neutru) în care are loc reacția. Pentru a egaliza numărul de atomi de oxigen și hidrogen, se introduc fie molecule de apă și protoni (dacă mediul este acid), fie molecule de apă și ioni de hidroxid (dacă mediul este alcalin).
Astfel, la scrierea semireacțiilor de reducere și oxidare, trebuie să se procedeze de la compoziția ionilor prezenți efectiv în soluție. Substanțele care sunt slab disociate, slab solubile sau care au evoluat sub formă de gaz trebuie scrise în formă moleculară.
Ca exemplu, luați în considerare procesul de oxidare a etilenei cu o soluție apoasă diluată de permanganat de potasiu (reacția Wagner). În timpul acestei reacții, etilena este oxidată la etilenglicol, iar permanganatul de potasiu este redus la dioxid de mangan. La locul dublei legături se adaugă doi hidroxili:
3C 2 H 4 + 2KMnO 4 + 4H 2 O → 3C 2 H 6 O 2 + 2MnO 2 + 2KOH
Semireacția de reducere: MnO 4 ¯ + 2H 2 O + 3 e→ MnO 2 + 4OH ¯ 2Semireacția de oxidare: C 2 H 4 + 2OH − − 2 e → C2H6O23
În sfârșit, avem în formă ionică:
2MnO 4 ¯ + 4H 2 O + 3C 2 H 4 + 6OH ¯ → 2MnO 2 + 8OH ¯ + 3C 2 H 6 O 2
După efectuarea reducerilor necesare ale termenilor similari, scriem ecuația în formă moleculară:
3C 2 H 4 + 2KMnO 4 + 4 H 2 O \u003d 3C 2 H 6 O 2 + 2MnO 2 + 2KOH.
Caracterizarea unor oxidanţi
Oxigen
Oxigenul aerului este utilizat pe scară largă în procesele tehnologice, deoarece este cel mai ieftin agent oxidant. Dar oxidarea cu oxigen din aer este plină de dificultăți asociate cu controlul procesului, care se desfășoară în diferite direcții. Oxidarea este de obicei efectuată la temperatură ridicată în prezența catalizatorilor.
Ozon
Ozonul O 3 este folosit pentru a obține aldehide și cetone, dacă este dificil să le obțină în alte moduri. Cel mai adesea, ozonul este folosit pentru a stabili structura compușilor nesaturați. Ozonul este produs prin acțiunea unei descărcări electrice liniștite asupra oxigenului. Unul dintre avantajele semnificative ale ozonării, în comparație cu clorinarea, este absența toxinelor după tratament.
Permanganat de potasiu
Permanganatul de potasiu este cel mai des folosit agent oxidant. Reactivul este solubil în apă (6,0% la 20ºC), precum și în metanol, acetonă și acid acetic. Pentru oxidare se folosesc soluții apoase (uneori acetonă) de KMnO 4 într-un mediu neutru, acid sau alcalin. Când se desfășoară procesul într-un mediu neutru, în masa de reacție se adaugă săruri de magneziu, aluminiu sau se trece dioxid de carbon pentru a neutraliza hidroxidul de potasiu eliberat în timpul reacției. Reacția de oxidare a KMnO 4 într-un mediu acid se realizează cel mai adesea în prezența acidului sulfuric. Mediul alcalin în timpul oxidării este creat de KOH format în timpul reacției sau este adăugat inițial la masa de reacție. În medii ușor alcaline și neutre, KMnO 4 se oxidează conform ecuației:
KMnO4+ 3 e+ 2H 2 O \u003d K + + MnO 2 + 4OH ¯
într-un mediu acid:
KMnO4+ 5 e+ 8H + = K + + Mn2+ + 4H2O
Permanganatul de potasiu este utilizat pentru a obține 1,2-dioli din alchene, în oxidarea alcoolilor primari, aldehidelor și alchilarenelor la acizi carboxilici și, de asemenea, pentru scindarea oxidativă a scheletului de carbon la legături multiple.
În practică, se utilizează de obicei un exces destul de mare (mai mult de 100%) de KMnO4. Acest lucru se datorează faptului că, în condiții normale, KMnO 4 se descompune parțial în dioxid de mangan odată cu eliberarea de O 2 . Se descompune exploziv cu H2SO4 concentrat când este încălzit în prezența agenților reducători; amestecurile de permanganat de potasiu cu substanțe organice sunt de asemenea explozive.
Peracide
Acizii peracetic și performic se obțin prin reacția 25-90% peroxid de hidrogen cu acidul carboxilic corespunzător, conform următoarei reacții:
RCOOH + H2O2 \u003d RCOOH + H2O
În cazul acidului acetic, acest echilibru se stabilește relativ lent, iar acidul sulfuric este de obicei adăugat ca catalizator pentru a accelera formarea peracidului. Acidul formic este suficient de puternic singur pentru a asigura un echilibru rapid.
Acidul pertrifluoracetic, obținut în amestec cu acidul trifluoracetic prin reacția anhidridei trifluoracetice cu peroxid de hidrogen 90%, este un agent oxidant și mai puternic. În mod similar, acidul peracetic poate fi obținut din anhidridă acetică și peroxid de hidrogen.
Solid m-acid cloroperbenzoic, deoarece este relativ sigur de manevrat, destul de stabil si poate fi depozitat o perioada indelungata.
Oxidarea are loc din cauza atomului de oxigen eliberat:
RCOOH = RCOOH + [O]
Peracizii sunt utilizați pentru a obține epoxizi din alchene, precum și lactone din cetone aliciclice.
Apă oxigenată
Peroxidul de hidrogen este un lichid incolor, miscibil cu apa, etanol si dietil eter. O soluție 30% de H 2 O 2 se numește perhidrol. Un preparat foarte concentrat poate reacționa exploziv cu substanțele organice. La depozitare, se descompune în oxigen și apă. Persistența peroxidului de hidrogen crește odată cu diluarea. Pentru oxidare se folosesc soluții apoase de diferite concentrații (de la 3 la 90%) în medii neutre, acide sau alcaline.
H 2 O 2 \u003d H 2 O + [O]
Prin acțiunea acestui reactiv asupra compușilor carbonilici α,β-nesaturați în mediu alcalin se obțin epoxialdehidele și cetonele corespunzătoare, peracizii sunt sintetizați prin oxidarea acizilor carboxilici în mediu acid. O soluție de 30% de H 2 O 2 în acid acetic oxidează alchenele la 1,2-dioli. Peroxidul de hidrogen este utilizat: pentru a obține peroxizi organici și anorganici, perborat de Na și percarbonat; ca agent oxidant în combustibilii pentru rachete; la primirea epoxizilor, hidrochinonă, pirocatecol, etilen glicol, glicerină, acceleratori de vulcanizare ai grupării tioram etc.; pentru albire uleiuri, grăsimi, blană, piele, materiale textile, hârtie; pentru curățarea materialelor semiconductoare cu germaniu și siliciu; ca dezinfectant pentru neutralizarea apelor uzate menajere si industriale; în medicină; ca sursă de O 2 în submarine; H 2 O 2 face parte din reactivul Fenton (Fe 2 + + H 2 O 2), care este folosit ca sursă de radicali liberi OH în sinteza organică.
Tetroxizi de ruteniu și osmiu
Tetroxidul de osmiu OsO4 este o pulbere albă până la galben pal cu p.t. 40,6ºС; t. kip. 131,2ºС. Se sublimează deja la temperatura camerei, solubil în apă (7,47 g în 100 ml la 25ºС), СCl 4 (250 g în 100 g solvent la 20ºС). În prezența compușilor organici, devine negru datorită reducerii la OsO2.
RuO 4 este o prismă galben-aurie cu așa pl. 25,4ºС, sublimează vizibil la temperatura camerei. Puțin solubil în apă (2,03 g în 100 ml la 20ºС), foarte solubil în CCl 4 . Un agent oxidant mai puternic decât OsO4. Peste 100ºС explodează. La fel ca tetroxidul de osmiu, are toxicitate ridicată și costuri ridicate.
Acești agenți oxidanți sunt utilizați pentru oxidarea alchenelor la α-glicoli în condiții blânde.
În reacțiile redox, substanțe organice mai des prezintă proprietățile agenților reducători, în timp ce ei înșiși sunt oxidați. Ușurința oxidării compușilor organici depinde de disponibilitatea electronilor atunci când interacționează cu un agent oxidant. Toți factorii cunoscuți care provoacă o creștere a densității electronilor în moleculele compușilor organici (de exemplu, efecte inductive și mezorice pozitive) vor crește capacitatea acestora de a se oxida și invers.
Tendința compușilor organici de a se oxida crește odată cu creșterea lor nucleofilitate, care corespunde următoarelor rânduri:
Creșterea nucleofilității în serie
Considera reacții redox reprezentanţi ai celor mai importante clase materie organică cu unii agenţi oxidanţi anorganici.
Oxidarea alchenei
Cu oxidare ușoară, alchenele sunt transformate în glicoli (alcooli dihidroxilici). Atomii reducători din aceste reacții sunt atomi de carbon legați printr-o legătură dublă.
Reacția cu o soluție de permanganat de potasiu are loc într-un mediu neutru sau ușor alcalin, după cum urmează:
3C 2 H 4 + 2KMnO 4 + 4H 2 O → 3CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH
În condiții mai severe, oxidarea duce la ruperea lanțului de carbon la dubla legătură și formarea a doi acizi (în mediu puternic alcalin, două săruri) sau a unui acid și dioxid de carbon (în mediu puternic alcalin, o sare și un carbonat):
1) 5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O
2) 5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O
3) CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 10KOH → CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 8K 2 MnO 4
4) CH 3 CH \u003d CH 2 + 10KMnO 4 + 13KOH → CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4
Bicromatul de potasiu într-un mediu cu acid sulfuric oxidează alchenele în mod similar reacțiilor 1 și 2.
În timpul oxidării alchenelor, în care atomii de carbon din legătura dublă conțin doi radicali de carbon, se formează două cetone:


Oxidarea alchinelor
Alchinele oxidează în condiții puțin mai severe decât alchenele, așa că de obicei se oxidează cu tripla legătură care rupe lanțul de carbon. Ca și în cazul alchenelor, atomii reducători de aici sunt atomi de carbon legați printr-o legătură multiplă. Ca rezultat al reacțiilor, se formează acizi și dioxid de carbon. Oxidarea poate fi efectuată cu permanganat sau dicromat de potasiu într-un mediu acid, de exemplu:
5CH 3 C≡CH + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O

Acetilena poate fi oxidată cu permanganat de potasiu într-un mediu neutru până la oxalat de potasiu:
3CH≡CH +8KMnO 4 → 3KOOC –COOK +8MnO 2 +2KOH +2H 2O
Într-un mediu acid, oxidarea se duce la acid oxalic sau dioxid de carbon:
5CH≡CH + 8KMnO 4 + 12H 2 SO 4 → 5HOOC -COOH + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
CH≡CH + 2KMnO 4 + 3H 2 SO 4 → 2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
Oxidarea omologilor benzenului
Benzenul nu se oxidează chiar și în condiții destul de dure. Omologii benzenului pot fi oxidați cu o soluție de permanganat de potasiu într-un mediu neutru până la benzoat de potasiu:
C 6 H 5 CH 3 + 2KMnO 4 → C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O
C 6 H 5 CH 2 CH 3 + 4KMnO 4 → C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH
Oxidarea omologilor benzenului cu dicromat sau permanganat de potasiu într-un mediu acid duce la formarea acidului benzoic.
5C 6 H 5 CH 3 + 6KMnO 4 +9 H 2 SO 4 → 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O


Oxidarea alcoolului
Produșii direcți ai oxidării alcoolilor primari sunt aldehidele, în timp ce cei ai alcoolilor secundari sunt cetonele.
Aldehidele formate în timpul oxidării alcoolilor se oxidează cu ușurință în acizi; prin urmare, aldehidele din alcoolii primari se obțin prin oxidare cu dicromat de potasiu în mediu acid la punctul de fierbere al aldehidei. Evaporându-se, aldehidele nu au timp să se oxideze.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O
Cu un exces de agent de oxidare (KMnO4, K2Cr2O7) în orice mediu, alcoolii primari sunt oxidați la acizi carboxilici sau sărurile acestora, iar alcoolii secundari la cetone.
5C 2 H 5 OH + 4KMnO 4 + 6H 2 SO 4 → 5CH 3 COOH + 4MnSO 4 + 2K 2 SO 4 + 11H 2 O
3CH 3 -CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CH 3 -COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
Alcoolii terțiari nu sunt oxidați în aceste condiții, dar alcoolul metilic este oxidat la dioxid de carbon.

Alcoolul dihidroxilic, etilenglicolul HOCH 2 -CH 2 OH, când este încălzit într-un mediu acid cu o soluție de KMnO 4 sau K 2 Cr 2 O 7, se oxidează ușor la acid oxalic, iar în neutru la oxalat de potasiu.
5CH 2 (OH) - CH 2 (OH) + 8KMnO 4 + 12H 2 SO 4 → 5HOOC -COOH + 8MnSO 4 + 4K 2 SO 4 + 22H 2 O
3CH 2 (OH) - CH 2 (OH) + 8KMnO 4 → 3KOOC - COOK + 8MnO 2 + 2KOH + 8H 2 O
Oxidarea aldehidelor și cetonelor
Aldehidele sunt agenți reducători destul de puternici și, prin urmare, sunt ușor oxidați de diferiți agenți oxidanți, de exemplu: KMnO 4, K 2 Cr 2 O 7, OH, Cu (OH) 2. Toate reacțiile au loc când sunt încălzite:
3CH 3 CHO + 2KMnO 4 → CH 3 COOH + 2CH 3 COOK + 2MnO 2 + H 2O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2KMnO 4 + 3KOH → CH 3 COOK + 2K 2 MnO 4 + 2H 2 O
5CH 3 CHO + 2KMnO 4 + 3H 2 SO 4 → 5CH 3 COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O
CH 3 CHO + Br 2 + 3NaOH → CH 3 COONa + 2NaBr + 2H 2 O

reacția oglinzii argintii
Cu o soluție de amoniac de oxid de argint, aldehidele sunt oxidate la acizi carboxilici, care dau săruri de amoniu într-o soluție de amoniac (reacție „oglindă de argint”):
CH 3 CH \u003d O + 2OH → CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
CH 3 -CH \u003d O + 2Cu (OH) 2 → CH 3 COOH + Cu 2 O + 2H 2 O
Aldehida formică (formaldehida) este oxidată, de regulă, la dioxid de carbon:
5HCOH + 4KMnO4 (colibă) + 6H 2 SO 4 → 4MnSO 4 + 2K 2 SO 4 + 5CO 2 + 11H 2 O
3CH 2 O + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CO 2 + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
HCHO + 4OH → (NH 4) 2 CO 3 + 4Ag↓ + 2H 2 O + 6NH 3
HCOH + 4Cu(OH) 2 → CO 2 + 2Cu 2 O↓+ 5H 2 O
Cetonele sunt oxidate în condiții severe de agenți oxidanți puternici cu ruperea legăturilor C-C și dau amestecuri de acizi:

acizi carboxilici. Dintre acizi, acizii formic și oxalici au proprietăți reducătoare puternice, care se oxidează la dioxid de carbon.
HCOOH + HgCl 2 \u003d CO 2 + Hg + 2HCl
HCOOH + Cl 2 \u003d CO 2 + 2HCl
HOOC-COOH + Cl 2 \u003d 2CO 2 + 2HCl
Acid formic, pe lângă proprietățile acide, prezintă și unele proprietăți ale aldehidelor, în special, reducătoare. Apoi este oxidat la dioxid de carbon. De exemplu:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
Când este încălzit cu agenți puternici de deshidratare (H2SO4 (conc.) sau P4O10) se descompune:
HCOOH →(t)CO + H2O
Oxidarea catalitică a alcanilor:

Oxidarea catalitică a alchenelor:

Oxidarea fenolului:


Întocmirea ecuațiilor reacțiilor redox care implică substanțe organice
ÎNÎn legătură cu introducerea examenului unificat de stat (USE) ca unică formă de certificare finală a absolvenților de liceu și trecerea liceului la învățământul de specialitate, pregătirea elevilor de liceu pentru cele mai „costisitoare” sarcini în ceea ce privește punctele din partea „C” a testului USE în chimie devin din ce în ce mai importante. În ciuda faptului că cele cinci sarcini din partea „C” sunt considerate diferite: proprietățile chimice ale substanțelor anorganice, lanțurile de transformări ale compușilor organici, sarcinile de calcul, toate acestea sunt într-o oarecare măsură legate de reacțiile redox (ORD). Dacă cunoștințele de bază ale teoriei OVR sunt stăpânite, atunci este posibil să finalizați corect prima și a doua sarcină în întregime, iar a treia - parțial. În opinia noastră, o parte semnificativă a succesului în implementarea părții „C” constă tocmai în aceasta. Experiența arată că, dacă, studiind chimia anorganică, studenții fac față suficient de bine sarcinilor de scriere a ecuațiilor OVR, atunci sarcini similare din chimia organică le provoacă mari dificultăți. Prin urmare, pe parcursul studiului întregului curs de chimie organică la clase de specialitate, încercăm să dezvoltăm la elevii de liceu abilitățile de compilare a ecuațiilor OVR.
Când studiem caracteristicile comparative ale compușilor anorganici și organici, introducem studenților utilizarea stării de oxidare (s.o.) (în chimia organică, în primul rând carbonul) și metodele de determinare a acesteia:
1) calculul mediei s.d. carbon într-o moleculă de materie organică;
2) definiția s.d. fiecare atom de carbon.
Lămurim în ce cazuri este mai bine să folosiți una sau alta metodă.
Articolul a fost publicat cu sprijinul companiei „GEO-Engineering”, care prezintă produse pe piață sub marca „ProfKresla”. Domeniul de activitate al firmei il reprezinta productia, comercializarea si montajul de fotolii si scaune pentru diverse hale. Profesionalismul ridicat al angajaților și facilitățile proprii de producție ne permit să implementăm rapid și eficient proiecte de orice complexitate. Toate produsele sub marca ProfKresla, fie că este vorba de scaune de teatru, scaune pentru săli de așteptare sau scaune pentru instituții de învățământ, se disting printr-un design modern și ergonomic, precum și prin rezistență ridicată la uzură, rezistență și confort. Din gama uriașă de produse prezentate în catalogul de pe site-ul profkresla.ru, puteți alege oricând modele care se potrivesc cel mai bine stilului corporativ adoptat în compania dumneavoastră. Dacă mai aveți dificultăți la alegere, atunci specialiștii companiei sunt întotdeauna gata să dea sfaturi, să ajute la determinarea modelului și apoi să pregătească un proiect, să facă toate măsurătorile și instalarea la fața locului.
P Când studiem subiectul „Alcani”, arătăm că procesele de oxidare, ardere, halogenare, nitrare, dehidrogenare și descompunere sunt procese redox. Când scrieți ecuațiile pentru reacțiile de ardere și descompunere a substanțelor organice, este mai bine să folosiți valoarea medie a s.d. carbon. De exemplu:
Atenție la prima jumătate a balanței electronice: la atomul de carbon în valoarea fracționată a s.d. numitorul este 4, deci calculăm transferul de electroni folosind acest coeficient.
În alte cazuri, atunci când studiem subiectul „Alcani”, determinăm valorile s.d. fiecare atom de carbon din compus, în timp ce atrage atenția elevilor asupra secvenței de substituție a atomilor de hidrogen la atomii de carbon primari, secundari și terțiari:


Astfel, aducem elevii la concluzia că la început procesul de substituție are loc la terțiar, apoi la secundar și, în sfârșit, la atomii de carbon primari.
P Când studiem tema „Alchenele”, avem în vedere procesele de oxidare în funcție de structura alchenei și a mediului de reacție.
Când alchenele sunt oxidate cu o soluție concentrată de permanganat de potasiu KMnO 4 într-un mediu acid (oxidare dură), legăturile - și - se rup cu formarea de acizi carboxilici, cetone și monoxid de carbon (IV). Această reacție este utilizată pentru a determina poziția dublei legături.
Dacă legătura dublă este la sfârșitul moleculei (de exemplu, în buten-1), atunci unul dintre produșii de oxidare este acidul formic, care se oxidează ușor la dioxid de carbon și apă:

Subliniem că dacă în molecula de alchenă atomul de carbon de la legătura dublă conține doi substituenți de carbon (de exemplu, în molecula de 2-metilbutenă-2), atunci în timpul oxidării sale se formează o cetonă, deoarece transformarea unui astfel de atom într-un atom al grupării carboxil este imposibil fără ruperea legăturii C-C, relativ stabilă în aceste condiții:

Clarificăm că dacă molecula de alchenă este simetrică și legătura dublă este conținută în mijlocul moleculei, atunci se formează un singur acid în timpul oxidării:

Raportăm că o caracteristică a oxidării alchenelor, în care atomii de carbon din legătura dublă conțin doi radicali de carbon, este formarea a două cetone:


Având în vedere oxidarea alchenelor în medii neutre sau ușor alcaline, concentrăm atenția elevilor de liceu asupra faptului că, în astfel de condiții, oxidarea este însoțită de formarea de dioli (alcooli dihidroxilici), iar grupărilor hidroxil sunt atașate acelor atomi de carbon. între care a existat o dublă legătură:

ÎNÎn mod similar, luăm în considerare oxidarea acetilenei și a omologilor ei, în funcție de mediul în care are loc procesul. Deci, clarificăm că într-un mediu acid, procesul de oxidare este însoțit de formarea acizilor carboxilici:

Reacția este utilizată pentru a determina structura alchinelor prin produși de oxidare:

În medii neutre și ușor alcaline, oxidarea acetilenei este însoțită de formarea oxalaților corespunzători (săruri ale acidului oxalic), iar oxidarea omologilor este însoțită de ruperea triplei legături și formarea sărurilor acizilor carboxilici:

ÎN Toate regulile sunt elaborate cu elevii pe exemple specifice, ceea ce duce la o mai bună asimilare a materialului teoretic. Prin urmare, atunci când studiază oxidarea arenelor în diferite medii, studenții pot face în mod independent presupuneri că într-un mediu acid ar trebui să se aștepte la formarea acizilor, iar într-un mediu alcalin, a sărurilor. Profesorul va trebui doar să clarifice ce produse de reacție se formează în funcție de structura arenei corespunzătoare.
Arătăm prin exemple că omologii benzenului cu un lanț lateral (indiferent de lungimea sa) sunt oxidați de un agent oxidant puternic la acid benzoic la atomul de carbon. Omologii de benzen, atunci când sunt încălziți, sunt oxidați de permanganat de potasiu într-un mediu neutru pentru a forma săruri de potasiu ale acizilor aromatici.
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 \u003d 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 \u003d 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 -CH 3 + 2KMnO 4 \u003d C 6 H 5 COOK + 2MnO 2 + KOH + H 2O.
Subliniem că, dacă există mai multe lanțuri laterale într-o moleculă de arenă, atunci într-un mediu acid fiecare dintre ele este oxidată la un atom de carbon a la o grupare carboxil, rezultând formarea acizilor aromatici polibazici:

P Abilitățile dobândite în compilarea ecuațiilor OVR pentru hidrocarburi le permit să fie utilizate în studiul secțiunii „Compuși care conțin oxigen”.
Deci, atunci când studiază subiectul „Alcooli”, elevii compun independent ecuațiile pentru oxidarea alcoolilor, folosind următoarele reguli:
1) alcoolii primari sunt oxidați la aldehide
3CH3-CH2OH + K2Cr2O7 + 4H2SO4 \u003d 3CH3-CHO + K2SO4 + Cr2(SO4)3 + 7H2O;
2) alcoolii secundari sunt oxidați la cetone

3) pentru alcoolii terțiari, reacția de oxidare nu este tipică.
Pentru pregătirea examenului, este indicat ca profesorul să ofere informații suplimentare acestor proprietăți, care, fără îndoială, vor fi utile elevilor.
Când metanolul este oxidat cu o soluție acidificată de permanganat de potasiu sau dicromat de potasiu, se formează CO2, alcoolii primari în timpul oxidării, în funcție de condițiile de reacție, pot forma nu numai aldehide, ci și acizi. De exemplu, oxidarea etanolului cu dicromat de potasiu la rece se termină cu formarea acidului acetic, iar când este încălzit, acetaldehida:
3CH 3 -CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 \u003d 3CH 3 -COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
3CH3-CH2OH + K2Cr2O7 + 4H2SO43CH3-CHO + K2SO4 + Cr2(SO4)3 + 7H2O.
Să le reamintim din nou studenților despre influența mediului asupra produșilor reacțiilor de oxidare a alcoolului, și anume: o soluție fierbinte neutră de KMnO 4 oxidează metanolul la carbonat de potasiu, iar alcoolii rămași la săruri ale acizilor carboxilici corespunzători:

Când studiem subiectul „Aldehide și cetone”, concentrăm atenția elevilor asupra faptului că aldehidele sunt mai ușor oxidate decât alcoolii în acizii carboxilici corespunzători nu numai sub acțiunea agenților oxidanți puternici (oxigenul aerului, soluțiile acidulate de KMnO 4 și K 2 Cr 2 O 7), dar și sub influența slabă (soluție de amoniac de oxid de argint sau hidroxid de cupru (II):):
5CH 3 -CHO + 2KMnO 4 + 3H 2 SO 4 \u003d 5CH 3 -COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 -CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 \u003d 3CH 3 -COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH3-CHO + 2OH CH3-COONH4 + 2Ag + 3NH3 + H2O.
Acordăm o atenție deosebită oxidării metanalului cu o soluție de amoniac de oxid de argint, deoarece în acest caz, se formează carbonat de amoniu și nu acid formic:
HCHO + 4OH \u003d (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
După cum arată experiența noastră de lungă durată, metoda propusă de a preda elevilor de liceu cum să scrie ecuații OVR cu participarea substanțelor organice crește rezultatul lor final de UTILIZARE în chimie cu mai multe puncte.
După cum sa menționat deja, oxidarea materiei organice este introducerea oxigenului în compoziția sa și (sau) eliminarea hidrogenului. Recuperarea este procesul invers (introducerea hidrogenului și eliminarea oxigenului). Având în vedere compoziția alcanilor (СnH2n+2), putem concluziona că aceștia sunt incapabili să participe la reacțiile de reducere, dar pot participa la reacțiile de oxidare.
Alcanii sunt compuși cu grade scăzute de oxidare a carbonului și, în funcție de condițiile de reacție, pot fi oxidați pentru a forma diferiți compuși.
La temperaturi obișnuite, alcanii nu reacționează nici măcar cu agenți oxidanți puternici (H2Cr2O7, KMnO4 etc.). Când sunt introduși într-o flacără deschisă, alcanii ard. În același timp, în exces de oxigen, ele sunt complet oxidate la CO2, unde carbonul are cea mai mare stare de oxidare de +4, și apă. Arderea hidrocarburilor duce la ruperea tuturor legăturilor C-C și C-H și este însoțită de degajarea unei cantități mari de căldură (reacție exotermă).
Este în general acceptat că mecanismul oxidării alcanilor include un proces de lanț radical, deoarece oxigenul în sine nu este foarte reactiv, pentru a extrage un atom de hidrogen dintr-un alcan este nevoie de o particulă care să inițieze formarea unui radical alchil care va reacționează cu oxigenul, dând un radical peroxi. Radicalul peroxi poate apoi extrage un atom de hidrogen dintr-o altă moleculă de alcan pentru a forma un hidroperoxid de alchil și un radical.

Este posibilă oxidarea alcanilor cu oxigen atmosferic la 100-150 ° C în prezența unui catalizator - acetat de mangan, această reacție este utilizată în industrie. Oxidarea are loc atunci când un curent de aer este suflat prin parafina topită care conține o sare de mangan.
Deoarece ca urmare a reacției, se formează un amestec de acizi, apoi se separă de parafina nereacționată prin dizolvare în alcalii apoase și apoi se neutralizează cu acid mineral.
Direct în industrie, această metodă este utilizată pentru a obține acid acetic din n-butan:
Oxidarea alchenei
Reacțiile de oxidare a alchenei sunt împărțite în două grupe: 1) reacții în care se păstrează scheletul de carbon, 2) reacții de distrugere oxidativă a scheletului de carbon al moleculei de-a lungul legăturii duble.
Reacții de oxidare a alchenelor cu conservarea scheletului de carbon
1. Epoxidare (reacția Prilezhaev)
Alchenele aciclice și ciclice, atunci când interacționează cu peracizii într-un mediu nepolar, formează epoxizi (oxirani).
De asemenea, oxiranii pot fi obținuți prin oxidarea alchenelor cu hidroperoxizi în prezența catalizatorilor care conțin molibden, wolfram, vanadiu:

Cel mai simplu oxiran, oxidul de etilenă, este produs industrial prin oxidarea etilenei cu oxigen în prezența argintului sau oxidului de argint ca catalizator.

2. antihidroxilare (hidroliza epoxizilor)
Hidroliza acidă (sau alcalină) a epoxizilor duce la deschiderea ciclului de oxizi cu formarea de transdioli.

În prima etapă, protonarea atomului de oxigen al epoxidului are loc cu formarea unui cation ciclic de oxoniu, care se deschide ca urmare a atacului nucleofil al moleculei de apă.
Deschiderea inelului epoxidic catalizat de bază duce, de asemenea, la formarea de trans-glicoli.

3. sin-hidroxilare
Una dintre cele mai vechi metode de oxidare a alchenelor este reacția Wagner (oxidare cu permanganat de potasiu). Inițial, în timpul oxidării, se formează un ester de permanganat ciclic, care este hidrolizat la un diol vicinal:

Pe lângă reacția Wagner, există o altă metodă de sin-hidroxilare a alchenelor sub acțiunea oxidului de osmiu (VIII), care a fost propusă de Krige. Sub acțiunea tetroxidului de osmiu asupra unei alchene în eter sau dioxan, se formează un precipitat negru al esterului ciclic al acidului osmic - osmat. Cu toate acestea, adăugarea de OsO4 la legătura multiplă este accelerată semnificativ în piridină. Precipitatul negru rezultat de osmat este ușor descompus prin acțiunea unei soluții apoase de hidrosulfit de sodiu:

Permanganatul de potasiu sau oxidul de osmiu (VIII) oxidează alchena la cis-1,2-diol.
Scindarea oxidativă a alchenelor
Scindarea oxidativă a alchenelor include reacții de interacțiune a acestora cu permanganatul de potasiu în acid alcalin sau sulfuric, precum și oxidarea cu o soluție de trioxid de crom în acid acetic sau dicromat de potasiu și acid sulfuric. Rezultatul final al unor astfel de transformări este scindarea scheletului de carbon la locul dublei legături și formarea de acizi carboxilici sau cetone.
Alchenele monosubstituite cu o legătură dublă terminală sunt scindate la un acid carboxilic și dioxid de carbon:

Dacă ambii atomi de carbon din legătura dublă conțin doar o grupare alchil, atunci se formează un amestec de acizi carboxilici:

Dar dacă o alchenă tetrasubstituită cu o legătură dublă este o cetonă:

Reacția de ozonoliză a alchenelor a căpătat o semnificație preparativă mult mai mare. Timp de multe decenii, această reacție a servit ca metodă principală de determinare a structurii alchenei inițiale. Această reacție este efectuată prin trecerea unui curent al unei soluții de ozon în oxigen, a unei soluții de alchenă în clorură de metilen sau acetat de etil la -80 ... -100 ° C. Mecanismul acestei reacții a fost stabilit de Krige:


Ozonidele sunt compuși instabili care se descompun prin explozie. Există două moduri de descompunere a ozonidelor - oxidativă și reductivă.
În timpul hidrolizei, ozonidele sunt împărțite în compuși carbonilici și peroxid de hidrogen. Peroxidul de hidrogen oxidează aldehidele în acizi carboxilici - aceasta este descompunerea oxidativă:

Mult mai importantă este scindarea reductivă a ozonidelor. Produșii de ozonoliză sunt aldehide sau cetone, în funcție de structura alchenei inițiale:
Pe lângă metodele de mai sus, există o altă metodă propusă în 1955 de Lemieux:
În metoda Lemieux, nu există proceduri care necesită timp pentru separarea dioxidului de mangan, deoarece dioxidul și manganatul sunt din nou oxidați de periodat la ionul permanganat. Acest lucru permite utilizarea numai a cantităților catalitice de permanganat de potasiu.