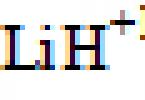Elementul chimic heliu a fost descoperit mai întâi pe Soare și abia apoi pe Pământ.
Un rol cheie în istoria descoperirii heliului l-a jucat Norman Lockyer, fondatorul uneia dintre cele mai importante publicații științifice din lume - revista. Natură. În pregătirea publicării revistei, a făcut cunoștință cu instituția științifică de la Londra și a devenit interesat de astronomie. Aceasta a fost o perioadă în care, inspirați de descoperirea Kirchhoff-Bunsen, astronomii abia începeau să studieze spectrul luminii emise de stele. Lockyer însuși a reușit să facă o serie de descoperiri importante - în special, a fost primul care a arătat că petele solare sunt mai reci decât restul suprafeței solare și a fost primul care a subliniat că Soarele are o înveliș exterioară, apelând aceasta cromosferă. În 1868, în timp ce studia lumina emisă de atomi în proeminențe – ejecții uriașe de plasmă de pe suprafața Soarelui – Locker a observat o serie de linii spectrale necunoscute anterior ( cm. Spectroscopie). Încercările de a obține aceleași linii în laborator au eșuat, din care Lockyer a concluzionat că a descoperit un nou element chimic. Lockyer a numit-o heliu, din greacă helios- „Soarele”.
Oamenii de știință au rămas nedumeriți cu privire la modul de reacție la apariția heliului. Unii au sugerat că s-a făcut o eroare în interpretarea spectrelor proeminențelor, dar acest punct de vedere a primit din ce în ce mai puțini susținători pe măsură ce tot mai mulți astronomi au putut observa liniile Lockyer. Alții au susținut că Soarele conține elemente care nu există pe Pământ - ceea ce, așa cum am menționat deja, contrazice punctul principal despre legile naturii. Încă alții (era o minoritate) credeau că într-o zi se va găsi heliu pe Pământ.
La sfârșitul anilor 1890, Lord Rayleigh și Sir William Ramsay au condus o serie de experimente care au condus la descoperirea argonului. Ramsay și-a modificat configurația pentru a o folosi pentru a studia gazele eliberate de mineralele care conțin uraniu. Ramsay a descoperit linii necunoscute în spectrul acestor gaze și a trimis mostre la mai mulți colegi pentru analiză. După ce a primit proba, Lockyer a recunoscut imediat liniile pe care le observase în lumina soarelui cu mai mult de un sfert de secol în urmă. Misterul heliului a fost rezolvat: gazul se găsește, fără îndoială, pe Soare, dar există și aici, pe Pământ. În zilele noastre, acest gaz este cel mai bine cunoscut în viața de zi cu zi ca un gaz pentru umflarea aeronavelor și baloanelor ( cm. Legea lui Graham), și în știință - datorită aplicării sale în criogenia, tehnologii pentru atingerea temperaturilor ultra-scăzute.
Coronium și nebuliu
Întrebarea dacă există elemente chimice undeva în Univers care nu se găsesc pe Pământ nu și-a pierdut relevanța în secolul al XX-lea. Când studiem atmosfera solară exterioară - solară coroane, constând din plasmă fierbinte, foarte rarefiată, astronomii au descoperit linii spectrale pe care nu le-au putut identifica cu niciunul dintre elementele terestre cunoscute. Oamenii de știință au sugerat că aceste linii aparțin unui nou element, care se numește coronium. Și când studiem spectrele unora nebuloase- acumulări îndepărtate de gaze și praf în Galaxie - au fost descoperite alte linii misterioase. Au fost atribuite unui alt element „nou” - nebulie. În anii 1930, astrofizicianul american Ira Sprague Bowen (1898-1973) a ajuns la concluzia că liniile de nebuliu aparțin de fapt oxigenului, dar a căpătat acest aspect datorită condițiilor extreme existente pe Soare și în nebuloase, iar aceste condiții nu pot fi reproduse. în laboratoarele pământeşti. Coronium s-a dovedit a fi fier puternic ionizat. Și aceste rânduri au primit numele linii interzise.
Joseph Norman LOCKYER
Joseph Norman Lockyer, 1836-1920
om de știință englez. Născut în orașul Rugby în familia unui medic militar. Lockyer a ajuns la știință într-un mod neobișnuit, începând cariera ca funcționar în Departamentul de Război. Pentru a câștiga bani în plus, a profitat de interesul publicului pentru știință și a început să publice o revistă de știință populară. Primul număr al revistei a fost publicat în 1869 Natură, iar timp de 50 de ani Lockyer a rămas redactorul ei. A participat la multe expediții de observare a eclipselor totale de soare. Una dintre aceste expediții l-a condus la descoperirea heliului. Lockyer este cunoscut și ca fondatorul arheoastronomiei - știința care studiază semnificația astronomică a structurilor antice precum Stonehenge - și autorul multor cărți de știință populară.
Cu toții cunoaștem heliul, un gaz foarte ușor care ajută baloanele și aeronavele să se ridice în aer. Heliul are un avantaj de siguranță foarte important - nu arde și nu explodează ca hidrogenul. Acest gaz este, de asemenea, o parte integrantă a amestecurilor de aer pentru utilizarea în respirație de către scafandrii de adâncime - spre deosebire de azot, este aproape insolubil în sânge sau lipide (componente grase) chiar și în condiții de presiune foarte ridicată.
Heliul te ajută să faci fără narcoza cu azot, în care sistemul nervos (care este 60% lipide) este infuzat cu azot, lăsând scafandrii să simtă că ar fi mâncat un singur martini la o adâncime de 30 de metri. Acest gaz ajută și la evitarea apariției bolii de decompresie, cunoscută și sub numele de boala de decompresie. Aceasta este o afecțiune dureroasă și periculoasă în care se formează bule de azot în sângele, sistemul nervos, articulațiile și sub piele ale scafandrului, atunci când presiunea scade prea repede pe măsură ce scafandrul iese la suprafață. Amestecul de heliu și oxigen (numit heliox) face vocea foarte scârțâitoare - acest lucru se datorează faptului că sunetul călătorește prin heliu mult mai repede decât prin aer și tocmai această proprietate a heliului îl face să fie o glumă preferată în timpul sărbătorilor. când baloanele sunt umflate cu heliu.
Heliul este al doilea element chimic cel mai ușor, care are multe proprietăți uimitoare. Acest gaz și-a primit numele deoarece a fost detectat pentru prima dată într-o imagine luminoasă a soarelui (helios în greacă) înainte de a fi descoperit pe Pământ. Toate gazele, atunci când sunt suficient de răcite, se condensează într-o stare lichidă, iar heliul are cea mai scăzută temperatură de condensare dintre orice substanță cunoscută (–269°C sau –452°F). Spre deosebire de alte elemente chimice, heliul nu îngheață niciodată, oricât de rece ar fi, decât în condiții de presiune foarte mare. În plus, forma lichidă a heliului, atunci când este răcită la temperaturi sub –271°C (–456°F) formează o fază unică numită superfluid - aceasta superfluid Curge perfect, fără nicio rezistență (vâscozitate).
Se crede că heliul din soare a fost format de fuziune nucleară . Este un proces în care nucleele de hidrogen, cel mai ușor element, se combină pentru a forma heliu, eliberând cantități enorme de energie.
Pe Pământ, acest gaz se formează în principal ca rezultat al radioactivității alfa(a)-degradare. Renumitul fizician din Noua Zeelandă Ernest Rutherford (1871–1937) a descoperit pentru prima dată că particulele alfa erau de fapt nucleele atomilor de heliu. Așa se formează heliul din elementele radioactive conținute în rocă, precum uraniul sau toriul, iar din acestea intră în aer.
Oamenii de știință pot determina cât de repede se formează heliu, cât de repede părăsește roca și cât de mult intră în aer și cât de mult heliu se poate pierde din aer în spațiu. De asemenea, pot măsura cantitatea de heliu din rocă și aer. Pe baza acestui lucru, oamenii de știință pot calcula vârsta maximă a rocilor și a aerului. Rezultatele sunt surprinzătoare pentru cei care cred în miliarde de ani. Desigur, toate astfel de calcule se bazează pe propoziții despre trecut, cum ar fi ipoteze despre condițiile inițiale și coeficienții constanti ai diferitelor procese. Nu vor putea niciodată dovedi vârsta a ceva. Pentru aceasta ai nevoie de un martor ocular care a văzut totul cu ochii lui ( uite Iov 38:4 ).
Heliu în atmosferă
Aerul este format în principal din azot (78,1%) și oxigen (20,1%). Cantitatea de heliu din el este foarte mică (0,0005%). Dar acesta este încă mult heliu, și anume 3,71 miliarde de tone. Cu toate acestea, din moment ce fiecare secunda Deoarece 67 de grame de heliu intră în atmosferă din scoarța terestră, atunci pentru a acumula heliul existent în atmosferă astăzi ar fi nevoie de aproximativ două milioane de ani , chiar dacă la început nu era deloc acolo.
Evoluționistii cred că pământul nostru este de 2500 de ori mai vechi, adică el 4,5 miliarde de ani. Desigur, pământul ar fi putut fi creat cu cea mai mare parte a heliului observat, deci două milioane de ani sunt varsta maxima . (Această vârstă ar putea fi mult mai mică, cum ar fi 6000 de ani.)
În plus, trebuie menționat că în trecut, formarea heliului s-ar fi produs mai rapid decât în prezent, deoarece sursele radioactive s-au degradat. Acest lucru ar reduce și mai mult intervalul de vârstă al Pământului.
Singura modalitate de a elimina această problemă este să presupunem că heliul pur și simplu se scurge în spațiu. Dar pentru ca acest lucru să se întâmple, atomii de heliu trebuie să se miște suficient de repede pentru a scăpa de gravitația Pământului (adică la o viteză mai mare decât viteza de evacuare). Ciocnirile dintre atomi le încetinesc mișcarea, dar peste o înălțime critică ( exobază), la aproximativ 500 de kilometri deasupra pământului, coliziunile apar foarte rar. Atomii care traversează această înălțime au șansa de a scăpa dacă călătoresc suficient de repede - cu cel puțin 10,75 kilometri pe secundă. Rețineți că, deși heliul din balon va pluti, atunci când este deschis, pur și simplu se va amesteca uniform cu toate celelalte gaze, așa cum este cazul tuturor gazelor normale.
Viteza medie a atomilor poate fi calculată dacă temperatura este cunoscută, deoarece este direct legată de energia medie a atomilor sau a moleculelor. Renumit fizician (și creaționist) James Clerk Maxwell a calculat câți atomi de gaz (sau molecule) ar avea o viteză dată la orice temperatură și masă. În acest fel putem calcula câți atomi ar traversa exobază destul de repede pentru a scăpa în spațiu.
Exobaza este foarte fierbinte. Dar chiar dacă presupunem o temperatură de 1500 K (1227°C sau 2241°F), care este mai mare decât temperatura medie, viteza cea mai comună a atomilor de heliu este de numai 2,5 kilometri pe secundă (5625 m/h) sau mai puțin. decat un sfert din debitul. Puțini atomi se mișcă mai repede decât viteza medie și totuși cantitatea de heliu care curge în spațiu este de aproximativ 1/40 cantitatea de heliu care intră în atmosferă. De asemenea, alte mecanisme de evacuare nu reușesc să țină cont de cantitatea mică de heliu din aer, care este aproximativ 1/2000 din cantitatea care ar fi prezentă în aer după miliarde de ani așteptate.
Aceasta este o problemă nerezolvată pentru fizicianul atmosferic care crede în lungile epoci ale istoriei pământului, K.G. Walker, care a spus următoarele: „... în ceea ce privește nivelul de heliu din atmosferă, aici ne confruntăm cu o problemă”. Un alt specialist, D.W. Chamberlain a mai spus că această problemă în ceea ce privește acumularea de heliu „... nu va dispărea de la sine și va rămâne nerezolvată”.
Comunitatea evoluționistă încearcă cu disperare să găsească alte explicații pentru această lipsă de heliu, dar niciuna dintre ele nu este potrivită. O soluție simplă la problemă poate fi găsită dacă acceptăm că pământul nu este deloc atât de vechi pe cât cred evoluționistii! Creaționist, om de știință Larry Vardiman, care a studiat atmosfera, a studiat mai profund această problemă și a scris un studiu mai detaliat al acestei probleme.
Heliu în roci
După cum am spus deja, cea mai mare parte a heliului de pe pământ se formează ca urmare a dezintegrarii radioactive din roci. Atomi mici de heliu curg liber din roci în atmosferă.
Am mai spus mai sus că a fost stabilită viteza cu care heliul intră în atmosferă. Dar putem măsura și viteza cu care heliul curge din roci. Acest proces are loc mai repede în stâncile mai fierbinți și, cu cât intri mai adânc în pământ, cu atât rocile devin mai fierbinți.
Fizicianul creației Robert Gentry a cercetat granitul de adâncime ca o posibilă modalitate de a stoca în siguranță deșeurile radioactive periculoase de la centralele nucleare. Depozitarea în siguranță necesită ca elementele să nu treacă prin rocă prea repede.
Granitul conține cristale minerale numite zirconii(silicat de zirconiu, ZrSiO 4), care conțin adesea elemente radioactive. Aceasta înseamnă că trebuie să formeze heliu, care trebuie să curgă în atmosferă.
Dar Gentry a descoperit că chiar și zirconii adânciți (197°C sau 387°F) conțineau prea mult heliu- adică dacă ar avea miliarde de ani să curgă afară.
Totuși, dacă în realitate au trecut doar câteva mii de ani în care acest heliu a intrat în atmosferă, atunci nu este de mirare că a mai rămas atât de mult heliu acolo.
[Știri octombrie 2002: Vezi datele despre dezintegrarea nucleară accelerată în articol Dezintegrarea nucleară: dovezi ale tinereții lumii , scris de un fizician nuclear creaționist Dr. Russell Humphreys .]
Concluzie
Cantitatea de heliu din aer și din roci este complet neconformă cu ideea că pământul nostru are miliarde de ani, așa cum susțin evoluționiștii și creaționiștii progresiști. Această cantitate de heliu este mai degrabă dovada științifică a unei vârste mici, așa cum se spune clar și clar în cartea Geneza.
Heliu(lat. Heliu), simbolul He, element chimic din grupa VIII a sistemului periodic, se referă la gaze inerte; numărul de serie 2, masa atomică 4,0026; gaz incolor și inodor. Heliul natural este format din 2 izotopi stabili: 3 He și 4 He (predomină puternic conținutul de 4 He).
Referință istorică. Pentru prima dată, Heliul a fost descoperit nu pe Pământ, unde este rar, ci în atmosfera Soarelui. În 1868, francezul J. Jansen și englezul J. N. Lockyer au studiat compoziția spectroscopică a proeminențelor solare. Imaginile pe care le-au obținut conțineau o linie galbenă strălucitoare (așa-numita linie D3), care nu putea fi atribuită niciunuia dintre elementele cunoscute la acel moment. În 1871, Lockyer și-a explicat originea prin prezența unui nou element în Soare, care se numea heliu (din grecescul helios - Soare). Pe Pământ, Heliul a fost izolat pentru prima dată în 1895 de către englezul W. Ramsay din mineralul radioactiv kleveite. Spectrul gazului eliberat la încălzirea kleveitei a arătat aceeași linie.
Distribuția heliului în natură. Pe Pământ există puțin Heliu: 1 m 3 de aer conține doar 5,24 cm 3 de Heliu, iar fiecare kilogram de material pământesc conține 0,003 mg de Heliu. În ceea ce privește abundența în Univers, Heliul ocupă locul al doilea după hidrogen: Heliul reprezintă aproximativ 23% din masa cosmică.
Pe Pământ, Heliul (mai precis, izotopul 4 He) se formează constant în timpul dezintegrarii uraniului, toriului și a altor elemente radioactive (în total, scoarța terestră conține aproximativ 29 de izotopi radioactivi care produc 4 He).
Aproximativ jumătate din tot Heliul este concentrat în scoarța terestră, în principal în coaja sa de granit, care a acumulat principalele rezerve de elemente radioactive. Conținutul de heliu din scoarța terestră este scăzut - 3·10 -7% în masă. Heliul se acumulează în acumulări de gaz liber în subsol și în petrol; Astfel de zăcăminte ajung la scară industrială. Concentrațiile maxime de Heliu (10-13%) au fost găsite în acumulări de gaz liber și gaze din minele de uraniu și (20-25%) în gazele eliberate spontan din apele subterane. Cu cât vârsta rocilor sedimentare purtătoare de gaze este mai înaintată și cu cât conținutul de elemente radioactive din acestea este mai mare, cu atât mai mult Heliu în compoziția gazelor naturale. Gazele vulcanice sunt de obicei caracterizate printr-un conținut scăzut de heliu.
Heliul este produs la scară industrială din gaze naturale și petroliere cu compoziție atât de hidrocarburi, cât și de azot. Pe baza calității materiilor prime, depozitele de heliu se împart în: bogate (conținut He > 0,5% în volum); obișnuit (0,10-0,50) și sărac (<0,10). В СССР природный Гелий содержится во многих нефтегазовых месторождениях. Значительные его концентрации известны в некоторых месторождениях природного газа Канады, США (штаты Канзас, Техас, Нью-Мексико, Юта).
Izotopi, atom și moleculă de heliu.În Heliul natural de orice origine (atmosferică, din gaze naturale, din minerale radioactive, meteorit etc.), predomină izotopul 4 He. Conținutul de 3 He este de obicei scăzut (în funcție de sursa de Heliu, acesta variază de la 1,3·10 -4 la 2·10 -8%) și numai în Heliul izolat de meteoriți ajunge la 17-31,5%. Rata de formare a 4 He în timpul dezintegrarii radioactive este scăzută: într-o tonă de granit care conține, de exemplu, 3 g de uraniu și 15 g de toriu, se formează 1 mg de heliu în 7,9 milioane de ani; totuși, întrucât acest proces are loc constant, pe durata existenței Pământului ar trebui să asigure un conținut de Heliu în atmosferă, litosferă și hidrosferă care să îl depășească semnificativ pe cel existent (este de aproximativ 5 10 14 m 3). Această deficiență de Heliu se explică prin evaporarea sa constantă din atmosferă. Atomii de lumină ai heliului, care cad în straturile superioare ale atmosferei, capătă treptat o viteză mai mare decât cea de-a doua viteză cosmică și câștigă astfel oportunitatea de a depăși forțele gravitației. Formarea și volatilizarea simultană a heliului duce la faptul că concentrația acestuia în atmosferă este aproape constantă.
Izotopul 3 He, în special, se formează în atmosferă în timpul dezintegrarii β a izotopului greu de hidrogen - tritiu (T), care, la rândul său, apare din interacțiunea neutronilor din radiația cosmică cu azotul din aer:
14 7 N + 3 0 n → 12 6 C + 3 1 T.
Nucleele atomului de 4 He (format din 2 protoni și 2 neutroni), numite particule alfa sau helii, sunt cele mai stabile dintre nucleele compuși. Energia de legare a nucleonilor (protoni si neutroni) in 4 He are o valoare maxima fata de nucleele altor elemente (28,2937 MeV); prin urmare, formarea nucleelor de 4 He din nuclee de hidrogen (protoni) 1 H este însoțită de eliberarea unei cantități uriașe de energie. Se crede că această reacție nucleară este:
4 1 H = 4 He + 2β + + 2n
[simultan cu 4 He, se formează doi pozitroni (β +) și doi neutrini (ν)] servește drept sursă principală de energie pentru Soare și alte stele similare acestuia. Datorită acestui proces, în Univers se acumulează rezerve foarte importante de Heliu.
Proprietățile fizice ale heliului.În condiții normale, Heliul este un gaz monoatomic, incolor și inodor. Densitate 0,17846 g/l, punct de fierbere -268,93°C, punct de topire -272,2°C. Conductivitate termică (la 0°C) 143,8·10 -3 W/(cm·K). Raza atomului de heliu, determinată prin diferite metode, variază de la 0,85 la 1,33 Å. Aproximativ 8,8 ml de heliu se dizolvă în 1 litru de apă la 20°C. Energia de ionizare primară a Heliului este mai mare decât cea a oricărui alt element - 39,38·10 -13 J (24,58 eV); Heliul nu are afinitate pentru electroni. Heliul lichid, format doar din 4 He, prezintă o serie de proprietăți unice.
Proprietățile chimice ale heliului. Până acum, încercările de a obține compuși chimici stabili ai heliului s-au încheiat cu eșec.
Obținerea heliului.În industrie, Heliul este obținut din gaze naturale care conțin heliu (în prezent se exploatează în principal zăcăminte care conțin > 0,1% Heliu). Heliul este separat de alte gaze prin răcire profundă, folosindu-se de faptul că se lichefiază mai greu decât toate celelalte gaze.
Aplicarea heliului. Datorită inerției sale, heliul este utilizat pe scară largă pentru a crea o atmosferă protectoare la topirea, tăierea și sudarea metalelor active. Heliul este mai puțin conductiv electric decât un alt gaz inert, argonul și, prin urmare, un arc electric într-o atmosferă cu Heliu produce temperaturi mai ridicate, ceea ce crește semnificativ viteza de sudare cu arc. Datorită densității sale scăzute, combinată cu neinflamabilitatea, heliul este folosit pentru a umple baloanele stratosferice. Conductivitatea termică ridicată a Heliului, inerția sa chimică și capacitatea extrem de scăzută de a intra într-o reacție nucleară cu neutroni fac posibilă utilizarea Heliului pentru răcirea reactoarelor nucleare. Heliul lichid este cel mai rece lichid de pe Pământ și servește ca agent de răcire în diferite cercetări științifice. Una dintre metodele de determinare a vârstei lor absolute se bazează pe determinarea conținutului de heliu din mineralele radioactive. Datorită faptului că Heliul este foarte slab solubil în sânge, este folosit ca componentă a aerului artificial furnizat pentru respirație scafandrilor (înlocuirea azotului cu Heliu previne apariția bolii de decompresie). Se studiază și posibilitățile de utilizare a Heliului în atmosfera unei cabine de nave spațiale.
Heliul este lichid. Interacțiunea relativ slabă a atomilor de heliu îl face să rămână gazos la temperaturi mai scăzute decât orice alt gaz. Temperatura maximă sub care poate fi lichefiat (temperatura sa critică Tk) este de 5,20 K. Heliul lichid este singurul lichid care nu îngheață: la presiune normală, Heliul rămâne lichid la temperaturi arbitrar scăzute și se solidifică doar la presiuni care depășesc 2, 5 Mn. /m2 (25 at).
Heliul este un element chimic cu simbolul He și numărul atomic 2. Este un gaz incolor, inodor, fără gust, netoxic, inert, monoatomic, primul din grupa gazelor nobile din tabelul periodic. Punctul său de fierbere este cel mai scăzut dintre toate elementele. După hidrogen, heliul este al doilea cel mai ușor și al doilea cel mai abundent element din universul observabil, prezent la aproximativ 24% din masa totală a elementelor, de peste 12 ori masa tuturor elementelor mai grele combinate. Abundența sa se datorează energiei nucleare foarte mari de legare (per nucleon) a heliului-4 în raport cu următoarele trei elemente după heliu. Această energie de legare a heliului-4 explică, de asemenea, de ce heliul este un produs atât al fuziunii nucleare, cât și al dezintegrarii radioactive. Cea mai mare parte a heliului din univers este sub formă de heliu-4 și se crede că s-a format în timpul Big Bang-ului. Cantități mari de heliu nou sunt create prin fuziunea nucleară a hidrogenului din stele. Heliul este numit după zeul grec al soarelui, Helios. Heliul a fost descoperit pentru prima dată ca o semnătură necunoscută a liniei spectrale galbene în lumina soarelui în timpul unei eclipse de soare în 1868 de către Georges Rayet, căpitanul C.T. Haig, Norman R. Pogson și locotenentul John Herschel.
Această observație a fost confirmată ulterior de astronomul francez Jules Janssen. Janssen este adesea creditat cu descoperirea acestui element împreună cu Norman Lockyer. Janssen a înregistrat linia spectrală a heliului în timpul eclipsei de soare din 1868, în timp ce Lockyer a observat fenomenul din Marea Britanie. Lockyer a fost primul care a sugerat că această linie a fost asociată cu un nou element, căruia i-a dat numele de heliu. Descoperirea oficială a elementului a fost făcută în 1895 de doi chimiști suedezi, Per Theodor Cleave și Niels Abraham Langlet, care au descoperit heliul provenind din minereul de uraniu kleveite. În 1903, au fost descoperite rezerve mari de heliu în zăcăminte de gaze naturale din anumite părți ale Statelor Unite. Astăzi, SUA este cel mai mare furnizor de gaze. Heliul lichid este utilizat în criogenie (cea mai mare utilizare unică, consumând aproximativ un sfert din producție), în special în magneții supraconductori de răcire, principala utilizare comercială fiind în scanerele RMN. Alte utilizări industriale ale heliului sunt ca gaz de presurizare și de purjare, ca atmosferă protectoare pentru sudarea cu arc și în procese precum creșterea cristalelor pentru a face plachete de siliciu. O utilizare binecunoscută, dar minoră, a heliului este ca gaz de ridicare pentru baloane și avioane. Ca și în cazul oricărui gaz a cărui densitate este diferită de cea a aerului, inhalarea unui volum mic de heliu schimbă temporar timbrul și calitatea vocii umane. În cercetarea științifică, comportamentul celor două faze lichide ale heliului-4 (heliu I și heliu II) este important pentru cercetătorii care studiază mecanica cuantică (în special proprietatea superfluidității) și pentru oamenii de știință care studiază fenomene precum supraconductibilitatea în materie aproape de zero absolut. . Pe Pământ, heliul este relativ rar - 5,2 ppm. după volum în atmosferă. Astăzi, cea mai mare parte a heliului prezent pe Pământ este creat prin dezintegrarea radioactivă naturală a elementelor radioactive grele (toriu și uraniu, deși există și alte exemple), deoarece particulele alfa emise de astfel de descompunere sunt compuse din nuclee de heliu-4. Acest heliu radiogen este captat în gazul natural în concentrații de până la 7% în volum, din care este extras comercial printr-o separare la temperatură joasă numită distilare fracțională. Heliul terestru era o resursă neregenerabilă deoarece, odată eliberat în atmosferă, putea călători cu ușurință în spațiu, iar elementul era considerat a fi din ce în ce mai rar. Cu toate acestea, cercetări recente sugerează că heliul, format pe Pământ din degradarea radioactivă, se poate colecta în rezervele de gaze naturale în cantități mai mari decât era de așteptat, în unele cazuri eliberat de activitatea vulcanică.
Poveste
Descoperiri științifice
Prima dovadă a existenței heliului a fost făcută pe 18 august 1868. În spectrul cromosferei solare a fost observată o linie galbenă strălucitoare cu o lungime de undă de 587,49 nanometri. Această linie a fost descoperită de astronomul francez Jules Janssen în timpul unei eclipse totale de soare din Guntur, India. Această linie a fost considerată inițial a fi sodiu. Pe 20 octombrie a aceluiași an, astronomul englez Norman Lockyer a observat o linie galbenă în spectrul Soarelui, pe care a numit-o linia D3 Fraunhofer pentru că era aproape de faimoasele linii de sodiu D1 și D2. Omul de știință a ajuns la concluzia că această linie a fost cauzată de un element al Soarelui, necunoscut pe Pământ. Lockyer și chimistul englez Edward Frankland au numit elementul din cuvântul grecesc pentru soare, ἥλιος (helios). În 1881, fizicianul italian Luigi Palmieri a descoperit pentru prima dată heliul pe Pământ prin linia sa spectrală D3, în timp ce analiza materialul care a fost sublimat în timpul erupției Vezuviului. La 26 martie 1895, chimistul scoțian Sir William Ramsay a izolat heliul pe Pământ prin tratarea mineralului cleveita (o gamă de uraniți cu cel puțin 10% elemente de pământuri rare) cu acizi minerali. Ramsay căuta argon, dar după ce a separat azotul și oxigenul de gazul produs de acidul sulfuric, a observat o linie galbenă strălucitoare care se potrivea cu linia D3 văzută în spectrul Soarelui. Aceste mostre au fost identificate ca heliu de către Lockyear și fizicianul britanic William Crookes. Heliul a fost izolat independent de kleveit în același an de chimiștii Per Theodor Kleve și Abraham Langlet din Uppsala, Suedia, care au colectat suficient gaz pentru a determina cu exactitate greutatea atomică a acestuia. Heliul a fost izolat și de geochimistul american William Francis Hillebrand înainte de descoperirea lui Ramsey, când a observat linii spectrale neobișnuite în timp ce testa o probă de mineral uraninit. Hillebrand, însă, a atribuit aceste linii azotului. În 1907, Ernest Rutherford și Thomas Royds au demonstrat că particulele alfa erau nuclee de heliu, permițând particulelor să pătrundă în peretele subțire de sticlă al unui tub evacuat și apoi creând o descărcare în tub pentru a studia spectrele noului gaz din interior. În 1908, heliul a fost pentru prima dată lichefiat de fizicianul olandez Heike Kamerlingh Onnes prin răcirea gazului la o temperatură mai mică de un kelvin. A încercat să facă gazul solid scăzând și mai mult temperatura, dar nu a reușit, deoarece heliul nu se solidifică la presiunea atmosferică. Studentul lui Onnes, Willem Hendrik Keesom, a reușit în cele din urmă să determine solidificarea a 1 cm3 de heliu în 1926 prin adăugarea unei presiuni externe suplimentare. În 1938, fizicianul rus Pyotr Leonidovich Kapitsa a descoperit că heliul-4 practic nu are vâscozitate la temperaturi apropiate de zero absolut, un fenomen numit acum superfluiditate. Acest fenomen este asociat cu condensarea Bose-Einstein. În 1972, același fenomen a fost observat și pentru heliu-3, dar la temperaturi mult mai apropiate de zero absolut, de către fizicienii americani Douglas D. Osheroff, David M. Lee și Robert C. Richardson. Se crede că fenomenul din heliu-3 se datorează împerecherii fermionilor de heliu-3 pentru a forma bosoni, analog cu perechile de electroni Cooper care produc supraconductivitate.
Extracție și utilizare
După o operațiune de foraj de petrol în 1903, Dexter, Kansas, a produs un gheizer cu gaz care nu ardea, iar geologul statului Kansas, Erasmus Haworth, a colectat mostre din gazul care scăpa și le-a dus la Universitatea din Kansas la Lawrence, unde, cu cu ajutorul chimiștilor Hamilton Cady și David McFarland, el a descoperit că gazul consta din 72% azot, 15% metan (procentul inflamabil cu doar suficient oxigen), 1% hidrogen și 12% gaz neidentificabil. La analize suplimentare, Cady și McFarland au descoperit că 1,84% din proba de gaz era heliu. Acest lucru a arătat că, în ciuda rarității sale generale pe Pământ, heliul a fost concentrat în cantități mari sub Marile Câmpii Americane, disponibil pentru extracție ca produs secundar al gazelor naturale. Acest lucru a permis Statelor Unite să devină principalul furnizor mondial de heliu. În urma unei sugestii a lui Sir Richard Threlfall, Marina Statelor Unite a sponsorizat trei mici plante experimentale de heliu în timpul Primului Război Mondial. Scopul a fost de a furniza baloane de baraj cu un gaz neinflamabil mai ușor decât aerul. În timpul acestui program, au fost produși 5.700 m3 (200.000 cu ft) de heliu 92%, deși mai puțin de un metru cub din acest gaz fusese produs anterior. O parte din acest gaz a fost folosit în prima navă cu heliu din lume, C-7 al Marinei SUA, care și-a făcut călătoria inaugurală de la Hampton Roads, Virginia, la Bolling Field din Washington, D.C., la 1 decembrie 1921, cu aproape doi ani înainte a fost construită.prima dirijabilă rigidă plină cu heliu în septembrie 1923 la uzina Shenandoah. Deși procesul de extracție folosind lichefierea gazelor la temperatură joasă nu a fost dezvoltat la acea vreme, producția a continuat în timpul Primului Război Mondial. Heliul a fost folosit în principal ca gaz de ridicare în aeronavele mai ușoare decât aerul. În timpul celui de-al Doilea Război Mondial, cererea de heliu ca gaz de ridicare și pentru sudarea cu arc ecranat a crescut. Spectrometrul de masă cu heliu a avut, de asemenea, o mare importanță în Proiectul Manhattan (numele de cod al lucrării de creare a primei bombe atomice în Statele Unite în timpul celui de-al Doilea Război Mondial). Guvernul Statelor Unite a înființat Rezervația Națională de Heliu în 1925 în Amarillo, Texas, cu scopul de a furniza avioane militare în timp de război și avioane comerciale în timp de pace. Datorită Legii privind controlul heliului (1927), care interzicea exportul de heliu rar, a cărui producție Statele Unite aveau atunci monopolul, împreună cu costul prohibitiv al gazului, Hindenburg, la fel ca toți zeppelinii germani, a fost obligat să utilizați hidrogenul ca gaz de ridicare. Piața heliului a fost suprimată după al Doilea Război Mondial, dar livrările au fost extinse în anii 1950 pentru a furniza heliu lichid ca lichid de răcire pentru a crea combustibil pentru rachete cu oxigen (printre alte utilizări) în timpul Cursei Spațiale și al Războiului Rece. Utilizarea heliului în Statele Unite în 1965 a fost de peste opt ori maximul consumului în timpul războiului. În urma modificărilor Legii heliului din 1960 (Legea publică 86-777), Biroul Statelor Unite a înființat cinci fabrici private pentru a recupera heliul din gazele naturale. Pentru acest program de conservare a heliului, Biroul a construit o conductă de 425 de mile (684 de kilometri) din Bushton, Kansas, pentru a conecta aceste centrale la zăcământul guvernamental de gaz Cliffside, parțial epuizat, lângă Amarillo, Texas. Acest amestec de heliu-azot a fost injectat și depozitat în câmpul de gaz Cliffside până când a fost necesar, timp în care a fost purificat în continuare. Până în 1995, un miliard de metri cubi de gaz au fost colectați, iar rezerva era de 1,4 miliarde de dolari în datorii, ceea ce a determinat Congresul Statelor Unite să elimine rezerva în 1996. Actul de privatizare a heliului din 1996 (Legea publică 104-273) obligă Departamentul de Interne al Statelor Unite să elibereze rezerva și să înceapă vânzările în 2005. Heliul produs între 1930 și 1945 a fost de aproximativ 98,3% pur (2% azot), suficient pentru avioane. În 1945, s-au produs cantități mici de 99,9% heliu pentru sudare. Până în 1949, erau disponibile cantități comerciale de 99,95% heliu clasa A. Timp de mulți ani, Statele Unite au produs mai mult de 90% din heliul utilizat comercial din lume, iar restul producând fabrici miniere din Canada, Polonia, Rusia și alte țări. La mijlocul anilor 1990, a început să funcționeze o nouă fabrică din Argeve, Algeria, care producea 17 milioane de metri cubi (600 de milioane de picioare cubi de heliu), cu o producție suficientă pentru a acoperi toate nevoile Europei. Între timp, până în 2000, consumul de heliu în Statele Unite a crescut la peste 15 milioane kg pe an. În 2004-2006, au fost construite fabrici suplimentare în Ras Laffan, Qatar și Skikda, Algeria. Algeria a devenit rapid al doilea mare producător de heliu. În acest timp, atât consumul de heliu, cât și costurile de producție au crescut. Din 2002 până în 2007 Prețurile heliului s-au dublat. Începând cu 2012, Rezerva Națională de Heliu a Statelor Unite a reprezentat 30% din rezervele mondiale de heliu. Rezerva este de așteptat să se epuizeze în 2018. În ciuda acestui fapt, legislația propusă în Senatul Statelor Unite ar permite rezervei să continue să vândă gaz. Alte rezerve mari de heliu au fost localizate în statul Hugoton din Kansas, SUA, și zăcămintele de gaze din apropiere din Kansas, precum și în salienturile Texas și Oklahoma. Noi fabrici de heliu urmau să fie deschise în 2012 în Qatar, Rusia și statul american Wyoming, dar nu se aștepta să atenueze deficitul. În 2013, a început construcția celei mai mari fabrici de heliu din lume din Qatar. 2014 a fost considerat pe scară largă un an al ofertei excesive în afacerea cu heliu, după ani de lipsuri.
Caracteristici
Atom de heliu
Heliul în mecanica cuantică
Din perspectiva mecanicii cuantice, heliul este al doilea cel mai simplu atom de modelat, după atomul de hidrogen. Heliul este format din doi electroni în orbitalii atomici care înconjoară un nucleu care conține doi protoni și (de obicei) doi neutroni. Ca și în mecanica newtoniană, niciun sistem format din mai mult de două particule nu poate fi rezolvat folosind o abordare matematică analitică precisă, iar heliul nu face excepție. Astfel, sunt necesare metode numerice matematice, chiar și pentru a rezolva un sistem format dintr-un nucleu și doi electroni. Astfel de tehnici de chimie computațională au fost folosite pentru a crea o imagine mecanică cuantică a legării electronice a heliului, care este precisă la mai puțin de 2% din valoarea corectă în mai mulți pași de calcul. Astfel de modele arată că fiecare electron din heliu acoperă parțial un nucleu de celălalt, astfel încât sarcina nucleară efectivă Z pe care o vede fiecare electron este de aproximativ 1,69 unități, mai degrabă decât sarcina 2 a unui nucleu clasic de heliu „gol”.
Stabilitatea relativă a nucleului de heliu-4 și a învelișului de electroni
Nucleul unui atom de heliu-4 este identic cu o particulă alfa. Experimentele de împrăștiere a electronilor de înaltă energie arată că sarcina sa scade exponențial de la un maxim în punctul central, la fel ca densitatea de încărcare a norului de electroni al heliului. Această simetrie reflectă o fizică similară subiacentă: o pereche de neutroni și o pereche de protoni dintr-un nucleu de heliu respectă aceleași reguli mecanice cuantice ca și o pereche de electroni de heliu (deși particulele nucleare sunt supuse unui potențial de legare nuclear diferit), astfel încât toate dintre acești fermioni ocupă complet orbitalii 1s din perechi și niciunul dintre ei nu are impuls orbital și fiecare dintre ei anulează spinul celuilalt. Adăugarea oricărei alte particule ar necesita moment unghiular și ar elibera substanțial mai puțină energie (de fapt, niciun nucleu cu cinci nucleoni nu este stabil). Deci această schemă este extrem de stabilă din punct de vedere energetic pentru toate aceste particule, iar această stabilitate explică multe fapte importante despre heliu în natură. De exemplu, stabilitatea și starea de energie scăzută a norului de electroni din heliu explică inerția chimică a elementului, precum și lipsa de interacțiune a atomilor de heliu între ei, creând cele mai scăzute puncte de topire și fierbere dintre toate elementele. La fel, stabilitatea energetică deosebită a nucleului de heliu-4, creată de efecte similare, explică ușurința producerii heliului-4 în reacțiile atomice care implică fie eliberarea metalelor grele, fie sinteza acestora. Un anumit heliu-3 stabil (2 protoni și 1 neutron) este produs în reacțiile de fuziune din hidrogen, dar această cantitate este foarte mică în comparație cu energia extrem de sensibilă a heliului-4. Stabilitatea neobișnuită a nucleului de heliu-4 este, de asemenea, importantă din punct de vedere cosmologic: explică faptul că, în primele minute după Big Bang, în timpul creării „mash de protoni și neutroni liberi” care au fost create inițial într-un raport de aproximativ 6:1, răcit într-o asemenea măsură încât legătura nucleară a devenit posibilă, aproape toate primele nuclee atomice compuse formate au fost nuclee de heliu-4. Legarea heliului-4 a fost atât de strânsă încât producția de heliu-4 a consumat aproape toți neutronii liberi în câteva minute înainte ca aceștia să poată fi degradați beta, lăsând puțin pentru a forma atomi mai grei, cum ar fi litiu, beriliu sau bor. Legarea nucleară a heliului-4 per nucleon este mai puternică decât cea a oricăruia dintre aceste elemente și, prin urmare, atunci când s-a format heliu, nu a existat nicio unitate energetică pentru a crea elementele 3, 4 și 5. A fost de puțin beneficiu energetic ca heliul să fuzioneze în următorul element cu mai puțină energie per nucleon, carbonul. Cu toate acestea, din cauza lipsei elementelor intermediare, acest proces necesită trei nuclee de heliu care se lovesc aproape simultan. Astfel, în minutele de după Big Bang, nu a existat timp pentru a se forma cantități semnificative de carbon înainte ca Universul timpuriu în expansiune să se răcească la o temperatură și presiune la care fuziunea heliului cu carbonul ar fi imposibilă. Din această cauză, universul timpuriu avea un raport hidrogen/heliu similar cu cel de astăzi (3 părți hidrogen la 1 parte heliu-4 în masă), aproape toți neutronii din univers capturați de heliu-4. Toate elementele mai grele (inclusiv elementele necesare pentru planetele stâncoase precum Pământul și pentru formele de viață bazate pe carbon sau alte forme de viață) au fost astfel create după Big Bang în stele care erau suficient de fierbinți pentru a fuziona heliul însuși. Toate elementele, cu excepția hidrogenului și a heliului, reprezintă astăzi doar 2% din masa materiei atomice din Univers. Heliul-4, dimpotrivă, reprezintă aproximativ 23% din materia obișnuită a universului - aproape toată materia obișnuită care nu este hidrogen.
Fazele gazoase și plasmatice
Heliul este al doilea cel mai puțin reactiv gaz nobil după neon și, prin urmare, al doilea cel mai puțin reactiv dintre toate elementele. Este inert și monoatomic în toate condițiile standard. Din cauza masei molare (atomice) relativ scăzute a heliului, conductivitatea sa termică, capacitatea termică specifică și viteza sunetului în faza gazoasă sunt mai mari decât cele ale oricărui alt gaz, cu excepția hidrogenului. Din aceste motive și din cauza dimensiunii mici a moleculelor de heliu monoatomic, heliul difuzează prin particulele solide cu o viteză de trei ori mai mare decât viteza aerului și cu aproximativ 65% din viteza hidrogenului. Heliul este gazul monoatomic cel mai puțin solubil în apă și unul dintre gazele mai puțin solubile în apă (CF4, SF6 și C4F8 au solubilități molare mai mici: 0,3802, 0,4394 și respectiv 0,2372 x2/10-5 față de 0,70797 x2/10-5 5 pentru heliu). ), în plus, indicele de refracție al heliului este mai aproape de unitate decât indicele de refracție al oricărui alt gaz. Heliul are un coeficient Joule-Thomson negativ la temperaturi ambientale normale, ceea ce înseamnă că se încălzește atunci când este lăsat să se extindă liber. Chiar sub temperatura sa de inversare Joule-Thomson (aproximativ 32 până la 50 K la 1 atmosferă), heliul se răcește pe măsură ce se extinde liber. Odată suprarăcită sub această temperatură, heliul poate fi lichefiat prin refrigerare. Majoritatea heliului extraterestre este în stare de plasmă și are proprietăți complet diferite de cele ale heliului atomic. În plasmă, electronii heliului nu sunt legați de nucleul său, rezultând o conductivitate electrică foarte mare chiar și atunci când gazul este doar parțial ionizat. Particulele încărcate sunt puternic influențate de câmpurile magnetice și electrice. De exemplu, în vântul solar, împreună cu hidrogenul ionizat, particulele interacționează cu magnetosfera Pământului, ducând la curenții Birkeland și aurora.
Heliu lichid
Spre deosebire de orice alt element, heliul va rămâne lichid până la zero absolut la presiuni normale. Aceasta este o influență directă a mecanicii cuantice: în special, energia punctului zero a sistemului este prea mare pentru a permite înghețarea. Heliul solid necesită o temperatură de 1-1,5 K (aproximativ -272 °C sau -457 °F) la o presiune de aproximativ 25 bar (2,5 MPa). Este adesea dificil să distingem heliul solid de lichid, deoarece indicele de refracție al celor două faze este aproape același. Solidul are un punct de topire distinct și o structură cristalină, dar este foarte compresibil; aplicarea presiunii în laborator poate reduce volumul acestuia cu mai mult de 30%. Cu un modul în vrac de aproximativ 27 MPa, heliul este de 100 de ori mai compresibil decât apa. Heliul solid are o densitate de 0,214 ± 0,006 g/cm3 la 1,15 K și 66 atm; densitatea prezisă la 0 K și 25 bar (2,5 MPa) este de 0,187 ± 0,009 g/cm3. La temperaturi mai ridicate, heliul se va solidifica cu o presiune suficientă. La temperatura camerei, acest lucru necesită aproximativ 114.000 atm.
Heliu stare I
Sub punctul său de fierbere de 4,22 kelvin și peste punctul său lambda de 2,1768 kelvin, heliul-4 izotopic există într-o stare lichidă incoloră normală numită heliu I. Ca și alte lichide criogenice, heliul I fierbe când este încălzit și se contractă când temperatura lui scade. . Cu toate acestea, sub punctul lambda, heliul nu fierbe și se extinde pe măsură ce temperatura scade și mai mult. Heliul I are un indice de refracție gazoasă de 1,026, ceea ce face suprafața sa atât de dificil de vizualizat încât spumele de polistiren pop-up sunt adesea folosite pentru a-și vizualiza suprafața. Acest lichid incolor are o vâscozitate foarte scăzută și o densitate de 0,145-0,125 g/ml (aproximativ 0-4 K), care este doar un sfert din valoarea așteptată de la fizica clasică. Mecanica cuantică este necesară pentru a explica această proprietate și astfel ambele stări ale heliului lichid (heliu I și heliu II) sunt numite lichide cuantice, ceea ce înseamnă că prezintă proprietăți atomice la scară macroscopică. Acest lucru se poate datora faptului că punctul de fierbere al heliului este atât de aproape de zero absolut încât împiedică mișcarea moleculară aleatorie (energia termică) să-și mascheze proprietățile atomice.
Heliu stare II
Heliul lichid sub punctul său lambda (numit heliu II) are caracteristici foarte neobișnuite. Datorita conductibilitatii sale termice ridicate, atunci cand fierbe, nu face barbotare ci se evapora direct de pe suprafata. Heliul-3 are si o faza superfluida, dar numai la temperaturi mult mai scazute; ca urmare, se cunosc puține despre proprietățile acestui izotop. Heliul II este un lichid superfluid și o stare mecanică cuantică cu proprietăți ciudate. De exemplu, când curge prin capilare cu grosimea de 10-7 până la 10-8 m, nu are vâscozitate măsurabilă. Cu toate acestea, atunci când s-au făcut măsurători între două discuri în mișcare, s-a observat o vâscozitate comparabilă cu cea a heliului gazos. Prezenta teorie explică acest lucru folosind un model cu două fluide pentru heliu II. În acest model, se consideră că heliul lichid sub punctul lambda conține o porțiune de atomi de heliu în stare fundamentală care sunt superfluizi și curg cu vâscozitate zero și o porțiune de atomi de heliu în stare excitată care se comportă ca un lichid obișnuit. În efectul de țâșnit, se construiește o cameră care este conectată la rezervorul de heliu II printr-un disc sinterizat prin care heliul superfluid curge ușor, dar prin care heliul nesuperfluid nu poate trece. Dacă interiorul recipientului se încălzește, heliul superfluid se transformă în heliu non-superfluid. Pentru a menține o proporție de echilibru de heliu superfluid, heliul superfluid curge și crește presiunea, determinând eliberarea lichidului din recipient. Conductivitatea termică a heliului II este mai mare decât cea a oricărei alte substanțe cunoscute, de un milion de ori mai mare decât cea a heliului I și de câteva sute de ori mai mare decât cea a cuprului. Acest lucru se datorează faptului că conducția termică are loc datorită unui mecanism cuantic excepțional. Majoritatea materialelor care conduc căldura au o bandă de valență de electroni liberi care servesc la transferul căldurii. Heliul II nu are o astfel de bandă de valență, dar totuși conduce bine căldura. Fluxul de căldură este determinat de ecuații care sunt similare cu ecuația de undă utilizată pentru a caracteriza propagarea sunetului în aer. Când este expus la căldură, călătorește cu 20 de metri pe secundă la 1,8 K prin Helium II sub formă de unde într-un fenomen cunoscut sub numele de al doilea sunet. Heliul II are, de asemenea, un efect târâtor. Când o suprafață trece printr-un nivel de Heliu II, Heliul II se deplasează pe suprafață, împotriva gravitației. Helium II va ieși din recipientul desigilat, alunecând pe părțile laterale până când ajunge într-o zonă mai caldă unde se va evapora. Se mișcă într-o peliculă de 30 nm, indiferent de materialul de suprafață. Acest film se numește film Rollin în onoarea omului de știință care a caracterizat pentru prima dată această calitate, Bernard W. Rollin. Ca urmare a acestui comportament „târâtor” și a capacității Helium II de a curge rapid prin găuri minuscule, este foarte dificil să se limiteze heliul lichid. Cu excepția cazului în care containerul este construit cu grijă, Helium II se va strecura de-a lungul suprafeței și prin supape până ajunge într-o zonă mai caldă, unde se va evapora. Undele care se propagă printr-o peliculă Rollin sunt guvernate de aceeași ecuație ca undele gravitaționale în apă puțin adâncă, dar în loc de gravitație, forța de restabilire este forța van der Waals. Aceste unde sunt cunoscute ca al treilea sunet.
Izotopi
Există nouă izotopi cunoscuți ai heliului, dar numai heliul-3 și heliul-4 sunt stabili. În atmosfera Pământului, există un atom de 3He la un milion de atomi de 4He. Spre deosebire de majoritatea elementelor, abundența izotopică a heliului variază foarte mult ca origine din cauza diferitelor procese de formare. Cel mai comun izotop, heliul-4, este produs pe Pământ prin dezintegrarea alfa a elementelor radioactive mai grele; particulele alfa rezultate sunt nuclee de heliu-4 complet ionizate. Heliul-4 este un nucleu neobișnuit de stabil, deoarece nucleonii săi sunt aranjați în învelișuri complete. De asemenea, s-a format în cantități uriașe în nucleosinteza big bang. Heliul-3 este prezent pe Pământ doar în urme; Majoritatea heliului-3 a fost prezent de la formarea Pământului, deși unele ajung pe Pământ capturate în praful cosmic. Urme de heliu sunt, de asemenea, produse prin degradarea tritiului beta. Rocile din scoarța terestră au rapoarte izotopice care variază cu un factor de zece, iar aceste rapoarte pot fi folosite pentru a studia originile rocilor și compoziția mantalei Pământului. 3El este mult mai frecvent în stele ca produs al fuziunii nucleare. Astfel, în mediul interstelar raportul dintre 3He și 4He este de aproximativ 100 de ori mai mare decât pe Pământ. Materialul extraplanetar, cum ar fi regolitul lunar și asteroidian, conține urme de heliu-3 de la bombardarea vântului solar. Suprafața Lunii conține heliu-3 în concentrații de ordinul a 10 ppm, mult mai mari decât cele aproximativ 5 ppm găsite în atmosfera Pământului. O serie de oameni de știință, începând cu Gerald Kulcinski în 1986, au propus explorarea Lunii, colectarea regolitului lunar și utilizarea heliului-3 pentru fuziune. Heliul-4 lichid poate fi răcit la aproximativ 1 kelvin folosind răcirea evaporativă într-o oală care atinge 1 K. Răcirea similară a punctului de fierbere inferior heliului-3 poate ajunge la aproximativ 0,2 kelvin într-un frigider cu heliu-3. Amestecuri egale de 3He și 4He lichide cu temperaturi sub 0,8 K se separă în două faze nemiscibile datorită disimilarității lor (au statistici cuantice diferite: atomii de heliu-4 sunt bosoni, în timp ce atomii de heliu-3 sunt fermioni). La mașinile frigorifice care funcționează pe un amestec de substanțe criogenice, această nemiscibilitate este utilizată pentru a atinge temperaturi de câteva milikelvini. Este posibil să se producă izotopi exotici de heliu care se descompun rapid în alte substanțe. Cel mai scurt izotop greu al heliului este heliul-5, cu un timp de înjumătățire de 7,6×10-22 s. Heliul-6 se descompune prin emiterea unei particule beta și are un timp de înjumătățire de 0,8 secunde. Heliul-7 emite, de asemenea, o particulă beta, precum și o rază gamma. Heliul-7 și heliul-8 se formează în unele reacții nucleare. Se știe că heliul-6 și heliul-8 au un halou nuclear.
Compuși cu heliu
Heliul are o valență de 0 și este inactiv din punct de vedere chimic în toate condițiile normale. Heliul este un izolator electric, cu excepția cazului în care este ionizat. Ca și alte gaze nobile, heliul are niveluri de energie metastabile care îi permit să rămână ionizat într-o descărcare electrică la o tensiune sub potențialul său de ionizare. Heliul poate forma compuși instabili cunoscuți sub numele de excimeri cu wolfram, iod, fluor, sulf și fosfor atunci când este supus la descărcări strălucitoare, bombardament cu electroni sau redus la plasmă prin alte mijloace. În acest fel au fost creați compușii moleculari HeNe, HgHe10 și WHe2 și ionii moleculari He+2, He2+2, HeH+ și HeD+. HeH+ este, de asemenea, stabil în starea sa fundamentală, dar este extrem de reactiv - este cel mai puternic acid Brønsted și, prin urmare, poate exista doar izolat, deoarece va protona orice moleculă sau protianion cu care intră în contact. Această metodă a creat, de asemenea, molecula neutră He2, care are un număr mare de sisteme de bandă, și HgHe, care pare să fie ținută împreună doar de forțele de polarizare. Compușii de heliu Van der Waals se pot forma, de asemenea, cu heliu gazos criogenic și atomi ai unei alte substanțe, cum ar fi LiHe și He2. Teoretic, este posibil să existe și alți compuși adevărați, cum ar fi fluorhidrura de heliu (HHeF), care ar fi similar cu HArF descoperit în 2000. Calculele arată că doi compuși noi care conțin o legătură heliu-oxigen pot fi stabili. Cele două noi specii moleculare prezise folosind teoria, CsFHeO și N(CH3)4FHeO, sunt derivați ai anionului metastabil FHeO propus pentru prima dată în 2005 de un grup din Taiwan. Dacă acest lucru este confirmat prin experiment, singurul element rămas fără compuși stabili cunoscuți va fi neonul. Atomii de heliu au fost inserați în molecule de cadre goale de carbon (fulerene) prin încălzire la presiune ridicată. Moleculele fullerene endoedrice create sunt stabile la temperaturi ridicate. Când se formează derivați chimici ai acestor fulerene, heliul rămâne în interior. Dacă se utilizează heliu-3, acesta poate fi observat cu ușurință utilizând spectroscopie de rezonanță magnetică nucleară cu heliu. Au fost raportate multe fulerene care conțin heliu-3. Deși atomii de heliu nu sunt legați prin legături covalente sau ionice, aceste substanțe au anumite proprietăți și o anumită compoziție, ca toți compușii chimici stoichiometrici. La presiuni mari, heliul poate forma compuși cu diverse alte elemente. Cristalele de clatrat de heliu-azot (He(N2)11) au fost crescute la temperatura camerei la presiuni de cca. 10 GPa într-o cameră de înaltă presiune cu nicovale de diamant. S-a dovedit că electrolitul izolator Na2He este stabil termodinamic la presiuni de peste 113 GPa. Are o structură de fluorit.
Origine și producție
Abundență naturală
Deși heliul este rar pe Pământ, este al doilea cel mai abundent element din Universul cunoscut (după hidrogen), reprezentând 23% din masa sa barionică. Marea majoritate a heliului s-a format prin nucleosinteza Big Bang la unu până la trei minute după Big Bang. Astfel, măsurătorile abundenței sale contribuie la modelele cosmologice. În stele, heliul se formează prin fuziunea nucleară a hidrogenului în reacțiile în lanț proton-proton și ciclul CNO, parte a nucleosintezei stelare. În atmosfera Pământului, concentrația de heliu în volum este de doar 5,2 părți per milion. Concentrația este scăzută și destul de constantă, în ciuda producției continue de nou heliu, deoarece cea mai mare parte a heliului din atmosfera Pământului intră în spațiu prin mai multe procese. În heterosfera terestră, o parte din atmosfera superioară, heliul și alte gaze mai ușoare sunt elementele cele mai abundente. Cea mai mare parte a heliului de pe Pământ este rezultatul dezintegrarii radioactive. Heliul se găsește în cantități mari în mineralele de uraniu și toriu, inclusiv kleveita, rășină, carnotită și monazit, deoarece eliberează particule alfa (nuclee de heliu, He2+), cu care electronii se leagă imediat de îndată ce particula este oprită de o piatră. Astfel, în întreaga litosferă sunt generate aproximativ 3000 de tone metrice de heliu. În scoarța terestră, concentrația de heliu este de 8 părți per miliard. În apa de mare concentrația este de doar 4 părți per trilion. Cantități mici de heliu sunt prezente și în izvoarele minerale, gazul vulcanic și fierul meteoric. Deoarece heliul este prins în pământ în condiții care captează și gazele naturale, cele mai mari concentrații naturale de heliu de pe planetă se găsesc în gazele naturale, din care se extrage majoritatea heliului comercial. Concentrațiile de heliu variază foarte mult, de la câteva ppm la peste 7% într-un mic zăcământ de gaze din județul San Juan, New Mexico. Începând cu 2011, rezervele globale de heliu au fost estimate la 40 de miliarde de metri cubi, un sfert din aceste rezerve fiind situate în zăcământul South Pars/North Dome Gas-Condensate, deținut în comun de Qatar și Iran. În 2015 și 2016, au fost anunțate rezerve mai probabile în Munții Stâncoși din America de Nord și Africa de Est.
Producție și distribuție modernă
Pentru utilizare pe scară largă, heliul este extras prin distilare fracționată din gazul natural, care poate conține până la 7% heliu. Deoarece heliul are un punct de fierbere mai mic decât orice alt element, temperatura scăzută și presiunea ridicată sunt folosite pentru a lichefia aproape toate celelalte gaze (în principal azot și metan). Heliul gazos brut rezultat este purificat prin etape succesive de scădere a temperaturii, moment în care aproape tot azotul rămas și alte gaze sunt precipitate din amestecul de gaze. Cărbunele activat este utilizat ca etapă finală de purificare, producând în mod obișnuit heliu de clasa A pur 99,995%. Principala impuritate din heliul clasa A este neonul. În etapa finală a producției, cea mai mare parte a heliului produs este lichefiat printr-un proces criogenic. Acest lucru este esențial pentru aplicațiile care necesită heliu lichid și, de asemenea, permite furnizorilor de heliu să reducă costul transportului de heliu pe distanțe lungi, deoarece cele mai mari containere de heliu lichid au o capacitate de peste cinci ori mai mare decât cele mai mari remorci de heliu cu gaz. În 2008, aproximativ 169 de milioane de metri cubi standard de heliu au fost extrași din gaze naturale sau extrași din rezervele de heliu, aproximativ 78% din Statele Unite, 10% din Algeria și cea mai mare parte din restul din Rusia, Polonia și Qatar. Până în 2013, producția crescută de heliu în Qatar (RasGas sub Air Liquide) a crescut ponderea Qatarului în producția globală de heliu la 25% și a făcut din țară al doilea exportator de heliu după Statele Unite. Se estimează că aproximativ 54 de miliarde de picioare cubi (1,5×109 m3) de heliu au fost descoperite în Tanzania în 2016. În Statele Unite, cea mai mare parte a heliului este extras din gazul natural în Hugoton și zăcămintele de gaz din apropiere din Kansas, Oklahoma și zăcământul Panhandle din Texas. O mare parte din acest gaz a fost odată transportat către Rezervația Națională de Heliu, dar rezerva a fost epuizată și vândută din 2005 și este de așteptat să se epuizeze în mare parte până în 2021, conform Actului Responsible Helium and Stewardship, adoptat în octombrie 2013 (HR). 527). Difuzia gazelor naturale brute prin membrane speciale semi-permeabile și alte bariere este o altă modalitate de recuperare și purificare a heliului. În 1996, Statele Unite au descoperit rezerve de heliu în astfel de complexe de puțuri de gaz, aproximativ 147 miliarde de picioare cubi standard (4,2 miliarde SCM). La ritmul de utilizare la acea vreme (72 milioane SCM pe an în SUA), ar exista suficient heliu pentru a rezista aproximativ 58 de ani în SUA și mai puțin decât atât (poate 80% din timp) în lume, dar factorii care afectează economia și prelucrarea, afectează indicatorii efectivi ai rezervelor. Heliul trebuie extras din gazul natural deoarece este doar o fracțiune din fracția de neon din aer, dar cererea pentru acesta este mult mai mare. Se estimează că, dacă toate produsele cu neon ar fi convertite pentru a stoca heliu, 0,1% din cererea mondială de heliu ar fi satisfăcută. De asemenea, doar 1% din necesarul mondial de heliu poate fi satisfăcut prin reinstalarea tuturor instalațiilor de distilare a aerului. Heliul poate fi sintetizat prin bombardarea litiului sau borului cu protoni de mare viteză sau prin bombardarea litiului cu deuteroni, dar aceste procese sunt complet neeconomice. Heliul este disponibil comercial sub formă lichidă sau gazoasă. Ca lichid, poate fi furnizat în recipiente izolate mici numite dewars, care dețin până la 1.000 de litri de heliu, sau în recipiente mari ISO, care au o capacitate nominală de până la 42 m3 (aproximativ 11.000 de galoane SUA). Sub formă gazoasă, cantități mici de heliu sunt vândute în butelii de înaltă presiune care conțin până la 8 m3 (aproximativ 282 picioare cubi standard) de heliu, în timp ce cantități mari de gaz de înaltă presiune sunt furnizate în remorci tubulare care au o capacitate de 4.860 m3. (aproximativ 172.000 picioare cubi standard) de heliu.picioare cubi).
Protectie de siguranta cu heliu
Potrivit susținătorilor conservării heliului, cum ar fi fizicianul laureat al Premiului Nobel Robert Coleman Richardson, scriind în 2010, prețul de pe piața liberă al heliului a contribuit la utilizarea lui „risipitoare” (cum ar fi pentru baloanele cu heliu). În anii 2000, prețurile au fost scăzute printr-o decizie a Congresului SUA de a vinde rezerve mari de heliu în țară până în 2015. Prețul ar trebui înmulțit cu 20 pentru a elimina epuizarea excesivă a heliului, a spus Richardson. În cartea lor The Future of Helium as a Natural Resource (Routledge, 2012), Nuttall, Clarke & Glowacki (2012) au propus, de asemenea, crearea unei Agenții Internaționale pentru Heliu (IHA) pentru a crea o piață durabilă pentru această marfă prețioasă.
Domenii de utilizare
În timp ce baloanele sunt poate cel mai cunoscut mod de a folosi heliu, ele reprezintă o mică parte din toată utilizarea heliului. Heliul este utilizat în multe scopuri care necesită unele dintre proprietățile sale unice, cum ar fi punctul de fierbere scăzut, densitate scăzută, solubilitate scăzută, conductivitate termică ridicată sau inerție. Din producția mondială totală de heliu din 2014, aproximativ 32 de milioane de kg (180 de milioane de metri cubi standard) de heliu pe an, cea mai mare utilizare (aproximativ 32% din totalul din 2014) este în aplicații criogenice, majoritatea implicând magneți supraconductori de răcire în domeniul medical. Scanere RMN și spectrometre RMN. Alte aplicații majore au fost sistemele de presurizare și purjare, sudare, întreținere în atmosferă controlată și detectarea scurgerilor. Alte utilizări pe categorii au reprezentat fracții relativ mici.
Atmosfere controlate
Heliul este folosit ca gaz de protecție în creșterea cristalelor de siliciu și germaniu, în producerea de titan și zirconiu și în cromatografia în gaz, deoarece este inert. Datorită inerției sale, naturii perfecte termice și calorice, vitezei mari a sunetului și raportului mare de capacitate termică, este util și în tunelurile eoliene supersonice și în instalațiile de impuls.
Sudare cu arc de tungsten cu gaz
Heliul este utilizat ca gaz de protecție în procesele de sudare cu arc pe materiale care sunt contaminate și slăbite de aer sau azot la temperaturi de sudare. Sudarea cu arc de tungsten cu gaz folosește o gamă de gaze de protecție inerte, dar folosește heliu în loc de argon ieftin, în special pentru materialele de sudare cu conductivitate termică mai mare, cum ar fi aluminiul sau cuprul.
Utilizări mai puțin obișnuite
Detectarea scurgerilor industriale
O utilizare industrială a heliului este detectarea scurgerilor. Deoarece heliul difuzează prin solide de trei ori mai repede decât aerul, este folosit ca gaz trasor pentru a detecta scurgerile în echipamentele cu vid înalt (cum ar fi rezervoarele criogenice) și containerele de înaltă presiune. Substanța de testat este plasată într-o cameră, care este apoi evacuată și umplută cu heliu. Heliul care trece printr-o scurgere este detectat de un dispozitiv sensibil (spectrometru de masă cu heliu) chiar și la rate de scurgere de 10-9 mbar l/s (10-10 Pa m3/s). Procedura de măsurare este de obicei efectuată automat și se numește test integral cu heliu. Procedura simplă este să umpleți obiectul de testat cu heliu și să căutați manual scurgeri folosind un dispozitiv portabil. Scurgerile de heliu prin fisuri nu trebuie confundate cu pătrunderea gazului prin materialul în vrac. În timp ce heliul a documentat constante de permeație (ratele de permeație estimate astfel) prin sticlă, ceramică și materiale sintetice, gazele nobile precum heliul nu vor pătrunde în majoritatea metalelor mari.
Zbor
Deoarece heliul este mai ușor decât aerul, dirijabilele și baloanele sunt pompate cu acest gaz pentru a le ridica în aer. În timp ce hidrogenul gazos este mai capabil să adere la o suprafață și penetrează membrana într-un ritm mai lent, heliul are avantajul de a fi neinflamabil și cu adevărat ignifug. O altă utilizare minoră a heliului este în rachete, unde heliul este folosit ca o pernă de aer pentru a înlocui combustibilul și oxidanții în rezervoarele de stocare și pentru a condensa hidrogenul și oxigenul pentru a produce combustibil pentru rachete. De asemenea, este folosit pentru purificarea combustibilului și a oxidantului din echipamentele de sprijin de la sol înainte de lansare și pentru pre-răcirea hidrogenului lichid pe nave spațiale. De exemplu, racheta Saturn V folosită în programul Apollo a necesitat aproximativ 370.000 m3 (13 milioane de picioare cubi) de heliu pentru a fi lansată.
Utilizări comerciale și recreative minore
Heliul ca gaz de respirație nu are proprietăți narcotice, așa că amestecurile de heliu precum Trimix, Heliox și Heliair sunt folosite pentru scufundări adânci pentru a reduce efectele anesteziei, care se agravează odată cu creșterea adâncimii. Pe măsură ce presiunea crește la adâncime, crește și densitatea gazului de respirație, iar greutatea moleculară scăzută a heliului reduce semnificativ efortul de respirație, reducând densitatea amestecului. Acest lucru reduce numărul de fluxuri Reynolds, ceea ce are ca rezultat un flux mai puțin turbulent și mai mult flux laminar, ceea ce necesită mai puțină muncă pentru a respira. La adâncimi sub 150 de metri (490 de picioare), scafandrii care inhalează amestecuri de heliu-oxigen încep să experimenteze tremurături și scăderea funcției psihomotorii, un sindrom nervos cauzat de hipertensiunea arterială. Într-o oarecare măsură, acest efect poate fi facilitat prin adăugarea unor gaze narcotice, cum ar fi hidrogenul sau azotul, la amestecul de heliu-oxigen. Laserele cu heliu-neon, un tip de laser cu gaz cu putere redusă care produce un fascicul roșu, au avut o varietate de aplicații practice, inclusiv cititoare de coduri de bare și indicatori laser, înainte de a fi înlocuite aproape universal cu lasere cu diode mai ieftine. Datorită inerției sale și conductivității termice ridicate, transparenței neutronilor și lipsei de formare a izotopilor radioactivi în condiții de reactor, heliul este utilizat ca agent de răcire în unele reactoare nucleare răcite cu gaz. Heliul amestecat cu un gaz mai greu, cum ar fi xenonul, este util pentru răcirea termoacustică datorită coeficientului ridicat de capacitate termică rezultat și numărului Prandtl scăzut. Inerția heliului are avantaje de mediu față de sistemele tradiționale de refrigerare, care contribuie la epuizarea stratului de ozon sau la încălzirea globală. Heliul este, de asemenea, utilizat în unele hard disk-uri.
Aplicații științifice
Utilizarea heliului reduce efectele de distorsionare ale schimbărilor de temperatură în spațiul dintre lentile la unele telescoape datorită indicelui său de refracție extrem de scăzut. Această metodă este utilizată în special în telescoapele solare, unde tubul telescopului izolat în vid ar fi prea greu. Heliul este un gaz purtător utilizat pe scară largă pentru cromatografia gazoasă. Vârsta rocilor și a mineralelor care conțin uraniu și toriu poate fi estimată prin măsurarea nivelurilor de heliu într-un proces cunoscut sub numele de datare cu heliu. Heliul la temperaturi scăzute este utilizat în criogenie și în unele aplicații de criogenie. Ca exemple de astfel de aplicații, heliul lichid este utilizat pentru a răci unele metale la temperaturile extrem de scăzute necesare pentru supraconductivitate, cum ar fi magneții supraconductori pentru imagistica prin rezonanță magnetică. Large Hadron Collider de la CERN folosește 96 de tone metrice de heliu lichid pentru a menține o temperatură de 1,9 kelvin.
Inhalare și siguranță
Efecte
Heliul neutru este netoxic în condiții standard, nu joacă niciun rol biologic și se găsește în urme în sângele uman. Viteza sunetului în heliu este de aproape trei ori mai mare decât viteza sunetului în aer. Deoarece frecvența fundamentală a unei cavități pline cu gaz este proporțională cu viteza sunetului în gaz, atunci când heliul este inhalat, există o creștere corespunzătoare a frecvențelor de rezonanță ale tractului vocal. Frecvența fundamentală (numită uneori ton) nu se schimbă, deoarece aceasta se produce prin vibrația directă a corzilor vocale, care nu se modifică. Cu toate acestea, frecvențele de rezonanță mai înalte provoacă o schimbare a timbrului, rezultând un sunet subțire, asemănător unei rate. Efectul opus, scăderea frecvențelor de rezonanță, poate fi obținut prin inhalarea unui gaz dens precum hexafluorura de sulf sau xenonul.
Pericole
 Inhalarea unor cantități în exces de heliu poate fi periculoasă, deoarece heliul este un simplu asfixiant care înlocuiește oxigenul necesar pentru respirația normală. Au fost raportate decese, inclusiv un tânăr care s-a sufocat în Vancouver în 2003 și doi adulți care s-au sufocat în Florida de Sud în 2006. În 1998, o fată australiană (vârsta ei necunoscută) din Victoria a căzut inconștientă și a devenit temporar albastră după ce a inhalat întreg conținutul unui rezervor de heliu. Inhalarea heliului direct din butelii presurizate sau chiar din supapele de umplere a buteliilor este extrem de periculoasă, deoarece debitele și presiunile mari pot provoca barotraumă, leziuni fatale ale țesutului pulmonar. Moartea cauzată de heliu este rară. Primul caz raportat a fost cel al unei fete de 15 ani din Texas, care a murit în 1998 din cauza inhalării de heliu la petrecerea unui prieten. În Statele Unite, doar două decese au fost raportate între 2000 și 2004, inclusiv un bărbat care a murit în Carolina de Nord din cauza barotraumelor în 2002. Un tânăr s-a sufocat în Vancouver în 2003, iar un bărbat de 27 de ani din Australia a avut o embolie după ce a inhalat gaz dintr-o butelie în 2000. De atunci, doi adulți s-au sufocat în Florida de Sud în 2006, mai multe cazuri au fost raportate în 2009 și 2010, unul care implică un tânăr din California găsit cu o pungă deasupra capului atașată de un rezervor de heliu, iar altul care implică un adolescent din Irlanda de Nord, a murit. de sufocare. În Eagle Point, Oregon, o adolescentă a murit în 2012 în urma unei barotraumă la o petrecere. O fată din Michigan a murit de hipoxie mai târziu în acel an. Pe 4 februarie 2015, a fost dezvăluit că pe 28 ianuarie, în timpul unei înregistrări a emisiunii de televiziune a grupului de fete japoneze 3B Junior, un membru al grupului de 12 ani (al cărui nume a fost ținut secret) a suferit o embolie, și-a pierdut cunoștința și a intrat în comă ca urmare a bulelor de aer care blochează fluxul de sânge în creier.după ce a inhalat cantități uriașe de heliu. Incidentul a fost făcut public până în săptămâna următoare. Personalul TV Asahi a susținut o conferință de presă de urgență pentru a raporta că fata a fost dusă la spital și că prezenta semne de recuperare, cum ar fi mișcarea ochilor și a membrelor, dar conștiința ei nu și-a revenit încă pe deplin. Polițiștii au demarat o anchetă din cauza neglijării măsurilor de securitate. Preocupările de siguranță pentru heliul criogenic sunt similare cu cele pentru azotul lichid; temperaturile sale extrem de scăzute pot provoca arsuri la rece, iar raportul său de expansiune lichid-gaz poate provoca explozii dacă nu sunt instalate dispozitive de reducere a presiunii. Containerele cu heliu gazos la 5-10 K ar trebui tratate ca și cum ar conține heliu lichid datorită expansiunii termice rapide și semnificative care apare atunci când heliul gazos la mai puțin de 10 K este încălzit la temperatura camerei. La presiuni mari (mai mult de aproximativ 20 atm sau doi MPa), un amestec de heliu și oxigen (heliox) poate duce la sindromul nervos de înaltă presiune, un fel de efect anestezic invers; adăugarea unei cantități mici de azot la amestec poate atenua problema.
Inhalarea unor cantități în exces de heliu poate fi periculoasă, deoarece heliul este un simplu asfixiant care înlocuiește oxigenul necesar pentru respirația normală. Au fost raportate decese, inclusiv un tânăr care s-a sufocat în Vancouver în 2003 și doi adulți care s-au sufocat în Florida de Sud în 2006. În 1998, o fată australiană (vârsta ei necunoscută) din Victoria a căzut inconștientă și a devenit temporar albastră după ce a inhalat întreg conținutul unui rezervor de heliu. Inhalarea heliului direct din butelii presurizate sau chiar din supapele de umplere a buteliilor este extrem de periculoasă, deoarece debitele și presiunile mari pot provoca barotraumă, leziuni fatale ale țesutului pulmonar. Moartea cauzată de heliu este rară. Primul caz raportat a fost cel al unei fete de 15 ani din Texas, care a murit în 1998 din cauza inhalării de heliu la petrecerea unui prieten. În Statele Unite, doar două decese au fost raportate între 2000 și 2004, inclusiv un bărbat care a murit în Carolina de Nord din cauza barotraumelor în 2002. Un tânăr s-a sufocat în Vancouver în 2003, iar un bărbat de 27 de ani din Australia a avut o embolie după ce a inhalat gaz dintr-o butelie în 2000. De atunci, doi adulți s-au sufocat în Florida de Sud în 2006, mai multe cazuri au fost raportate în 2009 și 2010, unul care implică un tânăr din California găsit cu o pungă deasupra capului atașată de un rezervor de heliu, iar altul care implică un adolescent din Irlanda de Nord, a murit. de sufocare. În Eagle Point, Oregon, o adolescentă a murit în 2012 în urma unei barotraumă la o petrecere. O fată din Michigan a murit de hipoxie mai târziu în acel an. Pe 4 februarie 2015, a fost dezvăluit că pe 28 ianuarie, în timpul unei înregistrări a emisiunii de televiziune a grupului de fete japoneze 3B Junior, un membru al grupului de 12 ani (al cărui nume a fost ținut secret) a suferit o embolie, și-a pierdut cunoștința și a intrat în comă ca urmare a bulelor de aer care blochează fluxul de sânge în creier.după ce a inhalat cantități uriașe de heliu. Incidentul a fost făcut public până în săptămâna următoare. Personalul TV Asahi a susținut o conferință de presă de urgență pentru a raporta că fata a fost dusă la spital și că prezenta semne de recuperare, cum ar fi mișcarea ochilor și a membrelor, dar conștiința ei nu și-a revenit încă pe deplin. Polițiștii au demarat o anchetă din cauza neglijării măsurilor de securitate. Preocupările de siguranță pentru heliul criogenic sunt similare cu cele pentru azotul lichid; temperaturile sale extrem de scăzute pot provoca arsuri la rece, iar raportul său de expansiune lichid-gaz poate provoca explozii dacă nu sunt instalate dispozitive de reducere a presiunii. Containerele cu heliu gazos la 5-10 K ar trebui tratate ca și cum ar conține heliu lichid datorită expansiunii termice rapide și semnificative care apare atunci când heliul gazos la mai puțin de 10 K este încălzit la temperatura camerei. La presiuni mari (mai mult de aproximativ 20 atm sau doi MPa), un amestec de heliu și oxigen (heliox) poate duce la sindromul nervos de înaltă presiune, un fel de efect anestezic invers; adăugarea unei cantități mici de azot la amestec poate atenua problema.
:Etichete
Lista literaturii folosite:
Rayet, G. (1868) "Analyse spectral des protuberances observées, pendant l"éclipse totale de Soleil visible le 18 août 1868, à la presqu"île de Malacca" (Analiza spectrală a protuberanțelor observate în timpul eclipsei totale de soare, văzută pe 18 august 1868, din peninsula Malacca), Comptes rendus…, 67: 757–759. De la p. 758: „... je vis immédiatement une série de neuf lignes brillantes qui... me semblent devoir être assimilées aux lignes principales du spectre solaire, B, D, E, b, une ligne inconnue, F, et deux lignes du groupe G." (... Am văzut imediat o serie de nouă linii strălucitoare care... mi s-au părut că ar trebui clasificate drept liniile principale ale spectrului solar, B, D, E, b, o linie necunoscută, F și două linii de grupul G.
Heliul este elementul de ordinul doi al sistemului periodic de elemente chimice al lui D. I. Mendeleev, cu număr atomic 2. Este situat în subgrupa principală a grupei a opta, prima perioadă a sistemului periodic. Conduce grupul de gaze nobile din tabelul periodic. Notat prin simbolul El (lat. Heliu). Substanța simplă heliu (număr CAS: 7440-59-7) este un gaz monoatomic inert, fără culoare, gust sau miros. Heliul este unul dintre cele mai comune elemente din Univers, al doilea numai după hidrogen. Heliul este, de asemenea, al doilea element chimic cel mai ușor (după hidrogen). Heliul este extras din gazul natural printr-un proces de separare la temperatură joasă - așa-numita distilare fracționată.
La 18 august 1868, omul de știință francez Pierre Jansen, în timpul unei eclipse totale de soare în orașul indian Guntur, a examinat pentru prima dată cromosfera Soarelui. Jansen a reușit să configureze spectroscopul în așa fel încât spectrul coroanei solare să poată fi observat nu numai în timpul unei eclipse, ci și în zilele obișnuite. Chiar a doua zi, spectroscopia proeminențelor solare, împreună cu liniile de hidrogen - albastru, verde-albastru și roșu - a scos la iveală o linie galbenă foarte strălucitoare, luată inițial de Jansen și alți astronomi care au observat că este linia D de sodiu. Jansen a scris imediat despre aceasta Academiei Franceze de Științe. Ulterior s-a constatat că linia galbenă strălucitoare din spectrul solar nu coincide cu linia sodiului și nu aparține niciunuia dintre elementele chimice cunoscute anterior.
Două luni mai târziu, pe 20 octombrie, astronomul englez Norman Lockyer, neștiind despre evoluțiile colegului său francez, a efectuat și el cercetări asupra spectrului solar. După ce a descoperit o linie galbenă necunoscută cu o lungime de undă de 588 nm (mai precis 587,56 nm), a desemnat-o D3, deoarece era foarte aproape de liniile Fraunhofer D 1 (589,59 nm) și D 2 (588,99 nm) sodiu. Doi ani mai târziu, Lockyer, împreună cu chimistul englez Edward Frankland, cu care a lucrat, a propus să dea noului element numele de „heliu” (din greaca veche ἥλιος - „soare”).
Este interesant că scrisorile lui Jansen și Lockyer au ajuns la Academia Franceză de Științe în aceeași zi - 24 octombrie 1868, dar scrisoarea lui Lockyer, scrisă cu patru zile mai devreme, a sosit cu câteva ore mai devreme. A doua zi, ambele scrisori au fost citite la o ședință a Academiei. În cinstea noii metode de studiu a proeminențelor, Academia Franceză a decis să bată o medalie. Pe o parte a medaliei erau portrete ale lui Jansen și Lockyer peste ramuri de dafin încrucișate, iar pe cealaltă era o imagine a miticului zeu Soare Apollo, care conducea un car cu patru cai care galopau cu viteză maximă.
În 1881, italianul Luigi Palmieri a publicat un raport despre descoperirea sa de heliu în gazele vulcanice (fumarole). El a examinat o substanță uleioasă galben deschis care s-a depus din jeturile de gaz de pe marginile craterului Vezuvius. Palmieri a calcinat acest produs vulcanic în flacăra unui arzător Bunsen și a observat spectrul gazelor eliberate. Cercurile științifice au întâmpinat acest mesaj cu neîncredere, deoarece Palmieri a descris experiența sa neclar. Mulți ani mai târziu, cantități mici de heliu și argon au fost de fapt găsite în fumarole.
La numai 27 de ani de la descoperirea sa inițială, heliul a fost descoperit pe Pământ - în 1895, chimistul scoțian William Ramsay, examinând o probă din gazul obținut din descompunerea mineralului kleveite, a descoperit în spectrul său aceeași linie galbenă strălucitoare găsită mai devreme în spectrul solar. Proba a fost trimisă pentru cercetări suplimentare celebrului spectroscopist englez William Crookes, care a confirmat că linia galbenă observată în spectrul probei coincide cu linia D3 a heliului. Pe 23 martie 1895, Ramsay a trimis un mesaj despre descoperirea sa de heliu pe Pământ Societății Regale din Londra, precum și Academiei Franceze prin celebrul chimist Marcelin Berthelot.
În 1896, Heinrich Kaiser, Siegbert Friedländer și doi ani mai târziu Edward Beley au dovedit în sfârșit prezența heliului în atmosferă.
Chiar înainte de Ramsay, heliul a fost izolat și de chimistul american Francis Hillebrand, dar el a crezut în mod eronat că a obținut azot și într-o scrisoare către Ramsay și-a recunoscut prioritatea descoperirii.
Examinând diferite substanțe și minerale, Ramsay a descoperit că heliul din ele însoțește uraniul și toriu. Dar abia mai târziu, în 1906, Rutherford și Royds au descoperit că particulele alfa ale elementelor radioactive erau nuclee de heliu. Aceste studii au pus bazele teoriei moderne a structurii atomice.
Abia în 1908, fizicianul olandez Heike Kamerlingh Onnes a reușit să obțină heliu lichid prin throttling (vezi efectul Joule-Thomson), după ce gazul a fost pre-răcit în hidrogen lichid fierbinte sub vid. Încercările de a obține heliu solid au rămas fără succes pentru o lungă perioadă de timp, chiar și la o temperatură de 0,71 K, ceea ce a fost realizat de elevul lui Kamerlingh Onnes, fizicianul german Willem Hendrik Keesom. Abia în 1926, prin aplicarea unei presiuni peste 35 atm și răcirea heliului comprimat în heliu lichid fierbinte sub rarefacție, a reușit să izoleze cristalele.
În 1932, Keesom a studiat natura modificării capacității termice a heliului lichid cu temperatura. El a descoperit că în jurul valorii de 2,19 K, o creștere lentă și treptată a capacității de căldură face loc unei scăderi accentuate, iar curba capacității termice ia forma literei grecești λ (lambda). Prin urmare, temperatura la care are loc o creștere a capacității de căldură primește denumirea convențională de „punct λ”. O valoare mai precisă a temperaturii în acest punct, stabilită ulterior, este de 2,172 K. În punctul λ apar modificări profunde și bruște ale proprietăților fundamentale ale heliului lichid - o fază a heliului lichid este înlocuită în acest punct cu alta, fără a se elibera. căldură latentă; are loc o tranziție de fază de ordinul doi. Deasupra temperaturii punctului λ există așa-numitul heliu-I, iar sub acesta - heliu-II.
În 1938, fizicianul sovietic Pyotr Leonidovich Kapitsa a descoperit fenomenul de superfluiditate a heliului II lichid, care constă într-o scădere bruscă a coeficientului de vâscozitate, ca urmare a căreia heliul curge practic fără frecare. Acesta este ceea ce a scris într-unul dintre rapoartele sale despre descoperirea acestui fenomen.
originea numelui
Din greaca ἥλιος - „Soare” (vezi Helios). Este curios că numele elementului folosea terminația „-i”, caracteristică metalelor (în latină „-um” - „heliu”), întrucât Lockyer a presupus că elementul pe care l-a descoperit este un metal. Prin analogie cu alte gaze nobile, ar fi logic să îi dăm numele „Helion”. În știința modernă, numele „heliu” este atribuit nucleului unui izotop ușor de heliu - heliu-3.
Prevalența
În Univers
Heliul este al doilea ca abundență în Univers după hidrogen - aproximativ 23% din masă. Cu toate acestea, heliul este rar pe Pământ. Aproape tot heliul din Univers s-a format în primele minute după Big Bang, în timpul nucleosintezei primordiale. În Universul modern, aproape tot noul heliu se formează ca rezultat al fuziunii termonucleare din hidrogen în interiorul stelelor (vezi ciclul proton-proton, ciclul carbon-azot). Pe Pământ, se formează ca urmare a dezintegrarii alfa a elementelor grele (particulele alfa emise în timpul dezintegrarii alfa sunt nuclee de heliu-4). O parte din heliul care apare în timpul dezintegrarii alfa și se infiltrează prin rocile scoarței terestre este captată de gazul natural, concentrația de heliu în care poate ajunge la 7% din volum și mai mult.
Scoarta terestra
În cadrul celui de-al optulea grup, heliul ocupă locul al doilea ca conținut în scoarța terestră (după argon). Conținutul de heliu din atmosferă (format ca urmare a dezintegrarii Ac, Th, U) este de 5,27×10−4% în volum, 7,24×10−5% în masă. Rezervele de heliu din atmosferă, litosferă și hidrosferă sunt estimate la 5×1014 m³. Gazele naturale care conțin heliu conțin de obicei până la 2% heliu în volum. Extrem de rare sunt acumulările de gaze, al căror conținut de heliu ajunge la 8 - 16%. Conținutul mediu de heliu în materia terestră este de 3 g/t. Cea mai mare concentrație de heliu se observă în mineralele care conțin uraniu, toriu și samariu: kleveit, fergusonit, samarskite, gadolinit, monazit (nisipuri monazite din India și Brazilia), thorianit. Conținutul de heliu din aceste minerale este de 0,8 - 3,5 l/kg, iar în torianit ajunge la 10,5 l/kg.
Definiție
Heliul se determină calitativ prin analiza spectrelor de emisie (linii caracteristice 587,56 nm și 388,86 nm), cantitativ prin metode de analiză spectrometrică de masă și cromatografică, precum și prin metode bazate pe măsurarea proprietăților fizice (densitate, conductivitate termică etc.).
Proprietăți chimice
Heliul este elementul cel mai puțin activ din punct de vedere chimic din grupa a opta a tabelului periodic (gaze inerte). Mulți compuși de heliu există doar în fază gazoasă sub formă de așa-numitele molecule excimeri, în care stările electronice excitate sunt stabile, iar starea fundamentală este instabilă. Heliul formează molecule diatomice He 2 +, fluorură de HeF, clorură de HeCl (moleculele de excimer se formează prin acțiunea unei descărcări electrice sau a radiațiilor ultraviolete asupra unui amestec de heliu cu fluor sau clor). Compusul chimic al heliului LiHe este cunoscut (poate că s-a înțeles compusul LiHe 7
Chitanță
În industrie, heliul se obține din gazele naturale care conțin heliu (în prezent se exploatează în principal zăcăminte care conțin > 0,1% heliu). Heliul este separat de alte gaze prin răcire profundă, profitând de faptul că se lichefiază mai greu decât toate celelalte gaze. Răcirea se realizează prin throttling în mai multe etape, purificând-o de CO 2 și hidrocarburi. Rezultatul este un amestec de heliu, neon și hidrogen. Acest amestec, așa-numitul. heliul brut (He - 70-90% vol.) se purifică din hidrogen (4-5%) folosind CuO la 650-800 K. Purificarea finală se realizează prin răcirea amestecului rămas cu N2 fierbere sub vid și adsorbția impurităților pe activ. carbon în adsorbante, răcit de asemenea cu N2 lichid. Acestea produc heliu de puritate tehnică (99,80% heliu în volum) și puritate ridicată (99,985%). În Rusia, heliul gazos este obținut din gazele naturale și petroliere. În prezent, heliul este extras la uzina de heliu a lui Gazprom Dobycha Orenburg LLC din Orenburg din gaz cu un conținut scăzut de heliu (până la 0,055% vol.), deci heliul rusesc are un cost ridicat. O problemă urgentă este dezvoltarea și prelucrarea cuprinzătoare a gazelor naturale din zăcăminte mari din Siberia de Est, cu un conținut ridicat de heliu (0,15-1% vol.), ceea ce va reduce semnificativ costul acesteia. SUA este lider în producția de heliu (140 milioane m³ pe an), urmată de Algeria (16 milioane m³). Rusia ocupă locul trei în lume - 6 milioane m³ pe an. Rezervele mondiale de heliu se ridică la 45,6 miliarde m³.