Отличные проводники электрического тока — золото, медь, железо, алюминий, сплавы. Наряду с ними существует большая группа веществ-неметаллов, расплавы и водные растворы которых тоже обладают свойством проводимости. Это сильные основания, кислоты, некоторые соли, получившие общее название "электролиты". Что такое ионная проводимость? Выясним, какое отношение имеют вещества-электролиты к этому распространенному явлению.
Какие частицы переносят заряды?
Мир вокруг полон различных проводников, а также изоляторов. Об этих свойствах тел и веществ известно с глубокой древности. Греческий математик Фалес провел опыт с янтарем (на греческом — «электрон»). Потерев его о шелк, ученый наблюдал явление притяжения волос, волокон шерсти. Позже стало известно, что янтарь является изолятором. В этом веществе нет частиц, которые могли бы переносить электрический заряд. Хорошие проводники — металлы. В их составе присутствуют атомы, положительные ионы и свободные, бесконечно малые отрицательные частицы — электроны. Именно они обеспечивают перенос зарядов, когда пропускают ток. Сильные электролиты в сухом виде не содержат свободных частиц. Но при растворении и расплавлении происходит разрушение кристаллической решетки, а также поляризация ковалентной связи.
Вода, неэлектролиты и электролиты. Что такое растворение?
Отдавая или присоединяя электроны, атомы металлических и неметаллических элементов превращаются в ионы. Между ними в кристаллической решетке существует достаточно прочная связь. Растворение или расплавление ионных соединений, например, хлорида натрия, приводит к ее разрушению. В полярных молекулах нет ни связанных, ни свободных ионов, они возникают при взаимодействии с водой. В 30-х годах XIX века М. Фарадей обнаружил, что растворы некоторых веществ проводят ток. Ученый ввел в науку такие важнейшие понятия:
- ионы (заряженные частицы);
- электролиты (проводники второго рода);
- катод;
- анод.
Есть соединения - сильные электролиты, кристаллические решетки которых полностью разрушаются с освобождением ионов.

Существуют нерастворимые вещества и те, что сохраняются в молекулярном виде, например, сахар, формальдегид. Такие соединения называются неэлектролитами. Для них не характерно образование заряженных частиц. Слабые электролиты (угольная и уксусная кислота, и ряд других веществ) содержат мало ионов.
Теория электролитической диссоциации
В своих работах шведский ученый С. Аррениус (1859-1927) опирался на выводы Фарадея. В дальнейшем уточнили положения его теории русские исследователи И. Каблуков и В. Кистяковский. Они выяснили, что при растворении и расплавлении образуют ионы не все вещества, а только электролиты. Что такое диссоциация по С. Аррениусу? Это и есть разрушение молекул, которое приводит к появлению заряженных частиц в растворах и расплавах. Основные теоретические положения С. Аррениуса:
- Основания, кислоты и соли в растворах находятся в диссоциированном виде.
- Обратимо распадаются на ионы сильные электролиты.
- Слабые образуют мало ионов.

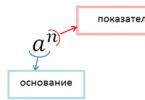
Показателем вещества (ее часто выражают в процентах) является соотношение числа молекул, распавшихся на ионы, и общего количества частиц в растворе. Электролиты являются сильными, если значение этого показателя свыше 30%, у слабых — менее 3%.
Свойства электролитов
Теоретические выводы С. Аррениуса дополнили более поздние исследования физико-химических процессов в растворах и расплавах, проведенные русскими учеными. Получили объяснение свойства оснований и кислот. К первым относят соединения, в растворах которых из катионов можно обнаружить только ионы металла, анионами являются частицы OH - . Молекулы кислот распадаются на отрицательные ионы кислотного остатка и протоны водорода (H +). Движение ионов в растворе и расплаве — хаотичное. Рассмотрим результаты опыта, для которого потребуется собрать цепь, включить в нее и обыкновенную лампочку накаливания. Проверим проводимость растворов разных веществ: поваренной соли, уксусной кислоты и сахара (первые два - электролиты). Что такое электрическая цепь? Это источник тока и проводники, соединенные между собой. При замыкании цепи лампочка будет гореть ярче в растворе поваренной соли. Движение ионов приобретает упорядоченность. Анионы направляются к положительному электроду, а катионы — к отрицательному.

В этом процессе в уксусной кислоте участвует небольшое количество заряженных частиц. Сахар не является электролитом, не проводит ток. Между электродами в этом растворе окажется изолирующий слой, лампочка гореть не будет.
Химические взаимодействия между электролитами
При сливании растворов можно наблюдать, как ведут себя электролиты. Что такое ионные уравнения подобных реакций? Рассмотрим на примере химического взаимодействия между и нитратом натрия:
2NaNO 3 + BaCl 2 + = 2NaCl + Ba(NO 3) 2 .
Формулы электролитов запишем в ионном виде:
2Na + + 2NO 3- + Ba 2+ + 2Cl - = 2Na + + 2Cl - + Ba 2+ + 2NO 3- .
Взятые для реакции вещества - сильные электролиты. В этом случае состав ионов не меняется. Химическое взаимодействие между возможно в трех случаях:
1. Если один из продуктов является нерастворимым веществом.
Молекулярное уравнение: Na 2 SO 4 + BaCl 2 = BaSO 4 + 2NaCl.
Запишем состав электролитов в виде ионов:
2Na + + SO 4 2- + Ba 2+ + 2Cl - = BaSO 4(белый осадок) + 2Na + 2Cl - .
2. Одно из образовавшихся веществ — газ.
3. Среди продуктов реакции есть слабый электролит.

Вода — один из наиболее слабых электролитов
Химически чистая не проводит электрический ток. Но в ее составе есть небольшое количество заряженных частиц. Это протоны Н + и анионы ОН - . Диссоциации подвергается ничтожно малое число молекул воды. Существует величина — ионное произведение воды, которая является постоянной при температуре 25 °C. Она позволяет узнать концентрации Н + и ОН - . Преобладают ионы водорода в растворах кислот, гидроксид-анионов больше в щелочах. В нейтральных — совпадает количество Н + и ОН - . Среду растворов также характеризует водородный показатель (рН). Чем он выше, тем больше присутствует гидроксид-ионов. Среда является нейтральной при интервале рН близком к 6-7. В присутствии ионов Н + и ОН - изменяют свой цвет вещества-индикаторы: лакмус, фенолфталеин, метилоранж и другие.
Свойства растворов и расплавов электролитов находят широкое применение в промышленности, технике, сельском хозяйстве и медицине. Научное обоснование заложено в работах ряда выдающихся ученых, объяснивших поведение частиц, из которых состоят соли, кислоты и основания. В их растворах протекают многообразные реакции ионного обмена. Они используются во многих производственных процессах, в электрохимии, гальванике. Процессы в живых существах также происходят между ионами в растворах. Многие неметаллы и металлы, токсичные в виде атомов и молекул, незаменимы в виде заряженных частиц (натрий, калий, магний, хлор, фосфор и другие).
1. ЭЛЕКТРОЛИТЫ
1.1. Электролитическая диссоциация. Степень диссоциации. Сила электролитов
Согласно теории электролитической диссоциации, соли, кислоты, гидроксиды, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы.
Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией . Вещества, диссоциирующие на ионы в растворах, называют электролитами. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами ; к ним относятся, например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами ; к ним принадлежат ионы кислотных остатков и гидроксид-ионы.
Для количественной характеристики процесса диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита (α) называется отношение числа его молекул, распавшихся в данном растворе на ионы (n ), к общему числу его молекул в растворе (N ), или
α = .
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
Электролиты со степенью диссоциации больше 0,3 (30%) обычно называют сильными, со степенью диссоциации от 0,03 (3%) до 0,3 (30%)-средними, менее 0,03 (3%)-слабыми электролитами. Так, для 0,1 M раствора CH 3 COOH α = 0,013 (или 1,3 %). Следовательно, уксусная кислота является слабым электролитом. Степень диссоциации показывает, какая часть растворенных молекул вещества распалась на ионы. Степень электролитической диссоциации электролита в водных растворах зависит от природы электролита, его концентрации и температуры.
По своей природе электролиты можно условно разделить на две большие группы: сильные и слабые . Сильные электролиты диссоциируют практически полностью (α = 1).
К сильным электролитам относятся:
1) кислоты (H 2 SO 4 , HCl , HNO 3 , HBr , HI , HClO 4 , H М nO 4 );
2) основания – гидроксиды металлов первой группы главной подгруппы (щелочи) – LiOH , NaOH , KOH , RbOH , CsOH , а также гидроксиды щелочноземельных металлов – Ba (OH ) 2 , Ca (OH ) 2 , Sr (OH ) 2 ;.
3) соли, растворимые в воде (см. таблицу растворимости).
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии (в молекулярной форме). Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами.
К слабым электролитам относятся:
1) неорганические кислоты (H 2 CO 3 , H 2 S , HNO 2 , H 2 SO 3 , HCN , H 3 PO 4 , H 2 SiO 3 , HCNS , HСlO и др.);
2) вода (H 2 O );
3) гидроксид аммония (NH 4 OH );
4) большинство органических кислот
(например, уксусная CH 3 COOH, муравьиная HCOOH);
5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов (см. таблицу растворимости).
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация соляной кислоты (НС l ) записывается следующим образом:
HCl → H + + Cl – .
Основания диссоциируют с образованием катионов металла и гидроксид-ионов. Например, диссоциация КОН
КОН → К + + ОН – .
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например,
H 2 CO 3 H + + HCO 3 – ,
HCO 3 – H + + CO 3 2– .
Первое равновесие – диссоциация по первой ступени – характеризуется константой
![]() .
.
Для диссоциации по второй ступени:
![]() .
.
В случае угольной кислоты константы диссоциации имеют следующие значения: K I = 4,3 × 10 –7 , K II = 5,6 × 10 –11 . Для ступенчатой диссоциации всегда K I >K II >K III > ... , т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Средние (нормальные) соли, растворимые в воде, диссоциируют с образованием положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка
Ca(NO 3) 2 → Ca 2+ + 2NO 3 –
Al 2 (SO 4) 3 → 2Al 3+ +3SO 4 2– .
Кислые соли (гидросоли) – электролиты, содержащие в анионе водород, способный отщепляться в виде иона водорода Н + . Кислые соли рассматривают как продукт, получающийся из многоосновных кислот, в которых не все атомы водорода замещены на металл. Диссоциация кислых солей происходит по ступеням, например:
KHCO 3 → K + + HCO 3 – (первая ступень)
Краткий вариант материала по теме "Электролиты и неэлектролиты". Позволяет быстро ориентироватся в теме, т.к. представлен в виде таблицы с определениями и примерами. Поможет систематизировать знания, подготовится к проверочным и тестовым работам.
Просмотр содержимого документа
«Шпаргалка "Электролиты и неэлектролиты"»
ВЕЩЕСТВА
| электролиты | неэлектролиты |
| проводники второго рода | (т.к. не образуют ионы) |
| вещества с
кислоты (HCl, HNO 3 , CH 3 COOH), основания (KOH, NaOH, Ba(OH) 2), соли (KCl, NH 4 NO 3 , MgSO 4), вода | вещества с
простые вещества неметаллы (N 2 , O 2 , H 2) |
ЭЛЕКТРОЛИТЫ
| сильные | слабые |
| степень диссоциации меньше 3% |
|
| все соли сильные основания (LiOH, KOH, NaOH, Ba(OH) 2)) | слабые кислоты |
| при разбавлении могут стать сильными. |
|
Степень диссоциации (α)
α = N расп. / N общ.
_____________________________________________________________________________________
По способности проводить ток в водном растворе или расплаве
ВЕЩЕСТВА
| электролиты | неэлектролиты |
| проводят ток в растворе или расплаве (т.к. присутствуют заряженные частицы - ионы), проводники второго рода | не проводят ток в растворе или расплаве (т.к. не образуют ионы) |
| вещества с ионной или сильно полярной ковалентной связью кислоты (HCl, HNO 3 , CH 3 COOH), основания (KOH, NaOH, Ba(OH) 2), соли (KCl, NH 4 NO 3 , MgSO 4), вода | вещества с неполярной или слабо полярной ковалентной связью органические соединения (углеводороды, сахароза,спирты), простые вещества неметаллы (N 2 , O 2 , H 2) |
ЭЛЕКТРОЛИТЫ
| сильные | слабые |
| степень диссоциации больше 30% | степень диссоциации меньше 3% |
| все соли – как растворимые, так и плохо растворимые; сильные кислоты (HCl, HBr, HI, HNO 3 , HClO 3 , HClO 4 , H 2 SO 4 (разб.)); сильные основания (LiOH, KOH, NaOH, Ba(OH) 2)) | слабые кислоты (H 2 S, H 2 SO 3 , H 2 CO 3 , H 2 SiO 3 , CH 3 COOH); слабые основания – нерастворимые гидроксиды металлов и NH 4 OH. |
| Степень диссоциации зависит от концентрации вещества в растворе, поэтому некоторые слабые электролиты при разбавлении могут стать сильными. |
|
Степень диссоциации (α) – отношение числа молекул, распавшихся на ионы (N расп.) к общему числу растворенных молекул (N общ.)
α = N расп. / N общ.
Электролиты
(от Электро... и греч. lytos - разлагаемый, растворимый)
жидкие или твёрдые вещества и системы, в которых присутствуют в сколько-нибудь заметной концентрации ионы, обусловливающие прохождение электрического тока. В узком смысле Э. называются вещества, растворы которых проводят электрический ток ионами, образующимися в результате электролитической диссоциации (См. Электролитическая диссоциация). Э. в растворах подразделяют на сильные и слабые. Сильные Э. практически полностью диссоциированы на ионы в разбавленных растворах. К ним относятся многие неорганические соли и некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Молекулы слабых Э. в растворах лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым Э. относится большинство органических кислот и многие органические основания в водных и неводных растворах. Деление Э. на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих Э., а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др. По количеству ионов, на которые диссоциирует в растворе одна молекула, различают бинарные, или одно-одновалентные, Э. (обозначаются 1-1 Э., например КС1), одно-двухвалентные Э. (обозначаются 1-2 Э., например CaCl 2) и т. д. Э. типа 1-1, 2-2, 3-3 и т. п. называются симметричными, типа 1-2, 1-3 и т. п. - несимметричными. Свойства разбавленных растворов слабых Э. удовлетворительно описываются классической теорией электролитической диссоциации. Для не слишком разбавленных растворов слабых Э., а также для растворов сильных Э. эта теория неприменима, поскольку они являются сложными системами, состоящими из ионов, недиссоциированных молекул или ионных пар, а также более крупных агрегатов. Свойства таких растворов определяются характером взаимодействий ион-ион, ион-растворитель, а также изменением свойств и структуры растворителя под влиянием растворённых частиц. Современные статистические теории сильных Э. удовлетворительно описывают свойства лишь очень разбавленных (моль/л) растворов. Э. чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат Э. Важный класс Э. - Полиэлектролиты . Э. являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы Э. Изучение свойств растворов Э. важно для создания новых химических источников тока (См. ) и совершенствования технологических процессов разделения веществ - экстракции (См. Экстракция) из растворов и ионного обмена (См. Ионный обмен). А. И. Мишустин.
Большая советская энциклопедия. - М.: Советская энциклопедия . 1969-1978 .
Смотреть что такое "Электролиты" в других словарях:
В широком смысле жидкие или твёрдые в ва и системы, в к рых присутствуют в заметной концентрации ионы, обусловливающие прохождение по ним электрич. тока (ионную проводимость); в узком смысле в ва, распадающиеся в р ре на ионы. При растворении Э.… … Физическая энциклопедия
Современная энциклопедия
Вещества, разлагающиеся под влиянием гальванич. тока. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ЭЛЕКТРОЛИТЫ тело, разлагаемое химически на составные простые посредством электрического тока, т. е. над которым… … Словарь иностранных слов русского языка
Электролиты - ЭЛЕКТРОЛИТЫ, жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. В узком смысле химические соединения, которые в растворах распадаются на ионы вследствие электролитической диссоциации.… … Иллюстрированный энциклопедический словарь
- (от электро... и...лит) жидкие или твердые вещества, в которых в сколько нибудь заметных концентрациях присутствуют ионы, способные перемещаться и проводить электрический ток. В узком смысле соли, растворы которых проводят электрический ток из… … Большой Энциклопедический словарь
Водные и другие растворы щелочей, кислот и солей, проводящие электр. ток. Э. наз. проводниками второго рода, т. к. они резко отличаются от металлов (проводников первого рода). Электр. ток, проходя по проводникам первого рода, не производит… … Технический железнодорожный словарь
электролиты - – системы, обладающие в жидком или твердом состоянии ионной проводимостью. Словарь по аналитической химии … Химические термины
Электролиты - – соли и др. химические вещества, растворы которых проводят электрический ток из за наличия ионов, образующихся в результате электролитической диссоциации. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ … Энциклопедия терминов, определений и пояснений строительных материалов
Электролит химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты проводники второго рода,… … Википедия
Электролиты - жидкие или твердые вещества, в которых в результате электролитической диссоциации образуются в сколько нибудь заметной концентрации ионы, обусловливающие прохождение постоянного электрического тока. Электролиты в растворах… … Энциклопедический словарь по металлургии
Вещества, обладающие ионной проводимостью; их называют проводниками второго рода прохождение тока через них сопровождается переносом вещества. К электролитам относятся расплавы солей, оксидов или гидроксидов, а также (что встречается значительно… … Энциклопедия Кольера
Книги
- Общая химия. Специальный курс. Гриф МО РФ , Вольхин В.В. , Учебное пособие «Общая химия» состоит из трех книг: «Основной курс» (кн. 1), «Специальный курс» (кн. 2) и «Избранные главы» (кн. 3). В книге 1 изложен полный курс основ химии. Книга 2… Категория: Учебники: доп. пособия Серия: Учебники для ВУЗов. Специальная литература Издатель: Лань ,
- Плазменно-электролитическое модифицирование поверхности металлов и сплавов. В 2 томах. Том 2 , Вольхин В.В. , Во второй части книги систематизированы сведения о современном методе поверхностной обработки и упрочнения металлов, позволяющем получать многофункциональные защитные покрытия - микродуговом… Категория:
Вы когда-либо размышляли, открывая свой любимый спортивный напиток: «Что вообще представляют собой эти электролиты?» Мы все знаем, что они важны для гидратации организма, особенно если вы занимаетесь спортом, но почему это так? Разве они не являются всего лишь солями?
С точки зрения того, как функционируют наши тела, электролиты – это далеко не просто соли...
Ваше тело представляет собой сложную и тщательно сбалансированную систему, состоящую из клеток, тканей и жидкостей, сквозь которые почти каждую секунду проходит непостижимое количество электрических импульсов. А возможно это лишь потому, что в этих клетках, тканях и жидкостях поддерживается гомеостатическая среда, необходимая для того, чтобы электрические сигналы беспрепятственно достигали пункта назначения.
Ключевым фактором поддержания высокой проводимости электрических импульсов являются электролиты.
Что такое электролиты?
При растворении в жидкости, соли разделяются на составляющие их ионы, создавая электропроводящий раствор. Например, поваренная соль (NaCl), растворенная в воде, разделяется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl-). Любая жидкость, которая проводит электричество, например, соленая вода, является электролитным раствором, а ионы соли, которые он содержит, называются электролитами.В организме обнаружено несколько распространенных электролитов, каждый из которых выполняет определенную и важную роль, но большинство из них в некоторой степени отвечают за поддержание баланса жидкостей между внутриклеточной и межклеточной средой. Этот баланс критически важен для таких вещей, как гидратация, проводимость нервных импульсов, функционирование мышц и уровень рН.
Электролитный дисбаланс, неважно большой или маленький, может быть весьма вредным для вашего здоровья. Например, для сокращения мышц нужны кальций, калий и натрий . Дефицит этих минералов может привести к мышечной слабости или сильным судорогам. Слишком большое количество натрия, с другой стороны, может повысить кровяное давление и значительно увеличить риск развития сердечных заболеваний. К счастью, уровни электролитов в основном зависят от потребляемой вами пищи и воды, поэтому поддержание их баланса просто сводится к правильному питанию.
Давайте рассмотрим 7 основных электролитов, обнаруженных в организме человека, чтобы лучше понять, что каждый из них делает и почему это важно.
7 основных электролитов и их функции
Семью основными электролитами являются:1. Натрий (Na +)
2. Хлор (Cl-)
3. Калий (K +)
4. Магний (Mg ++)
5. Кальций (Ca ++)
6. Фосфат (HPO4-)
7. Бикарбонат (HCO3-)
Натрий (Na+)
Натрий отвечает за контроль общего количества воды в организме. Он также важен для регулирования объема крови и поддержания функции мышц и нервов. Натрий является основным положительно заряженным ионом (катионом) в межклеточном пространстве вашего организма и главным образом содержится в крови, плазме и лимфе. Он необходим для поддержания электролитного баланса между внутриклеточной и межклеточной средой (натрий – в межклеточной жидкости, калий – внутри клеток ).Большая часть натрия поступает в организм в результате потребления поваренной соли. Минимальное количество натрия, необходимое для правильного функционирования организма – 500 мг в день, рекомендуемое количество – 2,3 г
. Но современный человек обычно потребляет в среднем 3,4 г в день
, а это уже чревато развитием гипертонии и повышением риска развития сердечных заболеваний.

Состояние, при котором в жидкостях тела наблюдается избыточный уровень натрия, называется гипернатриемией и развивается оно, как правило, в результате недостаточного количества воды в организме (обезвоживание). Это может привести к слабости и летаргии, а в тяжелых случаях к эпилептическим припадкам или коме.
Слишком низкий уровень натрия в организме вызывает состояние, называемое гипонатриемией, которое является наиболее распространенным расстройством электролитного баланса. Часто вызывается тяжелой диареей или рвотой, симптомы могут включать в себя головную боль, спутанность сознания, усталость, галлюцинации и мышечные спазмы.
Хлор (Cl-)
Основной отрицательно заряженный ион (анион), хлор содержится, главным образом, в межклеточной жидкости и тесно взаимодействует с натрием, чтобы поддерживать правильный баланс и давление в различных жидкостных отделах организма (кровь, внутриклеточная и межклеточная жидкость ). Он также жизненно важен для поддержания правильного уровня кислотности в организме, пассивно уравновешивая положительные ионы в крови, тканях и органах.Как и натрий, большую часть хлора вы получаете, потребляя соль.
Избыток хлора в организме (гиперхлоремия ) и его дефицит (гипохлоремия ) являются редкими состояниями, но могут возникать из-за дисбаланса других электролитов. Симптомы могут включать в себя затруднение дыхания и кислотно-щелочной дисбаланс.
Калий (K+)
В то время как натрий в основном содержится вне клеток, калий является основным катионом внутри клеток и чрезвычайно важен для регулирования сердечного ритма и функционирования мышц. Совместно с натрием участвует в поддержании электролитного баланса и обеспечивает проводимость электрических импульсов между клетками.Мясо, молоко, фрукты и овощи, как правило, являются хорошими источниками калия, но большинство взрослых людей не потребляют эти продукты в достаточном количестве. Правильный баланс между калием и натрием очень важен для поддержания нашего здоровья, но зачастую мы избегаем натуральных фруктов и овощей, содержащих много калия, и потребляем обработанные промышленным путем продукты, содержащие много натрия. Хуже всего то, что дисбаланс между калием и натрием может еще больше увеличить риск развития гипертонии, сердечных заболеваний и даже инсульта.

По большей части избыток калия в организме (гиперкалиемия ) является довольно редким состоянием, но может быть смертельным, если быстро его не исправить, так как вызывает аритмию, паралич легких и остановку сердца. Фактически, гиперкалиемия настолько опасна, что именно в это состояние вводят осужденных на смертную казнь в Соединенных Штатах посредством инъекции раствора хлорида калия. Дефицит калия (гипокалиемия), с другой стороны, встречается гораздо чаще и вызывается потерей воды в результате сильной рвоты или диареи. Легкие случаи могут проявляться незначительными симптомами, такими как мышечная слабость и судороги, но тяжелые случаи могут быть столь же смертельны, как гиперкалиемия, и лечить их следует немедленно.
Магний (Mg++)
Магний является одним из самых недооцененных минералов в нашем питании. Он необходим не только для протекания более чем 300 биохимических реакций в организме, но также играет важную роль в синтезе как ДНК, так и РНК. Четвертый из наиболее распространенных минералов в организме человека, магний помогает поддерживать нормальное функционирование нервов и мышц, укрепляет иммунную систему, поддерживает стабильный сердечный ритм, стабилизирует уровень сахара в крови и необходим для образования костной ткани. Орехи, специи, листовая зелень, кофе и чай – все это, как правило, хорошие источники данного минерала.
Избыток магния в организме (гипермагниемия) является относительно редким состоянием, потому что организм очень эффективно справляется с удалением избытка данного минерала, что затрудняет потребление слишком большого его количества с пищей. Гипермагниемия может возникать в случае почечной недостаточности или злоупотребления пищевыми добавками с магнием, и может привести к тошноте, рвоте, нарушению дыхания или аритмии. Гипомагниемия (дефицит магния) чаще всего встречается у алкоголиков, потому что почки удаляют из организма до 260% больше магния, чем обычно, после употребления алкоголя, но это состояние также может быть вызвано простым недоеданием. Симптомы включают в себя усталость, судороги, спазмы и онемение мышц.
Кальций (Ca++)
Вероятно, вы уже знаете, что кальций необходим для образования костей и зубов, но вы можете не знать, что он также важен для передачи нервных импульсов, свертывания крови и сокращения мышц. Это самый распространенный минерал в вашем организме: около 99% всего кальция находится в костях скелета, но также он содержится в крови и других клетках тела (особенно в клетках мышц ). Если в вашей крови недостаточно кальция, организм берет его из ваших костей, чтобы восполнить недостаток; если это происходит постоянно, то в конечном итоге может привести к остеопорозу.
Рекомендуемое потребление кальция составляет от 1000 до 1500 мг в день (для поддержания надлежащего уровня минерала в крови и предотвращения ослабления костей ). Гиперкальциемия или избыток кальция в организме является довольно редким состоянием, но может возникать из-за чрезмерного потребления богатых кальцием продуктов, некоторых заболеваний костей или экстремального недостатка физической активности (например, при квадриплегии или параплегии ). Симптомы могут включать в себя проблемы с пищеварением и тошноту в легких случаях. Экстремальные же случаи гиперкальциемии могут привести к дисфункции мозга, коме и даже смерти. Умеренные случаи гипокальциемии (недостаток кальция ) могут не вызывать немедленных симптомов, но со временем это состояние может повлиять на мозг, приводя к бреду, потере памяти и депрессии; тяжелые случаи могут приводить к мышечным спазмам, судорогам и аритмии.
Фосфат (HPO4-)
Фосфор является вторым наиболее распространенным минералом после кальция в вашем организме и 85% его содержится в ваших костях в виде фосфата. Анионы фосфата тесно взаимодействуют с кальцием для укрепления костей и зубов, но также необходимы для производства энергии в клетках, роста и восстановления тканей, и являются основным строительным материалом для клеточных мембран и ДНК.Большинство людей получают необходимое количество фосфора с пищей, но избыток фосфата (гиперфосфатемия ) не является редкостью и обычно указывает на заболевание почек или дефицит кальция. Избыток фосфата в организме также связан с повышенным риском развития сердечно-сосудистых заболеваний. Гипофосфатемия (дефицит фосфата ) распространен меньше и чаще всего встречается у алкоголиков и людей с болезнью Крона или целиакией. Симптомы гипофосфатемии включают в себя боль в суставах, ослабленные кости, усталость и нарушения дыхания.
Бикарбонат (HCO3-)
Наши тела полагаются на сложную систему буферизации для поддержания надлежащих уровней pH. Легкие регулируют количество углекислого газа в организме, большая часть которого соединяется с водой и превращается в угольную кислоту (H2CO3). Угольная кислота может быть быстро превращена в бикарбонат (HCO3-), который является ключевым компонентом буферизации рН.Когда кислоты накапливаются в результате метаболических процессов или производства молочной кислоты в ваших мышцах, почки высвобождают бикарбонат (щелочной раствор ) в вашу систему, чтобы противодействовать повышенной кислотности. Когда уровень кислотности становится более низким, почки уменьшают количество бикарбоната для повышения кислотности. В отсутствие этой системы, быстрые изменения баланса рН могли бы вызвать серьезные проблемы в организме, такие как повреждение центральной нервной системы. Этот бикарбонатный буфер является одной из главных причин, по которым наши тела могут поддерживать гомеостаз и функционировать должным образом.
Баланс электролитов
Итак, вот он – ваш звездный состав электролитов. Как видите, каждый из них играет важную роль в поддержании функционирования вашего тела, но важно отметить, что они действуют должным образом, лишь пребывая в состоянии очень специфического равновесия. Знать, какую функцию выполняют электролиты в вашем организме, важно потому, что большинство людей не понимают необходимости поддержания электролитного баланса. Нарушение баланса до уровня избытка или недостатка электролитов может иметь катастрофические последствия. Так, например, увеличение количества случаев гипертонии и сердечно-сосудистых заболеваний во всем мире можно объяснить прогрессирующими проявлениями дисбаланса натрия.К счастью, теперь, когда вы знаете, что такое электролиты и как они должны быть сбалансированы, у вас есть простое решение – здоровое питание натуральными продуктами. В зимнее время можно подключить качественные мультивитамины с минералами в хелатной форме (лучше усваиваются ).
 Для тех, кто активно занимается спортом, уже давно придумали изотонические напитки, которые как раз и содержат необходимые нам минералы. Эти же самые напитки рекомендуется пить в туристических поездках в жаркие страны. Купить можно в любой аптеке в готовом виде или в порошке и добавлять в воду. Минеральная вода - тоже отличный вариант!
Для тех, кто активно занимается спортом, уже давно придумали изотонические напитки, которые как раз и содержат необходимые нам минералы. Эти же самые напитки рекомендуется пить в туристических поездках в жаркие страны. Купить можно в любой аптеке в готовом виде или в порошке и добавлять в воду. Минеральная вода - тоже отличный вариант!
Это кажется таким легким, но это жизненно важно для поддержания здоровья организма. Позаботьтесь о своем теле, и оно позаботится о вас!