V organickej chémii môžete nájsť uhľovodíkové látky s rôznym množstvom uhlíka v reťazci a väzbou C=C. Sú to homológy a nazývajú sa alkény. Vďaka svojej štruktúre sú chemicky reaktívnejšie ako alkány. Aké reakcie sú však pre nich typické? Zoberme si ich rozšírenie v prírode, rôzne spôsoby výroby a použitia.
Čo sú zač?
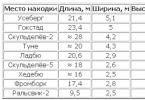
Alkény, ktoré sa tiež nazývajú olefíny (olejové), dostali svoj názov podľa eténchloridu, derivátu prvého člena tejto skupiny. Všetky alkény majú aspoň jednu dvojitú väzbu C=C. C n H 2n je vzorec všetkých olefínov a názov je vytvorený z alkánu s rovnakým počtom uhlíkov v molekule, len prípona -ane sa mení na -én. Arabská číslica na konci názvu oddelená pomlčkou označuje počet uhlíkov, od ktorých dvojitá väzba začína. Pozrime sa na hlavné alkény, tabuľka vám pomôže zapamätať si ich:
Ak majú molekuly jednoduchú, nerozvetvenú štruktúru, potom sa pridá prípona -ylén, čo sa odráža aj v tabuľke.
Kde ich nájdete?
Keďže reaktivita alkénov je veľmi vysoká, ich zástupcovia sú v prírode mimoriadne vzácni. Princíp života molekuly olefínu je „buďme priateľmi“. V okolí nie sú žiadne iné látky – žiadny problém, budeme sa navzájom kamarátiť, vytvárať polyméry.
Ale existujú a malý počet zástupcov je zahrnutý v sprievodnom ropnom plyne a vyšší je v oleji vyrobenom v Kanade.
Úplne prvý zástupca alkénov, etén, je hormón, ktorý stimuluje dozrievanie ovocia, takže ho v malých množstvách syntetizujú zástupcovia flóry. Existuje alkén, cis-9-trikozén, ktorý hrá úlohu sexuálneho atraktantu u samíc domácich múch. Nazýva sa aj muscalur. (Atraktant je látka prírodného alebo syntetického pôvodu, ktorá priťahuje zdroj zápachu v inom organizme). Z chemického hľadiska tento alkén vyzerá takto:
Pretože všetky alkény sú veľmi cenné suroviny, spôsoby ich umelej výroby sú veľmi rôznorodé. Pozrime sa na tie najbežnejšie.
Čo ak potrebujete veľa?
V priemysle sa trieda alkénov získava najmä krakovaním, t.j. štiepenie molekuly vplyvom vysokých teplôt, vyšších alkánov. Reakcia vyžaduje zahrievanie v rozsahu 400 až 700 °C. Alkán sa štiepi tak, ako chce, vytvára alkény, metódy získavania, ktoré zvažujeme, s veľkým počtom možností molekulárnej štruktúry:
C7H16 -> CH3-CH=CH2 + C4H10.
Ďalšia bežná metóda sa nazýva dehydrogenácia, pri ktorej sa molekula vodíka oddelí od predstaviteľa alkánového radu v prítomnosti katalyzátora.
V laboratórnych podmienkach sa alkény a spôsoby prípravy líšia, sú založené na eliminačných reakciách (eliminácia skupiny atómov bez ich substitúcie). Najbežnejšie eliminované atómy vody z alkoholov sú halogény, vodík alebo halogenovodík. Najbežnejší spôsob získania alkénov je z alkoholov v prítomnosti kyseliny ako katalyzátora. Je možné použiť aj iné katalyzátory
Všetky eliminačné reakcie podliehajú Zaitsevovmu pravidlu, ktoré hovorí:
Atóm vodíka sa odštiepi od uhlíka susediaceho s uhlíkom nesúcim -OH skupinu, ktorá má menej vodíkov.

Po uplatnení pravidla odpovedzte, ktorý reakčný produkt bude prevládať? Neskôr sa dozviete, či ste odpovedali správne.
Chemické vlastnosti
Alkény aktívne reagujú s látkami a porušujú ich väzbu pi (iný názov pre väzbu C=C). Koniec koncov, nie je taká silná ako jednoduchá väzba (sigma väzba). Uhľovodík sa po reakcii (adícii) premení z nenasýteného na nasýtený bez tvorby ďalších látok.
- pridanie vodíka (hydrogenácia). Na jeho prechod je potrebná prítomnosť katalyzátora a zahrievania;
- adícia halogénových molekúl (halogenácia). Je to jedna z kvalitatívnych reakcií na pí väzbu. Keď totiž alkény reagujú s brómovou vodou, zmení sa z hnedej na priehľadnú;
- reakcia s halogenovodíkmi (hydrohalogenácia);
- pridanie vody (hydratácia). Podmienky na uskutočnenie reakcie sú zahrievanie a prítomnosť katalyzátora (kyseliny);
Reakcie nesymetrických olefínov s halogenovodíkmi a vodou sa riadia Markovnikovovým pravidlom. To znamená, že vodík sa naviaže na uhlík z dvojitej väzby uhlík-uhlík, ktorá už má viac atómov vodíka.

- spaľovanie;
- nekompletný oxidačný katalytický. Produktom sú cyklické oxidy;
- Wagnerova reakcia (oxidácia manganistanom v neutrálnom prostredí). Táto alkénová reakcia je ďalšou kvalitatívnou väzbou C=C. Ako tečie, ružový roztok manganistanu draselného sa zafarbí. Ak sa rovnaká reakcia uskutoční v kombinovanom kyslom prostredí, produkty budú odlišné (karboxylové kyseliny, ketóny, oxid uhličitý);
- izomerizácia. Všetky typy sú charakteristické: cis- a trans-, pohyb dvojitej väzby, cyklizácia, skeletálna izomerizácia;
- Polymerizácia je hlavnou vlastnosťou olefínov pre priemysel.
Aplikácia v medicíne
Reakčné produkty alkénov majú veľký praktický význam. Mnohé z nich sa používajú v medicíne. Glycerín sa získava z propénu. Tento viacsýtny alkohol je výborným rozpúšťadlom a ak sa použije namiesto vody, roztoky budú koncentrovanejšie. Na liečebné účely sa v ňom rozpúšťajú alkaloidy, tymol, jód, bróm atď.. Glycerín sa používa aj pri príprave mastí, pást a krémov. Zabraňuje ich vysychaniu. Samotný glycerín je antiseptikum.
Pri reakcii s chlorovodíkom sa získajú deriváty, ktoré sa používajú ako lokálna anestézia pri aplikácii na kožu, ako aj na krátkodobú anestéziu pri menších chirurgických zákrokoch pomocou inhalácie.

Alkadiény sú alkény s dvoma dvojitými väzbami v jednej molekule. Ich hlavným využitím je výroba syntetického kaučuku, z ktorého sa potom vyrábajú rôzne vyhrievacie podložky a striekačky, sondy a katétre, rukavice, cumlíky a mnoho iného, ktoré sú pri starostlivosti o chorých jednoducho nenahraditeľné.
Priemyselné aplikácie
| Typ odvetvia | Čo sa používa | Ako môžu použiť |
| poľnohospodárstvo | etén | urýchľuje dozrievanie zeleniny a ovocia, defoliáciu rastlín, fólie pre skleníky |
| Lak a farebný | etén, butén, propén atď. | na výrobu rozpúšťadiel, éterov, rozpúšťadiel |
| Mechanické inžinierstvo | 2-metylpropén, etén | výroba syntetického kaučuku, mazacích olejov, nemrznúcich zmesí |
| Potravinársky priemysel | etén | výroba teflónu, etylalkoholu, kyseliny octovej |
| Chemický priemysel | etén, polypropylén | získavajú sa alkoholy, polyméry (polyvinylchlorid, polyetylén, polyvinylacetát, polyizotylén, acetaldehyd) |
| Baníctvo | etén atď. | výbušniny |
Alkény a ich deriváty našli širšie využitie v priemysle. (Kde a ako sa používajú alkény, tabuľka vyššie).

Toto je len malá časť využitia alkénov a ich derivátov. Každým rokom sa dopyt po olefínoch len zvyšuje, čo znamená, že rastie aj potreba ich výroby.
Téma lekcie: Alkény. Príprava, chemické vlastnosti a aplikácie alkénov.
Ciele a ciele lekcie:
- preskúmať špecifické chemické vlastnosti etylénu a všeobecné vlastnosti alkénov;
- prehĺbiť a konkretizovať pojmy?-väzby a mechanizmy chemických reakcií;
- poskytnúť počiatočné predstavy o polymerizačných reakciách a štruktúre polymérov;
- analyzovať laboratórne a všeobecné priemyselné metódy výroby alkénov;
- naďalej rozvíjať schopnosť pracovať s učebnicou.
Vybavenie: zariadenie na výrobu plynov, roztok KMnO 4, etylalkohol, koncentrovaná kyselina sírová, zápalky, liehová lampa, piesok, tabuľky „Štruktúra molekuly etylénu“, „Základné chemické vlastnosti alkénov“, demonštračné vzorky „Polyméry“.
POČAS VYUČOVANIA
I. Organizačný moment
Pokračujeme v štúdiu homologickej série alkénov. Dnes sa musíme pozrieť na spôsoby prípravy, chemické vlastnosti a aplikácie alkénov. Musíme charakterizovať chemické vlastnosti spôsobené dvojitou väzbou, získať počiatočné pochopenie polymerizačných reakcií a zvážiť laboratórne a priemyselné metódy výroby alkénov.
II. Aktivizácia vedomostí žiakov
- Aké uhľovodíky sa nazývajú alkény?
- Aké sú vlastnosti ich štruktúry?
- V akom hybridnom stave sú atómy uhlíka, ktoré tvoria dvojitú väzbu v molekule alkénu?
Zrátané a podčiarknuté: alkény sa líšia od alkánov prítomnosťou jednej dvojitej väzby vo svojich molekulách, čo určuje zvláštnosti chemických vlastností alkénov, spôsoby ich prípravy a použitia.
III. Učenie sa nového materiálu
1. Spôsoby výroby alkénov
Zostavte reakčné rovnice potvrdzujúce metódy výroby alkénov
– krakovanie alkánov C 8 H 18 ––> C 4 H 8 + C4H10; (tepelné praskanie pri 400-700 o C)
oktán butén bután
– dehydrogenácia alkánov C 4 H 10 ––> C 4 H 8 + H 2; (t, Ni)
bután butén vodík
– dehydrohalogenácia halogénalkánov C 4 H 9 Cl + KOH ––> C 4 H 8 + KCl + H 2 O;
chlórbutánhydroxid buténchlorid voda
draslík draslík
– dehydrohalogenácia dihalogénalkánov 
– dehydratácia alkoholov C 2 H 5 OH ––> C 2 H 4 + H 2 O (pri zahrievaní v prítomnosti koncentrovanej kyseliny sírovej)
Pamätajte!
Pri reakciách dehydrogenácie, dehydratácie, dehydrohalogenácie a dehalogenácie je potrebné mať na pamäti, že vodík sa prednostne abstrahuje z menej hydrogenovaných atómov uhlíka (Zaitsevovo pravidlo, 1875).
2. Chemické vlastnosti alkénov
Charakter väzby uhlík-uhlík určuje typ chemických reakcií, do ktorých organické látky vstupujú. Prítomnosť dvojitej väzby uhlík-uhlík v molekulách etylénových uhľovodíkov určuje nasledujúce vlastnosti týchto zlúčenín:
– prítomnosť dvojitej väzby umožňuje, aby boli alkény klasifikované ako nenasýtené zlúčeniny. Ich premena na nasýtené je možná len v dôsledku adičných reakcií, čo je hlavný znak chemického správania olefínov;
– dvojitá väzba predstavuje významnú koncentráciu elektrónovej hustoty, takže adičné reakcie sú elektrofilnej povahy;
– dvojitá väzba sa skladá z jednej a jednej väzby, ktorá sa pomerne ľahko polarizuje.
Reakčné rovnice charakterizujúce chemické vlastnosti alkénov
a) Adičné reakcie
Pamätajte! Substitučné reakcie sú charakteristické pre alkány a vyššie cykloalkány, ktoré majú len jednoduché väzby, adičné reakcie sú charakteristické pre alkény, diény a alkíny, ktoré majú dvojité a trojité väzby.

Pamätajte! Na prerušenie väzby sú možné nasledujúce mechanizmy:
a) ak sú alkény a činidlo nepolárne zlúčeniny, potom sa väzba - rozbije za vzniku voľného radikálu:
H2C = CH2 + H: H ––> + +
b) ak sú alkén a činidlo polárne zlúčeniny, potom štiepenie -väzby vedie k tvorbe iónov:
c) keď sa činidlá obsahujúce atómy vodíka v molekule spoja v mieste prerušenej väzby, vodík sa vždy pripojí k viac hydrogenovanému atómu uhlíka (Morkovnikovovo pravidlo, 1869).
– polymerizačná reakcia nCH 2 = CH 2 ––> n – CH 2 – CH 2 –– > (– CH 2 – CH 2 –)n
etén polyetylén
b) oxidačná reakcia
Laboratórne skúsenosti. Získajte etylén a študujte jeho vlastnosti (návod na študentských laviciach)
Návod na získanie etylénu a pokusy s ním
1. Do skúmavky dajte 2 ml koncentrovanej kyseliny sírovej, 1 ml alkoholu a malé množstvo piesku.
2. Skúmavku uzavrieme zátkou s hadičkou na výstup plynu a zohrejeme ju v plameni alkoholovej lampy.
3. Uvoľnený plyn prejsť cez roztok s manganistanom draselným. Všimnite si zmenu farby roztoku.
4. Zapáľte plyn na konci výstupnej trubice plynu. Venujte pozornosť farbe plameňa.
– alkény horia žiarivým plameňom. (Prečo?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (pri úplnej oxidácii sú produktmi reakcie oxid uhličitý a voda)
Kvalitatívna reakcia: „mierna oxidácia (vo vodnom roztoku)“
– alkény odfarbujú roztok manganistanu draselného (Wagnerova reakcia)
Za ťažších podmienok v kyslom prostredí môžu byť reakčnými produktmi karboxylové kyseliny, napríklad (v prítomnosti kyselín):
CH 3 – CH = CH 2 + 4 [O] ––> CH 3 COOH + HCOOH
- katalytická oxidácia
Pamätajte na to hlavné!
1. Nenasýtené uhľovodíky sa aktívne zúčastňujú adičných reakcií.
2. Reaktivita alkénov je spôsobená tým, že väzba sa pod vplyvom činidiel ľahko rozbije.
3. V dôsledku adície dochádza k prechodu atómov uhlíka z sp 2 na sp 3 - nastáva hybridný stav. Reakčný produkt má limitujúci charakter.
4. Pri zahrievaní etylénu, propylénu a iných alkénov pod tlakom alebo v prítomnosti katalyzátora sa ich jednotlivé molekuly spájajú do dlhých reťazcov – polymérov. Veľký praktický význam majú polyméry (polyetylén, polypropylén).
3. Aplikácia alkénov(študentská správa podľa nasledujúceho plánu).
1 – výroba paliva s vysokým oktánovým číslom;
2 – plasty;
3 – výbušniny;
4 – nemrznúca zmes;
5 – rozpúšťadlá;
6 – na urýchlenie dozrievania ovocia;
7 – produkcia acetaldehydu;
8 – syntetická guma.
III. Posilnenie naučeného materiálu

Domáca úloha:§§ 15, 16, býv. 1, 2, 3 str. 90, býv. 4, 5 s. 95.
Alkíny, halogénderiváty, alkoholy, polyméry a iné. Hlavným problémom nenasýtených uhľovodíkov je ich takmer úplná absencia v prírode, väčšinou sa látky tohto radu extrahujú v laboratóriu chemickou syntézou. Aby ste pochopili charakteristiky reakcií na výrobu alkénov, musíte pochopiť ich štruktúru.
Čo sú alkény?
Alkény sú organické látky, ktoré pozostávajú z atómov uhlíka a vodíka. Zvláštnosťou tejto série sú dvojité kovalentné väzby: sigma a pi. Určujú chemické a fyzikálne vlastnosti látok. Ich teplota topenia je nižšia ako teplota topenia zodpovedajúcich alkánov. Alkény sa tiež líšia od tejto „základnej“ série uhľovodíkov prítomnosťou adičnej reakcie, ku ktorej dochádza porušením väzby pí. Vyznačujú sa štyrmi typmi izomérie:
- podľa polohy dvojitej väzby;
- zmenami v uhlíkovej kostre;
- medzitrieda (s cykloalkánmi);
- geometrické (cis- a trans-).
Ďalším názvom tejto série látok sú olefíny. Je to spôsobené ich podobnosťou s viacsýtnymi karboxylovými kyselinami, ktoré majú vo svojom zložení dvojitú väzbu. Názvoslovie alkénov sa líši v tom, že prvý atóm v uhlíkovom reťazci je určený umiestnením násobnej väzby, ktorej poloha je uvedená aj v názve látky.
Krakovanie je hlavnou metódou výroby alkénov
Krakovanie je druh rafinácie oleja pri vysokých teplotách. Hlavným cieľom tohto procesu je získať látky s nižšou molekulovou hmotnosťou. K praskaniu za vzniku alkénov dochádza pri rozklade alkánov, ktoré sú súčasťou ropných produktov. K tomu dochádza pri teplotách od 400 do 700 °C. Pri tejto reakcii na výrobu alkénov vzniká okrem látky, ktorá bola účelom jej realizácie, aj alkán. Celkový počet atómov uhlíka pred a po reakcii je rovnaký.

Iné priemyselné spôsoby výroby alkénov
Je nemožné pokračovať v rozprávaní o alkénoch bez toho, aby sme spomenuli dehydrogenačnú reakciu. Na jej uskutočnenie sa použije alkán, v ktorom môže po odstránení dvoch atómov vodíka vzniknúť dvojitá väzba. To znamená, že metán nevstúpi do tejto reakcie. Preto množstvo alkénov začína etylénom. Špeciálne podmienky pre reakciu sú zvýšená teplota a katalyzátor. Tým posledným môže byť oxid nikelnatý alebo oxid chrómový. Výsledkom reakcie je produkcia alkénu s príslušným počtom atómov uhlíka a bezfarebného plynu (vodíka).
Ďalšou priemyselnou metódou extrakcie látok tohto radu je hydrogenácia alkínov. Táto reakcia za vzniku alkénov prebieha pri zvýšených teplotách a za účasti katalyzátora (niklu alebo platiny). Hydrogenačný mechanizmus je založený na prerušení jednej z dvoch pí väzieb poskytnutého alkínu, po ktorom sa na miesta deštrukcie pridajú atómy vodíka.

Laboratórna metóda s použitím alkoholu
Jednou z najjednoduchších a najlacnejších metód je intramolekulárna dehydratácia, teda eliminácia vody. Pri písaní reakčnej rovnice je potrebné pamätať na to, že sa bude vykonávať podľa Zaitsevovho pravidla: vodík sa oddelí od najmenej hydrogenovaného atómu uhlíka. Teplota by mala byť nad 150 °C. Ako katalyzátor musíte použiť látky s hygroskopickými vlastnosťami (schopné priťahovať vlhkosť), napríklad kyselinu sírovú. Dvojitá väzba sa vytvorí v mieste, kde sa odstráni hydroxylová skupina a vodík. Výsledkom reakcie bude zodpovedajúci alkén a jedna molekula vody.

Extrakcia v laboratóriu na báze halogénderivátov
Existujú ešte dve laboratórne metódy. Prvým je pôsobenie alkalického roztoku na deriváty alkánov, ktoré obsahujú jeden atóm halogénu. Táto metóda sa nazýva dehydrohalogenácia, to znamená eliminácia zlúčenín vodíka s nekovovými prvkami skupiny sedem (fluór, bróm, chlór, jód). Implementácia reakčného mechanizmu, ako v predchádzajúcom prípade, prebieha podľa Zaitsevovho pravidla. Katalyzačnými podmienkami sú alkoholový roztok a zvýšená teplota. Po reakcii vzniká alkén, soľ kovového prvku alkálie a halogénu a voda.
Druhá metóda je veľmi podobná predchádzajúcej. Vykonáva sa pomocou alkánu, ktorý obsahuje dva halogény. Na takúto látku pôsobí aktívny kov (zinok alebo horčík) v prítomnosti alkoholového roztoku a zvýšenej teplote. Reakcia prebehne iba vtedy, ak je vodík nahradený halogénom na dvoch susedných atómoch uhlíka; ak nie je splnená podmienka, dvojitá väzba nevznikne.
Prečo potrebujete užívať zinok a horčík? Počas reakcie sa kov oxiduje, čím sa môžu uvoľniť dva elektróny a eliminujú sa dva halogény. Ak vezmete alkalické prvky, budú reagovať s vodou, ktorá je v alkoholovom roztoku. Pokiaľ ide o kovy, ktoré prichádzajú po horčíku a zinku v sérii Beketov, budú príliš slabé.
Alkény- nenasýtené uhľovodíky, ktoré obsahujú jednu dvojitú väzbu. Príklady alkénov:

Spôsoby získavania alkénov.
1. Krakovanie alkánov pri 400-700°C. Reakcia prebieha mechanizmom voľných radikálov:

2. Dehydrogenácia alkánov:
3. Eliminačná reakcia (eliminácia): zo susedných atómov uhlíka sú eliminované 2 atómy alebo 2 skupiny atómov a vzniká dvojitá väzba. Takéto reakcie zahŕňajú:
A) Dehydratácia alkoholov (zahriatie nad 150 °C, za účasti kyseliny sírovej ako činidla odstraňujúceho vodu):
B) Eliminácia halogenovodíkov pri vystavení alkoholovému alkalickému roztoku:

Atóm vodíka sa prednostne odštiepi od atómu uhlíka, ktorý je naviazaný na menší počet atómov vodíka (najmenej hydrogenovaný atóm) - Zaitsevovo pravidlo.
B) Dehalogenácia:

Chemické vlastnosti alkénov.
Vlastnosti alkénov sú určené prítomnosťou násobnej väzby, preto alkény vstupujú do elektrofilných adičných reakcií, ktoré prebiehajú v niekoľkých stupňoch (H-X - činidlo):
1. etapa:

2. etapa:
 .
.
Vodíkový ión pri tomto type reakcie patrí k atómu uhlíka, ktorý má zápornejší náboj. Rozdelenie hustoty je:

Ak je substituent donor, ktorý prejavuje +I- efekt, potom sa hustota elektrónov posunie smerom k najviac hydrogenovanému atómu uhlíka, čím sa na ňom vytvorí čiastočne negatívny náboj. Reakcie idú podľa Markovnikovovo pravidlo: pri spájaní polárnych molekúl ako NH (HCl, HCN, HOH atď.) k nesymetrickým alkénom sa vodík viaže prednostne na viac hydrogenovaný atóm uhlíka na dvojitej väzbe.
A) Adičné reakcie:
1) Hydrohalogenácia:
Reakcia sa riadi Markovnikovovým pravidlom. Ak je však v reakcii prítomný peroxid, pravidlo sa neberie do úvahy:
2) Hydratácia. Reakcia sa riadi Markovnikovovým pravidlom v prítomnosti kyseliny fosforečnej alebo sírovej:

3) Halogenácia. V dôsledku toho sa brómová voda zafarbí - ide o kvalitatívnu reakciu na viacnásobnú väzbu:
4) Hydrogenácia. Reakcia prebieha v prítomnosti katalyzátorov.
DEFINÍCIA
Alkény sa nazývajú nenasýtené uhľovodíky, ktorých molekuly obsahujú jednu dvojitú väzbu. Štruktúra molekuly alkénu s použitím etylénu ako príkladu je znázornená na obr. 1.
Ryža. 1. Štruktúra molekuly etylénu.
Z hľadiska fyzikálnych vlastností sa alkény len málo líšia od alkánov s rovnakým počtom atómov uhlíka v molekule. Nižšie homológy C 2 - C 4 sú za normálnych podmienok plyny; C5 - C17 - kvapaliny; vyššie homológy sú pevné látky. Alkény sú nerozpustné vo vode. Vysoko rozpustný v organických rozpúšťadlách.
Príprava alkénov
V priemysle sa alkény získavajú pri rafinácii ropy: krakovanie a dehydrogenácia alkánov. Laboratórne metódy na získanie alkénov sme rozdelili do dvoch skupín:
- Eliminačné reakcie
- dehydratácia alkoholov
CH3-CH2-OH -» CH2=CH2 + H20 (H2S04 (konc), to = 170).
— dehydrohalogenácia monohalogénalkánov
CH3-CH(Br)-CH2-CH3 + NaOH alkohol -> CH3-CH=CH-CH3 + NaBr + H20 (to).
— dehalogenácia dihalogénalkánov
CH3-CH(Cl)-CH(Cl)-CH2-CH3 + Zn(Mg) -> CH3-CH=CH-CH2-CH3 + ZnCl2 (MgCl2).
- Neúplná hydrogenácia alkínov
CH=CH + H2 ->CH2=CH2 (Pd, to).
Chemické vlastnosti alkénov
Alkény sú vysoko reaktívne organické zlúčeniny. To sa vysvetľuje ich štruktúrou. Chémia alkénov je chémia dvojitých väzieb. Typické reakcie pre alkény sú elektrofilné adičné reakcie.
Chemické premeny alkénov prebiehajú štiepením:
1) väzby π-C-C (adícia, polymerizácia a oxidácia)
- hydrogenácia
CH3-CH=CH2 + H2 -> CH3-CH2-CH2 (kat = Pt).
- halogenácia
CH3-CH2-CH=CH2+ Br2 -> CH3-CH2-CH(Br)-CH2Br.
— hydrohalogenácia (prebieha podľa Markovnikovovho pravidla: atóm vodíka sa prednostne viaže na viac hydrogenovaný atóm uhlíka)
CH3-CH=CH2 + H-Cl -> CH3-CH(Cl)-CH3.
- hydratácia
CH2=CH2+H-OH -> CH3-CH2-OH (H+, to).
- polymerizácia
nCH2=CH2->-[-CH2-CH2-]-n (kat, to).
- oxidácia
CH2=CH2 + 2KMn04 + 2KOH -> HO-CH2-CH2-OH + 2K2Mn04;
2CH2=CH2+02 -> 2C20H4 (epoxid) (kat = Ag,to);
2CH2=CH2+02 -> 2CH3-C(0)H (kat = PdCl2, CuCl).
2) väzby σ- a π-C-C
CH3-CH=CH-CH2-CH3 + 4[0] -> CH3COOH + CH3CH2COOH (KMn04, H+, t0).
3) väzby Csp3-H (v alylickej polohe)
CH2=CH2 + Cl2 -» CH2=CH-CI + HCl (to = 400).
4) Prerušenie všetkých väzieb
C2H4 + 202 -> 2C02 + 2H20;
CnH2n + 3n/202 -> nC02 + nH20.
Aplikácie alkénov
Alkény našli uplatnenie v rôznych odvetviach národného hospodárstva. Pozrime sa na príklad jednotlivých zástupcov.
Etylén je široko používaný v priemyselnej organickej syntéze na výrobu rôznych organických zlúčenín, ako sú halogénové deriváty, alkoholy (etanol, etylénglykol), acetaldehyd, kyselina octová atď. Etylén sa vo veľkých množstvách spotrebuje na výrobu polymérov.
Propylén sa používa ako surovina na výrobu niektorých alkoholov (napríklad 2-propanol, glycerín), acetónu atď. Polypropylén sa vyrába polymerizáciou propylénu.
Príklady riešenia problémov
PRÍKLAD 1
| Cvičenie | Pri hydrolýze vodným roztokom hydroxidu sodného NaOH dichloridu, získaného pridaním 6,72 litra chlóru do etylénového uhľovodíka, sa vytvorilo 22,8 g dvojsýtneho alkoholu. Aký je vzorec alkénu, ak je známe, že reakcie prebiehajú v kvantitatívnych výťažkoch (bez strát)? |
| Riešenie | Napíšme rovnicu pre chloráciu alkénu vo všeobecnej forme, ako aj reakciu na výrobu dvojsýtneho alkoholu: CnH2n + Cl2 = CnH2nCl2 (1); CnH2nCl2 + 2NaOH = CnH2n(OH)2 + 2HCl (2). Vypočítajme množstvo chlóru: n(Cl2) = V(Cl2)/Vm; n(Cl2) = 6,72 / 22,4 = 0,3 mol, teda etyléndichlorid bude tiež 0,3 mol (rovnica 1), dvojsýtny alkohol by mal byť tiež 0,3 mol a podľa podmienok úlohy je to 22,8 g. To znamená, že jeho molárna hmotnosť sa bude rovnať: M(CnH2n(OH)2) = m(CnH2n(OH)2)/n(CnH2n(OH)2); M(CnH2n(OH)2) = 22,8/0,3 = 76 g/mol. Nájdite molárnu hmotnosť alkénu: M(CnH2n) = 76 - (2 x 17) = 42 g/mol, čo zodpovedá vzorcu C 3 H 6 . |
| Odpoveď | Alkénový vzorec C3H6 |
PRÍKLAD 2
| Cvičenie | Koľko gramov bude potrebných na brómovanie 16,8 g alkénu, ak je známe, že pri katalytickej hydrogenácii rovnakého množstva alkénu sa pridalo 6,72 litra vodíka? Aké je zloženie a možná štruktúra pôvodného uhľovodíka? |
| Riešenie | Napíšme vo všeobecnom tvare rovnice pre bromáciu a hydrogenáciu alkénu: CnH2n + Br2 = CnH2nBr2 (1); CnH2n + H2 = CnH2n+2 (2). Vypočítajme množstvo vodíkovej látky: n(H2) = V(H2)/Vm; n(H2) = 6,72 / 22,4 = 0,3 mol, teda alkén bude tiež 0,3 mol (rovnica 2) a podľa podmienok úlohy je to 16,8 g. To znamená, že jeho molárna hmotnosť sa bude rovnať: M(CnH2n) = m(CnH2n)/n(CnH2n); M(CnH2n) = 16,8 / 0,3 = 56 g/mol, čo zodpovedá vzorcu C 4 H 8 . Podľa rovnice (1) n(CnH2n): n(Br2) = 1:1, t.j. n(Br2) = n(CnH2n) = 0,3 mol. Poďme zistiť hmotnosť brómu: m(Br2) = n(Br2) x M(Br2); M(Br2) = 2 x Ar(Br) = 2 x 80 = 160 g/mol; m(Mn02) = 0,3 x 160 = 48 g. Vytvorme štruktúrne vzorce izomérov: butén-1 (1), butén-2 (2), 2-metylpropén (3), cyklobután (4). CH2=CH-CH2-CH3(1); CH3-CH=CH-CH3(2); CH2=C(CH3)-CH3(3); |
| Odpoveď | Hmotnosť brómu je 48 g |