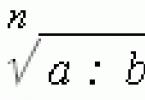
Condițiile de echilibru în procesele de transfer de căldură (echilibru termic) sunt determinate de măsurători relativ simple ale temperaturilor fazelor de contact. Echilibrul mecanic (când se transferă impulsul) este determinat de egalitatea presiunilor măsurate direct în fazele adiacente. Este mult mai dificil de determinat starea de echilibru a unui sistem în procesele de transfer de masă. Prin urmare, aici se va acorda atenție principală acestui tip de echilibru.
Procesul de transfer de masă de la o fază la alta într-un sistem închis izolat format din două sau mai multe faze are loc spontan și continuă până când se stabilește un echilibru de fază mobilă între faze în condiții date (temperatură și presiune). Se caracterizează prin faptul că, într-o unitate de timp, tot atâtea molecule ale componentului trec de la prima fază la a doua cât de la a doua la prima (adică nu există o tranziție preferențială a unei substanțe de la o fază la alta) . Ajuns la o stare de echilibru, sistemul poate rămâne în ea fără modificări cantitative și calitative pentru un timp arbitrar lung, până când o influență externă îl scoate din această stare. Astfel, starea unui sistem izolat la echilibru este determinată doar de condițiile interne. Prin urmare, gradienții parametrilor intensivi și fluxurile corespunzătoare acestora trebuie să fie egale cu zero:
dT = 0; dP = 0; dm i = 0
unde T este temperatura; P - presiune; m i - potenţialul chimic al componentei i-a.
Aceste expresii sunt numite condiții de echilibru termic, mecanic și, respectiv, chimic (material). Toate procesele spontane merg în direcția atingerii echilibrului. Cu cât starea sistemului se abate de la echilibru, cu atât este mai mare rata de transfer de substanțe între faze datorită creșterii forței motrice care determină acest proces. Prin urmare, pentru a efectua procesele de transfer de substanțe, este necesar să se prevină stabilirea unei stări de echilibru, pentru care sistemul este furnizat cu materie sau energie. În practică, în sistemele deschise, această condiție este de obicei implementată prin crearea unei mișcări de fază relativă în aparate cu contracurent, cocurent sau alte modele de curgere.
Din a doua lege a termodinamicii rezultă că în procesele spontane entropia S a sistemului crește și atinge valoarea sa maximă în starea de echilibru, adică. în acest caz dS = 0.
Această condiție, precum și cele trei anterioare, determină starea de echilibru a sistemului.
Potențialul chimic dm i este definit ca creșterea energiei interne U a sistemului atunci când în sistem se adaugă un număr infinit mic de moli ai componentei i, referitor la această cantitate de substanță, la volum constant V, entropie S și numărul de moli din fiecare dintre componentele rămase n j (unde n = l , 2, 3, …, j).
În cazul general, potențialul chimic poate fi definit ca creșterea oricăruia dintre potențialele termodinamice ale sistemului la diverși parametri constanți: energia Gibbs G– la presiune constantă Р, temperatura Т și n j ; entalpia H - la constanta S, P și n j .
În acest fel
Potențialul chimic depinde nu numai de concentrația unei componente date, ci și de tipul și concentrația altor componente ale sistemului. Pentru un amestec de gaze ideale, m i depinde numai de concentrația componentei considerate și de temperatură:
![]()
unde este valoarea lui m i în starea standard (de obicei la Р i = 0,1 MPa), depinde numai de temperatură; P i - presiunea parțială a i-a componentă a amestecului; este presiunea componentei i-a în starea standard.
Potențialul chimic caracterizează capacitatea componentului considerat de a părăsi această fază (prin evaporare, cristalizare etc.). Într-un sistem format din două sau mai multe faze, tranziția unei componente date poate avea loc spontan doar dintr-o fază în care potențialul său chimic este mai mare la o fază cu un potențial chimic mai mic. În condiții de echilibru, potențialul chimic al componentei în ambele faze este același.
În general, potențialul chimic poate fi scris astfel:
unde a i este activitatea componentei i-a a amestecului; x i și, respectiv, g i, fracția molară și coeficientul de activitate al i-a componentă.
Coeficientul de activitate g i este o măsură cantitativă a imperfecțiunii comportării componentei i-a din amestec. Pentru g i > 1, abaterea de la comportamentul ideal se numește pozitivă, pentru g i< 1 - отрицательным. Для отдельных систем g i £ 1. Тогда а i = х i ‚ и уравнение принимает вид:
![]()
Pentru sistemele ideale, potențialul chimic poate fi exprimat și în termeni de volatilitate f i a componentei:
![]()
Unde este volatilitatea componentei i-a în condiții standard. Valorile lui a i și f i se găsesc în literatura de referință.
La efectuarea proceselor tehnologice, mediile de lucru (gaz, abur, lichid) se află într-o stare de neechilibru, care nu poate fi descrisă de parametrii termodinamici. Pentru a descrie starea de neechilibru a sistemelor, sunt introduși parametri suplimentari de neechilibru sau disipativi, care sunt utilizați ca gradienți de mărimi termodinamice intense - temperatură, presiune, potențial chimic și densitatea fluxurilor disipative corespunzătoare asociate cu transferul de energie, masă și impuls.
Regula fazei
Existența unei faze date într-un sistem sau echilibrul fazelor este posibilă numai în anumite condiții. Când aceste condiții se schimbă, echilibrul sistemului este perturbat, are loc o schimbare de fază sau o tranziție a unei substanțe de la o fază la alta. Posibila existență a unei faze date în echilibru cu altele este determinată de regula fazei, sau Legea echilibrului de fază Gibbs:
C + F = k + n
unde C este numărul de grade de libertate (presiune, temperatură, concentrație) - numărul minim de parametri care pot fi modificați independent unul de celălalt fără a perturba echilibrul acestui sistem; Ф - numărul de faze ale sistemului; k este numărul de componente independente ale sistemului; n este numărul de factori externi care afectează poziția de echilibru în sistemul dat.
Pentru procesele de transfer de masă, n = 2, deoarece factorii externi în acest caz sunt temperatura și presiunea. Apoi expresia ia forma
C + F = k + 2
De aici C \u003d k - F + 2.
Astfel, regula fazei face posibilă determinarea numărului de parametri care pot fi modificați fără a încălca echilibrul de fază al sistemului. De exemplu, pentru un sistem de echilibru monocomponent "lichid - vapori", numărul de grade de libertate va fi:
C = 1 - 2 + 2 = 1
Adică, în acest caz, un singur parametru poate fi setat în mod arbitrar - presiunea sau temperatura. Astfel, pentru un sistem monocomponent, există o relație clară între temperatură și presiune în condiții de echilibru. Un exemplu sunt datele de referință utilizate pe scară largă - relația dintre temperatură și presiunea vaporilor saturați de apă.
Pentru un sistem de echilibru monocomponent format din trei faze "solid - lichid - vapori", numărul de grade de libertate este zero: С = 1 - 3 + 2 = 0.
De exemplu, sistemul „apă – gheață – vapori de apă” este în echilibru la o presiune de 610,6 Pa și o temperatură de 0,0076 °C.
Pentru un sistem de echilibru cu două componente „lichid - vapori”, numărul de grade de libertate C \u003d 2 - 2 + 2 \u003d 2. În acest caz, una dintre variabile (de exemplu, presiunea) este setată și o echivoc. relația dintre temperatură și concentrație sau (la temperatură constantă) între presiune și concentrație. Relația dintre parametri (temperatura - concentrație, presiune - concentrație) este construită în coordonate plate. Astfel de diagrame sunt de obicei numite diagrame de fază.
Astfel, regula fazelor determină posibilitatea coexistenței fazelor, dar nu indică dependențele cantitative ale transferului de materie între faze.
Starea termodinamică a echilibrului chimic
Condiția termodinamică pentru echilibrul unui proces care are loc în condiții izobaric-izoterme este egalitatea cu zero a modificării energiei Gibbs (D r G(T)=0). Când reacția continuă n un A+n b B=n cu C+n d D
modificarea energiei Gibbs standard este
D r G 0 T=(n c×D f G 0 C+ n d×D f G 0 D)–(n A×D f G 0 A+ n b×D f G 0 B).
Această expresie corespunde unui proces ideal în care concentrațiile reactanților sunt egale cu unitatea și rămân neschimbate în timpul reacției. În cursul proceselor reale, concentrațiile reactanților se modifică, concentrația substanțelor inițiale scade, în timp ce concentrația produselor de reacție crește. Luând în considerare dependența de concentrație a energiei Gibbs (vezi Sec. 1 . 3. 4) modificarea lui în timpul reacţiei este
D r G T=–
– =
=(n c×D f G 0 C+ n d×D f G 0 D)–(n A×D f G 0 A+ n b×D f G 0 B) +
+ R× T×(n c×ln C + n d×ln C D–n A×ln C A–n b×ln C B)
D r G T=D r G 0 T+R× T× ,
unde este concentrația adimensională i-a-a substanță; X i– fracția molară i-a-a substanță; pi- presiune parțială i-a-a substanță; R 0 \u003d \u003d 1,013 × 10 5 Pa - presiune standard; cu i– concentrația molară i-a-a substanță; Cu 0 \u003d 1 mol / l - concentrație standard.
Într-o stare de echilibru
D r G 0 T+R×T× = 0,
Valoare La 0 este numit constanta standard (termodinamică) de echilibru a reacției. Deci la o anumită temperatură T ca urmare a fluxului de reacții directe și inverse, echilibrul se stabilește în sistem la anumite concentrații de reactanți - concentratii de echilibru (C i) R . Valorile concentrațiilor de echilibru sunt determinate de valoarea constantei de echilibru, care este o funcție de temperatură și depinde de entalpie (D r H 0) și entropia (D r S 0) reacții˸
D r G 0 T+R× T×ln K 0 = 0,
deoarece D r G 0 T=D r H 0 T - T×D r S 0 T,
Dacă valorile entalpiei (D r H 0 T) și entropia (D r S 0 T) sau D r G 0 T reacție, atunci puteți calcula valoarea constantei standard de echilibru.
Constanta de echilibru de reacție caracterizează amestecurile și soluțiile de gaze ideale. Interacțiunile intermoleculare în gaze și soluții reale conduc la o abatere a valorilor calculate ale constantelor de echilibru de la cele reale. Pentru a ține cont de acest lucru, în locul presiunilor parțiale ale componentelor amestecurilor de gaze, se folosește fugacitatea acestora, iar în locul concentrației de substanțe în soluții, activitatea lor. fugacitate i componenta este legată de ᴇᴦο presiune parțială prin relație fi=g i× pi, unde g i- coeficientul de fugacitate.Activitatea si concentratia componentei sunt legate prin raport un i=g i× C i, unde g i– coeficientul de activitate.
Trebuie remarcat faptul că într-o gamă destul de largă de presiuni și temperaturi, amestecurile de gaze pot fi considerate ideale și pot fi efectuate calcule ale compoziției de echilibru a amestecului de gaze, având în vedere coeficientul de fugacitate g. i@ 1. În cazul soluțiilor lichide, în special soluțiilor electrolitice, coeficienții de activitate ai componentelor acestora pot diferi semnificativ de unitate (g i¹ 1) și activitățile ar trebui utilizate pentru a calcula compoziția de echilibru.
Condiția termodinamică a echilibrului chimic - concept și tipuri. Clasificarea și caracteristicile categoriei „Starea termodinamică a echilibrului chimic” 2015, 2017-2018.
Sistemele macroscopice au adesea o „memorie”, de parcă și-ar aminti istoria lor. De exemplu, dacă folosiți o lingură pentru a organiza mișcarea apei într-o cană, atunci această mișcare va continua pentru ceva timp, dar cu inerție. Oțelul capătă proprietăți speciale după prelucrare. Cu toate acestea, memoria se estompează în timp. Mișcarea apei în cupă se oprește, tensiunile interne din oțel slăbesc din cauza deformării plastice, iar neomogenitățile de concentrație scad din cauza difuziei. Se poate argumenta că sistemele tind să atingă stări relativ simple care sunt independente de istoria anterioară a sistemului. În unele cazuri, această stare se atinge rapid, în altele încet. Cu toate acestea, toate sistemele tind la stări în care proprietățile lor sunt determinate de factori interni, și nu de perturbații anterioare. Astfel de stări limită simple sunt, prin definiție, independente de timp. Aceste stări se numesc echilibru. Sunt posibile situații când starea sistemului este neschimbată, dar în el au loc fluxuri de masă sau energie. În acest caz, nu vorbim despre un echilibru, ci despre o stare staționară.
Starea unui sistem termodinamic, caracterizată în condiții externe constante prin invariabilitatea parametrilor în timp și absența fluxurilor în sistem, se numește echilibru.
stare de echilibru- starea limita, spre care tinde sistemul termodinamic, izolat de influentele externe. Condiția de izolare trebuie înțeleasă în sensul că rata proceselor de stabilire a echilibrului în sistem este mult mai mare decât rata de schimbare a condițiilor la limitele sistemului. Un exemplu este procesul de ardere a combustibilului în camera de ardere a unui motor rachetă. Timpul de rezidență al elementului de combustibil în cameră este foarte scurt (10 _3 - 1 (N s), cu toate acestea, timpul de echilibru este de aproximativ 10 ~ 5 s. Un alt exemplu este că procesele geochimice din scoarța terestră decurg foarte lent, dar durata de viață a sistemelor termodinamice de acest fel este calculată în milioane de ani, de aceea, în acest caz, este aplicabil și modelul de echilibru termodinamic.
Folosind conceptul introdus, putem formula următorul postulat: există stări speciale ale sistemelor simple - cele care sunt pe deplin caracterizate de valori macroscopice ale energiei interne U, volum Vși numere de alunițe n și n 2 > i, componente chimice. Dacă sistemul în cauză are proprietăți mecanice și electrice mai complexe, atunci numărul de parametri necesari pentru a caracteriza starea de echilibru crește (este necesar să se țină cont de prezența forțelor de tensiune superficială, a câmpurilor gravitaționale și electromagnetice etc.).
Din punct de vedere practic, experimentatorul trebuie să stabilească întotdeauna dacă sistemul studiat este în echilibru. Pentru aceasta, absența modificărilor vizibile în sistem nu este suficientă! De exemplu, două bare de oțel pot avea aceeași compoziție chimică, dar proprietăți complet diferite datorită prelucrărilor mecanice (forjare, presare), tratamentului termic etc. unul din ei. Dacă proprietățile sistemului studiat nu pot fi descrise folosind aparatul matematic al termodinamicii, aceasta poateînseamnă că sistemul nu este în echilibru.
În realitate, doar foarte puține sisteme ajung la o stare de echilibru absolut. În special, în această stare, toate materialele radioactive trebuie să fie într-o formă stabilă.
Se poate argumenta că sistemul este în echilibru dacă proprietățile sale sunt descrise în mod adecvat folosind aparatul termodinamicii.
Este util să reamintim că în mecanică, echilibrul unui sistem mecanic este starea unui sistem mecanic sub influența forțelor, în care toate punctele sale sunt în repaus în raport cu cadrul de referință luat în considerare.
Să luăm în considerare două exemple care explică conceptul de echilibru în termodinamică. Dacă se stabilește contactul între sistemul termodinamic și mediu, atunci în cazul general va începe un proces, care va fi însoțit de o modificare a unor parametri ai sistemului. În acest caz, unii dintre parametrii nu se vor modifica. Fie ca sistemul să fie format dintr-un cilindru care conține un piston (Fig. 1.9). În momentul inițial de timp, pistonul este fix. În dreapta și în stânga acestuia este gaz. Presiunea din stânga pistonului este R Ah corect - R in si R A > R B Dacă scoateți elementul de fixare, pistonul va fi eliberat și va începe să se miște spre dreapta, în timp ce volumul subsistemului DAR va începe să crească, iar dreapta - să scadă (-D VB = D VA). Subsistemul DAR pierde energie, subsistem LA o dobândește, presiune r A scăderi, presiune r in crește până când presiunile din stânga și din dreapta pistonului sunt egale. În acest caz, masele de gaz ale subsistemelor din stânga și dreapta pistonului nu se modifică. Astfel, în procesul luat în considerare, energia este transferată de la un subsistem la altul datorită modificărilor de presiune și volum. Variabilele independente din procesul considerat sunt presiunea și volumul. Acești parametri de stare la ceva timp după eliberarea pistonului vor lua valori constante și vor rămâne neschimbați până când sistemul este influențat din exterior. Starea atinsă este echilibrul.
Stare de echilibru - este starea finală a procesului de interacţiune a unuia sau mai multor sisteme cu mediul lor.
După cum reiese din exemplul de mai sus, parametrii unui sistem într-o stare de echilibru depind de starea inițială a sistemului (subsistemele sale) și de mediu. Trebuie remarcat faptul că interrelația indicată a stărilor inițiale și finale este unilaterală și nu permite restabilirea stării inițiale de neechilibru pe baza informațiilor despre parametrii stării de echilibru.
Orez. 1.9.
Un sistem termodinamic este în echilibru dacă toți parametrii de stare nu se modifică după ce sistemul este izolat de alte sisteme și de mediu.
Forța motrice a procesului considerat de stabilire a echilibrului a fost diferența de presiune la stânga și la dreapta pistonului, adică. diferența parametrilor de intensitate. În momentul inițial Ar \u003d r l -r in*0, la momentul final Ap \u003d 0, p "A \u003d Pv-
Ca un alt exemplu, luați în considerare sistemul prezentat în Fig. 1.10.

Orez. 1.10.
Shell-uri de sistem DARși AT - nedeformabil și rezistent la căldură (adiabatic). La momentul inițial, gazul din sistem LA este la temperatura camerei, apă în sistem DARîncălzit. Presiunea sistemului LA măsurată cu un manometru. La un moment dat în timp, stratul termoizolant între DARși LAîndepărtat (în acest caz, peretele rămâne nedeformat, dar devine permeabil la căldură (diatermic)). Presiunea sistemului LAîncepe să crească, este evident că energia este transferată din A în Bîn același timp, nu se observă modificări vizibile ale sistemelor, nu există mișcări mecanice. Privind în viitor, să spunem că acest mecanism de transfer de energie poate fi justificat folosind a doua lege a termodinamicii. În exemplul anterior, în procesul de stabilire a echilibrului, două coordonate s-au schimbat - presiunea și volumul. Se poate presupune că în al doilea exemplu ar trebui să se schimbe și două coordonate, dintre care una este presiunea; schimbarea secundei nu am putut observa.
Experiența arată că după o anumită perioadă de timp, stările sistemelor Aw Bîncetează să se schimbe, se stabilește o stare de echilibru.
Termodinamica se ocupă de stările de echilibru. Termenul „echilibru” implică faptul că acțiunea tuturor forțelor asupra sistemului și în cadrul sistemului este echilibrată. În acest caz, forțele motrice sunt egale cu zero și nu există fluxuri. Starea unui sistem de echilibru nu se schimbă dacă sistemul este izolat de mediu.
Este posibil să se ia în considerare tipuri separate de echilibru: termic (termic), mecanic, de fază și chimic.
Într-un sistem în stat termic echilibru, temperatura este aceeași în orice punct și nu se modifică în timp. Într-un sistem în stat mecanic echilibru, presiunea este constantă, deși mărimea presiunii poate varia de la un punct la altul (coloană de apă, aer). fază echilibru - echilibru între două sau mai multe faze ale unei substanțe (vapor - lichid; gheață - apă). Dacă sistemul a ajuns în stare chimic echilibru, nu poate detecta modificări ale concentrațiilor de substanțe chimice.
Dacă un sistem termodinamic este în echilibru, se presupune că a atins echilibrul de toate felurile (termic, mecanic, de fază și chimic). În caz contrar, sistemul este dezechilibrat.
Semne caracteristice ale unei stări de echilibru:
- 1) nu depinde de timp (staționaritate);
- 2) caracterizat prin absența fluxurilor (în special, căldură și masă);
- 3) nu depinde de „istoria” dezvoltării sistemului (sistemul „nu-și amintește” cum a ajuns în această stare);
- 4) stabil în raport cu fluctuațiile;
- 5) în absența câmpurilor nu depinde de poziția în sistem în cadrul fazei.
1. Proprietăţi extreme ale potenţialelor termodinamice.
2. Condiții de echilibru și stabilitate a unui sistem omogen spațial.
3. Condiţii generale pentru echilibrul de fază în sisteme termodinamice.
4. Tranziții de fază de primul fel.
5. Tranziții de fază de al doilea fel.
6. Generalizarea teoriei semifenomenologice.
Problemele de stabilitate a sistemelor termodinamice au fost luate în considerare în subiectul precedent în legătură cu problema echilibrului chimic. Sa punem problema fundamentarii teoretice a conditiilor formulate anterior (3.53) pe baza legii II a termodinamicii, folosind proprietatile potentialelor termodinamice.
Considerăm o modificare macroscopică infinitezimală a stării sistemului: 1 -2, în care toți parametrii săi sunt legați de o valoare infinitezimală:
Respectiv:
Apoi, în cazul unei tranziții cvasistatice, din formulările generalizate ale principiilor I și II ale termodinamicii (2.16) rezultă:
Dacă 1-2 este necvasi-static, atunci sunt valabile următoarele inegalități:
În expresia (4.3), valorile cu prim corespund unui proces necvasistatic, iar mărimile fără prim corespund unui proces cvasistatic. Prima inegalitate a sistemului (4.3) caracterizează principiul absorbției maxime de căldură obținută pe baza generalizării a numeroase date experimentale, iar a doua caracterizează principiul muncii maxime.
Scriind lucrarea pentru un proces non-cvasistatic sub formă și introducerea parametrilor și într-un mod similar, obținem:
Expresia (4.4) este absolut echivalentă cu inegalitatea Clausius.
Să luăm în considerare principalele consecințe ale (4.4) pentru diferite moduri de descriere a sistemelor termodinamice:
1. Sistem adiabatic izolat: (). Respectiv. Apoi:
Aceasta înseamnă că dacă variabilele de stare ale sistemului sunt fixe, atunci, datorită (4.5), entropia acestuia va apărea până când starea de echilibru apare în sistem, conform legii zero a termodinamicii. Adică, starea de echilibru corespunde entropiei maxime:
Variațiile din (4.6) se fac în funcție de acei parametri care, pentru parametrii fixați ai sistemului specificați, pot lua valori de neechilibru. Poate fi concentrația P, presiune R, temperatura etc.
2. Sistemul din termostat (). În consecință, ceea ce ne permite să rescriem (4.4) sub forma:
Ținând cont de forma expresiei pentru energie liberă: și egalitate, obținem:
Astfel, cursul proceselor de neechilibru pentru un sistem plasat într-un termostat este însoțit de o scădere a energiei sale libere. Și valoarea de echilibru corespunde minimului său:
3. Sistemul de sub piston (), i.e. .În acest caz, relația (4.4) ia forma:
Astfel, echilibrul în sistemul de sub piston are loc atunci când este atinsă valoarea minimă a potențialului Gibbs:
4. Sistem cu pereți imaginari (). Apoi. Apoi
care vă permite să scrieți
În consecință, într-un sistem cu pereți imaginari, procesele de neechilibru sunt direcționate către o scădere a potențialului, iar echilibrul este atins în condiția:
Condiția determină starea de echilibru a sistemului în sine și este utilizată pe scară largă în studiul sistemelor multicomponente sau multifazate. Condițiile minime sau maxime determină criteriile de stabilitate a acestor stări de echilibru în raport cu perturbațiile spontane sau create artificial ale sistemului.
În plus, prezența proprietăților extreme ale potențialelor termodinamice permite utilizarea metodelor variaționale pentru studiul lor prin analogie cu principiile variaționale ale mecanicii. Cu toate acestea, acest lucru necesită utilizarea unei abordări statistice.
Să luăm în considerare condițiile de echilibru și stabilitate ale sistemelor termodinamice folosind exemplul unui gaz plasat într-un cilindru deasupra unui piston. În plus, pentru a simplifica analiza, neglijăm câmpurile externe, presupunând Atunci variabilele de stare sunt ().
S-a remarcat mai devreme că un sistem termodinamic poate fi influențat fie lucrând la el, fie împărțindu-i o oarecare căldură. Prin urmare, este necesar să se analizeze echilibrul și stabilitatea în raport cu fiecare dintre influențele notate.
Acțiunea mecanică este asociată cu deplasarea pistonului liber. În acest caz, munca efectuată pe sistem este
Ca parametru intern care se poate modifica și pentru care trebuie efectuată variația, alegem volumul.
Reprezentând potențialul Gibbs prin energie liberă
si variind, scriem:
Din ultima egalitate rezultă:
Expresia (4.13) ar trebui considerată ca o ecuație pentru valoarea de echilibru a volumului pentru parametrii de sistem dați ().
Condițiile de stabilitate a stării de echilibru au forma:
Ținând cont de (4.13), ultima condiție poate fi rescrisă ca:
Condiția (4.14) impune anumite cerințe ecuației de stare. Deci, izoterme ale gazelor ideale
peste tot satisface condiția de stabilitate. În același timp, ecuația van der Waals
sau ecuația Dieteriga
au secțiuni pe care nu sunt îndeplinite condițiile de stabilitate și care nu corespund stărilor de echilibru real, adică. implementat experimental.
Dacă, totuși, există izoterme la un moment dat, atunci se folosesc metode speciale de analiză matematică pentru a verifica stabilitatea, adică. verificați dacă sunt îndeplinite următoarele condiții:
În mod similar, cerințele de stabilitate impuse ecuației de stare pot fi formulate pentru alți parametri ai sistemului. Luați în considerare, ca exemplu, dependența potențialului chimic. Să introducem densitatea numărului de particule. Atunci potenţialul chimic poate fi reprezentat ca
Să calculăm diferența în funcție de variabilele de stare:
La scrierea ultimei expresii s-a avut în vedere că s-a folosit identitatea termodinamică (3.8). Apoi
Adică, condiția de stabilitate a potențialului chimic ia forma
În punctul critic în prezența deviației, avem:
Să ne întoarcem la analiza stabilității sistemului la acțiunea termică asociată cu transferul unei anumite cantități de căldură. Apoi, ca parametru variațional, luăm în considerare entropia sistemului S. Pentru a ține cont exact de efectul termic, fixăm parametrii mecanici. Atunci este convenabil să alegeți un set ca variabile ale stării termodinamice și energia liberă ca potențial termodinamic.
Variind, găsim:
Din starea de echilibru obținem
Ecuațiile (4.21) ar trebui considerate ca o ecuație pentru valoarea de echilibru a entropiei. Din pozitivitatea celei de-a doua variații a energiei libere:
Deoarece temperatura ia întotdeauna valori pozitive, rezultă din (4.22):
Expresia (4.23) este condiția dorită pentru stabilitatea unui sistem termodinamic în raport cu încălzirea. Unii autori consideră capacitatea termică pozitivă ca una dintre manifestările principiului Le Chatelier-Brown. Când informați sistemul termodinamic despre cantitatea de căldură:
Apare temperatura acestuia, ceea ce, în conformitate cu cea de-a doua lege a termodinamicii din formularea lui Clausius (1850), duce la o scădere a cantității de căldură care intră în sistem. Cu alte cuvinte, ca răspuns la influențele externe - mesajul cantității de căldură - parametrii termodinamici ai sistemului (temperatura) se modifică în așa fel încât influențele externe sunt slăbite.
Luați în considerare mai întâi un sistem monocomponent într-o stare în două faze. În continuare, prin fază înțelegem o substanță omogenă în termeni chimici și fizici.
Astfel, fiecare fază va fi considerată ca un subsistem omogen și stabil termodinamic, caracterizat printr-o valoare comună a presiunii (în conformitate cu cerința absenței fluxurilor de căldură). Să studiem starea de echilibru a unui sistem cu două faze în raport cu modificarea numărului de particule și situate în fiecare dintre faze.
Ținând cont de ipotezele făcute, cel mai convenabil este să folosiți descrierea sistemului sub piston cu parametrii fiși (). Aici este numărul total de particule în ambele faze. De asemenea, pentru simplitate, „oprim” câmpurile externe ( A=0).
În conformitate cu metoda aleasă de descriere, condiția de echilibru este condiția (4.10) pentru minimul potențialului Gibbs:
care este completată de condiția de constanță a numărului de particule N:
Variind în (4.24a), luând în considerare (4.24b), găsim:
Astfel, criteriul general pentru echilibrul unui sistem cu două faze este egalitatea potențialelor lor chimice.
Dacă se cunosc expresiile potențialelor chimice și atunci soluția ecuației (4.25) va fi o curbă
numită curba de echilibru de fază sau echilibru de fază discret.
Cunoscând expresiile pentru potențiale chimice, din egalitate (2.yu):
putem găsi volumele specifice pentru fiecare dintre faze:
Adică, (4.26) poate fi rescrisă ca ecuații de stare pentru fiecare dintre faze:
Să generalizăm rezultatele obținute la caz n faze şi k componente chimic nereactive. Pentru arbitrar i a-a componentă, ecuația (4.25) are forma:
Este ușor de observat că expresia (4.28) reprezintă sistemul ( n- 1) ecuații independente. În consecință, din condițiile de echilibru pentru k componentă pe care o primim k(n-1) ecuații independente ( k(n-1) conexiuni).
Starea sistemului termodinamic în acest caz este dată de temperatură, presiune pși k-1 valori ale concentrațiilor relative ale componentelor în fiecare fază. Astfel, starea sistemului în ansamblu este stabilită de un parametru.
Ținând cont de constrângerile suprapuse, găsim numărul de parametri independenți ai sistemului (grad de libertate).
Egalitatea (4.29) se numește regula fazei Gibbs.
Pentru un sistem monocomponent () în cazul a două faze () există un grad de libertate, i.e. putem modifica în mod arbitrar doar un parametru. În cazul a trei faze (), nu există grade de libertate (), adică coexistența a trei faze într-un sistem monocomponent este posibilă doar într-un punct, numit punct triplu. Pentru apă, punctul triplu corespunde următoarelor valori: .
Dacă sistemul nu este monocomponent, sunt posibile cazuri mai complicate. Deci, un sistem cu două componente () în două faze () are două grade de libertate. În acest caz, în loc de curba de echilibru de fază, obținem o regiune sub forma unei benzi, ale cărei limite corespund diagramelor de fază pentru fiecare dintre componentele pure, iar regiunile interne corespund diferitelor valori ale concentrația relativă a componentelor. Un grad de libertate în acest caz corespunde curbei de coexistență a trei faze și corespunde celui de-al patrulea punct de coexistență a patru faze.
După cum sa discutat mai sus, potențialul chimic poate fi reprezentat astfel:
În consecință, primele derivate ale potențialului chimic sunt egale cu valorile specifice ale entropiei, luate cu semnul opus și volumul:
Dacă în punctele care satisfac echilibrul de fază:
primele derivate ale potențialului chimic pentru diferite faze experimentează o discontinuitate:
se spune că sistemul termodinamic suferă o tranziție de fază de ordinul întâi.
Tranzițiile de fază de primul fel sunt caracterizate prin prezența unei călduri latente a tranziției de fază, care este diferită de zero, și un salt în volumele specifice ale sistemului. Căldura specifică latentă a tranziției de fază este determinată din relația:
iar saltul în volum specific este:
Exemple de tranziții de fază de primul fel sunt procesele de fierbere și evaporare a lichidelor. Topirea solidelor, transformarea structurii cristaline etc.
Luați în considerare două puncte apropiate de pe curba de echilibru de fază () și (), ai căror parametri diferă prin valori infinitezimale. Atunci ecuația (4.25) este valabilă și pentru diferențele potențialelor chimice:
asta implică:
Efectuând transformări în (4.34), obținem:
Expresia (4.35) se numește ecuația Clausius-Clapeyron. Această ecuație face posibilă obținerea formei unei curbe de echilibru de fază din valorile căldurii de tranziție de fază și ale volumelor de fază cunoscute din experiment și fără a implica conceptul de potențial chimic, care este destul de dificil de determinat atât teoretic, cât și experimental. .
Așa-numitele stări metastabile sunt de mare interes practic. În aceste stări, o fază continuă să existe în regiunea de stabilitate a celeilalte faze:
Exemple de stări metastabile suficient de stabile sunt diamantele, sticla amorfă (împreună cu cristalul de rocă cristalin) etc. Stările metastabile ale apei sunt larg cunoscute în natură și în instalațiile industriale: lichid supraîncălzit și vapori suprarăciți, precum și lichid suprarăcit.
O împrejurare importantă este că condiția pentru realizarea experimentală a acestor stări este absența unei noi faze, impurități, impurități etc. în sistem, adică. absența unui centru de condensare, vaporizare și cristalizare. În toate aceste cazuri, noua fază apare inițial în cantități mici (picături, bule sau cristale). Prin urmare, efectele de suprafață care sunt proporționale cu cele de volum devin semnificative.
Pentru simplitate, ne mărginim să luăm în considerare cel mai simplu caz de coexistență a două stări de fază dezordonate spațial - lichid și vapori. Luați în considerare un lichid care conține o mică bule de vapori saturati. În acest caz, forța de tensiune superficială acționează de-a lungul interfeței. Pentru a ține cont, introducem parametrii:
Iată suprafața filmului,
Coeficientul de tensiune superficială. Semnul „-” din a doua ecuație (4.36) corespunde faptului că filmul este contractat și munca forței externe este direcționată spre creșterea suprafeței:
Apoi, ținând cont de tensiunea superficială, potențialul Gibbs se va modifica cu valoarea:
Introducând modelul sistemului sub piston și ținând cont de egalitate, scriem expresia pentru potențialul Gibbs sub forma
Iată și sunt valorile specifice ale energiei libere și sunt volumele specifice fiecărei faze. La valori fixe ale lui (), valoarea (4.39) atinge un minim. În acest caz, potențialul Gibbs poate fi variat. Aceste cantități sunt legate folosind relația:
Unde R poate fi exprimat în termeni de: Să alegem cantități ca parametri independenți, apoi potențialul Gibbs (4.39) poate fi rescris ca:
(aici luate in calcul)
Efectuând variația (4.40), scriem:

Ținând cont de independența cantităților, reducem (4.41) la sistem



Să analizăm egalitatea obținută. Din (4.42a) rezultă:
Semnificația sa este că presiunea din faza 1 este egală cu presiunea externă.
Introducerea expresiilor pentru potențialele chimice ale fiecărei faze și luarea în considerare
scriem (4.42b) sub forma:
Iată presiunea din faza II. Diferența dintre ecuația (4.44) și starea de echilibru de fază (4.25) este că presiunea din (4.44) în fiecare dintre faze poate fi diferită.
Din egalitate (4.42c) rezultă:
Comparând egalitatea rezultată cu (4.44) și expresia potențialului chimic, obținem formula pentru presiunea gazului în interiorul unei bule sferice:
Ecuația (4.45) este formula Laplace cunoscută din cursul fizicii generale. Generalizând (4.44) și (4.45), scriem condițiile de echilibru dintre un lichid și o bulă de vapori sub forma:
În cazul studierii problemei tranziției de fază lichid-solid, situația devine mult mai complicată din cauza necesității de a lua în considerare caracteristicile geometrice ale cristalelor și anizotropia direcției de creștere predominantă a cristalelor.
Tranzițiile de fază se observă și în cazuri mai complexe, în care doar derivatele secunde ale potențialului chimic în raport cu temperatură și presiune suferă o discontinuitate. În acest caz, curba de echilibru de fază este determinată nu de una, ci de trei condiții:
Tranzițiile de fază care satisfac ecuațiile (4.47) se numesc tranziții de fază de al doilea fel. În mod evident, căldura latentă a tranziției de fază și modificarea volumului specific în acest caz este egală cu zero:
Pentru a obține ecuația diferențială a curbei de echilibru de fază, nu poate fi utilizată ecuația Clausius-Clapeyron (4.35), deoarece la substituirea directă a valorilor (4.48) în expresia (4.35), se obține o incertitudine. Să luăm în considerare faptul că condiția u se păstrează la deplasarea de-a lungul curbei de echilibru de fază. Apoi:
Să calculăm derivatele din (4.49)
Înlocuind expresiile obţinute în (4.49), găsim:
Sistemul de ecuații liniare (4.51) scris față de și este omogen. Prin urmare, soluția sa netrivială există doar dacă determinantul compus din coeficienți este egal cu zero. Prin urmare, scriem


Ținând cont de condiția obținută și alegând orice ecuație din sistemul (4.51), obținem:


Ecuațiile (4.52) pentru curba de echilibru de fază în cazul unei tranziții de fază de ordinul doi sunt numite ecuații Ehrenfest. În acest caz, curba de echilibru de fază poate fi determinată din caracteristicile cunoscute de salturi de capacitate termică, coeficient de dilatare termică, coeficient de elasticitate.
Tranzițiile de fază de ordinul doi apar mult mai devreme decât tranzițiile de fază de ordinul întâi. Acest lucru este evident chiar și din condiția (4.47), care este mult mai rigidă decât ecuația curbei de echilibru de fază (4.10) cu condițiile (4.31). Un exemplu de astfel de tranziții de fază este trecerea unui conductor de la starea supraconductivă la starea normală în absența unui câmp magnetic.
În plus, există tranziții de fază cu o căldură latentă egală cu zero, pentru care, în timpul tranziției, se observă prezența unei singularități în ecuația calorică (capacitatea termică suferă o discontinuitate de al doilea fel). Acest tip de tranziție de fază se numește tranziție de fază de tip. Exemple de astfel de tranziții sunt tranziția heliului lichid de la starea superfluid la starea normală, trecerea la punctul Curie pentru feromagneți, trecerea de la starea inelastică la starea elastică pentru aliaje și așa mai departe.
) în condiţii de izolare faţă de mediu. În general, aceste valori nu sunt constante, ci doar fluctuează (fluctuează) în jurul valorilor lor medii. Dacă un sistem de echilibru corespunde mai multor stări, în fiecare dintre acestea sistemul poate fi nedefinit, atunci se spune că sistemul este într-un echilibru metastabil. Într-o stare de echilibru în sistem, nu există fluxuri de materie sau energie, potențiale de neechilibru (sau forțe motrice), modificări ale numărului de faze prezente. Există echilibru termic, mecanic, radiație (radiant) și chimic. În practică, condiția de izolare înseamnă că procesele de stabilire a echilibrului decurg mult mai repede decât se produc schimbări la granițele sistemului (adică schimbările în condiții externe sistemului), iar sistemul schimbă materie și energie cu mediul. Cu alte cuvinte, echilibrul termodinamic este atins dacă rata proceselor de relaxare este suficient de mare (de regulă, aceasta este caracteristică proceselor la temperatură înaltă) sau timpul de atingere a echilibrului este lung (acest caz apare în procesele geologice).
În procesele reale, echilibrul incomplet este adesea realizat, dar gradul acestei incompletitudine poate fi semnificativ și nesemnificativ. În acest caz, sunt posibile trei opțiuni:
- echilibrul este atins într-o parte (sau părți) dintr-un sistem relativ mare - echilibru local,
- echilibrul incomplet este atins datorită diferenței dintre ratele proceselor de relaxare care au loc în sistem - echilibru parțial,
- au loc atât echilibrul local cât și cel parțial.
În sistemele neechilibrate, apar modificări în fluxurile de materie sau energie sau, de exemplu, faze.
Stabilitatea echilibrului termodinamic
Starea de echilibru termodinamic se numește stabilă dacă în această stare nu există nicio modificare a parametrilor macroscopici ai sistemului.
Criterii de stabilitate termodinamică a diferitelor sisteme:
- Sistem izolat (absolut care nu interacționează cu mediul). este entropia maximă.
- Sistem inchis (schimba doar caldura cu termostatul).- energie libera minima.
- Sistem fix de temperatură și presiune este minimul potențialului Gibbs.
- Sistem cu entropie și volum fixe- energie interna minima.
- Sistem cu entropie și presiune fixe- entalpie minimă.
Vezi si
Fundația Wikimedia. 2010 .
Vedeți ce este „echilibru termodinamic” în alte dicționare:
- (vezi. ECHILIBRUL TERMODINAMIC). Dicţionar enciclopedic fizic. Moscova: Enciclopedia Sovietică. Redactor-șef A. M. Prokhorov. 1983. ECHILIBRI TERMODINAMIC ... Enciclopedia fizică
Vezi Echilibru termodinamic... Dicţionar enciclopedic mare
ECHILIBRI TERMODINAMIC - (2) … Marea Enciclopedie Politehnică
echilibru termodinamic- starea de echilibru termodinamic Absenţa lichidului supraîncălzit şi a aburului suprarăcit. [A.S. Goldberg. Dicţionar de energie engleză rusă. 2006] Subiecte energie în general Sinonime stare de echilibru termodinamic EN căldură ... ... Manualul Traducătorului Tehnic
Vezi echilibrul termodinamic. * * * ECHILIBRI TERMODINAMIC ECHILIBRI TERMODINAMIC, vezi Echilibru termodinamic (vezi ECHILIBRI TERMODINAMIC) ... Dicţionar enciclopedic
ECHILIBRI TERMODINAMIC- este starea sistemului în care parametrii macroscopici ai acestuia nu se modifică în timp. În această stare a sistemului, nu există procese însoțite de disiparea energiei, cum ar fi fluxurile de căldură sau reacțiile chimice. Din punct de vedere microscopic...... Paleomagnetologie, petromagnetologie și geologie. Dicţionar de referinţă.
echilibru termodinamic- termodinaminė pusiausvyra statusas T sritis chemija apibrėžtis Nekintanti termodinaminės sistemos būsena, kuriaje nevyksta medžiagos arba energijos pernaša. atitikmenys: engl. echilibru termodinamic. echilibru termodinamic... Chemijos terminų aiskinamasis žodynas
echilibru termodinamic- termodinaminė pusiausvyra statusas T sritis fizika atitikmenys: angl. echilibru termodinamic vok. thermodynamisches Gleichgewicht, n rus. echilibru termodinamic, n pranc. équilibre thermodynamique, m … Fizikos terminų žodynas