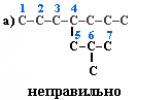
Pasirinkite pagrindinę anglies grandinę molekulėje. Pirma, jis turi būti ilgiausias. Antra, jei yra dvi ar daugiau tokio pat ilgio grandinių, tada iš jų parenkama labiausiai išsišakojusi. Pavyzdžiui, molekulėje yra 2 grandinės su tuo pačiu skaičiumi (7) C atomų (paryškinta spalva):
(a) atveju grandinė turi 1 pakaitą, o (b) atveju – 2. Todėl reikėtų pasirinkti (b) variantą.
1. Sunumeruokite anglies atomus pagrindinėje grandinėje taip, kad su pakaitais susieti C atomai gautų kuo mažesnį skaičių. Todėl numeracija pradedama nuo arčiausiai šakos esančios grandinės galo. Pavyzdžiui:

Pavadinkite visus radikalus (pakaitus), priešais nurodydami skaičius, nurodančius jų vietą pagrindinėje grandinėje. Jei yra keli identiški pakaitalai, kiekvienam iš jų rašomas skaičius (vieta), atskirtas kableliu, o jų skaičius nurodomas priešdėliais di-, trys-, tetra-, penta- ir tt (Pavyzdžiui, 2,2-dimetilas arba 2,3,3,5-tetrametilas).
Visų pakaitų pavadinimai yra išdėstyti abėcėlės tvarka (kaip nustatyta pagal naujausias IUPAC taisykles).
Įvardykite pagrindinę anglies atomų grandinę, t.y. atitinkamas normalus alkanas.
Taigi šakotojo alkano pavadinime šaknis + priesaga yra įprasto alkano pavadinimas (graikiškas skaitmuo + priesaga "an"), priešdėliai yra angliavandenilių radikalų skaičiai ir pavadinimai. Pavadinimo konstrukcijos pavyzdys:

Chem. Šv. alkanaiAlkanų krekingas. Krekingas yra terminio angliavandenilių skilimo procesas, pagrįstas didelių molekulių anglies grandinės suskaidymo reakcijomis, susidarant junginiams su trumpesne grandine. Alkanų izomerizacija Normalios struktūros alkanai, veikiami katalizatorių ir kaitinami, nekeičiant molekulių sudėties gali virsti šakotais alkanais, t.y. įsitraukia į izomerizacijos reakcijas. Šiose reakcijose dalyvauja alkanai, kurių molekulėse yra ne mažiau kaip 4 anglies atomai.Pavyzdžiui, n-pentano izomerizacija į izopentaną (2-metilbutaną) vyksta 100°C temperatūroje, esant aliuminio chlorido katalizatoriui:
 Pradinė medžiaga ir izomerizacijos reakcijos produktas turi tas pačias molekulines formules ir yra struktūriniai izomerai (anglies skeleto izomerija).
Pradinė medžiaga ir izomerizacijos reakcijos produktas turi tas pačias molekulines formules ir yra struktūriniai izomerai (anglies skeleto izomerija).
Alkanų dehidrogenavimas
Kaitinant alkanus esant katalizatoriams (Pt, Pd, Ni, Fe, Cr 2 O 3, Fe 2 O 3, ZnO), jų katalizė dehidrogenacija– vandenilio atomų atskilimas dėl CH-H ryšių nutrūkimo.
Dehidrinimo produktų struktūra priklauso nuo reakcijos sąlygų ir pagrindinės grandinės ilgio pradinėje alkano molekulėje.
1. Žemesni alkanai, kurių grandinėje yra nuo 2 iki 4 anglies atomų, kaitinant virš Ni katalizatoriaus, atskiria vandenilį nuo kaimyninis anglies atomais ir virsti alkenai:
Kartu su butenas-2ši reakcija sukelia butenas-1 CH2 \u003d CH-CH2-CH3. Esant Cr 2 O 3 /Al 2 O 3 katalizatoriui esant 450-650 С nuo n-butanas taip pat gaunamas butadieno-1,3 CH2=CH-CH=CH2.
2. Norint gauti, naudojami alkanai, kurių pagrindinėje grandinėje yra daugiau nei 4 anglies atomai cikliškas jungtys. Tuo pačiu metu tai atsitinka dehidrociklizacija- dehidrogenavimo reakcija, dėl kurios grandinė užsidaro į stabilų ciklą.
Jei pagrindinėje alkano molekulės grandinėje yra 5 (bet ne daugiau) anglies atomų ( n-pentanas ir jo alkilo dariniai), tada kaitinant virš Pt katalizatoriaus vandenilio atomai atsiskiria nuo galinių anglies grandinės atomų ir susidaro penkių narių ciklas (ciklopentanas arba jo dariniai):

Alkanai, kurių pagrindinė grandinė yra 6 ar daugiau anglies atomų, taip pat dalyvauja dehidrociklizacijos reakcijoje, tačiau visada sudaro 6 narių ciklą (cikloheksanas ir jo dariniai). Reakcijos sąlygomis šis ciklas toliau dehidrogenuojamas ir virsta energetiškai stabilesniu aromatinio angliavandenilio (areno) benzeno ciklu. Pavyzdžiui:

Šios reakcijos yra proceso pagrindas reformuojantis– naftos produktų perdirbimas, siekiant gauti arenų ( aromatizavimas sotieji angliavandeniliai) ir vandenilis. transformacija n- Arenose esantys alkanai pagerina benzino atsparumą smūgiams.
Sankt Peterburgo valstybinis technologijos institutas
(Technikos universitetas)
Organinės chemijos katedra 4 fakultetas
476 grupė
Kursinis darbas
Alkenų oksidacija
Studentas……………………………………… Rytina A.I.
Lektorius………………………………… Piterskaya Yu.L.
Sankt Peterburgas
Įvadas
1. Epoksidacija (N.A. Priležajevo reakcija, 1909 m.)
2. Hidroksilinimas
2.1anti- Hidroksilinimas
2.2sin- Hidroksilinimas
3. Oksidacinis alkenų skilimas
4.Ozonolizė
5. Alkenų oksidacija esant paladžio druskoms
Išvada
Naudotų šaltinių sąrašas
Įvadas
Oksidacija yra viena iš svarbiausių ir labiausiai paplitusių organinių junginių virsmų.
Organinėje chemijoje oksidacija suprantama kaip procesai, vedantys į junginio išeikvojimą vandenilyje arba jo sodrinimą deguonimi. Šiuo atveju iš molekulės pašalinami elektronai. Atitinkamai, redukcija suprantama kaip atsiskyrimas nuo organinės deguonies molekulės arba vandenilio pridėjimas prie jos.
Redokso reakcijose oksidatoriai yra junginiai, turintys didelį elektronų afinitetą (elektrofilai), o reduktoriai yra junginiai, kurie turi tendenciją atiduoti elektronus (nukleofilai). Junginio oksidacijos lengvumas didėja didėjant jo nukleofiliškumui.
Organinių junginių oksidacijos metu, kaip taisyklė, neįvyksta visiškas elektronų perdavimas ir atitinkamai anglies atomų valentingumas. Todėl oksidacijos laipsnio samprata – sąlyginis atomo krūvis molekulėje, apskaičiuotas remiantis prielaida, kad molekulė susideda tik iš jonų – yra tik sąlyginė, formali.
Sudarant redokso reakcijų lygtis būtina nustatyti reduktorius, oksidatorių ir duotų bei gautų elektronų skaičių. Paprastai koeficientai parenkami naudojant elektronų-jonų balanso metodą (pusinės reakcijos metodas).
Šiuo metodu atsižvelgiama į elektronų perėjimą iš vieno atomo ar jono į kitą, atsižvelgiant į terpės (rūgštinės, šarminės ar neutralios), kurioje vyksta reakcija, pobūdį. Norint išlyginti deguonies ir vandenilio atomų skaičių, įvedamos arba vandens molekulės ir protonai (jei terpė rūgštinė), arba vandens molekulės ir hidroksido jonai (jei terpė šarminė).
Taigi, rašant redukcijos ir oksidacijos pusines reakcijas, reikia vadovautis tirpale faktiškai esančių jonų sudėtimi. Medžiagos, kurios prastai disocijuoja, blogai tirpsta arba išsiskiria kaip dujos, turėtų būti parašytos molekuline forma.
Kaip pavyzdį apsvarstykite etileno oksidacijos procesą praskiestu vandeniniu kalio permanganato tirpalu (Vagnerio reakcija). Šios reakcijos metu etilenas oksiduojamas iki etilenglikolio, o kalio permanganatas redukuojamas į mangano dioksidą. Dvigubos jungties vietoje pridedami du hidroksilai:
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 + 2KOH
Redukcijos pusinė reakcija: MnO 4 ¯ + 2H 2 O + 3 e→ MnO 2 + 4OH ¯ 2Oksidacijos pusinė reakcija: C 2 H 4 + 2OH − − 2 e → C 2 H 6 O 2 3
Galiausiai turime joninę formą:
2MnO 4 + 4H 2 O + 3C 2 H 4 + 6OH → 2 MnO 2 + 8OH + 3 C 2 H 6 O 2
Atlikę būtinus panašių terminų redukcijas, parašome lygtį molekuline forma:
3C 2 H 4 + 2KMnO 4 + 4 H 2 O \u003d 3C 2 H 6 O 2 + 2MnO 2 + 2KOH.
Kai kurių oksidatorių apibūdinimas
Deguonis
Oro deguonis plačiai naudojamas technologiniuose procesuose, nes yra pigiausias oksidatorius. Tačiau oksidacija oro deguonimi yra kupina sunkumų, susijusių su proceso valdymu, kuris vyksta įvairiomis kryptimis. Oksidacija paprastai atliekama aukštoje temperatūroje, dalyvaujant katalizatoriams.
Ozonas
Ozonas O 3 naudojamas aldehidams ir ketonams gauti, jei sunku juos gauti kitais būdais. Dažniausiai ozonas naudojamas nesočiųjų junginių struktūrai nustatyti. Ozonas susidaro veikiant tyliai elektros iškrovai deguoniui. Vienas iš reikšmingų ozonavimo pranašumų, palyginti su chloravimu, yra toksinų nebuvimas po apdorojimo.
Kalio permanganatas
Kalio permanganatas yra dažniausiai naudojamas oksidatorius. Reagentas tirpsta vandenyje (6,0 % 20ºC temperatūroje), taip pat metanolyje, acetone ir acto rūgštyje. Oksidacijai naudojami vandeniniai (kartais acetono) KMnO 4 tirpalai neutralioje, rūgštinėje arba šarminėje terpėje. Atliekant procesą neutralioje aplinkoje, į reakcijos masę pridedama magnio, aliuminio druskų arba perleidžiamas anglies dioksidas, neutralizuojantis reakcijos metu išsiskiriantį kalio hidroksidą. KMnO 4 oksidacijos reakcija rūgščioje aplinkoje dažniausiai atliekama esant sieros rūgščiai. Šarminę aplinką oksidacijos metu sukuria reakcijos metu susidaręs KOH arba jis iš pradžių dedamas į reakcijos masę. Lengvai šarminėje ir neutralioje terpėje KMnO 4 oksiduojasi pagal lygtį:
KMnO4+ 3 e+ 2H 2 O \u003d K + + MnO 2 + 4OH ¯
rūgščioje aplinkoje:
KMnO4+ 5 e+ 8H + = K + + Mn 2+ + 4H 2 O
Kalio permanganatas naudojamas 1,2-dioliams gauti iš alkenų, oksiduojant pirminius alkoholius, aldehidus ir alkilarenus į karboksirūgštis, taip pat oksidaciniam anglies skeleto skaidymui esant daugybei ryšių.
Praktikoje dažniausiai naudojamas gana didelis KMnO 4 perteklius (daugiau nei 100%). Taip yra dėl to, kad normaliomis sąlygomis KMnO 4 iš dalies suyra į mangano dioksidą, išskirdamas O 2 . Sprogiai suyra su koncentruotu H 2 SO 4 kaitinant esant redukuojantiems agentams; kalio permanganato mišiniai su organinėmis medžiagomis taip pat yra sprogūs.
Perrūgštys
Peracto ir skruzdžių rūgštys gaunamos reaguojant 25-90 % vandenilio peroksido su atitinkama karboksirūgštimi pagal šią reakciją:
RCOOH + H 2 O 2 \u003d RCOOOH + H 2 O
Acto rūgšties atveju ši pusiausvyra nusistovi palyginti lėtai, o sieros rūgštis paprastai pridedama kaip katalizatorius, kad pagreitėtų perrūgšties susidarymas. Skruzdžių rūgštis yra pakankamai stipri, kad užtikrintų greitą pusiausvyrą.
Pertrifluoracto rūgštis, gaunama mišinyje su trifluoracto rūgštimi reaguojant trifluoracto anhidridui su 90% vandenilio peroksidu, yra dar stipresnis oksidatorius. Panašiai peracto rūgštį galima gauti iš acto anhidrido ir vandenilio peroksido.
Tvirtas m-chlorperbenzenkarboksirūgštis, nes ji yra gana saugu naudoti, gana stabili ir gali būti laikoma ilgą laiką.
Oksidacija vyksta dėl išsiskyrusio deguonies atomo:
RCOOOH = RCOOH + [O]
Perrūgštys naudojamos epoksidams gauti iš alkenų, taip pat laktonams iš aliciklinių ketonų gauti.
Vandenilio peroksidas
Vandenilio peroksidas yra bespalvis skystis, maišomas su vandeniu, etanoliu ir dietilo eteriu. 30% H 2 O 2 tirpalas vadinamas perhidroliu. Labai koncentruotas preparatas gali sprogiai reaguoti su organinėmis medžiagomis. Sandėliuojant jis skyla į deguonį ir vandenį. Vandenilio peroksido patvarumas didėja skiedžiant. Oksidacijai naudojami įvairios koncentracijos (nuo 3 iki 90%) vandeniniai tirpalai neutralioje, rūgštinėje ar šarminėje terpėje.
H 2 O 2 \u003d H 2 O + [O]
Šiam reagentui veikiant α,β-nesočiuosius karbonilo junginius šarminėje terpėje, gaunami atitinkami epoksialdehidai ir ketonai, perrūgštys sintetinamos oksiduojant karboksirūgštis rūgščioje terpėje. 30 % H 2 O 2 tirpalas acto rūgštyje oksiduoja alkenus į 1,2-diolius. Vandenilio peroksidas naudojamas: gauti organinius ir neorganinius peroksidus, Na perboratą ir perkarbonatą; kaip oksidatorius raketų degaluose; gavus epoksidų, hidrochinono, pirokatecholio, etilenglikolio, glicerino, tiuramo grupės vulkanizacijos greitintuvų ir kt.; aliejams, riebalams, kailiui, odai, tekstilės medžiagoms, popieriui balinti; germanio ir silicio puslaidininkinių medžiagų valymui; kaip dezinfekavimo priemonė buitinėms ir pramoninėms nuotekoms neutralizuoti; medicinoje; kaip O 2 šaltinis povandeniniuose laivuose; H 2 O 2 yra dalis Fenton reagento (Fe 2 + + H 2 O 2), kuris naudojamas kaip OH laisvųjų radikalų šaltinis organinėje sintezėje.
Rutenio ir osmio tetroksidai
Osmio tetroksidas OsO 4 yra balti arba šviesiai geltoni milteliai, kurių lyd. 40,6ºС; t. kip. 131,2ºС. Sublimuojasi jau kambario temperatūroje, tirpsta vandenyje (7,47 g 100 ml esant 25ºС), СCl 4 (250 g 100 g tirpiklio esant 20ºС). Esant organiniams junginiams, jis pajuoduoja dėl redukavimo iki OsO 2 .
RuO 4 yra aukso geltonumo prizmė su tokia pl. 25,4ºС, kambario temperatūroje pastebimai sublimuoja. Mažai tirpsta vandenyje (2,03 g 100 ml esant 20ºС), labai gerai tirpsta CCl 4 . Stipresnis oksidatorius nei OsO 4 . Virš 100ºС sprogsta. Kaip ir osmio tetroksidas, jis turi didelį toksiškumą ir didelę kainą.
Šie oksidatoriai yra naudojami alkenams oksiduoti į α-glikolius esant švelnioms sąlygoms.
Redokso reakcijose organinės medžiagos dažniau pasižymi redukuojančių agentų savybėmis, o patys oksiduojasi. Organinių junginių oksidacijos paprastumas priklauso nuo elektronų prieinamumo sąveikaujant su oksiduojančiu agentu. Visi žinomi veiksniai, sukeliantys elektronų tankio padidėjimą organinių junginių molekulėse (pavyzdžiui, teigiamas indukcinis ir mezomerinis poveikis), padidins jų gebėjimą oksiduotis ir atvirkščiai.
Organinių junginių polinkis oksiduotis didėja jiems augant nukleofiliškumas, kuris atitinka šias eilutes:
Nukleofiliškumo augimas serijoje
Apsvarstykite redokso reakcijos svarbiausių klasių atstovai organinės medžiagos su kai kuriais neorganiniais oksidatoriais.
Alkenų oksidacija
Dėl švelnios oksidacijos alkenai paverčiami glikoliais (dvihidrosiais alkoholiais). Redukuojantys atomai šiose reakcijose yra anglies atomai, sujungti dviguba jungtimi.
Reakcija su kalio permanganato tirpalu neutralioje arba silpnai šarminėje terpėje vyksta taip:
3C 2H 4 + 2KMnO 4 + 4H 2 O → 3CH 2 OH – CH 2 OH + 2 MnO 2 + 2KOH
Esant sunkesnėms sąlygoms, oksiduojantis nutrūksta anglies grandinė ties dviguba jungtimi ir susidaro dvi rūgštys (stipriai šarminėje terpėje dvi druskos) arba rūgštis ir anglies dioksidas (stipriai šarminėje terpėje druska ir anglies dioksidas). karbonatas):
1) 5CH 3 CH=CHCH 2 CH 3 + 8 KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8 MnSO 4 + 4K 2 SO 4 + 17 H 2 O
2) 5CH 3 CH=CH 2 + 10 KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10 MnSO 4 + 5K 2 SO 4 + 20 H 2 O
3) CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 10KOH → CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 8K 2 MnO 4
4) CH 3 CH \u003d CH 2 + 10KMnO 4 + 13KOH → CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4
Kalio dichromatas sieros rūgšties terpėje oksiduoja alkenus panašiai kaip 1 ir 2 reakcijose.
Oksiduojant alkenus, kurių anglies atomai dviguboje jungtyje turi du anglies radikalus, susidaro du ketonai:


Alkino oksidacija
Alkinai oksiduojasi šiek tiek sunkesnėmis sąlygomis nei alkenai, todėl dažniausiai oksiduojasi trigubai ryšiai nutraukiant anglies grandinę. Kaip ir alkenų atveju, redukuojantys atomai čia yra anglies atomai, sujungti daugybine jungtimi. Dėl reakcijų susidaro rūgštys ir anglies dioksidas. Oksidacija gali būti atliekama permanganatu arba kalio dichromatu rūgščioje aplinkoje, pavyzdžiui:
5CH 3 C≡CH + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 8 MnSO 4 + 4K 2 SO 4 + 12H 2 O

Acetilenas gali būti oksiduojamas kalio permanganatu neutralioje terpėje iki kalio oksalato:
3CH≡CH +8KMnO4 → 3KOOC –COOK +8MnO2 +2KOH +2H2O
Rūgščioje aplinkoje oksidacija pereina į oksalo rūgštį arba anglies dioksidą:
5CH≡CH + 8KMnO4 + 12H 2 SO 4 → 5HOOC -COOH + 8 MnSO 4 + 4K 2 SO 4 + 12H 2 O
CH≡CH + 2KMnO4 + 3H 2 SO 4 → 2CO 2 + 2 MnSO 4 + 4H 2 O + K 2 SO 4
Benzeno homologų oksidacija
Benzenas nesioksiduoja net ir gana atšiauriomis sąlygomis. Benzeno homologai gali būti oksiduojami kalio permanganato tirpalu neutralioje terpėje iki kalio benzoato:
C 6 H 5 CH 3 + 2 KMnO 4 → C 6 H 5 COOK + 2 MnO 2 + KOH + H 2 O
C 6 H 5 CH 2 CH 3 + 4 KMnO 4 → C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4 MnO 2 + KOH
Oksiduojant benzeno homologus dichromatu arba kalio permanganatu rūgštinėje terpėje susidaro benzenkarboksirūgštis.
5C 6 H 5 CH 3 + 6 KMnO 4 + 9 H 2 SO 4 → 5C 6 H 5 COOH + 6 MnSO 4 + 3K 2 SO 4 + 14 H 2 O
5C 6 H 5 – C 2 H 5 + 12 KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 12 MnSO 4 + 6K 2 SO 4 + 28 H 2 O


Alkoholio oksidacija
Tiesioginiai pirminių alkoholių oksidacijos produktai yra aldehidai, o antrinių – ketonai.
Oksiduojant alkoholius susidarę aldehidai lengvai oksiduojasi į rūgštis, todėl aldehidai iš pirminių alkoholių gaunami oksiduojant kalio dichromatu rūgščioje terpėje aldehido virimo temperatūroje. Išgaruojant aldehidai nespėja oksiduotis.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O
Esant oksidatoriaus (KMnO 4, K 2 Cr 2 O 7) pertekliui bet kurioje terpėje, pirminiai alkoholiai oksiduojami į karboksirūgštis arba jų druskas, o antriniai - į ketonus.
5C 2H 5OH + 4KMnO 4 + 6H 2 SO 4 → 5CH 3 COOH + 4 MnSO 4 + 2K 2 SO 4 + 11 H 2 O
3CH 3 -CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CH 3 -COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
Tretiniai alkoholiai tokiomis sąlygomis nėra oksiduojami, tačiau metilo alkoholis oksiduojamas iki anglies dioksido.

Dvihidrosis alkoholis, etilenglikolis HOCH 2 -CH 2 OH, kaitinant rūgštinėje terpėje su KMnO 4 arba K 2 Cr 2 O 7 tirpalu, lengvai oksiduojasi iki oksalo rūgšties, o neutralioje – į kalio oksalatą.
5CH 2 (OH) - CH 2 (OH) + 8KMnO 4 + 12H 2 SO 4 → 5HOOC -COOH + 8 MnSO 4 + 4K 2 SO 4 + 22 H 2 O
3CH 2 (OH) - CH 2 (OH) + 8KMnO4 → 3KOOC -COOK + 8MnO2 + 2KOH + 8H 2O
Aldehidų ir ketonų oksidacija
Aldehidai yra gana stiprūs reduktoriai, todėl juos lengvai oksiduoja įvairūs oksidatoriai, pvz.: KMnO 4, K 2 Cr 2 O 7, OH, Cu (OH) 2. Visos reakcijos vyksta kaitinant:
3CH 3 CHO + 2 KMnO 4 → CH 3 COOH + 2 CH 3 COOK + 2 MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2KMnO 4 + 3KOH → CH 3 COOK + 2K 2 MnO 4 + 2H 2 O
5CH 3 CHO + 2KMnO4 + 3H 2 SO 4 → 5CH 3 COOH + 2 MnSO 4 + K 2 SO 4 + 3H 2 O
CH 3 CHO + Br 2 + 3NaOH → CH 3 COONa + 2 NaBr + 2H 2 O

sidabrinio veidrodžio reakcija
Sidabro oksido amoniako tirpalu aldehidai oksiduojami į karboksirūgštis, kurios amoniako tirpale sudaro amonio druskas („sidabro veidrodžio“ reakcija):
CH 3 CH \u003d O + 2OH → CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
CH 3 -CH \u003d O + 2Cu (OH) 2 → CH 3 COOH + Cu 2 O + 2H 2 O
Skruzdžių aldehidas (formaldehidas) paprastai oksiduojamas į anglies dioksidą:
5HCOH + 4KMnO 4 (trobelė) + 6H 2 SO 4 → 4 MnSO 4 + 2K 2 SO 4 + 5CO 2 + 11 H 2 O
3CH 2O + 2K 2Cr 2O 7 + 8H 2 SO 4 → 3CO 2 + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
HCHO + 4OH → (NH 4) 2 CO 3 + 4Ag↓ + 2H 2 O + 6NH 3
HCOH + 4Cu(OH) 2 → CO 2 + 2Cu 2 O↓+ 5H 2 O
Ketonai sunkiomis sąlygomis oksiduojami stipriais oksidatoriais, nutraukiant C-C ryšius ir susidaro rūgščių mišiniai:

karboksirūgštys. Iš rūgščių stiprias redukuojančias savybes turi skruzdžių ir oksalo rūgštys, kurios oksiduojasi iki anglies dioksido.
HCOOH + HgCl 2 \u003d CO 2 + Hg + 2HCl
HCOOH + Cl 2 \u003d CO 2 + 2HCl
HOOC-COOH + Cl 2 \u003d 2CO 2 + 2HCl
Skruzdžių rūgštis, be rūgščių savybių, taip pat pasižymi kai kuriomis aldehidų savybėmis, ypač redukuojamomis. Tada jis oksiduojamas iki anglies dioksido. Pavyzdžiui:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
Kaitinamas su stipriomis dehidratuojančiomis medžiagomis (H2SO4 (konc.) arba P4O10), jis suyra:
HCOOH →(t)CO + H2O
Katalizinė alkanų oksidacija:

Katalizinė alkenų oksidacija:

Fenolio oksidacija:


Redokso reakcijų, kuriose dalyvauja organinės medžiagos, lygčių sudarymas
INĮvedus vieningą valstybinį egzaminą (US), kaip vienintelę vidurinių mokyklų absolventų baigiamojo atestavimo formą, ir perėjus aukštajai mokyklai prie specializuoto išsilavinimo, aukštųjų mokyklų studentų paruošimas atlikti „brangiausias“ užduotis. USE testo chemijos C dalies punktai tampa vis svarbesni. Nepaisant to, kad penkios „C“ dalies užduotys yra skirtingos: neorganinių medžiagų cheminės savybės, organinių junginių virsmų grandinės, skaičiavimo užduotys, visi jie tam tikru mastu yra susiję su redokso reakcijomis (ORR). Įsigijus pagrindines OVR teorijos žinias, galima teisingai atlikti pirmąją ir antrąją užduotis visiškai, o trečiąją – iš dalies. Mūsų nuomone, didelė dalis sėkmės įgyvendinant „C“ dalį slypi būtent tai. Patirtis rodo, kad jei studijuodami neorganinę chemiją studentai pakankamai gerai susidoroja su OVR lygčių rašymo užduotimis, tai panašios organinės chemijos užduotys jiems sukelia didelių sunkumų. Todėl per visą organinės chemijos kursą specializuotose klasėse stengiamės ugdyti aukštųjų mokyklų studentų OVR lygčių sudarymo įgūdžius.
Tirdami neorganinių ir organinių junginių lyginamąsias charakteristikas, supažindiname su oksidacijos būsenos (s.o.) (organinėje chemijoje, pirmiausia anglies) panaudojimu ir jos nustatymo metodais:
1) vidutinio s.d. anglis organinės medžiagos molekulėje;
2) s.d apibrėžimas. kiekvienas anglies atomas.
Aiškinamės, kokiais atvejais geriau naudoti vieną ar kitą būdą.
Straipsnis publikuotas remiant įmonei „GEO-Engineering“, kuri rinkoje pristato produktus prekės ženklu „ProfKresla“. Įmonės veiklos sritis – fotelių ir kėdžių įvairioms salėms gamyba, pardavimas ir montavimas. Aukštas darbuotojų profesionalumas ir nuosavos gamybos patalpos leidžia greitai ir efektyviai įgyvendinti bet kokio sudėtingumo projektus. Visi „ProfKresla“ prekės ženklo gaminiai, nesvarbu, ar tai būtų Teatro kėdės, laukiamųjų kambarių ar mokymo įstaigų kėdės, išsiskiria šiuolaikišku ir ergonomišku dizainu, taip pat dideliu atsparumu dilimui, tvirtumu ir patogumu. Iš didžiulio produktų asortimento, pateikto profkresla.ru svetainės kataloge, visada galite pasirinkti modelius, kurie geriausiai atitinka jūsų įmonėje priimtą firminį stilių. Jei vis tiek kyla sunkumų dėl pasirinkimo, tuomet įmonės specialistai visada pasiruošę patarti, padėti nustatyti modelį, o vėliau parengti projektą, atlikti visus reikiamus matavimus ir montavimą vietoje.
P Nagrinėdami temą „Alkanai“ parodome, kad oksidacijos, degimo, halogeninimo, nitrinimo, dehidrogenavimo, skilimo procesai yra redokso procesai. Rašant organinių medžiagų degimo ir skilimo reakcijų lygtis, geriau naudoti vidutinę s.d reikšmę. anglies. Pavyzdžiui:
Atkreipiame dėmesį į pirmąją elektroninio balanso pusę: ties anglies atomu trupmeninėje s.d. vardiklis yra 4, todėl elektronų perdavimą skaičiuojame naudodami šį koeficientą.
Kitais atvejais, tirdami temą „Alkanai“, nustatome s.d. kiekvienas junginio anglies atomas, atkreipiant studentų dėmesį į vandenilio atomų pakeitimo pirminiuose, antriniuose, tretiniuose anglies atomuose seką:


Taigi darome studentus prie išvados, kad pradžioje pakeitimo procesas vyksta tretiniuose, paskui antriniuose ir, galiausiai, pirminiuose anglies atomuose.
P Nagrinėdami temą „Alkenai“, atsižvelgiame į oksidacijos procesus, priklausančius nuo alkeno struktūros ir reakcijos terpės.
Kai alkenai oksiduojami koncentruotu kalio permanganato KMnO 4 tirpalu rūgštinėje terpėje (kieta oksidacija), - ir - ryšiai nutrūksta, susidaro karboksirūgštys, ketonai ir anglies monoksidas (IV). Ši reakcija naudojama dvigubos jungties padėčiai nustatyti.
Jei dviguba jungtis yra molekulės gale (pavyzdžiui, butene-1), tada vienas iš oksidacijos produktų yra skruzdžių rūgštis, kuri lengvai oksiduojasi į anglies dioksidą ir vandenį:

Pabrėžiame, kad jei alkeno molekulėje prie dvigubos jungties anglies atomas turi du anglies pakaitus (pavyzdžiui, 2-metilbuteno-2 molekulėje), tai jo oksidacijos metu susidaro ketonas, nes toks atomas virsta. Patekimas į karboksilo grupės atomą neįmanomas nenutraukus C-C jungties, santykinai stabilus tokiomis sąlygomis:

Paaiškiname, kad jei alkeno molekulė yra simetriška, o dviguba jungtis yra molekulės viduryje, tada oksidacijos metu susidaro tik viena rūgštis:

Pranešame, kad alkenų, kurių anglies atomai dviguboje jungtyje yra du anglies radikalai, oksidacijos ypatybė yra dviejų ketonų susidarymas:


Atsižvelgdami į alkenų oksidaciją neutralioje arba silpnai šarminėje terpėje, atkreipiame aukštųjų mokyklų moksleivių dėmesį į tai, kad tokiomis sąlygomis oksidaciją lydi diolių (dihidroalkoholių) susidarymas, o prie tų anglies atomų prisijungia hidroksilo grupės. tarp kurių buvo dvigubas ryšys:

IN Panašiai nagrinėjame acetileno ir jo homologų oksidaciją, priklausomai nuo terpės, kurioje vyksta procesas. Taigi, paaiškiname, kad rūgštinėje aplinkoje oksidacijos procesą lydi karboksirūgščių susidarymas:

Reakcija naudojama alkinų struktūrai nustatyti pagal oksidacijos produktus:

Neutralioje ir silpnai šarminėje terpėje acetileno oksidaciją lydi atitinkamų oksalatų (oksalo rūgšties druskų) susidarymas, o homologų oksidaciją lydi trigubos jungties nutrūkimas ir karboksirūgščių druskų susidarymas:

IN Visos taisyklės yra parengtos su studentais pagal konkrečius pavyzdžius, o tai leidžia geriau įsisavinti teorinę medžiagą. Todėl, tirdami arenų oksidaciją įvairiose terpėse, studentai gali savarankiškai daryti prielaidas, kad rūgščioje terpėje reikia tikėtis rūgščių, o šarminėje – druskų susidarymo. Mokytojas turės tik išsiaiškinti, kokie reakcijos produktai susidaro priklausomai nuo atitinkamos arenos struktūros.
Pavyzdžiais parodome, kad benzeno homologai su viena šonine grandine (nepriklausomai nuo jos ilgio) yra oksiduojami stipriu oksidatoriumi į benzenkarboksirūgštį prie -anglies atomo. Benzeno homologai, kaitinami, neutralioje terpėje oksiduojami kalio permanganatu, kad susidarytų aromatinių rūgščių kalio druskos.
5C 6 H 5 -CH 3 + 6 KMnO 4 + 9H 2 SO 4 \u003d 5C 6 H 5 COOH + 6 MnSO 4 + 3K 2 SO 4 + 14 H 2 O,
5C 6 H 5 - C 2 H 5 + 12 KMnO 4 + 18 H 2 SO 4 \u003d 5C 6 H 5 COOH + 5CO 2 + 12 MnSO 4 + 6K 2 SO 4 + 28 H 2 O,
C 6 H 5 -CH 3 + 2 KMnO 4 \u003d C 6 H 5 COOK + 2 MnO 2 + KOH + H 2 O.
Pabrėžiame, kad jei areno molekulėje yra kelios šoninės grandinės, tai rūgščioje terpėje kiekviena iš jų prie a-anglies atomo oksiduojasi į karboksilo grupę, todėl susidaro daugiabazės aromatinės rūgštys:

PĮgyti angliavandenilių OVR lygčių sudarymo įgūdžiai leidžia jas panaudoti studijuojant skyrių „Deguonies turintys junginiai“.
Taigi, studijuodami temą „Alkoholiai“, studentai savarankiškai sudaro alkoholių oksidacijos lygtis, vadovaudamiesi šiomis taisyklėmis:
1) pirminiai alkoholiai oksiduojami iki aldehidų
3CH 3 -CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 \u003d 3CH 3 -CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) antriniai alkoholiai oksiduojami į ketonus

3) tretiniams alkoholiams oksidacijos reakcija nebūdinga.
Norint pasiruošti egzaminui, mokytojui patartina apie šias savybes suteikti papildomos informacijos, kuri neabejotinai bus naudinga mokiniams.
Metanolį oksiduojant parūgštintu kalio permanganato arba kalio dichromato tirpalu, susidaro CO 2, pirminiai alkoholiai oksidacijos metu, priklausomai nuo reakcijos sąlygų, gali sudaryti ne tik aldehidus, bet ir rūgštis. Pavyzdžiui, etanolio oksidacija kalio dichromatu šaltuoju būdu baigiasi acto rūgšties susidarymu, o kaitinant - acetaldehidu:
3CH 3 -CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 \u003d 3CH 3 -COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11 H 2 O,
3CH 3 -CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 -CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O.
Dar kartą priminkime mokiniams apie aplinkos įtaką alkoholio oksidacijos reakcijų produktams, būtent: karštas neutralus KMnO 4 tirpalas oksiduoja metanolį į kalio karbonatą, o likusieji alkoholiai – į atitinkamų karboksirūgščių druskas:

Nagrinėdami temą „Aldehidai ir ketonai“ atkreipiame studentų dėmesį į tai, kad aldehidai lengviau nei alkoholiai oksiduojasi į atitinkamas karboksirūgštis ne tik veikiant stiprioms oksiduojančioms medžiagoms (oro deguonis, parūgštinti KMnO 4 tirpalai ir kt. K 2 Cr 2 O 7), bet veikiant silpnam (amoniako sidabro oksido arba vario (II) hidroksido tirpalas):
5CH3-CHO + 2KMnO4 + 3H2SO4 \u003d 5CH3-COOH + 2MnSO4 + K2SO4 + 3H2O,
3CH 3 -CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 \u003d 3CH 3 -COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH 3 -CHO + 2OH CH 3 -COONH 4 + 2Ag + 3NH3 + H 2 O.
Ypatingą dėmesį skiriame metanalio oksidacijai sidabro oksido amoniako tirpalu, nes šiuo atveju susidaro amonio karbonatas, o ne skruzdžių rūgštis:
HCHO + 4OH \u003d (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
Kaip rodo mūsų ilgametė patirtis, siūlomas metodas mokyti aukštųjų mokyklų studentus, kaip rašyti OVR lygtis, dalyvaujant organinėms medžiagoms, keliais taškais padidina galutinį jų panaudojimo rezultatą chemijoje.
Kaip jau minėta, organinės medžiagos oksidacija yra deguonies įvedimas į jos sudėtį ir (arba) vandenilio pašalinimas. Atkūrimas yra atvirkštinis procesas (vandenilio įvedimas ir deguonies pašalinimas). Atsižvelgiant į alkanų (СnH2n+2) sudėtį, galime daryti išvadą, kad jie negali dalyvauti redukcijos reakcijose, tačiau gali dalyvauti oksidacijos reakcijose.
Alkanai yra junginiai, turintys mažą anglies oksidacijos laipsnį ir, priklausomai nuo reakcijos sąlygų, gali būti oksiduojami, kad susidarytų įvairūs junginiai.
Įprastoje temperatūroje alkanai nereaguoja net su stipriais oksidatoriais (H2Cr2O7, KMnO4 ir kt.). Įvedus į atvirą ugnį, alkanai dega. Tuo pačiu metu, esant deguonies pertekliui, jie visiškai oksiduojasi iki CO2, kur anglis turi aukščiausią oksidacijos laipsnį +4, ir vandens. Angliavandenilių degimas veda prie visų C-C ir CH jungčių nutrūkimo ir kartu išsiskiria dideliu šilumos kiekiu (egzoterminė reakcija).
Visuotinai pripažįstama, kad alkano oksidacijos mechanizmas apima radikalų grandininį procesą, nes pats deguonis nėra labai reaktyvus, todėl norint abstrahuoti vandenilio atomą iš alkano, reikia dalelės, kuri inicijuos alkilo radikalo susidarymą, kuris reaguoja su deguonimi, sudarydamas peroksiradikalą. Tada peroksiradikalas gali abstrahuoti vandenilio atomą iš kitos alkano molekulės, sudarydamas alkilo hidroperoksidą ir radikalą.

Alkanus galima oksiduoti atmosferos deguonimi 100-150 °C temperatūroje, esant katalizatoriui - mangano acetatui, ši reakcija naudojama pramonėje. Oksidacija įvyksta, kai oro srovė pučiama per išlydytą parafiną, kuriame yra mangano druskos.
Nes dėl reakcijos susidaro rūgščių mišinys, po to jos atskiriamos nuo nesureagavusio parafino ištirpinant vandeniniame šarme, o po to neutralizuojamos mineraline rūgštimi.
Tiesiogiai pramonėje šis metodas naudojamas acto rūgščiai gauti iš n-butano:
Alkenų oksidacija
Alkenų oksidacijos reakcijos skirstomos į dvi grupes: 1) reakcijos, kurių metu išsaugomas anglies karkasas, 2) molekulės anglies karkaso išilgai dvigubos jungties oksidacinio sunaikinimo reakcijos.
Alkenų oksidacijos reakcijos išsaugant anglies skeletą
1. Epoksidacija (Priležajevo reakcija)
Acikliniai ir cikliniai alkenai, sąveikaudami su perrūgštimis nepolinėje terpėje, sudaro epoksidus (oksiranus).
Taip pat oksiranus galima gauti oksiduojant alkenus hidroperoksidais, esant katalizatoriams, kurių sudėtyje yra molibdeno, volframo, vanadžio:

Paprasčiausias oksiranas, etileno oksidas, gaminamas pramoniniu būdu, oksiduojant etileną deguonimi, kai katalizatorius yra sidabras arba sidabro oksidas.

2. antihidroksilinimas (epoksidų hidrolizė)
Rūgštinė (arba šarminė) epoksidų hidrolizė veda prie oksido ciklo atidarymo, susidarant transdioliams.

Pirmajame etape epoksido deguonies atomo protonavimas vyksta susidarant cikliniam oksonio katijonui, kuris atsidaro dėl vandens molekulės nukleofilinės atakos.
Bazės katalizuojamas epoksidinio žiedo atidarymas taip pat lemia trans-glikolių susidarymą.

3. sin-hidroksilinimas
Vienas iš seniausių alkenų oksidavimo būdų yra Vagnerio reakcija (oksidacija kalio permanganatu). Iš pradžių oksidacijos metu susidaro ciklinis permanganato esteris, kuris hidrolizuojamas į greta esantį diolį:

Be Wagnerio reakcijos, yra ir kitas būdas sin-hidroksilinti alkenus veikiant osmio (VIII) oksidui, kurį pasiūlė Krige. Veikiant osmio tetroksidui alkeną eteryje arba dioksane, susidaro juodos osminės rūgšties ciklinio esterio nuosėdos - osmatas. Tačiau OsO4 pridėjimas prie daugialypės jungties yra žymiai pagreitintas piridine. Susidariusios juodos osmato nuosėdos lengvai suskaidomos veikiant vandeniniam natrio hidrosulfito tirpalui:

Kalio permanganatas arba osmio (VIII) oksidas oksiduoja alkeną iki cis-1,2-diolio.
Oksidacinis alkenų skilimas
Oksidacinis alkenų skilimas apima jų sąveikos reakcijas su kalio permanganatu šarminėje arba sieros rūgštyje, taip pat oksidaciją chromo trioksido tirpalu acto rūgštyje arba kalio dichromatu ir sieros rūgštimi. Galutinis tokių virsmų rezultatas – dvigubos jungties vietoje anglies skeleto suskaidymas ir karboksirūgščių arba ketonų susidarymas.
Monopakeisti alkenai, turintys galinę dvigubą jungtį, suskaidomi į karboksirūgštį ir anglies dioksidą:

Jei abu anglies atomai dviguboje jungtyje turi tik vieną alkilo grupę, susidaro karboksirūgščių mišinys:

Bet jei alkenas, tetrapakeistas dviguba jungtimi, yra ketonas:

Alkenų ozonolizės reakcija įgavo daug didesnę preparatinę reikšmę. Daugelį dešimtmečių ši reakcija buvo pagrindinis būdas nustatyti pradinio alkeno struktūrą. Ši reakcija atliekama leidžiant ozono tirpalo deguonyje, alkeno tirpalo metileno chloride arba etilo acetate srovę -80 ... -100 ° C temperatūroje. Šios reakcijos mechanizmą nustatė Krige:


Ozonidai yra nestabilūs junginiai, kurie suyra sprogimo metu. Yra du ozonidų skaidymo būdai – oksidacinis ir redukcinis.
Hidrolizės metu ozonidai suskaidomi į karbonilo junginius ir vandenilio peroksidą. Vandenilio peroksidas oksiduoja aldehidus į karboksirūgštis – tai oksidacinis skilimas:

Daug svarbesnis yra redukcinis ozonidų skaidymas. Ozonolizės produktai yra aldehidai arba ketonai, priklausomai nuo pradinio alkeno struktūros:
Be pirmiau minėtų metodų, yra dar vienas metodas, kurį 1955 m. pasiūlė Lemieux:
Taikant Lemieux metodą, nėra daug laiko reikalaujančių mangano dioksido atskyrimo procedūrų, nes dioksidas ir manganatas vėl perjodatu oksiduojami iki permanganato jonų. Tai leidžia naudoti tik katalizinį kalio permanganato kiekį.