В органічній хімії можна зустріти вуглеводневі речовини з різною кількістю вуглецю в ланцюзі та C=C-зв'язком. Вони є гомологами та називаються алкенами. Через свою будову вони хімічно активніші, ніж алкани. Але які саме реакції характерні для них? Розглянемо їх поширення у природі, різні способи отримання та застосування.
Що собою представляють?
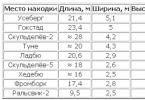
Алкени, які також називаються олефінами (маслянисті), отримали свою назву від етен-хлориду, похідного першого представника цієї групи. Всі алкени мають хоча б один подвійний C=C-зв'язок. C n H 2n - формула всіх олефінів, а назва утворюється від алкану з такою ж кількістю вуглецю в молекулі, тільки суфікс -ан змінюється на -ен. Арабською цифрою наприкінці назви через дефіс позначають номер вуглецю, від якого починається подвійний зв'язок. Розглянемо основні алкени, таблиця допоможе вам запам'ятати їх:
Якщо молекули мають просту нерозгалужену будову, додають суфікс -ілен, це також відображено в таблиці.
Де їх можна зустріти?
Оскільки реакційна здатність алкенів дуже висока, їх представники у природі зустрічаються дуже рідко. Принцип життя молекули олефінів - "Давай дружити". Немає навколо інших речовин — не біда, дружитимемо між собою, утворюючи полімери.
Але вони є, і невелика кількість представників входить до складу супутнього нафтового газу, а найвищих — до нафти, яка видобувається на території Канади.
Найперший представник алкенів етен - це гормон, що стимулює дозрівання плодів, тому його у невеликих кількостях синтезують представники флори. Є алкен цис-9-трикозен, який у самок домашньої мухи грає роль статевого атрактанта. Ще його називають мускалур. (Атрактант - речовини природного або синтетичного походження, що викликає потяг до джерела запаху в іншого організму). З погляду хімії, алкен цей виглядає так:
Так як дуже цінною сировиною є всі алкени, способи одержання їх штучним шляхом дуже різноманітні. Розглянемо найпоширеніші.
А якщо потрібно багато?
У промисловості клас алкенів, переважно, виходить при крекінгу, тобто. розщепленні молекули під впливом високих температур, вищих алканів. Для реакції необхідне нагрівання від 400 до 700 °C. Розщеплюється алкан так, як захочеться, утворюючи алкени, способи отримання яких ми розглядаємо, з великою кількістю варіантів будови молекул:
C 7 H 16 -> CH 3 -CH=CH 2 + C 4 H 10.
Ще один поширений спосіб називається дегідрування, при якому від представника ряду алкану у присутності каталізатора відокремлюють молекулу водню.
У лабораторних умовах алкени та способи одержання відрізняються, вони засновані на реакціях елімінування (відщеплення групи атомів без їх заміщення). Найчастіше елімінуються атоми води зі спиртів, галогени, водень чи галогенводень. Найбільш поширений спосіб отримання алкенів - зі спиртів у присутності кислоти як каталізатора. Можливе використання інших каталізаторів.
Усі реакції елімінування підпорядковані правилу Зайцева, який проголошує:
Атом водню відщеплюється від того вуглецю, що є сусідом з вуглецем, що несе групу -OH, у якого менше водень.

Застосувавши правило, дайте відповідь, який продукт реакції переважатиме? Пізніше ви дізнаєтесь, чи правильно відповіли.
Хімічні властивості
Алкени активно реагують з речовинами, розриваючи свій пі-зв'язок (ще одна назва зв'язку C=C). Адже вона не така міцна, як одинарна (сигма-зв'язок). Вуглеводень з ненасиченого перетворюється на насичений, не утворюючи інших речовин після реакції (приєднання).
- приєднання водню (гідрування). Присутність каталізатора та нагрівання потрібна для її проходження;
- приєднання молекул галогенів (галогенування). Є однією з якісних реакцій на пі-зв'язок. Адже при реакції алкенів з бромною водою вона з бурої стає прозорою;
- реакція з галогенводнями (гідрогалогенування);
- приєднання води (гідратація). Умовами проходження реакції є нагрівання та присутність каталізатора (кислоти);
Реакції несиметричних олефінів з галогенводнями та водою підпорядковуються правилу Марковникова. А отже, водень приєднається до того вуглецю з подвійного вуглець-вуглецевого зв'язку, у якого вже більше атомів водню.

- горіння;
- неповне окислення каталітичне. Продуктом є циклічні оксиди;
- реакція Вагнера (окислення перманганатом у нейтральному середовищі). Ця реакція алкенів - ще один якісний C = C-зв'язок. При перебігу рожевий розчин марганцівки знебарвлюється. Якщо ту ж реакцію провести у сполученому кислому середовищі, продукти будуть вже іншими (карбонові кислоти, кетони, вуглекислий газ);
- ізомеризація. Характерні всі види: цис-і транс-, переміщення подвійного зв'язку, циклізація, скелетна ізомеризація;
- полімеризація - основна властивість олефінів для промисловості.
Застосування у медицині
Велике практичне значення мають продукти реакції алкенів. Багато хто з них використовується в медицині. З пропену одержують гліцерин. Цей багатоатомний спирт є прекрасним розчинником, причому якщо його використовувати замість води, розчини будуть більш концентрованими. У медичних цілях у ньому розчиняють алкалоїди, тимол, йод, бром та ін. Також гліцерин застосовують при приготуванні мазей, паст та кремів. Він запобігає їх висиханню. Сам собою гліцерин є антисептиком.
При реакції з хлороводнем виходять похідні, які застосовують як місцева анестезія при нанесенні на шкіру, а також для короткочасного наркозу при незначних хірургічних втручаннях, за допомогою інгаляцій.

Алкадієни - це алкени з двома подвійними зв'язками в одній молекулі. Основне їх застосування - виробництво синтетичного каучуку, з якого потім виготовляють різні грілки та спринцівки, зонди та катетери, рукавички, соски та багато іншого, що просто незамінно при догляді за хворими.
Застосування у промисловості
| Вид промисловості | Що застосовують | Яким чином можуть використати |
| Сільське господарство | Етен | прискорює дозрівання овочів та фруктів, дефоліація рослин, плівки для теплиць |
| Лако-барвиста | етен, бутен, пропен та ін. | для отримання розчинників, ефірів, сольвенту |
| Машинобудування | 2-метилпропен, етен | виробництво синтетичного каучуку, мастила, антифриз |
| Харчова промисловість | Етен | виробництво тефлону, етилового спирту, оцтової кислоти |
| Хімічна промисловість | етен, поліпропілен | отримують спирти, полімери (полівінілхлорид, поліетилен, полівінілацетат, поліізотіл, оцтовий альдегід |
| Гірська промисловість | етен та ін. | вибухові речовини |
Найширше застосування знайшли алкени та його похідні у промисловості. (Де та як використовуються алкени, таблиця вище).

Це лише мала частина використання алкенів та їх похідних. З кожним роком потреба в олефінах тільки зростає, а отже, зростає потреба і в їхньому виробництві.
Тема урока:Алкени. Одержання, хімічні властивості та застосування алкенів.
Цілі та завдання уроку:
- розглянути конкретні хімічні властивості етилену та загальні властивості алкенів;
- поглибити та конкретизувати поняття про?-зв'язок, про механізми хімічних реакцій;
- дати початкові уявлення про реакції полімеризації та будову полімерів;
- розібрати лабораторні та загальні промислові способи одержання алкенів;
- продовжити формування вміння працювати з підручником.
Обладнання:прилад для отримання газів, розчин КМnO 4 , етиловий спирт, концентрована сірчана кислота, сірники, спиртування, пісок, таблиці «Будова молекула етилену», «Основні хімічні властивості алкенів», демонстраційні зразки «Полімери».
ХІД УРОКУ
I. Організаційний момент
Ми продовжуємо вивчення гомологічного ряду алкенів. Сьогодні ми маємо розглянути способи отримання, хімічні властивості та застосування алкенів. Ми повинні охарактеризувати хімічні властивості, зумовлені подвійним зв'язком, отримати початкові уявлення про реакції полімеризації, розглянути лабораторні та промислові способи одержання алкенів.
ІІ. Активізація знань учнів
- Які вуглеводні називають алкенами?
- Які особливості їхньої будови?
- У якому гібридному стані знаходяться атоми вуглецю, що утворюють подвійний зв'язок у молекулі алкену?
Підсумок: алкени відрізняються від алканів наявністю в молекулах одного подвійного зв'язку, що зумовлює особливості хімічних властивостей алкенів, способів їх отримання та застосування.
ІІІ. Вивчення нового матеріалу
1. Способи одержання алкенів
Скласти рівняння реакцій, що підтверджують способи одержання алкенів
– крекінг алканів C 8 H 18 ––> C 4 H 8 + C 4 H 10; (Термічний крекінг при 400-700 o С)
октан бутен бутан
- дегідрування алканів C 4 H 10 -> C 4 H 8 + H 2 ; (t, Ni)
бутан бутен водень
– дегідрогалогенування галогеналканів C 4 H 9 Cl + KOH ––> C 4 H 8 + KCl + H 2 O;
хлорбутан гідроксид бутен хлорид вода
калію калію
– дегідрогалогенування дигалогеналканів 
– дегідратація спиртів С 2 Н 5 ОН ––> С 2 Н 4 + Н 2 О (при нагріванні у присутності концентрованої сірчаної кислоти)
Запам'ятайте!
При реакціях дегідрування, дегідратації, дегідрогалогенування та дегалогенування слід пам'ятати, що водень переважно відривається від менш гідрогенізованих атомів вуглецю (правило Зайцева, 1875)
2. Хімічні властивості алкенів
Характер вуглець - вуглецевий зв'язок визначає тип хімічних реакцій, в які вступають органічні речовини. Наявність у молекулах етиленових вуглеводнів подвійний вуглець – вуглецевого зв'язку зумовлює такі особливості цих сполук:
– наявність подвійного зв'язку дозволяє віднести алкени до ненасичених сполук. Перетворення їх у насичені можливе лише внаслідок реакцій приєднання, що є основною рисою хімічної поведінки олефінів;
– подвійний зв'язок є значною концентрацією електронної щільності, тому реакції приєднання носять електрофільний характер;
- подвійний зв'язок складається з одного - і одного зв'язку, який досить легко поляризується.
Рівняння реакцій, що характеризують хімічні властивості алкенів
а) Реакції приєднання
Запам'ятайте! Реакції заміщення властиві алканам і вищим циклоалканам, які мають лише одинарні зв'язки, реакції приєднання – алкенам, дієнам та алкінам, що мають подвійні та потрійні зв'язки.

Запам'ятай! Можливі наступні механізми розриву зв'язку:
а) якщо алкени та реагент – неполярні сполуки, то зв'язок розривається з утворенням вільного радикала:
H 2 C = CH 2 + H: H - -> + +
б) якщо алкен і реагент – полярні сполуки, то розрив зв'язку призводить до утворення іонів:
в) при з'єднанні за місцем розриву зв'язку реагентів, що містять у складі молекули атоми водню, водень завжди приєднується до більш гідрованого атома вуглецю (правило Морковникова, 1869).
– реакція полімеризації nCH 2 = CH 2 ––> n – CH 2 – CH 2 –– > (– CH 2 – CH 2 –)n
етен поліетилен
б) реакція окиснення
Лабораторний досвід.Отримати етилен та вивчити його властивості (інструкція на столах учнів)
Інструкція з отримання етилену та дослідів з ним
1. Помістіть у пробірку 2 мл концентрованої сірчаної кислоти, 1 мл спирту та невелику кількість піску.
2. Закрийте пробкою з газовідвідною трубкою і нагрійте в полум'ї спиртування.
3. Газ, що виділяється, пропустіть через розчин з перманганатом калію. Зверніть увагу на зміну кольору розчину.
4. Підпаліть газ у кінці газовідвідної трубки. Зверніть увагу на колір полум'я.
- Алкени горять полум'ям, що світиться. (Чому?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (при повному окисленні продуктами реакції є вуглекислий газ та вода)
Якісна реакція: «м'яке окиснення (у водному розчині)»
- Алкени знебарвлюють розчин перманганату калію (реакція Вагнера)
За більш жорстких умов у кислому середовищі продуктами реакції можуть бути карбонові кислоти, наприклад (у присутності кислот):
CH 3 - CH = CH 2 + 4 [O] - -> CH 3 COOH + HCOOH
- Каталічне окислення
Запам'ятайте головне!
1. Ненасичені вуглеводні активно вступають у реакції приєднання.
2. Реакційна активність алкенів пов'язана з тим, що зв'язок під дією реагентів легко розривається.
3. В результаті приєднання відбувається перехід атомів вуглецю з sp 2 - sp 3 - гібридний стан. Продукт реакції має граничний характер.
4. При нагріванні етилену, пропілену та інших алкенів під тиск або у присутності каталізатора їх окремі молекули з'єднуються у довгі ланцюжки – полімери. Полімери (поліетилен, поліпропілен) мають велике практичне значення.
3. Застосування алкенів(повідомлення учня за наступним планом).
1 – отримання пального з високим октановим числом;
2 – пластмас;
3 – вибухових речовин;
4 – антифризів;
5 – розчинників;
6 – для прискорення дозрівання плодів;
7 – одержання ацетальдегіду;
8 – синтетичного каучуку.
ІІІ. Закріплення вивченого матеріалу

Домашнє завдання:§§ 15, 16, упр. 1, 2, 3 стор. 90, упр. 4, 5 стор. 95.
Алкіни, галогенопохідні, спирти, полімери та інші. Головна проблема ненасичених вуглеводнів - майже повна відсутність їх у природі, здебільшого речовини саме цього ряду видобувають у лабораторії шляхом хімічного синтезу. Щоб зрозуміти особливості реакцій отримання алкенів, треба розібратися у тому будову.
Що таке алкени?
Алкени - органічні речовини, які складаються з атомів вуглецю та водню. Особливістю цього ряду є подвійні ковалентні зв'язки: сигма та пі. Вони зумовлюють хімічні та фізичні властивості речовин. Температура плавлення у них нижча, ніж у відповідних алканів. Також від цього "базового" ряду вуглеводнів алкени відрізняються наявністю реакції приєднання, яка відбувається шляхом розриву пі-зв'язку. Для них характерні чотири види ізомерії:
- за становищем подвійного зв'язку;
- щодо змін вуглецевого скелета;
- міжкласова (з циклоалканами);
- геометрична (цис-і транс-).
Інша назва цього ряду речовин – олефіни. Це зумовлено їх схожістю з багатоатомними карбоновими кислотами, які у своєму складі мають подвійний зв'язок. Номенклатура алкенів відрізняється тим, що визначення першого атома в карбоновому ланцюзі ведеться розміщення кратного зв'язку, положення якої також вказується в назві речовини.
Крекінг – основний спосіб добування алкенів
Крекінг – вид переробки нафти за високих температурних режимів. Головна мета цього процесу – добування речовин із меншою молекулярною масою. Крекінг для одержання алкенів відбувається під час розщеплення алканів, що входять до складу нафтопродуктів. Це відбувається за температур від 400 до 700 °С. У ході цієї реакції отримання алкенів, крім речовини, яка була метою її проведення, утворюється алкан. Загальна кількість атомів вуглецю до та після реакції - однакова.

Інші промислові способи одержання алкенів
Не можна продовжувати розмову про алкени без згадки про реакцію дегідрування. Для проведення береться алкан, у якому може утворитися подвійний зв'язок після відщеплення двох атомів водню. Тобто метан у цю реакцію не вступатиме. Тому ряд алкенів починається з етилену. Особливими умовами для проведення реакції є підвищена температура та каталізатор. У ролі останнього може бути нікель або оксид хрому (III). Результатом реакції буде одержання алкену з відповідною кількістю атомів вуглецю та безбарвного газу (водню).
Іншим промисловим способом добування речовин цього ряду є гідрування алкінів. Ця реакція одержання алкенів проходить за підвищених температур і за участю каталізатора (нікелю або платини). Механізм гідрування будується на розриванні одного з двох пі зв'язків наданого алкіну, після чого по місцях руйнування приєднуються атоми водню.

Лабораторний спосіб з використанням спирту
Одним із найпростіших і не витратних способів є внутрішньомолекулярна дегідратація, тобто відщеплення води. При написанні рівняння реакції варто пам'ятати, що вона здійснюватиметься за правилом Зайцева: водень відщепиться від найменш гідрованого атома вуглецю. Температура при цьому повинна бути вищою за 150 °С. Як каталізатор потрібно використовувати речовини з гігроскопічними властивостями (здатними натягувати вологу), наприклад, сірчану кислоту. За місцем відриву гідроксильної групи та водню утворюватиметься подвійний зв'язок. Результатом реакції будуть відповідний алкен та одна молекула води.

Видобування в лабораторії на основі галогенопохідних
Існує ще два лабораторні способи. Перший – дія розчином лугу на похідні алканів, які у своєму складі мають один атом галогену. Такий спосіб називають дегідрогалогенуванням, тобто відщепленням сполук водню з неметалевими елементами сьомої групи (фтор, бром, хлор, йод). Здійснення механізму реакції, як і й у попередньому разі, проходить за правилом Зайцева. Каталізуючими умовами є спиртовий розчин та підвищена температура. Після проведення реакції утворюються алкен, сіль металевого елемента лугу та галогену, вода.
Другий спосіб дуже нагадує попередній. Він здійснюється за допомогою алкану, який має у складі два галогени. На таку речовину діють активним металом (цинком або магнієм) у присутності розчину спирту та підвищеної температури. Реакція буде проходити тільки в тому випадку, якщо водень заміщений на галоген у двох сусідніх атомів вуглецю, якщо умова не дотримано, подвійний зв'язок не утворюється.
Чому потрібно брати саме цинк та магній? В ході реакції відбувається окислення металу, який може віддати два електрони, і відщеплення двох галогенів. Якщо взяти лужні елементи, вони реагуватимуть із водою, яка є у складі розчину спирту. Що ж до металів, які у ряду Бекетова стоять після магнію і цинку, всі вони будуть занадто слабкими.
Алкени- Ненасичені вуглеводні, у складі яких є один подвійний зв'язок. Приклади алкенів:

Методи одержання алкенів.
1. Крекінг алканів за 400-700°С. Реакція йде за вільнорадикальним механізмом:

2. Дегідрування алканів:
3. Реакція елімінування (відщеплення): від сусідніх атомів вуглецю відщеплюються 2 атоми або 2 групи атомів, і утворюється подвійний зв'язок. До таких реакцій відносять:
А) Дегідратацію спиртів (нагрів понад 150°С, за участю сірчаної кислоти, як водовіднімального реагенту):
Б) Відщеплення галогенводнів при дії спиртового розчину лугу:

Атом водню відщеплюється переважно від атома вуглецю, який пов'язаний з меншим числом атомів водню (найменш гідрогенізованого атома) - правило Зайцева.
В) Дегалогенування:

Хімічні властивості алкенів.
Властивості алкенів обумовлюються наявністю кратного зв'язку, тому алкени вступають у реакції електрофільного приєднання, яке протікає у кілька стадій (Н-Х – реагент):
1-ша стадія:

2-я стадія:
 .
.
Іон водню в таких реакціях належить тому атому вуглецю, який має більш негативний заряд. Розподіл щільності такий:

Якщо заступником стоїть донор, який проявляється +I- ефект, то електронна щільність зміщується убік найбільш гидрогенизированного атома вуглецю, створюючи у ньому частково негативний заряд. Реакції йдуть по правилу Марковникова: при приєднанні полярних молекул типу НХ (HCl, HCN, HOHі т.д.) до несиметричних алкенів водень приєднується переважно до більш гідрогенізованого атома вуглецю при подвійному зв'язку.
А) Реакції приєднання:
1) Гідрогалогенування:
Реакція йде за правилом Марковнікова. Але якщо в реакції присутній пероксид, то правило не враховується:
2) Гідратація. Реакція йде за правилом Марковникова в присутність фосфорної або сірчаної кислоти:

3) Галогенування. В результаті відбувається знебарвлення бромної води - це якісна реакція на кратний зв'язок:
4) Гідрування. Реакція протікає у присутність каталізаторів.
ВИЗНАЧЕННЯ
Алкенаміназиваються ненасичені вуглеводні, молекули яких містять один подвійний зв'язок. Будова молекули алкенів з прикладу етилену наведено на рис. 1.
Мал. 1. Будова молекули етилену.
За фізичними властивостями алкени мало відрізняються від алканів з тим самим числом атомів вуглецю в молекулі. Нижчі гомологи З 2 - З 4 за нормальних умов - гази; З 5 - З 17 - рідини; вищі гомологи – тверді речовини. Алкени нерозчинні у воді. Добре розчинні в органічних розчинниках.
Отримання алкенів
У промисловості алкени отримують при переробці нафти: крекінгу та дегідрування алканів. Лабораторні способи одержання алкенів ми розділили на дві групи:
- Реакції елімінування (відщеплення)
- Дегідратація спиртів
CH 3 -CH 2 -OH → CH 2 = CH 2 + H 2 O (H 2 SO 4 (conc), t 0 = 170).
- Дегідрогалогенування моногалогеналканів
CH 3 -CH(Br)-CH 2 -CH 3 + NaOH alcohol → CH 3 -CH=CH-CH 3 + NaBr + H 2 O (t 0).
- Дегалогенуваннядигалогеналканів
CH 3 -CH(Cl)-CH(Cl)-CH 2 -CH 3 + Zn(Mg) → CH 3 -CH=CH-CH 2 -CH 3 + ZnCl 2 (MgCl 2).
- Неповне гідрування алкінів
CH≡CH + H 2 →CH 2 =CH 2 (Pd, t 0).
Хімічні властивості алкенів
Алкени - дуже реакційноздатні органічні сполуки. Це їх будовою. Хімія алкенів – це хімія подвійного зв'язку. Типові реакції для алкенів – реакції електрофільного приєднання.
Хімічні перетворення алкенів протікають із розщепленням:
1) π-зв'язку С-С (приєднання, полімеризація та окислення)
- гідрування
CH 3 -CH = CH 2 + H 2 → CH 3 -CH 2 -CH 2 (kat = Pt).
- Галогенування
CH 3 -CH 2 -CH=CH 2 + Br 2 → CH 3 -CH 2 -CH(Br)-CH 2 Br.
- гідрогалогенування (протікає за правилом Марковникова: атом водню приєднується переважно до більш гідрованого атома вуглецю)
CH 3 -CH = CH 2 + H-Cl → CH 3 -CH(Cl)-CH 3 .
- гідратація
CH 2 = CH 2 + H-OH → CH 3 -CH 2 -OH (H +, t 0).
- полімеризація
nCH 2 =CH 2 → -[-CH 2 -CH 2 -] - n (kat, t 0).
- Окислення
CH 2 =CH 2 + 2KMnO 4 + 2KOH → HO-CH 2 -CH 2 -OH + 2K 2 MnO 4 ;
2CH 2 =CH 2 + O 2 → 2C 2 OH 4 (епоксид) (kat = Ag,t 0);
2CH 2 =CH 2 + O 2 → 2CH 3 -C(O)H (kat = PdCl 2 CuCl).
2) σ- та π-зв'язків С-С
CH 3 -CH=CH-CH 2 -CH 3 + 4[O] → CH 3 COOH + CH 3 CH 2 COOH (KMnO 4 H +, t 0).
3) зв'язків З sp 3 -Н (в алільному положенні)
CH 2 = CH 2 + Cl 2 → CH 2 = CH-Cl + HCl (t 0 = 400).
4) Розрив всіх зв'язків
C 2 H 4 + 2O 2 → 2CO 2 + 2H 2 O;
C n H 2n + 3n/2 O 2 → nCO 2 + nH 2 O.
Застосування алкенів
Алкени знайшли застосування у різних галузях народного господарства. Розглянемо з прикладу окремих представників.
Етилен широко використовується в промисловому органічному синтезі для одержання різноманітних органічних сполук, таких як галогеновиробні, спирти (етанол, етиленгліколь), оцтовий альдегід, оцтова кислота та ін. У великій кількості етилен витрачається для виробництва полімерів.
Пропілен використовується як сировина для отримання деяких спиртів (наприклад, пропанолу-2, гліцерину), ацетону та ін Полімеризацією пропілену отримують поліпропілен.
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | При гідроліз водним розчином гідроксиду натрію NaOH дихлориду, отриманого приєднанням 6,72 л хлору до етиленового вуглеводню, утворилося 22,8 г двоатомного спирту. Якою є формула алкену, якщо відомо, що реакції протікають з кількісними виходами (без втрат)? |
| Рішення | Запишемо рівняння хлорування алкену у загальному вигляді, а також реакцію одержання двоатомного спирту: C n H 2 n + Cl 2 = C n H 2 n Cl 2 (1); C n H 2 n Cl 2 + 2NaOH = C n H 2 n (OH) 2 + 2HCl (2). Розрахуємо кількість речовини хлору: n(Cl 2) = V(Cl 2) / V m; n(Cl 2) = 6,72 / 22,4 = 0,3 моль, отже, дихлориду етилену теж буде 0,3 моль (рівняння 1), двоатомного спирту також має вийти 0,3 моль, а за умовою завдання це 22,8 г. Значить молярна маса його дорівнюватиме: M(CnH2n(OH)2) = m(CnH2n(OH)2)/n(CnH2n(OH)2); M(C n H 2 n (OH) 2) = 22,8/0,3 = 76 г/моль. Знайдемо молярну масу алкену: M(C n H 2 n) = 76 - (2×17) = 42 г/моль, що відповідає формулі C 3 H 6 . |
| Відповідь | Формула алкенуC 3 H 6 |
ПРИКЛАД 2
| Завдання | Скільки грамів потрібно для бромування 16,8 г алкену, якщо відомо, що при каталітичному гідруванні такої кількості алкену приєдналося 6,72 л водню? Який склад та можлива будова вихідного вуглеводню? |
| Рішення | Запишемо у загальному вигляді рівняння бромування та гідрування алкену: C n H 2 n + Br 2 = C n H 2 n Br 2 (1); C n H 2 n + H 2 = C n H 2 n +2 (2). Розрахуємо кількість речовини водню: n(H 2) = V(H 2) / V m; n(H 2) = 6,72 / 22,4 = 0,3 моль, отже, алкена теж буде 0,3 моль (рівняння 2), а за умовою завдання це 16,8 г. Значить молярна маса його дорівнюватиме: M(C n H 2n) = m(C n H 2n) / n(C n H 2n); M(C n H 2 n) = 16,8 / 0,3 = 56 г/моль, що відповідає формулі C 4 H 8 . Відповідно до рівняння (1) n(C n H 2 n) :n(Br 2) = 1:1, тобто. n(Br 2) = n(C n H 2 n) = 0,3 моль. Знайдемо масу брому: m(Br 2) = n(Br 2) × M(Br 2); M(Br 2) = 2×Ar(Br) = 2×80 = 160 г/моль; m(MnO 2) = 0,3 × 160 = 48 р. Складемо структурні формули ізомерів: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4). CH 2 =CH-CH 2 -CH 3 (1); CH 3 -CH=CH-CH 3 (2); CH 2 =C(CH 3)-CH 3 (3); |
| Відповідь | Маса брому дорівнює 48 г |