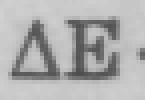Триоксид серы, как правило, имеет вид бесцветной жидкости. Он также может существовать в виде льда, волокнистых кристаллов или газа. Когда триоксид серы подвергается воздействию воздуха, начинает выделяться белый дым. Он является составным элементом такого химически активного вещества, как концентрированная серная кислота. Это прозрачная, бесцветная, маслянистая и весьма агрессивная жидкость. Она используется в производстве удобрений, взрывчатых веществ, других кислот, в нефтяной промышленности, в свинцово-кислотных аккумуляторных батареях в автомобилях.
Концентрированная серная кислота: свойства
Серная кислота хорошо растворяется в воде, обладает коррозионным воздействием на металлы и ткани, при контакте обугливает древесину и большинство других органических веществ. В результате длительного воздействия низкой концентрации вещества или краткосрочном воздействии высокой могут иметь место неблагоприятные последствия для здоровья от вдыхания.

Концентрированная серная кислота используется для изготовления удобрений и других химикатов, в переработке нефти, в производстве чугуна и стали и для многих других целей. Поскольку она имеет достаточно высокую температуру кипения, она может быть использована для выпуска более летучих кислот из их солей. Концентрированная серная кислота обладает сильным гигроскопичным свойством. Ее иногда используют в качестве сушильного агента для дегидратации (удаления воды химическим методом) многих соединений, например, углеводов.

Реакции серной кислоты
Концентрированная серная кислота необычным образом реагирует на сахар, оставляя за собой ломкую губчатую черную массу из углерода. Подобная реакция наблюдается при воздействии на кожу, целлюлозу и другие растительные и животные волокна. Когда концентрированная кислота смешивается с водой, выделяется большое количество тепла, достаточное для мгновенного кипячения. Для разбавления ее следует добавлять медленно в холодную воду при постоянном помешивании, чтобы ограничить накопление тепла. Серная кислота реагирует с жидкостью, образуя гидраты с резко выраженными свойствами.

Физические характеристики
Жидкость без цвета и запаха в разбавленном растворе имеет кислый вкус. Серная кислота является экстремально агрессивной при воздействии на кожу и все ткани организма, при непосредственном контакте вызывает сильные ожоги. В чистом виде H 2 SO4 не является проводником электричества, однако ситуация меняется в противоположную сторону с добавлением воды.

Некоторые свойства заключается в том, что молекулярная масса составляет 98.08. Температура кипения составляет 327 градусов Цельсия, плавления -2 градуса Цельсия. Серная кислота является сильной минеральной кислотой и одним из главных продуктов химической промышленности ввиду ее широкого коммерческого применения. Она образуется естественным образом в результате окисления сульфидных материалов, таких как сульфид железа.

Химические свойства серной кислоты (H 2 SO4) проявляются в различных химических реакциях :
- При взаимодействии со щелочами образуются два ряда солей, в том числе сульфаты.
- Реагирует с карбонатами и гидрокарбонатами с образованием солей и углекислого газа (СО 2).
- На металлы она воздействует по-разному, в зависимости от температуры и степени разбавления. Холодная и разбавленная дает выход водороду, горячая и концентрированная дает выбросы SO 2 .
- На триоксид серы (SO 3) и воду (Н 2 О) разлагается при кипячении раствор H 2 SO4 (концентрированная серная кислота). Химические свойства включают также роль сильного окислителя.

Пожарная опасность
Серная кислота обладает высокой реакционной способностью к воспламенению мелкодисперсных горючих материалов при контакте. При нагревании начинают выделяться высокотоксичные газы. Она является взрывоопасной и несовместимой с огромным количеством веществ. При повышенных температурах и давлении могут происходить достаточно агрессивные химические изменения и деформации. Может бурно реагировать с водой и другими жидкостями, приводя к разбрызгиванию.

Опасность для здоровья
Серная кислота разъедает все ткани организма. Вдыхание паров может привести к серьезным повреждениям легких. Поражение слизистой глаз может привести к полной потере зрения. Контакт с кожей может вызывать тяжелые некрозы. Даже несколько капель могут быть фатальными, если кислота получает доступ к трахее. Хроническое воздействие может вызвать трахеобронхит, стоматит, конъюнктивит, гастрит. Могут возникнуть перфорации желудка и перитонит, сопровождаемые циркуляторным коллапсом. Серная кислота является очень едким веществом, с которым следует обращаться с особой осторожностью. Признаки и симптомы при воздействии могут быть тяжелыми и включают слюнотечение, сильную жажду, затруднение глотания, боль, шок и ожоги. Рвотные массы, как правило, имеют цвет молотого кофе. Острое ингаляционное воздействие может привести к чиханию, осиплости голоса, удушью, ларингиту, одышке, раздражению дыхательных путей и боли в груди. Кровотечения из носа и десен, отек легких, хронический бронхит и пневмония также могут возникнуть. Воздействие на кожу может привести к серьезным болевым ожогам и дерматиту.

Первая помощь
- Поместить пострадавших на свежий воздух. Сотрудники экстренных служб должны избегать при этом воздействия серной кислоты.
- Оценить жизненные показатели, включая пульс и частоту дыхания. Если пульс не обнаруживается, провести реанимационные мероприятия в зависимости от полученных дополнительных травм. Если дыхание есть и затруднено, обеспечить респираторную поддержку.
- Снять запачканную одежду как можно скорее.
- В случае попадания в глаза промывать теплой водой по крайней мере 15 минут, на кожу - промыть водой с мылом.
- При вдыхании ядовитых паров нужно прополоскать рот большим количеством воды, пить и самостоятельно вызывать рвоту запрещается.
- Доставить пострадавших в лечебное учреждение.
Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см 3 и содержит около 95 % H 2 SO 4 . Затвердевает она лишь ниже -20 °С.
Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С). Незначительная собственная электролитическая диссоциация моногидрата протекает параллельно по двум направлениям: [Н 3 SO 4 + ]·[НSO 4 - ] = 2·10 -4 и [Н 3 О + ]·[НS 2 О 7 - ] = 4·10 -5 . Его молекулярно-ионный состав может быть приближенно охарактеризован следующими данными (в %):
|
При добавлении даже малых количеств воды преобладающей становится диссоциация по схеме:
Н 2 О + Н 2 SО 4 <==> Н 3 О+ + НSO 4 -
Химические свойства.
H 2 SO 4 - сильная двухосновная кислота.
H 2 SO 4 <--> H + + HSO 4 - <--> 2H + + SO 4 2-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K 2 = ( · ) / = 1,2 · 10 -2
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + H 2 +1 SO 4 (разб) --> Zn +2 SO 4 + H 2 O
b) концентрированная H 2 +6 SO 4 - сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S +4 O 2 , S 0 или H 2 S -2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag 0 + 2H 2 +6 SO 4 --> Ag 2 +1 SO 4 + S +4 O 2 + 2H 2 O
8Na 0 + 5H 2 +6 SO 4 --> 4Na 2 +1 SO 4 + H 2 S -2 + 4H 2 O
2) концентрированная H 2 S +6 O 4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S +4 O 2):
С 0 + 2H 2 S +6 O 4 (конц) --> C +4 O 2 + 2S +4 O 2 + 2H 2 O
S 0 + 2H 2 S +6 O 4 (конц) --> 3S +4 O 2 + 2H 2 O
2P 0 + 5H 2 S +6 O 4 (конц) --> 5S +4 O 2 + 2H 3 P +5 O 4 + 2H 2 O
3) с основными оксидами:
CuO + H 2 SO 4 --> CuSO4 + H2O
CuO + 2H + --> Cu 2+ + H 2 O
4) с гидроксидами:
H 2 SO 4 + 2NaOH --> Na 2 SO 4 + 2H 2 O
H + + OH - --> H 2 O
H 2 SO 4 + Cu(OH) 2 --> CuSO 4 + 2H 2 O
2H + + Cu(OH) 2 --> Cu 2+ + 2H 2 O
5) обменные реакции с солями:
BaCl 2 + H 2 SO 4 --> BaSO 4 + 2HCl
Ba 2+ + SO 4 2- --> BaSO 4
Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Моногидрат (чистая, 100%-ая серная кислота) является ионизирующим растворителем, имеющим кислотный характер. В нём хорошо растворяются сульфаты многих металлов (переходя при этом в бисульфаты), тогда как соли других кислот растворяются, как правило, лишь при возможности их сольволиза (с переводом в бисульфаты). Азотная кислота ведет себя в моногидрате как слабое основание
HNO 3 + 2 H 2 SO 4 <==> H 3 O + + NO 2 + + 2 HSO 4 -
хлорная - как очень слабая кислота
H 2 SO 4 + HClO 4 = H 3 SO 4 + + ClO 4 -
Фторсульфоновая и хлорсульфоновая оказываются кислотами несколько более сильными (HSO 3 F > HSO 3 Cl > HClO 4). Моногидрат хорошо растворяет многие органические вещества, имеющие в своём составе атомы с неподелёнными электронными парами (способными к присоединению протона). Некоторые из них могут быть затем выделены обратно в неизменённом состоянии путем простого разбавления раствора водой. Моногидрат обладает высоким значением криоскопической константы (6,12°) и им иногда пользуются как средой для определения молекулярных весов.
Концентрированная H 2 SO 4 является довольно сильным окислителем, особенно при нагревании (восстанавливается обычно до SO 2). Например, она окисляет HI и частично HВr (но не HСl) до свободных галогенов. Окисляются ею и многие металлы - Cu, Hg и др. (тогда как золото и платина по отношению к H 2 SO 4 устойчивы). Так взаимодействие с медью идёт по уравнению:
Cu + 2 H 2 SO 4 = CuSO 4 + SO 2 + H 2 O
Действуя в качестве окислителя, серная кислота обычно восстанавливается до SO 2 . Однако наиболее сильными восстановителями она может быть восстановлена до S и даже H 2 S. С сероводородом концентрированная серная кислота реагирует по уравнению:
H 2 SO 4 + H 2 S = 2H 2 O + SO 2 + S
Следует отметить, что она частично восстанавливается также газообразным водородом и поэтому не может применяться для его осушки.

Рис. 13. Электропроводность растворов серной кислоты.
Растворение концентрированной серной кислоты в воде сопровождается значительным выделением тепла (и некоторым уменьшением общего объёма системы). Моногидрат почти не проводит электрического тока. Напротив, водные растворы серной кислоты являются хорошими проводниками. Как видно на рис. 13, максимальной электропроводностью обладает приблизительно 30 %-ная кислота. Минимум кривой соответствует гидрату состава H 2 SO 4 ·H 2 O.
Выделение тепла при растворении моногидрата в воде составляет (в зависимости от конечной концентрации раствора) до 84 кДж/моль H 2 SO 4 . Напротив, смешиванием 66 %-ной серной кислоты, предварительно охлажденной до 0 °С, со снегом (1:1 по массе) может быть достигнуто понижение температуры, до -37 °С.
Изменение плотности водных растворов H 2 SO 4 с её концентрацией (вес. %) дано ниже:
|
|
Как видно из этих данных, определение по плотности концентрации серной кислоты выше 90 вес. % становится весьма неточным.
Давление водяного пара над растворами H 2 SO 4 различной концентрации при разных температурах показано на рис. 15. В качестве осушителя серная кислота может действовать лишь до тех пор, пока давление водяного пара над её раствором меньше, чем его парциальное давление в осушаемом газе.

Рис. 15. Давление водяного пара.

Рис. 16. Температуры кипения над растворами H 2 SO 4 . растворов H 2 SO 4 .
При кипячении разбавленного раствора серной кислоты из него отгоняется вода, причём температура кипения повышается вплоть до 337 °С, когда начинает перегоняться 98,3 % H 2 SO 4 (рис. 16). Напротив, из более концентрированных растворов улетучивается избыток серного ангидрида. Пар кипящей при 337 °С серной кислоты частично диссоциирован на H 2 O и SO 3 , которые вновь соединяются при охлаждении. Высокая температура кипения серной кислоты позволяет использовать её для выделения при нагревании легколетучих кислот из их солей (например, HCl из NaCl).
Получение.
Моногидрат может быть получен кристаллизацией концентрированной серной кислоты при -10 °С.
Производство серной кислоты.
1-я стадия. Печь для обжига колчедана.
4FeS 2 + 11O 2 --> 2Fe 2 O 3 + 8SO 2 + Q
Процесс гетерогенный:
1) измельчение железного колчедана (пирита)
2) метод "кипящего слоя"
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С - 500°С; катализатор V 2 O 5):
2SO 2 + O 2 <--> 2SO 3
3-я стадия. Поглотительная башня:
nSO 3 + H 2 SO 4 (конц) --> (H 2 SO 4 · nSO 3)(олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Применение.
Помните! Серную кислоту нужно вливать малыми порциями в воду, а не на оборот. Иначе может произойти бурная химическая реакция, в результате которой человек может получить сильные ожоги.

Серная кислота - один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат, сульфат аммония), различных кислот и солей, лекарственных и моющих средств, красителей, искусственных волокон, взрывчатых веществ. Применяется в металлургии (разложение руд, напр. урановых), для очистки нефтепродуктов, как осушитель и др.
Практически важно то обстоятельство, что очень крепкая (выше 75 %) серная кислота не действует на железо. Это позволяет хранить и перевозить её в стальных цистернах. Напротив, разбавленная H 2 SO 4 легко растворяет железо с выделением водорода. Окислительные свойства для неё вовсе не характерны.
Крепкая серная кислота энергично поглощает влагу и поэтому часто применяется для осушки газов. От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду, что нередко используется в технике. С этим же (а также с окислительными свойствами крепкой H 2 SO 4) связано её разрушающее действие на растительные и животные ткани. Случайно попавшую при работе на кожу или платье серную кислоту следует тотчас же смыть большим количеством воды, затем смочить пострадавшее место разбавленным раствором аммиака и вновь промыть водой.
Молекулы чистой серной кислоты.

Рис.1. Схема водородных связей в кристалле H 2 SO 4 .
Молекулы, образующие кристалл моногидрата, (НО) 2 SO 2 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 1. Сама молекула (НО) 2 SO 2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d(S-ОН) = 154 пм, РНО-S-ОН = 104°, d(S=O) = 143 пм, РOSO = 119°. В ионе HOSO 3 - , d(S-ОН) = 161 и d(SO) = 145 пм, а при переходе к иону SO 4 2- тетраэдр приобретает правильную форму и параметры выравниваются .
Кристаллогидраты серной кислоты.
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 14. Из них наиболее бедный водой представляет собой соль оксония: H 3 O + HSO 4 - . Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.

Рис. 14. Температуры плавления в системе H 2 O·H 2 SO 4 .
Кислоты с металлом является специфичной для данных классов соединений. В ее ходе протон водорода восстанавливается и в связке с кислотным анионом заменяется на катион металла. Это пример реакции с образованием соли, хотя существует и несколько типов взаимодействий, не подчиняющихся данному принципу. Они протекают как окислительно-восстановительные и не сопровождаются выделением водорода.
Принципы реакций кислот с металлами
Все реакции с металлом приводят к образованию солей. Исключением является, пожалуй, лишь реакция благородного металла с царской водкой, смесью соляной и Любое другое взаимодействие кислот с металлами приводит к образованию соли. В случае если кислота не является ни серной концентрированной, ни азотной, то в качестве продукта выщепляется молекулярный водород.
Но когда в реакцию вступает концентрированная серная кислота, взаимодействие с металлами протекает по принципу окислительно-восстановительного процесса. Потому экспериментально было выделено два типа взаимодействий типичных металлов и крепких неорганических кислот:
- взаимодействие металлов с разбавленными кислотами;
- взаимодействие с концентрированной кислотой.
Реакции по первому типу протекают с любой кислотой. Исключением является лишь концентрированная и азотная кислота любой концентрации. Они реагируют по второму типу и приводят к образованию солей и продуктов восстановления серы и азота.
Типичные взаимодействие кислот с металлами
Металлы, расположенные левее водорода в стандартном электрохимическом ряду, реагируют с и другими кислотами различной концентрации за исключением азотной с образованием соли и выделением молекулярного водорода. Металлы, расположенные правее водорода в ряду электроотрицательности, не могут реагировать с указанными выше кислотами и взаимодействуют лишь с азотной кислотой независимо от ее концентрации, с концентрированной серной кислотой и с царской водкой. Это типичное взаимодействие кислот с металлами.
Реакции металлов с концентрированной серной кислотой
Реакции с разбавленной азотной кислотой
Разбавленная азотная кислота реагирует с металлами, расположенными левее и правее водорода. В ходе реакции с активными металлами образуется аммиак, который сразу же растворяется и взаимодействует с нитрат-анионом, образуя еще одну соль. С металлами средней активности кислота реагирует с выделением молекулярного азота. С малоактивными реакция протекает с выделением оксида 2-валентного азота. Чаще всего образуется несколько продуктов восстановления серы в одной реакции. Примеры реакций предложены в графическом приложении ниже.

Реакции с концентрированной азотной кислотой
В данном случае окислителем также выступает азот. Все реакции заканчиваются образованием соли и выделением Схемы протекания окислительно-восстановительных реакций предложены на графическом приложении. При этом отдельного внимания заслуживает реакция с малоактивными элементами. Такое взаимодействие кислот с металлами неспецифично.

Реакционная способность металлов
Металлы вступают в реакции с кислотами достаточно охотно, хотя есть несколько инертных веществ. Это и элементы, имеющие высокий стандартный электрохимический потенциал. Существует ряд металлов, который построен на основании данного показателя. Он называется рядом электроотрицательности. Если металл стоит в нем левее водорода, то он способен вступать в реакцию с разбавленной кислотой.
Существует лишь одно исключение: железо и алюминий за счет образования на их поверхности 3-валентных оксидов не могут реагировать с кислотой без нагревания. Если смесь подогревается, то изначально в реакцию вступает оксидная пленка металла, а затем он сам растворяется в кислоте. Металлы, расположенные правее водорода в электрохимическом ряду активности, не могут реагировать с неорганической кислотой, в том числе и с разбавленной серной. Исключений из правил два: эти металлы растворяются в концентрированной и разбавленной азотной кислоте и царской водке. В последней не могут быть растворены только родий, рутений, иридий и осмий.
Любая кислота представляет собой сложное вещество, молекула которого содержит один или несколько атомов водорода и кислотный остаток.
Формула серной кислоты - H2SO4. Следовательно, в состав молекулы серной кислоты входят два атома водорода и кислотный остаток SO4.
Образуется серная кислота при взаимодействии оксида серы с водой
SO3+H2O -> H2SO4
Чистая 100%-я серная кислота (моногидрат) - тяжёлая жидкость, вязкая как масло, без цвета и запаха, с кислым «медным» вкусом. Уже при температуре +10 °С она застывает и превращается в кристаллическую массу.
Концентрированная серная кислота содержит приблизительно 95% H2 SO4. И застывает она при температуре ниже –20°С.
Взаимодействие с водой

Серная кислота хорошо растворяется в воде, смешиваясь с ней в любых соотношениях. При этом выделяется большое количество тепла.
Серная кислота способна поглощать пары воды из воздуха. Это её свойство используют в промышленности для осушения газов. Осушают газы, пропуская их через специальные ёмкости с серной кислотой. Конечно же, этот способ можно применять только для тех газов, которые не вступают в реакцию с ней.
Известно, что при попадании серной кислоты на многие органические вещества, особенно углеводы, эти вещества обугливаются. Дело в том, что углеводы, как и вода, содержат и водород, и кислород. Серная кислота отнимает у них эти элементы. Остаётся уголь.
В водном растворе H2SO4 индикаторы лакмус и метиловый оранжевый окрашиваются в красный цвет, что говорит о том, что этот раствор имеет кислый вкус.
Взаимодействие с металлами
Как и любая другая кислота, серная кислота способна замещать атомы водорода на атомы металла в своей молекуле. Взаимодействует она практически со всеми металлами.
В разбавленном виде серная кислота реагирует с металлами как обычная кислота. В результате реакции образуется соль с кислотным остатком SO4 и водород.
Zn + H2SO4 = ZnSO4 + H2
А концентрированная серная кислота является очень сильным окислителем. Она окисляет все металлы, независимо от их положения в ряду напряжений. И при реакции с металлами она сама восстанавливается до SO2. Водород не выделяется.
Сu + 2 H2SO4 (конц) = CuSO4 + SO2 + 2H2O
Zn + 2 H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
А вот золото, железо, алюминий, металлы платиновой группы в серной кислоте не окисляются. Поэтому серную кислоту перевозят в стальных цистернах.
Сернокислые соли, которые получаются в результате таких реакций, называют сульфатами. Они не имеют цвета, легко кристаллизуются. Некоторые из них хорошо растворяются в воде. Малорастворимыми являются только CaSO4 и PbSO4 . Почти не растворяется в воде BaSO4.
Взаимодействие с основаниями

Реакция взаимодействия кислоты с основаниями называется реакцией нейтрализации. В результате реакции нейтрализации серной кислоты образуется соль, содержащая кислотный остаток SO4, и вода H2O.
Примеры реакций нейтрализации серной кислоты:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H2SO4 + CaOH = CaSO4 + 2 H2O
Серная кислота вступает в реакцию нейтрализации как с растворимыми, так и с нерастворимыми основаниями.
Так как в молекуле серной кислоты два атома водорода, и для её нейтрализации требуется два основания, то она относится к двухосновным кислотам.
Взаимодействие с основными оксидами
Из школьного курса химии нам известно, что оксидами называют сложные вещества, в состав которых входят два химических элемента, одним из которых является кислород в степени окисления -2 . Основными оксидами называют оксиды 1, 2 и некоторых 3 валентных металлов. Примеры основных оксидов: Li2O, Na2O, CuO, Ag2O, MgO, CaO, FeO, NiO.
С основными оксидами серная кислота вступает в реакцию нейтрализации. В результате такой реакции, как и в реакции с основаниями, образуются соль и вода. Соль содержит кислотный остаток SO4.
CuO + H2SO4 = CuSO4 + H2O
Взаимодействие с солями
Серная кислота взаимодействует с солями более слабых или летучих кислот, вытесняя из них эти кислоты. В результате такой реакции образуется соль с кислотным остатком SO4 и кислота
H2SO4+BaCl2=BaSO4+2HCl
Применение серной кислоты и её соединений

Бариева каша ВaSO4 способна задерживать рентгеновские лучи. Заполняя ею полые органы человеческого организма, рентгенологи исследуют их.
В медицине и строительстве широко применяют природный гипс CaSO4 * 2H2O, кристаллогидрат сульфата кальция. Глауберова соль Na2SO4 * 10H2O используется в медицине и ветеринарии, в химической промышленности - для производства соды и стекла. Медный купорос CuSO4 * 5H2O известен садоводам и агрономам, которые используют его для борьбы с вредителями и болезнями растений.
Серная кислота широко используется в различных отраслях промышленности: химической, металлообрабатывающей, нефтяной, текстильной, кожевенной и других.
С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода (разбавленные серная, фосфорная, сернистая, все бескислородные и органические кислоты и др.)
реагируют металлы:
расположенные в ряду напряжений до водорода
(эти металлы способны
вытеснять водород из кислоты);
образующие с этими кислотами растворимые соли
(на поверхности этих металлов
не образуется защитная солевая
пленка).
В результате реакции образуются растворимые соли
и выделяется водород:
2А1 + 6НСI = 2А1С1 3 + ЗН 2
М
g
+ Н 2
SO
4
=
М
gS
О 4
+ Н 2
разб.
С
u
+ Н 2
SO
4
→
X
(так
как С
u
стоит после Н 2)
разб.
РЬ + Н 2
SO
4
→
X
(так
как РЬ
SO
4
нерастворим
в воде)
разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный
остаток, К ним относятся концентрированная серная, а также азотная кислота
любой концентрации. Такие кислоты называют кислотами-окислителями.

Окислительные свойства кислотных остатков и значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная серная кислоты взаимодействуют практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после него, кроме золота и платины. Так как окислителями в этих случаях являются ноны кислотных остатков (за счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то при взаимодействии азотной, а концентрированной серной кислот с металлами не выделяется водород. Металл под действием данных кислот окисляется до характерной (устойчивой) степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и степени разбавления кислоты

Взаимодействие серной кислоты с металлами
Разбавленная и концентрированная серные кислоты ведут себя по-разному. Разбавленная серная кислота ведет себя, как обычная кислота. Активные металлы, стоящие в ряду напряжений левее водорода
Li, К , Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с цинком.
H 2 SO 4 + Zn = Zn SO 4 + H 2
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь. А в концентрированной серной кислоты, цинк и медь, ведут себя таким образом…
Цинк, как активный металл, может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу, и даже сероводород.
2H 2 SO 4 + Zn = SO 2 +ZnSO 4 + 2H 2 O
Медь - менее активный металл. При взаимодействии с концентрированно серной кислотой восстанавливает ее до сернистого газа.
2H 2 SO 4 конц. + Cu = SO 2 + CuSO 4 + 2H 2 O
В пробирках с концентрированной серной кислотой выделяется сернистый газа.
Следует иметь в виду, что на схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот.
На основании
приведенных схем составим уравнения конкретных реакций — взаимодействия меди и
магния с концентрированной серной кислотой:
0 +6
+2 +4
С
u
+ 2Н 2
SO
4
= С
uSO
4
+
SO
2
+ 2Н 2
O
конц.
0 +6 +2 -2
4М
g
+ 5Н 2
SO
4
= 4М
gSO
4
+ Н 2
S
+ 4Н 2
O
конц.
Некоторые металлы ( Fe . АI, С r ) не взаимодействуют с концентрированной серной и азотной кислотами при обычной температуре, так как происходит пассивации металла. Это явление связано с образованием на поверхности металла тонкой, но очень плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися
окислителями за счет ионов Н + , он образует соли, в которых его
степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых
его степень окисления более устойчива:
0 +2
F
е+Н 2
SO
4
=
F
е
SO
4
+Н 2
0 разб. +
3
F
е+Н 2
SO
4
=
F
е 2 (SO 4
) 3 + 3
SO 2
+ 6Н 2
O
конц
И.И.Новошинский
Н.С.Новошинская