Do polovice 19. storočia chemici nazhromaždili značný experimentálny materiál a už mali k dispozícii značné množstvo organických zlúčenín. Syntéza týchto zlúčenín sa však uskutočnila náhodne, nevedome. Chemici sa zaoberali najmä štúdiom zloženia a vlastností prírodných látok. Viac zatiaľ nerozhodli. No prudký rozvoj priemyslu si už vyžadoval výrobu mnohých látok, ktoré, žiaľ, príroda človeku nevedela dať. Ľudia potrebovali rôzne farbivá, lieky, látky, výbušniny, pušný prach. Vznikla tak potreba cieľavedomej syntézy mnohých látok. Tomu však bránila neexistencia všeobecnej teórie organickej chémie. Práca chemikov tej doby bola ako práca v tme, dotykom, intuíciou. Dokonca aj stanovenie štruktúry molekúl sa považovalo za zásadne nemožné a akýkoľvek pokus o to nebol vážnou záležitosťou. Pozíciu, v ktorej sa ocitli chemici v prvej polovici minulého storočia, naznačuje list F. Wehlera J. Berzeliusovi, napísaný v roku 1835. Obsahuje tieto slová: "Organická chémia teraz môže poblázniť každého. Zdá sa, pre mňa ako hustý les plný úžasných vecí, bezhraničná húština, z ktorej sa nedá vyjsť, kam sa neodvážite preniknúť.
Na zrod jednotnej teórie však už boli vytvorené určité, no dosť významné predpoklady. Vďaka výskumu nemeckých chemikov A. Kekuleho a G. Kolbeho (1857), ako aj škótskeho chemika A. Coopera (1858) sa zistilo, že uhlík má štvormocnosť a je schopný sa spájať s iným uhlíkom. atómov, aby vytvorili reťazce. Atóm uhlíka už bol znázornený moderným symbolom „C“ so štyrmi pomlčkami, čo znamenalo jeho mocnosť:
Títo vedci sa však nikdy nedokázali priblížiť k vytvoreniu všeobecnej teórie štruktúry organických látok.
Autorom takejto teórie bol vynikajúci ruský chemik - profesor Kazanskej univerzity Alexander Michajlovič Butlerov (1828-1886). Pevne stál na materialistických pozíciách a bol presvedčený, že vytvorenie štruktúry molekúl je možné.
Podstata hlavných ustanovení teórie A.M. Butlerova, ktoré boli publikované v roku 1861, je nasledovná:
- 1. Atómy, ktoré tvoria molekulu organickej hmoty, nie sú v neusporiadanom stave, ale sú v určitom slede navzájom pospájané chemickými väzbami (podľa valencie týchto atómov). A.M. Butlerov nazval určité poradie a postupnosť spojenia atómov v molekule chemickou štruktúrou.
- 2. Vlastnosti látky závisia nielen od toho, ktoré atómy a koľko z nich je súčasťou molekuly, ale aj od poradia, v ktorom sú v molekule pospájané (teda od chemickej štruktúry).
- 3. Atómy a skupiny, ktoré tvoria molekulu, navzájom ovplyvňujú svoje chemické správanie. Tento efekt je obzvlášť viditeľný, ak sú tieto atómy alebo skupiny priamo navzájom viazané.
- 4. Keď poznáte vlastnosti látky, môžete určiť jej štruktúru. A naopak, chemická štruktúra organickej zlúčeniny hovorí veľa o jej vlastnostiach.
- 5. Štruktúru molekuly možno vyjadriť pomocou štruktúrneho vzorca, ktorý je pre danú látku jedinečný.
Dôležitosť teórie chemickej štruktúry A.M. Butlerova je ťažké preceňovať. Prvýkrát umožnil organickým chemikom pozrieť sa na molekulu ako na systém, v ktorom existuje prísne poradie väzieb medzi atómami. Ukázala možnosť poznať túto súvislosť, vyvrátila blud idealistickej doktríny o nepoznateľnosti štruktúry molekúl a vedecky vysvetlila mnohé fakty v organickej chémii, napríklad fenomén izomérie.
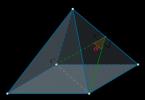
V procese tvorby teórie štruktúry AM. Butlerov dospel k záveru, že organické zlúčeniny musia mať priestorovú štruktúru. Bolo to spôsobené predovšetkým tým, že niektoré prípady izomérie (geometrické a optické) bolo ťažké vysvetliť z hľadiska rovinnej štruktúry molekúl. Smelé dohady geniálneho chemika čoskoro v roku 1874 potvrdil holandský vedec R 1 . Wang Hoff a francúzsky chemik Le Beley. Nezávisle od seba predložili myšlienku, že štyri valencie atómu uhlíka sú nasmerované v priestore do štyroch rohov štvorstenu (za predpokladu, že uhlík samotný je v jeho strede). Táto myšlienka odhalila jedno z tajomstiev prírody: vybrala si štvorsten ako hlavný geometrický prvok organickej chémie. Tak bola teória štruktúry A.M. Butlerova doplnená o teóriu priestorového usporiadania atómov v molekule, ktorá následne vytvorila základ novej vedy - stereochémia.
Teória A.M. Butlerova umožnila predpovedať existenciu neznámych organických zlúčenín a uskutočniť ich účelnú syntézu. Učenie A.M. Butlerova si zachovalo svoj vedecký základ a stalo sa základom moderných teoretických konceptov organickej chémie.
Všeobecne akceptované hlavné ustanovenia Butlerovovej teórie sa považujú za základ modernej chémie. Vedec ako prvý vysvetlil vlastnosti.Podrobne študoval povahu vzťahov atómov.
Predpoklady pre vznik teórie
Alexander Butlerov sa stal zakladateľom novej teórie práve vtedy, keď sa vo vede nahromadilo množstvo otázok, na ktoré vedci nevedeli nájsť odpovede. Vysvetlenia si napríklad vyžadovali javy valencie a izomérie. Okrem toho sa chemici naďalej hádali o tom, ako správne písať chemické vzorce. Butlerov túto otázku objasnil. Dokázal, že vzorce by mali odrážať štruktúru hmoty.
Okrem toho existovalo niekoľko konceptov, ktoré boli v rozpore s názormi vyjadrenými Butlerovom. Bola to teória radikálov. Jej zakladateľom bol Jens Berzelius. Tvrdil, že v molekulách sú špeciálne prvky – radikály, ktoré prechádzajú z jednej látky do druhej. Existovala aj teória typov. Jeho priaznivci verili, že všetky zložité látky sú derivátmi jednoduchých anorganických látok - vody, vodíka, amoniaku atď. Všetky tieto pojmy si navzájom odporujú. Veda potrebovala teóriu, ktorá by dala všetko na svoje miesto.
Butlerovove nové nápady
Alexander Michajlovič Butlerov (1828-1886) bol jedným z vynikajúcich chemikov svojej doby. Veľa sa zaoberal teoretickými otázkami svojej vedy. V roku 1858 vedec vystúpil na jednom zo stretnutí Parížskej chemickej spoločnosti. Zároveň po prvýkrát zazneli z jeho úst hlavné ustanovenia Butlerovovej teórie.
Výskumník vo svojej správe použil nové termíny, ktoré sa neskôr udomácnili v medzinárodnej vede. Bol to napríklad on, kto sa stal autorom konceptu štruktúry zlúčenín. Vedec veril, že štruktúra rôznych látok umožňuje ich priradenie k rovnakým skupinám (najmä metán, chloroform, metylalkohol atď.).
Štúdium syntézy látok
V roku 1861 boli v publikovanej správe „O chemickej štruktúre hmoty“ formulované hlavné ustanovenia teórie chemickej štruktúry A. M. Butlerova. Vedec podrobne opísal metódy syntézy a použitia rôznych reakcií. Jednou z najdôležitejších téz chemika bolo jeho tvrdenie, že každej chemickej látke zodpovedá jeden vzorec. Jeho význam spočíva v tom, že charakterizuje všetky vlastnosti a ukazuje spojenie atómov v rámci molekúl.
Butlerovova teória tiež predpokladala, že pomocou riadených reakcií je možné vyrábať nové látky. V nasledujúcich rokoch slávny chemik a jeho študenti vykonali mnoho experimentov, aby potvrdili tento predpoklad. Podarilo sa im syntetizovať také nové látky ako izobutylén a niektoré alkoholy. Pre ich éru mali tieto objavy kolosálny význam, ktorý možno porovnávať len s významom definície iných prvkov Mendelejevom (napríklad ekabor).

Systematizácia chémie
V 19. storočí hlavné ustanovenia Butlerovovej teórie úplne zmenili predstavu vedcov o prvkoch. Najmä výskumník bol prvý, kto naznačil, že molekuly nie sú chaotickou akumuláciou atómov. Naopak, majú usporiadanú štruktúru. Atómy sú navzájom spojené v určitej postupnosti, ktorá tiež určuje povahu celej látky.
Butlerov, rozvíjajúc svoju teóriu, sa spoliehal na matematické princípy a zákony. Pomocou tejto vedy dokázal vysvetliť väčšinu procesov a vzťahov v chemikáliách. Pre súčasníkov to bola skutočná revolúcia. Išlo o to, že aj keby vedci poznali nejaké fakty o povahe určitých látok, nedokázali by svoje poznatky postaviť do jasného systematizovaného obrazu. Hlavné ustanovenia Butlerovovej teórie štruktúry tento problém vyriešili. Teraz chémia nebola nesúrodou pokladnicou faktov, ale harmonickým systémom, kde všetko podliehalo prísnej matematickej logike.

Rozmanitosť látok
Slávna Butlerovova teória venuje veľkú pozornosť izomérii - javu, ktorý spočíva v existencii izomérov - látok, ktoré majú rovnakú molekulovú hmotnosť a atómové zloženie, ktoré sa zároveň navzájom líšia usporiadaním atómov a štruktúrou. Táto vlastnosť vysvetľuje rozmanitosť vlastností látok v prírode.
Butlerov dokázal svoju teóriu na príklade butánu. Podľa predstavy vedca mali v prírode existovať dva druhy tejto látky. V tom čase však veda poznala iba jeden bután. Butlerov vykonal mnoho experimentov a napriek tomu získal novú látku, ktorá má podobné zloženie, ale má odlišné vlastnosti. Dostal názov izobután.

Vplyv atómov na seba
Butlerov objavil aj ďalšiu dôležitú zákonitosť. S tvorbou chemických väzieb začína proces prenosu elektrónov z jedného atómu na druhý. Zároveň sa mení ich hustota. Existujú elektrónové páry, ktoré ovplyvňujú vlastnosti novovzniknutej látky. Vedec študoval tento jav na príklade chlorovodíka, kde chlór mení elektrónovú hustotu vodíkových väzieb.
Butlerov a hlavné ustanovenia teórie štruktúry dokázali vysvetliť podstatu premeny látok. V budúcnosti objavený princíp podrobne študovali jeho nasledovníci a študenti. Pochopenie mechanizmu zmeny látok umožnilo vedcom pochopiť, ako syntetizovať nové prvky. Zvláštny nárast týchto objavov začal koncom 19. storočia. Potom európski a americkí vedci v nových laboratóriách pomocou metód navrhnutých Butlerovom dokázali vyrobiť nové látky.

chemické väzby
Butlerov veril, že štruktúru látok možno študovať chemickými metódami. Táto pozícia bola potvrdená vďaka mnohým úspešným experimentom vedca. Výskumník bol tiež zástancom myšlienky, že vzorce môžu byť správne iba vtedy, ak začnú odrážať poradie chemických väzieb rôznych atómov. Butlerov analyzuje tento predpoklad už mnoho rokov.
Identifikoval tri typy väzieb – jednoduché, dvojité a trojité. Vedec mal pravdu, no ďalší vývoj vedy ukázal, že existujú aj iné chemické väzby. Najmä teraz ich môžu špecialisti charakterizovať aj pomocou fyzikálnych parametrov.

Vývoj Butlerovej teórie
Nová teória štruktúry chemických zlúčenín od A. M. Butlerova mala materialistický charakter. Vedec ako prvý odvážne vyhlásil, že výskumníci sú schopní študovať vlastnosti atómov, z ktorých sú postavené všetky prvky. Zároveň Butlerov sám považoval svoju teóriu za dočasnú. Veril, že jeho nástupcovia by ho mali vyvinúť, pretože nevysvetľoval úplne niektoré fakty chemickej vedy.
Vedec mal pravdu. Butlerovova teória sa ďalej rozvíjala dvoma smermi. Prvým bolo, že veda bola schopná určiť nielen poradie spojenia, ale aj priestorové usporiadanie atómov v molekule. Takto sa zrodila stereochémia. Táto disciplína sa začala podrobne študovať Butlerov sám hovoril o tomto novom smere, hoci počas svojho života nemal čas študovať túto teoretickú problematiku.
Druhým smerom vo vývoji teórie vedca bol vznik doktríny venovanej elektronickej štruktúre atómov. Toto nie je len chemická, ale aj fyzikálna disciplína. Podrobnejšie bola študovaná podstata vzájomného ovplyvňovania atómov a vysvetlené dôvody prejavu rôznych vlastností. Boli to hlavné ustanovenia Butlerovovej teórie, ktoré umožnili vedcom dosiahnuť taký úspech.
Ako sa formovala veda na začiatku 19. storočia, keď švédsky vedec J. J. Berzelius prvýkrát predstavil koncept organických látok a organickej chémie. Prvou teóriou organickej chémie je teória radikálov. Chemici zistili, že počas chemických premien prechádzajú skupiny niekoľkých atómov nezmenené z molekuly jednej látky na molekulu inej látky, rovnako ako atómy prvkov prechádzajú z molekuly do molekuly. Takéto "nemenné" skupiny atómov sa nazývajú radikály.
Nie všetci vedci však súhlasili s teóriou radikálov. Mnohí vo všeobecnosti odmietli myšlienku atomizmu - myšlienku komplexnej štruktúry molekuly a existencie atómu ako jej súčasti. Čo je nepopierateľne dokázané v našich dňoch a nespôsobuje najmenšie pochybnosti, v XIX storočí. bol predmetom búrlivých sporov.
Obsah lekcie zhrnutie lekcie podpora rámcová lekcia prezentácia akceleračné metódy interaktívne technológie Prax úlohy a cvičenia samoskúšobné workshopy, školenia, prípady, questy domáce úlohy diskusia otázky rečnícke otázky študentov Ilustrácie audio, videoklipy a multimédiá fotografie, obrázky, grafika, tabuľky, schémy humor, anekdoty, vtipy, komiksové podobenstvá, výroky, krížovky, citáty Doplnky abstraktyčlánky čipy pre zvedavých cheat sheets učebnice základný a doplnkový slovník pojmov iné Zdokonaľovanie učebníc a vyučovacích hodínoprava chýb v učebnici aktualizácia fragmentu v učebnici prvky inovácie v lekcii nahradenie zastaraných vedomostí novými Len pre učiteľov perfektné lekcie kalendárny plán na rok metodické odporúčania programu diskusie Integrované lekcieHlavné ustanovenia teórie chemickej štruktúry A.M. Butlerov
1. Atómy v molekulách sú navzájom spojené v určitom poradí podľa ich valencie. Postupnosť medziatómových väzieb v molekule sa nazýva jej chemická štruktúra a odráža sa v jednom štruktúrnom vzorci (štruktúrny vzorec).
2. Chemická štruktúra môže byť stanovená chemickými metódami. (V súčasnosti sa používajú aj moderné fyzikálne metódy).
3. Vlastnosti látok závisia od ich chemickej štruktúry.
4. Podľa vlastností danej látky môžete určiť štruktúru jej molekuly a podľa štruktúry molekuly môžete predpovedať vlastnosti.
5. Atómy a skupiny atómov v molekule sa navzájom ovplyvňujú.
Butlerovova teória bola vedeckým základom organickej chémie a prispela k jej rýchlemu rozvoju. Na základe ustanovení teórie A.M. Butlerov podal vysvetlenie fenoménu izomérie, predpovedal existenciu rôznych izomérov a niektoré z nich získal po prvý raz.
Rozvoj teórie štruktúry uľahčili práce Kekuleho, Kolbeho, Coopera a van't Hoffa. Ich teoretické návrhy však nemali všeobecný charakter a slúžili najmä na vysvetlenie experimentálneho materiálu.
2. Štruktúrne vzorce
Štruktúrny vzorec (štrukturálny vzorec) popisuje poradie spojenia atómov v molekule, t.j. jeho chemická štruktúra. Chemické väzby v štruktúrnom vzorci sú znázornené pomlčkami. Väzba medzi vodíkom a inými atómami sa zvyčajne neuvádza (takéto vzorce sa nazývajú skrátené štruktúrne vzorce).
Napríklad úplné (rozšírené) a skrátené štruktúrne vzorce n-butánu C4H10 sú:
Ďalším príkladom sú izobutánové vzorce.
Často sa používa ešte kratší zápis vzorca, keď sú zobrazené nielen väzby s atómom vodíka, ale aj symboly atómov uhlíka a vodíka. Napríklad štruktúra benzénu C6H6 sa odráža vo vzorcoch:
Štrukturálne vzorce sa líšia od molekulárnych (hrubých) vzorcov, ktoré ukazujú len to, ktoré prvky a v akom pomere sú zahrnuté v zložení látky (t. j. kvalitatívne a kvantitatívne elementárne zloženie), ale neodrážajú poradie väzbových atómov.
Napríklad n-bután a izobután majú rovnaký molekulový vzorec C4H10, ale odlišnú sekvenciu väzieb.
Rozdiel v látkach je teda spôsobený nielen rozdielnym kvalitatívnym a kvantitatívnym elementárnym zložením, ale aj rôznymi chemickými štruktúrami, ktoré sa môžu prejaviť iba v štruktúrnych vzorcoch.
3. Pojem izoméria
Už pred vytvorením teórie štruktúry boli známe látky rovnakého elementárneho zloženia, ale s rôznymi vlastnosťami. Takéto látky sa nazývali izoméry a samotný tento jav sa nazýval izoméria.
V srdci izomérie, ako ukazuje A.M. Butlerov, spočíva rozdiel v štruktúre molekúl pozostávajúcich z rovnakej sady atómov. teda
izoméria je fenomén existencie zlúčenín, ktoré majú rovnaké kvalitatívne a kvantitatívne zloženie, ale odlišnú štruktúru a v dôsledku toho aj odlišné vlastnosti.
Napríklad, keď molekula obsahuje 4 atómy uhlíka a 10 atómov vodíka, je možná existencia 2 izomérnych zlúčenín:
V závislosti od povahy rozdielov v štruktúre izomérov sa rozlišuje štruktúrna a priestorová izoméria.
4. Štrukturálne izoméry
Štrukturálne izoméry - zlúčeniny rovnakého kvalitatívneho a kvantitatívneho zloženia, ktoré sa líšia v poradí väzbových atómov, to znamená v chemickej štruktúre.
Napríklad zloženie C5H12 zodpovedá 3 štruktúrnym izomérom:
Ďalší príklad:
5. Stereoizoméry
Priestorové izoméry (stereoizoméry) s rovnakým zložením a rovnakou chemickou štruktúrou sa líšia priestorovým usporiadaním atómov v molekule.
Priestorové izoméry sú optické a cis-trans izoméry (guličky rôznych farieb predstavujú rôzne atómy alebo atómové skupiny):
Molekuly takýchto izomérov sú priestorovo nekompatibilné.
Stereoizoméria hrá dôležitú úlohu v organickej chémii. Tieto otázky budú podrobnejšie zvážené pri štúdiu zlúčenín jednotlivých tried.
6. Elektronické reprezentácie v organickej chémii
Aplikácia elektrónovej teórie štruktúry atómu a chemickej väzby v organickej chémii bola jednou z najdôležitejších etáp vo vývoji teórie štruktúry organických zlúčenín. Koncepciu chemickej štruktúry ako postupnosti väzieb medzi atómami (A.M. Butlerov) doplnila elektrónová teória o predstavy o elektrónovej a priestorovej štruktúre a ich vplyve na vlastnosti organických zlúčenín. Práve tieto reprezentácie umožňujú pochopiť spôsoby prenosu vzájomného vplyvu atómov v molekulách (elektronické a priestorové efekty) a správanie molekúl pri chemických reakciách.
Podľa moderných myšlienok sú vlastnosti organických zlúčenín určené:
povaha a elektronická štruktúra atómov;
typ atómových orbitálov a povaha ich interakcie;
typ chemických väzieb;
chemická, elektronická a priestorová štruktúra molekúl.
7. Vlastnosti elektrónov
Elektrón má dvojakú povahu. V rôznych experimentoch môže vykazovať vlastnosti častíc aj vĺn. Pohyb elektrónu sa riadi zákonmi kvantovej mechaniky. Spojenie medzi vlnovými a korpuskulárnymi vlastnosťami elektrónu odráža de Broglieho vzťah.
Energiu a súradnice elektrónu, ako aj iných elementárnych častíc nie je možné súčasne merať s rovnakou presnosťou (Heisenbergov princíp neurčitosti). Pohyb elektrónu v atóme alebo molekule preto nemožno opísať pomocou trajektórie. Elektrón môže byť v ktoromkoľvek bode priestoru, ale s rôznymi pravdepodobnosťami.
Časť priestoru, v ktorej je vysoká pravdepodobnosť nájdenia elektrónu, sa nazýva orbitál alebo elektrónový oblak.
Napríklad:
8. Atómové orbitály
Atómový orbitál (AO) - oblasť najpravdepodobnejšieho pobytu elektrónu (elektrónového oblaku) v elektrickom poli atómového jadra.
Poloha prvku v Periodickom systéme určuje typ orbitálov jeho atómov (s-, p-, d-, f-AO atď.), ktoré sa líšia energiou, tvarom, veľkosťou a priestorovou orientáciou.
Prvky 1. periódy (H, He) sú charakterizované jednou AO - 1s.
V prvkoch 2. periódy elektróny obsadzujú päť AO na dvoch energetických úrovniach: prvá úroveň je 1s; druhá úroveň - 2s, 2px, 2py, 2pz. (čísla označujú číslo energetickej hladiny, písmená označujú tvar orbitálu).
Stav elektrónu v atóme je úplne opísaný kvantovými číslami.
Príspevok k chémii ruského chemika, akademika Petrohradskej akadémie vied a profesora Petrohradskej univerzity, tvorcu teórie chemickej štruktúry, je popísaný v tomto článku.
Príspevok Butlerova Alexandra Michajloviča k chémii:
Alexander Michajlovič v roku 1858 objavil novú metódu syntézy metylénjodidu. Pri tom plnil mnohé úlohy a pracoval na jeho derivátoch.
Chemik bol schopný syntetizovať metyléndiacetát a v procese zmydelnenia získal polymér formaldehydu. Na jeho základe v roku 1861 Butlerov ako prvý získal urotropín a metylénitan, pričom vykonal prvú syntézu cukrového prvku.
Butlerovov príspevok k štúdiu chémie bol plne odhalený v jeho objavnej správe z roku 1861. V ňom on:
- Dokázal nedokonalosť vtedajších teórií chémie.
- Zdôraznil dôležitosť teórie atomicity.
- Definoval pojem chemická štruktúra.
- Formulovaných 8 pravidiel pre tvorbu chemických zlúčenín.
- Butlerov ako prvý ukázal rozdiel medzi reaktivitou rôznych zlúčenín.
Alexander Mikhailovič predložil myšlienku, že atómy v molekulách sa navzájom ovplyvňujú. Vysvetlil v roku 1864 proces izomérie väčšiny zlúčenín organického pôvodu. V procese experimentov, v prospech svojej myšlienky, vedec skúmal štruktúru terciárneho butylalkoholu a izobutylénu. Vykonával tiež polymerizáciu etylénových uhľovodíkov.
Hlavnou úlohou Butlerova v chémii je, že je zakladateľom teórie tautomérie, ktorá kladie jej základy.