Líšia sa podobnými vlastnosťami a sú spojené spoločným vzorcom, ktorý popisuje pravidelnosť štrukturálneho rozdielu každého nasledujúceho člena skupiny od predchádzajúceho. Napríklad homologický rad alkánov alebo iné skupiny. má veľký význam pre výskum, prognózovanie alebo praktickú aplikáciu. Pre organické látky kombinované v skupine sa pozorujú pravidelné zmeny chemických a fyzikálnych vlastností a všetky korelujú so zmenou molekulovej hmotnosti.
Rovnako dôležité sú pravidlá, ktoré popisujú, ako sa menia vlastnosti látok pri prechode z jednej skupiny do druhej. Aby sme pochopili, čo je homologická séria, mali by sme zvážiť konkrétne príklady. Pre akúkoľvek skupinu zlúčenín sú charakteristické rastúce teploty topenia (kryštalizácie), varu (kondenzácie) a hustoty s nárastom molekulovej hmotnosti a počtu atómov uhlíka v molekule.
Nazývajú sa nasýtené alebo parafínové; sú to acyklické (neexistujú cykly) zlúčeniny normálnej alebo rozvetvenej štruktúry, ktorých atómy v molekulách sú spojené jednoduchými väzbami. Všeobecný vzorec má tvar CnH2n+2 a opisuje homologickú sériu alkánov. Molekula každého ďalšieho člena sa zväčší v porovnaní s predchádzajúcim o jeden atóm C a dva atómy H. K zahŕňajú:
- metán;
- etán;
- propán a pod.
Zahŕňajú aj cykloparafíny. Ide o veľkú skupinu organických zlúčenín, ktorých molekuly sú uzavreté kruhmi. Ich homologická séria má vzorec CnH2n, počnúc chemikáliou s tromi atómami uhlíka. Príklady cykloparafínov:
- cyklopropán;
- cyklobután;
- cyklopentán a pod
Nenasýtené alebo nenasýtené uhľovodíky sú tiež acyklické. Patria sem látky normálnej a izoštruktúry. Homológny rad alkénov má všeobecný vzorec CnH2n. Tieto zlúčeniny sa vyznačujú prítomnosťou jednej dvojitej väzby medzi dvoma atómami uhlíka. Ak predchádzajúca séria začínala uhľovodíkom s jedným atómom uhlíka (metán), tak táto začína látkou, ktorej molekula obsahuje dva atómy uhlíka. Príklady alkénov:
- etén;
- propén;
- butén a pod.
Uhľovodíky, v molekule ktorých sú dva atómy uhlíka spojené trojitou väzbou, sú ešte nenasýtenejšie, inak sa nazývajú acetylénové. Sú spojené homologickou sériou alkínov. Je opísaný vzorcom CnH2n-2 a začína acetylénom, ktorý má vo vzorci dva atómy C. Príklady alkínov:
- etín;
- propín;
- butin-1 a tak ďalej.
Nenasýtené acyklické uhľovodíky, v ktorých molekule sú dve dvojité väzby, sa nazývajú diény. Majú všeobecný vzorec CnH2n-2. Ich homologická séria začína uhľovodíkom s tromi atómami uhlíka na molekulu. Dvojité väzby môžu byť konjugované (oddelené jednou jednoduchou väzbou), kumulované (umiestnené na susedných atómoch) alebo izolované (oddelené niekoľkými jednoduchými väzbami). Príklady diénov:
- 1,2-propadién;
- 1,3-butadién;
- izoprén a pod
Špeciálnu skupinu tvoria cyklické štruktúry, v molekule ktorých sa nachádza benzénový kruh. Homológny rad najjednoduchších aromatických uhľovodíkov začína zlúčeninou so šiestimi atómami uhlíka – benzénom. série sa tvoria, keď je jeden alebo viac atómov vodíka pripojených k benzénovému kruhu nahradených radikálmi. Takto sa získa množstvo látok: benzén, toluén, xylén. Ak sú v molekule dva alebo viac substituentov, potom hovoria o prítomnosti izomérov pre tieto látky. Ďalšie homologické rady aromatických zlúčenín vznikajú z naftalénu, antracénu a iných látok.
Ak je v molekule uhľovodíka funkčná skupina, potom aj takéto chemické zlúčeniny tvoria homológny rad.
- Množstvo alkoholov sa vyznačuje prítomnosťou hydroxylovej skupiny (-OH) v molekule. Pre jednosýtne alkoholy je jeden atóm vodíka v acyklickom uhľovodíku nahradený hydroxylovou skupinou; ich vzorec: CnH2n+1OH. Sú tam aj riadky
- Množstvo fenolov sa tiež vyznačuje prítomnosťou hydroxylovej skupiny (-OH) v molekule, ktorá však nahrádza vodík v benzénovom kruhu.
- Množstvo aldehydov sa vyznačuje prítomnosťou karbonylovej skupiny (>C=O) v molekule chemickej zlúčeniny; všeobecný vzorec aldehydov: R-CH=O.
- Množstvo ketónov sa tiež vyznačuje prítomnosťou karbonylovej skupiny (> C \u003d O), ale ak je v aldehydoch spojená s jedným radikálom, potom v ketónoch existujú dva uhľovodíkové radikály. Ketónový vzorec: R1-CO-R2.
- Množstvo karboxylových kyselín sa odlišuje od iných chemikálií karboxylovou skupinou, ktorá kombinuje karbonylové a hydroxylové skupiny. Vzorec je RCOOH.
Pre každú sériu, či už ide o homologickú sériu aldehydov, karboxylových (organických) kyselín, alkoholov alebo iných látok, budú ich vlastnosti do značnej miery determinované typom funkčnej skupiny a budú sa prirodzene meniť spolu so zvyšovaním molekulovej hmotnosti. látka. Takáto klasifikácia obrovskej triedy chemických zlúčenín pomáha pochopiť prírodu a študovať ich vlastnosti.
Alkány sú triedou uhľovodíkov so všeobecným vzorcom C n H 2n+2. Príbuzné zlúčeniny, ktoré sa líšia jednou metylénovou skupinou -CH2 - tvoria homológny rad alkánov. Najjednoduchšou látkou v rade je metán s jedným atómom uhlíka (CH 4).
homológy
Príbuzné zlúčeniny – homológy – sú si chemicky podobné, ale majú odlišné fyzikálne vlastnosti. V závislosti od počtu atómov uhlíka sa izolujú plynné, kvapalné, pevné alkány. Prvými štyrmi zástupcami sú plyny, homológy s 5-15 atómami uhlíka sú horľavé kvapaliny. Vyššie alkány sú vosky a pevné látky s 16-390 atómami uhlíka.

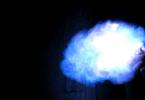
Ryža. 1. Spaľovanie metánu.
Názvy alkánov sa odlišujú príponou -an podľa gréckeho označenia číslovky:
- un- alebo gén- - jeden;
- do- - dvoch;
- tri - tri;
- tetra---štyri;
- pent - päť;
- hex - šesť;
- hept- - sedem;
- okt - osem;
- non- - deväť;
- decembra - desať.
Názvy prvých štyroch homológov sú zafixované historicky. Každé desiate meno „prechádza“ na ďalších deväť látok, pričom si zachováva číselné predpony a príponu triedy. Tabuľka homologickej série alkánov popisuje prvých 20 homológov.
|
názov |
Vzorec |
Fyzikálne vlastnosti |
|
Plyny. Horia modrým plameňom, pričom sa uvoľňuje veľké množstvo tepla. |
||
|
Horľavé olejové kvapaliny. Obsiahnuté v oleji. Používa sa na výrobu kvapalných palív - benzínu, petroleja, vykurovacieho oleja |
||
|
Tridecan |
||
|
tetradekán |
||
|
Pentadekán |
||
|
Hexadekán |
Vosky a pevné látky. Používa sa na výrobu vazelíny, parafínu |
|
|
heptadekán |
||
|
Octadecan |
||
|
Nanadekan |
||
Teploty topenia a varu alkánov sa zvyšujú so zvyšujúcim sa počtom atómov uhlíka, a teda aj molekulovou hmotnosťou. Zároveň majú všetky alkány hustotu menšiu ako jednotu. Alkány plávajú na hladine vody a rozpúšťajú sa iba v organických rozpúšťadlách.
izoméry
Alkány sú necyklické nasýtené uhľovodíky. Molekuly sú dlhé alebo rozvetvené uhlíkové reťazce. Homológne alkány môžu tvoriť izoméry. Čím viac atómov uhlíka, tým viac možností izomérov. Prvé tri alkány (metán, etán, propán) netvoria izoméry. Bután, pentán, hexán majú iba štruktúrne izoméry. Bután má dva: n-bután a izobután. Pentán tvorí n-pentán, izopentán, neopentán. Hexán má päť izomérov: n-hexán, izohexán, 3-metylpentán, diizopropyl, neohexán.
Homológy od heptánu a vyššie tvoria okrem štruktúrnych izomérov stereoizoméry alebo priestorové izoméry, ktoré sa líšia polohou atómov v priestore. Dve molekuly majú rovnakú štruktúru a štruktúru, ale vyzerajú ako objekt a jeho zrkadlový obraz.

Ryža. 2. Stereoizoméry.
Dlhé názvy izomérov sú zostavené podľa medzinárodnej nomenklatúry IUPAC. Slovné označenie pozostáva z troch častí:
- čísla a predčíslia označujúce počet pridružených skupín;
- názvy skupín;
- názov hlavného (najdlhšieho) reťazca.
Napríklad názov izoméru heptánu, 2,3-dimetylpentán, naznačuje, že molekula pozostáva z piatich atómov uhlíka (pentán) a dvoch metylových skupín pripojených k druhému a tretiemu atómu uhlíka.
Na zobrazenie štruktúry izomérov sa používajú štruktúrne vzorce. Metylová skupina -CH3 je napísaná buď cez čiaru nahor alebo nadol od atómu uhlíka, alebo v zátvorkách za skupinou -CH2 v uhlíkovom reťazci. Napríklad H3C-CH2-CH(CH2CH3)-CH2-CH3.

Ryža. 3. Štrukturálny vzorec.
Počet izomérov pre každý alkán možno vypočítať matematicky. Preto mnohé izoméry existujú iba teoreticky. Predpokladá sa, že hektán (C 100 H 202) môže mať 592 107 ∙ 10 34 izomérov, a to zďaleka nie je posledný alkán v homologickej sérii.
Čo sme sa naučili?
Alkány sú tvorené homológnym radom metánu so všeobecným vzorcom C n H 2n+2. Každý nasledujúci homológ sa od predchádzajúceho líši jednou skupinou CH2. Keď atómy uhlíka pribúdajú v homologickej sérii, mení sa fyzikálny stav látok. Vyššie alkány sú zlúčeniny obsahujúce viac ako 15 atómov uhlíka. Toto sú pevné látky. Kvapaliny obsahujú 5-15 atómov uhlíka, plyny - 1-4. Počnúc štvrtým homológom tvoria všetky alkány štruktúrne izoméry. Okrem toho, alkány z heptánu a vyššie môžu tvoriť stereoizoméry.
Tématický kvíz
Hodnotenie správy
Priemerné hodnotenie: 4.2. Celkový počet získaných hodnotení: 212.
Obmedzte (nasýtené) uhľovodíky nazývané uhľovodíky, v molekulách ktorých sú atómy uhlíka spojené jednoduchou väzbou a všetky valenčné jednotky nespotrebované na väzbe medzi atómami uhlíka sú nasýtené atómami vodíka.
Predstaviteľmi nasýtených uhľovodíkov sú metán CH4; etán C2H6; propán C3H8; bután C4H10; pentán C5H12; hexán C6H14. Táto séria však môže pokračovať. Existujú sacharidy C30H62, C50H102, C70H142, C100H202.
Ak vezmeme do úvahy uhľovodíky metánovej série, potom je ľahké vidieť, že každý nasledujúci uhľovodík možno vyrobiť zo zodpovedajúceho predchádzajúceho nahradením jedného atómu vodíka skupinou CH3 (metyl). Zloženie následnej molekuly uhľovodíka sa teda zvyšuje o skupinu CH2.
Množstvo chemických zlúčenín rovnakého štruktúrneho typu, ktoré sa navzájom líšia jednou alebo viacerými štruktúrnymi jednotkami (zvyčajne skupinou CH2), sa nazýva homologická séria, a každý zo sacharidov – člen homologickej série alebo homológ. Ak zoradíme homológy vzostupne podľa ich relatívnej molekulovej hmotnosti, tvoria homológny rad.
Skupina CH2 sa nazýva homológny rozdiel alebo homológny rozdiel. Všeobecný vzorec nasýtených uhľovodíkov je C n H 2 n + 2, kde n – počet atómov uhlíka v molekule.
Ak sa z molekuly uhľovodíka odoberie atóm vodíka, potom sa zvyšok molekuly s otvorenou väzbou nazýva uhľovodíkový radikál (označený písmenom R). Voľné radikály neexistujú kvôli ich vysokej reaktivite.
fenomén homológie– existencia radu organických zlúčenín, v ktorých sa vzorec ľubovoľných dvoch susedov radu líši o rovnakú skupinu (najčastejšie CH 2). Fyzikálno-chemické vlastnosti zlúčenín sa menia pozdĺž homologickej série. V organickej chémii je koncept homológie založený na základnom postavení, že chemické a fyzikálne vlastnosti zlúčeniny sú určené štruktúrou jej molekúl: tieto vlastnosti sú určené funkčnými skupinami zlúčeniny a jej uhlíkovým skeletom.
 Celý komplex chemických vlastností a následne aj priradenie zlúčeniny k určitej triede je presne určený funkčnými skupinami, ale miera prejavu chemických vlastností alebo fyzikálnych vlastností závisí od uhlíkovej kostry molekuly.
Celý komplex chemických vlastností a následne aj priradenie zlúčeniny k určitej triede je presne určený funkčnými skupinami, ale miera prejavu chemických vlastností alebo fyzikálnych vlastností závisí od uhlíkovej kostry molekuly.
Pri absencii izomérie v prípade podobných uhlíkových skeletov zlúčenín možno vzorec homologických zlúčenín zapísať ako X – (CH2) n – Y, zlúčeniny s rôznym počtom n metylénových jednotiek sú homológy a patria do rovnakej triedy zlúčenín. Takže homológne zlúčeniny patria do rovnakej triedy zlúčenín a vlastnosti najbližších homológov sú najbližšie.
V homologickej sérii dochádza k určitej pravidelnej zmene vlastností od mladších členov radu k starším, ale tento vzorec nie je vždy dodržaný, v niektorých prípadoch môže byť porušený. Najčastejšie sa to deje na začiatku série, pretože vodíkové väzby sa tvoria v prítomnosti funkčných skupín schopných ich tvoriť.
Príkladom homologickej série je séria nasýtených uhľovodíkov (alkánov). Jeho najjednoduchší zástupca – metán CH4. Homológy metánu sú: etán C2H6; propán C3H8; bután C4H10; pentán C5H12; hexán C 6 H 14, heptán C 7 H 16, oktán - C 8 H 18, nonán - C 9 H 20, dekán - C 10 H 22, undekán - C 11 H 24, nodekán – C12H26, tridekán – C13H28, tetradekán – C14H30, pentadekan – C 15 H 32, eikosan - C 20 H 42, pentakosan - C 25 H 52, triakontán - C 30 H 62, tetrakontán - C 40 H 82, hektán - C 100 H 202.
Máte nejaké otázky? Viete, čo je homologická séria?
Ak chcete získať pomoc tútora - zaregistrujte sa.
Prvá lekcia je zadarmo!
stránky, s úplným alebo čiastočným kopírovaním materiálu, je potrebný odkaz na zdroj.
Z Wikipédie, voľnej encyklopédie
 Homológna séria- množstvo chemických zlúčenín rovnakého štruktúrneho typu (napríklad alkány alebo alifatické alkoholy - mastné alkoholy), líšiacich sa navzájom zložením určitým počtom opakujúcich sa štruktúrnych jednotiek - tzv. homológny rozdiel. Homológy- látky, ktoré patria do rovnakej homologickej série.
Homológna séria- množstvo chemických zlúčenín rovnakého štruktúrneho typu (napríklad alkány alebo alifatické alkoholy - mastné alkoholy), líšiacich sa navzájom zložením určitým počtom opakujúcich sa štruktúrnych jednotiek - tzv. homológny rozdiel. Homológy- látky, ktoré patria do rovnakej homologickej série.
Najjednoduchším príkladom homologickej série sú alkány (všeobecný vzorec C n H 2n+2): metán CH 4, etán C 2 H 6, propán C 3 H 8 atď.; homológnym rozdielom tohto radu je metylénová jednotka -CH 2 -.
Homológia a štruktúra zlúčenín
Koncept homológie v organickej chémii je založený na základnom postoji, že chemické a fyzikálne vlastnosti látky sú určené štruktúrou jej molekúl: tieto vlastnosti sú definované ako funkčné skupiny zlúčeniny (hydroxyalkoholy, karboxylová skupina karboxylových kyselín , arylová skupina aromatických zlúčenín a pod.) a jej uhlíkový skelet.
Samotný komplex chemických vlastností, a teda príslušnosť zlúčeniny k určitej triede, je presne určený funkčnými skupinami (napríklad prítomnosť karboxylovej skupiny určuje prejav kyslých vlastností zlúčeniny a jej príslušnosť k trieda karboxylových kyselín), ale na mieru prejavu chemických vlastností (napríklad reaktivita a disociačná konštanta) alebo fyzikálnych vlastností (teploty varu a topenia, index lomu a pod.) ovplyvňuje aj uhlíková kostra molekuly (pozri obr. 1).
V prípade podobnosti uhlíkových skeletov zlúčenín, teda neprítomnosti izomérie, možno vzorec homológnych zlúčenín zapísať ako X-(CH2)n-Y, zlúčeniny s rôznym číslom n metylénové jednotky sú homológy a patria do rovnakej triedy zlúčenín (napr. H-(CH2)n-COOH- alifatické karboxylové kyseliny). Homológne zlúčeniny teda patria do rovnakej triedy zlúčenín a vlastnosti najbližších homológov sú najbližšie.
V homologických sériách dochádza k pravidelnej zmene vlastností od mladších členov radu k starším, tento vzorec však môže byť porušený predovšetkým na začiatku radu v dôsledku tvorby vodíkových väzieb. v prítomnosti funkčných skupín schopných ich tvorby (pozri obr. 2, teplota topenia).
Pri štúdiu paralelizmov vo fenoménoch dedičnej variability N. I. Vavilov, analogicky s homológnym radom organických zlúčenín, zaviedol koncept Homológny rad v dedičnej premenlivosti.
pozri tiež
Napíšte recenziu na článok "Homologická séria"
Úryvok charakterizujúci sériu Homologická
Po princovi Andrejovi Boris pristúpil k Natashe a vyzval ju, aby tancovala, a tá pobočnícka tanečnica, ktorá začala ples, a stále mladí ľudia, a Natasha, ktorá odovzdala svojich prebytočných pánov Soni, šťastná a začervenaná, neprestali tancovať celý večer. Nevšimla si a nevidela nič, čo na tomto plese zamestnávalo všetkých. Nielenže si nevšimla, ako sa panovník dlho rozprával s francúzskym vyslancom, ako zvlášť vľúdne hovoril s takou a takou dámou, ako princ robil také a také a hovoril, ako mala Helena veľký úspech a dostalo sa jej zvláštnej pozornosti napr. a podobne; panovníka ani nevidela a všimla si, že odišiel len preto, že po jeho odchode sa ples stal živším. Jeden z veselých kotiliónov, pred večerou, princ Andrei opäť tancoval s Natašou. Pripomenul jej ich prvé stretnutie v Otradnenskej uličke a ako nemohla zaspať počas mesačnej noci a ako ju nepočul. Natasha sa pri tejto pripomienke začervenala a snažila sa ospravedlniť, akoby bolo niečo hanebné v pocite, v ktorom ju princ Andrej mimovoľne začul.
Princ Andrei, rovnako ako všetci ľudia, ktorí vyrastali vo svete, rád stretával vo svete to, čo nemalo spoločný svetský odtlačok. A taká bola Nataša so svojím prekvapením, radosťou a nesmelosťou, ba aj chybami vo francúzštine. Rozprával sa s ňou obzvlášť nežne a opatrne. Princ Andrei, ktorý sedel vedľa nej a rozprával sa s ňou o najjednoduchších a najbezvýznamnejších témach, obdivoval radostný lesk v jej očiach a úsmev, ktorý sa netýkal hovorených prejavov, ale jej vnútorného šťastia. Kým Natašu vybrali a ona s úsmevom vstala a tancovala po sále, princ Andrej obdivoval najmä jej nesmelú milosť. Uprostred kotilionu sa Natasha po dokončení postavy, stále ťažko dýchajúc, priblížila k svojmu miestu. Nový pán ju opäť pozval. Bola unavená a zadýchaná a zrejme myslela na odmietnutie, no hneď opäť veselo zdvihla ruku na kavalierovo rameno a usmiala sa na princa Andreja.
„Rád by som si oddýchol a posadil sa s tebou, som unavený; ale vidíš, ako si ma vyberajú, a som z toho rád, a som šťastný a milujem všetkých a ty a ja to všetko chápeme, “a ten úsmev povedal oveľa viac. Keď ju pán opustil, Nataša prebehla cez chodbu, aby zobrala dve dámy na kúsky.
"Ak príde najprv k svojej sesternici a potom k inej dáme, bude mojou ženou," povedal si celkom nečakane princ Andrei a pozrel sa na ňu. Išla prvá k sesternici.
„Aký nezmysel vám niekedy príde na myseľ! pomyslel si princ Andrej; ale pravda je len to, že to dievča je také milé, také výnimočné, že tu nebude mesiac tancovať a nevydá sa... Toto je tu vzácnosť,“ pomyslel si, keď Nataša narovnávala spadnutú ružu. z jej živôtika, sadla si vedľa neho.
Na konci kotilióna starý gróf v modrom fraku pristúpil k tanečníkom. Pozval princa Andreja k sebe a spýtal sa jeho dcéry, či sa baví? Natasha neodpovedala a len sa usmiala s takým úsmevom, ktorý povedal vyčítavo: "Ako ste sa na to mohli opýtať?"
- Toľko zábavy, ako nikdy v živote! - povedala a princ Andrei si všimol, ako rýchlo sa jej tenké ruky zdvihli, aby objali otca, a okamžite spadli. Natasha bola šťastná ako nikdy v živote. Bola na tom najvyššom stupni šťastia, keď sa človek stáva úplne dôverčivým a neverí v možnosť zla, nešťastia a smútku.
Pierre sa na tomto plese po prvý raz cítil urazený pozíciou, ktorú jeho manželka zastávala vo vyšších sférach. Bol namosúrený a roztržitý. Na čele mal širokú ryhu a on, stojac pri okne, pozeral cez okuliare, nikoho nevidel.
Natasha, cestou na večeru, prešla okolo neho.
Zasiahla ju zachmúrená, nešťastná tvár Pierra. Zastala pred ním. Chcela mu pomôcť, sprostredkovať mu prebytok svojho šťastia.
„Aké zábavné, gróf,“ povedala, „nie?
Pierre sa neprítomne usmial, očividne nerozumel tomu, čo sa mu hovorí.
"Áno, som veľmi rád," povedal.
"Ako môžu byť s niečím nespokojní," pomyslela si Natasha. Najmä taký dobrý ako tento Bezukhov?" V Natašiných očiach boli všetci, ktorí boli na plese, rovnako milí, milí, úžasní ľudia, ktorí sa milovali: nikto sa nemohol uraziť, a preto mali byť všetci šťastní.
Na druhý deň si princ Andrei spomenul na včerajší ples, ale dlho sa na ňom nezdržal. „Áno, lopta bola veľmi geniálna. A predsa... áno, Rostova je veľmi milá. Je niečo svieže, zvláštne, nie Petrohrad, čo ju odlišuje. To si myslel o včerajšom plese a po vypití čaju si sadol k práci.
Ale z únavy alebo nespavosti (deň nebol vhodný na vyučovanie a princ Andrei nemohol nič robiť) sám kritizoval svoju prácu, ako sa mu často stávalo, a bol rád, keď počul, že niekto prišiel.
Návštevníkom bol Bitsky, ktorý pôsobil v rôznych komisiách, navštívil všetky spoločnosti v Petrohrade, vášnivý obdivovateľ nových myšlienok a Speranského a úzkostlivý spravodajca z Petrohradu, jeden z tých ľudí, ktorí si vyberajú trend ako šaty - podľa módy, ale ktorí sa z tohto dôvodu zdajú byť najhorlivejšími prívržencami trendov. Nervózne, sotva si stihol zložiť klobúk, bežal k princovi Andrejovi a okamžite začal hovoriť. Práve sa dozvedel podrobnosti o dnešnom rannom zasadnutí Štátnej rady, ktoré otvoril panovník, a nadšene o ňom hovoril. Cisárov prejav bol mimoriadny. Bol to jeden z prejavov, ktoré mali len konštituční monarchovia. „Panovník priamo povedal, že rada a senát sú štátnymi statkami; povedal, že vláda by nemala byť založená na svojvôli, ale na pevných princípoch. Panovník povedal, že financie by sa mali transformovať a správy by sa mali zverejniť,“ povedal Bitsky, trafil dobre známe slová a výrazne otvoril oči.
Obmedzte (nasýtené) uhľovodíky nazývané uhľovodíky, v molekulách ktorých sú atómy uhlíka spojené jednoduchou väzbou a všetky valenčné jednotky nespotrebované na väzbe medzi atómami uhlíka sú nasýtené atómami vodíka.
Predstaviteľmi nasýtených uhľovodíkov sú metán CH4; etán C2H6; propán C3H8; bután C4H10; pentán C5H12; hexán C6H14. Táto séria však môže pokračovať. Existujú sacharidy C30H62, C50H102, C70H142, C100H202.
Ak vezmeme do úvahy uhľovodíky metánovej série, potom je ľahké vidieť, že každý nasledujúci uhľovodík možno vyrobiť zo zodpovedajúceho predchádzajúceho nahradením jedného atómu vodíka skupinou CH3 (metyl). Zloženie následnej molekuly uhľovodíka sa teda zvyšuje o skupinu CH2.
Množstvo chemických zlúčenín rovnakého štruktúrneho typu, ktoré sa navzájom líšia jednou alebo viacerými štruktúrnymi jednotkami (zvyčajne skupinou CH2), sa nazýva homologická séria, a každý zo sacharidov – člen homologickej série alebo homológ. Ak zoradíme homológy vzostupne podľa ich relatívnej molekulovej hmotnosti, tvoria homológny rad.
Skupina CH2 sa nazýva homológny rozdiel alebo homológny rozdiel. Všeobecný vzorec nasýtených uhľovodíkov je C n H 2 n + 2, kde n – počet atómov uhlíka v molekule.
Ak sa z molekuly uhľovodíka odoberie atóm vodíka, potom sa zvyšok molekuly s otvorenou väzbou nazýva uhľovodíkový radikál (označený písmenom R). Voľné radikály neexistujú kvôli ich vysokej reaktivite.
fenomén homológie– existencia radu organických zlúčenín, v ktorých sa vzorec ľubovoľných dvoch susedov radu líši o rovnakú skupinu (najčastejšie CH 2). Fyzikálno-chemické vlastnosti zlúčenín sa menia pozdĺž homologickej série. V organickej chémii je koncept homológie založený na základnom postavení, že chemické a fyzikálne vlastnosti zlúčeniny sú určené štruktúrou jej molekúl: tieto vlastnosti sú určené funkčnými skupinami zlúčeniny a jej uhlíkovým skeletom.
 Celý komplex chemických vlastností a následne aj priradenie zlúčeniny k určitej triede je presne určený funkčnými skupinami, ale miera prejavu chemických vlastností alebo fyzikálnych vlastností závisí od uhlíkovej kostry molekuly.
Celý komplex chemických vlastností a následne aj priradenie zlúčeniny k určitej triede je presne určený funkčnými skupinami, ale miera prejavu chemických vlastností alebo fyzikálnych vlastností závisí od uhlíkovej kostry molekuly.
Pri absencii izomérie v prípade podobných uhlíkových skeletov zlúčenín možno vzorec homologických zlúčenín zapísať ako X – (CH2) n – Y, zlúčeniny s rôznym počtom n metylénových jednotiek sú homológy a patria do rovnakej triedy zlúčenín. Takže homológne zlúčeniny patria do rovnakej triedy zlúčenín a vlastnosti najbližších homológov sú najbližšie.
V homologickej sérii dochádza k určitej pravidelnej zmene vlastností od mladších členov radu k starším, ale tento vzorec nie je vždy dodržaný, v niektorých prípadoch môže byť porušený. Najčastejšie sa to deje na začiatku série, pretože vodíkové väzby sa tvoria v prítomnosti funkčných skupín schopných ich tvoriť.
Príkladom homologickej série je séria nasýtených uhľovodíkov (alkánov). Jeho najjednoduchší zástupca – metán CH4. Homológy metánu sú: etán C2H6; propán C3H8; bután C4H10; pentán C5H12; hexán C 6 H 14, heptán C 7 H 16, oktán - C 8 H 18, nonán - C 9 H 20, dekán - C 10 H 22, undekán - C 11 H 24, nodekán – C12H26, tridekán – C13H28, tetradekán – C14H30, pentadekan – C 15 H 32, eikosan - C 20 H 42, pentakosan - C 25 H 52, triakontán - C 30 H 62, tetrakontán - C 40 H 82, hektán - C 100 H 202.
Máte nejaké otázky? Viete, čo je homologická séria?
Ak chcete získať pomoc od tútora -.
Prvá lekcia je zadarmo!
blog.site, pri úplnom alebo čiastočnom skopírovaní materiálu je potrebný odkaz na zdroj.