În chimia organică, puteți găsi substanțe hidrocarburi cu cantități diferite de carbon în lanț și legătură C=C. Sunt omologi și se numesc alchene. Datorită structurii lor, sunt mai reactivi din punct de vedere chimic decât alcanii. Dar ce fel de reacții sunt tipice pentru ei? Să luăm în considerare distribuția lor în natură, diferite metode de producție și aplicare.
Ce sunt ei?
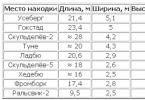
Alchenele, care sunt numite și olefine (uleioase), își iau numele de la clorura de etenă, un derivat al primului membru al acestui grup. Toate alchenele au cel puțin o legătură dublă C=C. C n H 2n este formula tuturor olefinelor, iar numele este format dintr-un alcan cu același număr de atomi de carbon în moleculă, doar sufixul -ane se schimbă în -enă. Cifra arabă de la sfârșitul numelui, despărțită printr-o cratimă, indică numărul de carbon de la care începe legătura dublă. Să ne uităm la principalele alchene, tabelul vă va ajuta să le amintiți:
Dacă moleculele au o structură simplă, neramificată, atunci se adaugă sufixul -ylene, acest lucru se reflectă și în tabel.
Unde le poți găsi?
Deoarece reactivitatea alchenelor este foarte mare, reprezentanții lor sunt extrem de rari în natură. Principiul de viață al unei molecule de olefină este „să fim prieteni”. Nu există alte substanțe în jur - nicio problemă, vom fi prieteni unul cu celălalt, formând polimeri.
Dar ele există, iar un număr mic de reprezentanți sunt incluși în gazul petrolier însoțitor, iar cei mai mari sunt în petrolul produs în Canada.
Primul reprezentant al alchenelor, etena, este un hormon care stimulează coacerea fructelor, deci este sintetizat în cantități mici de către reprezentanții florei. Există o alchenă, cis-9-tricosene, care joacă rolul unui atractant sexual la femelele muștelor de casă. Se mai numește și muscalur. (Un atractant este o substanță de origine naturală sau sintetică care provoacă atracție față de sursa de miros dintr-un alt organism). Din punct de vedere chimic, această alchenă arată astfel:
Deoarece toate alchenele sunt materii prime foarte valoroase, metodele de producere a acestora artificial sunt foarte diverse. Să ne uităm la cele mai comune.
Dacă ai nevoie de mult?
În industrie, clasa alchenelor se obține în principal prin cracare, adică. scindarea moleculei sub influența temperaturilor ridicate, alcanilor superiori. Reacția necesită încălzire în intervalul de la 400 la 700 °C. Alcanul descompune așa cum dorește, formând alchene, metodele de obținere pe care le avem în vedere, cu un număr mare de opțiuni de structură moleculară:
C7H16 -> CH3-CH=CH2 + C4H10.
O altă metodă comună se numește dehidrogenare, în care o moleculă de hidrogen este separată de un reprezentant al unei serii de alcani în prezența unui catalizator.
În condiții de laborator, alchenele și metodele de preparare diferă; ele se bazează pe reacții de eliminare (eliminarea unui grup de atomi fără înlocuirea acestora). Cei mai frecvent eliminați atomii de apă din alcooli sunt halogenii, hidrogenul sau halogenurile de hidrogen. Cel mai comun mod de a obține alchene este din alcooli în prezența unui acid ca catalizator. Este posibil să se utilizeze alți catalizatori
Toate reacțiile de eliminare sunt supuse regulii lui Zaitsev, care spune:
Un atom de hidrogen este separat de carbonul adiacent carbonului care poartă grupa -OH, care are mai puțini hidrogeni.

După ce a aplicat regula, răspundeți ce produs de reacție va predomina? Mai târziu vei afla dacă ai răspuns corect.
Proprietăți chimice
Alchenele reacţionează activ cu substanţele, rupându-le legătura pi (un alt nume pentru legătura C=C). La urma urmei, nu este la fel de puternică ca o singură legătură (sigma bond). O hidrocarbură este transformată din nesaturată în saturată fără a forma alte substanțe după reacție (adăugare).
- adaos de hidrogen (hidrogenare). Prezența unui catalizator și încălzirea este necesară pentru trecerea acestuia;
- adăugarea de molecule de halogen (halogenare). Este una dintre reacțiile calitative la legătura pi. La urma urmei, atunci când alchenele reacţionează cu apa de brom, aceasta devine din maro la transparent;
- reacția cu halogenuri de hidrogen (hidrohalogenare);
- adăugare de apă (hidratare). Condițiile pentru ca reacția să aibă loc sunt încălzirea și prezența unui catalizator (acid);
Reacțiile olefinelor nesimetrice cu halogenuri de hidrogen și apă respectă regula lui Markovnikov. Aceasta înseamnă că hidrogenul se va atașa de carbonul din dubla legătură carbon-carbon care are deja mai mulți atomi de hidrogen.

- combustie;
- catalitic de oxidare incomplet. Produsul este oxizi ciclici;
- Reacția Wagner (oxidare cu permanganat într-un mediu neutru). Această reacție alchenă este o altă legătură calitativă C=C. Pe măsură ce curge, soluția roz de permanganat de potasiu devine decolorată. Dacă aceeași reacție este efectuată într-un mediu acid combinat, produsele vor fi diferite (acizi carboxilici, cetone, dioxid de carbon);
- izomerizarea. Toate tipurile sunt caracteristice: cis- și trans-, mișcarea dublei legături, ciclizarea, izomerizarea scheletului;
- Polimerizarea este principala proprietate a olefinelor pentru industrie.
Aplicație în medicină
Produșii de reacție ai alchenelor sunt de mare importanță practică. Multe dintre ele sunt folosite în medicină. Glicerina se obține din propenă. Acest alcool polihidric este un solvent excelent, iar dacă este folosit în loc de apă, soluțiile vor fi mai concentrate. În scopuri medicale, în el se dizolvă alcaloizi, timol, iod, brom etc.. Glicerina este folosită și la prepararea unguentelor, pastelor și cremelor. Le împiedică să se usuce. Glicerina în sine este un antiseptic.
La reacția cu acid clorhidric, se obțin derivați care sunt utilizați ca anestezie locală atunci când sunt aplicați pe piele, precum și pentru anestezie de scurtă durată în timpul intervențiilor chirurgicale minore, prin inhalare.

Alcadienele sunt alchene cu două legături duble într-o moleculă. Utilizarea lor principală este producția de cauciuc sintetic, din care se fabrică apoi diverse plăcuțe și seringi de încălzire, sonde și catetere, mănuși, suzete și multe altele, care sunt pur și simplu de neînlocuit atunci când se îngrijesc bolnavii.
Aplicații industriale
| Tip de industrie | Ce se foloseste | Cum pot folosi |
| Agricultură | etena | accelerează coacerea legumelor și fructelor, defolierea plantelor, filme pentru sere |
| Lac și colorat | etenă, butenă, propenă etc. | pentru producerea de solvenți, eteri, solvenți |
| Inginerie mecanică | 2-metilpropenă, etenă | producție de cauciuc sintetic, uleiuri lubrifiante, antigel |
| Industria alimentară | etena | producerea de teflon, alcool etilic, acid acetic |
| Industria chimica | etenă, polipropilenă | se obtin alcooli, polimeri (policlorura de vinil, polietilena, acetat de polivinil, poliizobtilena, acetaldehida). |
| Minerit | etena etc. | explozivi |
Alchenele și derivații lor au găsit o utilizare mai largă în industrie. (Unde și cum sunt utilizate alchenele, tabelul de mai sus).

Aceasta este doar o mică parte din utilizarea alchenelor și a derivaților lor. În fiecare an cererea de olefine nu face decât să crească, ceea ce înseamnă că crește și nevoia de producție a acestora.
Tema lecției: Alchenele. Prepararea, proprietățile chimice și aplicațiile alchenelor.
Scopurile și obiectivele lecției:
- revizuirea proprietăților chimice specifice ale etilenei și proprietățile generale ale alchenelor;
- aprofundarea și concretizarea conceptelor de legături? și a mecanismelor reacțiilor chimice;
- dați idei inițiale despre reacțiile de polimerizare și structura polimerilor;
- analiza metodelor de laborator și industriale generale de producere a alchenelor;
- continua să-și dezvolte capacitatea de a lucra cu manualul.
Echipament: dispozitiv pentru producerea gazelor, soluție KMnO 4, alcool etilic, acid sulfuric concentrat, chibrituri, lampă cu alcool, nisip, tabele „Structura moleculei de etilenă”, „Proprietăți chimice de bază ale alchenelor”, mostre demonstrative „Polimeri”.
ÎN CURILE CURĂRILOR
I. Moment organizatoric
Continuăm să studiem seria omoloagă de alchene. Astăzi trebuie să ne uităm la metodele de preparare, proprietățile chimice și aplicațiile alchenelor. Trebuie să caracterizăm proprietățile chimice cauzate de dubla legătură, să obținem o înțelegere inițială a reacțiilor de polimerizare și să luăm în considerare metodele de laborator și industriale pentru producerea alchenelor.
II. Activarea cunoștințelor elevilor
- Ce hidrocarburi se numesc alchene?
- Care sunt caracteristicile structurii lor?
- În ce stare hibridă sunt atomii de carbon care formează o legătură dublă într-o moleculă de alchenă?
Concluzie: alchenele diferă de alcani prin prezența unei duble legături în moleculele lor, ceea ce determină particularitățile proprietăților chimice ale alchenelor, metodele de preparare și utilizare a acestora.
III. Învățarea de materiale noi
1. Metode de producere a alchenelor
Întocmește ecuații de reacție care confirmă metodele de producere a alchenelor
– cracarea alcanilor C 8 H 18 ––> C 4 H 8 + C4H10; (cracare termica la 400-700 o C)
octan buten butan
– dehidrogenarea alcanilor C 4 H 10 ––> C 4 H 8 + H 2; (t, Ni)
butan buten hidrogen
– dehidrohalogenarea haloalcanilor C 4 H 9 Cl + KOH ––> C 4 H 8 + KCl + H 2 O;
hidroxid de clorbutan apă clorură de butenă
potasiu potasiu
– dehidrohalogenarea dihaloalcanilor 
– deshidratarea alcoolilor C 2 H 5 OH ––> C 2 H 4 + H 2 O (la încălzire în prezența acidului sulfuric concentrat)
Tine minte!
În reacțiile de dehidrogenare, deshidratare, dehidrohalogenare și dehalogenare, trebuie amintit că hidrogenul este extras de preferință din atomi de carbon mai puțin hidrogenați (regula lui Zaitsev, 1875)
2. Proprietăţile chimice ale alchenelor
Natura legăturii carbon-carbon determină tipul de reacții chimice în care intră substanțele organice. Prezența unei legături duble carbon-carbon în moleculele de hidrocarburi de etilenă determină următoarele caracteristici ale acestor compuși:
– prezența unei duble legături permite clasificarea alchenelor ca compuși nesaturați. Transformarea lor în saturate este posibilă numai ca urmare a reacțiilor de adiție, care este principala caracteristică a comportamentului chimic al olefinelor;
– legătura dublă reprezintă o concentrație semnificativă de densitate electronică, deci reacțiile de adiție sunt de natură electrofilă;
– o legătură dublă este formată dintr-o legătură și una, care se polarizează destul de ușor.
Ecuații de reacție care caracterizează proprietățile chimice ale alchenelor
a) Reacții de adiție
Tine minte! Reacțiile de substituție sunt caracteristice alcanilor și cicloalcanilor superiori, care au doar legături simple; reacțiile de adiție sunt caracteristice alchenelor, dienelor și alchinelor, care au legături duble și triple.

Tine minte! Sunt posibile următoarele mecanisme de rupere a legăturii:
a) dacă alchenele și reactivul sunt compuși nepolari, atunci legătura - este ruptă pentru a forma un radical liber:
H 2 C = CH 2 + H: H ––> + +
b) dacă alchena și reactivul sunt compuși polari, atunci scindarea legăturii - duce la formarea ionilor:
c) când reactivii care conțin atomi de hidrogen în moleculă se unesc la locul unei legături rupte, hidrogenul se atașează întotdeauna la un atom de carbon mai hidrogenat (regula lui Morkovnikov, 1869).
– reacția de polimerizare nCH 2 = CH 2 ––> n – CH 2 – CH 2 –– > (– CH 2 – CH 2 –)n
eten polietilenă
b) reacţia de oxidare
Experienta de laborator. Obține etilenă și studiază proprietățile acesteia (instrucțiuni de pe birourile studenților)
Instrucțiuni pentru obținerea etilenei și experimente cu aceasta
1. Puneți 2 ml de acid sulfuric concentrat, 1 ml de alcool și o cantitate mică de nisip într-o eprubetă.
2. Închideți eprubeta cu un dop cu tub de evacuare a gazului și încălziți-o în flacăra unei lămpi cu alcool.
3. Se trece gazul eliberat printr-o soluție cu permanganat de potasiu. Observați schimbarea culorii soluției.
4. Aprindeți gazul la capătul tubului de evacuare a gazului. Atenție la culoarea flăcării.
– alchenele ard cu o flacără luminoasă. (De ce?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (cu oxidare completă, produșii de reacție sunt dioxid de carbon și apă)
Reacție calitativă: „oxidare ușoară (în soluție apoasă)”
– alchenele decolorează o soluție de permanganat de potasiu (reacția Wagner)
În condiții mai severe într-un mediu acid, produșii de reacție pot fi acizi carboxilici, de exemplu (în prezența acizilor):
CH 3 – CH = CH 2 + 4 [O] ––> CH 3 COOH + HCOOH
– oxidare catalitică
Amintiți-vă principalul!
1. Hidrocarburile nesaturate participă activ la reacțiile de adiție.
2. Reactivitatea alchenelor se datorează faptului că legătura se rupe ușor sub influența reactanților.
3. Ca urmare a adăugării, trecerea atomilor de carbon de la sp 2 la sp 3 - are loc o stare hibridă. Produsul de reacție are un caracter limitativ.
4. Când etilena, propilena și alte alchene sunt încălzite sub presiune sau în prezența unui catalizator, moleculele lor individuale sunt combinate în lanțuri lungi - polimeri. Polimerii (polietilenă, polipropilenă) sunt de mare importanță practică.
3. Aplicarea alchenelor(mesajul elevului conform următorului plan).
1 – producerea de combustibil cu cifră octanică mare;
2 – materiale plastice;
3 – explozivi;
4 – antigel;
5 – solvenți;
6 – pentru a accelera coacerea fructelor;
7 – producerea de acetaldehidă;
8 – cauciuc sintetic.
III. Consolidarea materialului învățat

Teme pentru acasă:§§ 15, 16, ex. 1, 2, 3 p. 90, ex. 4, 5 p. 95.
Alchine, derivați de halogen, alcooli, polimeri și altele. Principala problemă a hidrocarburilor nesaturate este absența lor aproape completă în natură; în cea mai mare parte, substanțele din această serie specială sunt extrase în laborator prin sinteză chimică. Pentru a înțelege caracteristicile reacțiilor pentru producerea de alchene, trebuie să înțelegeți structura lor.
Ce sunt alchenele?
Alchenele sunt substanțe organice care constau din atomi de carbon și hidrogen. O caracteristică specială a acestei serii sunt legăturile duble covalente: sigma și pi. Ele determină proprietățile chimice și fizice ale substanțelor. Punctul lor de topire este mai mic decât cel al alcanilor corespunzători. De asemenea, alchenele diferă de această serie „de bază” de hidrocarburi prin prezența unei reacții de adiție, care are loc prin ruperea legăturii pi. Ele se caracterizează prin patru tipuri de izomerie:
- după poziţia dublei legături;
- prin modificări ale scheletului de carbon;
- interclasare (cu cicloalcani);
- geometrice (cis- și trans-).
Un alt nume pentru această serie de substanțe este olefine. Acest lucru se datorează asemănării lor cu acizii carboxilici polihidroxici, care au o legătură dublă în compoziția lor. Nomenclatura alchenelor diferă prin aceea că primul atom din lanțul de carbon este determinat de plasarea unei legături multiple, a cărei poziție este indicată și în numele substanței.
Cracarea este metoda principală de producere a alchenelor
Cracarea este un tip de rafinare a petrolului la temperaturi ridicate. Scopul principal al acestui proces este obținerea de substanțe cu greutate moleculară mai mică. Cracarea pentru a produce alchene are loc în timpul descompunerii alcanilor care fac parte din produsele petroliere. Acest lucru se întâmplă la temperaturi cuprinse între 400 și 700 °C. În timpul acestei reacții pentru producerea de alchene, pe lângă substanța care a fost scopul implementării acesteia, se formează un alcan. Numărul total de atomi de carbon înainte și după reacție este același.

Alte metode industriale de producere a alchenelor
Este imposibil să vorbim în continuare despre alchene fără a menționa reacția de dehidrogenare. Pentru a o realiza, se ia un alcan, în care se poate forma o legătură dublă după eliminarea a doi atomi de hidrogen. Adică metanul nu va intra în această reacție. Prin urmare, o serie de alchene încep cu etilena. Condițiile speciale pentru reacție sunt temperatura ridicată și un catalizator. Acesta din urmă poate fi oxid de nichel sau crom (III). Reacția va avea ca rezultat producerea unei alchene cu numărul corespunzător de atomi de carbon și a unui gaz incolor (hidrogen).
O altă metodă industrială de extragere a substanțelor din această serie este hidrogenarea alchinelor. Această reacție de a produce alchene are loc la temperaturi ridicate și cu participarea unui catalizator (nichel sau platină). Mecanismul de hidrogenare se bazează pe ruperea uneia dintre cele două legături pi ale alchinei furnizate, după care se adaugă atomi de hidrogen la locurile de distrugere.

Metoda de laborator folosind alcool
Una dintre cele mai simple și mai ieftine metode este deshidratarea intramoleculară, adică eliminarea apei. Când scrieți ecuația de reacție, merită să ne amintim că aceasta se va desfășura conform regulii lui Zaitsev: hidrogenul va fi separat de atomul de carbon cel mai puțin hidrogenat. Temperatura ar trebui să fie peste 150 °C. Ca catalizator, trebuie să utilizați substanțe cu proprietăți higroscopice (capabile să atragă umiditatea), de exemplu, acidul sulfuric. Se va forma o dublă legătură la locul unde gruparea hidroxil și hidrogenul sunt îndepărtate. Rezultatul reacției va fi alchena corespunzătoare și o moleculă de apă.

Extracție în laborator pe bază de derivați de halogen
Mai sunt două metode de laborator. Prima este acțiunea unei soluții alcaline asupra derivaților de alcani, care conțin un atom de halogen. Această metodă se numește dehidrohalogenare, adică eliminarea compușilor cu hidrogen cu elemente nemetalice din grupa șapte (fluor, brom, clor, iod). Implementarea mecanismului de reacție, ca și în cazul precedent, se desfășoară conform regulii lui Zaitsev. Condițiile de catalizare sunt o soluție de alcool și o temperatură ridicată. După reacție, se formează o alchenă, o sare a unui element metalic al unui alcalin și a unui halogen și apă.
A doua metodă este foarte asemănătoare cu cea anterioară. Se realizează folosind un alcan, care conține doi halogeni. O astfel de substanță este afectată de un metal activ (zinc sau magneziu) în prezența unei soluții de alcool și a unei temperaturi ridicate. Reacția va avea loc numai dacă hidrogenul este înlocuit cu un halogen la doi atomi de carbon adiacenți; dacă condiția nu este îndeplinită, atunci nu se va forma o legătură dublă.
De ce trebuie să luați zinc și magneziu? În timpul reacției, metalul este oxidat, ceea ce poate ceda doi electroni, iar doi halogeni sunt eliminați. Dacă luați elemente alcaline, acestea vor reacționa cu apa care se află în soluția de alcool. În ceea ce privește metalele care vin după magneziu și zinc din seria Beketov, acestea vor fi prea slabe.
Alchenele- hidrocarburi nesaturate, care conțin o dublă legătură. Exemple de alchene:

Metode de obţinere a alchenelor.
1. Cracarea alcanilor la 400-700°C. Reacția are loc printr-un mecanism de radicali liberi:

2. Dehidrogenarea alcanilor:
3. Reacția de eliminare (eliminare): se elimină 2 atomi sau 2 grupe de atomi din atomii de carbon vecini și se formează o legătură dublă. Astfel de reacții includ:
A) Deshidratarea alcoolilor (încălzire peste 150°C, cu participarea acidului sulfuric ca reactiv de eliminare a apei):
B) Eliminarea halogenurilor de hidrogen atunci când sunt expuse la o soluție alcalină alcoolică:

Atomul de hidrogen este separat în mod preferenţial de atomul de carbon care este legat de mai puţini atomi de hidrogen (atomul cel mai puţin hidrogenat) - regula lui Zaitsev.
B) Dehalogenare:

Proprietățile chimice ale alchenelor.
Proprietățile alchenelor sunt determinate de prezența unei legături multiple, prin urmare alchenele intră în reacții de adiție electrofile, care au loc în mai multe etape (H-X - reactiv):
etapa 1:

a 2-a etapa:
 .
.
Ionul de hidrogen din acest tip de reacție aparține atomului de carbon care are o sarcină mai negativă. Distribuția densității este:

Dacă substituentul este un donor, ceea ce manifestă efectul +I-, atunci densitatea electronică se deplasează către atomul de carbon cel mai hidrogenat, creând asupra acestuia o sarcină parțial negativă. Reacțiile merg conform regula lui Markovnikov: la unirea unor molecule polare ca NH (acid clorhidric, HCN, HOH etc.) la alchenele nesimetrice, hidrogenul se atașează de preferință de atomul de carbon mai hidrogenat la dubla legătură.
A) Reacții de adiție:
1) Hidrohalogenare:
Reacția urmează regula lui Markovnikov. Dar dacă peroxidul este prezent în reacție, atunci regula nu este luată în considerare:
2) Hidratarea. Reacția urmează regula lui Markovnikov în prezența acidului fosforic sau sulfuric:

3) Halogenare. Ca rezultat, apa de brom devine decolorată - aceasta este o reacție calitativă la o legătură multiplă:
4) Hidrogenarea. Reacția are loc în prezența catalizatorilor.
DEFINIȚIE
Alchenele se numesc hidrocarburi nesaturate ale caror molecule contin o legatura dubla. Structura moleculei de alchenă folosind etilena ca exemplu este prezentată în Fig. 1.
Orez. 1. Structura moleculei de etilenă.
În ceea ce privește proprietățile fizice, alchenele diferă puțin de alcanii cu același număr de atomi de carbon în moleculă. Omologii inferiori C 2 - C 4 în condiții normale sunt gazele; C5 - C17 - lichide; omologii superiori sunt solide. Alchenele sunt insolubile în apă. Foarte solubil în solvenți organici.
Prepararea alchenelor
În industrie, alchenele se obțin în timpul rafinării petrolului: cracarea și dehidrogenarea alcanilor. Am împărțit metodele de laborator pentru obținerea alchenelor în două grupe:
- Reacții de eliminare
– deshidratarea alcoolilor
CH3-CH2-OH → CH2=CH2 + H20 (H2S04 (conc), t0 = 170).
— dehidrohalogenarea monohaloalcanilor
CH3-CH(Br)-CH2-CH3 + NaOH alcool → CH3-CH=CH-CH3 + NaBr + H20 (t0).
— dehalogenarea dihaloalcanilor
CH3-CH(CI)-CH(CI)-CH2-CH3 + Zn(Mg) → CH3-CH=CH-CH2-CH3 + ZnCI2 (MgCI2).
- Hidrogenarea incompletă a alchinelor
CH≡CH + H2 →CH2 =CH2 (Pd, t0).
Proprietățile chimice ale alchenelor
Alchenele sunt compuși organici foarte reactivi. Acest lucru se explică prin structura lor. Chimia alchenelor este chimia legăturilor duble. Reacțiile tipice pentru alchene sunt reacțiile de adiție electrofile.
Transformările chimice ale alchenelor au loc cu scindare:
1) Legături π-C-C (adăugare, polimerizare și oxidare)
- hidrogenare
CH3-CH=CH2 + H2 → CH3-CH2-CH2 (kat = Pt).
- halogenare
CH3-CH2-CH=CH2+Br2 → CH3-CH2-CH(Br)-CH2Br.
— hidrohalogenare (se procedează conform regulii lui Markovnikov: un atom de hidrogen se atașează în mod preferențial la un atom de carbon mai hidrogenat)
CH3-CH=CH2 + H-CI → CH3-CH(CI)-CH3.
- hidratare
CH2 =CH2 + H-OH → CH3-CH2-OH (H+, t0).
- polimerizare
nCH2 =CH2 → -[-CH2-CH2-]-n (kat, t0).
- oxidare
CH2 =CH2 + 2KMn04 + 2KOH → HO-CH2-CH2-OH + 2K2Mn04;
2CH2 =CH2 + O2 → 2C2OH4 (epoxid) (kat = Ag,t0);
2CH2 =CH2 + O2 → 2CH3-C(O)H (kat = PdCI2, CuCl).
2) legături σ- și π-C-C
CH3-CH=CH-CH2-CH3 + 4[O] → CH3COOH + CH3CH2COOH (KMn04, H+, t0).
3) legături C sp 3 -H (în poziție alilică)
CH2 =CH2 + CI2 → CH2 =CH-CI + HCI (t0 =400).
4) Ruperea tuturor legăturilor
C2H4 + 2O2 → 2CO2 + 2H20;
CnH2n + 3n/2O2 → nCO2 + nH2O.
Aplicații ale alchenelor
Alchenele și-au găsit aplicații în diverse sectoare ale economiei naționale. Să ne uităm la exemplul reprezentanților individuali.
Etilena este utilizată pe scară largă în sinteza organică industrială pentru a produce o varietate de compuși organici, precum derivați de halogen, alcooli (etanol, etilen glicol), acetaldehidă, acid acetic etc. Etilena este consumată în cantități mari pentru producerea polimerilor.
Propilena este folosită ca materie primă pentru producerea unor alcooli (de exemplu, 2-propanol, glicerină), acetonă etc. Polipropilena este produsă prin polimerizarea propilenei.
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | Când s-a hidrolizat cu o soluție apoasă de hidroxid de sodiu diclorură de NaOH, obținută prin adăugarea a 6,72 litri de clor la hidrocarbură de etilenă, s-au format 22,8 g de alcool dihidroxilic. Care este formula alchenei dacă se știe că reacțiile se desfășoară în randamente cantitative (fără pierderi)? |
| Soluţie | Să scriem ecuația pentru clorurarea unei alchene în formă generală, precum și reacția pentru producerea unui alcool dihidroxilic: CnH2n + CI2 = CnH2nCI2 (1); CnH2nCI2 + 2NaOH = CnH2n (OH)2 + 2HCI (2). Să calculăm cantitatea de clor: n(CI2) = V(CI2)/Vm; n(Cl2) = 6,72 / 22,4 = 0,3 mol, prin urmare, diclorura de etilenă va fi, de asemenea, 0,3 moli (ecuația 1), alcoolul dihidric ar trebui să fie și 0,3 moli și, în funcție de condițiile problemei, aceasta este de 22,8 g. Aceasta înseamnă că masa sa molară va fi egală cu: M(CnH2n(OH)2) = m(CnH2n(OH)2)/n(CnH2n(OH)2); M(CnH2n(OH)2) = 22,8/0,3 = 76 g/mol. Să aflăm masa molară a alchenei: M(C n H 2 n) = 76 - (2×17) = 42 g/mol, care corespunde formulei C3H6. |
| Răspuns | Formula alchenă C3H6 |
EXEMPLUL 2
| Exercițiu | Câte grame vor fi necesare pentru a bromura 16,8 g dintr-o alchenă, dacă se știe că în timpul hidrogenării catalitice a aceleiași cantități de alchenă s-au adăugat 6,72 litri de hidrogen? Care este compoziția și structura posibilă a hidrocarburii originale? |
| Soluţie | Să scriem în formă generală ecuațiile pentru bromurarea și hidrogenarea unei alchene: CnH2n + Br2 = CnH2nBr2 (1); CnH2n + H2 = CnH2n +2 (2). Să calculăm cantitatea de substanță hidrogen: n(H2) = V(H2)/Vm; n(H2) = 6,72 / 22,4 = 0,3 mol, prin urmare, alchena va fi, de asemenea, 0,3 mol (ecuația 2), iar în funcție de condițiile problemei este de 16,8 g. Aceasta înseamnă că masa sa molară va fi egală cu: M(CnH2n) = m(CnH2n)/n(CnH2n); M(CnH2n) = 16,8 / 0,3 = 56 g/mol, care corespunde formulei C4H8. Conform ecuației (1) n(C n H 2 n) : n(Br 2) = 1:1, adică. n(Br2) = n(CnH2n) = 0,3 mol. Să aflăm masa bromului: m(Br2) = n(Br2) × M(Br2); M(Br2) = 2×Ar(Br) = 2×80 = 160 g/mol; m(MnO2) = 0,3 × 160 = 48 g. Să creăm formulele structurale ale izomerilor: buten-1 (1), buten-2 (2), 2-metilpropenă (3), ciclobutan (4). CH2 =CH-CH2-CH3 (1); CH3-CH=CH-CH3 (2); CH2=C(CH3)-CH3(3); |
| Răspuns | Masa de brom este de 48 g |