Skiriasi panašiomis savybėmis ir vienija bendra formulė, apibūdinanti kiekvieno paskesnio grupės nario struktūrinio skirtumo dėsningumą nuo ankstesnio. Pavyzdžiui, homologinės alkanų serijos arba kitos grupės. yra labai svarbus tyrimams, prognozėms ar praktiniam taikymui. Organinėms medžiagoms, sujungtoms į grupę, stebimi reguliarūs cheminių ir fizinių savybių pokyčiai, ir visi jie koreliuoja su molekulinės masės pokyčiu.
Ne mažiau svarbios yra taisyklės, nusakančios, kaip keičiasi medžiagų savybės pereinant iš vienos grupės į kitą. Norint suprasti, kas yra homologinė serija, reikėtų atsižvelgti į konkrečius pavyzdžius. Bet kuriai junginių grupei būdinga didėjanti lydymosi (kristalizacija), virimo (kondensacijos) ir tankio temperatūra, didėjant molekulinei masei ir anglies atomų skaičiui molekulėje.
Jie vadinami sočiaisiais arba parafinais; tai acikliniai (ciklų nėra) normalios arba šakotos struktūros junginiai, kurių molekulėse atomai yra sujungti viengubomis jungtimis. Bendroji formulė turi formą CnH2n+2 ir apibūdina homologinę alkanų seriją. Kiekvieno kito nario molekulė, palyginti su ankstesne, padidėja vienu C atomu ir dviem H atomais. K apima:
- metanas;
- etanas;
- propanas ir pan.
Jie taip pat apima cikloparafinus. Tai didelė grupė organinių junginių, kurių molekulės yra uždarytos žiedais. Jų homologinė serija turi formulę CnH2n, pradedant chemine medžiaga su trimis anglies atomais. Cikloparafinų pavyzdžiai:
- ciklopropanas;
- ciklobutanas;
- ciklopentanas ir pan
Nesotieji arba nesotieji angliavandeniliai taip pat yra acikliniai. Tai apima normalios ir izostruktūros medžiagas. Homologinė alkenų serija turi bendrą formulę CnH2n. Šie junginiai išsiskiria tuo, kad tarp dviejų anglies atomų yra viena dviguba jungtis. Jei ankstesnė serija prasidėjo nuo angliavandenilio su vienu anglies atomu (metanu), tai ši prasideda medžiaga, kurios molekulėje yra du anglies atomai. Alkenų pavyzdžiai:
- etenas;
- propenas;
- butenas ir pan.
Angliavandeniliai, kurių molekulėje du anglies atomai yra sujungti triguba jungtimi, yra dar labiau nesotieji, kitaip vadinami acetilenais. Juos vienija homologinė alkinų serija. Jis apibūdinamas formule CnH2n-2 ir prasideda acetilenu, kurio formulėje yra du C atomai.Alkinų pavyzdžiai:
- etinas;
- propinas;
- butin-1 ir pan.
Nesotieji acikliniai angliavandeniliai, kurių molekulėje yra dvi dvigubos jungtys, vadinami dienais. Jie turi bendrą formulę CnH2n-2. Jų homologinė serija prasideda angliavandeniliu, kurio molekulėje yra trys anglies atomai. Dvigubos jungtys gali būti konjuguotos (atskirtos viena vienintele jungtimi), kumuliuotos (esančios gretimuose atomuose) arba izoliuotos (atskirtos keliomis pavienėmis jungtimis). Dienų pavyzdžiai:
- 1,2-propadienas;
- 1,3-butadienas;
- izoprenas ir pan
Specialią grupę sudaro ciklinės struktūros, kurių molekulėje yra benzeno žiedas. Paprasčiausių aromatinių angliavandenilių homologinė serija prasideda junginiu su šešiais anglies atomais – benzenu. serijos susidaro, kai vienas ar keli vandenilio atomai, prijungti prie benzeno žiedo, pakeičiami radikalais. Taip gaunama nemažai medžiagų: benzeno, tolueno, ksileno. Jei molekulėje yra du ar daugiau pakaitų, jie kalba apie šių medžiagų izomerų buvimą. Kitos homologinės aromatinių junginių serijos susidaro iš naftaleno, antraceno ir kitų medžiagų.
Jei angliavandenilio molekulėje yra funkcinė grupė, tai tokie cheminiai junginiai taip pat sudaro homologinę seriją.
- Daugelis alkoholių išsiskiria tuo, kad molekulėje yra hidroksilo grupė (-OH). Vienahidroksilių alkoholių atveju vienas vandenilio atomas acikliniame angliavandenilyje pakeičiamas hidroksilo grupe; jų formulė: CnH2n+1OH. Taip pat yra eilučių
- Daugeliui fenolių taip pat būdinga hidroksilo grupės (-OH) buvimas molekulėje, tačiau ji pakeičia vandenilį benzeno žiede.
- Nemažai aldehidų išsiskiria tuo, kad cheminio junginio molekulėje yra karbonilo grupė (>C=O); bendroji aldehidų formulė: R-CH=O.
- Nemažai ketonų taip pat išsiskiria karbonilo grupės buvimu (> C \u003d O), tačiau jei aldehiduose jis yra prijungtas prie vieno radikalo, tada ketonuose yra du angliavandenilių radikalai. Ketonų formulė: R1-CO-R2.
- Nemažai karboksilo rūgščių iš kitų cheminių medžiagų skiriasi karboksilo grupe, jungiančia karbonilo ir hidroksilo grupes. Formulė yra RCOOH.
Kiekvienoje serijoje, nesvarbu, ar tai būtų homologinė aldehidų, karboksirūgšties (organinių) rūgščių, alkoholių ar kitų medžiagų serija, jų savybės daugiausia priklausys nuo funkcinės grupės tipo ir natūraliai keisis didėjant molekulinei masei. medžiaga. Tokia didžiulės cheminių junginių klasės klasifikacija padeda suprasti gamtą ir ištirti jų savybes.
Alkanai yra angliavandenilių klasė, kurios bendroji formulė C n H 2n+2. Susiję junginiai, kurie skiriasi viena metileno grupe -CH2 - sudaro homologinę alkanų seriją. Paprasčiausia šios serijos medžiaga yra metanas su vienu anglies atomu (CH 4).
homologai
Giminingi junginiai – homologai – chemiškai panašūs, tačiau turi skirtingas fizines savybes. Priklausomai nuo anglies atomų skaičiaus, išskiriami dujiniai, skysti, kietieji alkanai. Pirmieji keturi atstovai yra dujos, homologai su 5-15 anglies atomų yra degūs skysčiai. Aukštesni alkanai yra vaškai ir kietos medžiagos, turinčios 16-390 anglies atomų.

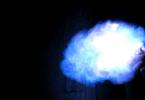
Ryžiai. 1. Metano deginimas.
Alkanų pavadinimai išsiskiria priesaga -an po graikiško skaičiaus pavadinimo:
- un- arba gene- vienas;
- to- - du;
- trys - trys;
- tetra---keturi;
- pent - penki;
- šešiakampis - šeši;
- hept- - septyni;
- spalis - aštuoni;
- ne - devyni;
- gruodis - dešimt.
Pirmųjų keturių homologų pavadinimai yra fiksuoti istoriškai. Kas dešimtas vardas „pereina“ į kitas devynias substancijas, išsaugant skaitvardžių priešdėlį ir klasės galūnę. Alkanų homologinės serijos lentelėje aprašyti pirmieji 20 homologų.
|
vardas |
Formulė |
Fizinės savybės |
|
Dujos. Jie dega mėlyna liepsna, išskirdami daug šilumos. |
||
|
Degūs aliejiniai skysčiai. Yra aliejuje. Naudojamas skystam kurui gaminti – benzinui, žibalui, mazutui |
||
|
Tridecan |
||
|
Tetradekanas |
||
|
Pentadekanas |
||
|
Heksadekanas |
Vaškas ir kietos medžiagos. Naudojamas vazelinui, parafinui gaminti |
|
|
Heptadekanas |
||
|
oktadekanas |
||
|
Nanadekanas |
||
Alkanų lydymosi ir virimo temperatūra didėja didėjant anglies atomų skaičiui ir atitinkamai molekulinei masei. Tuo pačiu metu visų alkanų tankis yra mažesnis už vienybę. Alkanai plūduriuoja vandens paviršiuje ir tirpsta tik organiniuose tirpikliuose.
Izomerai
Alkanai yra necikliniai sotieji angliavandeniliai. Molekulės yra ilgos arba šakotos anglies grandinės. Homologiniai alkanai gali sudaryti izomerus. Kuo daugiau anglies atomų, tuo daugiau izomerų variantų. Pirmieji trys alkanai (metanas, etanas, propanas) nesudaro izomerų. Butanas, pentanas, heksanas turi tik struktūrinius izomerus. Butanas turi du: n-butaną ir izobutaną. Pentanas sudaro n-pentaną, izopentaną, neopentaną. Heksanas turi penkis izomerus: n-heksaną, izoheksaną, 3-metilpentaną, diizopropilą, neoheksaną.
Heptano ir aukštesnio lygio homologai, be struktūrinių izomerų, sudaro stereoizomerus arba erdvinius izomerus, kurie skiriasi atomų padėtimi erdvėje. Dvi molekulės yra identiškos savo struktūra ir struktūra, tačiau atrodo kaip objektas ir jo veidrodinis vaizdas.

Ryžiai. 2. Stereoizomerai.
Ilgieji izomerų pavadinimai sudaryti pagal tarptautinę IUPAC nomenklatūrą. Žodinis žymėjimas susideda iš trijų dalių:
- numeriai ir priešdėliai, nurodantys susijusių grupių skaičių;
- grupių pavadinimai;
- pagrindinės (ilgiausios) grandinės pavadinimas.
Pavyzdžiui, heptano izomero pavadinimas 2,3-dimetilpentanas rodo, kad molekulę sudaro penki anglies atomai (pentanas) ir dvi metilo grupės, prijungtos prie antrojo ir trečiojo anglies atomų.
Izomerų struktūrai parodyti naudojamos struktūrinės formulės. -CH3 metilo grupė parašyta arba per eilutę aukštyn arba žemyn nuo anglies atomo, arba skliausteliuose po -CH2 grupės anglies grandinėje. Pavyzdžiui, H3C-CH2-CH(CH2CH3)-CH2-CH3.

Ryžiai. 3. Struktūrinė formulė.
Kiekvieno alkano izomerų skaičių galima apskaičiuoti matematiškai. Todėl daugelis izomerų egzistuoja tik teoriškai. Daroma prielaida, kad hektanas (C 100 H 202) gali turėti 592 107 ∙ 10 34 izomerus, ir tai toli gražu nėra paskutinis alkanas homologinėje serijoje.
Ko mes išmokome?
Alkanai susidaro iš homologinės metano serijos, kurios bendroji formulė C n H 2n+2. Kiekvienas paskesnis homologas nuo ankstesnio skiriasi viena CH 2 grupe. Didėjant anglies atomų kiekiui homologinėje serijoje, keičiasi medžiagų fizinė būsena. Aukštesni alkanai yra junginiai, kuriuose yra daugiau nei 15 anglies atomų. Tai kietos medžiagos. Skysčiuose yra 5-15 anglies atomų, dujose - 1-4. Pradedant nuo ketvirtojo homologo, visi alkanai sudaro struktūrinius izomerus. Be to, alkanai iš heptano ir daugiau gali sudaryti stereoizomerus.
Temos viktorina
Ataskaitos įvertinimas
Vidutinis reitingas: 4.2. Iš viso gautų įvertinimų: 212.
Riboti (sočiųjų) angliavandenilių kiekį vadinami angliavandeniliais, kurių molekulėse anglies atomai yra sujungti paprasta jungtimi, o visi valentiniai vienetai, nepanaudoti ryšiui tarp anglies atomų, yra prisotinti vandenilio atomų.
Sočiųjų angliavandenilių atstovai yra metanas CH 4 ; etanas C2H6; propanas C3H8; butanas C4H10; pentanas C5H12; heksanas C 6 H 14 . Tačiau šią seriją galima tęsti. Yra angliavandenių C 30 H 62, C 50 H 102, C 70 H 142, C 100 H 202.
Jei atsižvelgsime į metano serijos angliavandenilius, nesunku pastebėti, kad kiekvienas paskesnis angliavandenilis gali būti pagamintas iš atitinkamo ankstesnio, pakeičiant vieną vandenilio atomą CH 3 (metilo) grupe. Taigi vėlesnės angliavandenilio molekulės sudėtis padidėja CH 2 grupe.
Daugybė to paties struktūrinio tipo cheminių junginių, kurie vienas nuo kito skiriasi vienu ar keliais struktūriniais vienetais (dažniausiai CH 2 grupe), vadinama homologine serija, ir kiekvienas iš angliavandenių – homologinės serijos ar homologo narys. Jei homologus išdėstysime jų santykinės molekulinės masės didėjimo tvarka, jie sudaro homologinę seriją.
CH 2 grupė vadinama homologiniu skirtumu arba homologiniu skirtumu. Bendroji sočiųjų angliavandenilių formulė yra C n H 2 n + 2, kur n – anglies atomų skaičius molekulėje.
Jei iš angliavandenilio molekulės atimamas vandenilio atomas, tai likusi molekulės dalis su atvira jungtimi vadinama angliavandenilio radikalu (žymima raide R). Laisvieji radikalai neegzistuoja dėl didelio jų reaktyvumo.
homologijos reiškinys– organinių junginių serijų, kuriose bet kurių dviejų eilės kaimynų formulė skiriasi ta pačia grupe (dažniausiai CH 2), egzistavimas. Junginių fizikinės ir cheminės savybės keičiasi išilgai homologinės serijos. Organinėje chemijoje homologijos samprata remiasi pamatine pozicija, kad chemines ir fizines junginio savybes lemia jo molekulių struktūra: šias savybes lemia ir junginio funkcinės grupės, ir jo anglies skeletas.
 Visą cheminių savybių kompleksą, taigi ir junginio priskyrimą tam tikrai klasei, lemia būtent funkcinės grupės, tačiau cheminių savybių ar fizikinių savybių pasireiškimo laipsnis priklauso nuo molekulės anglies skeleto.
Visą cheminių savybių kompleksą, taigi ir junginio priskyrimą tam tikrai klasei, lemia būtent funkcinės grupės, tačiau cheminių savybių ar fizikinių savybių pasireiškimo laipsnis priklauso nuo molekulės anglies skeleto.
Jei panašių junginių anglies skeletų izomerijos nėra, homologinių junginių formulė gali būti parašyta kaip X – (CH2) n – Y, junginiai su skirtingu n metileno vienetų skaičiumi yra homologai ir priklauso tai pačiai junginių klasei. Taigi homologiniai junginiai priklauso tai pačiai junginių klasei, o artimiausių homologų savybės yra artimiausios.
Homologinėse serijose yra tam tikras reguliarus savybių pokytis nuo jaunesnių serijos narių iki vyresnių, tačiau šis modelis ne visada pastebimas, kai kuriais atvejais jis gali būti pažeistas. Dažniausiai tai atsitinka serijos pradžioje, nes vandenilio ryšiai susidaro esant funkcinėms grupėms, galinčioms jas sudaryti.
Homologinės serijos pavyzdys yra sočiųjų angliavandenilių (alkanų) serija. Paprasčiausias jos atstovas – metanas CH4. Metano homologai yra: etanas C 2 H 6 ; propanas C3H8; butanas C4H10; pentanas C5H12; heksanas C 6 H 14, heptanas C 7 H 16, oktanas - C 8 H 18, nonanas - C 9 H 20, dekanas - C 10 H 22, undekanas - C 11 H 24, nodekanas – C12H26, tridekanas – C13H28, tetradekanas – C14H30, pentadekanas – C 15 H 32, eikozanas - C 20 H 42, pentakozanas - C 25 H 52, triakontanas - C 30 H 62, tetrakontanas - C 40 H 82, hektanas - C 100 H 202.
Ar turite kokių nors klausimų? Ar žinote, kas yra homologinė serija?
Norėdami gauti korepetitoriaus pagalbą – registruokitės.
Pirma pamoka nemokama!
svetainę, visiškai ar iš dalies nukopijavus medžiagą, būtina nuoroda į šaltinį.
Iš Vikipedijos, laisvosios enciklopedijos
 Homologinė serija- daugybė to paties struktūrinio tipo cheminių junginių (pavyzdžiui, alkanai arba alifatiniai alkoholiai - riebalų alkoholiai), kurie vienas nuo kito skiriasi tam tikru skaičiumi pasikartojančių struktūrinių vienetų - vadinamieji. homologinis skirtumas. Homologai- medžiagos, priklausančios tai pačiai homologinei serijai.
Homologinė serija- daugybė to paties struktūrinio tipo cheminių junginių (pavyzdžiui, alkanai arba alifatiniai alkoholiai - riebalų alkoholiai), kurie vienas nuo kito skiriasi tam tikru skaičiumi pasikartojančių struktūrinių vienetų - vadinamieji. homologinis skirtumas. Homologai- medžiagos, priklausančios tai pačiai homologinei serijai.
Paprasčiausias homologinės serijos pavyzdys yra alkanai (bendroji formulė C n H 2n+2): metanas CH 4, etanas C 2 H 6, propanas C 3 H 8 ir kt.; šios serijos homologinis skirtumas yra metileno vienetas -CH 2 -.
Junginių homologija ir struktūra
Homologijos samprata organinėje chemijoje grindžiama pagrindine nuostata, kad chemines ir fizines medžiagos savybes lemia jos molekulių struktūra: šios savybės apibrėžiamos kaip junginio funkcinės grupės (hidroksilo alkoholiai, karboksilo rūgščių karboksilo grupė). , aromatinių junginių arilo grupė ir kt.) ir jos anglies skeletas.
Pats cheminių savybių kompleksas ir atitinkamai junginio priklausymas tam tikrai klasei yra tiksliai nulemtas funkcinių grupių (pavyzdžiui, karboksilo grupės buvimas lemia junginio rūgščių savybių pasireiškimą ir jo priklausymą karboksirūgščių klasė), tačiau cheminių savybių (pavyzdžiui, reaktyvumo ir disociacijos konstantos) arba fizikinių savybių (virimo ir lydymosi temperatūra, lūžio rodiklis ir kt.) pasireiškimo laipsnis taip pat turi įtakos molekulės anglies skeletui (žr. . 1).
Esant junginių anglies skeletų panašumui, ty nesant izomerizmo, homologinių junginių formulė gali būti parašyta kaip X-(CH2)n-Y, junginiai su skirtingu skaičiumi n metileno vienetai yra homologai ir priklauso tai pačiai junginių klasei (pvz., H-(CH2)n-COOH- alifatinės karboksirūgštys). Taigi homologiniai junginiai priklauso tai pačiai junginių klasei, o artimiausių homologų savybės yra artimiausios.
Homologinėse serijose reguliariai keičiasi savybės iš jaunesnių serijos narių į senesnius, tačiau šis modelis gali būti pažeistas, visų pirma, serijos pradžioje dėl vandenilinių jungčių susidarymo. esant funkcinėms grupėms, galinčioms jas susidaryti (žr. 2 pav. Lydymosi temperatūra).
Tirdamas paveldimo kintamumo reiškinių paralelumus, N. I. Vavilovas pagal analogiją su homologinėmis organinių junginių serijomis įvedė sąvoką Homologinė paveldimo kintamumo serija.
taip pat žr
Parašykite apžvalgą apie straipsnį "Homologinė serija"
Ištrauka, apibūdinanti seriją „Homological“.
Po princo Andrejaus Borisas priėjo prie Natašos, pakviesdamas ją šokti, ir tą adjutantą šokėją, kuri pradėjo balių, ir dar jaunus žmones, o Nataša, laiminga ir paraudusi perleisdama savo perteklinius ponus Sonyai, nenustojo šokti visą vakarą. Ji nepastebėjo ir nematė nieko, kas šiame baliuje visus užėmė. Ji ne tik nepastebėjo, kaip valdovas ilgą laiką kalbėjosi su prancūzų pasiuntiniu, kaip jis ypač maloniai kalbėjo su tokia ir tokia ponia, kaip princas padarė taip ir taip ir sakė, kaip Helenai puikiai sekėsi ir susilaukė ypatingo dėmesio. ir panašiai; ji net nematė suvereno ir pastebėjo, kad jis išvyko tik todėl, kad jam išvykus kamuolys tapo gyvesnis. Viename iš linksmų kotilijų prieš vakarienę princas Andrejus vėl šoko su Nataša. Jis priminė jai pirmąjį jų susitikimą Otradnenskaya alėjoje ir tai, kaip ji negalėjo užmigti mėnulio apšviestą naktį ir kaip jis negalėjo jos negirdėti. Nataša raudonavo išgirdusi šį priminimą ir bandė teisintis, tarsi jausme, kurį princas Andrejus netyčia išgirdo, būtų kažkas gėdingo.
Princas Andrejus, kaip ir visi žmonės, užaugę pasaulyje, mėgo sutikti pasaulyje tai, kas neturėjo bendro pasaulietinio įspaudo. Ir tokia buvo Nataša su savo nuostaba, džiaugsmu ir nedrąsumu ir net klaidomis prancūzų kalba. Jis kalbėjo su ja ypač švelniai ir atsargiai. Sėdėdamas šalia jos, kalbėdamas su ja paprasčiausiomis ir nereikšmingiausiomis temomis, princas Andrejus žavėjosi džiaugsmingu jos akių blizgesiu ir šypsena, susijusia ne su ištartomis kalbomis, o su vidine laime. Kol buvo išrinkta Nataša, ji šypsodamasi atsikėlė ir šoko po salę, princas Andrejus ypač žavėjosi jos nedrąsia malone. Kolijono viduryje Nataša, baigusi figūrą, vis dar sunkiai kvėpuodama priartėjo prie savo vietos. Naujasis džentelmenas vėl ją pakvietė. Ji buvo pavargusi ir praradusi kvapą ir, matyt, galvojo atsisakyti, bet iš karto vėl linksmai pakėlė ranką ant kavalieriaus peties ir nusišypsojo princui Andrejui.
„Man būtų malonu pailsėti ir pasėdėti su tavimi, aš pavargau; bet tu matai, kaip jie mane renkasi, ir aš tuo džiaugiuosi, ir aš laimingas, ir visus myliu, ir tu ir aš visa tai suprantame “, ir ta šypsena pasakė daug daugiau. Kai džentelmenas ją paliko, Nataša perbėgo per salę, kad paimtų dvi damas.
„Jei ji pirmiausia ateis pas savo pusseserę, o paskui pas kitą damą, tada ji bus mano žmona“, – gana netikėtai sau pasakė princas Andrejus, žiūrėdamas į ją. Pirmiausia ji nuėjo pas savo pusbrolį.
„Kokios nesąmonės kartais ateina į galvą! pagalvojo princas Andrejus; bet tiesa, kad ši mergina tokia miela, tokia ypatinga, kad mėnesį laiko čia nešoks ir neištekės... Tai čia retenybė“, – pagalvojo jis, kai Nataša tiesė nukritusią rožę. iš savo korsažo, atsisėdo šalia jo.
Pasibaigus kotilijonui, senas grafas mėlynu fraku priėjo prie šokėjų. Jis pasikvietė princą Andrejų pas save ir paklausė dukters, ar jai smagu? Nataša neatsakė ir tik nusišypsojo tokia šypsena, kuri priekaištingai pasakė: „Kaip tu galėjai apie tai paklausti?
– Taip smagu, kaip niekada gyvenime! - pasakė ji, o princas Andrejus pastebėjo, kaip greitai jos plonos rankos pakilo apkabinti tėvą ir iškart nukrito. Nataša buvo kaip niekada laiminga savo gyvenime. Ji buvo toje aukščiausioje laimės stadijoje, kai žmogus tampa visiškai pasitikintis ir netiki blogio, nelaimės ir sielvarto galimybe.
Pierre'as šiame baliuje pirmą kartą pasijuto įžeistas dėl pozicijos, kurią jo žmona užėmė aukštesnėse sferose. Jis buvo paniuręs ir išsiblaškęs. Jo kaktoje buvo plati raukšlė, ir jis, stovėdamas prie lango, žiūrėjo pro akinius, nieko nematęs.
Nataša, eidama vakarienės, praėjo pro jį.
Niūrus, nelaimingas Pierre'o veidas ją sužavėjo. Ji sustojo priešais jį. Ji norėjo jam padėti, perteikti jam savo laimės perteklių.
– Kaip smagu, grafe, – tarė ji, – ar ne?
Pjeras išsiblaškęs šypsojosi, akivaizdžiai nesuprasdamas, kas jam buvo sakoma.
„Taip, aš labai džiaugiuosi“, - sakė jis.
„Kaip jie gali būti kažkuo nepatenkinti“, – pagalvojo Nataša. Ypač tokį gerą kaip šis Bezukhovas? Natašos akimis, visi baliaus dalyviai buvo vienodai malonūs, mieli, nuostabūs, vienas kitą mylintys žmonės: niekas negalėjo vienas kito įžeisti, todėl visi turėjo būti laimingi.
Kitą dieną princas Andrejus prisiminė vakarykštį balių, bet ilgai prie jo negalvojo. „Taip, kamuolys buvo labai puikus. Ir vis dėlto... taip, Rostova labai graži. Ją išskiria ne Sankt Peterburgas, o kažkas šviežio, ypatingo. Tik tiek pagalvojo apie vakarykštį balių ir išgėręs arbatos sėdo prie darbo.
Tačiau nuo nuovargio ar nemigos (diena nebuvo palanki pamokoms, o princas Andrejus nieko negalėjo padaryti) jis pats kritikavo savo darbą, kaip jam dažnai nutikdavo, ir apsidžiaugė, kai išgirdo, kad kažkas atvyko.
Atvyko Bitskis, dirbęs įvairiose komisijose, aplankęs visas Sankt Peterburgo draugijas, aistringas naujų idėjų ir Speranskio gerbėjas, nerimastingas Sankt Peterburgo naujienų reporteris, vienas iš tų žmonių, kurie renkasi tokią tendenciją kaip suknelė. - pagal madą, bet kas dėl šios priežasties atrodo aršiausi tendencijų partizanai. Jis sunerimęs, vos spėjęs nusiimti skrybėlę, nubėgo pas princą Andrejų ir iškart pradėjo kalbėti. Jis ką tik sužinojo šio ryto valstybės tarybos posėdžio, kurį atidarė suverenas, detales ir entuziastingai apie tai kalbėjo. Imperatoriaus kalba buvo nepaprasta. Tai buvo viena iš tų kalbų, kurias pasakė tik konstituciniai monarchai. „Suverenas tiesiai pasakė, kad taryba ir senatas yra valstybės valdos; Jis sakė, kad valdžia turi būti grindžiama ne savivale, o tvirtais principais. Valdovas pasakė, kad finansai turi būti pertvarkyti, o ataskaitos turi būti paviešintos“, – sakė B. Bitskis, pataikydamas į gerai žinomus žodžius ir reikšmingai atvėręs akis.
Riboti (sočiųjų) angliavandenilių kiekį vadinami angliavandeniliais, kurių molekulėse anglies atomai yra sujungti paprasta jungtimi, o visi valentiniai vienetai, nepanaudoti ryšiui tarp anglies atomų, yra prisotinti vandenilio atomų.
Sočiųjų angliavandenilių atstovai yra metanas CH 4 ; etanas C2H6; propanas C3H8; butanas C4H10; pentanas C5H12; heksanas C 6 H 14 . Tačiau šią seriją galima tęsti. Yra angliavandenių C 30 H 62, C 50 H 102, C 70 H 142, C 100 H 202.
Jei atsižvelgsime į metano serijos angliavandenilius, nesunku pastebėti, kad kiekvienas paskesnis angliavandenilis gali būti pagamintas iš atitinkamo ankstesnio, pakeičiant vieną vandenilio atomą CH 3 (metilo) grupe. Taigi vėlesnės angliavandenilio molekulės sudėtis padidėja CH 2 grupe.
Daugybė to paties struktūrinio tipo cheminių junginių, kurie vienas nuo kito skiriasi vienu ar keliais struktūriniais vienetais (dažniausiai CH 2 grupe), vadinama homologine serija, ir kiekvienas iš angliavandenių – homologinės serijos ar homologo narys. Jei homologus išdėstysime jų santykinės molekulinės masės didėjimo tvarka, jie sudaro homologinę seriją.
CH 2 grupė vadinama homologiniu skirtumu arba homologiniu skirtumu. Bendroji sočiųjų angliavandenilių formulė yra C n H 2 n + 2, kur n – anglies atomų skaičius molekulėje.
Jei iš angliavandenilio molekulės atimamas vandenilio atomas, tai likusi molekulės dalis su atvira jungtimi vadinama angliavandenilio radikalu (žymima raide R). Laisvieji radikalai neegzistuoja dėl didelio jų reaktyvumo.
homologijos reiškinys– organinių junginių serijų, kuriose bet kurių dviejų eilės kaimynų formulė skiriasi ta pačia grupe (dažniausiai CH 2), egzistavimas. Junginių fizikinės ir cheminės savybės keičiasi išilgai homologinės serijos. Organinėje chemijoje homologijos samprata remiasi pamatine pozicija, kad chemines ir fizines junginio savybes lemia jo molekulių struktūra: šias savybes lemia ir junginio funkcinės grupės, ir jo anglies skeletas.
 Visą cheminių savybių kompleksą, taigi ir junginio priskyrimą tam tikrai klasei, lemia būtent funkcinės grupės, tačiau cheminių savybių ar fizikinių savybių pasireiškimo laipsnis priklauso nuo molekulės anglies skeleto.
Visą cheminių savybių kompleksą, taigi ir junginio priskyrimą tam tikrai klasei, lemia būtent funkcinės grupės, tačiau cheminių savybių ar fizikinių savybių pasireiškimo laipsnis priklauso nuo molekulės anglies skeleto.
Jei panašių junginių anglies skeletų izomerijos nėra, homologinių junginių formulė gali būti parašyta kaip X – (CH2) n – Y, junginiai su skirtingu n metileno vienetų skaičiumi yra homologai ir priklauso tai pačiai junginių klasei. Taigi homologiniai junginiai priklauso tai pačiai junginių klasei, o artimiausių homologų savybės yra artimiausios.
Homologinėse serijose yra tam tikras reguliarus savybių pokytis nuo jaunesnių serijos narių iki vyresnių, tačiau šis modelis ne visada pastebimas, kai kuriais atvejais jis gali būti pažeistas. Dažniausiai tai atsitinka serijos pradžioje, nes vandenilio ryšiai susidaro esant funkcinėms grupėms, galinčioms jas sudaryti.
Homologinės serijos pavyzdys yra sočiųjų angliavandenilių (alkanų) serija. Paprasčiausias jos atstovas – metanas CH4. Metano homologai yra: etanas C 2 H 6 ; propanas C3H8; butanas C4H10; pentanas C5H12; heksanas C 6 H 14, heptanas C 7 H 16, oktanas - C 8 H 18, nonanas - C 9 H 20, dekanas - C 10 H 22, undekanas - C 11 H 24, nodekanas – C12H26, tridekanas – C13H28, tetradekanas – C14H30, pentadekanas – C 15 H 32, eikozanas - C 20 H 42, pentakozanas - C 25 H 52, triakontanas - C 30 H 62, tetrakontanas - C 40 H 82, hektanas - C 100 H 202.
Ar turite kokių nors klausimų? Ar žinote, kas yra homologinė serija?
Norėdami gauti pagalbą iš dėstytojo -.
Pirma pamoka nemokama!
tinklaraštis.svetainė, visiškai arba iš dalies nukopijavus medžiagą, būtina nuoroda į šaltinį.