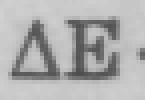Образование лиофобных дисперсных систем сопровождается увеличением свободной поверхностной энергии, поэтому дисперсные системы термодинамически неустойчивы. Однако, при определенных условиях они могут сохраняться в течение длительного времени.
Существуют два вида относительной устойчивости дисперсных систем: седиментационная и агрегативная.
Седиментационная устойчивость − это способность дисперсной системы сохранять неизменным во времени распределение частиц по объему системы, т.е. способность системы противостоять действию силы тяжести.
Действию силы тяжести противостоит диффузия. Соотношение этих факторов, т.е. седиментационная устойчивость, определяется, главным образом, размерами частиц дисперсной фазы.
Лиофобные золи (10 - 7 –10 - 5 см) - седиментационно-устойчивые системы. Здесь диффузия обеспечивает равномерное распределение частиц по объему системы.
В микрогетерогенных системах (10 - 5 − 10 - 3 см) − устанавливается седиментационно-диффузионное равновесие, для которого характерно гипсометрическое распределение частиц по объёму системы, выражающееся в распределении концентрации частиц по высоте. При этом концентрация частиц с высотой убывает.
Грубодисперсные системы (более 10 - 3 см) − седиментационно неустойчивые системы. В них происходит быстрая седиментация.
В жидкой среде зависимость скорости седиментации частиц (U) по объёму системы, выражающаяся в распределении концентрации частиц по высоте в зависимости от их радиуса, определяется уравнением Стокса:
где К - постоянная Стокса,
 ,
,
где η − вязкость среды; g − ускорение силы тяжести; ρ и ρ 0 − плотность частицы и дисперсионной среды, соответственно.
Суспензии, встречающиеся в практике, чаще всего полидисперсны, содержат частицы различных размеров. Зная скорость седиментации, можно рассчитать радиусы оседающих частиц. Седиментационный анализ суспензии, основанный на регистрации кинетики накопления осадка, составляет основу метода расчета кривых распределения вещества суспензии по радиусам частиц.
При седиментации дисперсионных систем могут наблюдаться 2 различных случая. В одном, когда каждая частица оседает отдельно, не сцепляясь с другими, оседание происходит медленно. Такая дисперсная система называется агрегативно устойчивой.
В случае, когда частицы дисперсной фазы коагулируют - сцепляются друг с другом под действием молекулярных сил и оседают в виде целых хлопьев, оседание происходит очень быстро. Такие системы называют агрегатно неустойчивыми.
Агрегативная устойчивость - это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
При нарушении агрегативной устойчивости происходит коагуляция.
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия - скрытая коагуляция . На этой стадии, не сопровождающейся внешними изменениями системы, частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия - явная коагуляция . На этой стадии частицы теряют свою седиментационную устойчивость, происходят наблюдаемые невооруженным глазом изменения системы: перемена окраски, помутнение, оседание частиц под действием силы тяжести.
Причины коагуляции многообразны, но наибольший интерес вызывает коагуляция электролитами, основные правила которой следующие:
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.
Минимальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции С К. Значение C K рассчитывают по уравнению:
 ,
,
где c эл − концентрация введенного электролита в моль/л; V п − пороговый объем электролита, вызвавший коагуляцию; V− объем золя.
Объем золя, который коагулирует под действием 1 моль электролита, называется коагулирующей способностью V К,
 .
.
Значит, чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
2. Коагулирующим действием обладает только тот ион, заряд которого совпадает по знаку с зарядом противоиона мицеллы; этот ион называется ионом-коагулянтом.
3. Коагулирующая способность иона-коагулянта тем больше, чем больше заряд иона. Количественно эта закономерность описывается эмпирическим правилом Шульце-Гарди:
 ,
,
где α − постоянная для данной системы величина; Z − заряд иона-коагулянта.
4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус.
5. при увеличении концентрации иона-коагулянта - потенциал золя уменьшается и агрегативная устойчивость золя понижается, при пороговой концентрации = 0.
Скорость коагуляции ν − это изменение концентрации коллоидных частиц в единицу времени при постоянном объеме системы.
Различают быструю и медленную коагуляцию.
При быстрой коагуляции каждое столкновение частиц приводит к их слипанию.
Теорию быстрой коагуляции разработал Смолуховский, который вывел уравнение:
 ,
,
где ν 0 − концентрация частиц золя в начальный момент времени; ν t − концентрация частиц золя в момент времени t; k к − константа скорости коагуляции (константа Смолуховского).
 ,
,
где k – константа Больцмана, k = 1,38∙10 −23 Дж∙К −1 ; – вязкость дисперсионной среды.
Из уравнения Смолуховского:
 .
.
Для характеристики быстрой коагуляции используется период коагуляции (период половинной коагуляции).
Период коагуляции (θ) - это время, через которое концентрация коллоидных частиц уменьшается в два раза.
При  , t = θ,
, t = θ,
Тогда из вышеприведенного уравнения вытекает:
 или
или  ,
, 
Медленная коагуляция связана с неполной эффективностью столкновений вследствие существования энергетического барьера. Поэтому только некоторые столкновения частиц приводят к их слипанию.
Среди факторов устойчивости лиофобных золей главную роль играют следующие:
- электростатический фактор устойчивости. Он обусловлен наличием ДЭС и дзета- по тенциала на поверхности частиц дисперсной фазы;
- адсорбционно-сольватный фактор устойчивости обусловлен снижением поверхностного натяжения в результате взаимодействия дисперсионной среды с частицей дисперсной фазы;
- структурно-механический фактор устойчивости обусловлен тем, что на поверхности частиц дисперсной фазы образуются прочные упругие пленки, препятствующие взаимодействию частиц.
Современная теория устойчивости развитая российскими и голландскими учеными Дерягиным, Ландау, Фервеем и Овербеном (теория ДЛФО) утверждает, что взаимодействие между сблизившимися коллоидными частицами совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. В этом слое появляется дополнительное давление, которое названо расклинивающим давлением. Оно положительно, когда давление в слое понижено, это препятствует вытеканию из него жидкости, т.е. препятствует сближению частиц.
Расклинивающее давление может быть и отрицательным, т.е. повышать давление в слое, ускорять вытекание из него жидкости и способствовать сближению частиц.
Возникновение расклинивающего давления в тонких жидких слоях обусловлено, главным образом, двумя факторами:
Электростатическим взаимодействием в слое - это силы отталкивания с энергией U отт;
Ван-дер-Ваальсовыми силами притяжения - с энергией U пр.
Результирующая энергия межчастичного взаимодействия U определяется как разность двух составляющих:
U = U отт – U пр
Если U отт > U пр, то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
При коагуляции золя электролитами различают концентрационную коагуляцию и нейтрализационную коагуляцию.
Концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения значения дзета-потенциала.
Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия.
Формула мицеллы имеет вид:
{n ∙ m Ag + ∙ (m-x) NO 3 - }x + ∙ x NO 3 - .
При добавлении KNO 3 диффузный слой противоионов предельно сжимается, формула мицеллы приобретает вид:
{n ∙ m Ag + ∙ m NO 3 - }.
При этом исчезает диффузный слой, дзета-потенциал становится равным нулю. Поэтому ничто не мешает коллоидным частицам сблизиться на такое расстояние, где преобладают силы притяжения - происходит коагуляция. Так как в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией.
Нейтрализационная коагуляция происходит при добавлении к золю неиндифферентного электролита. При этом потенциалопределяющие ионы связываются в малорастворимые соединения, что приводит к уменьшению абсолютных величин термодинамического потенциала, а следовательно, и дзета-потенциала вплоть до нуля.
Если взять рассмотренный ранее золь хлорида серебра, то для нейтрализации потенциалопределяющих ионов Ag + в золь необходимо ввести, например, хлорид калия. После добавления определенного количества этого неиндифферентного электролита мицелла будет иметь вид:
{(n + m) AgCl }.
В системе не будет ионов, способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной. При столкновении таких частиц происходит коагуляция.
Большое практическое значение имеет коагуляция смесью электролитов. При этом возможны три случая:
Аддитивное действие электролитов − электролиты действуют независимо, их суммарное действие складывается из воздействий каждого из электролитов;
Синергизм действия − взаимное усиление коагулирующего действия, для коагуляции электролитов требуется меньше, чем нужно по правилу аддитивности;
Антагонизм действия − ослабление коагулирующего действия одного электролита другим, для коагуляции их требуется добавить больше, чем требуется по правилу аддитивности.
Коллоидной защитой называется повышение агрегативной устойчивости золя путем введения в него высокомолекулярного соединения (ВМС).
Защитное действие ВМС связано с образованием на поверхности коллоидных частиц определенного адсорбционного слоя. Для характеристики защитного действия различных ВМС используют золотое число.
Золотое число − это количество миллиграммов ВМС, которое надо добавить к 10 см 3 0,0006 %-го красного золя золота, чтобы предотвратить его посинение при добавлении к нему 1 см 3 10 %-го раствора NaCl.
Известно, что при добавлении к красному золю золота некоторого количества NaCl начнется коагуляция золя, что приведет к изменению его окраски − он станет синим.
Вместо золя золота используются также коллоидные растворы серебра (серебряное число), гидроксида железа (железное число) и др.
В некоторых случаях введение в коллоидную систему очень малых количеств ВМС приводит не к защите, а к снижению устойчивости.
Сенсибилизацией называется снижение порога коагуляции золя при добавлении ВМС. В основном, это линейные макромолекулы, несущие полярные группы на обоих концах цепи. Макромолекула двумя концами присоединяется к двум разным частицам дисперсной фазы, скрепляя их. Этот вид коагуляции называется флокуляцией. Она используется для очистки природных и сточных вод.
Гетерокоагуляцией называется слипание разнородных частиц. Слипание разноименно заряженных частиц осуществляется за счет электростатических сил притяжения и происходит, так называемая, взаимная коагуляция. Этот процесс используют для разрушения дисперсных систем, необходимого при очистке природных и промышленных сточных вод.
Коллоидные растворы представляют собой термодинамически неустойчивые системы, в которых проявляется тенденция к снижению поверхностной энергии Гиббса за счет укрупнения частиц и уменьшения суммарной поверхности раздела фаз. Слипание коллоидных частиц приводит к увеличению их массы, в результате чего более крупные частицы под действием силы тяжести оседают на дно (седиментируют).
Известны, однако, многочисленные коллоидные растворы, в которых не происходит слипания частиц в течение длительного времени. Способность дисперсной системы сохранять во времени свое состояние и свойства характеризует устойчивость дисперсной системы.
Различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противостоять их слипанию между собой.
Седиментационная устойчивость коллоидных систем обусловлена малыми размерами частиц и их броуновским движением.
Агрегативная устойчивость коллоидных растворов с ионным стабилизатором обусловлена наличием на поверхности частиц диффузной ионной атмосферы, которая препятствует их слипанию. Агрегативная устойчивость - результат взаимодействия двух противоположно направленных сил, которые одновременно действуют на сближающиеся коллоидные частицы: Ван-дер-Ваальсовых сил межмолекулярного притяжения и электростатических сил отталкивания, возникающих между одноименно заряженными частицами. При значительной протяженности диффузной части мицеллы преобладают силы отталкивания, возникающие между одноименно заряженными противоионами. При малой толщине диффузного слоя частицы сближаются на расстояния, при которых молекулярное притяжение сильнее, что приводит к их агрегации (слипанию).
Таким образом, агрегативная устойчивость коллоидных систем зависит от условий формирования мицеллы - заряда твердой фазы, толщины и заряда диффузного слоя. Она тем больше, чем выше заряд твердой фазы (межфазный потенциал), чем больше толщина диффузного слоя и чем больше значение ζ -потенциала. Коллоидные растворы с ионным стабилизатором устойчивы, если ζ-потенциал превышает 50 мВ, относительно устойчивы при 30 < ζ < 50 мВ и неустойчивы при ζ < 30 мВ.
Потеря агрегативной устойчивости приводит к слипанию коллоидных частиц с образованием более крупных агрегатов; этот процесс называется коагуляцией . Следствием коагуляции является потеря седиментационной устойчивости: укрупненные частицы оседают под действием возросшей силы тяжести.
Примером коагуляции коллоидной системы служит процесс свертывания крови. Ему способствует наличие в крови катионов кальция, поэтому для длительного хранения крови, предназначенной для консервирования, эти ионы удаляют из крови различными физико-химическими методами.
Коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита, концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др. Наибольшее практическое значение имеет коагуляция под действием электролитов.
Согласно правилу Шульце - Гарди , коагуляцию коллоидных растворов вызывают любые ионы, имеющие знак заряда, противоположный заряду гранул, причем их действие тем сильнее, чем выше заряд иона-коагулянта.
Для количественной оценки коагулирующей способности электролитов введено понятие порога коагуляции , т.е. минимальной концентрации электролита, достижение которой вызывает начало коагуляции , заметное по помутнению раствора или изменению его окраски.
1000С эл V эл
С пор = ¾¾¾¾¾
V кр + V эл
где С пор - порог коагуляции электролита, ммоль/л; С эл - исходная концентрация раствора электролита, моль/л; V эл - добавленный объем раствора электролита, вызвавший начало коагуляции; V кр - исходный объем коллоидного раствора.
Величина, обратная порогу коагуляции, называется коагулирующей способностью КС:
КС = 1/С пор
Коагулирующая способность иона-коагулянта пропорциональна его заряду в шестой степени. Например, коагуляцию золя AgCl, полученного в избытке Cl - -ионов и имеющего отрицательно заряженные гранулы, вызовут положительно заряженные ионы, причем при добавлении к этому золю растворов NaCl, CaCl 2 или AlCl 3 коагулирующее действие катионов Na + , Ca 2+ и Al 3+ будет находиться в приблизительном соотношении 1 6: 2 6:3 6 » 1: 64: 729. Иными словами, для коагуляции потребуется добавить гораздо меньшее количество раствора AlCl 3 , чем раствора CaCl 2 и тем более раствора NaCl. Если золь AgCl был образован в избытке потенциалопределяющих катионов Ag + и имеет свойственный им положительный заряд гранулы, то коагуляцию такого золя вызовут анионы. При этом наиболее эффективным коагулянтом в ряду KCl - K 2 SO 4 - K 3 PO 4 будет анион с наибольшим зарядом, поскольку КС(Cl -) : КС(SO 4 2-) : КС(РО 4 3-) » 1: 64: 729.
Влияние электролита на коагуляцию коллоидных растворов следует учитывать при введении электролитов в живые организмы. Например, физиологический раствор NaCl (0,9%) нельзя заменить изотоническим раствором MgSO 4 , поскольку двухзарядные ионы Mg 2+ и SO 4 2- обладают значительно большим коагулирующим действием, чем однозарядные ионы Na + и Cl - . При инъекциях электролитов в мышечную ткань следует вводить их постепенно, чтобы не вызвать локального превышения порога коагуляции, которое приведет к коагуляции биосубстратов.
О протекании процесса коагуляции можно судить по величине ζ-потенциала (рис.24). Коагуляция становится возможной при снижении толщины диффузного слоя мицеллы, которое сопровождается и уменьшением электрокинетического потенциала. Снижение величины ζ-потенциала до 25-30 мВ свидетельствует о начале коагуляции, хотя внешних признаков (помутнения или изменения окраски) может не наблюдаться из-за низкой скорости этого процесса (так называемая "скрытая" коагуляция ). Дальнейшее снижение ζ-потенциала сопровождается увеличением скорости коагуляции и помутнением раствора ("явная" коагуляция ), и при ζ = 0 скорость коагуляции максимальна. Состояние коллоидных частиц, при котором электрокинетический потенциал равен 0, называется изоэлектрическим состоянием . В этом состоянии заряд гранул равен 0, поэтому в электрическом поле они не приобретают направленного движения.
Коагуляция
скрытая явная
v медленная быстрая
 |
ζ >30 мВ ζ < 30 мВ ζ = 0
Рис.24. Зависимость скорость коагуляции от концентрации электролита-коагулянта
Коагуляцию можно также вызвать, действуя смесями электролитов . При этом существует три возможных варианта взаимодействия между электролитами-коагулянтами:
1) аддитивное действие - суммирование коагулирующего действия ионов; так, смесь солей KCl и NaNO 3 , не взаимодействующих друг с другом, проявляет аддитивное действие по отношению к коллоидам с гранулами, заряженными как положительно, так и отрицательно (в первом случае коагуляцию вызывают анионы, во втором - катионы солей);
2) антагонизм - ослабление коагулирующего действия одного электролита в присутствии другого; например, добавка Na 2 SO 4 ослабляет коагулирующее действие катионов Ва 2+ из-за того, что растворе протекает реакция Ва 2+ + SO 4 2- ® BaSO 4 , приводящая к снижению концентрации этих катионов;
3) синергизм - усиление коагулирующего действия одного электролита в присутствии другого; например, коагулирующее действие FeCl 3 и KSCN в отношении коллоидов с положительно заряженными гранулами (коагулянты - однозарядные анионы) резко возрастает при их совместном присутствии, поскольку в результате реакции Fe 3+ + 6SCN - ® 3- образуется трехзарядный комплексный анион, проявляющий очень высокую коагулирующую способность.
При смешении двух коллоидных растворов, содержащих частицы с противоположными зарядами гранул происходит взаимная коагуляция - слипание разноименно заряженных гранул в крупные агрегаты. При этом коагуляция происходит тем полнее, чем полнее нейтрализуются заряды гранул.
Свежеполученный при коагуляции осадок можно вернуть в коллоидное состояние. Процесс, обратный коагуляции - превращение осадка в устойчивый коллоидный раствор, называется пептизацией . Пептизации способствует промывание осадка чистым растворителем, вымывающим из системы ионы-коагулянты, и добавление электролита-пептизатора, содержащего ионы, способные, адсорбируясь на поверхности частиц осадка, восстановить ионные атмосферы вокруг них и перевести их в коллоидное состояние. Пептизация усиливается при перемешивании и нагревании.
Процесс пептизации лежит в основе лечения многих заболеваний: рассасывания атеросклеротических бляшек на стенках кровеносных сосудов, почечных и печеночных камней. Однако застарелые тромбы и уплотнившиеся камни практически не пептизируются.
Устойчивость коллоидных растворов можно повысить добавлением к ним некоторых высокомолекулярных соединений (ВМС). Это явление получило название коллоидной защиты. Защитное действие ВМС объясняется тем, что они адсорбируются на поверхности коллоидных частиц. При этом гидрофобные участки их структур (углеводородные радикалы) обращены к частицам дисперсной фазы, а гидрофильные фрагменты (полярные группы) обращены наружу, к воде. Вокруг мицеллы образуется дополнительная оболочка из макромолекул ВМС и их собственных гидратных оболочек, которая препятствует сближению коллоидных частиц.
По отношению к водным коллоидным растворам защитным действием обладают растворимые в воде белки, полисахариды, пектины. Белки препятствуют выпадению в осадок малорастворимых холестерина и солей кальция на стенках кровеносных сосудов, образованию камней в мочевыводящих и желчепроводящих путях. В фармации защитные свойства ВМС используются для повышения устойчивости лекарственных препаратов, находящихся в коллоидном состоянии.
Для обеспечения коллоидной защиты необходимо создать достаточно высокую концентрацию ВМС, обеспечивающую образование мономолекулярной защитной оболочки вокруг мицеллы. Введение небольшого количества ВМС может привести к обратному эффекту: макромолекулы взаимодействуют одновременно с несколькими коллоидными частицами, связывая их с образованием рыхлых хлопьев. Агрегирование частиц дисперсной фазы в лиофобных коллоидных растворах под действием небольших количеств ВМС называется флокуляцией .
На явлении флокуляции основан метод очистки природных и питьевых вод. В качестве флокулянта используется хорошо растворимый в воде синтетический полимер - полиакриламид.
Агрегативная устойчивость/неустойчивость системы зависит от возможности контакта частиц; для слипания частицы должны сблизиться на определенное расстояние. В теории агрегативной устойчивости, известной под названием теория ДЛФО (первые буквы фамилий авторов теории: Б. В. Дерягин и Л. Д. Ландау, Россия, и Э. Фервей и Дж. Т. Овербек, Голландия), рассматривается совместное действие сил притяжения и сил отталкивания между частицами.
Исторический экскурс
Борис Владимирович Дерягин - выдающийся ученый, внесший неоценимый вклад практически в каждый раздел коллоидной химии. Исследуя свойства глинистых суспензий, он установил, что тонкие слои воды между отдельными частицами суспензии обладают свойствами, отличными от свойств воды в объеме, в том числе расклинивающим давлением, препятствующим сближению частиц. Совместное рассмотрение сил притяжения и отталкивания объясняло устойчивость системы. Эти исследования наряду с количественными расчетами и выявлением критерия устойчивости были опубликованы Б. В. Дерягиным совместно с Львом Давидовичем Ландау в нескольких научных статьях 1935-1941 гг.; за рубежом об этих работах узнали значительно позже.
Голландские ученые Э. Фервей (Vervey) и Дж.Т. Овербек (Overbek) также занимались исследованиями в этой области. Э. Фервей в 1934 г. защитил диссертацию, посвященную изучению двойного электрического слоя и стабильности лиофобных коллоидов. Позднее им была опубликована серия статей, где рассматривается действие электрических сил и сил Лондона - Ван-дер-Ваальса между коллоидными частицами, находящимися в растворе электролита. А в 1948 г. в соавторстве с Овербеком вышла его монография «Теория стабильности лиофобных коллоидов» .
Вопрос о научном приоритете относительно создания теории разрешился признанием заслуг всех четырех авторов.
Силы притяжения - это силы межмолекулярного взаимодействия (силы Лондона - Ван-дер-Ваальса). Силы притяжения, возникающие между отдельными атомами, проявляются на очень малых расстояниях порядка атомных размеров. При взаимодействии частиц вследствие аддитивности дисперсионных сил притяжение между частицами проявляется на значительно больших расстояниях. Энергия притяжения обратно пропорциональна квадрату расстояния между частицами:
Силы отталкивания между частицами имеют электростатическую природу. Электростатическая энергия отталкивания, возникающая при перекрытии диффузных слоев, уменьшается с увеличением расстояния по экспоненте:

В приведенных выше формулах для энергий притяжения и отталкивания А * - константа Гамаксра; х - расстояние между частицами; е - диэлектрическая проницаемость дисперсионной среды; е° = 8,85 К) 12 Ф/м - электрическая постоянная; (р^ - потенциал диффузного слоя; А. - толщина диффузного слоя двойного электрического слоя (ДЭС).
Подробнее о строении ДЭС, включающего адсорбционный и диффузный слои, см. в параграфе 4.3.
Энергии притяжения присваивают знак «минус», энергии отталкивания - знак «плюс». Энергии притяжения и отталкивания рассматриваются в теории ДЛФО как составляющие расклинивающего давления между частицами. Действие энергий притяжения и отталкивания в зависимости от расстояния между частицами показано на рис. 4.2.

Рис. 4.2.
На результирующей кривой суммарной энергии на рис. 4.2 можно выделить три участка.
Участок а. На малых расстояниях между коллоидными частицами (до 100 нм) преобладают силы притяжения, возникает энергетическая яма или ближний энергетический минимум. Если частицы сблизятся на такое расстояние, произойдет коагуляция под влиянием сил притяжения. Коагуляция в таких случаях необратима.
Участок б. На средних расстояниях электростатические силы отталкивания больше сил межмолекулярного притяжения, возникает энергетический максимум - потенциальный барьер, препятствующий слипанию частиц; высота барьера зависит от заряда поверхности и толщины диффузного слоя.
Если потенциальный барьер высок, частицы не в состоянии его преодолеть, то коагуляция не происходит. Возможности преодоления барьера определяются его снижением (уменьшение заряда поверхности и сил отталкивания между частицами, например при воздействии электролита) или увеличением энергии частиц (нагревание).
В лияние электролитов на строение двойного электрического слоя разобрано в подпараграфе 4.3.3.
Далее под влиянием сил притяжения частицы сближаются, и происходит коагуляция. Если частицы не могут преодолеть барьер, то коагуляция не происходит и система может сохранять агрегативную устойчивость достаточно долго.
Участок в. На относительно больших расстояниях (около 1000 нм) также превалируют силы притяжения, образуя на результирующей кривой так называемый дальний минимум. Глубина дальнего минимума индивидуальна для каждой системы. При незначительном дальнем минимуме сближению частиц препятствует потенциальный барьер.
Если дальний минимум достаточно глубок, то частицы при сближении не могут покинуть потенциальной ямы и остаются в равновесном состоянии на соответствующем расстоянии друг от друга, сохраняя свою индивидуальность.
Наличие высокого потенциального барьера препятствует более тесному сближению частиц, между ними сохраняется прослойка жидкости. Система в целом сохраняет дисперсность, представляя собой рыхлый осадок - коагулянт, или флокулянт. Такое состояние отвечает обратимости коагуляции; возможен перевод системы в состояние золя (пептизация).
« Пептизация - один из методов получения дисперсных систем, см. параграф 2.4.
При большой концентрации дисперсной фазы может образоваться структурированная система - гель.
Особенности структурированных систем более подробно обсуждаются в параграфе 9.4.
Резюме
Агрегативная устойчивость системы (устойчивость к коагуляции ) во многом определяется наличием электрического заряда на поверхности.
- Vetvey E.J., Overbeek J. Th. G. Theory of the stability of lyophobic colloids. N. Y.: Elsevier,1948.
Коллоидные системы характеризуются высокой раздробленностью дисперсной фазы (дисперсностью): размер коллоидных частиц обычно составляет см. Высокая дисперсность обуславливает большую поверхность раздела фаз и как следствие - большую поверхностную энергию Гиббса формула" src="http://hi-edu.ru/e-books/xbook707/files/f287, (9.1)
где s - площадь поверхности раздела фаз, формула" src="http://hi-edu.ru/e-books/xbook707/files/f16.gif" border="0" align="absmiddle" alt=") получили название лиофобных дисперсных систем. Такие системы не могут быть получены самопроизвольным диспергированием, для их образования должна быть затрачена внешняя энергия.
Казалось бы, термодинамически неустойчивые системы не имеют права на существование, они должны быстро терять устойчивость и агрегировать. Однако агрегативная устойчивость таких систем может быть обеспечена кинетическими факторами..gif" border="0" align="absmiddle" alt=" (9.2)
где к - константа, объединяющая физические свойства среды; формула" src="http://hi-edu.ru/e-books/xbook707/files/f289.gif" border="0" align="absmiddle" alt=".gif" border="0" align="absmiddle" alt=" (9.3)
Здесь формула" src="http://hi-edu.ru/e-books/xbook707/files/f292.gif" border="0" align="absmiddle" alt=" (9.4)
и графически передается кривой на рис. 9.1а.
Как видно из рис. 9.1а, на больших и очень малых расстояниях преобладает энергия притяжения частиц (U < 0); на средних расстояниях (формула" src="http://hi-edu.ru/e-books/xbook707/files/f294.gif" border="0" align="absmiddle" alt=" , препятствующему агрегации частиц.
Первый минимум (1) на кривой, соответствует непосредственному соприкосновению частиц, а второй (2) - притяжению частиц, между которыми имеются прослойки среды.
Устойчивость лиофобных систем, стабилизированных электролитами, зависит от соотношения величины электростатического барьера и кинетической энергии частиц формула" src="http://hi-edu.ru/e-books/xbook707/files/f296.gif" border="0" align="absmiddle" alt=", то при столкновении частицы не способны подойти друг к другу на расстояние 1 нм и они не слипаются. Такая система устойчива кинетически, оставаясь неустойчивой термодинамически.
Если формула" src="http://hi-edu.ru/e-books/xbook707/files/f298.gif" border="0" align="absmiddle" alt=" и, согласно (9..gif" border="0" align="absmiddle" alt=" при повышении концентрации постороннего электролита в системе. При достаточно высокой концентрации электролита толщина диффузного слоя уменьшается практически до нуля (изоэлектрическое состояние), исчезает потенциальный барьер (кривая 4), частицы слипаются при всяком столкновении друг с другом.

Рис.9.1.
Зависимость энергии взаимодействия двух частиц U от расстояния между ними - х (а); влияние концентрации электролита на величину потенциального барьера выделение">рис. 9.2.
 случаях адсорбция ПАВ приводит к снижению поверхностной энергии Гиббса и тем самым - к повышению термодинамической устойчивости системы (адсорбционно-сольватный фактор устойчивости).
случаях адсорбция ПАВ приводит к снижению поверхностной энергии Гиббса и тем самым - к повышению термодинамической устойчивости системы (адсорбционно-сольватный фактор устойчивости).
Кроме того, адсорбированные молекулы ПАВ образуют структуры, обладающие повышенной вязкостью и механической прочностью, разрушение которых требует определенной энергии и времени. Эти адсорбционные слои являются как бы барьером на пути сближения частиц и их агрегации (структурно-механический фактор устойчивости).
В случае ультрамикрогетерогенных систем, кроме перечисленных факторов, действует ещё и энтропийный фактор устойчивости. Сущность его определяется стремленгем дисперсной фазы к равномерному распределению по объёму системы вследствие броуновского движения. Этот фактор повышает термодинамическую устойчивость систем, снижая их общую энергию Гиббса.
Действительно, при равномерном распределении дисперсной фазы по объёму хаотичность системы выше, чем когда частицы находятся в виде агрегатов на дне сосуда..gif" border="0" align="absmiddle" alt="
такой процесс идет с уменьшением энергии Гиббса формула" src="http://hi-edu.ru/e-books/xbook707/files/f301.gif" border="0" align="absmiddle" alt="
формула" src="http://hi-edu.ru/e-books/xbook707/files/f303.gif" border="0" align="absmiddle" alt=".gif" border="0" align="absmiddle" alt=" - время половинной коагуляции; к -константа скорости коагуляции. Константа к определяется соотношением:
формула" src="http://hi-edu.ru/e-books/xbook707/files/f313.gif" border="0" align="absmiddle" alt=" (9.6)
Коагуляция лиофобных дисперсных систем может происходить в результате различных внешних воздействий: при нагревании или при охлаждении, перемешивании систем, действии ультразвука и т.д. Наиболее часто коагуляция дисперсных систем происходит при добавлении электролитов - электролитная коагуляция. Как уже описывалось выше, введете электролитов снижает высоту потенциального барьера отталкивания. Быстрая коагуляция наступает при введении определенного для данной системы количества электролита, при котором кинетическая энергия большинства частиц превышает величину указанного барьера. Это количество электролита в моль, вызывающее коагуляцию 1 литра золя называют порогом коагуляции Ск.
Коагулирующая способность электролитов зависит от заряда и радиуса ионов: порог коагуляции обратно пропорционален заряду (валентности) противоиона z в шестой степени (правило Шульца - Гарди):
Агрегативная устойчивость такого золя обеспечивается ионным фактором устойчивости. Потенциалобразующими (неиндифферентными) ионами при данном методе получения золя являются ионы формула" src="http://hi-edu.ru/e-books/xbook707/files/f238.gif" border="0" align="absmiddle" alt=" и формула мицеллы золя имеет вид:
формула" src="http://hi-edu.ru/e-books/xbook707/files/f206.gif" border="0" align="absmiddle" alt=" образуются сравнительно небольшие по размерам седиментационно - устойчивые агрегаты. Что приводит к повышению светорассеяния системы и, соответственно, - к увеличению её оптической плотности. Поэтому исследование коагуляции в данном случае удобнее всего проводить с помощью турбидиметрического метода, измеряя оптическую плотность растворов золя.